-
去甲斑蝥素(norcantharidin, NCTD)是斑蝥素的去甲基化衍生物,与斑蝥素相比能降低对肾脏的毒副作用和泌尿系统的刺激性。目前,NCTD临床应用形式以注射和口服为主,在肿瘤疾病治疗上有一定效果,如能抑制DNA复制,促进肿瘤细胞死亡,对多种肿瘤细胞具有细胞毒性且有一定升高白细胞的作用,具有显著的保护肝细胞的作用[1-3]。现代临床主要用于治疗肝癌、肺癌、乳腺癌、膀胱癌、胃癌和食管癌,但其治疗窗窄,LD50值低、毒性大等缺陷使其临床应用受到了限制[4]。近年来,NCTD滴丸和软胶囊两种剂型也表现出稳定性好、生物利用度高等优点,研究者正利用新型制剂的靶向性、缓控释等作用特点,增强靶向给药性,减少药物在肾脏分布和对泌尿系统的刺激作用,使其在肿瘤疾病中发挥更显著的疗效。
-
微球是指药物分散或被吸附在高分子聚合物基质中而形成的微小球实体。是一种新型缓控释制剂,常应用于注射剂或固体制剂。药物包裹于微球内可起到靶向、缓释、控释、栓塞等定点、定时、定量和长效的作用。作为新型药物载体,可增加药物稳定性,使药物易于扩散和吸收,降低药物毒性和局部刺激性,提高药效[5]。
NCTD微球与传统NCTD注射剂和片剂相比能提高药物在肿瘤部位的浓度,可有效抑制肿瘤生长,起到良好的抗癌作用。李琦等[6]制备的去甲斑蝥素海藻酸/聚酸酐微球(N-MS)。给予大鼠经肝动脉注射N-MS,给药前平均肿瘤体积为(79.20±30.75)mm3,给药8 d后平均肿瘤体积为(62.55±32.09)mm3;空白组、NCTD注射液组和N-MS组肿瘤生长率分别为(21.96±13.78)%、(11.20±7.22)%和(0.79±0.9)%。实验结果表明:N-MS组肿瘤体积降低趋势明显小于其他组,肿瘤生长速度最慢,N-MS组大鼠存活时间(35.13±4.54)d明显长于空白组(14.50±2.39)d和NCTD注射液组(16.25±1.98)d;各组肝肿瘤细胞凋亡指数(apoptotic index, AI)的比较,N-MS组(42.60±3.72)%明显高于空白组(3.28±2.31)%和NCTD注射液组(10.45±3.57)%。N-MS微球介入治疗肝癌较普通NCTD注射液有更好的抗肿瘤作用。
吴卫平等[7]将NCTD微球用于肝肿瘤介入治疗,分别对空白对照组、NCTD片剂组、和NCTD聚酸酐微球组分别进行肝动脉灌入药物,给药后各组大鼠肝肿瘤生长率分别为(13.6±6.7)%、(8.4±4.8)%和(0.9±0.3)%;各组肝肿瘤细胞凋亡情况分别为(2.5±0.8)%、(10.7±3.6)%和(26.6±8.7)%;各组大鼠平均生存时间为(10.3±2.3)d、(13.2±3.6)d和(24.2±7.5)d。研究数据显示,NCTD聚酸酐微球组相对于NCTD片剂组和空白组具有良好的抑制肿瘤生长,促进肿瘤凋亡和明显提高大鼠生存时间的作用。文庆怡等[8]研究去甲斑蝥素-N-乳糖酰壳聚糖/丝素蛋白微球作用于兔的抗肿瘤作用,实验结果也表明NCTD微球组抑制肿瘤生长和延长寿命作用明显强于NCTD注射液组。
大鼠静脉注射NCTD微球具有显著的降毒作用。将Lin等[9]制备的NCTD负载的静脉注射脂质微球(NLM)与NCTD注射液(NI)进行对比。研究结果显示:NLM和NI在大鼠体内的药动学相似。此外,其曲线下面积(AUC)与用药剂量无线性关系,且具有相当的抗肿瘤功效,NI组对大鼠心脏及肾毒性发生率分别为66.7%和73.3%,NLM被包裹在微球中,不仅降低了NCTD在体液中的分布,也降低了对内脏器官的毒副作用,对心脏没有明显损伤,对肾毒性也较低,其发生率仅为33.3%,经过恢复期,肾损害消失。这些研究表明,NLM和NI的抗肿瘤效应相当,但NLM可减少药物的毒副作用。
-
纳米粒是指粒径在1~1000 nm的粒子。包括药物纳米晶和载药纳米粒,是一种理想的药物载体。纳米粒进入人体循环后,能立即到达靶器官而被细胞吸收。可延长药物作用时间,减少药物用量及服用次数,起到缓释作用的同时可降低副作用[10-11]。
-
自然界中大量存在的阳离子聚合物壳聚糖,为天然高分子碱性多糖,具有良好的生物活性,可有效抑制肿瘤细胞生长,具有较强抗菌作用[12]。壳聚糖具有良好的生物降解力,现已广泛应用于新型纳米制剂,是抗癌药物的载体选择[13]。壳聚糖材料能修饰各种抗肿瘤药物,对肿瘤及器官具有靶向作用,同时能够延长药物作用时间,有效降低毒副作用。
徐晓莉等[14]研究了NCTD-半乳糖修饰壳聚糖纳米粒(NCTD-GC-NPs)对人肝肿瘤细胞SMMC-7721、HepG2摄入以及在小鼠体内的抗肿瘤活性。实验结果表明,培养5 h的两种细胞对6 μg/ml纳米粒的摄入情况:NCTD-GC-NP组为(142.30±8.47)个、NCTD片剂组为(87. 69±10. 49)个;另外对比了空白组、NCTD片剂低中高剂量组和NCTD-GC-NP低中高剂量组对瘤重的影响,荷瘤小鼠给药后瘤重分别为(1.688±0.354)g、(1.313±0.292)g、(1.191±0.375)g、(0.777±0.268)g、(1.289±0.385)g、(0.940±0.297)g和(0.661±0.325)g,给药组瘤重明显低于空白组且NCTD-GC-NP低中高剂量组瘤重均小于NCTD低中高剂量组,说明NCTD-GC-NP具有良好的抗肿瘤作用。
Ding等[15] 通过离子凝胶化技术制备NCTD壳聚糖纳米颗粒(PVP-NCTD-NP)新型制剂。在大鼠口服和静脉内给药后,药动学曲线表示PVP-NCTD-NP组和NCTD片剂组相对生物利用度分别为325.5%和173.3%,提高了1.878倍,消除半衰期增加,且改善了药物在肝脏和胆汁中的分布。PVP-NCTD-NP组粪便中消除药物量为NCTD片剂组的32倍。能增加NCTD的吸收,改善对肝脏系统的治疗效果,降低对肾、肝脏及胆的副作用。
随着多种类型的纳米载体材料广泛用于修饰抗肿瘤药物,如采用离子交联法制备的甘草次酸N-乳糖酰壳聚糖NCTD纳米粒,所制备的NCTD纳米粒平均粒径、载药量和包封率分别为(414.40±10.98) nm、(13.99±0.16)%和(87.19±0.31)%,其24 h释放率接近85%,而原料药在4 h基本完全释放,体外缓释作用明显[16]。
-
纳米胶束是由具有亲水基团和疏水基团的两亲嵌段共聚物在水中自组装形成的纳米级大小的核-壳型胶束。纳米胶束具有载药量高、稳定性好、缓释作用明显、可提高生物利用度、降低副作用等优点,使其得到广泛应用[17]。
传统NCTD注射液在体内释放速度快,抑瘤作用较差。而采用二硬脂酰磷脂酰乙醇胺-聚乙二醇-马来酰亚胺修饰,在水中制成圆球状去NCTD纳米胶束,其包封率为(83.67±1.78)%,粒径为(138.6±45.8) nm。体外抗肿瘤活性实验中NCTD纳米胶束组细胞生存率略低于阳性对照组,而载药组对细胞生存率无明显影响。体内抗肿瘤实验分为空白组、NCTD注射液组、NCTD纳米胶束低、高剂量组,经尾静脉给药,其中各组瘤质量分别为(1.15±0.14)g、(0.52±0.12)g、(0.63±0.14)g和(0.41±0.21)g,抑瘤率分别为0%、54.78%、45.22%和64.35%,表明NCTD纳米胶束高剂量组抑瘤率明显高于其他各组,肿瘤细胞存活率较其他组明显降低,且随药物作用时间的延长,存活率直线下降[18]。
用碳酸酐酶Ⅸ抗体修饰NCTD,制成的纳米胶束具有良好的抑制肿瘤效应。其包封率、载药量分别为(80.93±1.01)%和(1.26±0.03)%。将制备的纳米胶束作用于荷瘤鼠,实验结果表明:载体胶束和NCTD注射剂的抑瘤作用与剂量和时间均有关,但载药胶束的抑瘤性更强;碳酸酐酶Ⅸ抗体载药胶束能有效促进组织肿瘤凋亡,使药物直接作用于靶器官,药物直接释放于靶器官,这也同时降低了药物对其他器官的毒副作用[19]。
-
将药物包封于类脂质双分子层薄膜中间所制成的超微球形载体制剂称为脂质体。包载于脂质体中的药物,可降低药物的毒副作用,减少对正常细胞的损害,经修饰的脂质体可通过靶向作用将药物输送到靶器官和特定组织,改善药动学特征,延长半衰期,减少药物服用剂量等[20]。
顾宗林等[21] 通过优化逆向薄膜蒸发法条件制备的NCTD脂质体具有较小的粒径(90.50±2.40) nm,但包封率相对较低仅为(34.7±1.3)%。其体外释放度通过平衡透析法考察,NCTD脂质体和原料药释放度均符合Weibull方程,NCTD脂质体的释放度较原料药缓慢,具有明显的缓释效应。
乳糖化-NCTD与磷脂聚合成药物磷脂复合物(Lac-NCTD),对药物的脂溶性和渗透性均有大幅提高,以增大体内吸收率。将Lac-NCTD制成pH敏感性脂质体(pH-Lac-NCTD),在靶向给药、释放速度、抑制肿瘤生长和提高疗效方面均优于Lac-NCTD。pH-Lac-NCTD形态完整,粒径为(47.18 ± 4.16)nm,包封率为(70.0 ±1.3)%。pH-Lac-NCTD释药时间延长,其释药特点符合突释-缓释模型,服药后立即达到有效血药浓度,之后释药缓慢,能长时间保持平稳有效血药浓度。体内抑瘤结果表明:pH-Lac-NCTD脂质体到达肝脏和病变部位能定向释放药物,能在肿瘤部位主动释药,从而有效抑制肿瘤生长速度[22-23]。
将NCTD介孔二氧化硅纳米粒和粉防己碱为药物包载于脂质体中,制备为双载药系统脂质体。制备的双载药脂质体具有核囊结构,NCTD与粉防己碱的包封率分别为86.62%,79.19%,平均粒径 (207.5±3.6) nm。能达到被动靶向肝脏的作用,提高药物在肝脏分布,减少在肾脏分布,减少药物对肾的副作用。同时利用粉防己的协同作用,提高去甲斑蝥素的抗肿瘤效果[24]。
-
微乳作为一种新型的微粒制剂载体,释药性能良好,能增加药物溶解度,提高药物稳定性,增加生物利用度且具有缓释和靶向释药特征,被广泛应用于药剂学中。微乳是油水混合系统,将药物包裹于微乳颗粒中,可延缓药物释放,能有效降低NCTD的毒副作用,提高抗肿瘤作用。
将NCTD制成微乳可提高药物在体内的靶向作用,增强药物生物利用度。张莉等[25] 将肝靶向NCTD微乳进行了3个靶向性指标和半衰期(t1/2)、MRT、AUC评价,结果显示,NCTD 微乳在血浆中浓度较高,总靶向系数(Te)是注射剂的0.34倍,靶向效率re为4.07,相对分布效率RTe为1.95,肝靶向性明显。NCTD 微乳改变NCTD 在小鼠体内的药时曲线和血药浓度,其消除t1/2、MRT和AUC比其注射剂分别增加了2.48倍、1.27倍和3.21倍,表明NCTD 微乳在血液循环系统中有长循环效应。
-
NCTD是一种极具发展前景的抗肿瘤药物,为了其更好的应用,现已采用改变剂型的方式,改善其水溶性差、对肾脏和泌尿系统的刺激性和毒性、释药速度快、体内代谢迅速、生物利用度低等问题。NCTD微球对肝癌的治疗具有很强的药理活性,其缓释和靶向作用能明显起到减毒增效,延长药物释放时间等作用。对难溶性药物,刺激性药物的应用提供了新的选择。NCTD新型制剂在提高抗肿瘤和降低毒性方面表现出良好的应用前景,但目前NCTD新型制剂中普遍存在包封率、载药率低等问题,因此,有待研究者进一步优化制备方法和载体材料,运用制剂新技术改善包封率和载药率,相信NCTD新型制剂会更好的应用于药剂学领域。
Research progress in new formulations of norcantharidin
-
摘要:
目的 综述去甲斑蝥素新型制剂研究进展。 方法 通过查阅近年来有关去甲斑蝥素新型制剂的中外文献,对其研究进展进行归纳总结与分析。 结果 经过对微球、纳米粒、脂质体和微乳等载药系统包载去甲斑蝥素的情况进行分析,结果表明去甲斑蝥素新型制剂是极具开发潜力的新型制剂。 结论 去甲斑蝥素是一种优良的抗肿瘤药物,但传统的注射剂和片剂在临床应用上有很大的毒副作用。根据目前研究结果显示,将其制备为新型制剂可以增强靶向性,减小对肾脏和泌尿系统的毒副作用,更好地发挥药效。因此,将去甲斑蝥素制成新型制剂具有良好的发展前景。 Abstract:Objective To review the research progress in new formulations of norcantharidin. Methods The foreign and domestic literature search in the new formulations of norcantharidin was conducted. The research and development of norcantharidin formulations were summarized and commented. Results The drug delivery systems, such as microspheres, nanoparticles, liposomes, and microemulsions, have great development potential as the new formulations for norcantharidin. Conclusion Norcantharidin is an excellent anti-tumor drug. The traditional injections and tablets have serious side effects in clinical application. The new formulations reduced the renal and urinary toxicity and side effects. Those formulations provided better therapeutic effects as target medication. Therefore, the new norcantharidin formulations have great development prospects. -
Key words:
- norcantharidin /
- microspheres /
- nanoparticles /
- liposomes /
- microemulsions
-
中药及其制剂由于其特殊的功效,低毒性和较少的副作用而在世界范围内越来越流行[1]。坤复康片是著名的中药配方,包括赤芍、苦参、香附、猪苓、女贞子、南刘寄奴、乌药、粉萆解、扁蓄,临床用于治疗中国女性的骨盆炎症[2-3]。红景天苷(图1)是坤复康片抗炎作用的重要生物活性化合物。研究证明,红景天苷包含许多药理作用,例如抗血栓[4]、抗成骨细胞凋亡[5]、保肝[6]和抗肿瘤[7]。
中药药动学研究不仅可以解释和预测有关功效和安全性的药物事件,而且还有助于评估处方或者中草药的合理性和相容性[8-10]。口服是应用中药的主要途径,并通过口服发挥药理作用。但是,口服坤复康片后,红景天苷的药动学特征尚未见报道。同时,坤复康片中其他成分对红景天苷吸收的影响目前也未被揭晓。
我们旨在开发一种选择性高、灵敏且快速的UPLC-MS/MS方法,用于测定大鼠血浆中的红景天苷。随后,本方法成功地用于该活性成分在大鼠体内的药动学研究。同时,通过比较大鼠口服给予红景天苷单体和坤复康片后的药动学行为,我们探究了坤复康片对红景天苷药动学特征的影响。
1. 材料
1.1 药品与试剂
红景天苷标准品和内标葛根素标准品(上海阿拉丁生化科技股份有限公司)。甲醇、乙腈均为色谱纯;水为纯化水;坤复康片为市售品(薄膜衣片,规格:0.4 g/片,批号:20190610);空白大鼠血浆取自健康Wistar大鼠,用前经检测对实验无干扰。
1.2 动物
Wistar雄性大鼠(180~220 g,上海交通大学公共实验室)。
1.3 仪器
Applied Biosystem 5500 QTRAP® hybrid triple-quad LC/MS/MS(美国AB科学技术公司);ZORBAX Eclipse Plus C18色谱柱(美国安捷伦科技有限公司,50 mm×2.1 mm, 1.8 μm)。
2. 方法
2.1 色谱条件
流动相:乙腈(A)−0.1%甲酸(B)。梯度洗脱:0.0~2.4 min, 1.0%~23.4% A; 2.4~2.5 min, 23.4%~95.0% A; 2.5~3.5 min,95.0% A; 3.5~3.6 min, 95.0%~1.0% A; 3.6~4.6 min, 1.0% A。用前经0.22 μm微孔滤膜过滤。在线脱气;流速:0.4 ml/min;柱温:30 ℃;进样量:2 μl。
2.2 质谱条件
ESI离子源:负离子模式;采集方式:多反应监测(MRM);离子化温度(TEM):550 ℃;喷雾电压:−4 500 V;雾化气(GS1):50 psi;辅助气(GS2):50 psi;气帘气(CUR):50 psi。红景天苷m/z 299.2 → 59.0,内标葛根素m/z 415.1 → 267.1,碰撞能量(CE): −29 V(红景天苷),−40 V(葛根素)。
2.3 标准溶液的配制
精密称取红景天苷对照品适量,加水定容至10 ml制成对照品溶液,浓度为100 μg/ml,4 ℃冷藏备用。
2.4 血浆样本处理
取血浆样品50 μl,加入70 ng/ml葛根素内标溶液10 μl,涡旋混匀,加入400 μl甲醇,涡旋提取1 min。12 000 r/min离心10 min,吸取2 μl上清液进样LC-MS/MS分析。
2.5 方法学考察
根据FDA发布的生物分析方法标准,设定红景天苷3个质控浓度(5、50、200 ng/ml),通过将标准溶液用空白血浆稀释的方式配制质控样本,对方法的专属性、精密度、准确性、稳定性、提取回收率、线性关系进行了考察(FDA,2001年)。验证试验连续进行3 d。每次验证均重复6份质控样品。
2.6 试验设计
12只雄性Wistar大鼠,随机分为2组,适应性饲养3 d后,于实验前12 h禁食,自行饮水。红景天苷单体和坤复康片事先用0.5%羧甲基纤维素钠制成混悬液,2组大鼠分别灌胃给予红景天苷单体和坤复康片混悬液,剂量分别为0.95和120 mg/kg。其中,坤复康片剂量为单次口服临床等效量。大鼠于给药前和给药后0、0.17、0.5、1、2、3、4、6、8、12、24、48 h眼眶取全血150 μl,立即置于含肝素的试管中,摇匀,12 000 r/min离心10 min,分离血浆50 μl,−20 ℃保存,备测。
3. 结果
3.1 方法学考察
3.1.1 专属性
在本研究中,我们尝试了各种流动相条件以获得分析物的最佳响应、合适的保留时间和良好的峰形。主要测试了甲醇、乙腈、0.1%甲酸和100%水作为潜在的流动相。结果表明,0.1%甲酸和甲醇作为流动相可以产生更高的响应和更好的峰形。因此,选择了甲醇-0.1%甲酸水。对于MS条件,测试了正扫描和负扫描模式。由于处于负离子模式的红景天苷显示出更明显的碎片特征和更高的灵敏度,因此选择了该模式。空白血浆、红景天苷和内标血浆的典型色谱见图2。其中,红景天苷和内标保留时间分别为1.52和1.98 min。在空白血浆中,没有发现内源性物质干扰红景天苷的分析。
3.1.2 提取回收率试验
于空白大鼠血浆中加入对照品溶液配制成(5、50、200 ng/ml)3种浓度的对照品血浆溶液,每个浓度平行为6份,按“血浆预处理方法”项处理,进样,测定峰面积A1。另取6份空白大鼠血浆,按“血浆预处理方法”项处理后,加入按对照品溶液配制成(5、50、200 ng/ml)3种浓度的对照品血浆溶液,每个浓度平行为6份,进样,测定峰面积A2。计算A1/A2为提取回收率,分别为(87.2±6.2)%、(85.1±4.4)%、(90.4±7.1)%。内标葛根素的提取回收率为(91.2±5.9)%。结果表明红景天苷的提取回收率较高,且稳定。
3.1.3 精密度与准确性试验
制备高、中、低浓度的质控样品,按“2.4”项下方法提取后进样分析。在3 d内测定日内精密度,通过准备各浓度下6份重复样本来评估日间精密度。从标准曲线计算出质控样品浓度,并对质控样品结果进行方差分析以获得精确度和准确性。结果见表1。几组样本的标准偏差和相对误差均在合理范围内,表明红景天苷的精密度和准确性良好。
表 1 血浆质控样本的精密度与准确性(n=6)浓度(ng/ml) 标准偏差(%) 相对误差(%) 日内 日间 日内 日间 5 2.74 4.76 −8.51 2.36 50 4.33 3.59 4.84 −4.55 200 4.29 1.98 3.57 −2.18 3.1.4 线性关系考察
取空白大鼠血浆适量,配成含红景天苷4、5、10、20、50、100、200、500 ng/ml的标准空白血浆系列溶液。按“2.4”项下提取,每个浓度平行测定6份样本。以待测物红景天苷浓度为横坐标,待测物与内标葛根素峰面积的比值为纵坐标,进行线性回归,权重系数为1/C2,计算直线回归方程。红景天苷标准曲线为:Y=0.039 5X−0.013 1。其中,X为红景天苷的浓度(ng/ml),Y为红景天苷和内标质谱峰面积的比值。线性范围为4~500 ng/ml,红景天苷定量限为4 ng/ml。
3.1.5 稳定性试验
分别取低、中、高3个浓度的质控样本各6份,测定反复冻融3次、−20 ℃存放2周、室温(20 ℃)下存放4 h、自动进样器(4 ℃)保存24 h后药物的浓度,考察冻融和存放时间对红景天苷稳定性的影响,试验结果表明:红景天苷在上述条件下稳定,不影响测定结果。结果见表2。
表 2 红景天苷在大鼠血浆中的稳定性(n=6)条件 浓度(ng/ml) 标准偏差
(%)加入量 测得量 3次冻融 5 4.77 6.53 50 44.53 4.12 200 189.22 7.46 −20 ℃冷冻20 d 5 4.74 8.25 50 45.12 4.37 200 190.98 8.33 室温下(20 ℃)存放4 h 5 4.76 2.56 50 44.43 6.87 200 188.23 5.53 自动进样器(4 ℃)存放24 h 5 4.72 8.12 50 46.33 7.97 200 189.23 6.63 3.2 药动学试验
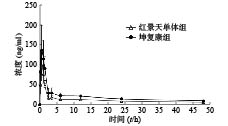
该方法用于大鼠口服红景天苷单体和坤复康片的药动学研究。图3和表3给出了通过DAS 2.0计算两组大鼠的平均浓度-时间曲线及其药动学参数的数据。浓度-时间曲线见图3。与红景天苷单体组相比,坤复康片组中cmax、AUC0−t和AUC0−∞的水平显著增加。
表 3 红景天苷大鼠体内药动学参数($\bar x \pm s,\;n = 6$ )参数 红景天苷单体组 坤复康片组 t1/2 (t/h) 36.08±6.63 27.44±9.87 MRT (t/h) 16.11±0.82 15.97±0.61 CL[L/(kg·h)] 0.022±0.003 0.016±0.003 cmax (ng/ml) 85.81±15.66 143.86±46.91* AUC0−t (ng·h/ml) 587.11±35.02 956.35±47.65** AUC0−∞ (ng·h/ml) 917.61±121.43 1 296.47±249.32* tmax (t/h) 0.50±0.00 0.83±0.47 *P <0.05,** P <0.01,与红景天苷单体组比较。 4. 讨论
本实验建立了新的血浆中红景天苷的LC/MS/MS测定方法,方法简单方便易行,分离效率好,专属性强,血浆中杂质或内源性物质对待测物均不产生干扰,保留时间短、灵敏、稳定可靠,适用于针对红景天苷大鼠血浆样本的批量检测。
实验结果显示,给大鼠分别予红景天苷单体和坤复康片灌胃后,红景天苷的一些药动学特征,如t1/2、MRT在两组中未见差异,说明复方中其他成分可能对红景天苷的体内消除过程影响较小。另一方面,部分药动学参数显示出显著差异,主要表现为两组AUC0−t、AUC0−∞、cmax均有显著差异,表明复方给药增加了红景天苷吸收入体内的血药浓度和体内暴露量,提示该复方成分对红景天苷有增加吸收的作用。该结果证明了方剂配伍可明显影响彼此在体内化学成分的药动学参数,说明在中医辨证理论指导下的复方配伍原则具有丰富的科学内涵。
根据文献[11]报道,除红景天苷外,坤复康片主要还包括氧化苦参碱、苦参碱、芍药内酯苷、芍药苷及苯甲酰芍药苷等若干种成分,复方中几味药材间存在复杂的相互作用,从而可能导致药效发生改变,值得我们进一步深入研究。
-
[1] ZHANG Z H, YANG L, HOU J, et al. Promising positive liver targeting delivery system based on arabinogalactan-anchored polymeric micelles of norcantharidin[J]. Artif Cells Nanomed Biotechnol,2018,46(sup3):S630-S640. doi: 10.1080/21691401.2018.1505742 [2] ChANG C, ZHU Y Q, TANG X T, et al. The anti-proliferative effects of norcantharidin on human HepG2 cells in cell culture[J]. Mol Biol Rep,2011,38(1):163-169. doi: 10.1007/s11033-010-0090-6 [3] LAWRENCE M, REES G D. Microemulsion-based media as novel drug delivery systems[J]. Adv Drug Deliv Rev,2000,45(1):89-121. doi: 10.1016/S0169-409X(00)00103-4 [4] 李柏, 朱立峰, 张亚妮, 等. 去甲斑蝥素两种注射剂型小鼠急性毒性比较[J]. 中西医结合学报, 2007, 5(1):74-77. [5] WANG S B, GUO S R, CHENG L. Disodium norcantharidate loaded poly(Epsilon-caprolactone) microspheres I. Preparation and evaluation[J]. Int J Pharm,2008,350(1-2):130-137. doi: 10.1016/j.ijpharm.2007.08.030 [6] 李琦, 范忠泽, 李先茜, 等. 去甲斑蝥素微球介入治疗大鼠肝癌疗效及其机制研究[J]. 中西医结合学报, 2006, 4(4):378-383. [7] 吴卫平, 王宁. 微球用于肝肿瘤介入治疗中的效果观察[J]. 中华肿瘤防治杂志, 2016, 23(S2):22-23. [8] 文庆怡, 张光宇, 周晓峰, 等. 去甲斑蝥素-N-乳糖酰壳聚糖/丝素蛋白微球在兔体内的抗肿瘤作用[J]. 中国新药杂志, 2014, 23(9):1075-1080. [9] LIN X, ZHANG B, ZHANG K R, et al. Preclinical evaluations of norcantharidin-loaded intravenous lipid microspheres with low toxicity[J]. Expert Opin Drug Deliv,2012,9(12):1449-1462. doi: 10.1517/17425247.2012.724675 [10] 李素珍, 刘为萍, 朱静, 等. 去甲斑蝥素立方液晶纳米粒制备及体外释放度研究[J]. 中华中医药杂志, 2017, 32(12):5566-5568. [11] CAPAN Y, WOO B H, GEBREKIDAN S, et al. Preparation and characterization of poly (D, L-lactide-co-glycolide) microspheres for controlled release of poly(L-lysine) complexed plasmid DNA[J]. Pharm Res,1999,16(4):509-513. doi: 10.1023/A:1018862827426 [12] 郑连英. 甲壳低聚糖的研究进展[J]. 材料科学与工程, 1999, 17(3):97-100. [13] ELGADIR M A, UDDIN M S, FERDOSHH S, et al. Impact of chitosan composites and chitosan nanoparticle composites on various drug delivery systems: a review[J]. J Food Drug Anal,2015,23(4):619-629. doi: 10.1016/j.jfda.2014.10.008 [14] 徐晓莉, 李晓森, 王钦, 等. 人肝肿瘤细胞SMMC-7721、HepG2对去甲斑蝥素-半乳糖修饰壳聚糖纳米粒的摄入及S180荷瘤小鼠在体抗肿瘤活性的影响[J]. 中国老年学杂志, 2017, 37(15):3661-3664. doi: 10.3969/j.issn.1005-9202.2017.15.009 [15] DING X Y, HONG C J, LIU Y, et al. Pharmacokinetics, tissue distribution, and metabolites of a polyvinylpyrrolidone-coated norcantharidin chitosan nanoparticle formulation in rats and mice, using LC-MS/MS[J]. Int J Nanomedicine,2012,7:1723-1735. [16] 张亚会. 甘草次酸囊泡包裹的N-乳糖酰壳聚糖纳米粒的制备及质量评价[D]. 兰州: 甘肃中医药大学, 2016. [17] 李文渊, 童丽, 热增才旦. 纳米胶束作为药物载体的研究进展[J]. 中国执业药师, 2009, 6(12):36-40. [18] 王琳, 陆丹玉, 方晨. 去甲斑蝥素纳米胶束的制备及抑瘤作用研究[J]. 中国药房, 2017, 28(19):2680-2684. doi: 10.6039/j.issn.1001-0408.2017.19.25 [19] 王琳, 张雅娟, 杨智钧, 等. 碳酸酐酶Ⅸ抗体修饰去甲斑蝥素纳米胶束的肺靶向性研究[J]. 中药药理与临床, 2017, 33(1):52-56. [20] HE C, HU Y P, YIN L C, et al. Effects of particle size and surface charge on cellular uptake and biodistribution of polymeric nanoparticles[J]. Biomaterials,2010,31(13):3657-3666. doi: 10.1016/j.biomaterials.2010.01.065 [21] 顾宗林, 王佳明, 郭哲宁, 等. 去甲斑蝥素脂质体的制备及其体外释放特性的研究[J]. 抗感染药学, 2012, 9(4):277-280. doi: 10.3969/j.issn.1672-7878.2012.04-009 [22] 周奕, 叶建林. 乳糖化-去甲斑蝥素磷脂复合物pH敏感型脂质体肝靶向抗肿瘤活性研究[J]. 中草药, 2014, 45(19):2803-2808. [23] 周奕, 许静玉, 管敏, 等. 乳糖化-去甲斑蝥素磷脂复合物及其pH敏感型脂质体的制备[J]. 中国新药杂志, 2011, 20(17):1631-1638. [24] 熊友香, 汤红霞, 马瑞, 等. 去甲斑蝥素/粉防己碱双载药脂质体的制备工艺及体外释放性质考察[J]. 中国中药杂志, 2018, 43(12):2531-2536. [25] 张莉. 肝靶向去甲斑蝥素微乳的研究[D]. 成都: 四川大学, 2004. -

 点击查看大图
点击查看大图
计量
- 文章访问数: 6248
- HTML全文浏览量: 2555
- PDF下载量: 50
- 被引次数: 0





 下载:
下载:



 下载:
下载:
