-
阿尔茨海默症(Alzheimer's disease,AD)是常见的神经系统变性疾病之一,是一种持续性神经功能障碍,也是痴呆最常见的病因,其发生可导致进行性记忆减退、认知障碍、人格改变等症状。65岁以上患病率约5%,85岁以上患病率高于20%,是老年人死亡的主要原因之一[1-3]。AD的病理特征主要是老年斑(senile plaques,SP)、神经纤维缠结(neurofibrillary tangles,NFTs)和广泛神经元缺失。tau蛋白是一种微管相关蛋白,过度磷酸化tau蛋白是造成神经纤维缠结的主要原因,且AD患者病情严重程度与tau蛋白具有明显相关性。因此,tau蛋白显像剂的研究逐渐受到关注[4-5]。
近年来,研究者们研发了多种tau蛋白的PET显像剂,如“THK系列”(包括18F-THK5105、18F-THK523、18F-THK5117、18F-THK5351)[6-8],“RO系列”(包括18F-RO6958548、11C-RO6931643、11C-RO6924963)[9-11],“T系列”(包括18F-T807、18F-T808)[12]以及11C-PBB3[13]等。其中“T系列”18F-T807和18F-T808是由Simens公司开发的tau蛋白的分子探针。
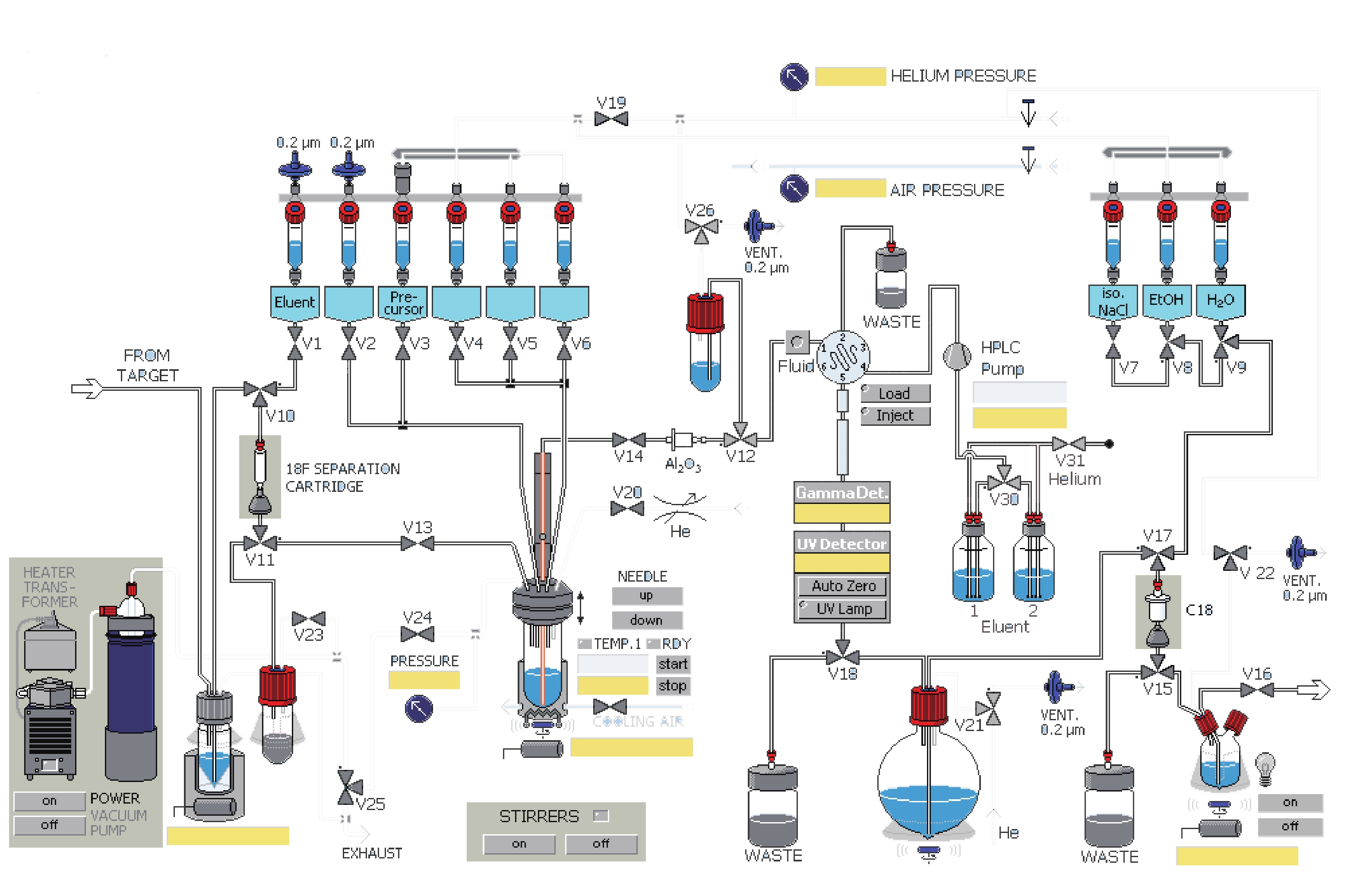
课题组在参考相关文献的基础上[14-15],使用GE公司的TRACERlab FXFN氟多功能合成模块(图1),以18F-T807前体(BOC保护)NPPI-95(1)为原料,使用改进一锅法自动合成了18F-T807(2),提高了产品产率,并开展初步的正常大鼠生物分布实验,探索其分布特征。
-
18F-T807前体(BOC保护)NPPI-95(江苏华益公司);强阴离子交换固相萃取柱(QMA柱)、K222、碳酸钾水溶液、乙腈、(德国ABX公司);乙醇(国药化学试剂);盐酸(国药分析质检中心);DMSO(北京百灵威);Ultimate C18柱(美国Waters: 4.6 mm×250 mm,5 μm);富18O水(日本大阳日酸株式会社);0.22 μm MILLEX-GS液体滤膜、0.2 μm Millex-25空气滤膜(德国默克);0.7 mm×40 mm针头(西班牙BD Microlance);Wistar大鼠(北部战区总医院实验动物科)。溶剂乙醇为色谱纯,其余均为分析纯。
TRACERlab FXFN(美国GE)配备半制备VP 250×16高效液相色谱(德国MN)和紫外检测器及放射性检测器;正电子示踪剂质量控制薄层扫描仪(美国Bioscan),配塑料闪烁体晶体探测器;分析用HPLC(北京优联);GC-7900气相色谱(北京天美);CRC 25R活度计(美国Capintec),合成条件满足药品生产质量管理规范(GMP)的要求。
-
表 1 TRACERlab FXFN合成器各溶剂瓶预装溶剂
溶剂瓶 溶剂 1号瓶(V1) 1.5mg K2CO3溶于0.5 ml水 2号瓶(V2) 1.5 mg K222溶于1ml乙腈 3号瓶(V3) 1 mg前体溶于1.2 ml DMSO溶剂 5号瓶(V5) 1.5 ml HPLC流动相 6号瓶(V6) 1.5 ml HPLC流动相 圆底烧瓶 2 ml 84%NaHCO3水溶液和30 ml水 7号瓶(V7) 9 ml 0.9%生理盐水 8号瓶(V8) 1 ml 乙醇 9号瓶(V9) 10 ml 水 18F-T807自动化合成主要有以下几步:①18F-离子的柱分离纯化及蒸馏干燥。②T807前体的18F-离子亲核取代反应。③18F-T807的HPLC分离纯化。④18F-T807 C18柱溶剂转换与再纯化。
自动合成的具体步骤如下:
(1)共2.5 ml含18F-离子的18O水由MINItrace加速器经由18O(p, n)18F反应制备,轰击束流45μA,轰击时间40 min,18F-离子混合液由氦气作为载气经过TARGET管线传输到TRACERlab FXFN合成模块的锥形瓶内。
(2)V10、V11号阀门开启,18F-离子及18O水混合液中的18F-离子在真空泵抽取下被QMA柱(由1 ml乙醇,2 ml水活化)捕获滞留,18O水回收进入18O水回收瓶。
(3)V1、V13、V24号阀门开启,V1号瓶内的K2CO3溶液流经V1、V10、QMA柱、V11、V13,将18F-离子交换抽入反应瓶。
(4)关V1、V13号阀门,开启V2号阀门将V2号瓶内穴醚K222乙腈溶剂抽入反应管,18F-离子进入穴醚形成复合物。
(5)关V2号阀门,开启V20号阀门混合液在氦气吹拂下于85 ℃共沸蒸馏8 min,然后加热到110 ℃,在氦气吹拂下共沸蒸馏4 min除水。
(6)开启V3、V19号阀门,在氦气推动下V3号瓶内的前体流入反应管,V3、V19、V24号阀门关闭,反应管加热到140 ℃,反应10 min。
(7)反应瓶降温到50 ℃,开V24、V25号阀门恢复大气压。
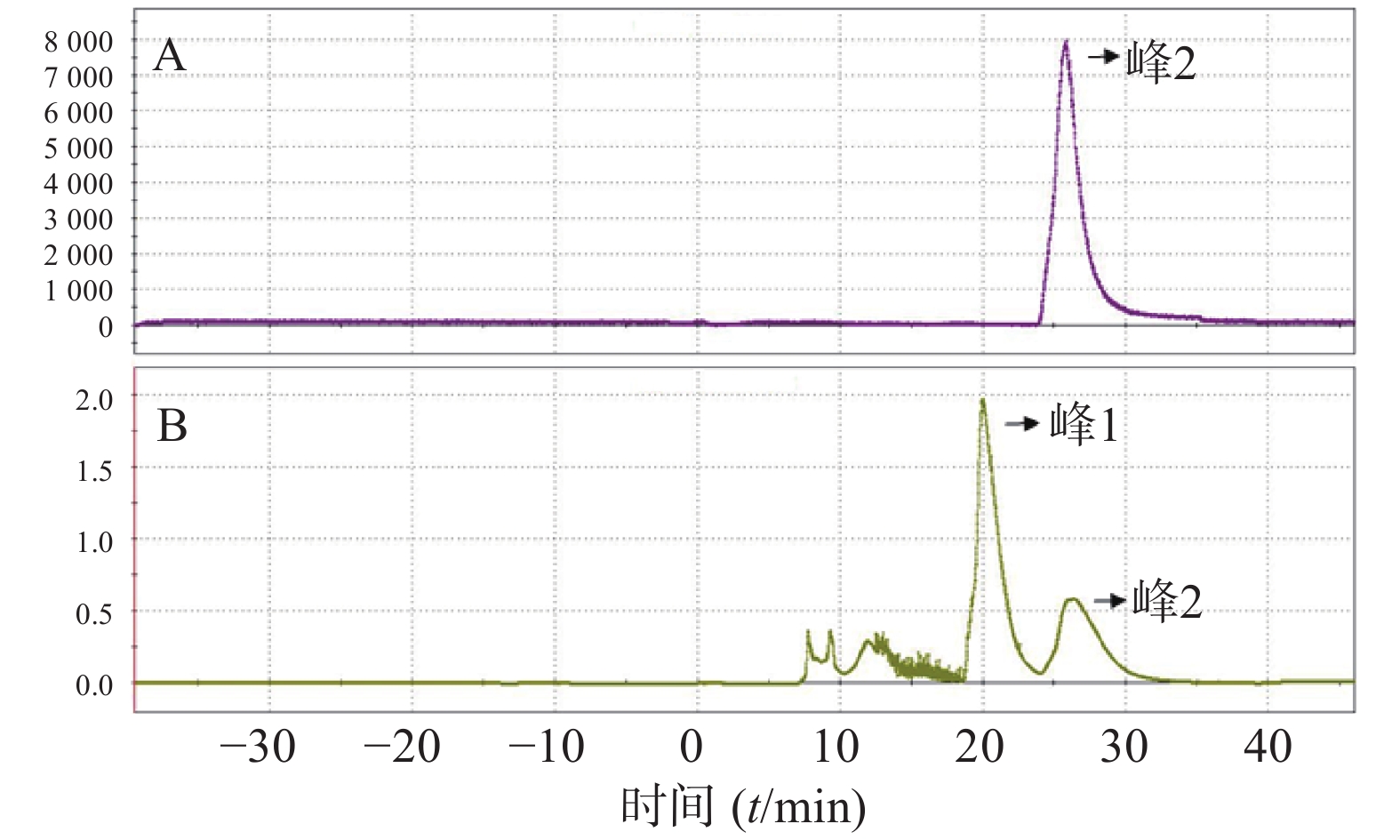
(8)反应后混合液经由V5、V6号瓶内的共3 ml HPLC流动相(25%乙醇水溶液,调整pH至2.0)冲洗到V26号阀门下的中转瓶内,然后打开V26、V12号阀门,在氦气压力下经由Fluid进入HPLC进样环,在Fluid控制下进样环旋转,产物进入HPLC半制备柱,Eluent1号瓶内流动相以5 ml/min的流速通过柱子分离。流动相以紫外(UV,λ=254 nm)和放射计数器监测。图3是18F-T807的HPLC及UV图。
(9)18F-T807溶液通过V18号阀门进入圆底瓶,圆底瓶内装有2 ml 84% NaHCO3水溶液和30 ml无菌注射用水。然后经V21、V15、V17号阀门,产物溶液通过V15、V17号阀门间的C18柱(以5 ml乙醇和10 ml水活化),产物会被捕获滞留在柱子上,然后打开V9阀门,用V9号瓶内10 ml水冲洗柱子到废液瓶(WASTE)内,然后C18柱经由V8号瓶内的1 ml乙醇冲洗进入V15阀门下的产品瓶,再经由V7号瓶内装有9 ml生理盐水再次冲洗。
(10)手动打开V22和V16号阀门,18F-T807在氦气压力下经过0.22μm液体滤膜过滤进入分装热室的收集瓶。
-
对3批连续生产的产物进行了质量控制。质控项目包括澄明度、pH、核素半衰期、核素纯度、放化纯度、K222和残留溶剂、细菌内毒素、无菌测试,测试结果均符合标准要求。
-
选择健康雄性Wistar大鼠30只,分为6组,每组5只,实验前6 h禁食禁水,每只通过尾静脉注入0.2 ml(约7.4 MBq)的18F-T807后,分别在5、15、30、60、90、120 min断头处死,取出脑、心、肝、肺、肾、肌肉、骨和血,去污、称重、计数,数据经衰减校正后计算放射性摄取率(每克组织的放射性摄取剂量占注射剂量的百分比)。
-
18F-T807有多种合成方法,本文在参考相关文献报道基础上,优化反应条件,改变前体用量为1 mg,同时使用HPLC分离条件为25%乙醇水溶液, pH调整至2.0,在线脱BOC保护。C18柱溶剂转换与再纯化,应用经改进的合成方法使合成产率由(20.5±6.1)%提高到(25.7±5.8)%,总反应时间为70 min。
连续3批产品,其质量控制结果如下:肉眼观察溶液无色透明,6 h后pH值为7,半衰期满足要求,不包含长半衰期核素(t1/2>5天),核素纯度大于99.5%,HPLC和TLC分析结果,即化学纯度和放化纯度合格,流动相是50%甲醇/水(HCl调节pH至2,),流速1.3 ml/min,紫外检测波长为254 nm,TLC条件为NH3H2O-甲醇-CH2Cl2 (1∶5∶94),气相色谱结果显示残留的丙酮、乙腈、DMSO等溶剂均在检测线下,细菌内毒素实验(鲎试剂法)合格,无菌检查合格。各项结果表明产品符合人体使用标准。
正常大鼠18F-T807在体内的生物分布如表2所示,可见大部分器官在给药5 min后摄取率最高,其中肾、肝、血的摄取率较高,超过5.56%ID/g(%ID/g为放射性摄取率,即各器官的每克放射性摄取值),在肌肉、骨骼摄取率相对较低,因此推断18F-T807主要是经过肝肾排出体外。18F-T807的脑、心、肺摄取率最低,120 min已降低至本底水平(1.08% ID/g),各器官的放射性摄取率随时间的推移逐渐降低,但清除较慢,在120 min 时大部分器官仍有较高的摄取率。
表 2 18F-T807在正常大鼠体内的分布(
$ \bar x \pm s $ ,n=5)器官 放射性摄取率(% ID/g) 5 min 15 min 30 min 60 min 90 min 120 min 脑 2.25±0.18 2.03±0.86 1.81±0.54 1.59±0.62 1.20±0.57 1.11±0.38 心 2.05±0.58 1.99±0.66 1.78±0.31 1.55±0.25 1.19±0.74 1.08±0.36 肝 5.79±2.58 5.95±1.17 5.48±0.66 5.29±0.71 4.83±0.84 4.27±0.86 肺 2.12±0.91 2.01±0.56 1.91±0.19 1.57±0.73 1.21±0.52 1.09±0.23 肾 7.36±4.01 5.11±1.21 3.89±1.99 3.63±1.82 3.17±1.68 2.99±0.98 肌肉 2.34±0.86 2.57±1.18 2.44±0.95 2.19±1.36 2.04±1.03 1.51±0.89 骨 2.58±0.91 2.67±0.75 2.02±0.68 1.99±0.82 1.52±0.46 1.27±0.55 血 5.56±0.35 5.41±0.56 4.73±0.74 4.57±1.31 4.22±0.37 4.01±0.45 -
在TRACERlab FXFN合成器上使用优化条件的一锅法自动合成了18F-T807,提高了产品产率。合成后进行的各种质量控制检测均显示产品符合质控标准。初步的正常大鼠生物分布实验,显示了其不同时间放射性摄取率的分布情况,为应用该产品开展人体显像提供了重要基础。
Synthesis method optimization and biodistribution study of 18F-T807 on TRACERlab FXFN synthesizer
-
摘要:
目的 优化18F-T807的合成方法,并进行初步生物分布研究。 方法 使用TRACERlab FXFN合成器,以BOC(t-Butyloxy carbonyl)保护的18F-T807前体NPPI-9为起始原料,改进实验条件进行合成,进行质量控制分析和Wistar大鼠生物分布研究。 结果 改进合成条件合成产率由(20.5±6.1)%提高到(25.7±5.8)%,质控符合标准,Wistar大鼠肾、肝、血分布较高,在脑、心、肺摄取最低。 结论 使用改进一锅法合成18F-T807简便易行,产率高,可以满足科研与临床的需求。 Abstract:Objective To optimize the synthesis method of 18F-T807 and study preliminary biodistribution. Methods 18F-T807 was synthesized using an optimized method in TRACERlab FXFN synthesizer with a t-BOC(t-Butyloxy carbonyl)-protected 18F-T807 precursor NPPI-9 as starting material, improving experimental conditions for synthesis, then QC and biodistribution study in Wistar rats conducted. Results The improved synthesis conditions increased the synthesis yield from 20.5%±6.1% to 25.7%±5.8%. QC met the standard. Wistar rats had higher intake in kidney, liver, blood and lowest intake in brain, heart, lung. Conclusion The optimized synthesis method to synthesize 18F-T807 is simple and easy, and high yield, which can meet the needs of scientific research and clinical practice. -
Key words:
- T807 /
- tau protein /
- radiopharmaceutical /
- PET
-
针对非小细胞肺癌(NSCLC)的靶向药EGFR-TKIs,自第一代问世以来发展迅速,目前第四代已在临床研发阶段。但由于新的耐药突变的不断产生,导致其应用受限。因此如何克服EGFR-TKIs耐药问题和寻找可改善肺癌靶向治疗耐药的药物已成当务之急。植物来源的单体成分种类繁多,应用前景巨大。毒胡萝卜(Thapsia garganica L.,伞形科毒胡萝卜属)是于地中海西部沿海地区发现的一种开花植物,一直被作为止痛剂应用于传统医学。毒胡萝卜素是从该植物中分离的单体化合物,作为内质网应激(ERS)的诱导剂,近年也被用于抗肿瘤和抗病毒研究。吉非替尼作为第一代EGFR-TKIs,副作用小,有效率高。本研究旨在探讨毒胡萝卜素和吉非替尼联合用药对人肺腺癌耐药细胞株PC9/GR耐药性的影响,并探讨其可能的机制。
1. 材料与方法
1.1 实验材料
吉非替尼(纯度99.94%,HY-50895)、毒胡萝卜素(纯度99.95%,HY-13433)、CCK8试剂(HY-K0301-500T)均购自美国MCE公司;胎牛血清(F8318-500ML)和DMEM培养基(D6429-500ML)购自美国Sigam Aldrich公司;胰酶(25200-072)购自美国Gibco公司;凋亡试剂盒(559763)购自美国BD公司; ATF-6抗体(#65880)、IRE1α抗体(#3294)均购自美国CST公司;羊抗兔二抗(AS003)购自abclonal;PVDF膜购自Millipore;其余试剂均为国产分析纯试剂。人肺腺癌细胞(PC9)由同济医院惠赠,PC9/GR细胞购自湖南丰晖生物科技有限公司。
1.2 方法
1.2.1 细胞株及细胞培养
PC9细胞使用DMEM培养基培养,其中含10%的胎牛血清、100 U/ml的青霉素和100 μg/ml的链霉素,于37 ℃、5% CO2的恒温培养箱中孵育。PC9/GR细胞使用上述培养基维持培养并额外含800 ng/ml的吉非替尼。
1.2.2 CCK8法检测细胞增殖
检测细胞对吉非替尼的耐药性:分别取对数生长期的PC9和PC9/GR细胞制成单细胞悬液,调整细胞浓度为40 000/ml,接种于96孔板,每孔100 μl细胞悬液,在培养箱中孵育过夜。吸弃96孔板上清液,加入含药培养基(PC9细胞中吉非替尼浓度分别为0、1、5、10、20、40、80、250、500、1 000 nmol/L;PC9/GR细胞中吉非替尼的浓度分别为0、1、10、100、1 000、2 500、5 000、10 000、20 000、40 000 nmol/L),同时设对照组,每组设4个复孔。72 h时吸弃上清液,再加入含CCK8的DMEM,0.5 h后用酶标仪检测A450。
检测毒胡萝卜素对细胞增殖的影响:分别取对数生长期的PC9和PC9/GR细胞同上述处理铺96孔板,贴壁后加入浓度为0.1、1、10、100、1 000、10 000 nmol/L的毒胡萝卜素,同时设对照组,每组设4个复孔。72 h时使用CCK8法检测A450。
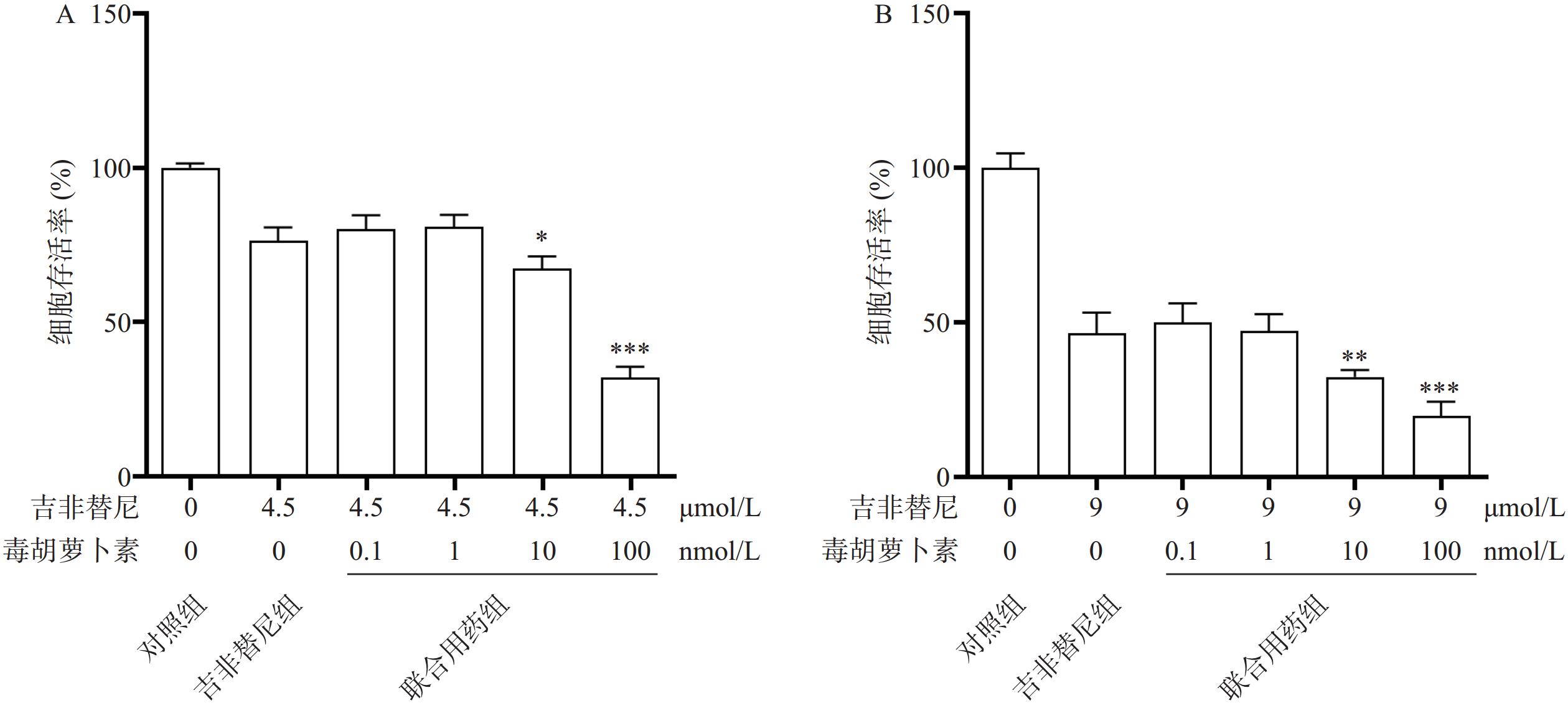
检测毒胡萝卜素对PC9/GR细胞耐药的逆转:取PC9/GR对数生长期的细胞同上述处理铺96孔板,设12组,加入吉非替尼的浓度分别为0、4.5、4.5、4.5、4.5、4.5、0、9、9、9、9、9 μmol/L,毒胡萝卜素的浓度分别为0、0、0.1、1、10、100、 0、0、0.1、1、10、100 nmol/L。72 h时用CCK8法检测A450。
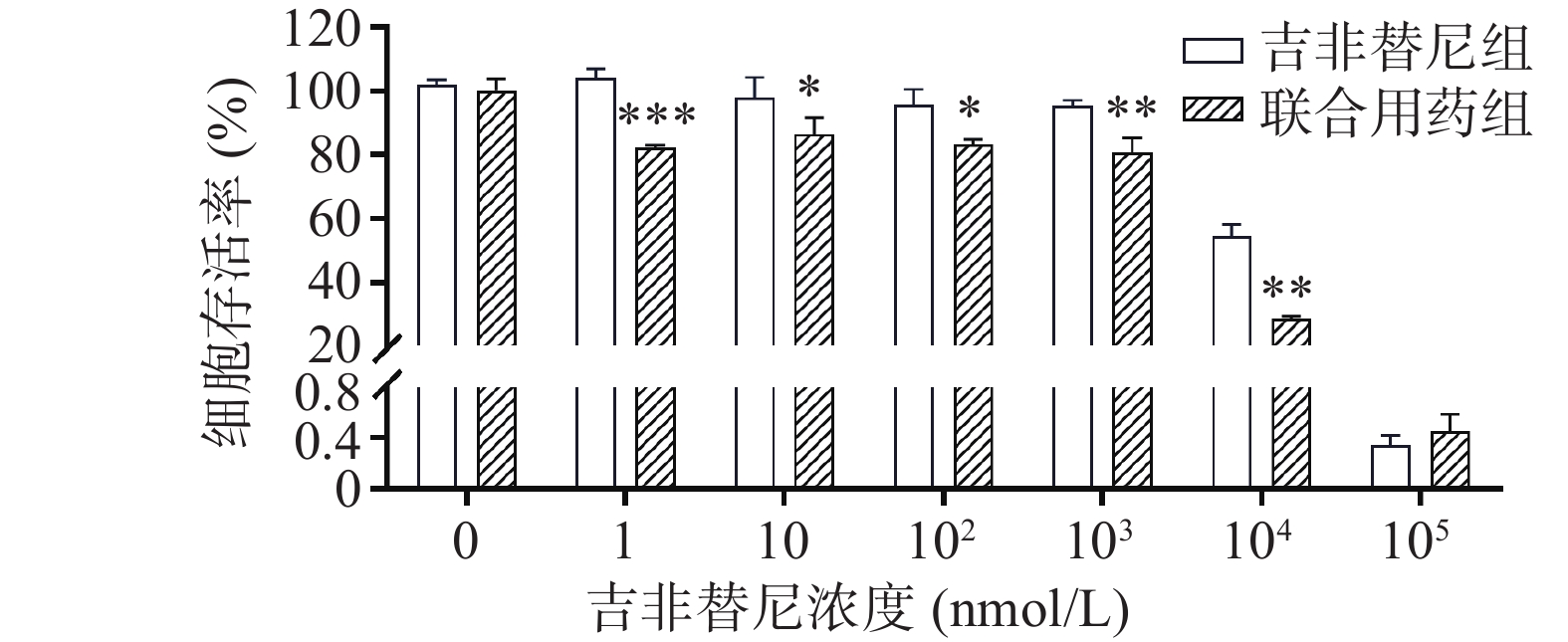
检测毒胡萝卜素对PC9/GR细胞耐药的逆转:取PC9/GR对数生长期的细胞同上述处理铺96孔板,设两组,为吉非替尼单药组和联合用药组:其中单药组设7个小组,加入吉非替尼的浓度分别为0、1、10、102、103、104、105 μmol/L;联合用药组设7个小组,每小组加入10 nmol/L的毒胡萝卜素,同时加入浓度分别为0、1、10、102、103、104、105 nmol/L的吉非替尼。72 h时用CCK8法检测A450。逆转倍数(RF)=逆转前的IC50值/逆转后的IC50值。
1.2.3 流式细胞术检测细胞凋亡
取对数生长期的PC9/GR铺6孔板,每孔3×105个细胞,孵育过夜,吸弃上清液,加入含药培养基(对照组为9 μmol/L的吉非替尼组,实验组为9 μmol/L的吉非替尼组+10 nmol/L的毒胡萝卜素联合用药组),孵育72 h后,收集上清液及贴壁细胞,按说明书加入膜联蛋白(Annexin V-PE),室温孵育20 min后,再加入7-AAD,5 min后,收集细胞,流式细胞仪上机检测。
1.2.4 蛋白印迹法检测PC9/GR细胞ERS相关蛋白IRE1α、ATF-6的表达
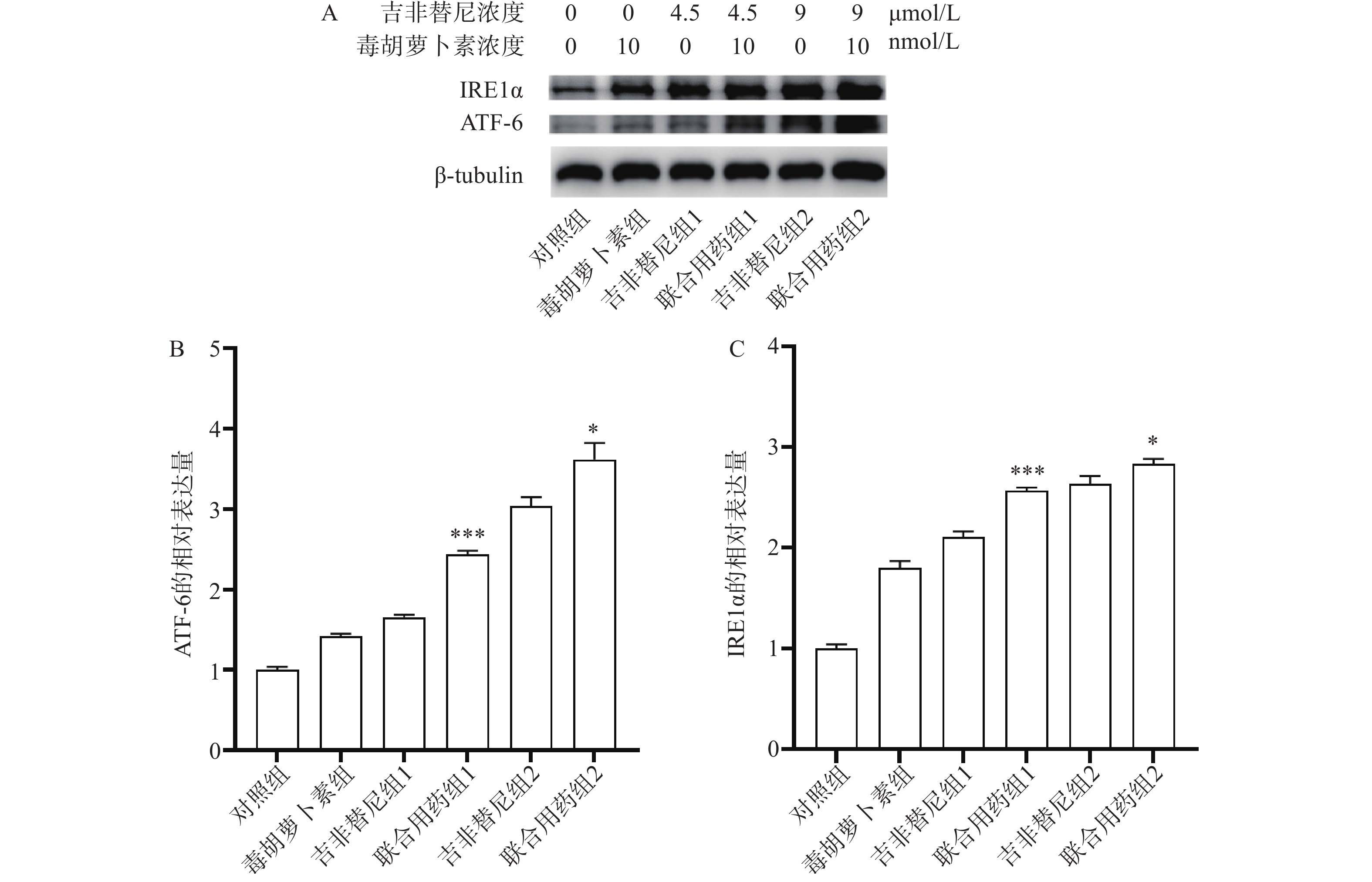
取对数生长期的PC9/GR铺6孔板,每孔3×105个细胞,孵育过夜,吸弃上清液,加入含药培养基(每孔吉非替尼浓度依次为0、0、4.5、4.5、9、9 μmol/L,毒胡萝卜素浓度依次为0、10、0、10、0、10 nmol/L),培养72 h,去上清液,收集细胞蛋白,BCA法测量样品中总蛋白浓度。蛋白变性后取蛋白样品,使用蛋白印迹法检测IRE1α、ATF-6蛋白表达。
1.3 统计学处理
数据采用GraphPad Prism 9软件进行统计分析,计量资料用(
$ \bar x $ ±s)表示,符合正态分布和方差齐性者采用单因素方差分析的单向分类方差分析(ANOVA),对取得的数据两两比较使用 LSD 检验。以P<0.05 为有统计学意义。2. 结果
2.1 吉非替尼对PC9和PC9/GR细胞株的IC50值
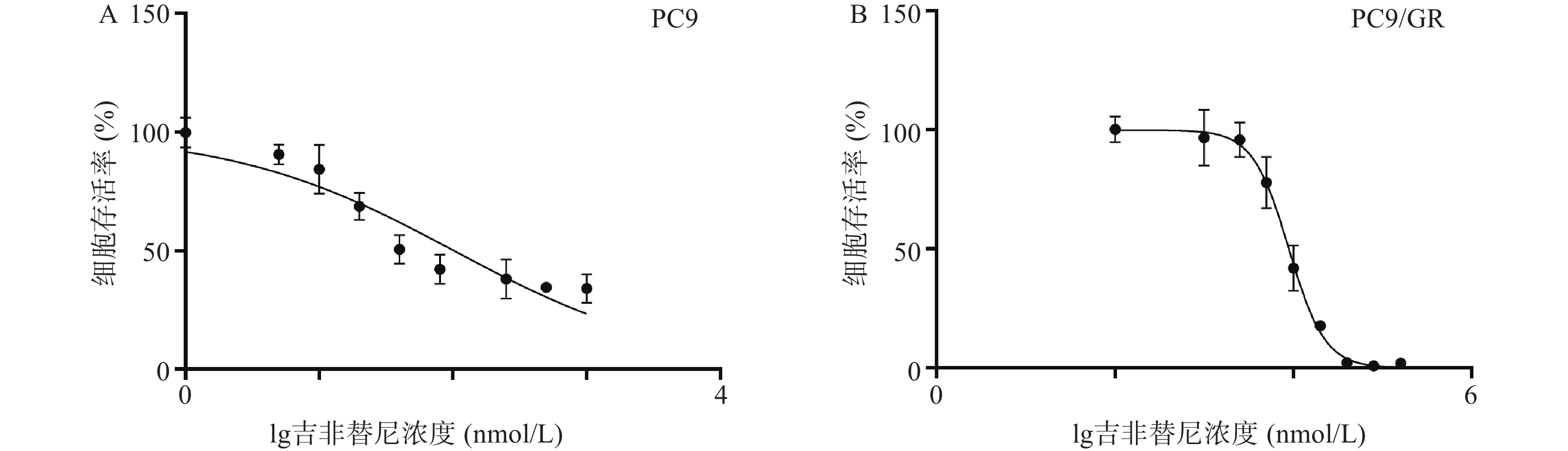
吉非替尼对人肺腺癌细胞株PC9和PC9/GR的IC50值经计算分别为0.1019 μmol/L(图1A)和8.912 μmol/L(图1B),按公式计算耐药倍数为87.5(本课题中PC9和PC9/GR细胞株的IC50值分别以0.1 μmol/L和9 μmol/L进行实验)。
2.2 CCK8法检测毒胡萝卜素对细胞增殖的影响
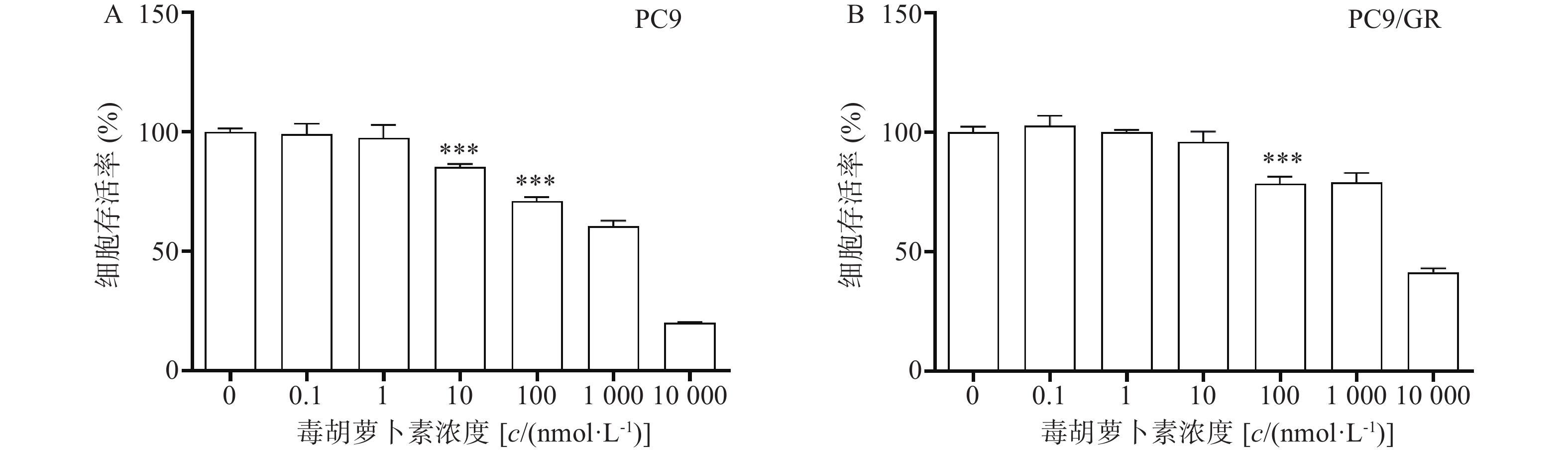
毒胡萝卜素对人肺腺癌细胞株PC9和PC9/GR的增殖均有抑制作用,呈剂量依赖性。当毒胡萝卜素浓度为10 nmol/L时,对PC9和PC9/GR的抑制率分别为14.7%(图2A)和4.11%(图2B)。毒胡萝卜素浓度为10 nmol/L时对PC9细胞的增殖显示较弱的抑制作用,而对PCR/GR细胞增殖的作用与对照组相比无统计学差异。抑制率(IR)=(1−药物组A值/对照组A值)×100%。本课题中,毒胡萝卜素的工作浓度选择10 nmol/L或者围绕10 nmol/L进行设计。
2.3 毒胡萝卜素对PC9/GR耐药的逆转作用
相比于吉非替尼单独用药,毒胡萝卜素(浓度依次为0、0.1、1、10、100 nmol/L)和吉非替尼(4.5 μmol/L或9 μmol/L)联合用药72 h时,PC9/GR的细胞增殖率在10 nmol/L和100 nmol/L时显著下降,并且具有统计学差异性(图3A、B)。
在不同浓度(0、1、10、102、103、104、105 nmol/L)的吉非替尼联合10 nmol/L的毒胡萝卜素作用后,PC9/GR的细胞增殖率相比吉非替尼单独用药(吉非替尼组浓度依次为0、1、10、102、103、104、105 nmol/L)也出现了下降,具有统计学差异(图4)。计算得出吉非替尼单独用药的IC50值为11.039 μmol/L,联合用药后其IC50值为3.584 μmol/L,其RF为3.15。
2.4 药物作用对PC9/GR细胞凋亡的影响
与对照组(图5A)、吉非替尼单独作用(图5B)、毒胡萝卜素单独作用(图5)相比,联合用药(图5)后PC9/GR细胞早期凋亡和晚期凋亡的比例均相应增加,并且具有统计学差异(图5)。说明毒胡萝卜素在一定程度上可以改善PC9/GR细胞的耐药性。
2.5 Western blotting法检测药物作用对细胞PCR/GR中ATF-6和IRE1α蛋白表达的影响
结果显示,与吉非替尼组1或2相比,药物作用后联合用药组1或联合用药组2中PC9/GR细胞的ATF-6及IRE1α蛋白表达均上调(图6A),并且有统计学差异(图6B、C)。ATF-6和IRE1α均是ERS的指标蛋白,说明PC9/GR细胞在药物联合作用后发生了ERS。
3. 讨论
肺癌是当今世界最常见、致死率最高的恶性肿瘤之一,严重危害人类健康[1]。NSCLC是最常见的病理类型,约占所有比例的85%[2]。约70%的NSCLC患者在确诊时已处于晚期,失去了手术的机会。近年来,NSCLC的分子靶向治疗发展迅速,靶向药EGFR-TKIs不断更新,成为放化疗和免疫治疗之外的重要治疗手段之一。
截止目前,EGFR-TKIs已从第1代发展至第3代[3],且有多款第4代靶向药已进入临床实验阶段。然而由于抗肿瘤耐药性,患者使用靶向药一定时间后不可避免的会出现耐药[4]。于是寻找能够克服肿瘤耐药的药物及方法已经成为肿瘤治疗领域中亟待解决的问题。由于中草药植物的毒副作用小且疗效明确,故从中寻找能够克服肿瘤耐药的成分已经成为一种趋势。毒胡萝卜素是从地中海菊属植物中提取的单体成分[5],作为常用的ERS的诱导剂,毒胡萝卜素在科研中有着广泛的应用[6]。也有文献报道其有抗肿瘤活性[7],同时对冠状病毒、合胞病毒、甲型流感病毒等有较强的抑制作用[8]。本研究中使用的吉非替尼耐药细胞株PC9/GR经CCK8实验证明其对吉非替尼具有耐药性。实验结果显示,吉非替尼对PC9的IC50值为0.1019 μmol/L(图1A),对PC9/GR的IC50值为8.912 μmol/L(图1B),耐药倍数为87.6。当毒胡萝卜素浓度为 10 nmol/L时,对PCR/GR细胞增殖的作用与对照组相比无统计学差异,故该浓度的毒胡萝卜素未显示出对PCR/GR的细胞增殖的抑制作用(图2B),故本课题中毒胡萝卜素选择10 nmol/L作为实验浓度。而提高毒胡萝卜素的浓度,其对PC9/GR细胞抑制率也增加,表明毒胡萝卜素本身对于肺腺癌细胞PC9/GR具有抑制作用。实验发现联合用药中当毒胡萝卜素浓度为大于或等于10 nmol/L时,PCR/GR细胞的增殖相比吉非替尼单独用药受到了更强的抑制,并具有显著性差异(图3A、B)。本课题同时使用不同浓度的吉非替尼联合10 nmol/L的毒胡萝卜素共同作用于PC9/GR细胞,结果发现所有联合用药组相比于吉非替尼单独用药组,均对PC9/GR细胞的生长产生抑制作用。分别计算吉非替尼单药和联合用药对PC9/GR细胞的IC50值,发现联合用药的IC50值降低(图4),逆转倍数为3.15。说明10 nmol/L的毒胡萝卜素可以有效改善PC9/GR对吉非替尼的耐药。
肿瘤细胞的耐药性严重影响着患者的预后。耐药突变、自噬、肿瘤免疫微环境都是肿瘤细胞产生耐药的因素[9]。由于耐药突变,EGFR-TKIs治疗已经陷入了研究人员开发新药物与肿瘤细胞产生新耐药突变的循环之中。近年来,因自噬异常与肿瘤发生和进展、细胞死亡及抗肿瘤治疗疗效相联系而受到广泛关注[10]。但是抑制自噬只能延缓EGFR-TKI耐药的产生,并不能有效解决耐药的问题[11]。因此,耐药问题亟待找到新的解决方法。体内低氧、低糖等恶劣环境会导致肿瘤细胞发生ERS,并启动未折叠蛋白反应从而让细胞重新恢复稳态。ERS过度可启动细胞凋亡。因此,ERS也与肺癌治疗息息相关[12]。毒胡萝卜素作为研究ERS常用的激动剂,是一种特异性的肌浆/内质网Ca2+-ATP酶抑制剂,能够使内质网中Ca2+量减少、未折叠蛋白增多,引起ERS[13]。本研究中通过细胞凋亡实验发现,和单独用药相比,毒胡萝卜素联合吉非替尼联合用药可以进一步促进PC9/GR细胞的凋亡(图5B、D和E)。通过蛋白印迹实验证实,联合用药相比吉非替尼单独用药,PC9/GR细胞中ATF-6(图6A、B)和IRE1α蛋白(图6A、C)的表达均上调,表明联合用药后PC9/GR细胞处于ERS状态。这是毒胡萝卜素有效改善PC9/GR对吉非替尼耐药的可能原因之一。
综上所述,体外实验证实毒胡萝卜素低浓度下可以有效促进PC9/GR的ERS,高浓度下对肺癌细胞具有直接杀伤作用,说明毒胡萝卜素本身具有抗肿瘤活性,本课题同时证实,毒胡萝卜素能增强吉非替尼对PC9/GR的杀伤作用。其可能的机制是,在抗肿瘤药物和ERS状态的双重压力下,肺腺癌耐药细胞株PC9/GR对靶向药吉非替尼的敏感性增加。因此,毒胡萝卜素有望成为解决非小细胞肺癌靶向治疗耐药的潜在药物之一,但其中的机制仍需进一步的探索。
-
表 1 TRACERlab FXFN合成器各溶剂瓶预装溶剂
溶剂瓶 溶剂 1号瓶(V1) 1.5mg K2CO3溶于0.5 ml水 2号瓶(V2) 1.5 mg K222溶于1ml乙腈 3号瓶(V3) 1 mg前体溶于1.2 ml DMSO溶剂 5号瓶(V5) 1.5 ml HPLC流动相 6号瓶(V6) 1.5 ml HPLC流动相 圆底烧瓶 2 ml 84%NaHCO3水溶液和30 ml水 7号瓶(V7) 9 ml 0.9%生理盐水 8号瓶(V8) 1 ml 乙醇 9号瓶(V9) 10 ml 水 表 2 18F-T807在正常大鼠体内的分布(
$ \bar x \pm s $ ,n=5)器官 放射性摄取率(% ID/g) 5 min 15 min 30 min 60 min 90 min 120 min 脑 2.25±0.18 2.03±0.86 1.81±0.54 1.59±0.62 1.20±0.57 1.11±0.38 心 2.05±0.58 1.99±0.66 1.78±0.31 1.55±0.25 1.19±0.74 1.08±0.36 肝 5.79±2.58 5.95±1.17 5.48±0.66 5.29±0.71 4.83±0.84 4.27±0.86 肺 2.12±0.91 2.01±0.56 1.91±0.19 1.57±0.73 1.21±0.52 1.09±0.23 肾 7.36±4.01 5.11±1.21 3.89±1.99 3.63±1.82 3.17±1.68 2.99±0.98 肌肉 2.34±0.86 2.57±1.18 2.44±0.95 2.19±1.36 2.04±1.03 1.51±0.89 骨 2.58±0.91 2.67±0.75 2.02±0.68 1.99±0.82 1.52±0.46 1.27±0.55 血 5.56±0.35 5.41±0.56 4.73±0.74 4.57±1.31 4.22±0.37 4.01±0.45 -
[1] CHO H, CHOI J Y, HWANG M S, et al. Tau PET in Alzheimer disease and mild cognitive impairment[J]. Neurology,2016,87(4):375-383. doi: 10.1212/WNL.0000000000002892 [2] CHIEN D T, SZARDENINGS A K, BAHRI S, et al. Early clinical PET imaging results with the novel PHF-tau radioligand [F18]-T808[J]. J Alzheimers Dis,2014,38(1):171-184. [3] WEINER M W, VEITCH D P, AISEN P S, et al. The Alzheimer's Disease Neuroimaging Initiative: a review of papers published since its inception[J]. Alzheimers Dement,2012,8(1suppl):S1-68. [4] MACCIONI R B, FARÍAS G, MORALES I, et al. The revitalized tau hypothesis on Alzheimer's disease[J]. Arch Med Res,2010,41(3):226-231. doi: 10.1016/j.arcmed.2010.03.007 [5] SABRI O, SEIBYL, ROWE C, et al. Use of florbetapir-PET for imaging beta-amyloid pathology[J]. JAMA,2011,305(3):275-283. doi: 10.1001/jama.2010.2008 [6] OKAMURA N, FURUMOTO S, FODERO-TAVOLETTI M T, et al. Non-invasive assessment of Alzheimer's disease neurofibrillary pathology using 18F-THK5105 PET[J]. Brain,2014,137(Pt6):1762-1771. [7] FODERO-TAVOLETTI M T, OKAMURA N, FURUMOTO S, et al. 18F-THK523: a novel in vivo tau imaging ligand for Alzheimer's disease[J]. Brain,2011,134(Pt4):1089-1100. [8] OKAMURA N, FURUMOTO S, HARADA R, et al. Characterization of 18F-THK-5351, a novel PET tracer for imaging tau pathology in Alzheimer's disease[EB/OL]. 2014 [9] HONER M, GOBBI L, KNUST H, et al. Preclinical evaluation of 18F-RO6958948, 11C-RO6931643, and 11C-RO6924963 as novel PET radiotracers for imaging tau aggregates in alzheimer disease[J]. J Nucl Med,2018,59(4):675-681. doi: 10.2967/jnumed.117.196741 [10] WONG D F, COMLEY R A, KUWABARA H, et al. Characterization of 3 novel tau radiopharmaceuticals, 11C-RO-963, 11C-RO-643, and 18F-RO-948, in healthy controls and in alzheimer subjects[J]. J Nucl Med,2018,59(12):1869-1876. doi: 10.2967/jnumed.118.209916 [11] KUWABARA H, COMLEY R A, BORRONI E, et al. Evaluation of 18F-RO-948 PET for quantitative assessment of tau accumulation in the human brain[J]. J Nucl Med,2018,59(12):1877-1884. doi: 10.2967/jnumed.118.214437 [12] GAO M Z, WANG M, ZHENG Q H. Fully automated synthesis of [18F]T807, a PET tau tracer for Alzheimer's disease[J]. Bioorg Med Chem Lett,2015,25(15):2953-2957. doi: 10.1016/j.bmcl.2015.05.035 [13] MARUYAMA M, SHIMADA H, SUHARA T, et al. Imaging of tau pathology in a tauopathy mouse model and in Alzheimer patients compared to normal controls[J]. Neuron,2013,79(6):1094-1108. doi: 10.1016/j.neuron.2013.07.037 [14] 王治国, 左峰, 张国旭, 等. 新型阿尔茨海默症Tau蛋白PET显像剂18F-T807的合成[J]. 中国医学装备, 2019, 16(2):125-127. doi: 10.3969/J.ISSN.1672-8270.2019.02.034 [15] HUANG Y Y, CHIU M J, YEN R F, et al. An one-pot two-step automated synthesis of [18F]T807 injection, its biodistribution in mice and monkeys, and a preliminary study in humans[J]. PLoS One,2019,14(7):e0217384. doi: 10.1371/journal.pone.0217384 -






 下载:
下载:


 下载:
下载: