-
在我国成人死因中,脑卒中位列第一,全球第二[1-2]。在所有的脑卒中患者中,有78%的患者是缺血性脑卒中,其他为出血性脑卒中[3]。脑卒中的治疗药物很少,目前FDA唯一批准的药物只有组织纤溶酶原激活剂。但是,由于其治疗窗口狭窄、有禁忌证和并发症风险,组织纤溶酶原激活剂仅适用于3%~5%的脑卒中患者[2]。因而,寻求新的治疗靶点和手段显得十分重要。
烟酰胺磷酸核糖转移酶(Nampt)又被称作内脏脂肪素,也是一种脂肪因子。它还有一个名称是PBEF,是合成哺乳动物细胞内烟酰胺腺嘌呤二核苷酸(NAD+)的关键限速酶[4]。最近的研究证明了Nampt可以作为缺血性脑卒中治疗新靶点[2-3,5-7]。Nampt治疗缺血性脑卒中的作用机制包括急性期的脑保护以及慢性期的促血管修复和神经再生作用。这些作用机制通过体内体外试验在神经细胞、内皮祖细胞和神经干细胞得到证实。NAD+在细胞能量维持中起着关键作用[8],而Nampt可以通过补救合成途径促进哺乳动物中NAD+生物合成,影响ATP的产生,对抗缺血性脑卒中后的供能不足,维持细胞内能量稳态,抑制神经细胞死亡[3]。
Nampt既可存在于细胞内,也可以分泌到细胞外[9]。从细胞分泌出来后可以存在于血液中,与高血压、糖尿病等多种疾病相关[10,11]。在缺血性脑卒中发生后,外周血液的Nampt会显著性升高[12-13]。局部脑组织内Nampt对缺血性脑卒中的保护作用已经十分明确,而脑外组织来源的Nampt对缺血性脑卒中的作用研究较少。已知肝脏细胞可以分泌Nampt,并且肝脏被认为是血液Nampt的主要组织来源之一[3,14-15]。本研究主要通过Cre/loxP重组酶系统特异性敲除肝脏Nampt基因的表达,利用大脑中动脉阻塞(MCAO)缺血性脑卒中模型,研究肝脏来源的Nampt是否参与缺血性脑卒中的保护,为进一步明确Nampt作为缺血性脑卒中治疗新靶点的重要意义,为探究外周器官参与缺血性脑卒中损伤及修复的新机制打下基础。
-
NamptloxP/loxP小鼠(南京医科大学王强教授实验室赠予)和Albumin-Cre小鼠(上海南方模式生物科技发展有限公司)。动物自由饮水、进食;环境温度控制在(25±1) ℃,相对湿度40%~60%,昼夜均为12 h。所有动物实验均符合实验动物伦理学要求。
-
PCR仪(TaKaRa),M200 PRO多功能酶标仪(瑞士Tecan公司),SC12型水平电泳槽(北京凯元信瑞仪器有限公司),FR-980A生物电泳图像分析系统(上海复日科技有限公司),红外激光扫描成像系统(LI-COR),蛋白电泳、转膜系统(上海天能科技有限公司),高通量组织研磨仪(上海万柏生物科技有限公司),颅骨钻(广州坤图生物科技有限公司),CHR多功能手术仪(武汉春光医疗美容仪器有限公司)。
-
小鼠鉴定引物(上海生工生物工程股份有限公司)序列如表1所示。
表 1 基因型鉴定引物
序号 引物序列(5’-3’) 鉴定基因型 条带位置 引物1 野生型上游引物:
TGCAAACATCACATGCACAC
通用型下游引物:
TTGGCCCCTTACCATAACTG
突变型上游引物:
GAAGCAGAAGCTTAGGAAGATGGNamptloxP/loxPAlb-Cre 150 bp
351 bp
390 bpNamptloxP/loxP 351 bp 引物2 下游引物:
TTCCAGGCTATTCTGTTCCAG
上游引物:
TCTGGCTCTGTGTACTGCTGANamptloxP/loxP 300 bp 鼠尾基因组DNA提取试剂盒(康为世纪生物科技有限公司),多聚甲醛(博光生物科技有限公司),GAPDH抗体和BCA蛋白浓度试剂盒(上海碧云天生物技术有限公司),PBEF抗体(F-8)(Santa Cruz Biotechnology),Premix TaqTM (TaKaRa),硝酸纤维素转移膜(Whatman),IRDye®800CW Donkey anti-Mouse IgG二抗(LI-COR),血浆Visfatin 检测试剂盒(Phoenix Pharmaceuticals, Inc),2,3,5-氯化三苯基四氮唑(BBI Life Science),异戊巴比妥(BIOSZUNE LIFE SCIENCES DEP),水合氯醛(国药集团化学试剂有限公司)。
-
白蛋白(Alb)仅在肝脏中表达。目前,Alb基因启动子作为肝脏特异性启动子被广泛用于制备肝脏特异性基因敲除小鼠模型[16]。NamptloxP/loxPAlb-Cre及其同窝对照NamptloxP/loxP小鼠由NamptloxP/loxP和Alb-Cre两种小鼠杂交获得。培育过程如图1:①将NamptloxP/loxP 小鼠与Alb-Cre小鼠交配,筛选获得NamptloxP/WTAlb-Cre,②NamptloxP/WTAlb-Cre与NamptloxP/loxP小鼠交配,得到NamptloxP/loxPAlb-Cre,③最后将NamptloxP/loxPAlb-Cre与NamptloxP/loxP交配,得到用于实验的NamptloxP/loxPAlb-Cre(即liver-specific Nampt knockout mice,以下简称LNKO)及其同窝对照NamptloxP/loxP小鼠(以下简称WT),用引物1对其子代进行基因型鉴定。实验中①②③交配使用的NamptloxP/loxP 小鼠全部用NamptloxP/loxP与NamptloxP/loxP小鼠交配所得,用引物2对其子代进行基因型鉴定。
-
剪取5周龄小鼠尾巴约0.5 cm。置于1.5 ml离心管中,剪碎后,按照鼠尾基因组DNA提取试剂盒(康为世纪生物科技有限公司)说明书进行提取。
-
扩增小鼠DNA,扩增程序如图2,扩增体系20 μl:Premix TaqTM 10 μl,引物1 μl (5 μm),DNA溶液2 μl,ddH2O体积为7 μl,混合均匀后放入PCR仪进行扩增。NamptloxP/loxPAlb-Cre与NamptloxP/loxP交配得到的子代用引物1和扩增程序图2A进行鉴定,NamptloxP/loxP 与NamptloxP/loxP交配得到的子代,理论上都为NamptloxP/loxP,用引物2和扩增程序图2B进行鉴定。
-
配制2%的琼脂糖凝胶(琼脂糖凝胶未凝固前每10 ml加入1 μl的gelRed试剂),在水平100 V电泳槽中电泳30 min。
-
最后用生物电泳图像分析系统,在312 nm紫外线下拍摄成像。
-
用1%异戊巴比妥腹腔麻醉小鼠(100 mg/kg),心脏取血后,取出小鼠的肝脏、脑,用高通量组织研磨仪对组织进行匀浆,在4 ℃,12 000×g的条件下,离心20 min后取上清液,用BCA法进行蛋白定量,通过蛋白免疫印迹法检测Nampt蛋白。
-
用4%水合氯醛腹腔麻醉小鼠(400 mg/kg),将小鼠固定在鼠板上,剔除左眼周围的毛发后,酒精棉球消毒,用镊子揪起左耳外耳道和左眼外眦之间的皮,平行于下层肌肉表面做1 cm切口,分离头骨外周肌肉,用颅骨钻在颞骨前下紧邻颧弓前上缘的部位打磨使颞骨变薄,用镊子去除部分头骨,在手术显微镜下找到大脑中动脉,并用电凝器凝断位于嗅束至大脑下静脉之间的主干,再缝合伤口。术后将小鼠置于保温毯上,待清醒后放回动物笼内饲养。
-
神经行为学损伤评分采用5分法[17]。0分:正常,无神经功能缺损;1分:瘫痪侧前爪不能完全伸展,轻度神经功能缺损;2分:行走时,小鼠向瘫痪侧转圈,中度神经功能缺损;3分:行走时,小鼠身体向瘫痪侧倾倒,重度神经功能缺损;4分:不能自发行走,有意识丧失。
-
MCAO造模24 h后将小鼠麻醉,断头取出脑,放入−20 ℃冷冻15~20 min,再用刀片将全脑冠状切出6片1 mm厚的脑片,去掉尾部带有嗅球、小脑和低位脑干的部分。脑片用37 ℃预热的2% TTC染色,37 ℃避光染色30 min,正常组织为红色,梗死组织为白色。4%多聚甲醛固定1 h后,用滤纸吸干液体再取出脑片,用扫描仪扫描脑片,用Image J计算梗死面积,以测量梗死脑组织体积占总测量脑片体积的百分比作为衡量脑梗死的指标。每片切片的脑梗死体积=(该切片双面梗死面积之和÷2)×层厚,相对脑梗死体积(%)=(全部切片梗死体积之和÷全部切片体积之和)×100%。
-
小鼠心脏取血得到血浆后,用ELISA法测定Nampt的含量。测定步骤按照血浆Visfatin 检测试剂盒说明书进行。
-
采用GraphPad Prism 8.0软件对数据进行统计分析,实验数据用(
$ \stackrel{-}{x} $ ±s)表示,通过独立样本t检验分析组间差异的显著性,以P<0.05为具有统计学差异。 -
核酸电泳条带为150 bp+351 bp+390 bp的为NamptloxP/loxPAlb-Cre,即LNKO小鼠,核酸电泳条带为351 bp的为NamptloxP/loxP,即WT小鼠。小鼠基因型鉴定结果如图3所示,从左到右,泳道1为DNA Maker,泳道2和3为WT小鼠(351 bp),泳道4和5为LNKO小鼠(150 bp+351 bp+390 bp)。
-
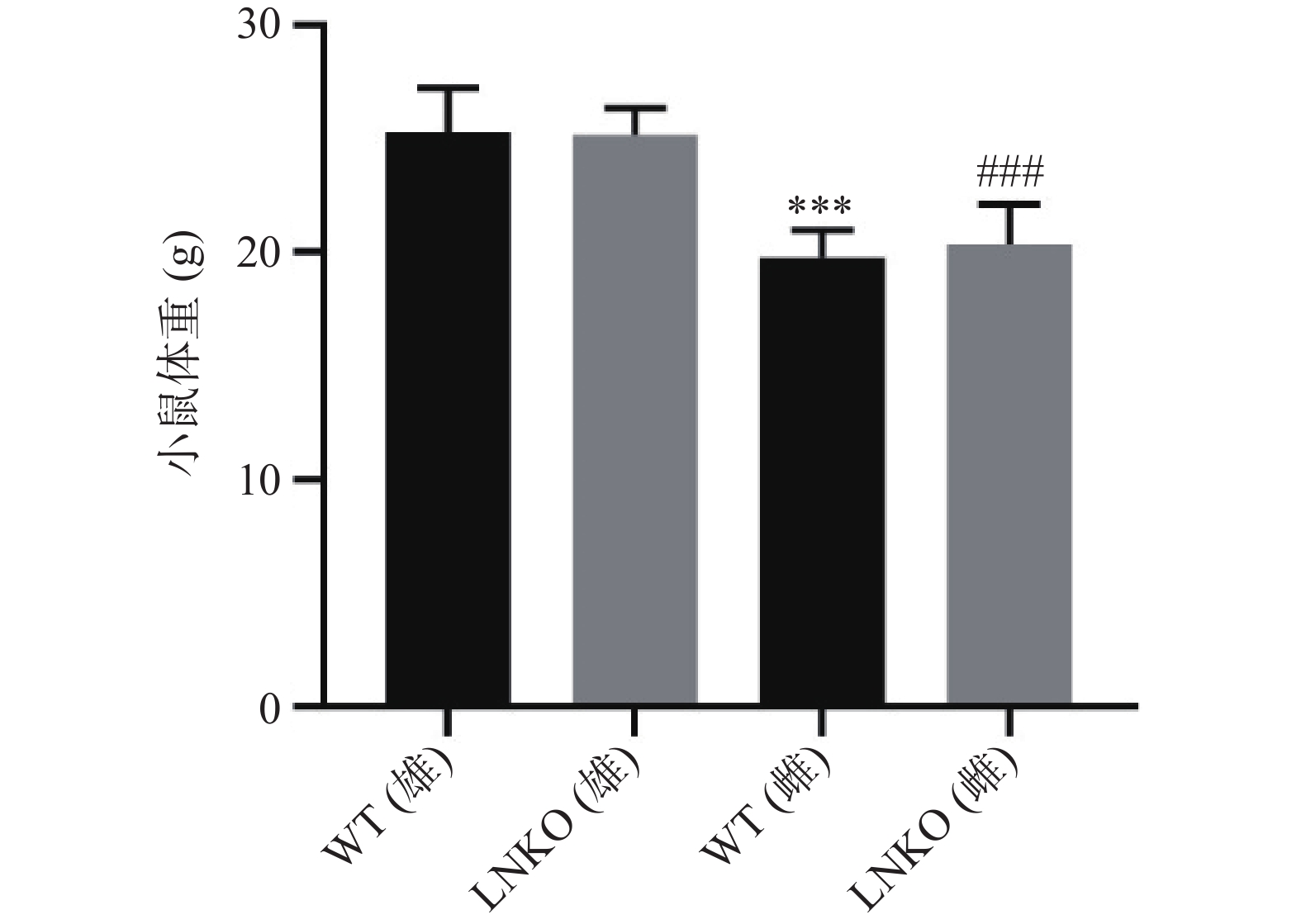
比较各组小鼠12周龄的体重。如图4所示,WT雄性小鼠的体重为(25.31±1.91) g,LNKO雄性小鼠的体重为(25.19±1.17) g,WT雌性小鼠的体重为(19.79±1.19) g,LNKO雌性小鼠的体重为(20.36±1.79) g。同一性别中,LNKO和WT小鼠体重比较没有显著性差异。WT小鼠中,雄鼠比雌鼠平均重5.52 g(P<0.001)。LNKO小鼠中,雄鼠比雌鼠平均重4.83 g (P<0.001)。以上结果说明特异性敲除肝脏Nampt基因表达,对小鼠的体重无影响。
-
为进一步验证成功培育肝脏特异性Nampt基因敲除小鼠,提取各组小鼠的肝脏和脑组织蛋白,通过蛋白免疫印迹验证两种组织中Nampt蛋白的表达。如图5A所示,同一性别肝脏组织中,LNKO小鼠Nampt蛋白表达水平都显著性低于其对照WT小鼠,其中LNKO雄性小鼠Nampt蛋白表达水平比WT雄性小鼠降低了67.1%;LNKO雌性小鼠Nampt蛋白表达水平比WT雌性小鼠降低了81.3%。如图5B所示,在脑组织中,LNKO小鼠Nampt蛋白表达水平与其对照小鼠相比无显著性差异。蛋白免疫印迹结果进一步证明,肝脏特异性Nampt基因敲除小鼠被成功构建。
-
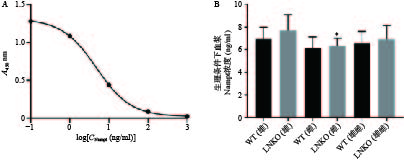
根据血浆Visfatin检测试剂盒的数据处理方法,测量Nampt蛋白的标准品(浓度依次为0.1、1、10、100、1000 ng/ml)在450 nm处的吸光度(A)值,对数据进行四参数Logistic曲线拟合得到图6A,R2=1,曲线拟合效果很好。
根据拟合曲线方程和样品的吸光度值,计算各组小鼠血浆Nampt蛋白浓度。如图6B所示,同一性别对应的LNKO与WT小鼠血浆Nampt蛋白浓度无显著性差异,LNKO与WT小鼠的血浆Nampt蛋白浓度也无显著性差异。只有LNKO雄性组的血浆Nampt蛋白平均浓度比LNKO雌性组略升高0.91 ng/ml(P<0.05)。
-
MCAO造模43只小鼠,成功造模38只,其中WT雄性小鼠11只,LNKO雄性小鼠8只,WT雌性小鼠11只,LNKO雌性小鼠8只,造模成功率为88.37%。
-
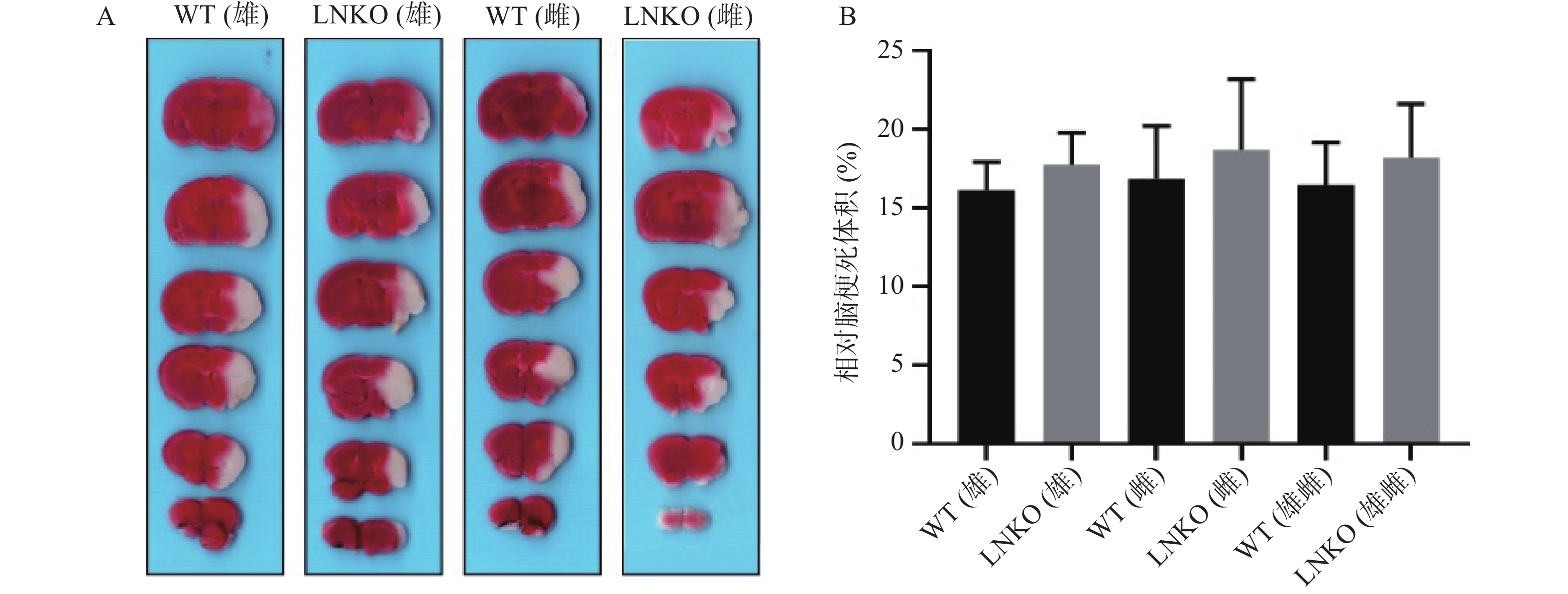
图7A显示各组典型脑片TTC染色,白色是梗死区。图7B代表统计后各组相对脑梗死体积。MCAO造模24 h后,相对脑梗死体积数据如下:WT雄性组为(16.14±1.78)%,LNKO雄性组为(17.71±2.08)%,WT雌性组为(16.85±3.36)%,LNKO雌性组为(18.68±4.50)%。各组在MCAO 造模24 h后的相对脑梗死体积无显著性差异。
-
神经行为学损伤评分数据如表2所示。造模24 h后,各组小鼠以轻度神经功能损伤为主,瘫痪侧前肢不能完全伸展;每组都存在部分发生中度神经功能损伤,行走时向瘫痪侧转圈。各组在MCAO造模24 h后神经行为学评分无显著性差异,而且各组神经行为学评分高低与相对脑梗死体积一致。
表 2 各组小鼠MCAO造模24 h后神经行为学损伤评分 (n≥8)
组别 神经行为学损伤评分(分) WT雄性组 1.20±0.42 LNKO雄性组 1.50±0.71 WT雌性组 1.32±0.56 LNKO雌性组 1.63±0.69 WT组 1.26±0.49 LNKO组 1.56±0.68 WT: 肝脏特异性Nampt基因敲除小鼠同窝对照;LNKO: 肝脏特异性Nampt基因敲除小鼠。 -
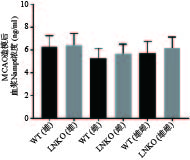
MCAO造模24 h后,各组血浆Nampt蛋白平均浓度:WT雄性组为(6.26±0.98) ng/ml,LNKO雄性组为(6.44±1.03) ng/ml,WT雌性组为(5.28±0.86) ng/ml,LNKO雌性组为(5.70±0.80) ng/ml。如图8所示,LNKO及其同窝对照WT小鼠在MCAO造模24 h后血浆Nampt蛋白表达无显著性差异。
-
本研究利用Cre/loxP重组酶系统成功构建肝脏特异性Nampt基因敲除小鼠,并证实肝脏来源Nampt对缺血性脑卒中没有明显保护作用。
Cre/loxP重组酶系统介导的基因打靶方法是目前应用最为广泛的基因条件性敲除方法。 loxP序列中的特殊回文结构可以被Cre酶特异性识别结合并催化两个loxP序列之间的片段发生同源重组,进而实现对该片段的基因敲除。我们通过基因鉴定和肝脏Nampt蛋白免疫印迹从基因和蛋白两个层面对该动物模型进行验证,结果都表明小鼠肝脏Nampt基因被特异性敲除。以同窝对照为阴性对照,监测两组小鼠的一般状况,发现其体重、活动状态等无显著差异。有研究曾比较10、55、110周雌性肝脏特异性Nampt基因敲除小鼠与对照小鼠体重,两者无显著性差异,这与本研究结果一致[16]。
Nampt是一种脂肪细胞因子,可由脂肪组织大量分泌。除此以外,其他如肝细胞,白细胞,单核细胞,B细胞,心肌细胞和各种神经细胞也可分泌Nampt,目前认为脂肪、肝脏和白细胞是血液Nampt来源的主要器官[3],但是血液中Nampt的各组织分泌的贡献率并不是十分清楚。本研究首次显示特异性敲除小鼠肝脏Nampt基因的表达并不能显著影响生理情况下血浆Nampt蛋白浓度,这是基于肝脏特异性Nampt基因敲除小鼠的一个在体研究结果,不同于前期的相关研究。前期研究报道了肝脏HepG2细胞[15]、大鼠来源肝细胞[14-15]和原代人的肝细胞[15]可以大量分泌Nampt蛋白,这些结论主要基于的都是体外的细胞实验,没有研究整体的动物和人。本研究结果说明生理状态下肝脏Nampt的分泌水平可能相对较低,对血液Nampt的贡献率不如脂肪组织。肝脏特异性Nampt基因敲除导致的Nampt分泌减少在生理状态下可能仍然能够被脂肪等组织很好地代偿,因而血浆Nampt水平不改变。在这点上,脂肪特异性Nampt基因敲除对血液Nampt水平的影响更大。Yoon等[18]发现雌性脂肪特异性Nampt基因敲除鼠的血浆Nampt水平显著低于雌性对照鼠。此外,研究结果说明肝脏特异性敲除Nampt基因表达后,性别因素并不显著影响肝脏对血液Nampt的贡献率,这与脂肪特异性Nampt基因敲除小鼠有所不同[18]。
但是肝脏特异性Nampt基因敲除是否影响外周血Nampt水平还可能与病理状态和禁食因素等有关。有研究报道与健康对照组相比,肝硬化患者的血液Nampt水平显著升高[19],提示病理状态时肝脏对血液Nampt的贡献会发生改变。另一方面, 血液Nampt水平受禁食因素影响,所以检测结果和动物进食状态有关。有研究发现禁食会升高Nampt血液水平[18]。本研究在未禁食下检测,肝脏特异性Nampt基因敲除不改变血液Nampt水平。但在禁食状态下,各组织对血液Nampt贡献情况很可能会发生改变,从而引起血液Nampt水平变化。本研究所反映的仅是在非禁食的生理状态下以及脑缺血后的肝脏特异性Nampt基因敲除小鼠的外周血Nampt水平,在其他条件下肝脏特异性Nampt基因敲除是否对血液Nampt水平有影响有待进一步研究。
本研究的一个重要目的是确认肝脏来源Nampt是否参与脑缺血损伤及修复。在缺血性脑卒中时,机体除了调动脑内细胞的Nampt发挥保护作用,肝脏来源的Nampt是否也参与了机体的内在防御修复作用仍属未知。本研究采用电凝法制备脑卒中模型和肝脏特异性Nampt基因敲除动物开展研究。电凝法手术在直视下操作,手术中出血量少,造模成功率高,导致的脑缺血效果稳定,可模拟永久性脑梗死。造模后小鼠出现轻度到中度神经功能损伤,脑片TTC染色出现白色梗死区域,说明电凝法可成功制备MCAO模型。肝脏特异性Nampt基因敲除小鼠肝脏Nampt蛋白表达下降,而脑内Nampt蛋白表达不受影响,非常适合本课题的研究目的。研究结果显示,同一性别,与野生型相比,肝脏特异性Nampt基因敲除并不影响脑卒中的相对梗死体积和神经行为学评分,说明肝脏来源Nampt不主要参与脑缺血损伤及修复。这一结果的原因可能与肝脏来源Nampt对血液Nampt的贡献率不大有关。血液Nampt的水平是外周Nampt发挥脑生物学功能的基础。在正常条件下,本研究已证实肝脏来源Nampt对血液Nampt的贡献率不大。在脑卒中条件下,卒中后24 h肝脏特异性Nampt基因敲除组和对照组小鼠血液Nampt水平无显著性差异,也说明肝脏来源Nampt对卒中后血液Nampt变化的贡献率不大。
本研究显示,肝脏特异性Nampt基因敲除后,雄性小鼠比雌性小鼠血浆中Nampt表达水平略高,但是后续这两种性别小鼠在缺血后脑梗死面积并没有显著性差异。在生理状态下,LNKO雄性比LNKO雌性血液Nampt水平表达略高。脑卒中24 h后,LNKO雄性小鼠比LNKO雌性小鼠血液Nampt水平有升高趋势,但无统计学差异。这两个血液水平的结果是比较一致的。同样,从脑梗死结果来看,虽然LNKO雌性小鼠的脑梗死体积和LNKO雄性小鼠相比无统计学差异,但是有升高趋势。从行为学评分来看,LNKO雌性小鼠的神经功能学损伤评分相比LNKO雄性小鼠也有升高趋势。这两个结果与血液水平也是总体一致的。
血液水平Nampt改变仅仅是影响脑梗死严重程度的一个因素,组织水平Nampt改变也会影响脑梗死程度。不仅如此,动物的个体差异,手术操作的差异,也会影响脑梗死程度。因此,在现有的动物例数下,两种性别的小鼠在缺血后脑梗死面积并没有统计学差异。后续可以考虑进一步扩大例数,确认两种性别小鼠在脑梗死程度上是否存在差别,并同时观察脑组织Nampt水平是否在两种性别小鼠脑缺血模型上有差别,以明确不同性别小鼠外周来源Nampt和脑组织Nampt对卒中的影响是否存在差异。
Nampt是防治脑卒中的内源性靶点[3],是兼具有多种重要功能的脂肪因子。已知Nampt 可被分泌入血,血液Nampt具有酶活性,有生物学功能[12]。外周来源Nampt很可能是机体维持生理稳态,在病理状态下加强防御、促进修复的重要内源性调控因子。因此,确认Nampt的血液来源和探究血液Nampt的潜在生物学功能具有重要意义。本研究首次确认了肝脏来源Nampt对生理状态血液Nampt的贡献情况和对脑缺血损伤的作用,为后续研究打下了重要基础。当然,本研究也存在不足,比如仅观测卒中后24 h的情况,未观察多个时间点的卒中情况,以及卒中慢性恢复期的情况。血液Nampt的另一个主要来源是脂肪,脂肪来源Nampt对血液Nampt的贡献情况已有报道[18],但对脑缺血损伤的作用尚未见报道。这些都有待进一步研究探索。
Effects of liver-specific Nampt knockout on ischemic stroke
-
摘要:
目的 烟酰胺磷酸核糖转移酶(nicotinamide phosphoribosyltransferase,Nampt)是缺血性脑卒中的治疗新靶点。本研究旨在阐明肝脏来源的Nampt是否对缺血性脑卒中具有保护作用。 方法 运用Cre/loxP系统制备肝脏特异性Nampt基因敲除小鼠。将NamptloxP/loxP小鼠与肝脏特异性表达Cre重组酶小鼠(Alb-Cre)进行杂交,采用聚合酶链反应方法鉴定子代基因型。测定基因敲除小鼠和同窝对照小鼠的体重。蛋白免疫印迹法检测小鼠肝脏和脑中Nampt蛋白的表达。采用电凝法对肝脏特异性Nampt基因敲除小鼠和对照小鼠制备大脑中动脉阻塞(middle cerebral artery occlusion,MCAO)脑卒中模型,造模24 h后对各组小鼠进行神经功能损伤评分,TTC染色测定脑梗死体积,ELISA法检测各组小鼠血浆Nampt水平。 结果 成功构建肝脏特异性Nampt基因敲除小鼠,其基因型为NamptloxP/loxP Alb-Cre。肝脏特异性Nampt基因敲除组肝脏Nampt蛋白表达与对照组相比下降74.2%。脑Nampt蛋白的表达在敲除组与对照组之间无显著性差异。肝脏特异性Nampt基因敲除对小鼠的体重无影响。正常生理条件下,同性别肝脏特异性Nampt基因敲除小鼠与对照小鼠血浆Nampt水平无明显差异。MCAO造模24 h后,肝脏特异性Nampt基因敲除组与对照组神经行为学损伤评分、脑梗死体积和血浆Nampt浓度也无显著性差异。 结论 成功构建肝脏特异性Nampt基因敲除小鼠;肝脏来源Nampt对缺血性脑卒中没有明显保护作用。 -
关键词:
- 烟酰胺磷酸核糖转移酶 /
- 特异性敲除 /
- 肝脏 /
- 脑卒中
Abstract:Objective Nicotinamide phosphoribosyltransferase (Nampt) is a new therapeutic target for ischemic stroke. The aim of this study was to investigate protective effect of liver-derived Nampt on ischemic stroke. Methods Liver-specific Nampt knockout mice were generated using the Cre/loxP system. NamptloxP/loxP mice were crossed with liver-specific Cre recombinase expression mice (Alb-Cre), and the progeny genotypes were identified by polymerase chain reaction. Body weight of knockout mice and control mice were measured. Nampt in liver and brain was determined by Western blot assay. Middle cerebral artery occlusion (MCAO), a classical ischemic stroke model, was generated in liver-specific Nampt knockout mice and control mice by electrocoagulation. After 24 h of modeling, neurological deficit scores of each group were evaluated and TTC staining was performed to determine the cerebral infarction volume. The level of plasma Nampt in each group was determined by ELISA. Results Liver-specific Nampt knockout mice with the genotype of NamptloxP/loxPAlb-Cre were successfully constructed. The hepatic Nampt expression in knockout mice was significantly decreased by 74.2% compared to control mice, while there was no significant difference in the expression of brain Nampt protein between the knockout group and the control group. Specific knockout of liver Nampt gene expression had no effect on the body weight of mice. Under normal physiological conditions, there was no significant difference in plasma Nampt levels between liver-specific Nampt knockout mice and control mice of the same gender. 24 h after MCAO modeling, there were no significant differences in neurological deficit scores, cerebral infarct volume and plasma Nampt concentration between liver-specific Nampt knockout group and control group. Conclusion Liver-specific Nampt knockout mice are successfully constructed. Liver-derived Nampt has no significant protective effects on ischemic stroke. -
Key words:
- Nampt /
- specific knockout /
- liver /
- stroke
-
肌间沟臂丛阻滞(interscalene brachial plexus block, ISB)是肩关节镜手术的常用麻醉方式[1],但膈神经麻痹(hemidiaphragmatic paresis,HDP)的发生率高,对术前合并呼吸系统疾病的患者不利[2]。此外,肌间沟臂丛阻滞还会导致术后长时间的上肢感觉及运动障碍,降低患者满意度及舒适度[3]。Kim等[4]与Kang等[5]于近期报道臂丛上干阻滞(superior trunk block,ST)应用于肩关节镜手术可以有效减少HDP的发生,同时对肌力的影响更小。周阳洋等[6]报道低浓度低剂量(0.375% 10 ml)罗哌卡因行臂丛上干阻滞,完全的HDP发生率为0,还能提供良好的术后镇痛,保留患肢部分肌力,提高患者舒适度,但部分HDP发生率较高(87.2%)。为进一步探究降低部分HDP发生率的可能性,本研究采用更低浓度(0.25%)的罗哌卡因比较肌间沟与臂丛上干阻滞用于肩关节镜手术的临床效果。
1. 资料与方法
1.1 一般资料
本研究获得海军军医大学第二附属医院伦理委员会批准(CZEC2020-10),所有患者及家属均签署知情同意书。选择2020年8月至12月于本院择期行肩关节镜下肩袖修补术的患者46例,男22例,女24例,年龄26~70岁,BMI (24.5±2.5)kg/m2,ASA I~Ⅱ级。排除标准:①神经阻滞禁忌证;②长期服用镇痛药物;③不能理解疼痛评分;④不能配合完成握力检查及膈肌移动度检查。采用随机数字法(n=46)分成2组:超声引导下肌间沟臂丛神经阻滞组(ISB组)和臂丛上干阻滞组(ST组)。
1.2 方法
1.2.1 麻醉监测
患者入室后监测心电图、脉氧饱和度,桡动脉穿刺监测有创动脉压。
1.2.2 阻滞药物的制备
ISB 组与ST组所用的药液均配制成浓度为 0.25% 10 ml罗哌卡因。取5 ml 0.75%罗哌卡因,加入0.9%氯化钠注射液10 ml,配制成浓度为0.25%的15 ml溶液,取10 ml 备用。
1.2.3 盐酸右美托咪定配制
取用 2 ml 盐酸右美托咪定注射液(规格 2 ml:200 µg)加入 48 ml 0.9% 氯化钠注射液,配制成50 ml 浓度为 4 µg/ml 的 总溶液。
1.2.4 神经阻滞
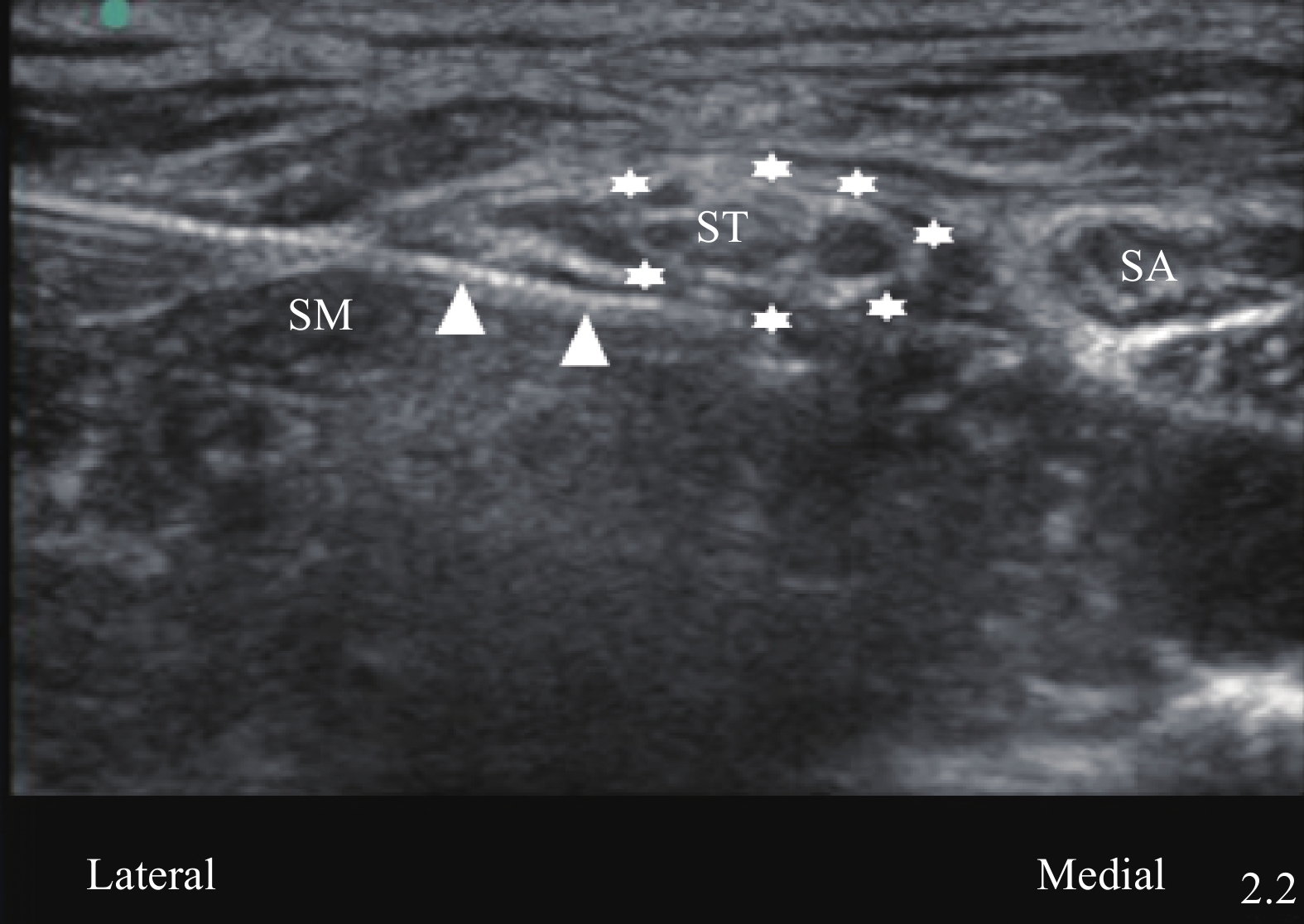
患者取平卧位,测量平静状态膈肌移动度,握力计测患侧手的握力。嘱患者头向健侧转 30°,使用高频线性探头进行定位扫查,对于ISB组,根据横突结节形状定位 C5、C6、C7 神经,找到“红绿灯征象”[7]后,平面内进针由外侧向内侧,穿过中斜角肌,采用一点法,针尖到达C5、C6外侧时回抽无血并注药,单次注射10 ml。对于ST组,在准确识别神经根的基础上探头缓慢向尾侧滑行,直至看到C5、C6汇合成臂丛上干,肩胛上神经即将分出,将该部位作为目标靶点。同样采用平面内进针,由外向内,超声引导下将针尖移至上干深面,旋转针尖使其开口朝向上干,包绕式注射5 ml 0.25% 罗哌卡因。注射完成后,将针尖移至上干浅面,阻滞针尖旋转180°,使其开口斜面继续朝向上干,包绕式注射剩余局麻药,见图1。
1.2.5 监护麻醉(MAC)
针刺拟手术区域,确认阻滞效果后,嘱患者摆侧卧位,予鼻导管吸氧及右美托咪定负荷剂量0.5~0.8 μg/kg(20 min内泵完)镇静,余以0.2~0.5 µg/(kg·h)微泵维持,直至手术结束前15 min停止泵注。
1.3 观察指标
1.3.1 膈肌移动度
测量患者阻滞前以及阻滞后30 min、3 h膈肌移动度。采用低频探头(X-Porte,Sonosite),通过肝窗或脾窗测量右侧或左侧膈肌移动度。测量平静呼吸及最大深吸气时的膈肌移动幅度,测量3遍,取平均值。膈肌麻痹(HDP)的程度是通过测量膈肌移动度的减少(以百分比差值计算)来定义。完全麻痹定义平静呼吸状态,移动度减少75%~100%,部分膈肌麻痹是指平均呼吸状态移动度减少25%~75%和轻度膈肌麻痹是指下降幅度小于25%[5]。
1.3.2 握力检查
患侧手全力抓持握力器,测量3次取均值。分别为阻滞前以及阻滞后30 min、3 h的平均握力。
1.3.3 术后疼痛
采用疼痛数字评分法(NRS)评估患者疼痛程度,记录神经阻滞后0~6 h,6~12 h及12~24 h时间段内患者静息状态下NRS最高评分以及阻滞时长(从阻滞开始起,直至出现痛觉恢复的时间)。
1.4 并发症
记录阻滞不全、霍纳(HONOR)综合征、声嘶、术后恶心呕吐的发生情况。
2. 结果
2.1 一般情况
本试验共纳入51例患者,共剔除5例。其中4例是因为ISB组阻滞效果欠佳,重新追加注射麻药,ST组1例是因对患者实施双侧臂丛上干阻滞。两组患者一般情况无统计学差异(P>0.05),见表1。
表 1 两组患者一般资料比较组别 例数
(例)年龄
(岁,
$\bar x $±s)性别
(例,
男/女)BMI
(kg/m2 ,
$\bar x $±s)阻滞侧
(例,
右/左)手术时间
(t/min,
$\bar x $±s)ISB组 23 58.3±10.3 11/12 24.6±2.4 13/10 81.9±8.6 ST组 23 61.1±6.6 9/14 23.8±2.5 11/12 83.7±12.5 2.2 膈肌移动度
ISB组患者平静呼吸状态下膈肌移动度为(2.02±0.42)cm,阻滞后30 min下降为(1.50±0.29)cm,阻滞后3 h膈肌移动度为(0.98±0.20)cm。最大深呼吸时膈肌移动度则分别为(5.30±0.70)cm、(3.53±1.04)cm和(1.86±0.58)cm。
ST组平静呼吸状态膈肌移动度为(1.91±0.21)cm,阻滞后30 min为(1.63±0.22)cm,阻滞后3 h膈肌移动度为(1.43±0.18)cm。最大深呼吸时膈肌移动度则分别为(5.17±0.48) cm、(3.51±0.95)cm和(2.29±0.55)cm。阻滞后30 min,ISB组与ST组膈肌移动度下降幅度差异无统计学意义(P>0.05),阻滞后3 h,两组之间膈肌移动度下降幅度差异显著(P<0.05)。阻滞后膈肌移动度,见表2。
表 2 两组患者阻滞侧膈肌移动度(cm,$\bar x $ ±s)时间 组别 平静呼吸 最大深呼吸 阻滞前 ISB组 2.02±0.42 5.30±0.70 ST组 1.91±0.21 5.17±0.48 阻滞后30 min ISB组 1.50±0.29 3.53±1.04 ST组 1.63±0.22 3.51±0.95 阻滞后3 h ISB组 0.98±0.20 1.86±0.58 ST组 1.43±0.18* 2.29±0.55* *P < 0.05,与ISB组比较。 根据膈肌麻痹定义,两组患者轻度麻痹、部分麻痹、完全麻痹的例数,见表3。
表 3 两组膈肌移动度下降例数及百分比[例(%)]时间 组别 平静呼吸 轻度麻痹 部分麻痹 完全麻痹 阻滞后30 min ISB组 9(39.1) 12(52.2) 2(8.7) ST组 17(73.9) 6(26.1) 0(0.0) 阻滞后3 h ISB组 4(17.4) 15(65.2) 4(17.4) ST组 14(60.9) 9(39.1)* 0(0.0)* *P<0.05,与ISB组比较。 2.3 握力检查
神经阻滞前,ISB组与ST组患者握力无明显差异(P=0.721),阻滞后30 min,ISB组与ST组握力下降幅度差异显著(P<0.001),阻滞后3 h,两组差异同样显著(P<0.001),ST组对握力的保留明显优于ISB组,见表4。
表 4 两组患者握力检查对比及下降幅度(kg,$\bar x $ ±s)时间 组别 握力 P 下降幅度(%) 阻滞前 ISB组 30.94±7.64 0.721 — ST组 30.23±5.58 — 阻滞后30 min ISB组 15.20±6.15 <0.001 52.17 ST组 24.01±4.91 20.59 阻滞后3 h ISB组 6.14±2.27 <0.001 80.11 ST组 14.35±3.33 52.38 注:“—”表示未获得数据。 2.4 术后疼痛评分及阻滞时长
2.4.1 两组患者各时间段的NRS最高评分
两组患者在阻滞后3~6 h,6~12 h及12~24 h 3个时间段内,NRS最高评分均具有显著差异(P<0.05),见表5。
表 5 两组患者各时间段的NRS最高评分(分,$\bar x $ ±s)组别 阻滞后时间段 PACU~3 h 3~6 h 6~12 h 12~24 h ISB组 0 0.57±1.16 2.74±1.25 3.39±1.27 ST组 0 0 1.74±0.86 1.83±1.07 P值 — 0.024 0.003 <0.001 注:“—”表示未获得数据。PACU表示麻醉后监护室。 2.4.2 阻滞时长
阻滞时长是指从神经阻滞完成直至患者痛觉恢复的时间,ISB组与ST组的平均时长分别是(8.3±1.97)h和(10.9±1.26)h,存在显著差异(P<0.01)。ISB组最长阻滞时长为11.6 h,最短为4.2 h,5名患者在6 h内恢复痛觉。ST组最长阻滞时间为13.6 h,最短为8.5 h 。
2.5 不良反应及并发症
所有入组患者均无霍纳(HONOR)综合征、声嘶、局麻药过敏及中毒的情况。
3. 讨论
肩关节镜手术虽属微创手术,但术后疼痛剧烈[8]。良好的术后镇痛可以加速患者康复,从而推进ERAS进程。近些年,围绕肩关节镜手术的神经阻滞报道很多,全世界学者都努力寻找麻醉的平衡点,镇痛完全,又能有效降低膈肌麻痹的发生率[9]。
肌间沟臂丛阻滞是肩关节围术期镇痛最常用的麻醉方式。但因解剖的关系在C5、C6和(或)C7处注射局麻药常会扩散至位于前斜角肌表面的膈神经,不可避免地导致膈肌麻痹。尽管降低局麻药浓度和(或)剂量可以减少HDP的发生,但迄今为止报道用最低容量5 ml 0.75%罗哌卡因行肌间沟臂丛阻滞,HDP的发生率仍达到33%[10]。Laurent等[11]提出臂丛上干阻滞的概念,Kim也报道了采用15 ml 0.375%布比卡因行上干阻滞+监护麻醉,HDP的发生率仅为4.8%[4]。我们课题组先前报道10 ml 0.375% 罗哌卡因环形包绕上干注射,完全HDP发生率为0.0%,但部分HDP发生率仍高达87.2%。为进一步降低HDP,减少对膈肌影响,因此,本研究选择10 ml 0.25% 罗哌卡因,进一步探讨低浓度低剂量局麻药在肩关节镜围术期的临床有效性。
结果显示,采用10 ml 0.25% 罗哌卡因,阻滞后30 min,ISB组与ST组对膈肌影响无明显差异(平静时P值=0.100;最大吸气时P值=0.955),考虑可能与低浓度罗哌卡因对运动神经阻滞起效慢相关,所以较短时间内两组差异性不明显。在阻滞后3 h,两组膈肌移动度下降具有显著差异(P<0.05)。此外,本研究ISB组采用的注药方式为临床上常用的一点法,由外向内进针,穿过中斜角肌,到达C5、C6外侧时注药,10 ml 0.25% 罗哌卡因可能无法完全包绕C5、C6神经根,导致阻滞不全或镇痛时间减少。肌间沟注药部位,膈神经常可于前斜角肌表面扫查到,采用类似于臂丛上干包绕式注药方式,局麻药注射至C5内侧时,药液常直接扩散至膈神经,导致其被阻滞。尽管本研究采用迄今为止满足外科手术麻醉最低药量,但ISB组平静呼吸时完全HDP的发生率仍有17.4%,而ST组则为0.0%,主要考虑臂丛上干阻滞距离膈神经更远,膈肌麻痹发生率更低。
术后疼痛方面,ST组明显优于ISB组。Kang[5]的研究认为,臂丛上干阻滞提供与肌间沟臂丛阻滞相似的镇痛效果。但本研究发现,无论是各时间段静息痛NRS最高评分,还是阻滞时长方面,ST组均明显优于ISB组,具有显著差异,这可能归因于解剖因素与给药方式。这类手术阻滞的目的是完全阻滞C5、C6神经根(无须阻滞C5分出的肩胛背神经)。在肌间沟水平,C5、C6常位于前、中斜角肌之间,神经周围的筋膜很薄,使得C5、C6边界难以辨别,会增加神经内注射风险,而且会有部分药液扩散至C7甚至C8,导致目标神经阻滞药量减少。本研究剔除的4例阻滞不全患者,可能与上述因素有关。
在握力方面,ST组明显优于ISB组,这与先前的两项RCT结果相符[4-5]。罗哌卡因本身具有运动感觉分离的效应,浓度高低决定了运动阻滞的程度,低浓度的使用使得运动功能的保留更为显著[3]。我们课题组也尝试采用更低浓度罗哌卡因(0.15%~0.2%)或者剂量(5~10 ml)行神经阻滞,握力的保留虽然更好,但有一定比例患者阻滞不全或者达到外科麻醉需求时间过长。
综上所述,10 ml 0.25%罗哌卡因臂丛上干阻滞较肌间沟臂丛阻滞具有更长的阻滞时间,更低的HDP发生率,更优的术后镇痛效果,更好的握力保留。
-
表 1 基因型鉴定引物
序号 引物序列(5’-3’) 鉴定基因型 条带位置 引物1 野生型上游引物:
TGCAAACATCACATGCACAC
通用型下游引物:
TTGGCCCCTTACCATAACTG
突变型上游引物:
GAAGCAGAAGCTTAGGAAGATGGNamptloxP/loxPAlb-Cre 150 bp
351 bp
390 bpNamptloxP/loxP 351 bp 引物2 下游引物:
TTCCAGGCTATTCTGTTCCAG
上游引物:
TCTGGCTCTGTGTACTGCTGANamptloxP/loxP 300 bp 表 2 各组小鼠MCAO造模24 h后神经行为学损伤评分 (n≥8)
组别 神经行为学损伤评分(分) WT雄性组 1.20±0.42 LNKO雄性组 1.50±0.71 WT雌性组 1.32±0.56 LNKO雌性组 1.63±0.69 WT组 1.26±0.49 LNKO组 1.56±0.68 WT: 肝脏特异性Nampt基因敲除小鼠同窝对照;LNKO: 肝脏特异性Nampt基因敲除小鼠。 -
[1] CAMPBELL B C V, KHATRI P. Stroke[J]. Lancet,2020,396(10244):129-142. doi: 10.1016/S0140-6736(20)31179-X [2] WANG S N, MIAO C Y. Targeting NAMPT as a therapeutic strategy against stroke[J]. Stroke Vasc Neurol,2019,4(2):83-89. doi: 10.1136/svn-2018-000199 [3] WANG P, MIAO C Y. NAMPT as a therapeutic target against stroke[J]. Trends Pharmacol Sci,2015,36(12):891-905. doi: 10.1016/j.tips.2015.08.012 [4] REVOLLO J R, GRIMM A A, IMAI S. The NAD biosynthesis pathway mediated by nicotinamide phosphoribosyltransferase regulates Sir2 activity in mammalian cells[J]. J Biol Chem,2004,279(49):50754-50763. doi: 10.1074/jbc.M408388200 [5] CHEN F, WENG Z, XIA Q, et al. Intracerebroventricular delivery of recombinant NAMPT deters inflammation and protects against cerebral ischemia[J]. Transl Stroke Res,2019,10(6):719-728. doi: 10.1007/s12975-019-00692-0 [6] ZHU T, XIE W J, WANG L, et al. Notoginsenoside R1 activates the NAMPT-NAD+-SIRT1 cascade to promote postischemic angiogenesis by modulating Notch signaling[J]. Biomed Pharmacother,2021,140:111693. doi: 10.1016/j.biopha.2021.111693 [7] WANG X, LI H, DING S. Pre-B-cell colony-enhancing factor protects against apoptotic neuronal death and mitochondrial damage in ischemia[J]. Sci Rep,2016,6:32416. doi: 10.1038/srep32416 [8] HOUTKOOPER R H, CANTÓ C, WANDERS R J, et al. The secret life of NAD+: an old metabolite controlling new metabolic signaling pathways[J]. Endocr Rev,2010,31(2):194-223. doi: 10.1210/er.2009-0026 [9] LIU J, CHE X, YOU J, et al. Intracellular Nampt impairs esophageal squamous cell carcinoma neo-adjuvant chemotherapy response independent of eNampt[J]. Am J Transl Res,2021,13(3):1411-1421. [10] DAKROUB A, NASSER S A, YOUNIS N, et al. Visfatin: a possible role in cardiovasculo-metabolic disorders[J]. Cells,2020,9(11):2444. doi: 10.3390/cells9112444 [11] ZHOU L, ZHANG S, BOLOR-ERDENE E, et al. NAMPT/SIRT1 attenuate ang II-induced vascular remodeling and vulnerability to hypertension by inhibiting the ROS/MAPK pathway[J]. Oxidative Med Cell Longev,2020,2020:1974265. [12] ZHAO Y, LIU X Z, TIAN W W, et al. Extracellular visfatin has nicotinamide phosphoribosyltransferase enzymatic activity and is neuroprotective against ischemic injury[J]. CNS Neurosci Ther,2014,20(6):539-547. doi: 10.1111/cns.12273 [13] LU L F, YANG S S, WANG C P, et al. Elevated visfatin/pre-B-cell colony-enhancing factor plasma concentration in ischemic stroke[J]. J Stroke Cerebrovasc Dis,2009,18(5):354-359. doi: 10.1016/j.jstrokecerebrovasdis.2009.01.003 [14] ŠKOP V, KONTROVÁ K, ZÍDEK V, et al. Autocrine effects of visfatin on hepatocyte sensitivity to insulin action[J]. Physiol Res,2010:615-618. doi: 10.33549/physiolres.931845 [15] GARTEN A, PETZOLD S, BARNIKOL-OETTLER A, et al. Nicotinamide phosphoribosyltransferase (NAMPT/PBEF/visfatin) is constitutively released from human hepatocytes[J]. Biochem Biophys Res Commun,2010,391(1):376-381. doi: 10.1016/j.bbrc.2009.11.066 [16] DALL M, TRAMMELL S A J, ASPING M, et al. Mitochondrial function in liver cells is resistant to perturbations in NAD+ salvage capacity[J]. J Biol Chem,2019,294(36):13304-13326. doi: 10.1074/jbc.RA118.006756 [17] LONGA E Z, WEINSTEIN P R, CARLSON S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke,1989,20(1):84-91. doi: 10.1161/01.STR.20.1.84 [18] YOON M J, YOSHIDA M, JOHNSON S, et al. SIRT1-mediated eNAMPT secretion from adipose tissue regulates hypothalamic NAD+ and function in mice[J]. Cell Metab,2015,21(5):706-717. doi: 10.1016/j.cmet.2015.04.002 [19] MOSCHEN A R, GERNER R, SCHROLL A, et al. A key role for Pre-B cell colony-enhancing factor in experimental hepatitis[J]. Hepatology,2011,54(2):675-686. doi: 10.1002/hep.24416 期刊类型引用(4)
1. 余万冰,张单丽,关素珍,王海燕. 基于高效液相色谱一测多评技术联合化学计量学的脂必泰胶囊质量评价. 中国药品标准. 2024(06): 545-554 .  百度学术
百度学术2. 严家文,朱琼. 来曲唑片仿制药与原研药溶出一致性评价研究. 广州化工. 2022(23): 126-129 .  百度学术
百度学术3. 胡天骄,刘雪赟. 阿戈美拉汀片溶出度测定的方法研究. 中南药学. 2020(02): 218-221 .  百度学术
百度学术4. 邢秀,李琼,张晶,孙国祥,张艳华. 多波长串联指纹图谱结合紫外全指纹溶出度测定评价复方两面针含片质量. 药物分析杂志. 2020(10): 1887-1896 .  百度学术
百度学术其他类型引用(1)
-





 下载:
下载:




 下载:
下载: