-
生物色谱法( bio-chromatography)于20世纪80年代中后期出现[1],是由生命科学与色谱分离技术交叉形成的一种极具发展潜力的新兴色谱技术。随着色谱柱制备技术和在线联用技术的深入发展,各种具有生物活性的材料,如蛋白质、细胞膜、仿生物膜、活细胞、细胞壁等纷纷被作为固定相成功投入研究。对于生物色谱技术来说,搭载生物材料的色谱固定相是技术的核心所在。对于适宜生物材料的选取、构建以及对于生物材料固定方法学的开发,使得固定相在最大程度上模拟体内的生理过程,是生物色谱技术最重要的研究方向[2-5]。
-
针对膜受体的活性分子筛选所提出的细胞膜色谱技术发展成为近年来的代表性生物色谱技术,西安交通大学贺浪冲、王嗣岑团队[6-8]开拓了该领域并进行了大量的理论和应用研究工作。该技术原理是直接提取细胞膜并固定于硅胶载体制备液相色谱固定相,通过结合受体动力学与液相色谱分析,在色谱柱内动态模拟药物在体内与受体相互作用的过程,并通过色谱参数来评价化合物的亲和活性。细胞膜色谱固定相[9-10]很好地保住了膜受体的结构和活性,且适用于与各类色谱质谱系统的联用。Ding等[11-12]在细胞膜色谱固定相方法学方面开展了大量工作,对细胞用量、破碎条件、固定相合成及填装流程进行了全面的方法学优化,对色谱柱质量标准具有较为精准的把控。此外,通过采用外源转染携带特定蛋白基因的质粒构建高表达细胞系,可实现针对特定靶受体的活性化合物筛选。但这种直接提取细胞膜并固定于载体所制备的生物色谱固定相不可避免地带来专属性和灵敏度两方面的局限性[13],主要源于细胞膜上其他膜受体的干扰和膜蛋白自身的低丰度、含量不可控等特性,不适用于靶向目标膜受体活性成分的高通量精准分析。
-
利用蛋白脂质体重构技术(proteoliposome re-constitution)[14-15]制备人工仿生膜镶嵌膜受体,包裹于硅胶基质表面,作为色谱固定相,是一种新近发展的体外模拟膜受体生物构象和微环境的新方法。其原理是将二油酰基磷脂酰胆碱、二油酰磷脂酰甘油、棕榈油酰磷脂酰胆碱、胆固醇等细胞膜含有的磷脂类成分与纯化或重组的膜受体按一定比例混合,采用不同的水化超声条件,制备成单层脂质囊泡、双层膜微胞、碟状胶束、平面磷脂膜等形式,实现膜受体-脂质体镶嵌模型重构[16-17]。膜受体脂质体是体外膜受体的理想存在形式,Mathiasen等[14]发展了两种膜受体-脂质体镶嵌模型,实现蛋白数量和融合度稳定可控,并将其用于纳米尺度的高含量分析,其研究结果发表在2014 年的《Nature Methods》上。相比较于细胞膜色谱固定相,膜受体脂质体具有蛋白种类和含量可控,磷脂和蛋白易于标记修饰等优势[18-19]。然而,此项技术仍然存在着蛋白在重构过程中发生结构改变而失活的风险。
-
分子生物色谱(MBC)是基于生物大分子特异性识别原理,属于扩展的亲和色谱[20]。广泛用于研究药物与血浆蛋白、糖蛋白、受体、DNA等大分子的相互作用关系,揭示了药物的血浆结合率等重要药理特性,而受体生物色谱[21-22]不仅能判定药物在体内的作用靶点,还可以研究药物与受体的作用强度以及与其他药物的竞争作用。对于生物色谱固定相,无论是应用于药物筛选,还是对蛋白-蛋白或蛋白-药物相互作用的研究,如何能够将大量功能完整的蛋白固定到载体表面都是技术关键。目前,色谱固定相上的蛋白固定化策略主要可分为物理吸附、化学键合、亲和标签偶联[23]。
-
物理吸附即通过蛋白质与表面之间的弱相互作用(即氢键、静电相互作用、疏水相互作用和范德华力)来实现蛋白质固定化。利用吸附原理进行偶联主要有两点好处,一是不需要对蛋白进行修饰,二是不需要额外的偶联剂[23-24]。在细胞膜色谱固定相及仿生膜生物色谱固定相发展初期,生物材料与硅胶基质的融合依赖于磷脂膜上氨基与硅胶表面硅羟基的氢键和静电吸附作用力。这种固定方式在实际应用中存在着很明显的缺陷[25],主要在于吸附作用力较弱,吸附过程可逆,且取向随机。随着时间推移,蛋白易从硅胶上脱落失活,导致色谱柱寿命短,稳定性不够[26]。
-
鉴于物理吸附的不足,化学修饰策略成为探索热潮。化学修饰策略主要可分为两种途径:①对生物分子进行化学修饰;②对固定相载体进行化学修饰。根据蛋白结构特征,可以对其天然存在的官能团进行共价修饰从而与固定相形成共价结合,以获得更加稳定的附着[24-25]。考虑到蛋白活性位点和固定相的空间相互作用,主要对蛋白质暴露的氨基酸的N端和C端进行修饰,用于修饰的基团包括氨基、羧基以及巯基等[24,27]。蛋白质与固定相载体的共价键结合又可分为非特异性结合与定点结合。绝大部分使用传统非特异性结合方法的生物大分子都存在结合取向随机的问题[28],此外,当随机固定化蛋白与表面之间的相互作用太强时,也存在变性的可能性。为了使蛋白质能够在固定相表现均匀的定向排列,开发定点结合的方法显得具有重要意义。
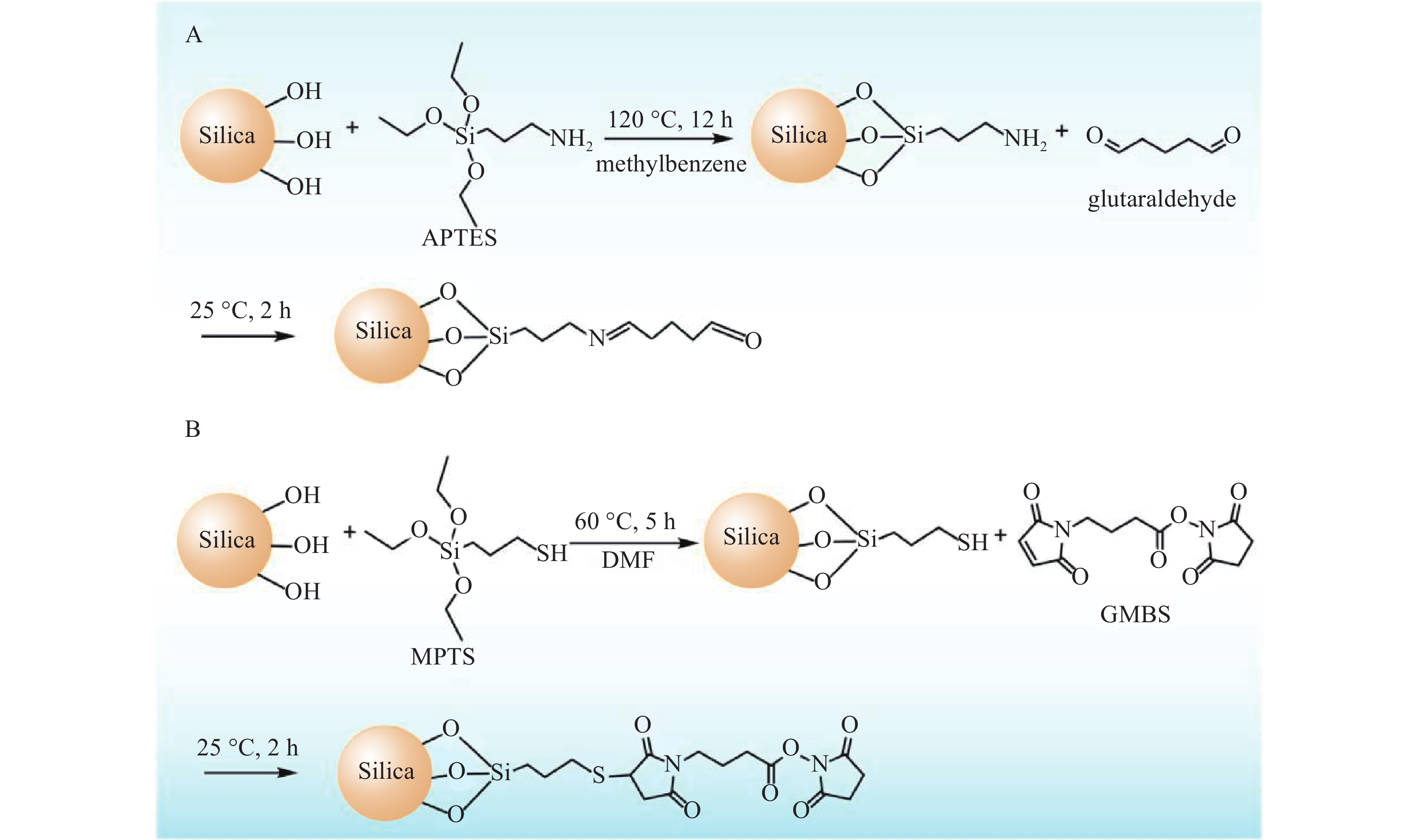
对固定相载体进行化学修饰,很好地避免因蛋白修饰可能影响蛋白生物活性的问题。本课题组利用固定相载体化学修饰技术,先后发展了3-氨基丙基三乙氧基硅烷(APTES)、 3-巯丙基三甲氧基硅烷(MPTS)修饰的硅胶(图1),使硅胶表面游离醛基、酯基等活性基团,与磷脂膜或蛋白上的氨基共价键合[12]。通过考察发现这种修饰方式有效提升了生物色谱柱的使用寿命和稳定性,并由此使得生物色谱在原代细胞、干细胞、纯蛋白等生物材料上的适用性更强。在固定相共价修饰的基础上,纯蛋白色谱固定相也易实现,此技术可广泛应用于各类胞膜及胞质蛋白的亲和活性成分的筛选与相互作用分析。
-
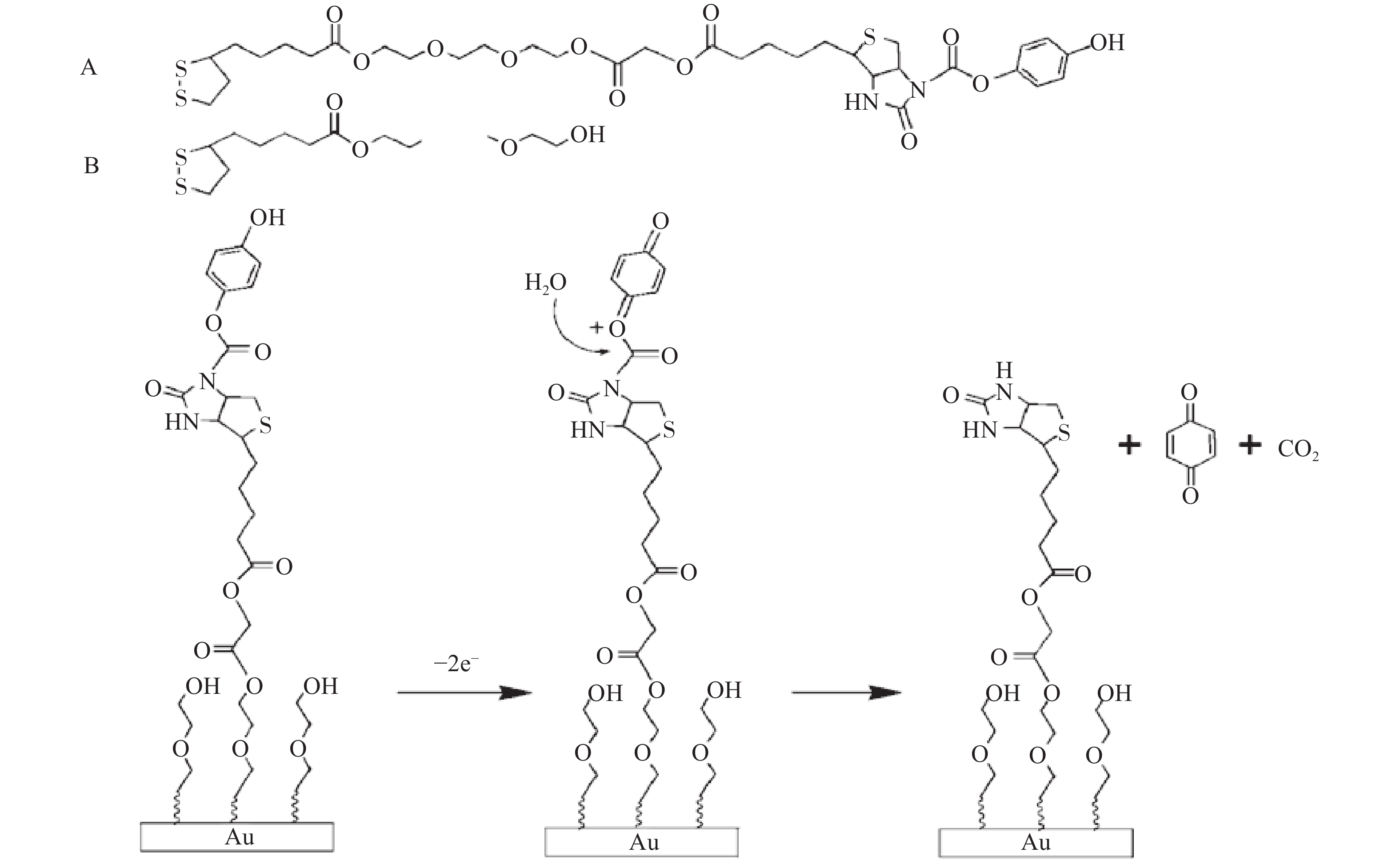
亲和标签偶联法则可以在更温和的条件下,使蛋白质定向均匀地连接到固定相上。不仅降低了蛋白质降解的风险,而且可以解离蛋白质,重复使用固定相[24,27]。生物素-亲和素系统稳定性很高,两者结合亲和常数可为抗原-抗体反应的百万倍,形成复合物的解离常数很小,呈不可逆反应性;而且酸、碱、变性剂等其他苛刻条件均不影响其结合[24,29-30]。Kim等[31]构建了一种基于氢醌笼状生物素表面的蛋白质模式形成方法,此方法还允许通过使用预先定型的电极阵列来选择性地产生生物素以固定目标蛋白(图2)。His是最受欢迎的标签,它是6个组氨酸残基组成的融合标签,可插入在目的蛋白的C末端或N末端,其主要优势在于分子量小,一般不影响蛋白的功能;免疫原性相对较低;纯化条件温和等[32]。
-
当药物随流动相流经生物色谱,由于不同成分与固定相上的生物活性物质的作用方式及作用程度的差别而在色谱柱上表现出不同的保留特性, 以此为基础,生物色谱已广泛应用于中药等复杂体系的活性化合物筛选分析[33]。细胞膜色谱技术自提出以来,已经用于160多种植物或中药的活性成分筛选,极大地推动了中药药效物质基础的发现[34-35]。在细胞膜色谱技术的基础上,一种全二维-CMC-液相色谱-高分辨质谱联用分析系统发展起来,通过对固定相不断进行优化,结合特定膜受体的高表达细胞构建技术,固定相共价修饰技术,使得细胞膜色谱技术在自动化、高通量、稳定性与专属性各方面性能提升的同时,也拓展应用于更多珍稀生物材料的筛选分析。Chen等利用双通道全二维HepG2/CMC/TOFMS分析系统(图3),成功筛选出黄柏和苦参中的潜在活性成分[36]。Ding等采用APTES修饰硅胶策略将HepG2干细胞膜键合于固定相上,从中药丹参中筛选出了作用于肝癌干细胞膜的活性组分[12]。除此之外,固定相共价修饰技术推进了纯蛋白生物色谱分析系统的发展,使筛选系统实现针对特定受体的高特异性筛选。Gu等采用MPTS修饰硅胶固定相固定ACE2受体,从连花清瘟胶囊给药的健康人血浆中筛选出8种靶向ACE2的活性化合物,并证实其中5种化合物具有对ACE2酶活性具有较高的抑制作用,为连花清瘟胶囊临床上防治新冠肺炎提供了直接的体内药效物质基础和潜在分子机制依据[37]。
-
色谱过程的本质是基于溶质、固定相与流动相之间的相互作用。当生物色谱兴起后,很快被用于生物分子之间的相互作用分析,应用范围涉及药物分子构效关系、靶点结合验证、结合解离动力学分析、蛋白关键作用位点研究等。James和Philips提出的前沿色谱法( frontal affinity chromatography)被广泛用于研究蛋白-配体间的相互作用,可同时了解药物蛋白结合情况和测定药物-蛋白平衡解离常数和生物利用度等药动学参数[38]。当色谱走向微型化后,相互作用分析从小分子药物-大分子拓展至大分子之间的作用分析,联合蛋白质组学技术,对蛋白关键作用位点的探测和构效关系研究,通过相互作用能力分析进行多肽及抗体类药物开发等前沿应用正处于快速发展阶段[39-40]。
-
生物色谱作为一种体外分析手段,在发展进程中将始终围绕着两个核心:①开发更好地模拟生物环境、适用性更佳、特异性更高的新型生物色谱固定相;②建立低生物用量、高灵敏度、功能化更全面的生物色谱分析系统。两者相互推进发展,最终建立起令人满意的分析策略。以下列举两点生物色谱分析方法学的新思路:
-
填充生物色谱柱的最大困难依然在于固定相制备困难,色谱柱性能不够稳定[41]。整体柱是一种利用有机或无机聚合方法在色谱柱内进行原位合成,形成连续床固定相的色谱柱。与填充柱相比,其优越的多孔性能、良好的重现性和机械强度使其具有更稳定的色谱行为和更高效的分离性能,因有望克服传统色谱分离介质的局限性而备受关注[42-44]。Svec教授认为[45],新型功能化整体柱的开发是当下整体柱发展的主流。随着多肽、蛋白质、DNA等各种生物大分子成功发展成为整体柱固定相材料,基于整体柱的生物色谱系统已广泛应用于复杂样品的分离纯化、小分子及抗体药物的筛选、蛋白与配体间的相互作用以及糖蛋白/磷酸化蛋白组学分析等多个生物领域[46]。近年来,暨南大学江正瑾课题组发展了仿生磷脂膜整体柱以及类磷脂膜整体柱[47],即通过在柱内键合脂质膜或柱后衍生化使得固定相表面暴露磷脂链来模拟细胞膜微环境,用于药物研发以及药物与细胞膜之间的相互作用研究[47]。总之,整体柱固定相制备过程简单,且因其优越的固定相性能,整体柱的通量与分析速度相比传统填充色谱有了很大提高,有望克服传统生物色谱固定相制备和应用中的不足,成为近年来新药研发和色谱研究领域的热点之一[43,48]。
-
新药研发、蛋白质组学分析、中药复杂成分分析等前沿领域的快速发展,对分析检测方法的灵敏度、样品通量等都提出了更高的要求。而且,对于生物色谱而言,生物材料往往获取不易,十分珍贵,常规色谱系统在生物领域的适用性上面临着很大挑战。Nano液相色谱分析系统是现阶段实现低生物用量、高灵敏度分析的重要手段[49-50],为新型生物色谱固定相的开发提供了有利条件。本课题组曾在nano色谱柱中装填细胞膜及仿生膜色谱固定相,实现了nano液相色谱串联三重飞行时间质谱用于中药活性成分的筛选分析。此外,nano液相能够更方便地与各种质谱联用,降低了对样品量的限制,将为多肽药物的筛选、生物大分子之间相互作用分析、蛋白组学分析等提供广阔的应用前景。
Advances in methodologies for preparation and analysis of new biochromatic stationary phase
-
摘要: 生物色谱法是一种极具发展潜力的新兴色谱技术,已广泛用于药物筛选及生物分子间相互作用分析。其技术核心是生物分子的色谱固定相,现今主要发展了细胞膜色谱,人工仿生膜色谱以及通过开发多种固定化策略将蛋白等直接固定于固定相载体。本文对新型生物色谱固定相方法学研究进展及基于新型固定相的生物色谱分析应用研究现状进行综述,并展望了基于整体柱的生物色谱固定相及微型生物色谱分析系统的应用前景。Abstract: Biochromatography is a new chromatographic technology with great development potential. It has been widely used in drug screening and biomolecular interaction analysis. The core of this technology is the chromatographic stationary phase of biomolecules. Nowadays, it mainly develops cell membrane chromatography, artificial biomimetic membrane chromatography and the various immobilization strategies to directly immobilizes proteins on the stationary phase carrier. This paper reviews the research progress of new biochromatographic stationary phase and the application of biochromatographic analysis based on new stationary phase. And, the applications of biochromatographic stationary phase and micro biochromatographic analysis system based on monolithic column are prospected.
-
Key words:
- biochromatography /
- immobilization method /
- drug screening /
- monolithic column
-
脑卒中是人类疾病中最常见的脑血管疾病,已经成为人类死亡的第二大原因[1]。脑卒中引起的一系列并发症和后遗症给患者家庭带来了不可估量的负担。脑卒中分为缺血性脑卒中和出血性脑卒中两种,其中,缺血性脑卒中又称脑中风,是脑卒中主要的发病方式,约占脑卒中患者的83%以上[2]。目前,尚无有效的治疗药物用于脑卒中引起的损伤,尤其是对于神经损伤的治疗[3]。活性多肽GRGDS是由甘氨酸-精氨酸-甘氨酸-天冬氨酸-丝氨酸(Gly-Arg-Gly-Asp-Ser,GRGDS)5种氨基酸构成,主要通过形成一个β转角的方式与其他细胞发生黏连[4],因而,能够阻断细胞外基质和细胞表面整合素的结合和黏附,可应用于组织工程或者癌症和肿瘤方面。本试验采用PC12细胞体外模拟脑缺血模型,探讨活性多肽GRGDS对氧糖剥夺损伤后的PC12细胞是否具有保护作用。
1. 材料
1.1 细胞株
PC12细胞购自ATCC细胞库,培养在含有10%胎牛血清的完全培养液中,每12 h观察一次细胞的生长状态,每24 h更换一次细胞培养液,待细胞长到80%进行传代。
1.2 药物与试剂
活性多肽GRGDS(上海淘普生物科技有限公司);高糖DMEM培养液、DMEM无糖培养液(Gibco公司);凋亡试剂盒、蛋白质提取试剂盒(上海碧云天生物技术有限公司);抗体:β-肌动蛋白(β-actin)、含半胱氨酸的天冬氨酸蛋白水解酶3(caspase 3)、活化型含半胱氨酸的天冬氨酸蛋白水解酶3(cleaved caspase 3)、磷酸化c-Jun氨基末端激酶(P-SAPK/JNK)、Bax蛋白(美国CST公司)。
1.3 仪器
细胞培养箱、酶标仪(美国Thermo公司);低温高速离心机(德国Eppendorf公司);细胞缺氧装置(美国Billips-Rothenberg公司);流式细胞仪(BDBiosci-ences公司);Western blot图像扫描仪(美国Odyssey公司)。
2. 方法
2.1 PC12细胞氧糖剥夺损伤模型的建立
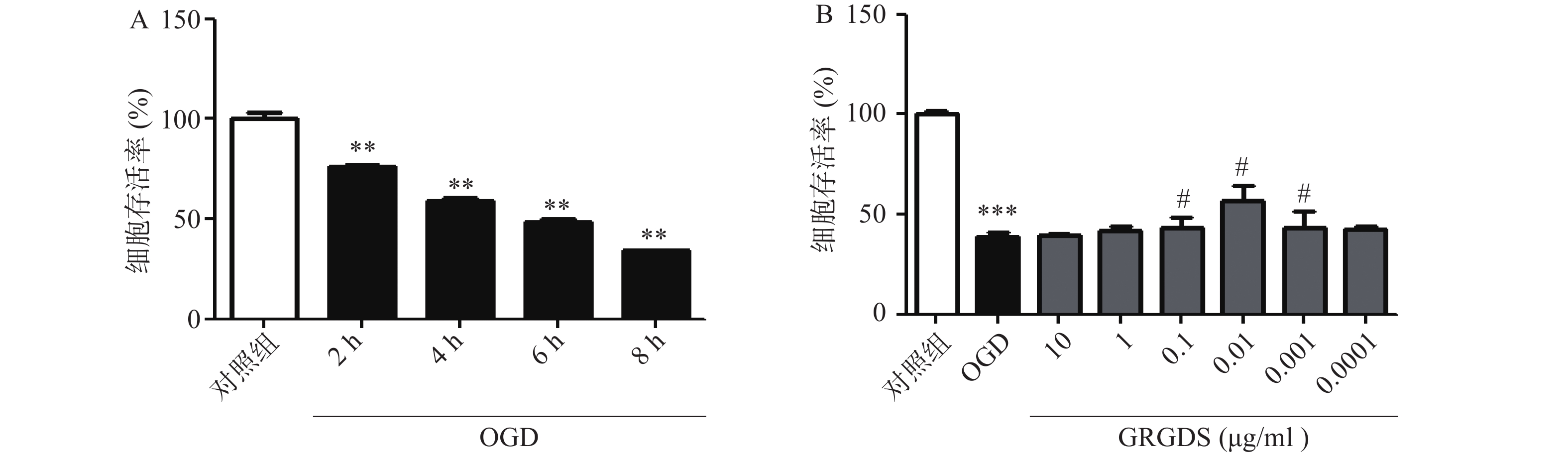
氧糖剥夺模型参照文献[5]体外模拟脑缺血模型,即OGD模型,再根据实验过程中的实际情况稍作改造。将细胞培养在培养板中,待细胞生长至培养板底面积80%以上,将对照组的培养液换成无血清高糖完全培养液,OGD组换成无糖培养液,活性多肽GRGDS给药组换成加有GRGDS药物处理的无糖培养液。将含有3组细胞的培养板置于恒温培养箱中孵育1 h,然后将模型组和给药组的细胞置于缺氧装置中,通入混合气体(95%N2,5%CO2),使装置内的氧气完全排出,分别将细胞缺糖和缺氧2、4、6、8 h后取出,采用MTT法选出细胞损伤的最佳时间,进行后续试验研究。
2.2 MTT法测定细胞活力
将PC12细胞以2.0×105个/ml的密度铺于96孔板中,按照“2.1”项下方法进行操作,在缺糖、缺氧之前,将给药组细胞的培养液换成含有不同浓度的活性多肽GRGDS(10、1、0.1、0.01、0.001、0.0001 μg/ml)的无糖培养液置于培养箱中适应1 h,OGD组和给药组一同置于缺氧装置中缺氧4 h。缺氧过后取出培养板,在避光条件下将所有组的细胞加入每孔20 μl提前配好的0.5%MTT溶液(5 mg/ml),用锡箔纸包好将其放入37 ℃恒温培养箱中,继续孵育4 h后弃掉上清液,再向每个细胞培养孔中加入150 μl二甲基亚砜(DMSO)溶液,温室振荡5 min,用全自动酶标仪在492 nm波长处检测每个孔中细胞的吸光值(A)。
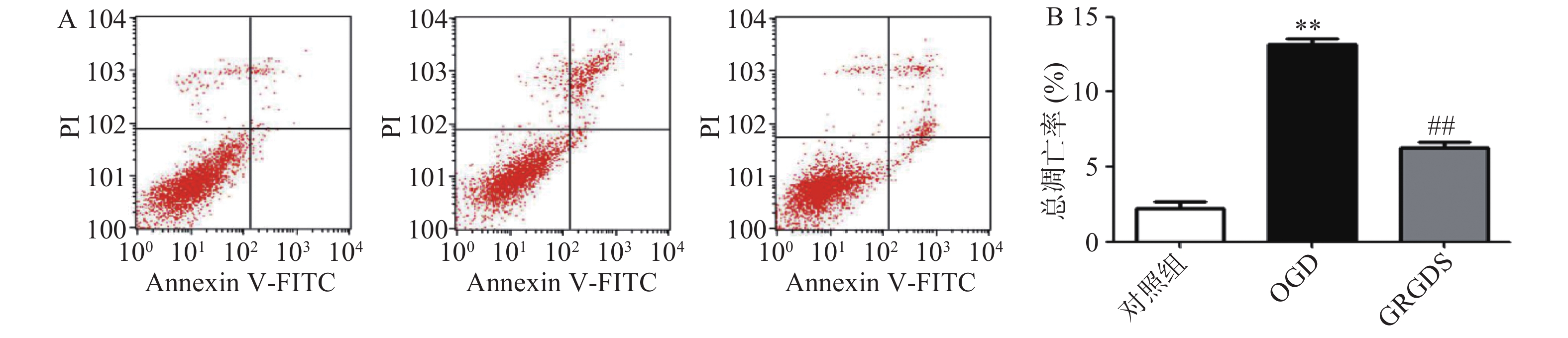
2.3 流式细胞仪检测细胞凋亡
将PC12细胞铺于6孔板中,待细胞贴壁后将OGD组中的培养液换成无糖DMEM培养液,给药组中的培养液换成加有活性多肽GRGDS处理的无糖DMEM培养液,恒温孵育1 h后置于缺氧装置中缺氧4 h,缺糖、缺氧后弃掉每孔中的细胞上清液,用磷酸盐缓冲液(PBS)清洗2次,洗掉细胞表面残留的培养液,再用不含依地酸(EDTA)的胰蛋白酶消化液消化1~2 min。将各组细胞置于不同的离心管中,以1200 r/min离心5 min,弃上清液,再加入PBS,将细胞进行重悬后再离心。离心后弃掉上清液,每个离心管中加入500 μl的1×缓冲液轻轻吹打混匀,避光条件下向各离心管中加入5 μl的细胞凋亡检测试剂(annexin V-FITC),室温放置5 min后,再加入5 μl的碘化丙啶(PI)染色液。充分混匀后室温避光放置15 min,用流式细胞仪进行检测。
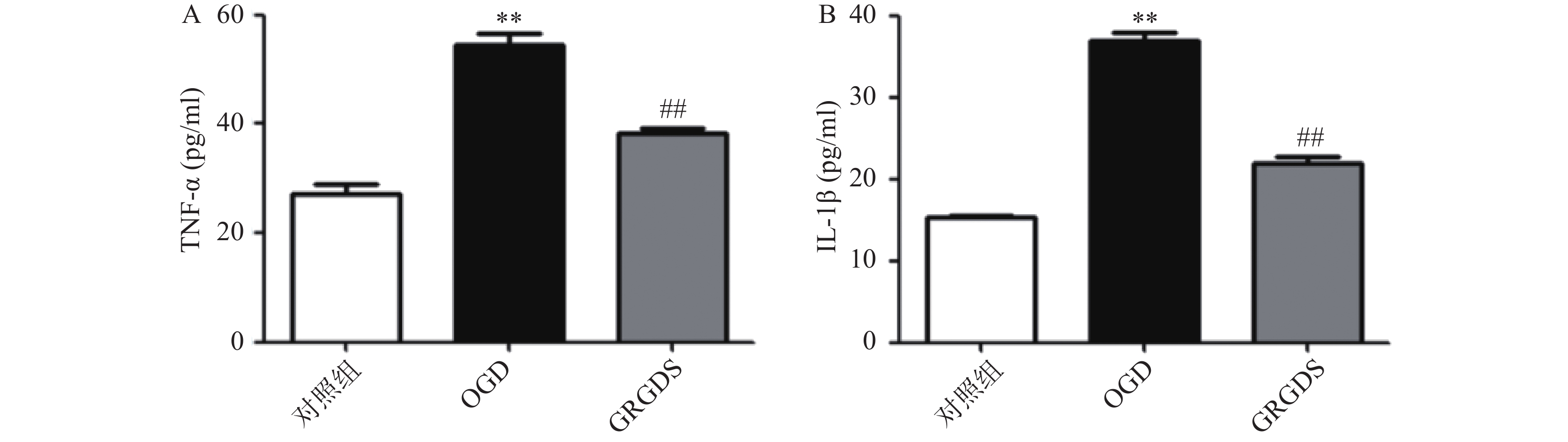
2.4 ELISA检测OGD后PC12细胞相关炎症因子的变化
将PC12细胞氧糖剥夺后取细胞上清液,4 ℃、300 r/min,离心15 min。离心后取上清液放入4 ℃冰箱冷藏保存,若不能及时检测,应将上清液放在−20 ℃冷冻保存。按照试剂盒中的说明书建立标准曲线,检测各组样本吸光值,并计算其浓度。
2.5 Western blot检测相关蛋白的表达
将氧糖剥夺损伤后的各组细胞上清液弃掉,用预冷的PBS清洗细胞表面残留的培养液,用细胞刮刀将各组细胞刮掉,置于预冷的RIPA裂解液中裂解30 min,使细胞中的蛋白完全裂解,以12 000 r/min,离心10 min,取上清液。BCA蛋白测定试剂盒测定蛋白浓度。各组蛋白中加入20 μl 5×蛋白上样缓冲液,100 ℃煮10 min。10%SDS-PAGE分离蛋白,转膜,用含5%脱脂奶粉的Tris缓冲液封闭1 h,孵育一抗4 ℃环境下过夜,回收一抗,洗膜3次(5 min/次),室温条件下加二抗,避光孵育2 h后洗膜。使用Western blot图像扫描仪扫描并统计结果。
2.6 统计学分析
所有实验数据均以(
$\bar x $ ± s)表示,并采用单因素方差分析比较组间差异。以P<0.05为差异有统计学意义。3. 结果
3.1 活性多肽GRGDS对OGD损伤的PC12细胞的保护作用
为了选择合适的缺糖缺氧时间,本实验设置了2、4、6、8 h的时间点,结果显示,细胞生存率随着氧糖剥夺时间的增长而显著降低,与对照组相比有显著性差异(P<0.01),且缺糖缺氧4 h细胞明显皱缩,细胞活性明显降低,细胞的损伤率达到50%,此时的损伤率有利于药物补救,更有助于细胞的恢复,因此,氧糖剥夺损伤时间为4 h条件最佳(图1A)。活性多肽GRGDS给药浓度为0.01 μg/ml,可显著提高缺糖缺氧4 h后PC12细胞的活力(P<0.01)。因此,选择缺糖缺氧4 h,给药浓度0.01 μg/ml作为实验条件进行后续研究(图1B)。
3.2 活性多肽GRGDS降低OGD后PC12细胞的凋亡
将细胞以2.0×105个/ml细胞密度铺于6孔板中,培养16 h后,将OGD组细胞的高糖培养液换成无糖的DMEM培养液,给药组细胞的高糖培养液换成给予活性多肽GRGDS药物处理的无糖DMEM培养液,37 ℃恒温培养箱中平衡1 h,缺氧4 h,而正常对照组细胞的培养液换成新的高糖DMEM培养液继续培养。缺糖缺氧结束后,用流式细胞仪检测各组细胞凋亡情况。图2结果显示,与正常对照组比较,OGD组细胞的凋亡率显著增加(P<0.01),由正常对照组(2.26±0.61)%上升到(12.14±1.69)%。给予活性多肽GRGDS 0.01 μg/ml剂量浓度处理后,细胞凋亡率明显降低,凋亡率降至(6.94±1.45)%(P<0.01)。
3.3 活性多肽GRGDS降低OGD后PC12细胞上清液中TNF-α和IL-1β的含量
正常对照组细胞上清液中TNF-α的含量为(27.16±2.69)pg/ml,两者相比,OGD组细胞中的TNF-α含量明显增加(P<0.01),为(54.51±2.89)pg/ml;与OGD比较,给予活性多肽GRGDS 0.01 μg/ml剂量浓度处理的细胞上清液TNF-α的含量显著降低,为(38.32±18)pg/ml(P<0.01,图3A)。正常对照组细胞上清液IL-1β的含量为(15.4±0.11)pg/ml,OGD组细胞上清液中IL-1β的含量为(35.99±2.25)pg/ml,两者相比,OGD中的IL-1β含量显著增加(P<0.01)。与OGD比较,给予活性多肽GRGDS 0.01 μg/ml剂量浓度处理的细胞上清液中IL-1β的含量显著降低,为(21.84±1.18)pg/ml(P<0.01,图3B)。
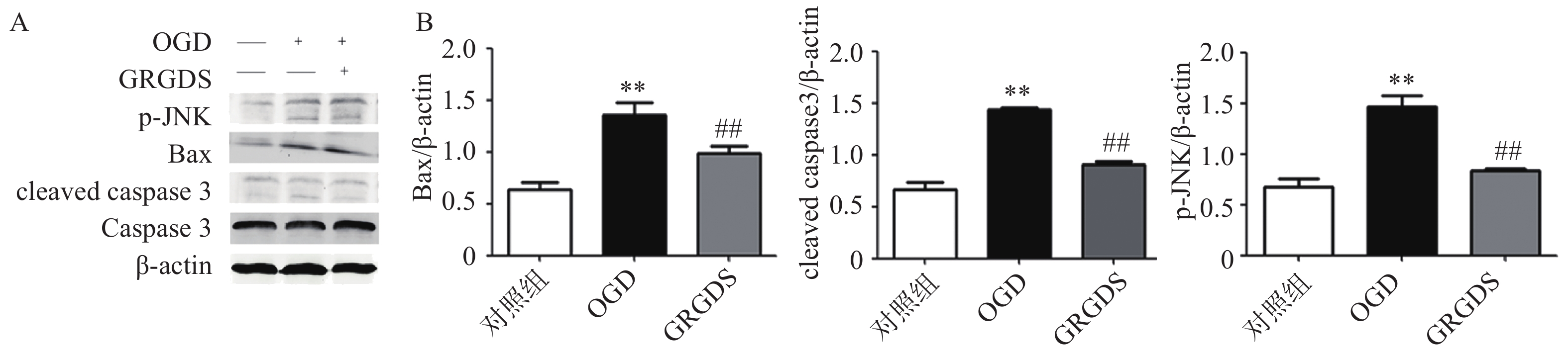
3.4 活性多肽GRGDS降低OGD后PC12细胞中p-JNK、Bax、cleaved caspase 3蛋白的表达
本实验检测了MAPKs信号通路中的JNK信号通路中相关蛋白表达的影响。结果如图4所示,PC12细胞经过氧糖剥夺损伤后,细胞中的p-JNK、Bax、cleaved caspase 3蛋白表达与正常对照组细胞相比均显著升高(P<0.01);而给予活性多肽GRGDS 0.01 μg/ml剂量浓度处理后,可明显降低氧糖剥夺损伤后细胞中p-JNK、Bax、cleaved caspase 3蛋白的表达(P<0.01)。
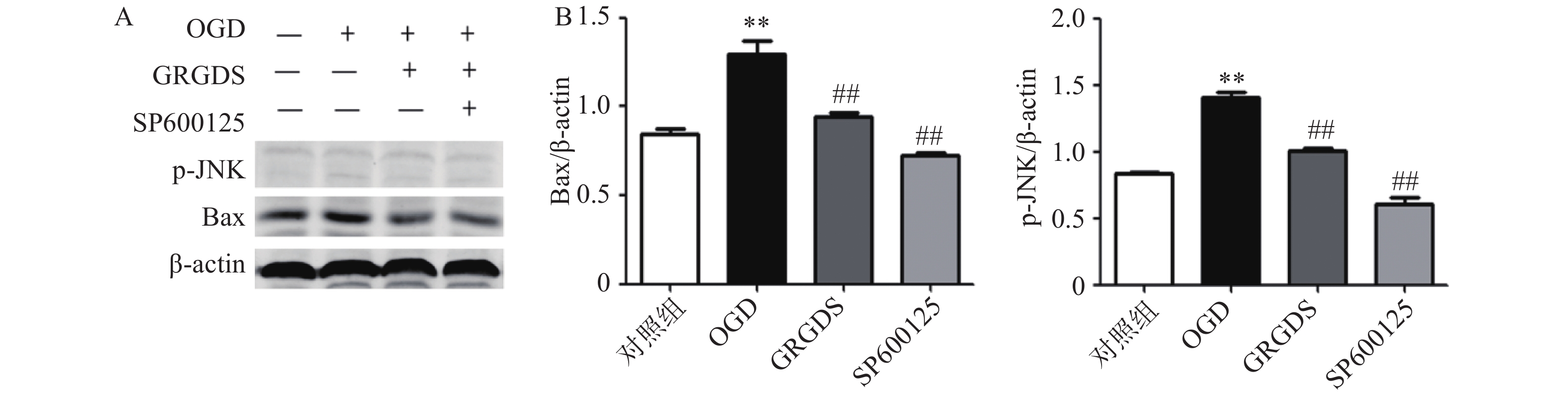
3.5 活性多肽GRGDS降低OGD后PC12细胞中加入JNK抑制剂p-JNK、Bax蛋白的表达
将原始浓度为10 mmol/ml的JNK抑制剂(SP600125)稀释成10 μmol/ml的浓度加入到PC12细胞中,缺糖缺氧后提取细胞蛋白分别检测p-JNK及其下游Bax蛋白的表达情况。结果如图5所示,OGD组细胞中p-JNK、Bax的蛋白表达与正常对照组细胞相比都显著增加(P<0.01);给予活性多肽GRGDS 0.01 μg/ml剂量浓度以及JNK抑制剂处理后,p-JNK、Bax蛋白的表达水平与OGD组相比均明显降低(P<0.01)。
4. 讨论
缺血性脑卒中是由血管阻塞引起的脑血液循环障碍诱发的神经系统损伤,致死、致残率较高,且病理机制十分复杂,目前医学上仍缺乏行之有效的治疗方法。在急性缺血的早期阶段,细胞凋亡可能是对氧糖剥夺的一种自我保护反应,有助于维护重要细胞的生存。然而,在局部缺血的大部分期间,钙超载、氧自由液和溶酶体酶的释放均会导致细胞坏死[6]。
最新研究表明,活性多肽GRGDS可激活体内干细胞,促进细胞的增长和分化[7]。但是,活性多肽GRGDS对于PC12细胞凋亡引起的一系列炎症反应的作用尚未见研究报道。因此,本实验研究了活性多肽GRGDS对氧糖剥夺损伤的PC12细胞凋亡和凋亡反应的抑制作用,并初步探讨其可能存在的药理和药效机制。首先,建立氧糖剥夺损伤的PC12细胞模型,同时加入不同给药剂量浓度的活性多肽GRGDS进行处理。结果发现,活性多肽GRGDS的不同给药剂量浓度可有效抑制氧糖剥夺PC12细胞的损伤,并且当活性多肽GRGDS的剂量浓度为0.01 μg/ml时药物作用效果最佳。故确定0.01 μg/ml浓度作为机制探讨剂量。
TNF-α是一种促炎性多效细胞因子,研究表明,TNF-α可以通过激活转录因子NF-κB的机制阻止神经元的死亡或凋亡,从而诱导Mn-SOD和Bcl-2的表达[8]。TNF-α在大脑发育过程中起着效应分子的作用,经常参与不同的信号通路,激活巨噬细胞和神经胶质细胞,促进神经毒素的产生,并启动神经细胞的凋亡或死亡过程[9]。IL-1β作为一种炎症和免疫源性细胞因子,可在多个环节参与脑缺血损伤机制。研究表明,大量炎性细胞因子(IL-1β、TNF-α)参与脑缺血再灌注损伤后脑细胞的凋亡和坏死[10]。因此检测了氧糖剥夺损伤的PC12细胞上清液,结果显示,氧糖剥夺损伤后PC12细胞上清液中TNF-α和IL-1β含量显著增加,给予活性多肽GRGDS 0.01 μg/ml剂量浓度处理后,上清液中的TNF-α和IL-1β含量明显降低。
本研究结果显示,经过氧糖剥夺损伤后,PC12细胞的凋亡率明显增加,而给予活性多肽GRGDS 0.01 μg/ml剂量浓度处理后PC12细胞的凋亡率显著下降,这提示了活性多肽GRGDS可能通过抑制PC12的凋亡而发挥神经保护作用。为了进一步研究活性多肽GRGDS是否通过抗凋亡作用发挥对PC12细胞的保护作用,本实验试着对凋亡信号通路中的p-JNK、Bax、cleaved caspase 3等相关蛋白的表达进行了检测。据报道,caspase 3是细胞凋亡中的关键部分,是其信号传导的效应通路。caspase 3可能通过线粒体、内质网和死亡受体三种途径激活体内细胞中的死亡信号。缺血性脑卒中一般会引起体内线粒体细胞色素c的释放导致caspase 3的表达、激活和裂解,从而促进细胞凋亡。在细胞死亡引起的凋亡过程中,cleaved caspase 3的表达会增加[11]。研究发现,MAPK可以参与调节多种信号通路诱导或减轻细胞凋亡,活化的JNK会引起脑缺血应激反应的细胞凋亡,而JNK抑制剂在脑缺血再灌注损伤后提供神经保护作用。Bcl-2蛋白家族中的抗凋亡Bcl-2(Bcl-xL)和促凋亡Bax蛋白之间的动态平衡在决定脑缺血期间的细胞命运中起关键作用。越来越多的证据表明,Bcl-2(Bcl-xL)/Bax比率的增加抑制Bax易位至线粒体并保护神经元免受细胞凋亡的损伤,而平衡向Bax过量的转变会引起缺血诱导的神经细胞凋亡。本研究结果显示,氧糖剥夺损伤后PC12细胞中p-JNK、Bax、cleaved caspase 3蛋白的表达水平显著升高,综合流式细胞仪检测氧糖剥夺损伤后PC12细胞凋亡的结果,表明活性多肽GRGDS可能通过抑制凋亡信号通路中的JNK/Bax信号通路,进而抑制氧糖剥夺损伤的PC12细胞凋亡反应,最终发挥神经保护作用。
本研究结果表明,活性多肽GRGDS 0.01 μg/ml剂量浓度可以明显抑制氧糖剥夺损伤的PC12细胞凋亡,降低细胞上清液中TNF-α和IL-1β的含量,并通过调控JNK/Bax信号通路蛋白的表达发挥神经保护作用。活性多肽GRGDS可能在脑缺血中对PC12细胞引起的损伤具有一定的神经保护作用。进一步的研究还需在动物模型上进行更深一层的体内药效试验解释活性多肽GRGDS对缺血性脑卒中的影响及其作用机制,为活性多肽GRGDS在临床上用于缺血性脑卒中的药物治疗提供良好的药理学基础。
-
[1] CLONIS Y D. Affinity chromatography matures as bioinformatic and combinatorial tools develop[J]. J Chromatogr A,2006,1101(1-2):1-24. doi: 10.1016/j.chroma.2005.09.073 [2] LI Z, RODRIGUEZ E, AZARIA S, et al. Affinity monolith chromatography: a review of general principles and applications[J]. Electrophoresis,2017,38(22-23):2837-2850. doi: 10.1002/elps.201700101 [3] BATISTA-VIERA F, JANSON J C, CARLSSON J. Affinity chromatography[J]. Methods Biochem Anal,2011,54:221-258. [4] MUHAMMAD S, HAN S L, XIE X Y, et al. Overview of online two-dimensional liquid chromatography based on cell membrane chromatography for screening target components from traditional Chinese medicines[J]. J Sep Sci,2017,40(1):299-313. doi: 10.1002/jssc.201600773 [5] ZHANG H, WU Z Y, YANG Y Y, et al. Recent applications of immobilized biomaterials in herbal analysis[J]. J Chromatogr A,2019,1603:216-230. doi: 10.1016/j.chroma.2019.06.059 [6] 贺浪冲, 耿信笃. 细胞膜受体色谱法一研究药物与受体作用的新方法[J]. 生物医药色谱新进展. 1996, 3: 8-9. [7] HE L C, WANG S C, YANG G D, et al. Progress in cell membrane chromatography[J]. Drug Discov Ther,2007,1(2):104-107. [8] 贺浪冲, 杨广德, 耿信笃. 固定在硅胶表面细胞膜的酶活性及其色谱特性[J]. 科学通报, 1999, 44(6):632-637. doi: 10.3321/j.issn:0023-074X.1999.06.013 [9] HOU X F, WANG S C, ZHANG T, et al. Recent advances in cell membrane chromatography for traditional Chinese medicines analysis[J]. J Pharm Biomed Anal,2014,101:141-150. doi: 10.1016/j.jpba.2014.05.021 [10] LI M, HOU X F, ZHANG J, et al. Applications of HPLC/MS in the analysis of traditional Chinese medicines[J]. J Pharm Anal,2011,1(2):81-91. doi: 10.1016/S2095-1779(11)70015-6 [11] DING X, CHEN X F, CAO Y, et al. Quality improvements of cell membrane chromatographic column[J]. J Chromatogr A,2014,1359:330-335. doi: 10.1016/j.chroma.2014.07.071 [12] DING X, CAO Y, YUAN Y F, et al. Development of APTES-decorated HepG2 cancer stem cell membrane chromatography for screening active components from Salvia miltiorrhiza[J]. Anal Chem,2016,88(24):12081-12089. doi: 10.1021/acs.analchem.6b02709 [13] 张月华, 蒋才武. 抗肿瘤中药药效物质筛选与辨识的研究方法进展[J]. 中南药学, 2020, 18(9):1517-1522. [14] MATHIASEN S, CHRISTENSEN S M, FUNG J J, et al. Nanoscale high-content analysis using compositional heterogeneities of single proteoliposomes[J]. Nat Methods,2014,11(9):931-934. doi: 10.1038/nmeth.3062 [15] SEREBRYANY E, ZHU G A, YAN E C Y. Artificial membrane-like environments for in vitro studies of purified G-protein coupled receptors[J]. Biochim Biophys Acta,2012,1818(2):225-233. doi: 10.1016/j.bbamem.2011.07.047 [16] GARNI M, THAMBOO S, SCHOENENBERGER C A, et al. Biopores/membrane proteins in synthetic polymer membranes[J]. Biochim Biophys Acta Biomembr,2017,1859(4):619-638. doi: 10.1016/j.bbamem.2016.10.015 [17] JØRGENSEN I L, KEMMER G C, POMORSKI T G. Membrane protein reconstitution into giant unilamellar vesicles: a review on current techniques[J]. Eur Biophys J,2017,46(2):103-119. doi: 10.1007/s00249-016-1155-9 [18] LIU G Y, HOU S L, TONG P H, et al. Liposomes: preparation, characteristics, and application strategies in analytical chemistry[J]. Crit Rev Anal Chem,2020:1-21. [19] SFORZI J, PALAGI L, AIME S. Liposome-based bioassays[J]. Biology (Basel),2020,9(8):E202. [20] 郭明, 由业诚, 孔亮, 等. 分子生物色谱及其在药物筛选中的应用[J]. 大连大学学报, 2003, 24(2):38-41. doi: 10.3969/j.issn.1008-2395.2003.02.012 [21] CHEN X F, WU Y L, CHEN C, et al. Identifying potential anti-COVID-19 pharmacological components of traditional Chinese medicine Lianhuaqingwen capsule based on human exposure and ACE2 biochromatography screening[J]. Acta Pharm Sin B,2021,11(1):222-236. doi: 10.1016/j.apsb.2020.10.002 [22] QV X Y, JIANG J G, PIAO J H. Pharmacodynamic studies of Chinese medicine at levels of whole animal, cell and molecular models[J]. Curr Med Chem,2010,17(36):4521-4537. doi: 10.2174/092986710794182926 [23] STEEN REDEKER E, TA D T, CORTENS D, et al. Protein engineering for directed immobilization[J]. Bioconjug Chem,2013,24(11):1761-1777. doi: 10.1021/bc4002823 [24] RUSMINI F, ZHONG Z Y, FEIJEN J. Protein immobilization strategies for protein biochips[J]. Biomacromolecules,2007,8(6):1775-1789. doi: 10.1021/bm061197b [25] WONG L S, KHAN F, MICKLEFIELD J. Selective covalent protein immobilization: strategies and applications[J]. Chem Rev,2009,109(9):4025-4053. doi: 10.1021/cr8004668 [26] 王晓宇, 陈啸飞, 顾妍秋, 等. 细胞膜色谱研究进展及其在中药活性成分筛选中的应用[J]. 分析化学, 2018, 46(11):1695-1702. doi: 10.11895/j.issn.0253-3820.171287 [27] SANGHVI M, MOADDEL R, WAINER I W. The development and characterization of protein-based stationary phases for studying drug-protein and protein-protein interactions[J]. J Chromatogr A,2011,1218(49):8791-8798. doi: 10.1016/j.chroma.2011.05.067 [28] CHA T, GUO A, ZHU X Y. Enzymatic activity on a chip: the critical role of protein orientation[J]. PROTEOMICS,2005,5(2):416-419. doi: 10.1002/pmic.200400948 [29] 刘石锋, 陈倩, 洪广成, 等. 生物素-亲和素系统的应用研究进展[J]. 生物技术, 2018, 28(5):503-507. [30] WILCHEK M, BAYER E A. The avidin-biotin complex in immunology[J]. Immunol Today,1984,5(2):39-43. doi: 10.1016/0167-5699(84)90027-6 [31] KIM K, YANG H, JON S, et al. Protein patterning based on electrochemical activation of bioinactive surfaces with hydroquinone-caged biotin[J]. J Am Chem Soc,2004,126(47):15368-15369. doi: 10.1021/ja0459330 [32] PINA A S, BATALHA Í L, DIAS A M G C, et al. Affinity tags in protein purification and peptide enrichment: an overview[J]. Methods Mol Biol,2021,2178:107-132. [33] 周思维, 邱瑞琪, 高彩芳, 等. 生物色谱用于中药活性成分筛选[J]. 中国医药工业杂志, 2017, 48(12):1692-1697. [34] HOU X F, ZHOU M Z, JIANG Q, et al. A vascular smooth muscle/cell membrane chromatography-offline-gas chromatography/mass spectrometry method for recognition, separation and identification of active components from traditional Chinese medicines[J]. J Chromatogr A,2009,1216(42):7081-7087. doi: 10.1016/j.chroma.2009.08.062 [35] FU J, LV Y N, JIA Q Q, et al. Dual-mixed/CMC model for screening target components from traditional Chinese medicines simultaneously acting on EGFR & FGFR4 receptors[J]. Talanta,2019,192:248-254. doi: 10.1016/j.talanta.2018.09.053 [36] CHEN X F, CAO Y, LV D Y, et al. Comprehensive two-dimensional HepG2/cell membrane chromatography/monolithic column/time-of-flight mass spectrometry system for screening anti-tumor components from herbal medicines[J]. J Chromatogr A,2012,1242:67-74. doi: 10.1016/j.chroma.2012.04.034 [37] CHEN C, YANG F Q, ZUO H L, et al. Applications of biochromatography in the screening of bioactive natural products[J]. J Chromatogr Sci,2013,51(8):780-790. doi: 10.1093/chromsci/bmt002 [38] KASAI K. Frontal affinity chromatography: an excellent method of analyzing weak biomolecular interactions based on a unique principle[J]. Biochim Biophys Acta Gen Subj,2021,1865(1):129761. doi: 10.1016/j.bbagen.2020.129761 [39] LINGG N, ÖHLKNECHT C, FISCHER A, et al. Proteomics analysis of host cell proteins after immobilized metal affinity chromatography: influence of ligand and metal ions[J]. J Chromatogr A,2020,1633:461649. doi: 10.1016/j.chroma.2020.461649 [40] ZHANG Y Y, FONSLOW B R, SHAN B, et al. Protein analysis by shotgun/bottom-up proteomics[J]. Chem Rev,2013,113(4):2343-2394. doi: 10.1021/cr3003533 [41] UNGER K K, SKUDAS R, SCHULTE M M. Particle packed columns and monolithic columns in high-performance liquid chromatography-comparison and critical appraisal[J]. J Chromatogr A,2008,1184(1-2):393-415. doi: 10.1016/j.chroma.2007.11.118 [42] BUNCH D R, WANG S H. Applications of monolithic columns in liquid chromatography-based clinical chemistry assays[J]. J Sep Sci,2011,34(16-17):2003-2012. doi: 10.1002/jssc.201100189 [43] STANIAK M, WÓJCIAK M, SOWA I, et al. Silica-based monolithic columns as a tool in HPLC-an overview of application in analysis of active compounds in biological samples[J]. Molecules,2020,25(14):E3149. doi: 10.3390/molecules25143149 [44] GUO J L, LIN H, WANG J C, et al. Recent advances in bio-affinity chromatography for screening bioactive compounds from natural products[J]. J Pharm Biomed Anal,2019,165:182-197. doi: 10.1016/j.jpba.2018.12.009 [45] SVEC F, LV Y Q. Advances and recent trends in the field of monolithic columns for chromatography[J]. Anal Chem,2015,87(1):250-273. doi: 10.1021/ac504059c [46] CHEN M L, LI L M, YUAN B F, et al. Preparation and characterization of methacrylate-based monolith for capillary hydrophilic interaction chromatography[J]. J Chromatogr A,2012,1230:54-60. doi: 10.1016/j.chroma.2012.01.065 [47] ZHAO X L, CHEN W J, ZHOU Z Y, et al. Preparation of a biomimetic polyphosphorylcholine monolithic column for immobilized artificial membrane chromatography[J]. J Chromatogr A,2015,1407:176-183. doi: 10.1016/j.chroma.2015.06.056 [48] 彭坤, 吴慧慧, 李林, 等. 功能化聚合物基质整体色谱柱的研究进展[J]. 分析测试学报, 2018, 37(10):1158-1165. doi: 10.3969/j.issn.1004-4957.2018.10.006 [49] MEJÍA-CARMONA K, MACIEL E V S, LANÇAS F M. Miniaturized liquid chromatography applied to the analysis of residues and contaminants in food: a review[J]. Electrophoresis,2020,41(20):1680-1693. doi: 10.1002/elps.202000019 [50] HARA T, IZUMI Y, HATA K, et al. Performance of small-domain monolithic silica columns in nano-liquid chromatography and comparison with commercial packed bed columns with 2 µm particles[J]. J Chromatogr A,2020,1616:460804. doi: 10.1016/j.chroma.2019.460804 -






 下载:
下载:
 下载:
下载: