-
海洋生物毒素是一类由海洋生物产生的天然活性物质,具有化学结构新颖,生物活性高,作用于钠、钾、钙等离子通道等特点,有望开发为先导化合物,为新型海洋药物的研发提供新策略,但其强烈毒性和高致死率也对人类健康产生巨大威胁[1]。目前,药物毒性评价多采用细胞模型和动物模型,由于细胞模型不能重现体内真实环境,动物模型存在伦理和物种差异等问题,近年来,在微流控技术基础上发展起来的器官芯片模型,可以模拟体内组织器官的结构和功能,再现体内微环境,在药物毒性评价与检测领域展现出极大潜力。本文构建了一种可模拟心血管结构与功能的心血管芯片模型,用于四种典型的深海毒素,即大田软海绵酸(OA)、芋螺毒素(CTX)、河豚毒素(TTX)和环亚胺毒素(GYM)的致伤评价,并初步探索了雷公藤甲素对毒素致伤的保护作用,旨在为深海毒素的防护提供参考。
-
SC-1B匀胶机、BP-2B型烘胶台(北京创世威纳科技有限公司);JKG-2A光刻机(上海学泽光学机械有限公司);PDC-32G-2型等离子清洗机(美国Harrick公司);CKX41型高倍显微镜(日本OLYMPUS公司);Harris Uni-Corel 15072型打孔器(美国Harris公司);超净工作台、CO2细胞培养箱、离心机、超低温冰箱(美国Thermo Fisher公司);Synergy 4多功能酶标仪(美国Bio-TEK公司);Harvard蠕动泵p-70(美国Harvard仪器公司);十万分之一电子分析天平(日本A&D公司)。
聚二甲基硅氧烷(PDMS)预聚剂和固化剂(美国Dow Corning公司);硅单面抛光片、显影液(苏州汶颢芯片科技有限公司);SU-82 075光刻胶(美国Microchem公司)、磷酸盐缓冲盐(PBS)、96培养孔板(美国Corning公司);无菌注射器(江苏恒康公司);PE/20软管(美国Scientific Commodities公司);多聚赖氨酸溶液(北京索莱宝科技有限公司);DMEM/F-12培养基(美国Hyclone公司);胎牛血清(加拿大MULTICELL公司);青霉素-链霉素溶液、胰蛋白酶(美国Gibco公司);CCK-8检测试剂盒(大连美仑生物有限公司);山羊血清、Tween-20溶液(碧云天生物科技公司);荧光素异硫氰酸酯标记的小麦胚芽凝集素(WGA-FITC)、二甲基亚砜(DMSO)、大田软海绵酸、河豚毒素、环亚胺毒素(北京普华仕科技发展有限公司);芋螺毒素(上海楚肽生物科技有限公司);雷公藤甲素(上海陶素生物科技有限公司)。所有化学试剂除特殊说明外均为分析纯。
-
精密称取OA溶解于DMSO,配置浓度为31 μmol/L的储备液;CTX溶解于超纯水中,配置浓度为200 μmol/L的储备液;TTX溶解于0.1%甲酸溶液,配置浓度为313 μmol/L的储备液;5 μmol/L的GYM标准溶液,氮气吹干后培养基复溶,于−20 ℃保存。用培养基稀释至低、中、高三个浓度的溶液:OA(10、50、100 nmol/L)、CTX(0.5、5、20 μmol/L)、TTX(0.04、0.4、4 μmol/L)、GYM(4、10、40 μmol/L)。雷公藤甲素溶解于DMSO,配置浓度为10 mmol/L的储备液,培养基稀释至实验浓度0.5、1、3、10、20、50 μmol/L。
-
人脐静脉内皮细胞(HUVEC)购买自美国ATCC细胞库,培养于含10%胎牛血清和1%青霉素-链霉素的DMEM/F-12培养基中,置于37 ℃、5% CO2培养箱中培养,取对数生长期细胞用于后续实验。
-
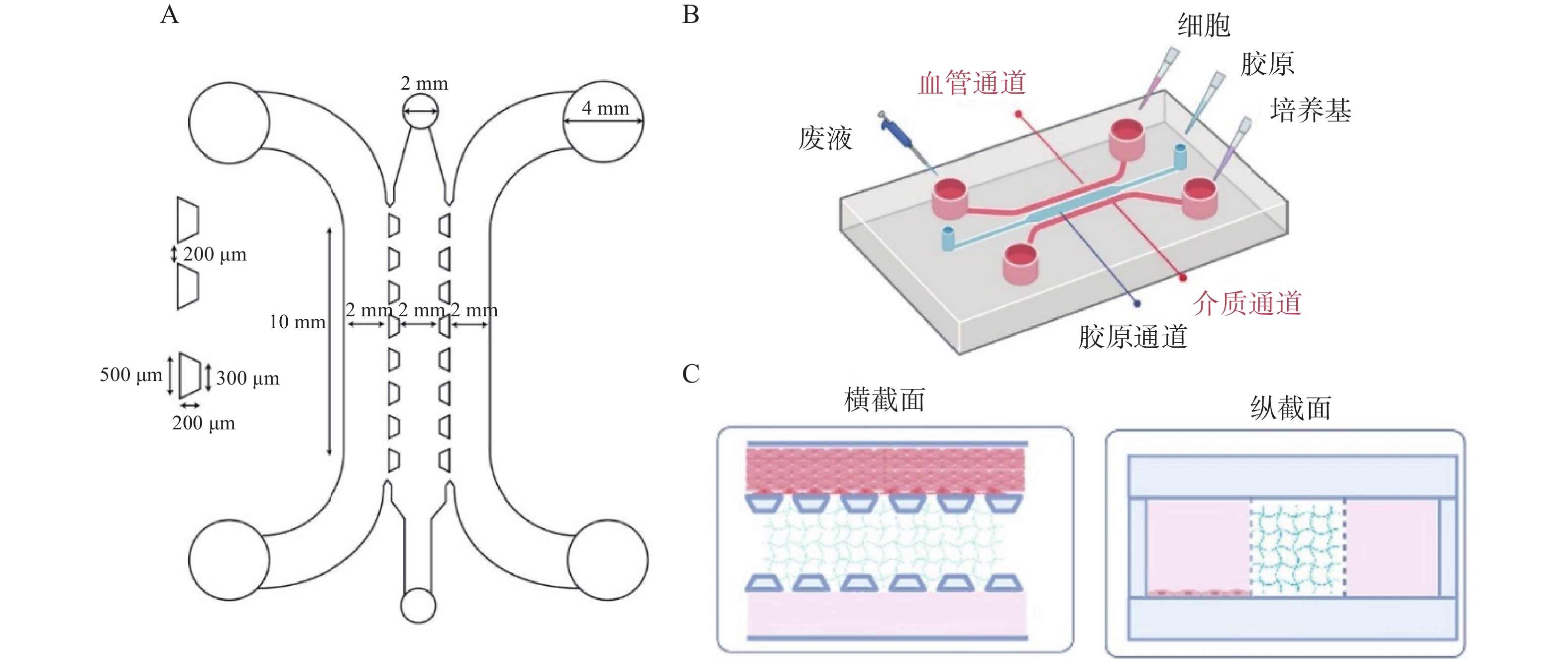
使用AutoCAD软件设计、软光刻技术制备三通道并列的微流控芯片,如图1所示。将凝血酶(4 U/ml)、PBS和纤维蛋白原(100 mg/ml)按25∶22∶3比例混匀加入芯片胶原通道;血管通道加入PBS稀释的基质胶(1∶50,V/V)后加入对数生长期的HUVEC细胞(3×106 cells/ml);在外部设备上,使用蠕动泵灌注培养基,人体血流剪切应力为5~20 dyn/cm2,参照剪切应力公式τ=6 μQ/h2w计算流体流速(其中τ为流体剪切应力,μ为流体粘滞度,Q为流体流速,h和w分别为芯片内细胞培养腔的高度和宽度),模拟细胞在体内所受的血流剪切应力,于体外重构心血管微环境[2]。
-
取对数生长期的HUVEC细胞,按5 000 cells/孔的细胞密度接种于96孔板,空白组不加细胞。24 h后吸除原培养基,空白组与正常对照组各孔中只加入细胞培养液,实验组中加入含有不同浓度的毒素试液,每孔100 μl,每组6个平行。24 h后观察细胞形态,向各组每孔中加入10%的CCK-8溶液,避光孵育1 h。酶标仪检测450 nm处各样品的吸光度值(OD)计算相对细胞活力。
相对细胞活力(%)=[(OD药物−OD空白)/(OD对照−OD空白)]×100
-
于心血管芯片模型血管通道加入20 μl不同浓度的毒素,24 h后用PBS缓慢润洗通道内细胞。将4%多聚甲醛缓慢注入到芯片微通道内,固定20 min,PBS润洗去除通道内残留的多聚甲醛。加入10%山羊血清的PBST(PBS+0.1% Tween-20),封闭30 min。在通道内加入适量的WGA-FITC(WGA-FITC∶PBS=1∶200,V/V
),避光孵育1 h。芯片通道PBS润洗3次,每次5 min,荧光倒置显微镜下观察并采集数据。根据毒素损伤前后WGA-FITC染色荧光强度(MFI)变化情况计算糖萼损伤率。 糖萼损伤率(%)=[1−(MFI损伤/MFI正常)]×l00
-
考察不同浓度的雷公藤甲素对HUVEC细胞活性的影响,筛选出雷公藤甲素的最佳预保护浓度用于后续实验。取对数生长期的HUVEC细胞接种于96孔板,向实验组、对照组各孔中分别加入雷公藤甲素预保护1 h。实验组加入不同浓度的毒素溶液,CCK-8法评价雷公藤甲素对毒素损伤后HUVEC细胞的保护作用,实验步骤详见“1.5”项。
采用上述构建的心血管芯片模型,于血管通道内加入雷公藤甲素预保护1 h后,实验组加入不同浓度的毒素,考察雷公藤甲素对毒素损伤血管糖萼组织保护作用,实验步骤详见“1.6”项。
-
采用Image J软件计算免疫荧光强度表达,GraphPad Prism 7统计学软件进行数据分析,组间比较采用单因素方差分析,*P<0.05,**P<0.01表示差异有统计学意义。
-
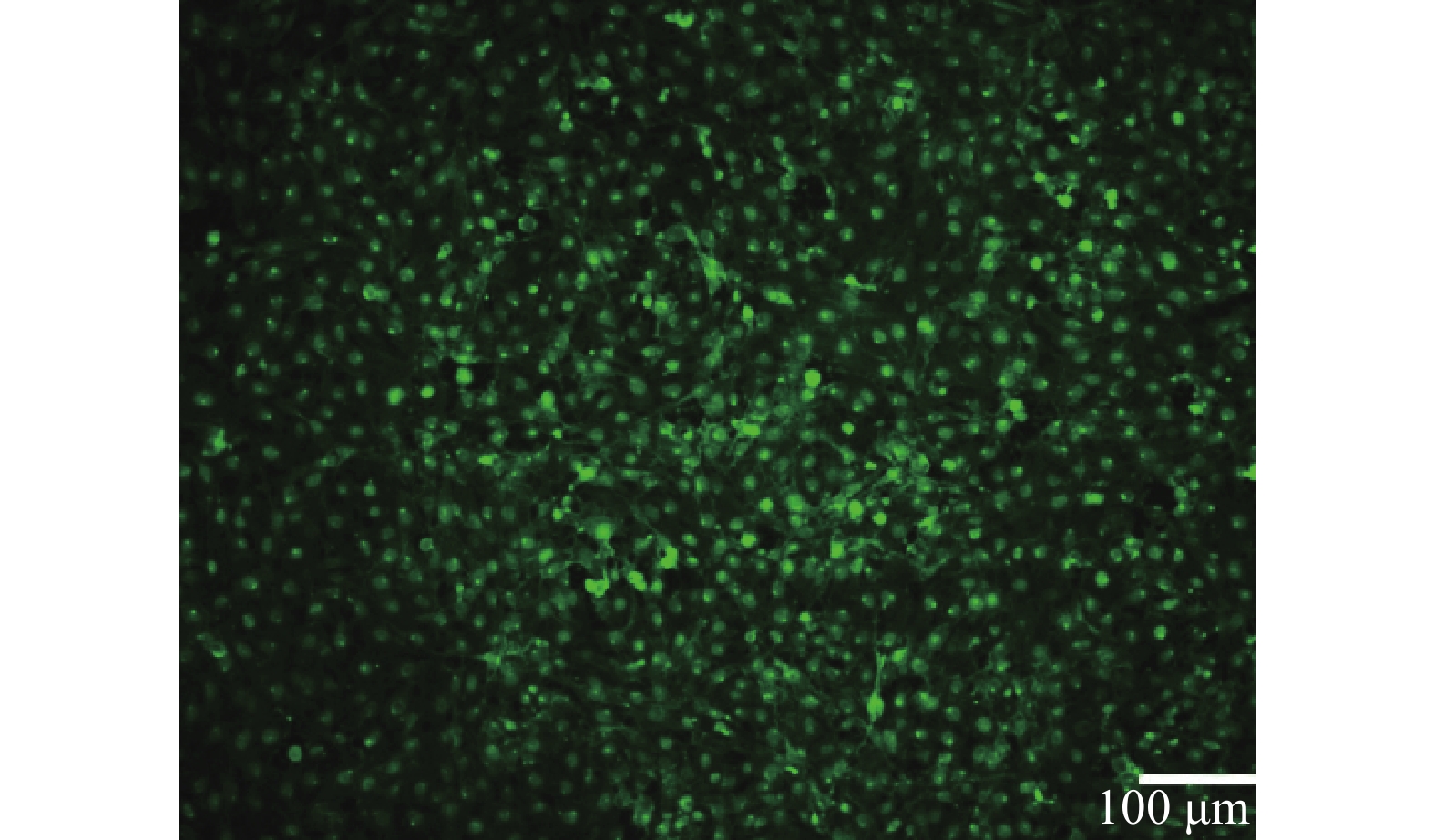
以1 μl/min的流速动态培养细胞,HUVEC细胞在所构建的心血管器官芯片模型中生长状态良好,存活率高。经WGA-FITC免疫荧光染色,可清楚观察到结构完整的血管内皮糖萼,符合体外心血管模型的要求,如图2所示。
-
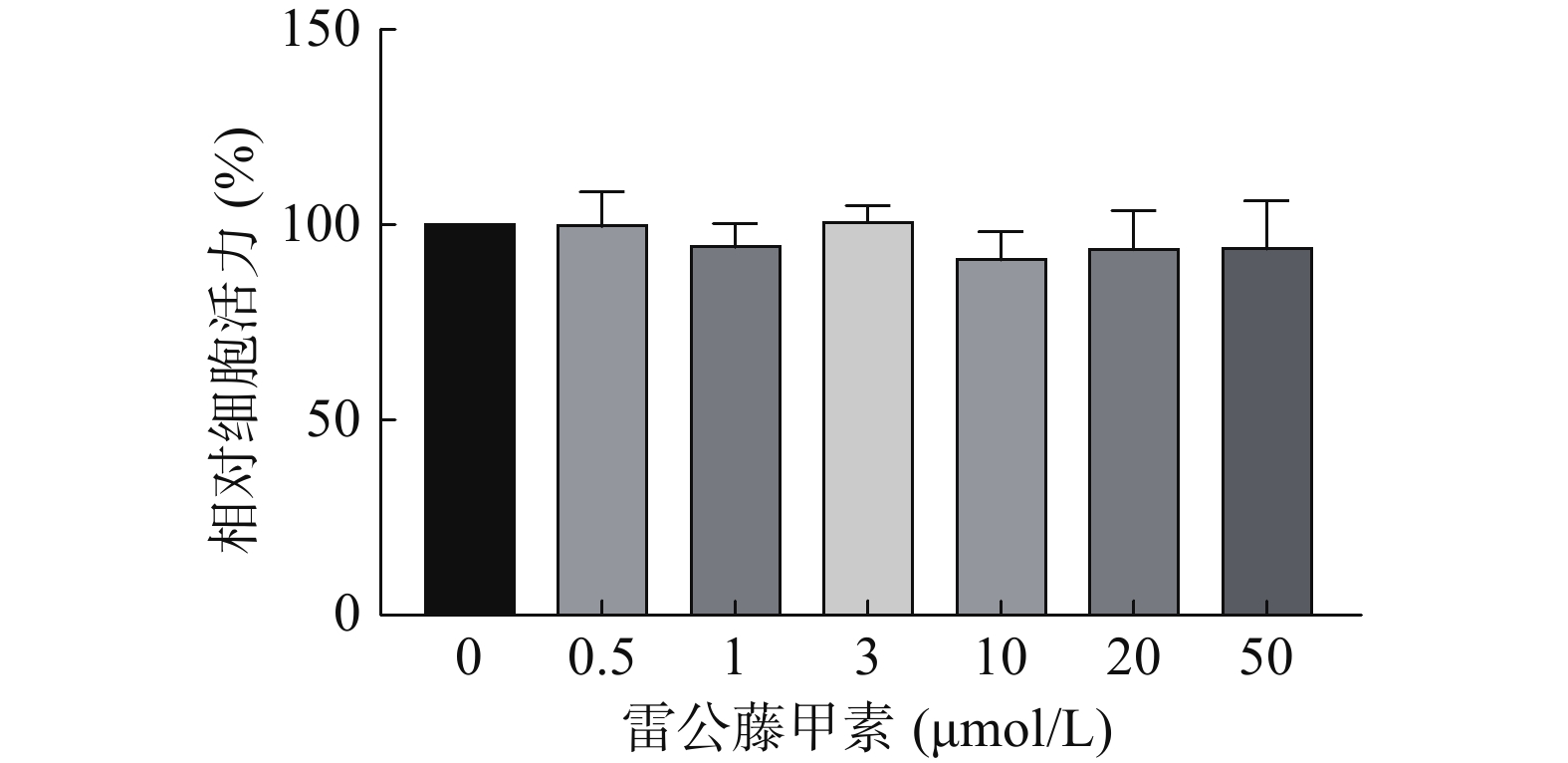
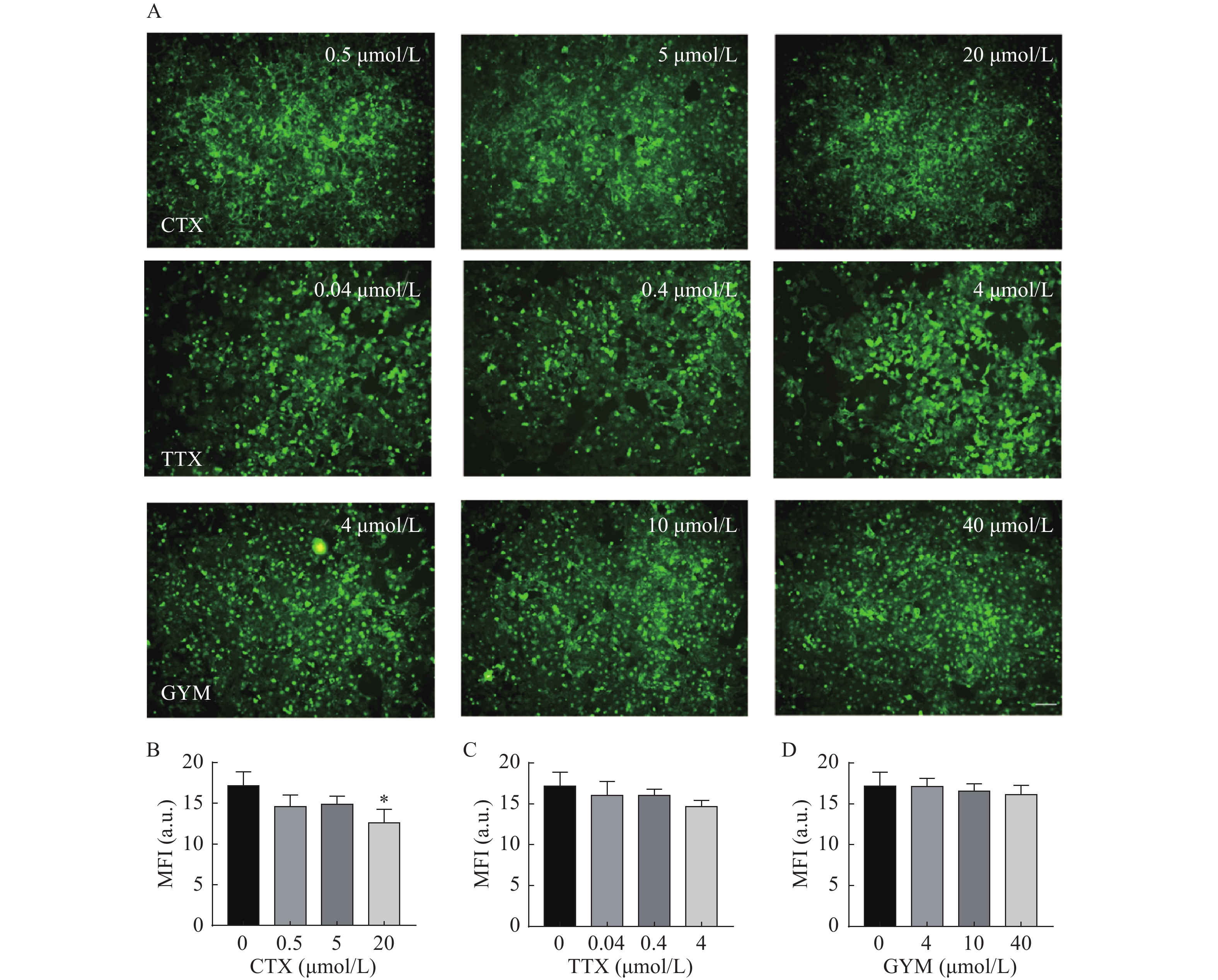
采用CCK-8法考察不同浓度的雷公藤甲素对HUVEC细胞活力的影响,结果如图3所示,在测试浓度范围内,雷公藤甲素对HUVEC细胞不存在明显的活力抑制,选择浓度为1 μmol/L的雷公藤甲素进行后续实验。
-
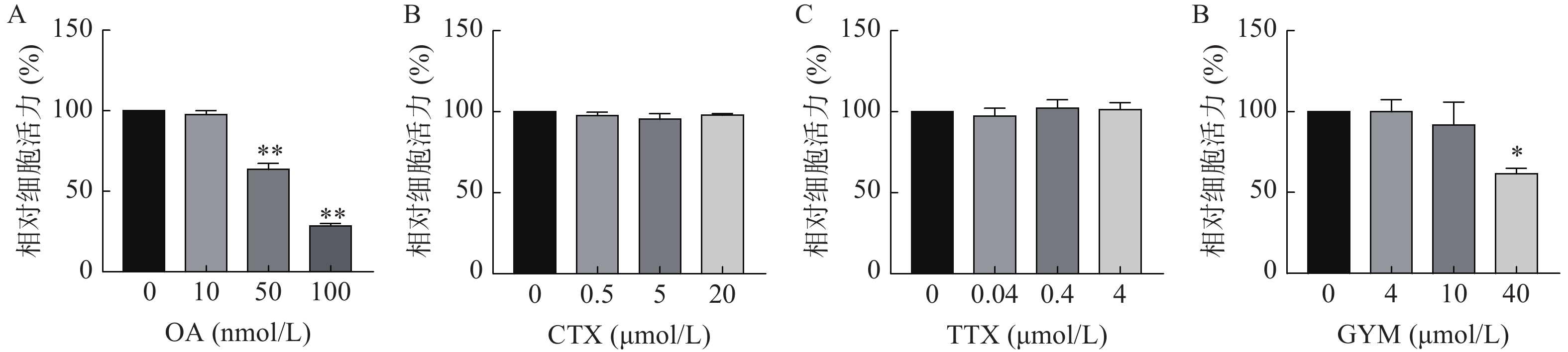
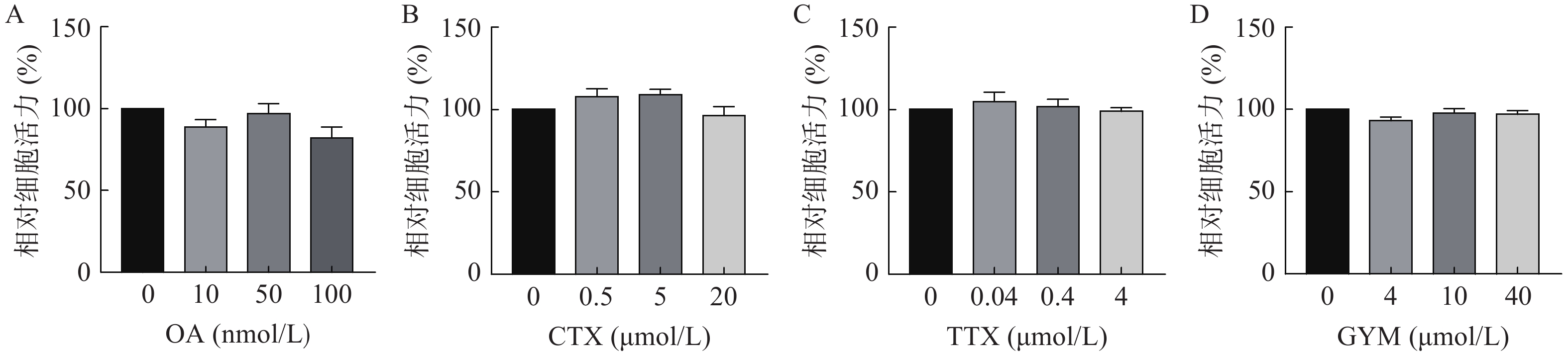
采用CCK-8法测定雷公藤甲素预保护前后,低、中、高三个浓度的毒素对HUVEC细胞活力的影响。与对照组相比,OA在中、高浓度下对细胞活力具有较强的抑制作用(P<0.01),其IC50为54.12 nmol/L。GYM在高浓度对细胞活力有较大影响(P<0.05),但是在加入1 μmol/L雷公藤甲素预保护后,OA与GYM对细胞的毒性显著降低,细胞活力与对照组相比无显著性差异,说明雷公藤甲素对OA和GYM损伤HUVEC细胞具有一定的保护作用。而CTX、TTX在雷公藤甲素预保护前后,对HUVEC细胞活力均无显著抑制作用,结果如图4、5所示。
-
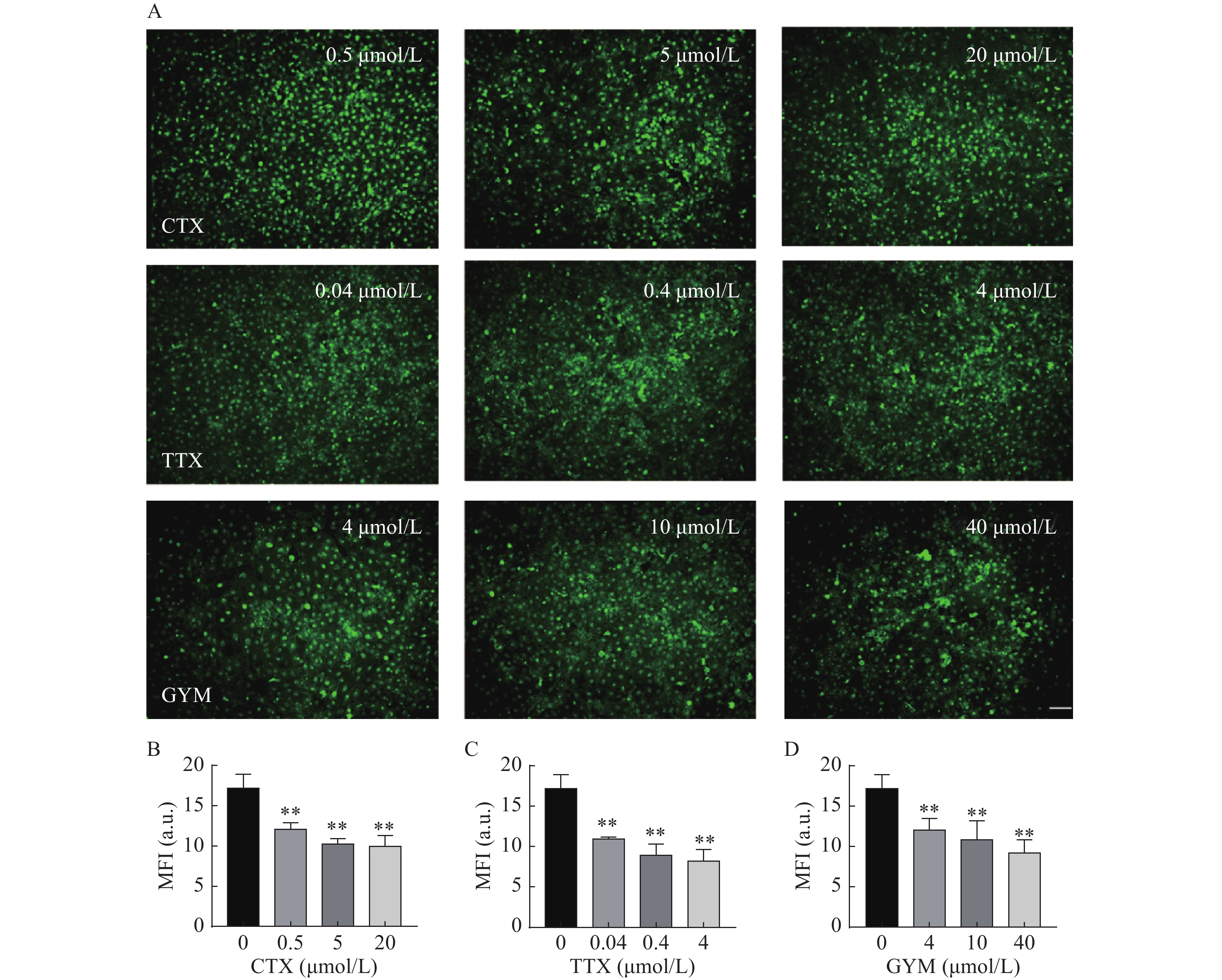
在所建立的心血管芯片平台上研究雷公藤甲素对四种毒素产生细胞内皮糖萼损伤的保护作用,免疫荧光染色结果如图6和图7所示。OA作用后,HUVEC细胞出现皱缩、变圆、体积变小等形态变化,且随着实验浓度的增大,所呈现的上述细胞形态变化加剧,培养液中可见大量细胞碎片和悬浮的死细胞,说明OA对HUVEC细胞毒性较强,不仅对细胞糖萼有较严重的损伤,还影响了细胞与芯片PDMS基底的贴附水平,心血管芯片结构和功能受损。CTX、TTX和GYM作用后,HUVEC细胞受到不同程度的损伤,内皮细胞糖萼的WGA-FITC染色荧光强度信号与对照组相比均明显降低,具有统计学意义(P<0.01)。经雷公藤甲素预保护后,低浓度OA所产生的细胞损伤得以减轻,糖萼损伤率为28.20%,但是中浓度和高浓度作用下的细胞依旧损伤严重。除OA外,其余三种毒素作用后的糖萼WGA-FITC染色荧光强度均有明显升高,糖萼损伤率见表1。
表 1 心血管芯片上的糖萼损伤率
毒素 给药浓度(μmol/L) 糖萼损伤率(%) 预保护前 预保护后 CTX 0.5 36.30 14.90 5 48.04 13.47 20 52.28 26.52 TTX 0.04 29.55 6.52 0.4 40.30 6.69 4 41.97 14.60 GYM 4 23.53 0.22 10 25.89 3.65 40 40.41 6.01 -
海洋生物中的活性物质有很多,对海洋生物毒素研究却是冰山一角。海洋生物毒素根据化学结构的不同常分为三类:聚醚类、多肽类和生物碱类毒素[3]。OA是一种聚醚类化合物,是近年来研究最突出的一种海洋生物毒素,研究发现暴露于OA会导致细胞凋亡以及促进肿瘤和癌症的发生,对人体造成很大危害[4]。多肽类毒素以CTX最具代表性,CTX能特异性地作用于神经递质受体以及多种离子通道,不仅可直接作为药物,还可作为分子工具发展新药先导化合物,对神经生物学的研究具有重要意义[5]。TTX是一种生物碱类毒素,可选择性地与钠离子通道受体结合,研究发现,TTX的麻醉效果强,持续时间长,在镇痛、镇静方面应用前景广泛[6]。随着对海洋生物研究的深入,一些新的毒素也陆续被发现。GYM是一种具有环亚胺结构的毒素,相对于其他三种毒素发现较晚、毒性较弱,但其降解速度缓慢,存在长期毒性效应,在生态系统中的潜在风险不容忽视[7]。尽管海洋生物毒素的研究越来越受到人们的重视,但是现有的评价模型限制了毒素研究工作的进一步开展。
微流控器官芯片模型利用微流控技术对流体进行精确调控,模拟生物体内环境,在体外进行器官生理及病理状态的复制,到目前为止,已经实现肝、肾、肠道等多种器官芯片的构建,在药物筛选、药效和毒性评价方面显示出良好的应用前景[8]。大量研究表明,血液循环流动产生的剪切应力对内皮细胞分化、生长状态和功能表达有着重要作用[9]。本研究基于微流控技术构建心血管芯片模型,将HUVEC细胞接种于三通道的微流控芯片中,通过蠕动泵控制培养基流动速度为1 μl/min,有利于营养物质的输送和废物排出,与静态培养相比,细胞所处的动态环境更接近体内生理条件,心血管芯片模型中的细胞生长状态良好,形态呈铺路石样。
糖萼是存在于内皮细胞表面的多糖-蛋白复合物,参与调节炎症反应、血管通透性、凝血平衡在内的多种生理过程,是血管内皮细胞发挥生物功能的重要结构[10]。本研究采用免疫荧光染色法,通过FITC-WGA与HUVEC细胞中糖萼的葡萄糖胺基团选择性结合,测量其荧光强度以反映细胞糖萼损伤情况。结果显示,在实验浓度范围内,OA对细胞具有较大毒性,对糖萼组织损害严重;40 μmol/L的GYM对细胞活力有较强的抑制作用,糖萼损伤率高达40.41%;而TTX和CTX两种毒素对HUVEC细胞无明显活力抑制,但是其糖萼组织受损严重,可见这两种毒素虽然本身对细胞不存在明显的毒性作用,但是通过其他途径与细胞上的结构组织相互作用,从而影响细胞的功能表达。
雷公藤甲素是卫矛科植物雷公藤的主要活性成分,具有抗炎、抗菌、抗肿瘤等药理作用,但是对心血管的作用尚未完全明确。张诗雨等[11]发现雷公藤甲素可作用于血管内皮细胞核转录因子NF-κB,改善脂多糖(LPS)刺激HUVEC细胞所产生的炎症反应。宗佳琪等[12]在LPS诱导的内毒血症大鼠的心血管功能损伤研究中,同样也发现雷公藤甲素对血管内皮相似的保护作用。本研究初步探索了雷公藤甲素对毒素致伤的保护作用,结果显示,经1 μmol/L雷公藤甲素预保护后,四种毒素作用下的细胞活力与对照组相当,对实验浓度范围内CTX、TTX、GYM以及低浓度OA所产生的糖萼损伤具有一定保护作用。
综上,本文构建了一种心血管芯片模拟心血管结构与功能,包括血管表面的糖萼组织。应用该芯片考察了OA、TTX、CTX和GYM四种深海毒素的毒性效应,发现四种毒素对HUVEC细胞活力以及表面的糖萼组织具有损伤,且呈一定的剂量关系,而雷公藤甲素对上述毒素致伤具有保护作用。
Evaluation of toxin-induced injury and protective effect of triptolide based on a cardiovascular chip model
-
摘要:
目的 构建一种心血管芯片模型,评估四种海洋毒素即大田软海绵酸(OA)、芋螺毒素(CTX)、河豚毒素(TTX)和环亚胺毒素(GYM)对血管糖萼组织的损伤,初步探索雷公藤甲素对毒素致伤的保护作用。 方法 将人脐静脉内皮细胞(HUVEC)接种于三通道结构的微流控芯片,并对所构建的心血管芯片模型进行表征。采用CCK-8法和免疫荧光染色法分析低、中、高三个浓度的海洋毒素对细胞活力和糖萼组织损伤情况,以及雷公藤甲素对毒素致伤的保护作用。 结果 所构建心血管器官芯片中的细胞生长状态良好,具有结构完整的糖萼组织,与对照组相比,OA中、高浓度以及GYM高浓度均对细胞活力具有一定抑制(P<0.05),CTX和TTX在所测浓度下对细胞没有明显活力抑制,但是四种毒素均引起细胞表面糖萼组织的严重损伤(P<0.01),且随着浓度增加,糖萼损伤率升高。经雷公藤甲素预保护后,四种毒素对HUVEC的毒性显著降低,糖萼组织损伤率下降。 结论 四种毒素对HUVEC细胞活力以及表面的糖萼组织具有损伤,且呈一定的剂量关系,而雷公藤甲素对毒素损伤后的HUVEC细胞具有保护作用。 Abstract:Objective To construct a cardiovascular chip model for evaluating the damage of vascular glycocalyx induced by four marine toxins: okadaic acid (OA), conotoxin (CTX), tetrodotoxin (TTX) and gymnodimine (GYM), and explore the protective effect of triptolide on toxin-induced injury. Methods Human umbilical vein endothelial cells(HUVEC) were inoculated into a three-channel microfluidic chip. CCK-8 method and immunofluorescence staining were used to analyze the damage of cell viability and glycocalyx tissue induced by low, middle and high concentrations of marine toxin, as well as the protective effect of triptolide on toxin-induced injury. Results The cells in the cardiovascular chip grew well and had structurally intact glycocalyx. Compared with the control group, the activity of HUVEC cells were inhibited in group of the medium and high concentration of OA and high concentration of GYM (P<0.05). The activity of cells had not been inhibited by CTX and TTX significantly , but all the four toxins caused serious damage to the glycocalyx tissue (P<0.01). After pre-protection with triptolide, the toxicity of the four toxins to HUVEC cells and the damage rate of glycocalyx decreased significantly. Conclusion The four marine biotoxins could damage the activity and glycocalyx of HUVEC cells in a dose-dependent manner, while triptolide has a protective effect on HUVEC cells injured by toxin. -
Key words:
- cardiovascular chip /
- marine biotoxins /
- glycocalyx damage /
- triptolide
-
药物利用研究(DUR)是促进用药安全、有效和经济的重要手段[1]。随机对照临床试验(RCT)作为评价药物安全性、有效性的金标准,在外推至日常诊疗环境时往往面临挑战。作为RCT的重要补充,真实世界研究(RWS)考察日常诊疗环境中产生的真实世界数据(RWD),注重评价药物使用的“安全性”和“有效性”,已经成为药物利用研究的热点[2]。RWS着眼于应用到医疗实践环境中,大大缩短了试验周期、降低了成本,真实世界实效性临床研究更加易于获取全面的病例数据,使其结果更具有可靠性及可行性[3]。应当正确认识两者关系,将两者作为互补且相辅相成的研究方法和手段来为药物利用评价和监管评价等方面提供循证支持[4-7]。
随着医院管理信息系统(HIS)的高速发展以及高新传感器技术在生物医疗领域探索运用,使得逐步精准化、数字化患者的各项检查及健康诊疗数据成为现实,并进一步完善患者诊疗、实验室检查以及用药信息等全生命周期的医疗记录,且便于追溯及交互关联[2]。尽管数据库技术及大数据挖掘服务于药物安全性、有效性等方面研究成为现实,但应用于DUR尚缺乏具体的技术指导方案、自然流程等。本研究借鉴国内外RWS在药品器械上市后适应证开发及安全性评价方面的做法,梳理DUR中RWS有效技术手段和方法路径,为RWS更好的服务于DUR提供借鉴和参考。
1. 相关概念
DUR是按照预定的标准,评价、分析和解释一个给定的医疗卫生制度下药物利用的模式、质量、影响因素和结果,着重于药物的市场销售、分配、处方和使用情况,强调由此产生的医疗、社会和经济方面的结果。广泛应用于药物流行病学、抗菌药物管理、药物监测、药物警戒等方面的研究。2020年4月,国家药监局发布《真实世界证据支持药物研发与审评的指导原则(试行)》[8],对RWD、真实世界证据(RWE)以及RWS等概念做了相关阐述[8-9]。RWS作为实现从RWD到RWE的有效手段,是连接两者的桥梁[10]。然而,大规模的数据并不一定就能产生有价值的证据,只有通过适用性评估的RWD、分析得出医疗产品的使用和潜在收益或风险的临床证据时才有可能使数据转变为证据[11-12]。数据适用性即从数据使用者角度出发,评价数据满足使用者需求的程度[13],强调数据质量在开展相应RWS方面的可应用程度[14]。
2. 真实世界药物利用研究现状
2.1 真实世界研究与药物利用研究结合现状
国家药品监督管理局自2014年起就陆续出台多项措施,支持RWS用于医疗器械评价、药物审评、研发及监管决策,完善医疗器械不良事件监测和再评价制度,并联合高校、医联体推进多项试点工作的开展,出台了《真实世界研究支持儿童药物研发与审评的技术指导原则(试行)》[15]等法规文件以推进RWS。目前RWS主要集中在以下3个方面:①药物治疗效果[16-17],RWS在药物疗效、不良事件、安全可靠方面的结果研究,以满足药物对人类临床应答的解释以及推广方面应用;②指南或临床实践[18-20],国内外权威的指南是临床实践的重要参考依据,RWS也可用于协助制定和修订患者治疗方案,而RWE有利于指南更加科学性和具有实践性。此外,RWS还可以用于协助政府部门管理的指导性文件的制定;③经济效益[21-23],RWS应用于卫生经济学中筛选研究和治疗选择等方面,帮助医师制定最优的药物治疗方案,并提供合理的经济成本。此外,RWS在帮助制定个性化医疗政策方面也具有很大的潜力。
2.2 真实世界研究体系现状
国际上,随着药品审评和监管标准的不断提高,越来越多的研究者重视RWS,目前已经形成了良好的研究体系,比如美国的以患者为中心的结局研究所(PCORI)和欧盟临床试验公共注册和结果数据库(EUPAS)。RWS主要集中于:①在研究用药的随机对照试验、观察性研究及实践指南中的应用;②在疾病的发病风险评估、医疗健康保险的应用。目前国内的RWS主要涉及:①在中医方面的应用研究[24-26],包括中药的药物疗效及不良反应的研究;②基于医院信息数据库疾病及其合并疾病的用药特征的分析;③在医疗大数据及循证医学方面的应用[27-29]。
RWS的研究设计和方法学也不断完善,近年来不少国家或国际组织都陆续出台关于RWS的指南以及指导原则,提高了RWS的质量和可靠性,比如美国 FDA[30-31]、欧洲EMA[32],英国NICE[33]。
3. 真实世界研究在药物利用研究中的应用
3.1 真实世界药物利用研究的方法
3.1.1 数据来源及研究问题
RWS收集真实诊疗数据或者基于已经存在的研究型数据库或数据研究平台,建立登记数据库,针对具体研究问题,运用循证医学方法,开展数据分析,从而回答验证假设[34-36]。RWD通常来自于以上一个或多个数据库,包含需要主动收集的数据以及常规诊疗行为产生的临床数据。随着医学大数据的快速发展,一些研究型数据库或数据研究平台也逐步拓展,目前,国内外利用公共数据库如SEER、MIMIC等进行相关研究已成为RWS的重要发展方向。
RWS通常基于研究目的建立研究数据库或数据集,研究要素一般包含目标患者人口学特征、用药信息、门诊、住院信息、实验室检查、治疗转归与结局,以及其他研究目的所涉及到的临床治疗、护理、手术处置等信息。如果数据来自多个不同数据库,还必须通过如患者身份证号码、住院号/检查号、姓名等患者唯一标识码进行辨识和数据关联。如果研究的资料内容涉及到患者的个人信息等情况,还要注意取得伦理学审核以及保护患者隐私[37-41]。真实世界DUR的药品数据通常通过ATC编码来规范,采用用药依从性,限定日剂量(DDD)、平均治疗天数(ATD)、总DDD数、处方年费用等DUR指标[42]。基于药物效果和安全性研究、经济学和药物政策、多个疾病和多个治疗方案的复杂病情分析是当前真实世界药物利用研究的一个热点。
RWS作为一项非随机、开放性、不使用安慰剂的研究。为了挖掘真实的临床医疗环境产生的诊疗数据,应把质量控制作为全局指标来进行把握,并从研究伊始就建立起全面的数据质量控制方案并严格遵守。同时,在研究中详细记录异常情况[43],还要注意数据清洗以及混杂因素的控制,如此才能保证研究证据的质量及等级[44]。
3.1.2 研究人群及纳排标准
RWS人群纳入条件较为宽松,但仍在研究中需要明确与研究目的相关或可能影响研究的因素,以及纳入及排除标准的研究时间段和制定日期。研究通常通过WHO国际疾病分类(ICD-9/10)筛选研究人群。研究人群通常为患有特定疾病的患者、药物使用者(罕见病、孕妇、儿童等)以及患有多种疾病的复杂病例或有多种伴随症状的人群。有时候为解决研究对象以往接受过某种治疗措施可能导致的选择偏倚,还需要考虑遵照首次用药人群的设计[45]。最后,研究者需谨慎纳入和排除标准,以免直接影响研究结果的外推。
研究者应当严格参照PICOTS原则明确的6个关键点(总体、干预、比较对象、结果、时间和场所),同利益相关者一同提出针对研究问题可利用的科学方法[46]。
3.1.3 真实世界药物利用研究设计
观察性研究设计是RWS中广泛使用的设计类型之一[44],常见的有前瞻性观察研究[47]、回顾性队列研究[18,48]、Meta分析[49]等。根据不同的研究目的和研究对象,可以选择适合的研究方法和样本来源,通常需要开展大规模、跨学科的合作,以确保研究结果的可靠性和科学性。RWS设计时要结合研究目的来具体确定研究要素,综合考虑年龄、混杂偏倚和特殊人群、药品ATC编码,以及病历等非结构化数据。设计通常包括以下几个阶段:①定义问题:在研究开始之前明确研究的目的和问题,确定研究的对象、变量和数据采集方式。需要考虑研究的可行性、科学性和意义。②研究设计:根据定义的问题,制定设计方案。明确设计类型、样本容量、数据采集方式、结局指标以及数据分析方法等。③招募研究对象:确定研究对象的选择标准,并依照这些标准进行样本招募。④数据收集和管理:采集所需的研究数据,将收集到的数据进行规范化、清洗、质量控制和审查等处理。⑤数据分析:使用统计学方法进行数据分析,包括描述性统计、回归分析、生存分析和成本效益分析等。⑥结果解释和推广:将研究结果进行整合、解释和推广,发表研究报告和文章,向目标受众,如医师、政策制定者、患者和公众等,传达研究结论和建议。
3.1.4 特征变量及评价指标
RWS设计阶段应该充分了解现有数据的优缺点,并恰当合理的定义并描述暴露因素,尽可能的收集与暴露相关的特征指标。RWS结局指标是评估一种治疗或干预措施在真实医疗实践中的效果和安全性以及相关临床和经济结果的指标。
通常有以下几种结局指标:①主要疗效结局:主要的成果、结果或效果指标。例如,治疗效果、复发率、临床终点事件;②次要疗效结局:主要疗效结局之外的其他疗效结果或事件。如总体存活率(OS)、无进展生存期(PFS)、无病生存期(DFS)、疾病进展时间(TTP)、治疗失败时间(TTF)、死亡率,住院时间等[50];③安全性结局[12,51]:一般采用药物不良反应(ADR)、不良反应发生率(IRs,通常以1000人/年表示)[12]、危险性信号、药物相互作用等;④经济学结局[52-53]:包括成本效益和成本效用评估、日均费用、医疗保险、社会资源利用及患者的自付费用等。
选取结局指标时需要根据研究目的和研究对象,进行目标导向和可行性评估。常规首选应该是临床意义明确和易于全面评估的主要疗效结局,同时可以考虑次要疗效结局和安全性结局作为辅助评估。为综合评估治疗效果和成本并获得系统的经济评估结果,相关经济学方面的评价指标也应该考虑进来。
3.2 统计及敏感性分析
通常对目标患者群体和治疗模式进行描述性统计分析,分析各分类变量的频率、百分比,以及在连续区间尺度上测量的变量平均值、标准差、中位数及范围,有学者应用Kaplan-Meier(KM)生存函数进行相关生存分析[54]。针对研究目标确定分析要素,选用合适的统计分析方法,如卡方检验、logistic回归和多元线性回归等,对治疗结局、暴露因素、协变量数据类型及分布情况进行校正分析。由于所有研究结果基于假设提出,而这些假设往往是推论真实性的依据。研究者需对数据的局限性和问题本质有清晰认识,研究过程中对假设进行调整,评价观察结果对特定假设的敏感度或方向大小上的一致性。
3.3 混杂因素及偏倚控制
3.3.1 混杂因素
RWD来源包含电子病历、医保数据库、生命体征记录、医学图像等,存在许多复杂的混杂因素。混杂因素可能的类型包括个体基线特征、随时间变化的特征、医疗诊断和治疗、环境因素。常见的混杂控制策略包括随机对照、匹配分析、协变量校正、倾向值和剂量反应模型等。除此之外,在实施RWS时,还要注意有代表性的样本选择,对数据质量和分析偏倚进行评估和控制,以获得准确和可靠的研究结论。
3.3.2 偏倚控制
RWS是在真实临床环境下进行的研究,目标人群的治疗措施因非随机分配影响内部真实性,虚弱个体治疗措施与结局之间的关联性等,使得其研究结果可能存在一定的偏倚,这些偏倚可能影响研究的可靠性和有效性。常见的偏倚类型包括选择性偏倚、信息偏倚[55]、报告偏倚、记忆偏倚等,常见的偏倚控制方法有模拟试验、设计分层、倾向值匹配、重复量表、级联分析等。
4. 展望
真实世界DUR作为一种新兴的药物评价方法,可将从真实世界环境下收集和分析的大量数据利用起来,通过实效性、回顾性研究使得过往产生的既有诊疗数据进一步提炼成RWE而二次利用。通过研究分析获得的循证医学证据,可以为DUR提供有价值的依据,帮助优化药物使用、个体化医疗、提高患者结局、降低医疗费用、促进医学的健康发展;也可采用前瞻性研究大样本或特殊人群,为其更好、更安全有效用药提供证据。
同时,RWS也是评价药物滥用的有效手段。随着大数据和医疗技术的不断发展,RWS将会成为药物治疗效果、患者治疗策略和临床实践方面重要的研究领域,并将不断地推动医药的创新、优化和进步。
值得注意的是,RWS是一项复杂的研究工作,需要具备较强的统计、数据挖掘和医学知识背景,同时也面临着数据质量、缺失值、样本匹配和结果影响因素多等问题。因此,在实施RWS时,需要有效的科学设计、广泛报告,同时进行敏感度分析和可能存在的偏差分析,为制定更加科学和有效的药物治疗方案提供科学支持。
-
表 1 心血管芯片上的糖萼损伤率
毒素 给药浓度(μmol/L) 糖萼损伤率(%) 预保护前 预保护后 CTX 0.5 36.30 14.90 5 48.04 13.47 20 52.28 26.52 TTX 0.04 29.55 6.52 0.4 40.30 6.69 4 41.97 14.60 GYM 4 23.53 0.22 10 25.89 3.65 40 40.41 6.01 -
[1] BARRECA M, SPANÒ V, MONTALBANO A, et al. Marine anticancer agents: an overview with a particular focus on their chemical classes[J]. Mar Drugs,2020,18(12):619. doi: 10.3390/md18120619 [2] YOSHIZUMI M, ABE J I, TSUCHIYA K, et al. Stress and vascular responses: atheroprotective effect of laminar fluid shear stress in endothelial cells: possible role of mitogen-activated protein kinases[J]. J Pharmacol Sci,2003,91(3):172-176. doi: 10.1254/jphs.91.172 [3] 陈巧莉, 杨兵, 洪晴悦, 等. 海洋生物毒素的分类、毒害作用机制及检测技术研究进展[J]. 食品科学, 2021, 42(5):321-331. doi: 10.7506/spkx1002-6630-20200326-380 [4] FU L L, ZHAO X Y, JI L D, et al. Okadaic acid (OA): Toxicity, detection and detoxification[J]. Toxicon,2019,160:1-7. doi: 10.1016/j.toxicon.2018.12.007 [5] JIN A H, MUTTENTHALER M, DUTERTRE S, et al. Conotoxins: chemistry and biology[J]. Chem Rev,2019,119(21):11510-11549. doi: 10.1021/acs.chemrev.9b00207 [6] BUCCIARELLI G M, LECHNER M, FONTES A, et al. From poison to promise: the evolution of tetrodotoxin and its potential as a therapeutic[J]. Toxins,2021,13(8):517. doi: 10.3390/toxins13080517 [7] OTERO P, SILVA M. Emerging marine biotoxins in European waters: potential risks and analytical challenges[J]. Mar Drugs,2022,20(3):199. doi: 10.3390/md20030199 [8] KIMURA H, SAKAI Y, FUJII T. Organ/body-on-a-chip based on microfluidic technology for drug discovery[J]. Drug Metab Pharmacokinet,2018,33(1):43-48. doi: 10.1016/j.dmpk.2017.11.003 [9] CUCULLO L, HOSSAIN M, PUVENNA V, et al. The role of shear stress in Blood-Brain Barrier endothelial physiology[J]. BMC Neurosci,2011,12:40. doi: 10.1186/1471-2202-12-40 [10] TARBELL J M, CANCEL L M. The glycocalyx and its significance in human medicine[J]. J Intern Med,2016,280(1):97-113. doi: 10.1111/joim.12465 [11] 张诗雨, 张静, 高攀, 等. 雷公藤甲素对血管内皮细胞炎症反应的影响及机制研究[J]. 时珍国医国药, 2021, 32(7):1537-1541. doi: 10.3969/j.issn.1008-0805.2021.07.01 [12] 宗佳琪, 王烁阳, 苏萍, 等. TLR4/NF-κB p65信号通路介导雷公藤甲素对内毒血症大鼠内皮保护作用[J]. 中国中药杂志, 2019, 44(22):4912-4917. -





 下载:
下载: