-
随着人们生活方式的改变,心血管疾病成为全球发病和死亡的重要原因,临床上以冠状动脉粥样硬化性心脏病(CHD,简称冠心病)最为常见,给患者、家庭和社会带来了巨大的负担[1,2]。血管性痴呆(VD)是缺血或出血性脑血管病引起脑组织损伤所致的痴呆类型[3]。最新研究估计,我国60岁以上的痴呆患者约有
1507 万人,其中VD患者约有392万人[4]。特发性膜性肾病(IMN)是常见的自身免疫性肾小球疾病,该病严重时可引起心、脑等器官障碍。研究显示,IMN患者约有40%可进展为终末期肾病,极大威胁患者生命安全[5]。冠心病、血管性痴呆、特发性膜性肾病虽属不同系统疾病,但文献研究发现,他们都有痰瘀互结的共同病因病机。冠心病不同阶段病人痰瘀互结的比例超过50%,血管性痴呆和特发性膜性肾病也有近50%,这为三类疾病的异病同治提供了重要的理论基础[6,7]。
异病同治是中医的重要理念,该理念提供了认识疾病的共同规律,帮助找到治疗方向,是辨证识机论治的根本。国医大师朱良春倡导“顽疾必兼痰和瘀”,痰瘀同治重大疾病疗效卓著。项目组前期提出“益气化痰活血、清热散结法”异病同治冠心病、血管性痴呆、特发性膜性肾病的组方用药新方案,根据中药组方规律结合经典方剂,按照“君、臣、佐、使”的原则,组建益气活血化痰、清热散结方-丹参白术方,该方剂从治疗湿热、血瘀、气虚、痰瘀等方面结合中药的用药特性组建,在临床取得了较好的治疗效果。
网络药理学是以系统生物学为基础,多学科、多领域融合形成的新兴学科。其综合性、系统性、整体性的理念与中药多成分、多靶点、多通路的特点相吻合。本研究基于网络药理学的方法,对丹参白术方治疗冠心病、血管性痴呆、特发性膜性肾病的靶点进行测试,初步探究其可能的物质基础和作用机制,为临床进一步研究提供依据。
-
丹参白术方由丹参、炒白术、黄芪、虎杖等9味中药组成。本研究依托中药系统药理学分析平台TCMSP[8](http://tcmspw.coni/tcmsp.php)、PubChem[9]数据库(https://pubchem.ncbi.nlm.nih.gov/)进行检索,根据TCMSP数据库中药物动力学(ADME)参数,以口服生物利用度(OB)≥30%,类药性(DL)≥0.18为筛选条件[10],收集并筛选丹参白术方的活性化合物。将获得的活性化合物输入TCMSP、PharmMapper[11-13](http://www. lilab-ecust.cn/pharmmapper/index.html)数据库,PharmMapper数据库中按照“Norm Fit≥0.8”的标准,筛选靶点,获取活性化合物相应的潜在作用靶点。运用UniProt[14]蛋白数据库(https://www.uniprot.org/),限定物种为人(Homo Sapiens),将得到的靶点标准化为基因名称(Gene Symbol),并导入Cytoscape 3.8.2软件,构建“中药-活性化合物-药物靶点”的网络图。
-
以“coronary heart disease”、“vascular dementia”和“idiopathic membranous nephropathy”作为关键词,搜索GeneCards[15]数据库(https://www.genecards.org/)、OMIM[16]数据库(http://www.omim.org)和DrugBank[17]数据库(https://www.drugbank.ca/)中与冠心病、血管性痴呆和特发性膜性肾病的潜在靶点。选择物种为“Homo sapiens”,在GeneCards数据库中分别以Score≥11.75、Score≥4.584和Score≥5.398为筛选条件。利用在线作图工具Venny 2.1.0(https://bioinfogp.cnb.csic.es/tools/venny/)针对丹参白术方活性化合物的潜在作用靶点与冠心病、血管性痴呆和特发性膜性肾病的靶点绘制韦恩图,所得的交集靶点即为丹参白术方对3种疾病“异病同治”的共有靶点。并将其导入Cytoscape 3.8.2软件,构建“丹参白术方-共有靶点-疾病”(冠心病、血管性痴呆和特发性膜性肾病)网络。
-
共有靶点导入STRING11.5数据库[18](https://string-db.org/),以intersection score>0.4为筛选标准[19],隐去无关靶标,构建蛋白质相互作用(PPI)网络模型。通过Cytoscape 3.8.2软件中的插件cytoHubba对PPI网络进行分析、筛选获得关键靶点。
-
将关键靶点导入Metascape数据库[20],参数设置为H species,P<0.01,选取排前20位的条目,并通过在线作图网站微生信(http://www.bioinformatics.com.cn/)进行可视化分析。
-
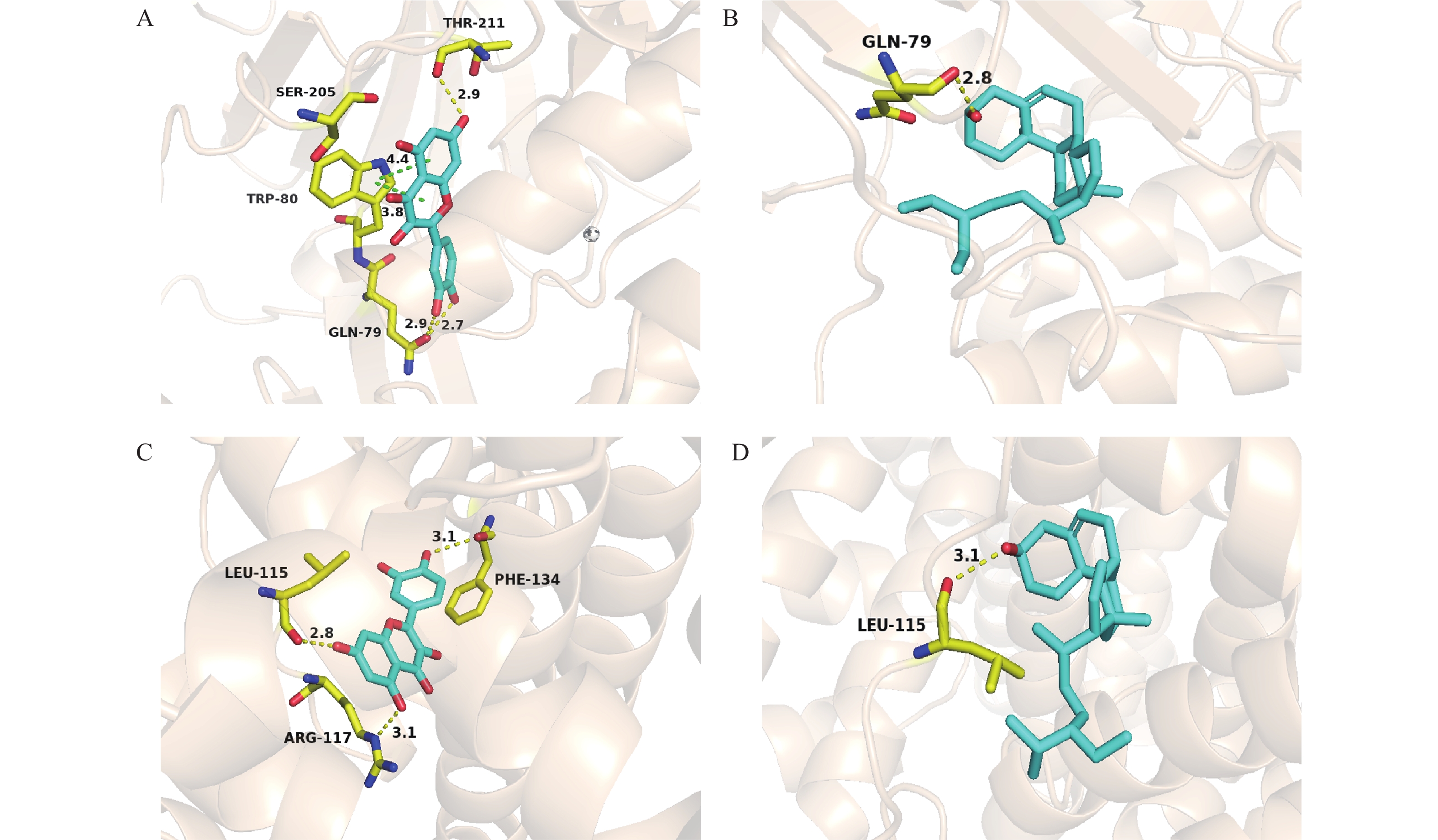
选取丹参白术方中的共有核心成分槲皮素和与筛选出的Degree值高的靶点AKT1和ALB进行分子对接,在PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)获取药物的2D结构信息,采用Schrödinger软件,将2D结构转化为MOL2格式并将其用作配体;同时通过蛋白质结构数据库(PDB)下载受体蛋白的3D结构,使用Schrödinger软件中的Glide模块对小分子和靶蛋白进行高精度(XP)对接,通过对比原配体与活性成分的对接打分值评判丹参白术方的活性成分与该靶点的亲和力。采用PyMol进行可视化展示。
-
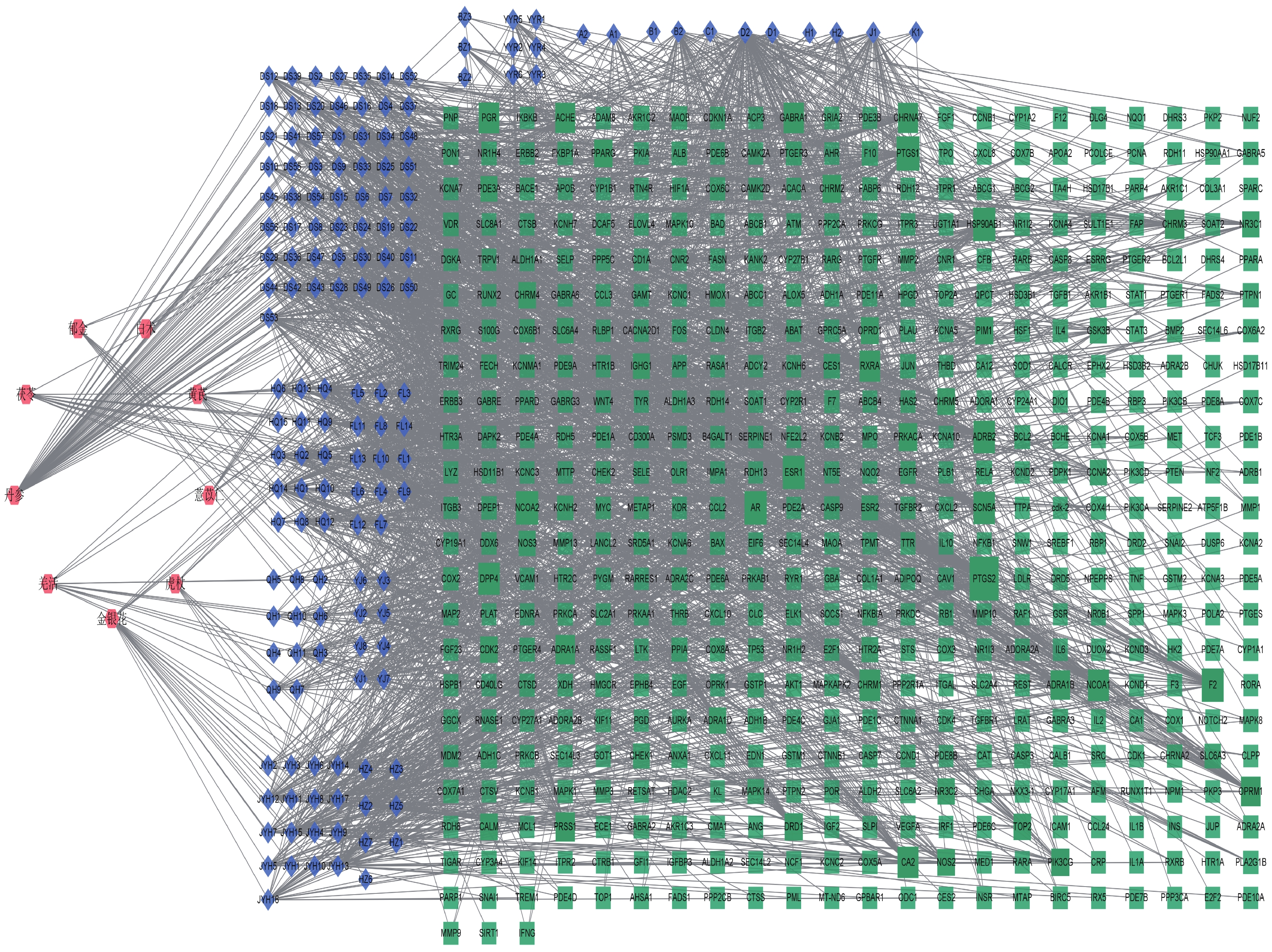
将丹参白术方中的9味中药上传至TCMSP、PubChem数据库搜索到1 121个化合物。按照OB≥30%且DL≥0.18的筛选标准,筛选出177个活性化合物,排除13个未发现相关靶点的化合物,共收集到164个活性化合物。基本信息见附件1。通过TCMSP、PharmMapper、UniProt数据库共获得活性化合物潜在作用靶点509个。通过Cytoscape3.8.2软件,构建“中药-活性化合物-药物靶点”网络,见图1。
-
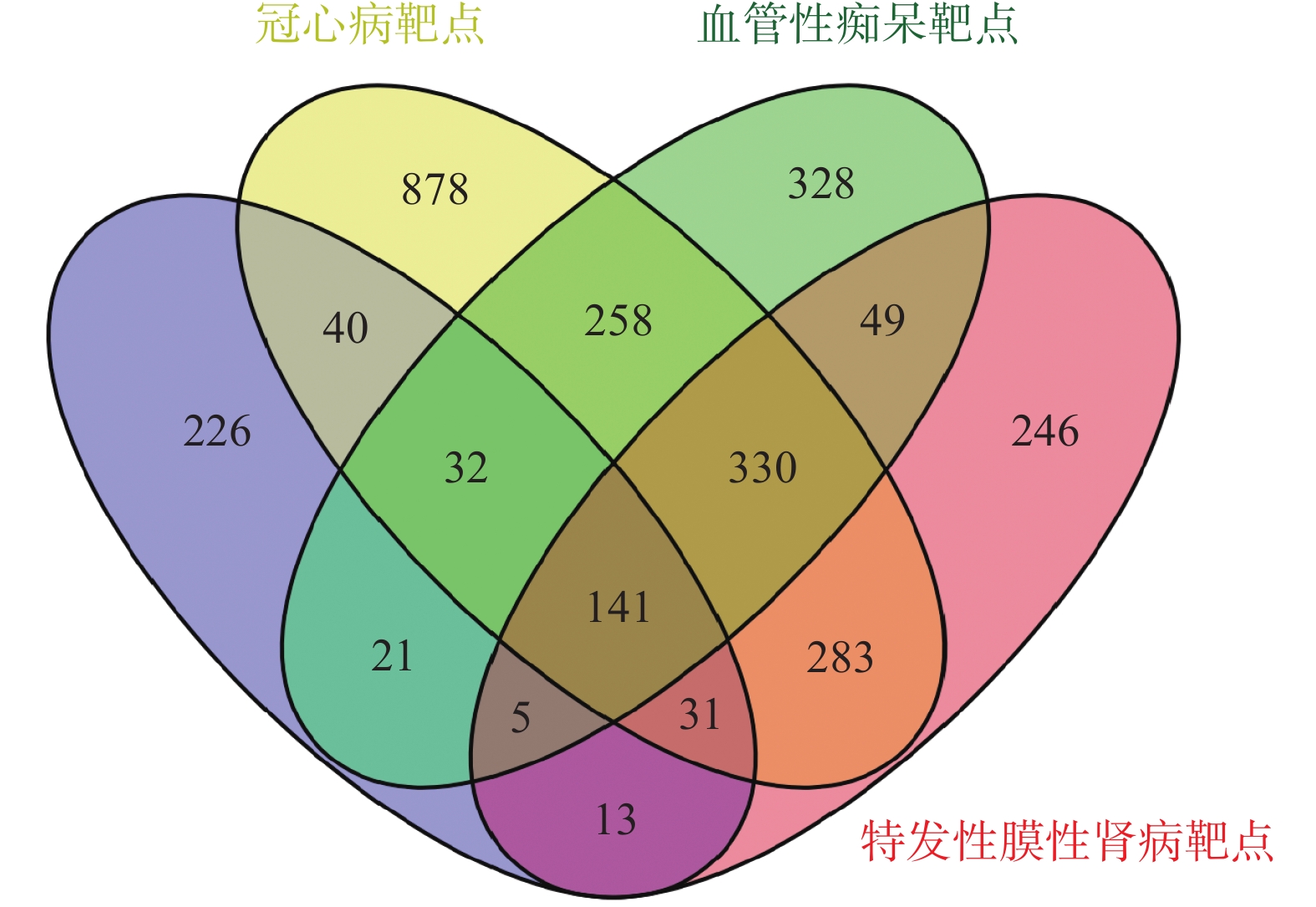
通过GeneCards、OMIM和DrugBank数据库,按照筛选标准搜集3种疾病的潜在靶点,去重后获得冠心病疾病靶点1 993个,血管性痴呆疾病靶点1 164个,特发性膜性肾病疾病靶点1 098个。将以上3种疾病靶点与丹参白术方509个潜在作用靶点进行交集,最终获得丹参白术方对3种疾病“异病同治”的共有靶点141个,通过Venny 2.1.0,将数据绘制韦恩图,见图2。将共有靶点导入Cytoscape 3.8.2构建“丹参白术方-共有靶点-疾病”网络图,见图3。
-
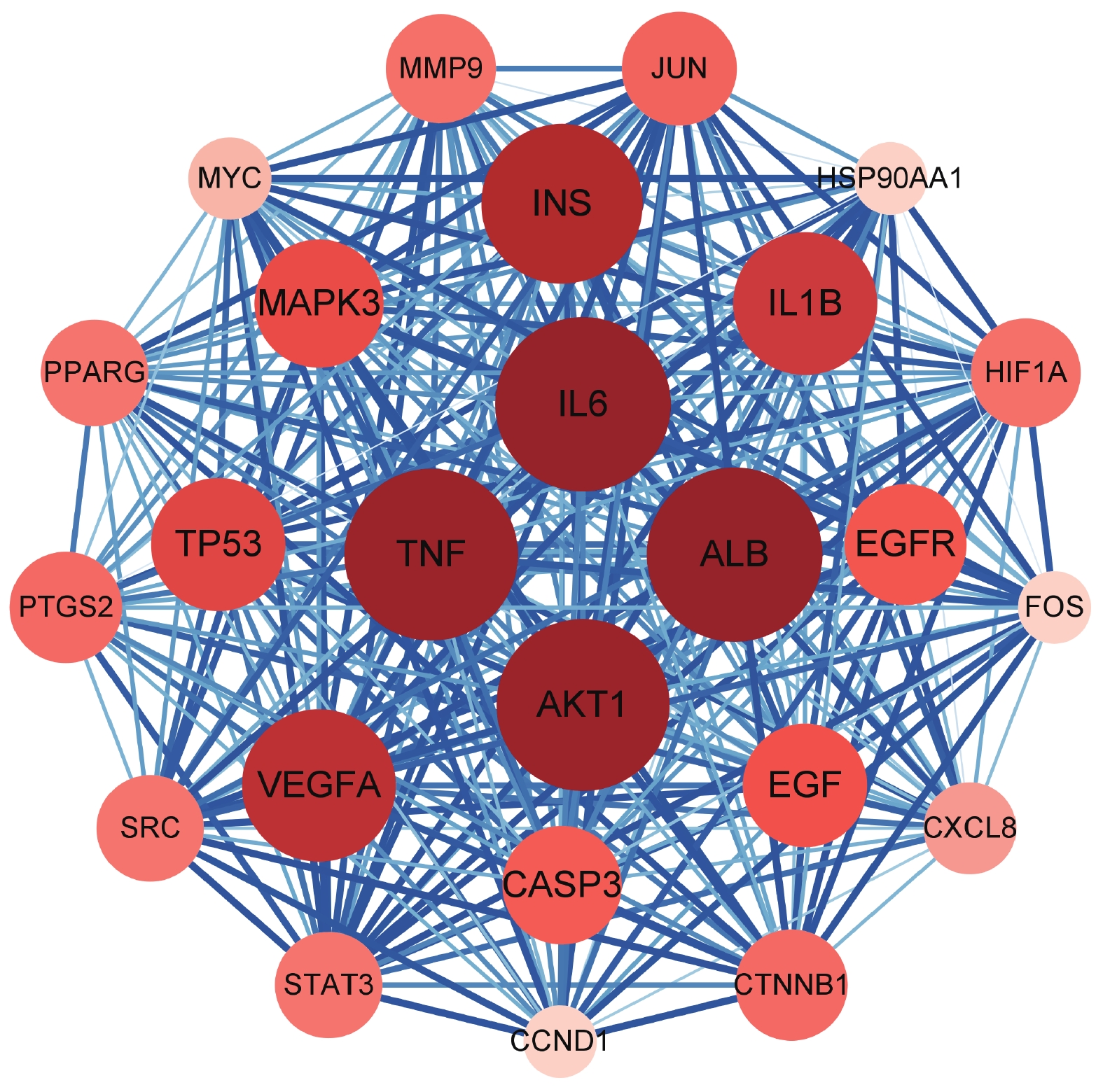
将以上获得的141个共有靶点输入STRING 11.5数据库,得出共有靶点的蛋白质间相互作用关系,通过平台分析得到节点数141个,边数3 564条,平均节点度值50.6,以intersection score>0.4为筛选标准,将筛选后的信息导入Cytoscape 3.8.2,使用其插件cytoHubba进行分析,cytoHubba提供了11种拓扑学分析方法搜寻关键靶点,使用3种算法:连接度(度值)、最大团体中心性(MCC)、最大邻域分量(MNC),各提取排名前30位的关键靶点,取交集,得到关键共有靶点25个,分别是:ALB、IL6、TNF、AKT1、JUN、CASP3、VEGFA、STAT3、INS、PTGS2、MAPK3、IL1B、TP53、MMP9、HIF1A、CTNNB1、SRC、FOS、MYC、CXCL8、CCND1、EGFR、EGF、HSP90AA1、PPARG,见图4。图形的面积和颜色深浅表示靶点度值的大小,面积越大,颜色越深说明靶点度值越大。
-
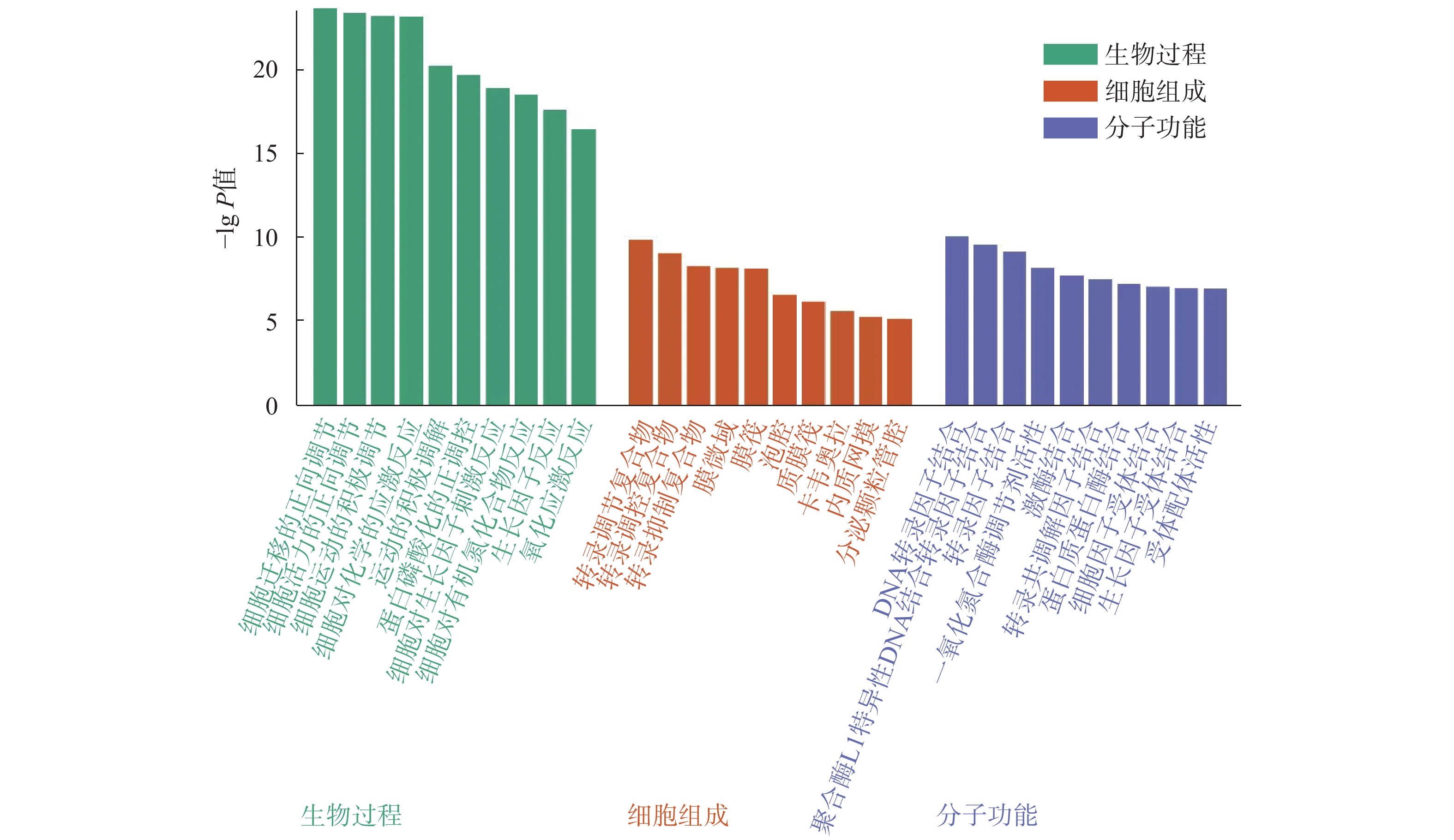
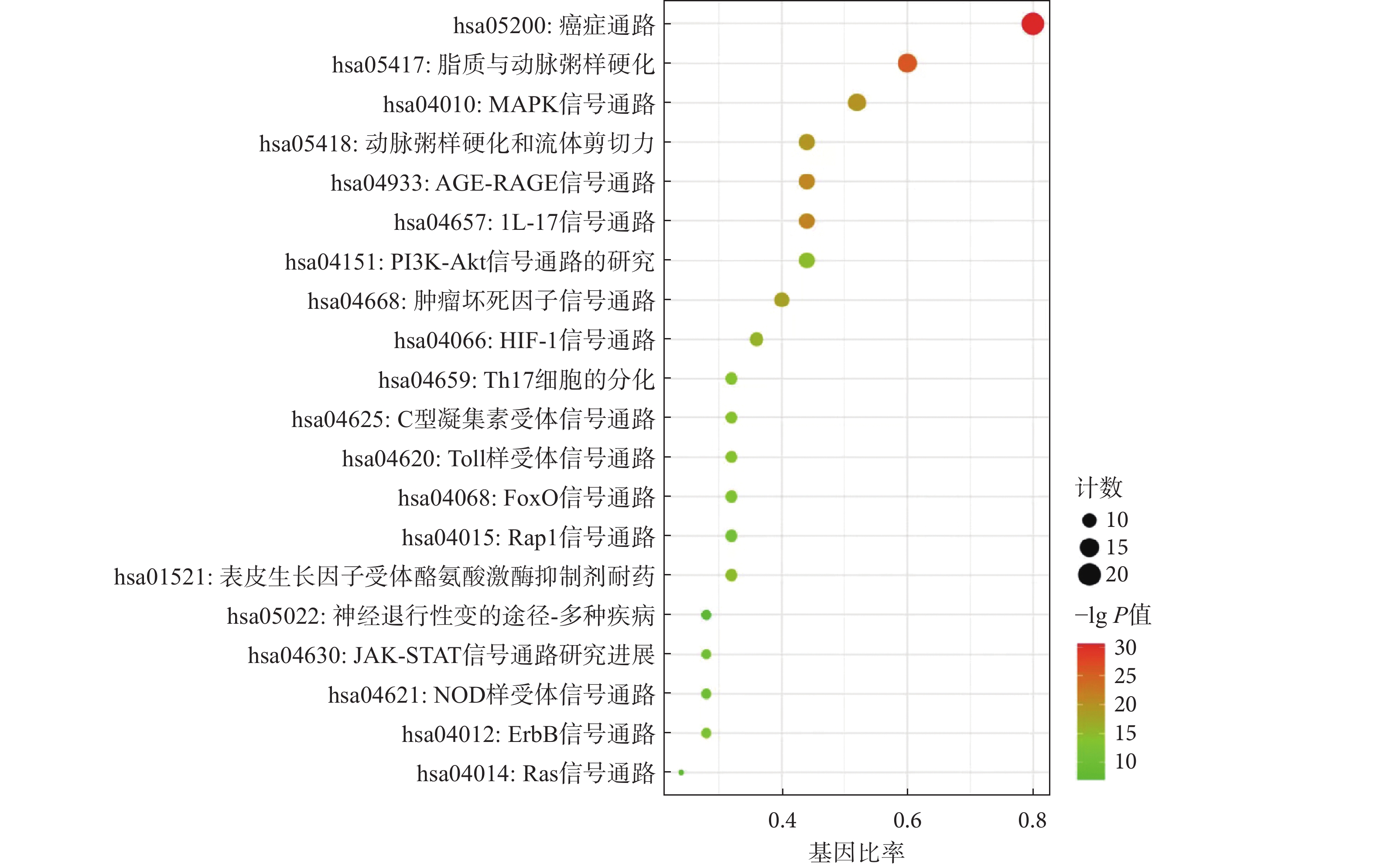
为进一步探究丹参白术方“异病同治”的作用机制,将上述获得的25个关键共有靶点上传至Metascape,进行GO功能分析和KEGG信号通路富集分析。共获得生物过程(BP)817个,细胞组成(CC)30个,分子功能(MF)44个,根据其P值大小,分别列举前10位的条目,具体见图5。KEGG通路富集分析筛选得到142条P<0.01的通路。将P值较小的,富集靶点较多的20条通路,使用在线作图工具微生信进行可视化分析,结果以散点图的形式呈现,具体见图6。
-
应用Schrödinger软件对丹参白术方的主要共有活性成分槲皮素(Quercetin)、β-甾谷醇与核心靶点AKT1和ALB进行分子对接,对接结果见表1。靶蛋白AKT1、ALB与其原配体的对接打分值(Docking score)分别为−10.807 kcal/mol、−7.664 kcal/mol。若活性成分的对接打分值低于或接近原配体则表明该活性成分与该靶点的结合能力较强。其中槲皮素对ALB的对接打分值低于原配体且对AKT1的Docking score值与其原配体接近,表明活性成分槲皮素与关键蛋白受体AKT1与ALB均具有较强的结合稳定性。活性成分β-甾谷醇对ALB的对接打分值与原配体接近,虽然对AKT1的对接打分值相对原配体较低,但小于−6 kcal/mol也被认为具有良好的结合活性。绘制分子对接模式图见图7。
表 1 丹参白术方的主要共有活性成分与核心蛋白的分子对接结果
活性成分 核心靶点 PDB ID 对接分数(kcal/mol) 槲皮素 AKT1 3O96 −10.332 β-甾谷醇 AKT1 3O96 −6.755 槲皮素 ALB 4LB2 −8.049 β-甾谷醇 ALB 4LB2 −7.358 -
研究显示,冠心病的发病发展过程中,冠状动脉系统粥样硬化斑块及其微循环障碍是痰瘀互结后病理变化的必然结果。临床研究显示活血化痰法能够保护内皮细胞,降脂抗黏,防治心绞痛发作,多种方药均能通过活血化痰改善疾病发生发展。对于特发性膜性肾病,痰瘀贯穿始终,并且“痰瘀互结沉痼”是形成该病难治性的主要原因。痰瘀同治能够有效控制感染,调节免疫,促进肾小球血流动力学改变,从而改善肾脏功能,延缓病情进展。在血管性痴呆发生发展中,痰瘀也是重要的发病因素,临床以化痰祛瘀方案治疗疗效甚佳[7]。因此,针对痰瘀互结的共同病机异病同治,有望成为中医药临床防治重大疾病的突破口,也是中医传统理论在当代重大疾病诊疗中的价值体现和创新应用。
丹参白术方以丹参、炒白术为君药,丹参祛瘀、生新、活血,《本草纲目》记载,其活血、通心包络,是活血化瘀的代表药。研究证明,以丹参为君药的中药方剂和有效成分能改善微循环缺血再灌注后引起的心、脑功能障碍和器官损伤[21]。炒白术健脾祛湿,可绝生痰之源。黄芪、虎杖为臣药,黄芪具有抗钙超载,清除氧自由基、改善心功能、保护血管内皮等作用,虎杖是清热解毒、散瘀止痛、止咳化痰的良药。
通过蛋白互作网络显示关键的共有靶点有:ALB、IL-6、TNF、AKT1、VEGFA。ALB是一种分子量为69 000的蛋白,通常占血浆总蛋白含量的50%以上,起着调节血浆胶体渗透压的作用,并作为载体蛋白,有研究发现,血清ALB水平低与不同类型的心血管疾病有关,包括静脉血栓栓塞、CHD和偶发缺血性心脏病等[22,23]。在该研究的蛋白互作网络中,ALB是程度最高的枢纽基因。
IL-6、TNF是参与多种生理与免疫过程的促炎细胞因子,研究证明,IL-17与TNF-α偶联对IL-6的产生具有协同诱导的作用,并对血管具有显著的促凝血和促血栓作用[24,25],而本复方制剂中丹参的有效成分丹参酮ⅡA,木犀草素均有抗凋亡作用,可降低IL-6水平[26-28]。
AKT1是AKT家族激酶的重要成员,有研究证实AKT1信号传导可减轻肾脏损伤,保护肾脏功能,并显著改善缺血再灌注损伤后患者的存活率[29]。
VEGFA是血管内皮生长因子家族中最重要的成员,具有调节内皮细胞增殖、抑制凋亡及增强血管通透性等生物作用。在心肌梗死患者血浆中VEGFA表达增加,并与IL-6水平正相关,能够刺激炎症斑块的新生血管并诱导其不稳定,是心肌梗死患者预后不良的独立风险因素[30]。在肾脏的发育过程中,足细胞中VEGFA表达水平异常与肾小球疾病的发生有密切关联[31]。
通路富集分析结果显示丹参白术方涉及多个生物学过程、细胞分子和分子功能。其中MAPK信号通路可以通过细胞因子、生长因子、神经递质、激素等外源性刺激信号被激活后参与细胞增殖、细胞分化、细胞凋亡等生理过程。研究发现[32],木犀草素通过激活MAPK信号通路,促进抗氧化酶的表达,同时降低丙二醛(MDA)的水平,减轻机体的脂质过氧化损伤,延缓动脉粥样硬化的发生与发展。PI3K-Akt信号通路参与细胞生长、分化、增殖、凋亡等,在氧化应激和炎症反应方面具有重要作用。分子对接验证结果显示,共有核心成分与核心靶点有良好的结合能力。
综上所述,本研究通过网络药理学阐述了丹参白术方通过多成分、多靶点、多通路“异病同治”冠心病、血管性痴呆、特发性膜性肾病的药理学作用机制,为进一步的基础和临床研究提供重要的参考依据。
Network pharmacological mechanism of Danshen Baizhu prescription on the treatment of coronary heart disease, vascular dementia and idiopathic membranous nephropathy
-
摘要:
目的 基于网络药理学探讨丹参白术方“异病同治”冠心病、血管性痴呆、特发性膜性肾病的物质基础和作用机制。 方法 通过TCMSP、PubChem、UniProt、GeneCards、OMIM和DrugBank数据库获取药物和疾病靶点,使用STRING数据库和Cytoscape软件绘制中药-化合物-药物靶点网络、复方-共有靶点-疾病网络、蛋白-蛋白互作图,运用Metascape数据库进行基因富集分析。 结果 共筛选出活性化合物164个,潜在作用靶点509个,“异病同治”的共有靶点141个。其中主要活性成分为丹参酮ⅡA、异鼠李素、槲皮素、木犀草素、山奈酚、β-谷甾醇、豆甾醇等;关键靶点为清蛋白、白介素6、肿瘤坏死因子、丝氨酸/苏氨酸激酶1、血管内皮生长因子A;主要富集于细胞迁移的正向调控、细胞活力的正向调节、蛋白质磷酸化的正向调节、对生长因子的反应、氧化应激反应等生物过程及脂质和动脉粥样硬化、MAPK、动脉粥样硬化和流体剪切力、AGE-RAGE、IL-17、PI3K-Akt等信号通路。 结论 丹参白术方“异病同治”冠心病、血管性痴呆、特发性膜性肾病的作用机制可能主要通过抑制炎症、抑制氧化应激反应、扩张血管等多靶点、多通路发挥作用。 Abstract:Objective To investigate the material basis and mechanism of Danshen Baizhu prescription in coronary heart disease, vascular dementia and idiopathic membranous nephropathy based on network pharmacology. Methods TCMSP, PubChem, UniProt, GeneCards, OMIM, and DrugBank databases were used to obtain drug and disease targets, and the TCM-compound-drug target network, compound-common target-disease network, and protein-protein interaction map were drawn by STRING database and Cytoscape software, and gene enrichment analysis was performed by Metascape database. Results A total of 164 active compounds, 509 potential targets, and 141 common targets were screened out. The main active ingredients were Tanshinone II A, Isorhamnetin, Quercetin, Luteolin, Kampferol, β-sitosterol, Stigmasterol, etc. The key targets were albumin, interleukin 6, Tumor necrosis factor , serine/threonine kinase 1, vascular endothelial growth factor A , mainly enriching in the positive regulation of cell migration, cell viability, protein phosphorylation, responsing to growth factors, oxidative stress and other biological processes and lipid and atherosclerosis, MAPK, atherosclerosis and fluid shear force, AGE-RAGE, IL-17, PI3K-Akt and other signaling pathways. Conclusion The mechanism of action of Danshen Baizhu prescription for coronary heart disease, vascular dementia and idiopathic membranous nephropathy may mainly play a role in multiple targets and pathways such as inhibition of inflammation, inhibition of oxidative stress, and vasodilation. -
内生真菌经过长期进化与宿主植物形成互利共生的关系,植物可以为内生真菌提供生长所需的营养物质,内生真菌可以促进植物生长、协助对抗干旱与虫害等胁迫、产生结构新颖丰富的次生代谢物以及诱导植物次生代谢物积累[1]。植物内生真菌作为来源于药用植物的一种新兴微生物资源,在医药、农业和食品工业领域都展现出越来越广泛的应用前景[2]。
金线莲Anectochilus roxburhii为兰科金线兰属(Anectochilus)多年生草本植物,又名金线兰、金耳环、鸟人参等,在民间有“药王”、“金草”等美称,具有清热凉血、除湿解毒等功效,主产于我国南部如福建、台湾、浙江等地,富含多糖、内酯苷和黄酮及苷类等成分,具有抗炎、提高免疫力、保肝、抗肿降糖等生物活性[3, 4]。目前,有关金线莲内生菌的研究多聚焦于植株体内内生菌生物多样性[5]、促进宿主生长[6],以及提高宿主抗病性[7]等研究。对于金线莲内生菌次生代谢产物的研究相对有限[8, 9],从金线莲内生真菌次生代谢产物中发现结构新颖、具有显著药效活性的先导化合物具有较大潜能,有待进一步挖掘。
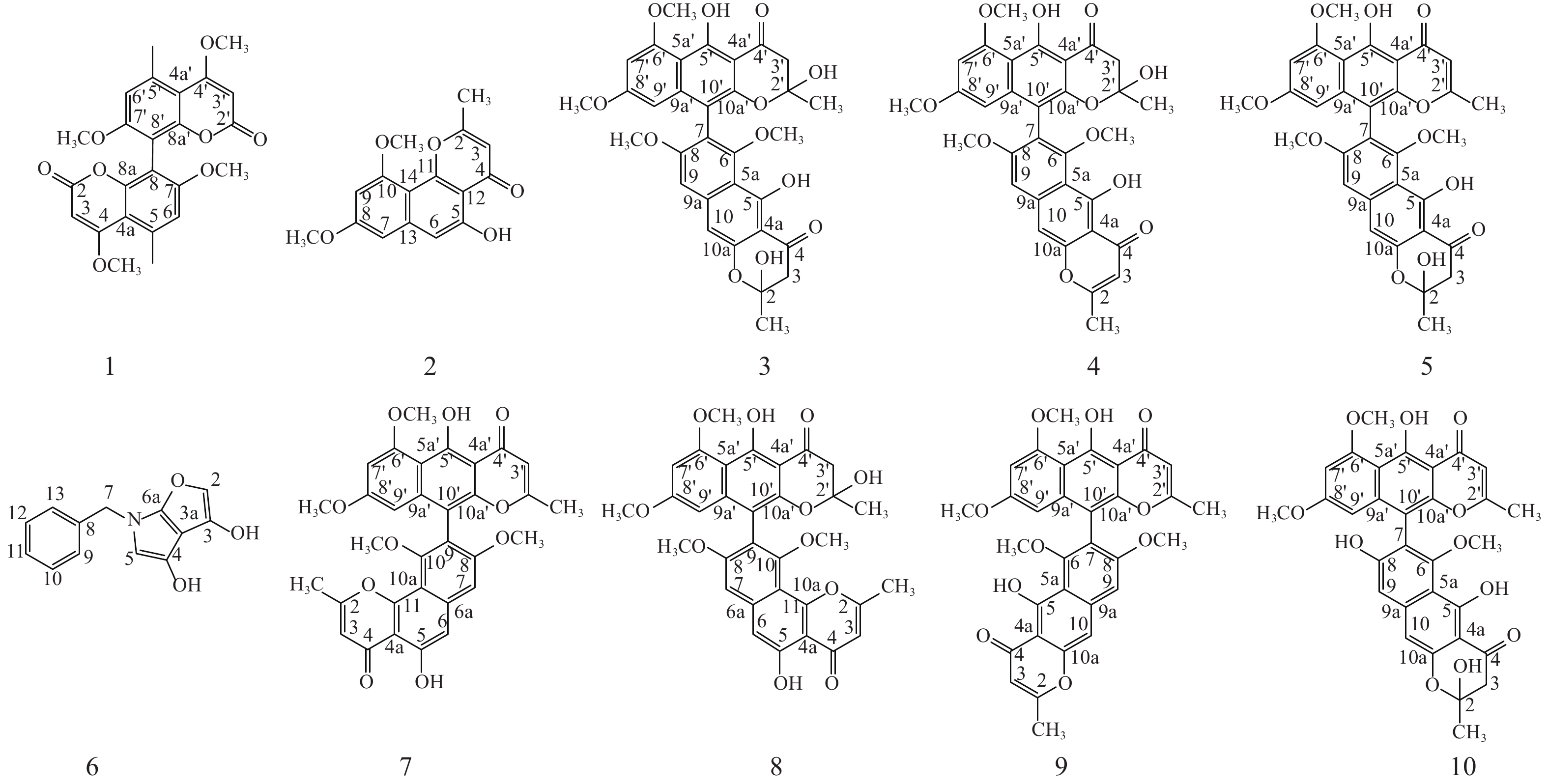
本研究选取从金线莲中分离得到的一株内生真菌株Aspergillus sp. J218,采用大米固体发酵法进行发酵,并从发酵产物的乙酸乙酯萃取物中分离纯化、鉴定得到10个化合物(图1)。所鉴定成分多为二聚萘并吡喃酮类化合物,提示该株内生真菌含有丰富的二聚化合成酶,对其生物合成潜能有进一步挖掘的价值。
1. 材料与方法
1.1 仪器与试剂
Agilent 1200 Series 半制备型液相色谱仪(美国Agilent公司);Eclipse XDB-C18 半制备色谱柱(250 mm×9.4 mm,5 μm;美国Agilent公司);Bruker Avance 600 MHz(德国Bruker公司);APEX7.0 FT-MS型质谱仪(德国Bruker公司);RE-52C旋转蒸发仪(上海沪西分析仪器厂有限公司);HWS-24型恒温水浴锅(上海一恒科学仪器有限公司);SHZ-DⅢ型循环水式真空泵(巩义予华仪器有限责任公司);Sephadex LH-20(美国Pharmacia公司);反相柱色谱硅胶12 nm S-50 μm (日本株式会社YMC);柱色谱硅胶(200~300 目)和 GF254 ( 100 mm × 100 mm) 硅胶板(青岛海洋化工厂);分析级乙醇、乙酸乙酯、甲醇、二氯甲烷(上海泰坦科技股份有限公司);色谱级甲醇、乙腈(上海泰坦科技股份有限公司);屈臣氏蒸馏水(广州屈臣氏食品饮料有限公司);发酵用水为去离子水;显色剂为香草醛-硫酸显色剂(12 g 香草醛,250 ml 乙醇,200 ml 浓硫酸,500 ml 蒸馏水)。
1.2 药材
本实验所用菌株为2020年从产自福建南靖的一株金线莲(Anectochilus roxburhii)中分离得到。采样植株经福建中医药大学吴岩斌副研究员鉴定为金线莲,内生真菌经形态学鉴定为曲霉菌属Aspergillus sp.,编号为J218,现保存于海军军医大学中药鉴定学教研室。
1.3 菌株发酵
将保存的金线莲内生真菌菌株Aspergillus sp. J218接种至经高压灭菌的PDA平板培养基上,于培养箱活化培养7 d,用灭菌的打孔器打孔取菌饼置于装有250 g大米培养基的1000 ml锥形瓶中,共40瓶,常温发酵30 d。
1.4 代谢产物提取与分离
发酵产物每瓶用500 ml 95%乙醇超声提取二次,每次45min, 过滤,减压浓缩至无醇味,将发酵提取物用石油醚(1∶1.5)脱脂2次,然后用乙酸乙酯(1∶2)萃取3次,合并乙酸乙酯部分萃取液,减压浓缩得到褐色浸膏24.7 g。将24.7 g浸膏由适量甲醇溶解,上样于Sephadex LH-20柱色谱,以80%甲醇进行洗脱,得到5个组分(Fr. 1~5)。
Fr.2析出淡黄色结晶,经300~400目硅胶色谱以二氯甲烷:甲醇(30∶1)洗脱得到化合物1(49.2 mg)。Fr.3部分经200目硅胶柱色谱,以二氯甲烷:甲醇(200∶1→7∶1)进行梯度洗脱,同时用TLC进行点板检测,合并得到5个组分Fr.3-1~3-5。Fr.3-4经300~400目硅胶色谱以二氯甲烷:甲醇(75∶1)洗脱得到化合物2(5 mg);Fr.3-5经Sephadex LH-20凝胶柱(80%甲醇洗脱)和300~400目硅胶色谱以石油醚:乙酸乙酯:甲醇(5∶10∶0.5)洗脱得到化合物3(22.6 mg);Fr.3-2 经200目硅胶柱色谱(二氯甲烷,二氯甲烷:甲醇=1000∶1→100∶1)得到5个亚组分Fr.3-2-1~3-2-5。Fr.3-2-5经300-400目硅胶色谱以二氯甲烷:甲醇(105∶1)洗脱得到化合物4(27.7 mg);Fr.3-2-4以65%甲醇-0.05%甲酸水为流动相,经Agilent 1200 Series 半制备型液相色谱,色谱柱为Eclipse XDB-C18,流速为2 ml/min,收集22 min馏分减压浓缩得到化合物5(49.3 mg);Fr.3-2-2经300-400目硅胶色谱以二氯甲烷:甲醇(135∶1)洗脱得到化合物6(10.7 mg)和化合物7(6.8 mg);Fr.3-2-2经300~400目硅胶色谱以二氯甲烷:甲醇(120∶1)洗脱得到化合物8(15.7 mg)和化合物9(11.5 mg)。Fr.4部分经200目硅胶柱色谱,以二氯甲烷:甲醇(800∶1→80∶1)进行梯度洗脱,得到化合物10(2.3 mg)。
2. 结果
化合物1:黄色粉末。分子式:C24H22O8, ESI-MS m/z: 439 [M+H]+。1H NMR (600 MHz, Chloroform-d) δH: 6.73 (s, 1H, H-6, 6′), 5.51 (s, 1H, H-3, 3′), 3.93 (s, 3H, 4,4′-OCH3), 3.80 (s, 3H, 5, 5′- OCH3), 2.70 (s, 3H, 7, 7′-CH3). 13C NMR (150 MHz, Chloroform-d) δC:169.88 (C-4, 4′), 163.12 (C-2, 2′), 159.57 (C-7, 7′), 153.49 (C-8a, 8a′), 138.52 (C-5, 5′), 111.43 (C-6, 6′), 108.45 (C-8, 8′), 107.47 (C-4a, 4a′), 87.72 (3, 3′-CH3), 56.11 (7, 7′- OCH3), 55.89 (4, 4′- OCH3), 24.06 (5, 5′-CH3) [10], 以上波谱数据与文献对照一致,确定化合物1为kotanin。
化合物2:黄色粉末。分子式:C16H14O5, ESI-MS m/z: 285 [M-H]−。1H NMR (600 MHz, Chloroform-d) δH: 12.81 (s, 1H, 5-OH), 6.88 (s, 1H, H-6), 6.60 (d, J = 2.2 Hz, 1H, H-7), 6.41 (d, J = 2.2 Hz, 1H, H-9), 6.29 (s, 1H, H-3), 3.99 (s, 3H, 10-OCH3), 3.94 (s, 3H, 8-OCH3), 2.51 (s, 3H, 2-CH3); 13C NMR (150 MHz, Chloroform-d) δC: 182.83 (C-4), 166.54 (C-2), 161.43 (C-8), 159.05 (C-10), 156.61 (C-5), 155.79 (C-11), 141.18 (C-13), 110.21 (C-3), 108.84 (C-14), 105.77 (C-6), 104.88 (C-12), 97.93 (C-7), 96.98 (C-9), 55.85 (10- OCH3), 55.44 (8- OCH3), 20.46 (2-CH3) [11], 以上波谱数据与文献对照一致,确定化合物2为flavasperone。
化合物3:黄色粉末。分子式:C32H30O12, ESI-MS m/z: 607 [M+H]+。1H NMR (600 MHz, Chloroform-d) δH: 14.53 (s, 1H, 5′-OH), 14.17 (s, 1H, 5-OH), 6.88~6.78 (m, 1H, H-9), 6.69 (d, J = 17.8 Hz, 1H, , H-10), 6.37 (d, J = 2.2 Hz, 1H, H-7′), 6.13 (dd, J = 8.5, 2.3 Hz, 1H, H-9′), 4.00 (s, 3H, 6′-OCH3), 3.79 (d, J = 9.8 Hz, 3H, 8-OCH3), 3.68~3.61 (m, 3H, 8′-OCH3), 3.38 (d, J = 3.1 Hz, 3H, 6-OCH3), 3.07~2.99 (m, 2H, 3-H2), 2.98~2.87 (m, 2H, 3′-H2), 1.79 (d, J = 6.0 Hz, 3H, 2-CH3), 1.48 (d, J = 3.8 Hz, 3H, 2′-CH3); 13C NMR (150 MHz, Chloroform-d) δC: 197.60 (C-4′), 196.89 (C-4), 164.85 (C-8′), 163.81 (C-8), 162.15 (C-6′), 161.81 (C-6), 161.01 (C-5′), 158.18 (C-5), 153.19 (C-10a), 151.34 (C-10a′), 142.66 (C-9a), 142.39 (C-9a′), 117.81 (C-7), 110.55 (C-5a), 107.73 (C-5a′), 106.44 (C-10′), 103.79 (C-4a), 103.58 (C-4a′), 102.77 (C-9), 102.24 (C-10), 100.21 (C-2), 100.11 (C-2′), 97.37 (C-7′), 96.21 (C-9′), 61.58 (C-6), 56.17 (C-6′), 55.89 (C-8), 55.16 (C-8′), 47.33 (C-3), 46.92 (C-3′), 29.24 (2′-CH3), 28.69 (2-CH3) [12, 13], 以上波谱数据与文献对照一致,确定化合物3为aurasperone B。
化合物4:微黄色粉末。分子式:C32H28O11, ESI-MS m/z: 587 [M-H]−。1H NMR (600 MHz, Chloroform-d) δH: 14.77 (s, 1H, 5-OH), 14.52 (s, 1H, 5′-OH), 7.12 (s, 1H, H-10), 6.97 (s, 1H, H-9), 6.36 (d, J = 2.2 Hz, 1H, H-7′), 6.13 (d, J = 2.3 Hz, 1H, H-9′), 6.04 (s, 1H, H-3), 4.00 (s, 3H, 6′-OCH3), 3.82 (s, 3H, 8-OCH3), 3.64 (s, 3H, 8′-OCH3), 3.42 (s, 3H, 6-OCH3), 2.92 (d, J = 8.7 Hz, 2H, 3′-H2), 2.40 (s, 3H, 2-CH3), 1.48 (s, 3H, 2′-CH3); 13C NMR (150 MHz, Chloroform-d) δC: 197.49 (C-4′), 184.46 (C-4), 167.68 (C-2), 164.96 (C-8′), 162.18 (C-8), 161.89 (C-6′), 161.86 (C-6), 160.22 (C-5), 157.40 (C-5′), 153.18 (C-10a), 151.30 (C-10a′), 142.62 (C-9a), 140.21 (C-9a′), 118.64 (C-7), 111.39 (C-5a), 107.83 (C-5a′), 107.36 (C-3), 106.62 (C-10′), 104.72 (C-4a), 103.84 (C-4a′), 101.75 (C-9), 101.18 (C-10), 100.23 (C-2′), 97.44 (C-7′), 96.23 (C-9′), 61.78 (6-OCH3), 56.19 (6′-OCH3), 55.90 (8-OCH3), 55.15 (8′-OCH3), 46.88 (C-3′), 28.86 (2′-CH3), 20.74 (2-CH3) [14, 15], 以上波谱数据与文献对照一致,确定化合物4为fonsecinone B。
化合物5:淡黄色粉末。分子式:C32H28O11, ESI-MS m/z: 589 [M+H]+。 1H NMR (600 MHz, Chloroform-d) δH: 14.94 (brs, 1H), 14.17 (d, J = 4.3 Hz, 1H), 7.00 (s, 1H, H-10), 6.86 (d, J = 3.7 Hz, 1H, H-9), 6.73 (d, J = 3.3 Hz, 1H, H-7′), 6.43 (d, J = 2.2 Hz, 1H, H-9′), 6.24 (d, J = 2.3 Hz, 1H, H-3′), 6.00 (t, J = 15.3 Hz, 1H, 2-OH), 4.04 (s, 3H, 6′-OCH3), 3.78 (s, 3H, 8-OCH3), 3.65 (d, J = 1.4 Hz, 3H, 8′-OCH3), 3.44 (s, 3H, 6-OCH3), 3.13~2.94 (m, 2H, 3-H2), 2.21~2.10 (m, 3H, 2′-CH3), 1.82 (s, 3H, 2-CH3); 13C NMR (150 MHz, Chloroform-d) δC: 196.59 (C-4), 184.58 (C-4′), 167.56 (C-2′), 164.06 (C-8), 162.63 (C-8′), 161.43 (C-6′), 161.04 (C-6), 160.96 (C-5), 159.43 (C-5′), 153.32 (C-10a′), 150.80 (C-10a), 142.74 (C-9a), 140.71 (C-9a′), 116.80 (C-7), 110.70 (C-5a′), 108.57 (C-5a), 107.20 (C-3′), 105.17 (C-10), 104.25 (C-4a′), 103.51 (C-4a), 102.67 (C-9), 101.85 (C-10′), 100.12 (C-2), 96.96 (C-7′), 96.49 (C-9′), 61.87 (6′-OCH3), 56.19 (6-OCH3), 55.91 (8′-OCH3), 55.18 (8-OCH3), 47.35 (C-3), 28.68 (2-CH3), 20.68 (2′-CH3) [12, 14], 以上波谱数据与文献对照一致,确定化合物5为fonsecinone D。
化合物6:黄色粉末。分子式:C13H11NO3, ESI-MS m/z: 230 [M+H]+。1H NMR (600 MHz, Chloroform-d) δH: 9.11 (s, 1H, 4-OH), 8.75 (s, 1H, H-2), 7.42~7.37 (m, 2H, H-9, 13), 7.37~7.31 (m, 1H, H-11), 7.26 (dt, J = 6.2, 1.4 Hz, 2H, H-10, 12), 6.27 (s, 1H, H-5), 6.03 (s, 1H, 3-OH), 3.91 (s, 2H, 7-H2); 13C NMR (150 MHz, Chloroform-d) δC: 178.08 (C-3), 168.85 (C-6a), 164.15 (C-4), 162.07 (C-2), 133.79 (C-8), 129.12 (C-9,13), 127.83 (C-10,12), 119.26 (C-3a), 116.06 (C-5), 39.60 (C-7) [16], 以上波谱数据与文献对照一致,确定化合物6为tensidol A。
化合物7:黄色粉末。分子式:C32H26O10, ESI-MS m/z: 571 [M+H]+。1H NMR (600 MHz, Chloroform-d) δH: 15.22 (brs, 1H,5′-OH), 12.81 (brs, 1H, 5-OH), 7.08 (s, 1H, H-6), 7.00 (s, 1H, H-7), 6.46 (d, J = 2.1 Hz, 1H, H-7′), 6.37 (s, 1H, H-3), 6.22 (d, J = 2.1 Hz, 1H, H-9′), 6.04 (s, 1H, H-3′), 4.06 (s, 3H, 6′-OCH3), 3.81 (s, 3H, 8-OCH3), 3.65 (s, 3H, 8′-OCH3), 3.46 (s, 3H, 10-OCH3), 2.52 (s, 3H, 2-CH3), 2.15 (s, 3H, 2′-CH3); 13C NMR (151 MHz, Chloroform-d) δC: 184.59 (C-4′), 183.01 (C-4), 167.48 (C-2), 166.87 (C-2′), 162.83 (C-5′), 161.61 (C-8′), 161.16 (C-6′), 160.07 (C-8), 156.96 (C-10), 156.69 (C-5), 155.15 (C-11), 150.86 (C-10a′), 140.82 (C-6a), 140.67 (C-9a′), 117.16 (C-9), 110.68 (C-3), 108.65(C-5a′), 108.01 (C-10a), 107.37 (C-3′), 106.07 (C-6), 105.05 (C-10′), 104.28 (C-4a′), 101.57 (C-7), 97.03(C-7′), 96.36 (C-9′), 61.21 (10-OCH3), 56.23 (6′-OCH3), 55.98 (8-OCH3), 55.18 (8′-OCH3), 20.67 (2′-CH3), 20.55 (2-CH3) [15, 17], 以上波谱数据与文献对照一致,确定化合物7为fonsecinone A。
化合物8:黄色粉末。分子式:C32H28O11, ESI-MS m/z: 588 [M+H]+。1H NMR (600 MHz, Chloroform-d) δH: 14.55 (s, 1H, 5′-OH), 12.79 (s, 1H, 5-OH), 7.07 (s, 1H, H-7), 7.02 (s, 1H, H-6), 6.41 (d, J = 2.2 Hz, 1H, H-7′), 6.37~6.35 (m, 1H, H-3), 6.17 (d, J = 2.2 Hz, 1H, H-9′), 4.04 (s, 3H, 6′-OCH3), 3.86 (s, 3H, 8-OCH3), 3.67 (s, 3H, 8′-OCH3), 3.42 (s, 3H, 6-OCH3), 2.97 (d, J = 18.4 Hz, 2H, 3′-H2), 2.51 (s, 3H, 2-CH3), 1.49 (s, 3H, 2′-CH3); 13C NMR (150 MHz, Chloroform-d) δC: 197.18 (C-4′),182.70 (C-4), 166.66 (C-2), 165.11 (C-8′), 162.45 (C-8), 161.91 (C-6′), 160.06 (C-10), 156.55 (C-5), 155.61 (C-5′), 154.98 (C-11), 151.13 (C-10a′), 142.53 (C-6a), 140.45 (C-9a′), 118.17 (C-9), 110.74 (C-10′), 109.4 (C-10a), 107.93 (C-5a′), 107.90 (C-3), 106.58 (C-10), 106.05 (C-4a), 103.71 (C-4a′), 102.01 (C-6), 100.22 (C-2′), 97.31 (C-7′), 96.49 (C-9′), 61.13 (10-OCH3), 56.20 (6′-OCH3), 55.98 (8-OCH3), 55.21 (8′-OCH3), 46.65 (C-3′), 29.16 (2′-CH3), 20.51 (2-CH3) [15], 以上波谱数据与文献对照一致,确定化合物8为fonsecinone C。
化合物9:黄色粉末。分子式:C32H26O10, ESI-MS m/z: 571 [M+H]+。1H NMR (600 MHz, Chloroform-d) δH: 15.20 (s, 1H, 5′-OH), 14.79 (s, 1H, 5-OH), 7.11 (s, 1H, H-10), 6.93 (s, 1H, H-9), 6.37 (d, J = 2.2 Hz, 1H, H-7′), 6.17 (d, J = 2.2 Hz, 1H, H-9′), 6.01 (d, J = 0.8 Hz, 1H, H-3), 5.94 (d, J = 0.8 Hz, 1H, H-3′), 3.98 (s, 3H, 6′-OCH3), 3.74 (s, 3H, 8-OCH3), 3.58 (s, 3H, 8′-OCH3), 3.42 (s, 3H, 6-OCH3), 2.37 (d, J = 0.7 Hz, 3H, 2-CH3), 2.07 (d, J = 0.7 Hz, 3H, 2′-CH3); 13C NMR (150 MHz, Chloroform-d) δC: 184.60 (C-4′), 184.43 (C-4), 167.62 (C-2), 167.54 (C-2′), 162.72 (C-5′), 162.01 (C-5), 161.41 (C-8′), 161.07(C-6′), 160.20 (C-8), 158.61 (C-6), 153.37 (C-10a), 150.84 (C-10a′), 140.70 (C-9a), 140.55 (C-9a′), 117.63 (C-7), 111.45 (C-5a), 108.59 (C-5a′), 107.44 (C-3), 107.26 (C-3′), 105.17 (C-10′), 104.73 (C-4a), 104.27 (C-4a′), 101.35 (C-9), 101.21 (C-10), 96.88 (C-7′), 96.53 (C-9′), 62.01 (6-OCH3), 56.21 (6′-OCH3), 55.91 (8-OCH3), 55.13 (8′-OCH3), 20.75 (2-CH3), 20.68 (2′-CH3) [11, 17], 以上波谱数据与文献对照一致,确定化合物9为aurasperone A。
化合物10:黄色粉末。分子式:C31H26O11, ESI-MS m/z: 575 [M+H]+。1H NMR (600 MHz, Chloroform-d) δH: 15.11 (s, 1H, 5′-OH), 14.28 (s, 1H, 5-OH), 7.05 (s, 1H, H-9), 6.68 (d, J = 2.4, 1H, H-7′), 6.28 (d, J = 2.4, 1H, H-9′), 5.95 (s, 1H, H-10), 5.91 (s, 1H, H-3′), 3.86 (s, 3H, 6′-OCH3), 3.69 (s, 3H, 8′-OCH3), 3.42 (s, 3H, 6-OCH3), 3.00 (dd, J = 16.9, 3.8 Hz, 2H, 3-H2), 2.14 (s, 3H, 2′-CH3), 1.28 (s, 3H, 2-CH3); 13C NMR (150 MHz, Chloroform-d) δC: 196.48 (C-4), 184.14 (C-4′), 168.21 (C-2′), 164.48 (C-5), 163.38 (C-5′), 162.22 (C-8′), 160.92 (C-6′), 159.81 (C-8), 157.63 (C-6), 152.99 (C-10a), 151.98 (C-10a′), 142.79 (C-9a), 140.72 (C-9a′), 115.05 (C-7), 110.59 (C-5a), 108.45 (C-5a′), 107.32 (C-3′), 106.50 (C-9), 106.48 (C-10′), 104.14 (C-4a′), 103.30 (C-4a), 102.31 (C-10), 100.02 (C-2), 97.21 (C-9′), 95.94 (C-7′), 62.03 (6-OCH3), 55.86 (6′-OCH3), 55.31 (8′-OCH3), 47.19 (C-3), 28.80 (2-CH3), 20.72 (2′-CH3) [18], 以上波谱数据与文献对照一致,确定化合物10为aurasperone F。
3. 讨论
本研究选取从金线莲植株中分离得到的一株内生真菌Aspergillus sp. J218为研究对象,从其大米固体发酵产物中共分离鉴定出10个化合物。其中化合物3、4、5、7、8、9、10均为二聚萘并吡喃酮类化合物,化合物1为香豆素类化合物二聚体。据报道,萘并吡喃酮类化合物的单体及二聚体类广泛分布于曲霉属和镰刀属真菌的次级代谢产物中,二聚萘并吡喃酮类化合物对多种致病菌,如绿脓杆菌、克鲁斯假丝酵母、幽门螺杆菌等,有中等抑菌活性[19],对多种癌细胞如MDA-MB-231、PANC-1、A549等表现出一定抑制活性[20-21]。研究表明,化合物7和9对幽门螺杆菌具有中等抑制活性[22];化合物8对 A549、HL-60 和 MGC-803细胞具有不用程度抑制作用[23];化合物6能够增强咪康唑对白色念珠菌的抑制活性[24];化合物1对枯草芽孢杆菌和尖孢镰刀菌具有一定的抑制作用[25]。由此可见,从Aspergillus sp. J218中分离鉴定的多数化合物对病原微生物具有一定的抑制作用,提示该菌株在提升宿主植物抗病性方面具有潜在的应用价值;所鉴定化学结构类型提示该菌株含有丰富的二聚化合成酶,但相关研究较少。Frandsen等推测二聚萘并吡喃酮类化合物是由乙酰辅酶A和丙二酰辅酶A分子经过一系列缩合、甲基化和氧化还原反应形成萘并吡喃酮单体,再由一种假定的漆酶Gip1将单体羟基上一个电子移除,然后通过电子重排形成碳活化单体,自身或相互偶联形成二聚体[26];徐丹等[27]发现二聚萘并吡喃酮化合物ustilaginoidins中C-2和C-3双键的还原是由一种磷脂甲基转移酶(UsgR)催化形成,这种还原酶对线性萘并-γ-吡喃酮单体的还原具有特异性,但对二聚体则无特异性,而漆酶(UsgL)对各种单体的阻转异构选择性偶联导致了ustilaginoidins系列衍生物的结构多样性。上述研究为该菌株后续探索该类芳香族聚酮化合物二聚化的生物合成途径提供了一条线索。
-
表 1 丹参白术方的主要共有活性成分与核心蛋白的分子对接结果
活性成分 核心靶点 PDB ID 对接分数(kcal/mol) 槲皮素 AKT1 3O96 −10.332 β-甾谷醇 AKT1 3O96 −6.755 槲皮素 ALB 4LB2 −8.049 β-甾谷醇 ALB 4LB2 −7.358 -
[1] 《心肺血管病杂志》编辑部. 中国心血管健康与疾病报告2019[J]. 心肺血管病杂志, 2020, 39(9):1145-1156. doi: 10.3969/j.issn.1007-5062.2020.09.028 [2] 胡盛寿, 高润霖, 刘力生, 等. 《中国心血管病报告2018》概要[J]. 中国循环杂志, 2019, 34(3):209-220. doi: 10.3969/j.issn.1000-3614.2019.03.001 [3] 王维治. 神经病学[M]. 2版. 北京: 人民卫生出版社, 2013: 1787. [4] JIA L F, DU Y F, CHU L, et al. Prevalence, risk factors, and management of dementia and mild cognitive impairment in adults aged 60 years or older in China: a cross-sectional study[J]. Lancet Public Health, 2020, 5(12):e661-e671. doi: 10.1016/S2468-2667(20)30185-7 [5] UNCANIN S, DZEMIDZIC J, SERDAREVIC N, et al. Idiopathic membranous nephropathy and treatment related complications[J]. Med Arch, 2020, 74(3):228-232. doi: 10.5455/medarh.2020.74.228-232 [6] 蒋恬, 胡镜清, 陈党红. “痰瘀互结”的3个致病特征[J]. 中华中医药杂志, 2022, 37(11):6376-6379. [7] 胡镜清, 韩晶岩. 痰瘀互结: 基础与临床[M]. 上海: 上海科学技术出版社, 2023. [8] RU J L, LI P, WANG J N, et al. TCMSP: a database of systems pharmacology for drug discovery from herbal medicines[J]. J Cheminform, 2014, 6:13. doi: 10.1186/1758-2946-6-13 [9] WANG Y L, BRYANT S H, CHENG T J, et al. PubChem BioAssay: 2017 update[J]. Nucleic Acids Res, 2017, 45(D1):D955-D963. doi: 10.1093/nar/gkw1118 [10] LIU H, WANG J N, ZHOU W, et al. Systems approaches and polypharmacology for drug discovery from herbal medicines: an example using licorice[J]. J Ethnopharmacol, 2013, 146(3):773-793. doi: 10.1016/j.jep.2013.02.004 [11] LIU X F, OUYANG S S, YU B, et al. PharmMapper server: a web server for potential drug target identification using pharmacophore mapping approach[J]. Nucleic Acids Res, 2010, 38(Web Server issue): W609-W614. [12] WANG X, PAN C X, GONG J Y, et al. Enhancing the enrichment of pharmacophore-based target prediction for the polypharmacological profiles of drugs[J]. J Chem Inf Model, 2016, 56(6):1175-1183. doi: 10.1021/acs.jcim.5b00690 [13] WANG X, SHEN Y H, WANG S W, et al. PharmMapper 2017 update: a web server for potential drug target identification with a comprehensive target pharmacophore database[J]. Nucleic Acids Res, 2017, 45(W1):W356-W360. doi: 10.1093/nar/gkx374 [14] CONSORTIUM U. UniProt: a hub for protein information[J]. Nucleic Acids Res, 2015, 43(Database issue): D204-D212. [15] REBHAN M, CHALIFA-CASPI V, PRILUSKY J, et al. GeneCards: integrating information about genes, proteins and diseases[J]. Trends Genet, 1997, 13(4):163. doi: 10.1016/S0168-9525(97)01103-7 [16] AMBERGER J S, BOCCHINI C A, SCHIETTECATTE F, et al. OMIM. org: online Mendelian Inheritance in Man(OMIM®), an online catalog of human genes and genetic disorders[J]. Nucleic Acids Res, 2015, 43(D1):D789-D798. doi: 10.1093/nar/gku1205 [17] WISHART D S, FEUNANG Y D, GUO A C, et al. DrugBank 5.0: a major update to the DrugBank database for 2018[J]. Nucleic Acids Res, 2018, 46(D1):D1074-D1082. doi: 10.1093/nar/gkx1037 [18] SZKLARCZYK D, GABLE A L, NASTOU K C, et al. The STRING database in 2021: customizable protein-protein networks, and functional characterization of user-uploaded gene/measurement sets[J]. Nucleic Acids Res, 2021, 49(D1):D605-D612. doi: 10.1093/nar/gkaa1074 [19] LIANG B, LI C N, ZHAO J Y. Identification of key pathways and genes in colorectal cancer using bioinformatics analysis[J]. Med Oncol, 2016, 33(10):111. doi: 10.1007/s12032-016-0829-6 [20] ZHOU Y Y, ZHOU B, PACHE L, et al. Metascape provides a biologist-oriented resource for the analysis of systems-level datasets[J]. Nat Commun, 2019, 10(1):1523. doi: 10.1038/s41467-019-09234-6 [21] HAN J Y, LI Q, MA Z Z, et al. Effects and mechanisms of compound Chinese medicine and major ingredients on microcirculatory dysfunction and organ injury induced by ischemia/reperfusion[J]. Pharmacol Ther, 2017, 177:146-173. doi: 10.1016/j.pharmthera.2017.03.005 [22] GARCIA-MARTINEZ R, CARACENI P, BERNARDI M, et al. Albumin: pathophysiologic basis of its role in the treatment of cirrhosis and its complications[J]. Hepatology, 2013, 58(5):1836-1846. doi: 10.1002/hep.26338 [23] ARQUES S. Human serum albumin in cardiovascular diseases[J]. Eur J Intern Med, 2018, 52:8-12. doi: 10.1016/j.ejim.2018.04.014 [24] VIRDIS A, DELL’AGNELLO U, TADDEI S. Impact of inflammation on vascular disease in hypertension[J]. Maturitas, 2014, 78(3):179-183. doi: 10.1016/j.maturitas.2014.04.012 [25] HOT A, LENIEF V, MIOSSEC P. Combination of IL-17 and TNFα induces a pro-inflammatory, pro-coagulant and pro-thrombotic phenotype in human endothelial cells[J]. Ann Rheum Dis, 2012, 71(5):768-776. doi: 10.1136/annrheumdis-2011-200468 [26] CHEN Y L, WU X M, YU S S, et al. Neuroprotective capabilities of Tanshinone IIA against cerebral ischemia/reperfusion injury via anti-apoptotic pathway in rats[J]. Biol Pharm Bull, 2012, 35(2):164-170. doi: 10.1248/bpb.35.164 [27] SUN S K, YIN Y, YIN X, et al. Anti-nociceptive effects of Tanshinone IIA(TIIA)in a rat model of complete Freund’s adjuvant(CFA)-induced inflammatory pain[J]. Brain Res Bull, 2012, 88(6):581-588. doi: 10.1016/j.brainresbull.2012.06.002 [28] 于倩, 巫冠中. 木犀草素抗炎机制的研究进展[J]. 药学研究, 2019, 38(2):108-111,119. [29] LIN H Y H, CHEN Y, CHEN Y H, et al. Tubular mitochondrial AKT1 is activated during ischemia reperfusion injury and has a critical role in predisposition to chronic kidney disease[J]. Kidney Int, 2021, 99(4):870-884. doi: 10.1016/j.kint.2020.10.038 [30] BRAILE M, MARCELLA S, CRISTINZIANO L, et al. VEGF-A in cardiomyocytes and heart diseases[J]. Int J Mol Sci, 2020, 21(15):5294. doi: 10.3390/ijms21155294 [31] CARRANZA K, VERON D, CERCADO A, et al. Cellular and molecular aspects of diabetic nephropathy; the role of VEGF-A[J]. Nefrologia, 2015, 35(2):131-138. doi: 10.1016/j.nefro.2015.05.013 [32] 孙霁寒. 木犀草素对高脂血症SD大鼠的降脂作用及初步机制研究[C] //营养研究与临床实践——第十四届全国营养科学大会暨第十一届亚太临床营养大会、第二届全球华人营养科学家大会. -





 下载:
下载:
 下载:
下载: