-
黑豆是由豆科植物大豆[Glycine max (Linn.) Merr.]的成熟种子,淡豆豉是由黑豆经发酵后加工而成[1]。淡豆豉性味苦且辛凉,具有解表、除烦和清解郁热的功效,可用于治疗头痛感冒、胸闷烦躁、失眠等症状。淡豆豉中含有异黄酮、多糖、氨基酸、蛋白、皂苷、纤溶酶等成分,其中异黄酮类被广泛认为是主要活性成分之一。研究发现,淡豆豉还具有抗细菌、降低血糖、调节肠道菌群及抗癌等药理活性[2-6]。
本课题组按照前期优化的发酵工艺自制淡豆豉,并建立通过高效液相色谱对淡豆豉中6种异黄酮进行含量测定的方法[7-8]。依据建立的分析方法对发酵前的黑豆、发酵后的半成品和成品淡豆豉中6种异黄酮的含量进行检测,比较黑豆发酵前后和不同程度发酵条件下淡豆豉中6种异黄酮的含量变化,为进一步完善淡豆豉的发酵工艺和深入研究淡豆豉中异黄酮类化合物的药理活性奠定研究基础。
-
SHIMAZULC-20ADXR高效液相色谱仪(日本岛津制作所);KQ-800DE数控超声波清洗器(昆山市超声仪器有限公司);Sartorius SQP型电子天平(北京赛多利斯科学仪器有限公司);YF103-200G高速中药粉碎机(瑞安市永历制药机械有限公司);DHG9420电热鼓风干燥箱(上海一恒科学仪器有限公司);AnkeTDL-2B台式低速离心机(济南存昌生物技术有限公司);Hitech Smart-S15纯水仪(上海和泰仪器有限公司)。
-
大豆苷对照品(批号AZ21091701)、黄豆黄苷对照品(批号AZ22052701) 、染料木苷对照品(批号AZ21090901)、大豆苷元对照品(批号AZ21102201)、黄豆黄素对照品(批号AZ22061011) 、染料木素对照(批号AZ21101501),均购于成都埃法生物科技有限公司;甲醇和冰醋酸为色谱纯(默克股份两合公司,德国);黑豆购买于安徽亳州神农谷药材商品交易中心,经海军军医大学药学系辛海量教授鉴定为豆科植物大豆的成熟种子;淡豆豉为本实验室发酵而成。
-
根据《中国药典》中淡豆豉的制作标准[1],按质量比1∶1∶10称量青蒿、桑叶和黑豆,用量筒量取青蒿桑叶总质量的8倍水,将青蒿、桑叶倒入圆底烧瓶中,加入量好的水,冷凝回流煎煮1 h,将煎煮好的中药用尼龙纱布过滤,药渣放入托盘中,滤液倒入烧杯中。将处理后的黑豆放入滤液中,浸泡16 h。取出黑豆,放入蒸煮锅蒸煮1 h。晾约1 h至黑豆表面基本干燥,之后放入烧杯中,将一定量的半干半湿的青蒿桑叶置于黑豆上层,覆盖1.5 cm,置于35 ℃、湿度50%的恒温培养箱中发酵,6天后取出一半,做为半成品淡豆豉样品。剩余一半清洗稍晾后继续放入烧杯中,上层覆盖干燥的混匀后的青蒿、桑叶,置于35 ℃、湿度50%的恒温培养箱继续发酵15天,即为成品淡豆豉样品。
-
精密称取对照品大豆苷10.93 mg、黄豆黄苷10.18 mg、染料木苷10.84 mg、大豆苷元5.09 mg、黄豆黄素5.19 mg和染料木素8.95 mg,分别加入甲醇超声溶解,于10 ml容量瓶内定容,制成浓度分别为1093 μg/ml、1018 μg/ml、1084 μg/ml、509 μg/ml、519 μg/ml和895 μg/ml的单一对照品储备液,再分别精密量取6种异黄酮对照品储备液适量,用甲醇稀释,配制成一系列浓度的混合对照品溶液[9-10]。
-
将黑豆及自制淡豆豉样品60 ℃干燥,粉碎,过四号筛。取样品粉末约0.5 g,精密称定,置具塞锥形瓶中,精密加入10 ml色谱甲醇,混匀,超声处理2 h,放冷,再次称重,甲醇补足减失重,摇匀,进样前用 0.45 μm 滤膜滤过,取续滤液,得供试品溶液。
-
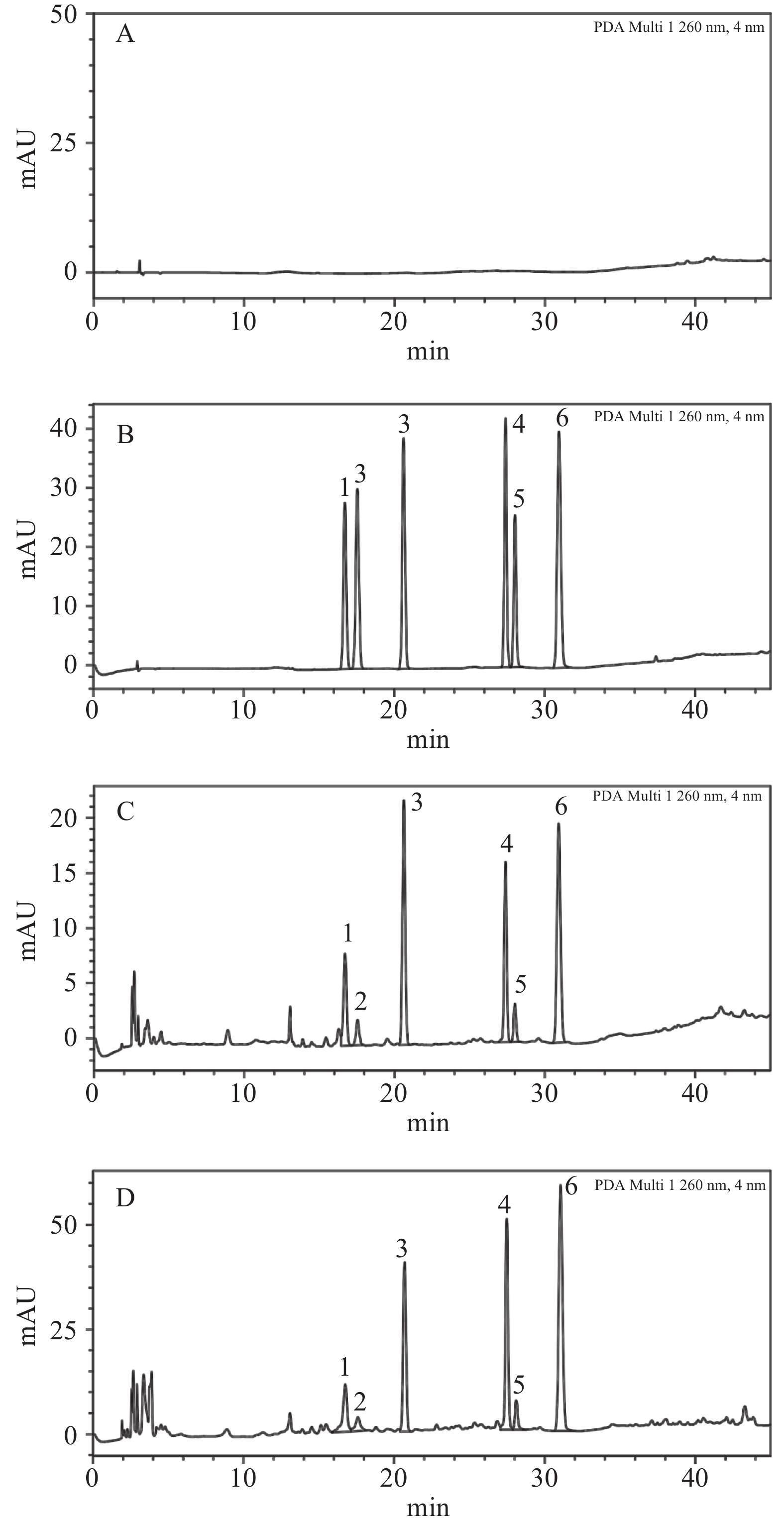
色谱柱:DiamonsilC18(4.6×250 mm,5 μm);流动相为0.2%醋酸水(A)-甲醇(B),梯度洗脱(0~6 min,20%B;6~7 min,20%~40%B;7~12 min,40%B;12~22 min,40%~60%B;22~27 min,60%B;27~35 min,60%~90%B;35~40 min,90%B;40~41 min,90%~20%B;41~45 min,20%B),流速:1.0 ml/min;柱温:30 ℃;检测波长:260 nm;进样量:10 μl。空白溶剂、对照品、黑豆和淡豆豉样品色谱峰如图1所示。大豆苷、黄豆黄苷、染料木苷、大豆苷元、黄豆黄素和染料木素的保留时间依次为16.72 min、17.56 min、20.63 min、27.40 min、28.03 min和30.95 min。
-
分别精密量取“2.1”项下对照品储备液溶液适量,置同一10ml容量瓶中,加50%甲醇至刻度,即得大豆苷54.65 μg/ml、黄豆黄苷50.90 μg/ml、染料木苷54.20 μg/ml、大豆苷元50.90 μg/ml、黄豆黄素51.90 μg/ml和染料木素44.75 μg/ml混合对照品溶液。取混合对照品溶液加50%甲醇进行逐级稀释,制成系列浓度的混合对照品溶液,进样分析。将信噪比大于且接近于10的对照品溶液浓度作为定量限(LOQ),对于高于定量限的系列浓度的混合对照品溶液,以峰面积(Y)为纵坐标、浓度(X)为横坐标,进行线性回归,得到大豆苷、黄豆黄苷、染料木苷、大豆苷元、黄豆黄素和染料木素的标准曲线,结果见表1。结果显示 6 种化学成分在相应浓度范围内呈现良好线性关系。
表 1 6种异黄酮标准曲线试验结果
成分 回归方程 线性范围
(μg/ml)r LOQ
(μg/ml)大豆苷 Y=36742X-10999 1.093~54.65 0.9999 0.1093 黄豆黄苷 Y=46941X-14743 1.018~50.90 0.9999 0.1018 染料木苷 Y=49764X-18948 1.084~54.20 0.9999 0.1084 大豆苷元 Y=49161X-14614 1.018~50.90 0.9999 0.1018 黄豆黄素 Y=32743X-8632.1 1.038~51.90 0.9993 0.1038 染料木素 Y=80493X-27200 0.895~44.75 0.9999 0.0895 -
取浓度分别为低、中、高的对照品溶液,在同一天内连续重复进样3次,以峰面积计算3次结果的RSD值。低浓度对照品中大豆苷、黄豆黄苷、染料木苷、大豆苷元、黄豆黄素和染料木素峰面积结果的RSD值分别为1.83%、0.39%、1.56%、1.45%、2.89%和0.59%;中浓度对照品中6种异黄酮成分峰面积结果的RSD值分别为0.08%、0.05%、0.05%、0.01%、0.41%和0.07%;高浓度对照品中6种异黄酮成分面积结果的RSD值分别为0.48%、0.42%、0.38%、0.44%、1.10%和0.59%。结果表明,此方法的日内精密度良好。
取浓度分别为低、中、高的对照品溶液,连续3天进样检测,以峰面积计算3次结果的RSD值。低浓度对照品中6种异黄酮成分峰面积结果的RSD值分别为0.13%、3.72%、3.52%、2.33%、2.15%和1.18%;中浓度对照品中6种异黄酮成分峰面积结果的RSD值分别为2.46%、2.61%、2.58%、2.28%、1.06%和1.81%;高浓度对照品中6种异黄酮成分面积结果的RSD值分别为3.44%、3.62%、3.70%、3.37%、3.08%和2.98%。结果表明,此方法的日间精密度良好。
-
取同一批自制淡豆豉按上述条件制备 6 份供试品溶液,按“2.3”项下色谱条件进样测定, 6种异黄酮大豆苷、黄豆黄苷、染料木苷、大豆苷元、黄豆黄素和染料木素的平均含量分别为124.2 μg/g、37.11 μg/g、252.5 μg/g、273.4 μg/g、58.65 μg/g、283.3 μg/g,并计算含量的RSD值分别为1.89%、1.79%、2.50%、2.04%、2.51%、2.67%,结果表明该方法的重复性良好。
-
取同一批自制淡豆豉的供试品溶液,按“2.3”项下色谱条件,在制备后0 h、2 h、4 h、6 h、8 h进样测定。测定6种异黄酮的峰面积,计算6种异黄酮峰面积的RSD 值,结果分别为1.93%、2.43%、0.94%、0.88%、1.01%和0.89%,结果表明供试品溶液在室温下放置8h的稳定性良好。
-
取重复性试验同批次淡豆豉粉末约0.5 g,精密称定,平行6份,分别置于具塞锥形瓶中,每份分别精密加入近似等量的 6种对照品溶液,精密加入色谱甲醇至10 ml,混匀,超声处理2h,放冷,再次称重,甲醇补足减失重,摇匀,进样前用0.45 μm滤膜滤过,取续滤液,得加样回收供试品溶液。按上述色谱条件测定各成分的峰面积,计算各个化合物的回收率和回收率的RSD值,结果见表2。结果表明该方法回收率良好。
表 2 加样回收率试验结果
成分 药材粉末称量(g) 原有量(μg) 加入量(μg) 测得量(μg) 回收率(%) 平均回收率(%) RSD(%) 大豆苷 0.4923
0.4956
0.5001
0.4927
0.5004
0.501263.16
63.58
64.16
63.21
64.20
64.3064.78
64.78
64.78
64.78
64.78
64.78121.5
123.7
123.2
121.5
123.9
124.490.11
92.79
91.20
90.05
92.21
92.7091.51 1.36 黄豆黄苷 0.4923
0.4956
0.5001
0.4927
0.5004
0.501218.02
18.14
18.31
18.04
18.32
18.3518.48
18.48
18.48
18.48
18.48
18.4837.69
37.42
37.81
37.18
37.90
37.82106.4
104.3
105.5
103.5
106.0
105.3105.2 1.02 染料木苷 0.4923
0.4956
0.5001
0.4927
0.5004
0.5012110.6
111.4
112.4
110.7
112.4
112.6113.4
113.4
113.4
113.4
113.4
113.4215.8
213.8
216.4
213.4
217.2
217.292.73
90.32
91.64
90.49
92.29
92.2291.61 1.09 大豆苷元 0.4923
0.4956
0.5001
0.4927
0.5004
0.5012126.0
126.8
128.0
126.1
128.1
128.3129.2
129.2
129.2
129.2
129.2
129.2248.7
247.6
250.1
246.7
250.8
251.294.94
93.44
94.49
93.31
95.01
95.1094.38 0.86 黄豆黄素 0.4923
0.4956
0.5001
0.4927
0.5004
0.501229.77
29.97
30.24
29.79
30.26
30.3130.53
30.53
30.53
30.53
30.53
30.5358.40
57.78
58.05
57.37
58.22
58.4493.77
91.08
91.10
90.34
91.59
92.1691.67 1.30 染料木素 0.4923
0.4956
0.5001
0.4927
0.5004
0.5012127.2
128.0
129.2
127.2
129.2
129.4130.4
130.4
130.4
130.4
130.4
130.4254.0
253.8
256.9
253.4
257.9
257.897.25
96.43
97.98
96.75
98.69
98.4097.58 0.94 -
本实验建立了一种通过高效液相色谱法对黑豆及发酵淡豆豉中的6种异黄酮成分进行含量检测的分析方法,并对建立的分析方法进行了系统性的方法学验证。从图1中可以看出,该方法能够检测出黑豆及淡豆豉中的大豆苷、黄豆黄苷、染料木苷、大豆苷元、黄豆黄素和染料木素这6种异黄酮成分,且空白溶剂对检测无影响。说明该高效液相色谱分析方法专属性良好,适用于本实验发酵工艺下的淡豆豉中异黄酮的含量测定。经线性、精密度、重复性、稳定性和加样回收率试验考查,该分析方法检测6种异黄酮的含量线性关系良好,较为精密和稳定,回收率符合《中国药典》规定标准[11-12]。其中,大豆苷、染料木苷和黄豆黄素的回收率偏低,可能是由于这3种化合物的稳定性较差,易分解或转化,也可能是在浓缩等预处理过程中由于溶解度偏低的原因导致化合物一定程度上的损失。
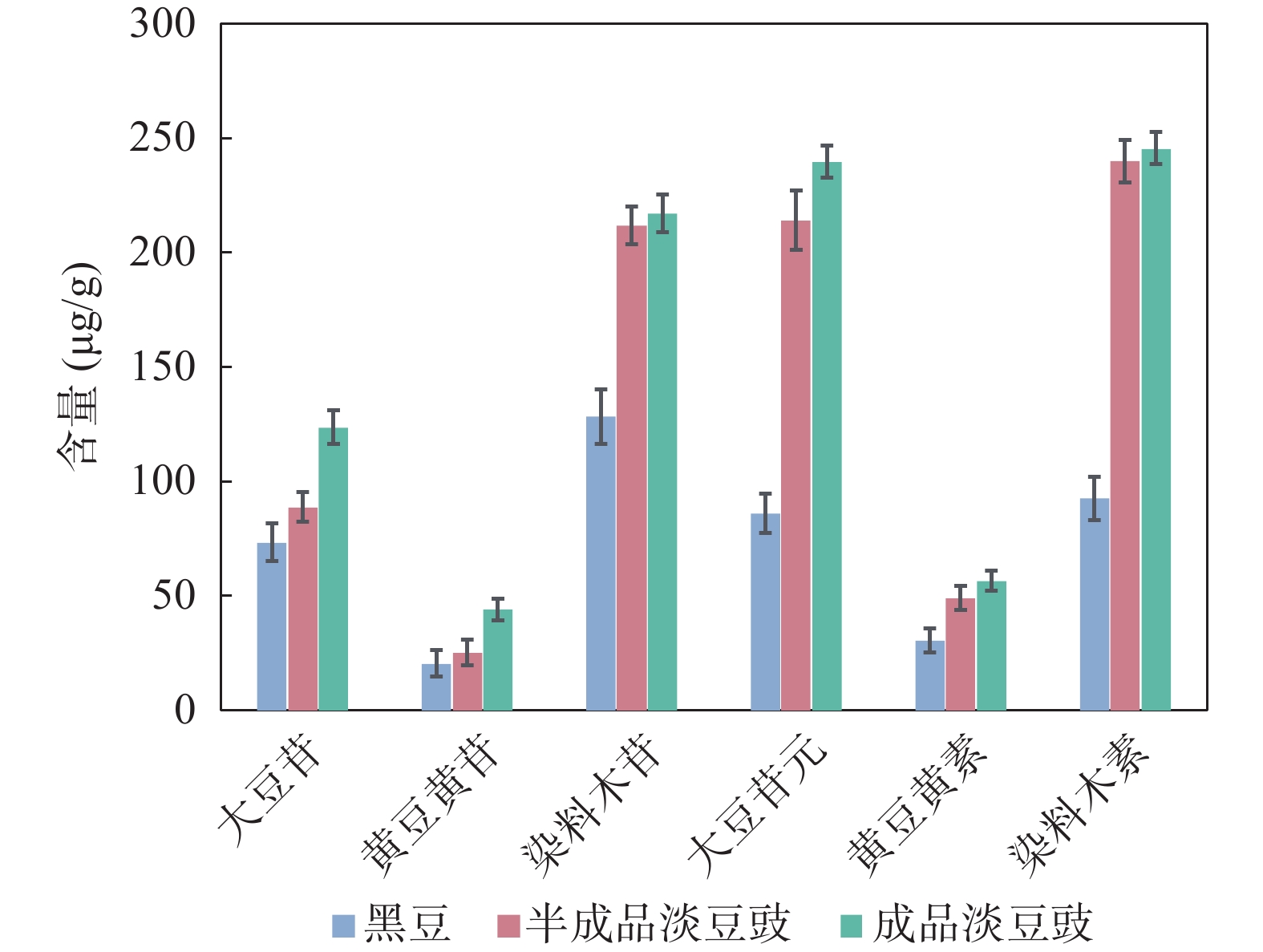
通过上述分析方法对发酵前的黑豆和课题组自制的半成品淡豆豉及成品淡豆豉进行含量测定,并对检测出的含量进行比较。根据图2所示,6种异黄酮在发酵后淡豆豉中的含量相较于在未发酵的黑豆中,均有显著性提升。其中,相较于大豆苷、黄豆黄苷、染料木苷等结合型糖苷,大豆苷元、黄豆黄素和染料木素等游离型苷元的提升更加明显。此外,与半成品淡豆豉相比较,成品淡豆豉中的6种异黄酮的含量均较高,其中大豆苷、黄豆黄苷、大豆苷元这3种异黄酮的含量增多较为明显。从整体趋势来看,在黑豆发酵成半成品淡豆豉再至成品淡豆豉的过程中,这6种异黄酮的含量逐渐增多,在黑豆发酵为淡豆豉后,其中的异黄酮含量显著升高,但随着发酵时间的延长,淡豆豉中异黄酮含量的增速变缓。
大豆异黄酮多以结合型糖苷的形式存在,一般认为结合型的糖苷是无活性的,大量研究表明,异黄酮苷元具有较强的生物活性[13]。所以,上述结果可以表明,黑豆经过发酵成淡豆豉后,其生物活性有明显提升。另外,在黑豆发酵过程中,6种异黄酮的含量持续提升,但随着发酵时间的推移,异黄酮含量提升趋势变缓。这种趋势的原因可能是,在黑豆发酵过程中,随着呼吸作用的增强,异黄酮的生物合成的关键酶——苯丙氨酸氨基裂解酶(PAL)含量也随之提高,使得发酵后的淡豆豉中的异黄酮的含量随之提高,但随着发酵时间的延长,呼吸作用的增强变缓[14]。
Comparison of contents variation of six isoflavones in black beans, semifinished and finished Sojae Semen Praeparatum
-
摘要:
目的 比较发酵前的黑豆及半成品和成品淡豆豉中大豆苷、黄豆黄苷、染料木苷、大豆苷元、黄豆黄素和染料木素 6 种异黄酮的含量变化。 方法 采用高效液相色谱法测定异黄酮的含量,色谱条件为DiamonsilC18色谱柱(4.6×250 mm,5 μm),柱温30 ℃,检测波长为260 nm,流动相为0.2%醋酸水(A)-甲醇(B),梯度洗脱,流速为1.0 ml/min。 结果 该方法测定6种异黄酮成分在测定范围内线性良好(r≥0.999 3),且回收率符合要求,黑豆经发酵后其中的6种异黄酮含量明显提升,且成品淡豆豉比半成品淡豆豉中含量更多。 结论 本研究建立的高效液相色谱法能够准确测定淡豆豉中6种异黄酮的含量。发酵可提升黑豆中的异黄酮的含量,且在发酵过程中结合型异黄酮向游离型异黄酮苷元转化。 Abstract:Objective To compare the contents variation of six flavonoids includingdaidzin, glycitin, genistin, daidzein, glycitein and genisteinin black beans, semifinished and finished Sojae Semen Praeparatum.Methods The contents of flavonoids were determined by HPLC, the condition were Diamonsil C18 column (4.6×250 mm, 5 μm) , column temperature 30 ℃, detection wavelength 260 nm, mobile phase 0.2% acetic acid water (A) - methanol (B), gradient elution, flow rate 1.0 ml/min. Results The linearity of this method to determine 6 isoflavones was good (r≥0.9993) within the determination range, and the recovery rate met the requirements. The RSD of precision, repeatability and stability experiment was less than 4%, 3%and 3%. The results of HPLC showed that the contents of six flavonoidsin Sojae Semen Praeparatum increased significantly compared with black beans. And, the contents of six flavonoids in finished Sojae Semen Praeparatum were slightly more than those in semifinished Sojae Semen Praeparatum. Conclusion The HPLC method established in this study could accurately determine the content of 6 isoflavones in Sojae Semen Praeparatum. The content of six isoflavones in black beans could be increased by the fermentation, and the combined isoflavones were transformed into free isoflavones during the fermentation process. -
Key words:
- black beans /
- Sojae Semen Praeparatum /
- daidzin /
- glycitin /
- genistin /
- daidzein /
- glycitein /
- genistein
-
脑卒中是人类疾病中最常见的脑血管疾病,已经成为人类死亡的第二大原因[1]。脑卒中引起的一系列并发症和后遗症给患者家庭带来了不可估量的负担。脑卒中分为缺血性脑卒中和出血性脑卒中两种,其中,缺血性脑卒中又称脑中风,是脑卒中主要的发病方式,约占脑卒中患者的83%以上[2]。目前,尚无有效的治疗药物用于脑卒中引起的损伤,尤其是对于神经损伤的治疗[3]。活性多肽GRGDS是由甘氨酸-精氨酸-甘氨酸-天冬氨酸-丝氨酸(Gly-Arg-Gly-Asp-Ser,GRGDS)5种氨基酸构成,主要通过形成一个β转角的方式与其他细胞发生黏连[4],因而,能够阻断细胞外基质和细胞表面整合素的结合和黏附,可应用于组织工程或者癌症和肿瘤方面。本试验采用PC12细胞体外模拟脑缺血模型,探讨活性多肽GRGDS对氧糖剥夺损伤后的PC12细胞是否具有保护作用。
1. 材料
1.1 细胞株
PC12细胞购自ATCC细胞库,培养在含有10%胎牛血清的完全培养液中,每12 h观察一次细胞的生长状态,每24 h更换一次细胞培养液,待细胞长到80%进行传代。
1.2 药物与试剂
活性多肽GRGDS(上海淘普生物科技有限公司);高糖DMEM培养液、DMEM无糖培养液(Gibco公司);凋亡试剂盒、蛋白质提取试剂盒(上海碧云天生物技术有限公司);抗体:β-肌动蛋白(β-actin)、含半胱氨酸的天冬氨酸蛋白水解酶3(caspase 3)、活化型含半胱氨酸的天冬氨酸蛋白水解酶3(cleaved caspase 3)、磷酸化c-Jun氨基末端激酶(P-SAPK/JNK)、Bax蛋白(美国CST公司)。
1.3 仪器
细胞培养箱、酶标仪(美国Thermo公司);低温高速离心机(德国Eppendorf公司);细胞缺氧装置(美国Billips-Rothenberg公司);流式细胞仪(BDBiosci-ences公司);Western blot图像扫描仪(美国Odyssey公司)。
2. 方法
2.1 PC12细胞氧糖剥夺损伤模型的建立
氧糖剥夺模型参照文献[5]体外模拟脑缺血模型,即OGD模型,再根据实验过程中的实际情况稍作改造。将细胞培养在培养板中,待细胞生长至培养板底面积80%以上,将对照组的培养液换成无血清高糖完全培养液,OGD组换成无糖培养液,活性多肽GRGDS给药组换成加有GRGDS药物处理的无糖培养液。将含有3组细胞的培养板置于恒温培养箱中孵育1 h,然后将模型组和给药组的细胞置于缺氧装置中,通入混合气体(95%N2,5%CO2),使装置内的氧气完全排出,分别将细胞缺糖和缺氧2、4、6、8 h后取出,采用MTT法选出细胞损伤的最佳时间,进行后续试验研究。
2.2 MTT法测定细胞活力
将PC12细胞以2.0×105个/ml的密度铺于96孔板中,按照“2.1”项下方法进行操作,在缺糖、缺氧之前,将给药组细胞的培养液换成含有不同浓度的活性多肽GRGDS(10、1、0.1、0.01、0.001、0.0001 μg/ml)的无糖培养液置于培养箱中适应1 h,OGD组和给药组一同置于缺氧装置中缺氧4 h。缺氧过后取出培养板,在避光条件下将所有组的细胞加入每孔20 μl提前配好的0.5%MTT溶液(5 mg/ml),用锡箔纸包好将其放入37 ℃恒温培养箱中,继续孵育4 h后弃掉上清液,再向每个细胞培养孔中加入150 μl二甲基亚砜(DMSO)溶液,温室振荡5 min,用全自动酶标仪在492 nm波长处检测每个孔中细胞的吸光值(A)。
2.3 流式细胞仪检测细胞凋亡
将PC12细胞铺于6孔板中,待细胞贴壁后将OGD组中的培养液换成无糖DMEM培养液,给药组中的培养液换成加有活性多肽GRGDS处理的无糖DMEM培养液,恒温孵育1 h后置于缺氧装置中缺氧4 h,缺糖、缺氧后弃掉每孔中的细胞上清液,用磷酸盐缓冲液(PBS)清洗2次,洗掉细胞表面残留的培养液,再用不含依地酸(EDTA)的胰蛋白酶消化液消化1~2 min。将各组细胞置于不同的离心管中,以1200 r/min离心5 min,弃上清液,再加入PBS,将细胞进行重悬后再离心。离心后弃掉上清液,每个离心管中加入500 μl的1×缓冲液轻轻吹打混匀,避光条件下向各离心管中加入5 μl的细胞凋亡检测试剂(annexin V-FITC),室温放置5 min后,再加入5 μl的碘化丙啶(PI)染色液。充分混匀后室温避光放置15 min,用流式细胞仪进行检测。
2.4 ELISA检测OGD后PC12细胞相关炎症因子的变化
将PC12细胞氧糖剥夺后取细胞上清液,4 ℃、300 r/min,离心15 min。离心后取上清液放入4 ℃冰箱冷藏保存,若不能及时检测,应将上清液放在−20 ℃冷冻保存。按照试剂盒中的说明书建立标准曲线,检测各组样本吸光值,并计算其浓度。
2.5 Western blot检测相关蛋白的表达
将氧糖剥夺损伤后的各组细胞上清液弃掉,用预冷的PBS清洗细胞表面残留的培养液,用细胞刮刀将各组细胞刮掉,置于预冷的RIPA裂解液中裂解30 min,使细胞中的蛋白完全裂解,以12 000 r/min,离心10 min,取上清液。BCA蛋白测定试剂盒测定蛋白浓度。各组蛋白中加入20 μl 5×蛋白上样缓冲液,100 ℃煮10 min。10%SDS-PAGE分离蛋白,转膜,用含5%脱脂奶粉的Tris缓冲液封闭1 h,孵育一抗4 ℃环境下过夜,回收一抗,洗膜3次(5 min/次),室温条件下加二抗,避光孵育2 h后洗膜。使用Western blot图像扫描仪扫描并统计结果。
2.6 统计学分析
所有实验数据均以(
$\bar x $ ± s)表示,并采用单因素方差分析比较组间差异。以P<0.05为差异有统计学意义。3. 结果
3.1 活性多肽GRGDS对OGD损伤的PC12细胞的保护作用
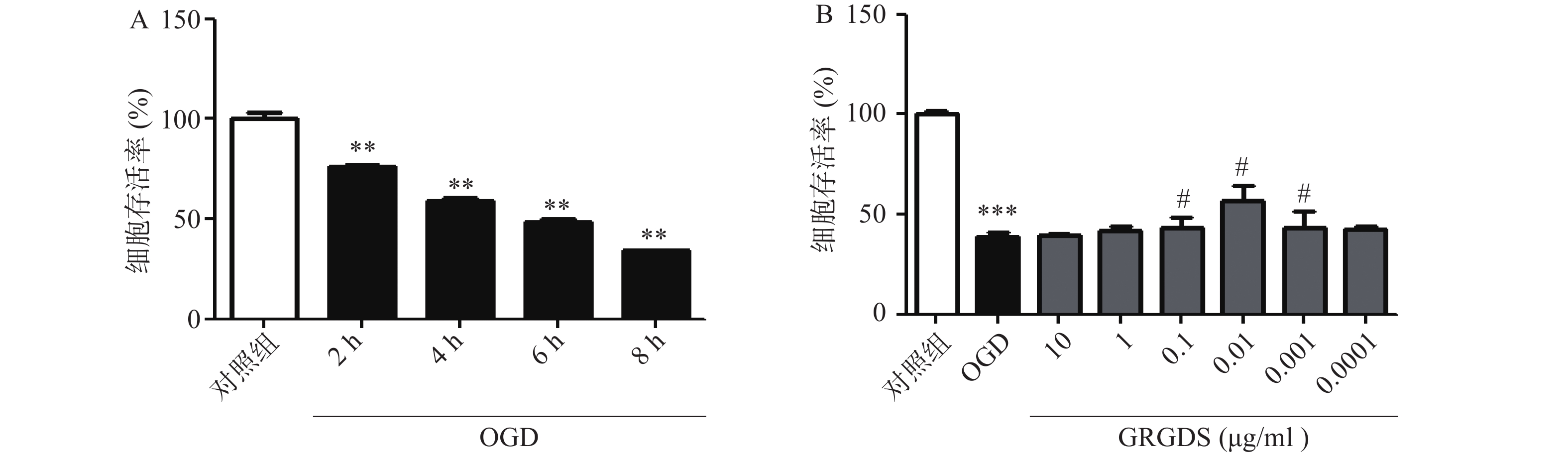
为了选择合适的缺糖缺氧时间,本实验设置了2、4、6、8 h的时间点,结果显示,细胞生存率随着氧糖剥夺时间的增长而显著降低,与对照组相比有显著性差异(P<0.01),且缺糖缺氧4 h细胞明显皱缩,细胞活性明显降低,细胞的损伤率达到50%,此时的损伤率有利于药物补救,更有助于细胞的恢复,因此,氧糖剥夺损伤时间为4 h条件最佳(图1A)。活性多肽GRGDS给药浓度为0.01 μg/ml,可显著提高缺糖缺氧4 h后PC12细胞的活力(P<0.01)。因此,选择缺糖缺氧4 h,给药浓度0.01 μg/ml作为实验条件进行后续研究(图1B)。
3.2 活性多肽GRGDS降低OGD后PC12细胞的凋亡
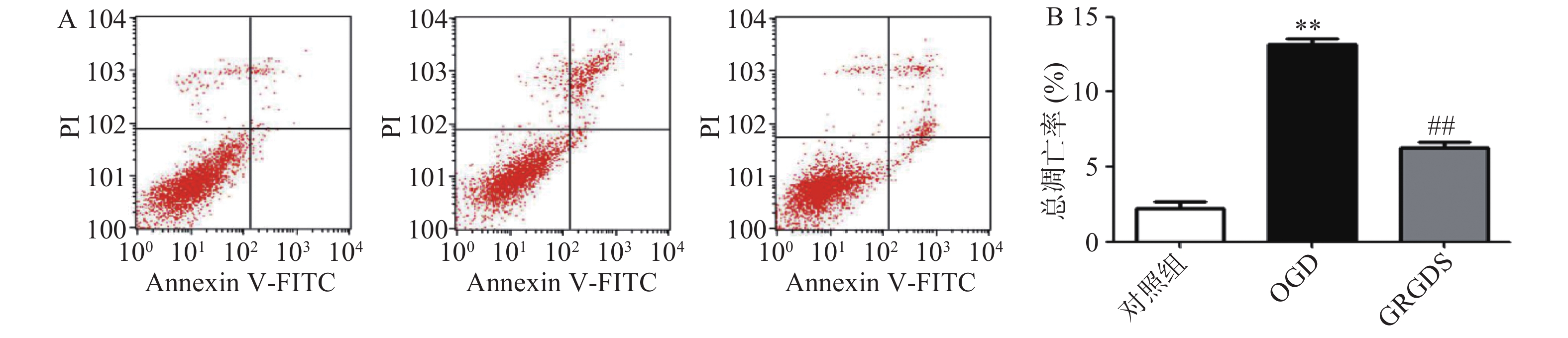
将细胞以2.0×105个/ml细胞密度铺于6孔板中,培养16 h后,将OGD组细胞的高糖培养液换成无糖的DMEM培养液,给药组细胞的高糖培养液换成给予活性多肽GRGDS药物处理的无糖DMEM培养液,37 ℃恒温培养箱中平衡1 h,缺氧4 h,而正常对照组细胞的培养液换成新的高糖DMEM培养液继续培养。缺糖缺氧结束后,用流式细胞仪检测各组细胞凋亡情况。图2结果显示,与正常对照组比较,OGD组细胞的凋亡率显著增加(P<0.01),由正常对照组(2.26±0.61)%上升到(12.14±1.69)%。给予活性多肽GRGDS 0.01 μg/ml剂量浓度处理后,细胞凋亡率明显降低,凋亡率降至(6.94±1.45)%(P<0.01)。
3.3 活性多肽GRGDS降低OGD后PC12细胞上清液中TNF-α和IL-1β的含量
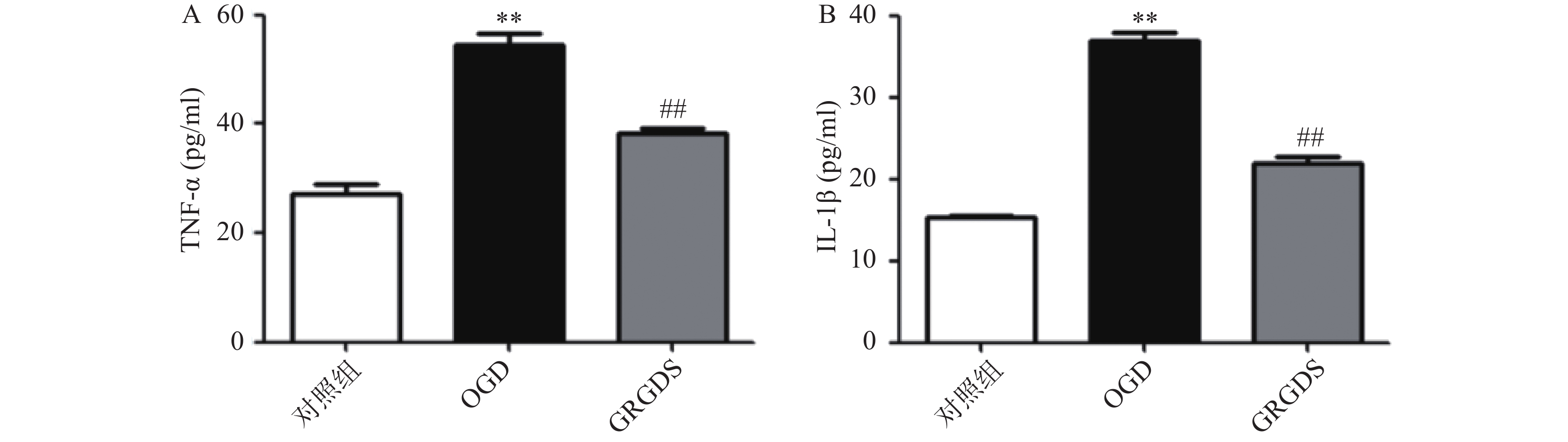
正常对照组细胞上清液中TNF-α的含量为(27.16±2.69)pg/ml,两者相比,OGD组细胞中的TNF-α含量明显增加(P<0.01),为(54.51±2.89)pg/ml;与OGD比较,给予活性多肽GRGDS 0.01 μg/ml剂量浓度处理的细胞上清液TNF-α的含量显著降低,为(38.32±18)pg/ml(P<0.01,图3A)。正常对照组细胞上清液IL-1β的含量为(15.4±0.11)pg/ml,OGD组细胞上清液中IL-1β的含量为(35.99±2.25)pg/ml,两者相比,OGD中的IL-1β含量显著增加(P<0.01)。与OGD比较,给予活性多肽GRGDS 0.01 μg/ml剂量浓度处理的细胞上清液中IL-1β的含量显著降低,为(21.84±1.18)pg/ml(P<0.01,图3B)。
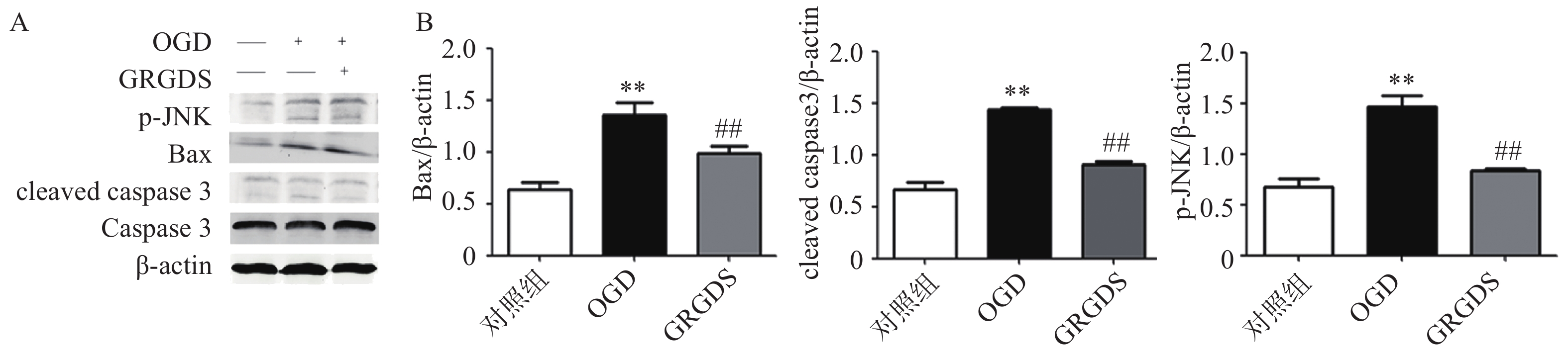
3.4 活性多肽GRGDS降低OGD后PC12细胞中p-JNK、Bax、cleaved caspase 3蛋白的表达
本实验检测了MAPKs信号通路中的JNK信号通路中相关蛋白表达的影响。结果如图4所示,PC12细胞经过氧糖剥夺损伤后,细胞中的p-JNK、Bax、cleaved caspase 3蛋白表达与正常对照组细胞相比均显著升高(P<0.01);而给予活性多肽GRGDS 0.01 μg/ml剂量浓度处理后,可明显降低氧糖剥夺损伤后细胞中p-JNK、Bax、cleaved caspase 3蛋白的表达(P<0.01)。
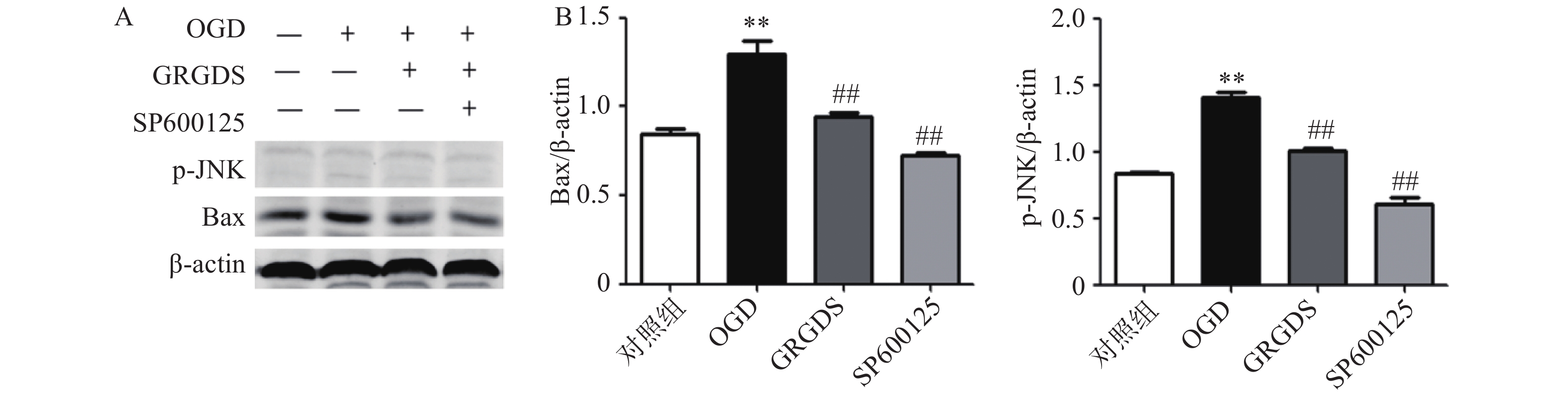
3.5 活性多肽GRGDS降低OGD后PC12细胞中加入JNK抑制剂p-JNK、Bax蛋白的表达
将原始浓度为10 mmol/ml的JNK抑制剂(SP600125)稀释成10 μmol/ml的浓度加入到PC12细胞中,缺糖缺氧后提取细胞蛋白分别检测p-JNK及其下游Bax蛋白的表达情况。结果如图5所示,OGD组细胞中p-JNK、Bax的蛋白表达与正常对照组细胞相比都显著增加(P<0.01);给予活性多肽GRGDS 0.01 μg/ml剂量浓度以及JNK抑制剂处理后,p-JNK、Bax蛋白的表达水平与OGD组相比均明显降低(P<0.01)。
4. 讨论
缺血性脑卒中是由血管阻塞引起的脑血液循环障碍诱发的神经系统损伤,致死、致残率较高,且病理机制十分复杂,目前医学上仍缺乏行之有效的治疗方法。在急性缺血的早期阶段,细胞凋亡可能是对氧糖剥夺的一种自我保护反应,有助于维护重要细胞的生存。然而,在局部缺血的大部分期间,钙超载、氧自由液和溶酶体酶的释放均会导致细胞坏死[6]。
最新研究表明,活性多肽GRGDS可激活体内干细胞,促进细胞的增长和分化[7]。但是,活性多肽GRGDS对于PC12细胞凋亡引起的一系列炎症反应的作用尚未见研究报道。因此,本实验研究了活性多肽GRGDS对氧糖剥夺损伤的PC12细胞凋亡和凋亡反应的抑制作用,并初步探讨其可能存在的药理和药效机制。首先,建立氧糖剥夺损伤的PC12细胞模型,同时加入不同给药剂量浓度的活性多肽GRGDS进行处理。结果发现,活性多肽GRGDS的不同给药剂量浓度可有效抑制氧糖剥夺PC12细胞的损伤,并且当活性多肽GRGDS的剂量浓度为0.01 μg/ml时药物作用效果最佳。故确定0.01 μg/ml浓度作为机制探讨剂量。
TNF-α是一种促炎性多效细胞因子,研究表明,TNF-α可以通过激活转录因子NF-κB的机制阻止神经元的死亡或凋亡,从而诱导Mn-SOD和Bcl-2的表达[8]。TNF-α在大脑发育过程中起着效应分子的作用,经常参与不同的信号通路,激活巨噬细胞和神经胶质细胞,促进神经毒素的产生,并启动神经细胞的凋亡或死亡过程[9]。IL-1β作为一种炎症和免疫源性细胞因子,可在多个环节参与脑缺血损伤机制。研究表明,大量炎性细胞因子(IL-1β、TNF-α)参与脑缺血再灌注损伤后脑细胞的凋亡和坏死[10]。因此检测了氧糖剥夺损伤的PC12细胞上清液,结果显示,氧糖剥夺损伤后PC12细胞上清液中TNF-α和IL-1β含量显著增加,给予活性多肽GRGDS 0.01 μg/ml剂量浓度处理后,上清液中的TNF-α和IL-1β含量明显降低。
本研究结果显示,经过氧糖剥夺损伤后,PC12细胞的凋亡率明显增加,而给予活性多肽GRGDS 0.01 μg/ml剂量浓度处理后PC12细胞的凋亡率显著下降,这提示了活性多肽GRGDS可能通过抑制PC12的凋亡而发挥神经保护作用。为了进一步研究活性多肽GRGDS是否通过抗凋亡作用发挥对PC12细胞的保护作用,本实验试着对凋亡信号通路中的p-JNK、Bax、cleaved caspase 3等相关蛋白的表达进行了检测。据报道,caspase 3是细胞凋亡中的关键部分,是其信号传导的效应通路。caspase 3可能通过线粒体、内质网和死亡受体三种途径激活体内细胞中的死亡信号。缺血性脑卒中一般会引起体内线粒体细胞色素c的释放导致caspase 3的表达、激活和裂解,从而促进细胞凋亡。在细胞死亡引起的凋亡过程中,cleaved caspase 3的表达会增加[11]。研究发现,MAPK可以参与调节多种信号通路诱导或减轻细胞凋亡,活化的JNK会引起脑缺血应激反应的细胞凋亡,而JNK抑制剂在脑缺血再灌注损伤后提供神经保护作用。Bcl-2蛋白家族中的抗凋亡Bcl-2(Bcl-xL)和促凋亡Bax蛋白之间的动态平衡在决定脑缺血期间的细胞命运中起关键作用。越来越多的证据表明,Bcl-2(Bcl-xL)/Bax比率的增加抑制Bax易位至线粒体并保护神经元免受细胞凋亡的损伤,而平衡向Bax过量的转变会引起缺血诱导的神经细胞凋亡。本研究结果显示,氧糖剥夺损伤后PC12细胞中p-JNK、Bax、cleaved caspase 3蛋白的表达水平显著升高,综合流式细胞仪检测氧糖剥夺损伤后PC12细胞凋亡的结果,表明活性多肽GRGDS可能通过抑制凋亡信号通路中的JNK/Bax信号通路,进而抑制氧糖剥夺损伤的PC12细胞凋亡反应,最终发挥神经保护作用。
本研究结果表明,活性多肽GRGDS 0.01 μg/ml剂量浓度可以明显抑制氧糖剥夺损伤的PC12细胞凋亡,降低细胞上清液中TNF-α和IL-1β的含量,并通过调控JNK/Bax信号通路蛋白的表达发挥神经保护作用。活性多肽GRGDS可能在脑缺血中对PC12细胞引起的损伤具有一定的神经保护作用。进一步的研究还需在动物模型上进行更深一层的体内药效试验解释活性多肽GRGDS对缺血性脑卒中的影响及其作用机制,为活性多肽GRGDS在临床上用于缺血性脑卒中的药物治疗提供良好的药理学基础。
-
表 1 6种异黄酮标准曲线试验结果
成分 回归方程 线性范围
(μg/ml)r LOQ
(μg/ml)大豆苷 Y=36742X-10999 1.093~54.65 0.9999 0.1093 黄豆黄苷 Y=46941X-14743 1.018~50.90 0.9999 0.1018 染料木苷 Y=49764X-18948 1.084~54.20 0.9999 0.1084 大豆苷元 Y=49161X-14614 1.018~50.90 0.9999 0.1018 黄豆黄素 Y=32743X-8632.1 1.038~51.90 0.9993 0.1038 染料木素 Y=80493X-27200 0.895~44.75 0.9999 0.0895 表 2 加样回收率试验结果
成分 药材粉末称量(g) 原有量(μg) 加入量(μg) 测得量(μg) 回收率(%) 平均回收率(%) RSD(%) 大豆苷 0.4923
0.4956
0.5001
0.4927
0.5004
0.501263.16
63.58
64.16
63.21
64.20
64.3064.78
64.78
64.78
64.78
64.78
64.78121.5
123.7
123.2
121.5
123.9
124.490.11
92.79
91.20
90.05
92.21
92.7091.51 1.36 黄豆黄苷 0.4923
0.4956
0.5001
0.4927
0.5004
0.501218.02
18.14
18.31
18.04
18.32
18.3518.48
18.48
18.48
18.48
18.48
18.4837.69
37.42
37.81
37.18
37.90
37.82106.4
104.3
105.5
103.5
106.0
105.3105.2 1.02 染料木苷 0.4923
0.4956
0.5001
0.4927
0.5004
0.5012110.6
111.4
112.4
110.7
112.4
112.6113.4
113.4
113.4
113.4
113.4
113.4215.8
213.8
216.4
213.4
217.2
217.292.73
90.32
91.64
90.49
92.29
92.2291.61 1.09 大豆苷元 0.4923
0.4956
0.5001
0.4927
0.5004
0.5012126.0
126.8
128.0
126.1
128.1
128.3129.2
129.2
129.2
129.2
129.2
129.2248.7
247.6
250.1
246.7
250.8
251.294.94
93.44
94.49
93.31
95.01
95.1094.38 0.86 黄豆黄素 0.4923
0.4956
0.5001
0.4927
0.5004
0.501229.77
29.97
30.24
29.79
30.26
30.3130.53
30.53
30.53
30.53
30.53
30.5358.40
57.78
58.05
57.37
58.22
58.4493.77
91.08
91.10
90.34
91.59
92.1691.67 1.30 染料木素 0.4923
0.4956
0.5001
0.4927
0.5004
0.5012127.2
128.0
129.2
127.2
129.2
129.4130.4
130.4
130.4
130.4
130.4
130.4254.0
253.8
256.9
253.4
257.9
257.897.25
96.43
97.98
96.75
98.69
98.4097.58 0.94 表 3 黑豆、发酵中和发酵后的淡豆豉中 6 种异黄酮类成分含量比较
含量(μg/g) 大豆苷 黄豆黄苷 染料木苷 大豆苷元 黄豆黄素 染料木素 黑豆 73.44 20.58 128.2 85.99 30.45 92.48 半成品淡豆豉 88.78 25.29 211.6 213.92 49.10 239.7 成品淡豆豉 123.6 44.02 217.0 239.3 56.75 245.4 -
[1] 国家药典委员会. 中华人民共和国药典(一部)2020 年版 [S]. 北京: 中国医药科技出版社, 2020: 350. [2] 陈丽艳, 官雪莲, 张蕾, 等. 淡豆豉对人体肠道六种常住菌的调节作用[J]. 中国微生态学杂志, 2017, 29(10):1122-1126. [3] 胡斌, 王秋红, 姜海, 等. 淡豆豉抗菌活性及化学成分分析[J]. 中国实验方剂学杂志, 2019, 25(6):163-167. [4] 曹冬英, 李鸷, 许文, 等. 4种市售黑豆及成品淡豆豉中异黄酮含量分析[J]. 药学研究, 2020, 39(10):581-584. [5] 李鸷, 曹冬英, 许文, 等. 基于发酵过程的淡豆豉6种黄酮类成分质量控制研究[J]. 药学研究, 2019, 38(10):563-566,573. [6] 田赛赛, 何金城, 韩燕, 等. 大豆及其发酵品的活性成分研究进展[J]. 药学服务与研究, 2016, 16(1):15-18. [7] GUO H, ZHANG Z, YAO Y, et al. A new strategy for statistical analysis-based fingerprint establishment: application to quality assessment of Semen sojae praeparatum[J]. Food Chem,2018,258:189-198. doi: 10.1016/j.foodchem.2018.03.067 [8] YAOY, MAX, LI T, et al. Quantification of isoflavone glycosides and aglycones in rat plasma by LC-MS/MS: Troubleshooting of interference from food and its application to pharmacokinetic study of Semen Sojae Praeparatum extract[J]. J Pharm Biomed Anal,2018,161:444-454. doi: 10.1016/j.jpba.2018.09.011 [9] 张景, 冯亭亭, 张明柱. 淡豆豉中异黄酮含量测定及其抑制乙酰胆碱酯酶活性研究[J]. 天然产物研究与开发, 2017, 29(2):310-315. [10] 廖丽娜, 张明敏, 曹尉尉, 等. 淡豆豉药材的高效液相指纹图谱研究[J]. 药学实践杂志, 2012, 30(5):351-352,386. [11] QULP, FANG R, PENG J Y, et al. Isolation of six isoflavones from semen soja epraeparatum by preparative HPLC[J]. Fitoterapia,2007,78(3):200-204. doi: 10.1016/j.fitote.2006.11.002 [12] 国家药典委员会. 中华人民共和国药典 (四部)2020 年版 [S]. 北京: 中国医药科技出版社, 2020: 480. [13] CHANGRR, LIUJ L, LUO Y S, et al. Isoflavones' effects on pharmacokinetic profiles of main iridoids from Gardeniae Fructus in rats[J]. J Pharm Anal,2020,10(6):571-580. doi: 10.1016/j.jpha.2019.11.004 [14] 董雨薇, 刘学, 薛晓欣, 等. 浅谈黑豆萌发过程中营养成分的变化[J]. 广东蚕业, 2019, 53(06):25-26. 期刊类型引用(6)
1. 王玉群,孟名柱. 准确识别门急诊药品包装盒的YOLO-V5深度学习预测模型的建立及初步应用. 医药导报. 2024(04): 661-667 .  百度学术
百度学术2. 马海东,王条敏,秦小英,张皓均,何翠. 医院西药房处方调剂差错原因分析与防范措施. 中国药业. 2024(13): 28-30 .  百度学术
百度学术3. 王丰,马文兵,董海燕. 信息药师基于相似度算法的门诊药房药品差错防范体系建设及其应用. 中国医院药学杂志. 2024(13): 1585-1591 .  百度学术
百度学术4. 汤小林,陈梦莹,柴晓燕,龚丽霞,黄燕. 品管圈活动降低门诊西药房调剂内部差错率的实践研究. 药品评价. 2023(07): 785-788 .  百度学术
百度学术5. 林婉茹. 加强西药房药品管理对降低药患纠纷及药品差错发生率的影响分析. 中国医药指南. 2023(30): 70-72 .  百度学术
百度学术6. 赵思宇. 调剂管理创新在药剂科中的应用. 中医药管理杂志. 2022(24): 199-201 .  百度学术
百度学术其他类型引用(0)
-






 下载:
下载:
 下载:
下载: