-
中药青蒿为植物菊科黄花蒿(Artemisia annua L.)的干燥地上部分,味苦、辛,性寒,归肝、胆经,具有清虚热等功效[1]。现代研究表明,青蒿及其所含有关单体成分除了在抗疟疾方面有效外,在抑菌抗炎、免疫调节和缓解热应激等方面也有效果[2],特别是在抗氧化方面,青蒿亦表现出良好作用[3]。现有研究表明,氧化应激与许多疾病关系密切,过度氧化应激可导致骨质疏松症等疾病[4]。目前,对青蒿所含活性成分青蒿素研究较多,特别是其抗疟、抗氧化等作用受到关注[5],但青蒿素之外的其他成分在抗氧化方面亦有活性[6-9],应受到重视。本研究进行青蒿抗氧化活性的谱效关系研究,分析色谱特征峰与DPPH和ABTS自由基清除能力的关联性[10],探究青蒿所含不同化学成分的抗氧化活性,以阐明青蒿体外抗氧化活性的药效物质基础,为青蒿的质量评价和资源开发等提供依据。
-
岛津LC-20AD型高效液相色谱仪,包括四元泵、PAD检测器、自动进样器(日本岛津株式会社);BT285S型电子分析天平(德国Sartorius 公司);DL-1000B型超声波清洗仪(上海之信仪器有限公司);ELx 800型多功能酶标仪(美国 Biotek公司)。
-
东莨菪内酯(批号:20220215)、芹菜素(批号:20220216)、木犀草素(批号:20220216)购自上海历鼎生物技术有限公司;异绿原酸A(批号:DSTDY054701)、异绿原酸B(批号:DST210625-037)、异绿原酸C(批号:DSTDY003802)、滨蒿内酯(批号:DSTDB003101)、艾黄素(批号:DST220119-004)、青蒿素(批号:DSTDQ004702)、青蒿酸(批号:DST210919-048)购自成都德思特生物技术有限公司;所有对照品纯度均≥98%。DPPH自由基清除能力试剂盒(批号:20220223)、ABTS自由基清除能力试剂盒(批号:20220224)购自上海励瑞生物科技有限公司。
-
11批青蒿药材样品信息见表1,经海军军医大学药学系生药教研室辛海量教授鉴定为Artemisia annua L.的干燥地上部分。
表 1 药材样品来源信息
序号 产地 序号 产地 S1 河北邯郸 S7 安徽亳州 S2 安徽亳州 S8 江西赣州 S3 河南驻马店 S9 四川自贡 S4 安徽亳州 S10 河南南阳 S5 湖北恩施 S11 重庆市 S6 安徽亳州 -
采用 Agilent C18(250 mm×4.6 mm, 5 μm)色谱柱;流动相为0.2%磷酸水溶液(A)-甲醇(B),梯度洗脱(0~5 min,90%→82.5% A;5~10 min,82.5%→75% A;10~30 min,75%→62% A;30~38 min,62%→58.3% A;38~43 min,58.3% A;43~48 min,58.3%→55% A;48~58 min,55→40% A;58~68 min,40%→20% A;68~72 min,20%→18.5% A;72~80 min,18.5%→5% A;80~90min,5%→90% A);流速:1 ml /min;柱温:室温;检测波长:220 nm;进样量:10 μl。
-
精密称取青蒿素、艾黄素、青蒿酸、猫眼草黄素、芹菜素、木犀草素、异绿原酸C、异绿原酸A、异绿原酸B、滨蒿内酯、东莨菪内酯对照品适量,用甲醇溶解得到浓度分别为300、31、96、78 、16、12、52、134、28、18、86 μg/ml的混合对照品溶液[11]。
-
药材粉末过50目筛后,精密称取1.5 g,加入甲醇50 ml,记录重量后超声(600 W,40 kHz,50 ℃)提取50 min,取出放置冷却至室温后加甲醇至之前的重量,混匀,过0. 45 μm微孔滤膜。
-
取“2.2.2”项下编号为S10的供试品溶液适量,按“2.1”项所述条件连续运行6次,计算得到RSD(色谱峰保留时间)均小于0.49%,RSD(峰面积)均小于1.93%,表明本研究所用设备精密度良好。
-
取“2.2.2”项下编号为S10的供试品溶液适量,分别于室温下放置0、2、4、8、12、16、24 h时按“2.1”项所述条件运行,计算得到RSD(色谱峰保留时间)均小于0.69%,RSD(峰面积)均小于4.67%,说明配制的溶液在1 d内具有稳定性。
-
取编号为S10的青蒿样品粉末1.5 g,共6份,精密称定,按“2.2.2”项和“2.1”项下制备供试品溶液并运行,计算得到色谱峰保留时间均小于0.72%,峰面积均小于4.76%,表明该方法重复性良好。
-
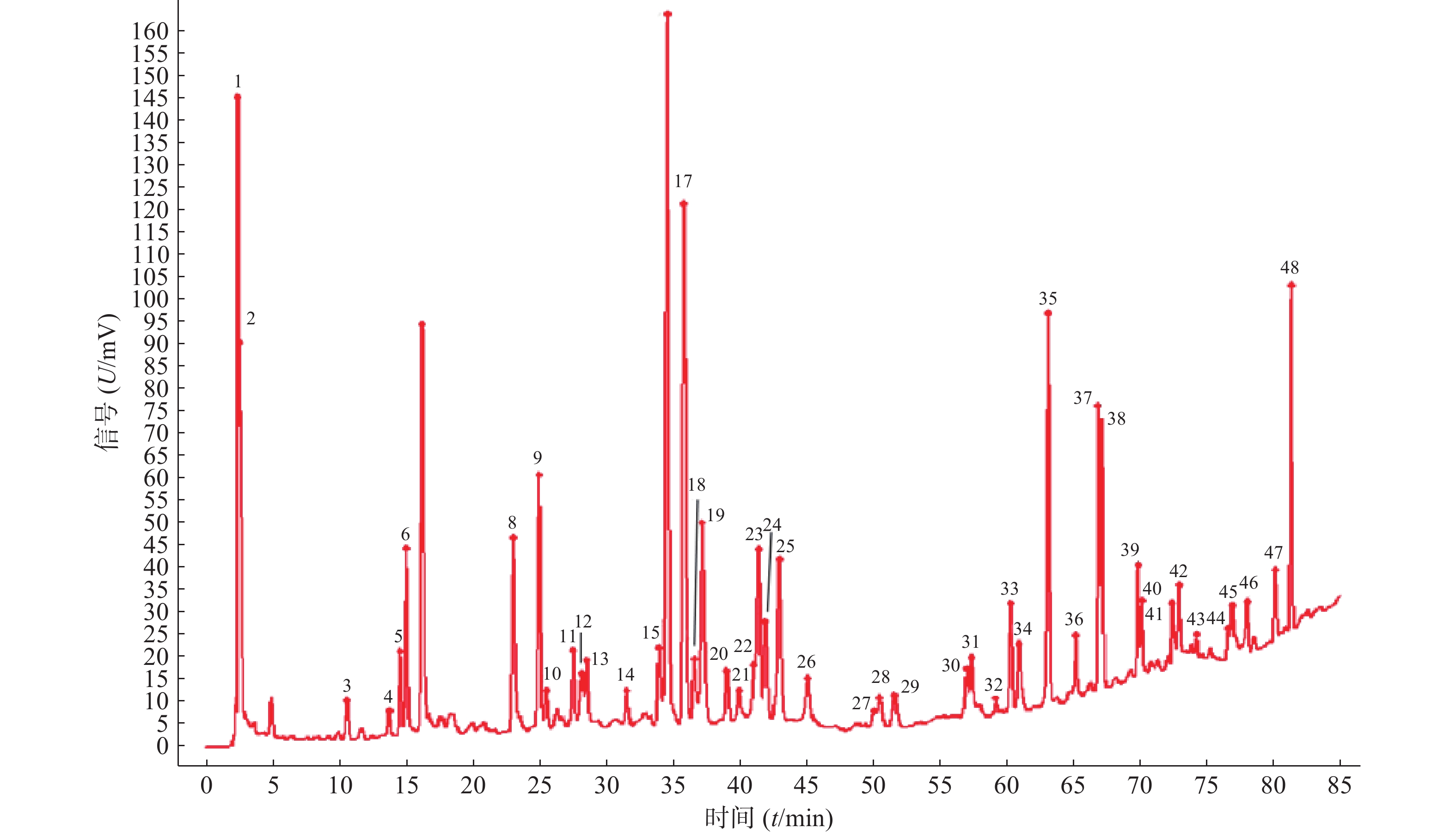
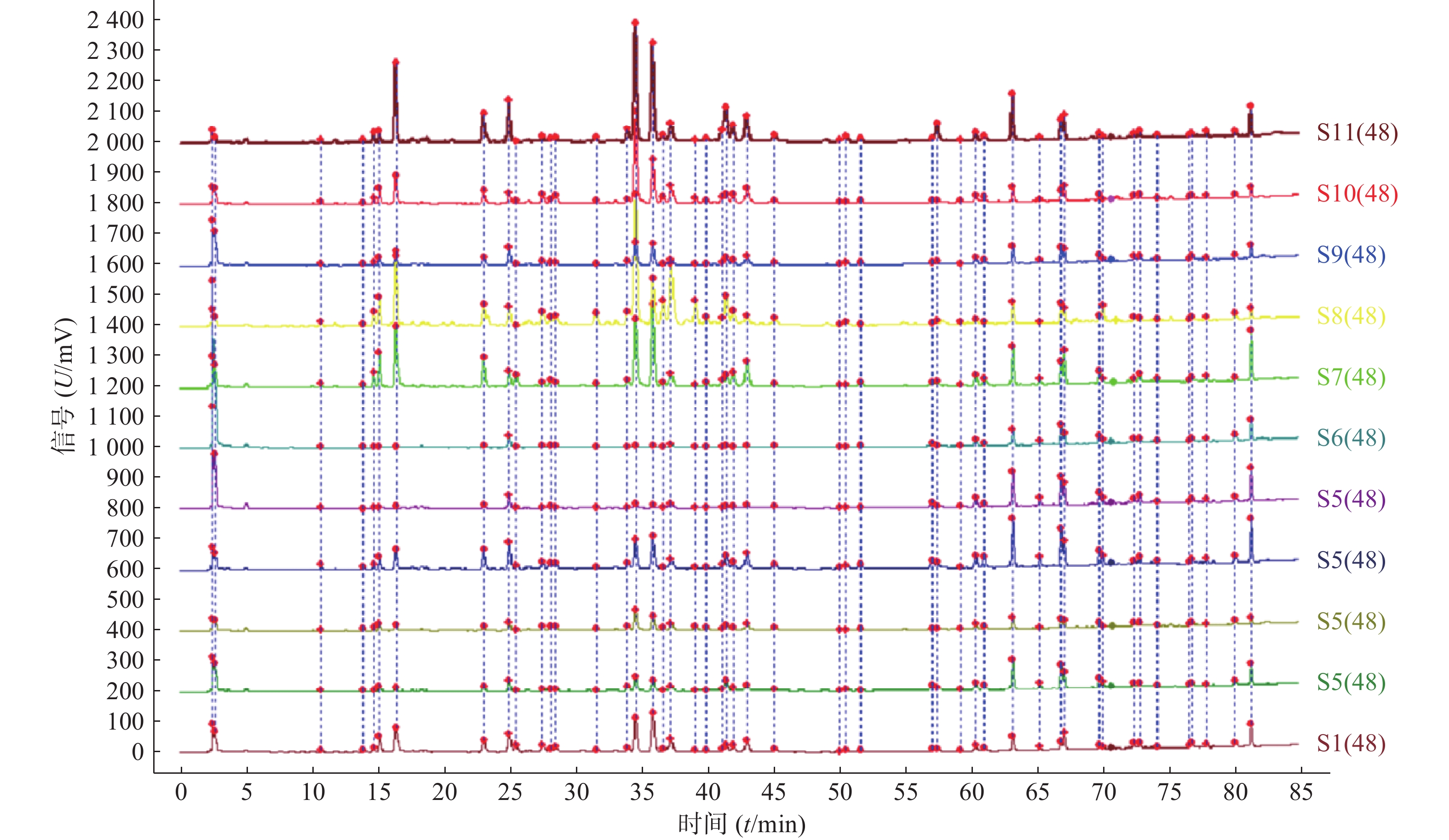
分别取11批青蒿样品,按照“2.2.2”项下方法制备供试品溶液,精密吸取供试品溶液10 μl,按“2.1”项下色谱条件进样检测后,将获得的HPLC数据导入《中药色谱指纹图谱相似度评价系统》(2012版),得到11批青蒿样品的指纹图谱,指认出48个共有峰,见图1、图2。
-
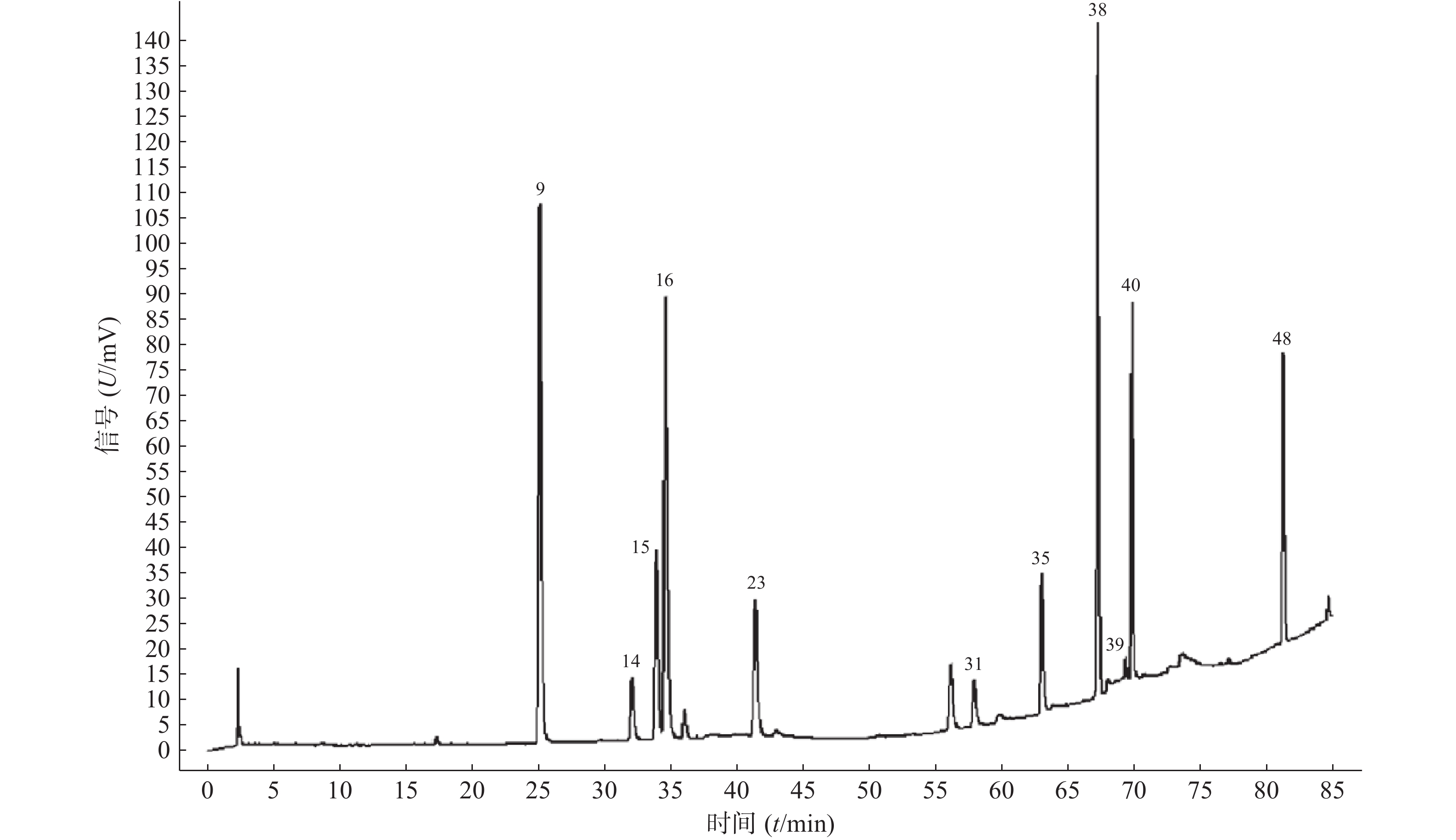
11批青蒿样品共有48个共有峰,共有峰占总峰比在0.776~0.864之间。选择S10为参照图谱,时间窗宽度设置为0.1 min,采用平均数法,以指纹图谱中峰形较好的色谱峰进行多点校正后生成叠加图谱,即为对照图谱。通过与混合对照品的HPLC分析结果对比,指认出9号峰为东莨菪内酯、14号峰为滨蒿内酯、15号峰为异绿原酸B、16号峰为异绿原酸A、23号峰为异绿原酸C、31号峰为木犀草素、35号峰为芹菜素、38号峰为猫眼草黄素、39号峰为青蒿素、40号峰为艾黄素、48号峰为青蒿酸(图3)。图谱显示,异绿原酸A峰面积大且稳定,分离度良好,故对比其保留时间(峰面积),其他峰的相对保留时间(峰面积)=其他峰的保留时间(峰面积)/异绿原酸A的保留时间(峰面积),见表2、表3。
表 2 11批中药青蒿样品HPLC图谱共有峰的相对保留时间
编号 S1 S2 S3 S4 S5 S6 S7 S8 S9 S10 S11 RSD(%) 峰1 0.071 0.071 0.071 0.071 0.070 0.070 0.070 0.071 0.070 0.072 0.072 1.060 峰2 0.075 0.075 0.075 0.075 0.075 0.074 0.075 0.075 0.074 0.075 0.075 0.540 峰3 0.303 0.308 0.308 0.309 0.309 0.309 0.310 0.311 0.310 0.310 0.309 0.680 峰4 0.396 0.401 0.401 0.401 0.400 0.401 0.401 0.402 0.402 0.403 0.402 0.450 峰5 0.418 0.423 0.423 0.424 0.424 0.423 0.424 0.425 0.424 0.425 0.425 0.460 峰6 0.433 0.437 0.437 0.437 0.436 0.436 0.436 0.437 0.437 0.439 0.438 0.340 峰7 0.468 0.472 0.472 0.472 0.472 0.472 0.472 0.473 0.473 0.473 0.473 0.300 峰8 0.662 0.667 0.667 0.667 0.667 0.666 0.667 0.668 0.667 0.668 0.668 0.250 峰9 0.717 0.723 0.723 0.723 0.723 0.722 0.724 0.724 0.724 0.724 0.724 0.280 峰10 0.731 0.739 0.738 0.738 0.741 0.737 0.738 0.738 0.738 0.738 0.740 0.340 峰11 0.794 0.796 0.796 0.796 0.796 0.795 0.797 0.797 0.796 0.797 0.797 0.120 峰12 0.810 0.815 0.815 0.815 0.809 0.814 0.815 0.815 0.814 0.817 0.817 0.310 峰13 0.823 0.825 0.825 0.825 0.825 0.824 0.826 0.827 0.825 0.826 0.826 0.130 峰14 0.912 0.912 0.912 0.913 0.911 0.912 0.914 0.914 0.913 0.913 0.914 0.110 峰15 0.983 0.982 0.983 0.983 0.982 0.982 0.983 0.985 0.982 0.984 0.983 0.100 峰16 1.000 1.000 1.000 1.000 1.000 1.000 1.000 1.000 1.000 1.000 1.000 0 峰17 1.038 1.037 1.037 1.037 1.037 1.037 1.037 1.038 1.037 1.038 1.038 0.050 峰18 1.058 1.056 1.058 1.058 1.060 1.060 1.061 1.062 1.060 1.059 1.059 0.160 峰19 1.078 1.079 1.078 1.078 1.075 1.074 1.078 1.079 1.075 1.078 1.079 0.170 峰20 1.133 1.131 1.131 1.131 1.131 1.129 1.130 1.131 1.129 1.132 1.132 0.110 峰21 1.157 1.154 1.157 1.155 1.155 1.156 1.156 1.157 1.154 1.158 1.156 0.110 峰22 1.190 1.190 1.189 1.189 1.190 1.192 1.188 1.189 1.187 1.189 1.192 0.130 峰23 1.199 1.198 1.198 1.198 1.198 1.198 1.199 1.199 1.197 1.198 1.198 0.050 峰24 1.215 1.214 1.214 1.214 1.213 1.213 1.213 1.215 1.212 1.214 1.214 0.070 峰25 1.246 1.244 1.244 1.244 1.243 1.242 1.243 1.244 1.242 1.244 1.245 0.100 峰26 1.307 1.306 1.306 1.307 1.306 1.305 1.306 1.308 1.306 1.306 1.308 0.070 峰27 1.452 1.453 1.450 1.450 1.450 1.450 1.450 1.453 1.449 1.448 1.449 0.110 峰28 1.464 1.462 1.463 1.463 1.464 1.463 1.464 1.465 1.461 1.461 1.460 0.110 峰29 1.497 1.493 1.495 1.495 1.492 1.492 1.495 1.500 1.492 1.494 1.494 0.160 峰30 1.656 1.655 1.656 1.653 1.648 1.645 1.648 1.649 1.647 1.658 1.659 0.300 峰31 1.665 1.665 1.672 1.663 1.659 1.657 1.657 1.658 1.656 1.667 1.667 0.320 峰32 1.718 1.718 1.717 1.716 1.711 1.709 1.710 1.711 1.708 1.719 1.721 0.270 峰33 1.752 1.752 1.751 1.748 1.743 1.738 1.738 1.740 1.739 1.754 1.756 0.400 峰34 1.770 1.770 1.769 1.767 1.762 1.758 1.758 1.759 1.758 1.772 1.775 0.360 峰35 1.833 1.834 1.833 1.830 1.825 1.821 1.821 1.822 1.820 1.835 1.838 0.360 峰36 1.893 1.894 1.893 1.890 1.884 1.879 1.879 1.880 1.879 1.896 1.900 0.420 峰37 1.942 1.943 1.942 1.939 1.932 1.927 1.927 1.928 1.928 1.945 1.949 0.430 峰38 1.950 1.950 1.949 1.946 1.939 1.934 1.934 1.935 1.935 1.953 1.956 0.430 峰39 2.027 2.027 2.026 2.023 2.015 2.010 2.009 2.011 2.011 2.030 2.034 0.460 峰40 2.036 2.036 2.032 2.031 2.024 2.019 2.018 2.016 2.020 2.039 2.043 0.470 峰41 2.102 2.102 2.101 2.097 2.090 2.084 2.084 2.085 2.085 2.105 2.109 0.450 峰42 2.117 2.116 2.114 2.111 2.103 2.097 2.097 2.097 2.098 2.119 2.122 0.470 峰43 2.156 2.155 2.153 2.149 2.141 2.135 2.134 2.135 2.136 2.157 2.161 0.490 峰44 2.226 2.224 2.223 2.219 2.211 2.204 2.204 2.205 2.205 2.226 2.230 0.470 峰45 2.233 2.232 2.230 2.226 2.218 2.212 2.211 2.213 2.212 2.234 2.238 0.470 峰46 2.267 2.265 2.263 2.259 2.250 2.243 2.243 2.244 2.244 2.265 2.270 0.490 峰47 2.329 2.327 2.325 2.321 2.312 2.306 2.304 2.306 2.306 2.328 2.332 0.480 峰48 2.363 2.362 2.36 2.355 2.346 2.339 2.338 2.340 2.340 2.363 2.367 0.490 共有峰/总峰 0.837 0.815 0.778 0.821 0.811 0.834 0.864 0.776 0.823 0.806 0.838 表 3 11批中药青蒿样品HPLC图谱共有峰的相对峰面积
编号 S1 S2 S3 S4 S5 S6 S7 S8 S9 S10 S11 RSD(%) 峰1 0.221 0.718 0.167 0.215 6.001 18.615 0.134 0.037 0.545 0.046 0.033 232.240 峰2 0.539 2.042 0.539 0.505 11.735 36.124 0.337 0.055 1.571 0.192 0.041 223.380 峰3 0.065 0.102 0.060 0.131 0.300 0.356 0.050 0.035 0.070 0.032 0.028 100.170 峰4 0.066 0.061 0.059 0.088 0.121 0.476 0.033 0.015 0.064 0.021 0.026 139.490 峰5 0.134 0.056 0.104 0.130 0.183 0.339 0.145 0.084 0.080 0.054 0.073 64.820 峰6 0.391 0.338 0.288 0.344 0.243 0.408 0.321 0.169 0.271 0.131 0.077 39.430 峰7 0.987 0.201 0.214 0.514 0.385 0.315 0.850 0.405 0.308 0.251 0.482 57.330 峰8 0.375 0.295 0.217 0.584 0.686 0.903 0.376 0.150 0.338 0.143 0.305 59.310 峰9 0.533 0.646 0.316 0.766 2.647 4.610 0.201 0.130 0.674 0.112 0.332 139.510 峰10 0.223 0.058 0.024 0.137 0.259 0.464 0.189 0.008 0.051 0.039 0.023 104.800 峰11 0.225 0.203 0.202 0.236 0.365 0.952 0.079 0.120 0.145 0.112 0.069 101.160 峰12 0.119 0.213 0.234 0.245 0.516 0.872 0.116 0.072 0.117 0.055 0.049 105.050 峰13 0.197 0.181 0.207 0.214 0.376 1.106 0.085 0.107 0.143 0.111 0.061 116.600 峰14 0.055 0.151 0.081 0.096 0.132 0.242 0.064 0.129 0.067 0.047 0.058 57.120 峰15 0.125 0.315 0.186 0.226 0.295 0.477 0.109 0.138 0.179 0.062 0.126 58.660 峰16 1.000 1.000 1.000 1.000 1.000 1.000 1.000 1.000 1.000 1.000 1.000 0 峰17 1.130 0.724 0.667 1.118 0.879 0.891 1.175 0.356 0.943 0.466 0.849 31.770 峰18 0.104 0.101 0.185 0.115 0.241 0.060 0.089 0.224 0.053 0.108 0.087 51.150 峰19 0.551 0.465 0.406 0.497 1.441 1.610 0.265 0.566 0.291 0.253 0.229 79.600 峰20 0.050 0.093 0.222 0.077 0.080 0.171 0.041 0.214 0.047 0.079 0.029 69.220 峰21 0.086 0.169 0.206 0.138 0.095 0.248 0.085 0.079 0.120 0.066 0.058 50.140 峰22 0.096 0.098 0.081 0.120 0.130 0.177 0.105 0.050 0.112 0.069 0.078 33.720 峰23 0.251 0.842 0.321 0.530 0.626 0.594 0.206 0.256 0.418 0.121 0.353 52.610 峰24 0.237 0.280 0.147 0.286 0.324 0.264 0.244 0.138 0.289 0.122 0.176 30.790 峰25 0.445 0.565 0.441 0.730 0.725 0.619 0.486 0.121 0.558 0.243 0.306 40.560 峰26 0.175 0.211 0.243 0.279 0.427 0.832 0.121 0.107 0.199 0.093 0.120 83.960 峰27 0.050 0.045 0.030 0.090 0.161 0.245 0.056 0.006 0.071 0.028 0.027 95.860 峰28 0.063 0.243 0.054 0.177 0.170 0.123 0.049 0.036 0.127 0.018 0.080 68.020 峰29 0.107 0.125 0.092 0.177 0.361 0.428 0.091 0.015 0.109 0.053 0.041 90.430 峰30 0.080 0.390 0.063 0.298 1.373 1.312 0.065 0.019 0.113 0.026 0.030 148.400 峰31 0.071 0.216 0.066 0.163 0.244 0.216 0.065 0.023 0.100 0.030 0.158 64.710 峰32 0.027 0.071 0.019 0.054 0.303 0.210 0.030 0.014 0.032 0.017 0.018 131.430 峰33 0.160 0.445 0.234 0.380 1.852 2.801 0.146 0.036 0.261 0.087 0.075 151.790 峰34 0.114 0.280 0.166 0.312 0.777 1.295 0.117 0.019 0.159 0.054 0.055 128.230 峰35 0.336 1.630 0.399 1.267 6.102 5.469 0.423 0.117 0.603 0.123 0.317 141.670 峰36 0.070 0.330 0.042 0.260 1.421 1.875 0.063 0.004 0.116 0.013 0.021 167.530 峰37 0.153 0.999 0.269 0.774 3.799 5.304 0.195 0.088 0.399 0.071 0.106 159.420 峰38 0.304 0.702 0.221 0.534 3.139 3.099 0.303 0.068 0.400 0.101 0.143 140.610 峰39 0.090 0.447 0.148 0.331 1.801 2.513 0.123 0.022 0.194 0.042 0.033 159.710 峰40 0.084 0.285 0.091 0.199 1.102 1.365 0.043 0.076 0.122 0.021 0.016 151.000 峰41 0.190 0.366 0.232 0.172 1.131 2.101 0.068 0.033 0.226 0.055 0.039 152.190 峰42 0.157 0.322 0.185 0.229 1.672 2.273 0.121 0.028 0.231 0.047 0.052 155.930 峰43 0.065 0.137 0.091 0.109 0.535 1.037 0.049 0.017 0.093 0.027 0.027 157.670 峰44 0.059 0.108 0.068 0.049 0.303 0.650 0.019 0.012 0.062 0.017 0.014 156.080 峰45 0.110 0.234 0.138 0.113 0.747 1.344 0.045 0.020 0.135 0.033 0.025 153.940 峰46 0.083 0.114 0.089 0.161 0.705 1.559 0.064 0.024 0.127 0.032 0.049 170.940 峰47 0.108 0.285 0.176 0.201 1.054 2.412 0.039 0.039 0.161 0.037 0.038 175.050 峰48 0.389 0.878 0.171 0.854 4.399 5.353 0.419 0.045 0.356 0.065 0.162 155.940 -
将试剂盒中Trolox溶液按说明书稀释成梯度浓度,加入反应液、不同浓度的Trolox溶液,并设置空白对照。反应结束后,在相应波长下测出测定孔吸光度Ac、空白孔吸光度Ak,自由基清除率(%)=(1−(Ac−Ak)÷Ak)×100%,以浓度(Y)对DPPH自由基清除率(X)进行线性回归,获得标准回归曲线方程,见表4,以标准回归曲线方程计算得出自由基清除能力。
表 4 自由基标准回归曲线方程
自由基 标准回归曲线方程 r DPPH Y=0.021 8X+0.005 7 0.999 9 ABTS Y=0.447 6X+0.012 4 0.997 3 -
取11批供试品溶液(编号:S1~11,按“2.2.2”项下方法制备)各1 ml,加无水甲醇9 ml稀释10倍;对照孔加入供试品100 μl、无水甲醇150 μl,测定孔加入供试品100 μl、DPPH工作液150 μl,空白孔加入供试品100 μl、DPPH工作液150 μl后混匀,避光室温下静置0.5 h,于540 nm波长处测得对照孔吸光度Ad,测定孔吸光度Ac,空白孔吸光度Ak,DPPH自由基清除率(%)=(1−(Ac-Ad)÷Ak)×100%,供试品DPPH自由基清除能力(mmol/L Trolox)=带入标准回归曲线方程所得Trolox的浓度×10,结果见表5。11批青蒿样品中,样品8(编号:S8)清除DPPH自由基的能力最强。
表 5 青蒿抗氧化活性检测(mmol/L Trolox)
编号 DPPH清除能力 ABTS清除能力 S1 2.725 6.243 S2 1.336 2.025 S3 2.765 4.521 S4 3.110 7.190 S5 1.617 2.848 S6 0.970 0.853 S7 5.057 8.641 S8 6.477 10.453 S9 2.025 2.575 S10 4.731 8.313 S11 5.321 9.848 -
取11批供试品溶液(编号:S1~11,按“2.2.2”项下方法制备)各1 ml,加无水甲醇9 ml稀释10倍;对照孔加入供试品100 μl、无水甲醇150 μl,测定孔加入供试品100 μl、ABTS工作液150 μl,空白孔加入无水乙醇100 μl、ABTS工作液150 μl,混匀置于室温反应6 min,于405 nm波长处测得对照孔吸光度Ad,测定孔吸光度Ac,空白孔吸光度Ak,DPPH自由基清除率(%)=(1−(Ac−Ad)÷Ak)×100%,供试品ABTS自由基清除能力(mmol/L Trolox)=代入标准回归曲线方程所得Trolox的浓度×10,结果见表5。11批青蒿样品中,样品8(编号:S8)清除ABTS自由基的能力最强。
-
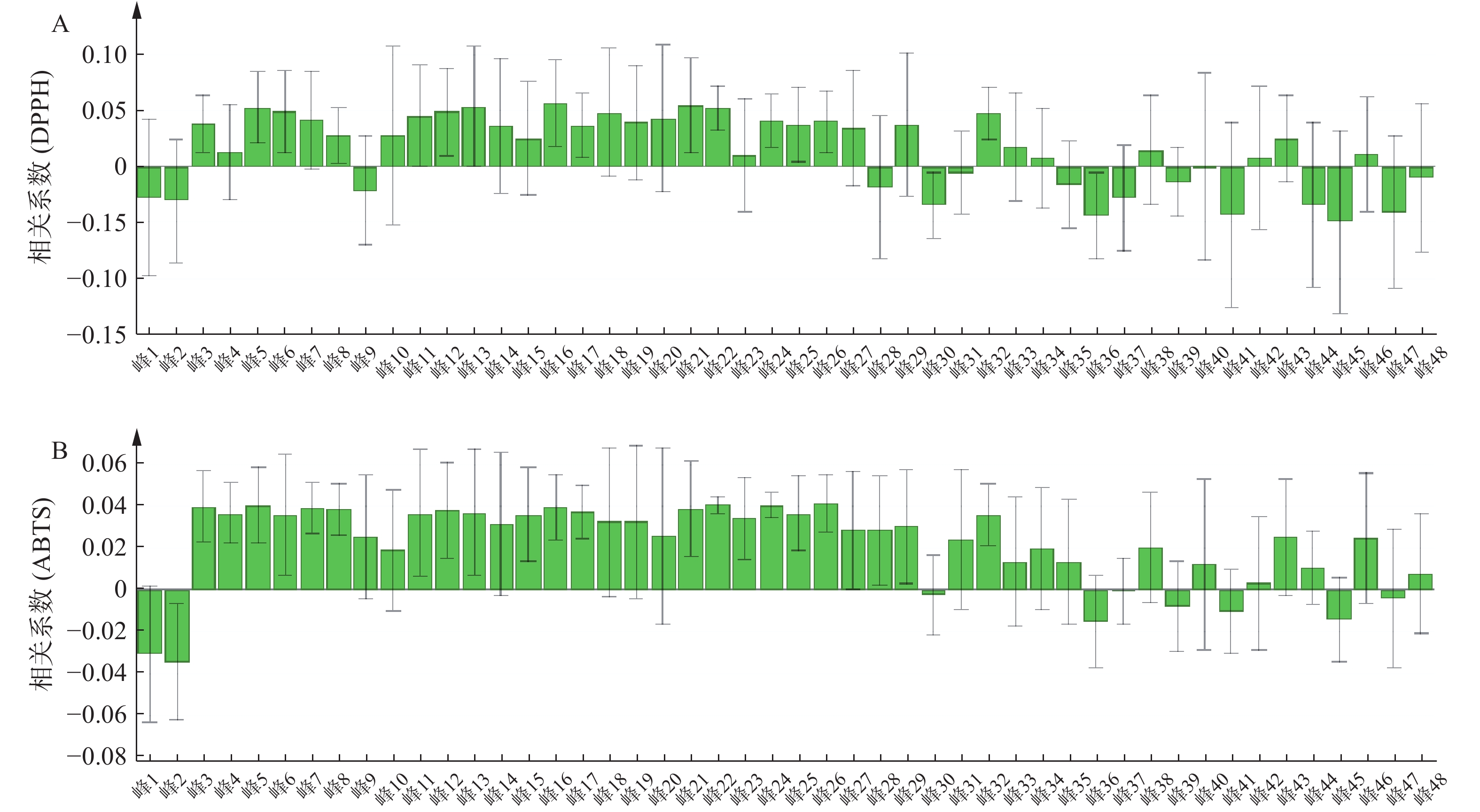
将表5青蒿抗氧化活性结果和表3的相对峰面积数据导入SIMCA 14.1软件构建PLSR模型。结果显示,峰3~峰8、峰10~峰27、峰29、峰32~峰34、峰38、峰40、峰42~峰43、峰46与DPPH自由基清除率呈正相关;峰3~峰29、峰31~峰35、峰38、峰40、峰42~峰44、峰46、峰48与ABTS自由基清除率呈正相关,结果见图4。
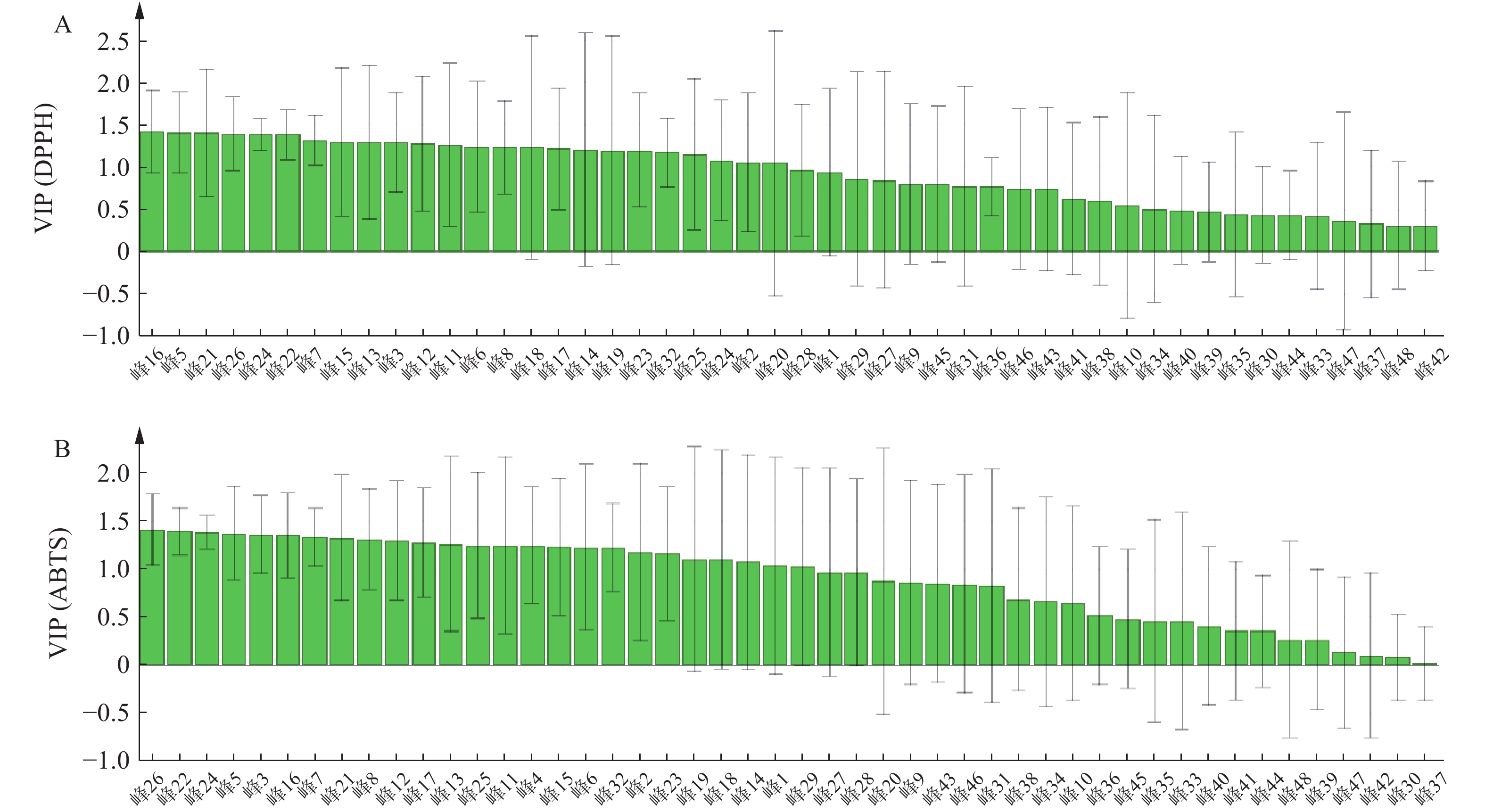
变量投影(VIP)用于评估每个自变量对因变量的重要性,VIP>1表明自变量对因变量的贡献有显著性。筛选出对自由基清除能力呈正相关,且VIP>1的峰。结果显示,青蒿药材样品已明确成分中对DPPH自由基清除能力的贡献大小依次为异绿原酸A(16号峰)>异绿原酸B(15号峰)>滨蒿内酯(14号峰)>异绿原酸C(23号峰);青蒿药材样品已明确成分中对ABTS自由基清除能力的贡献大小依次为异绿原酸A(16号峰)>异绿原酸B(15号峰)>异绿原酸C(23号峰)>滨蒿内酯(14号峰),提示相应成分与青蒿抗氧化能力呈正相关,结果见图5。
-
利用HPLC法测定青蒿药材样品的图谱,能准确、稳定地检测青蒿中的多种有效成分。实验前期研究发现,在乙腈-0.1%磷酸水、甲醇-0.1%磷酸水等流动相中,甲醇-0.1%磷酸水为流动相的分离效果最优,但青蒿素和艾黄素的分离度不佳;随后将水相改为0.2%磷酸水后,分离度得到了提高。研究前期考察了多个波长下各成分的显峰情况,发现在高波长下青蒿素不显峰,故最后选择220 nm为指纹图谱波长,但低波长时显峰较多,在一定程度上影响了几种已知成分的VIP值。
本研究以11批不同地区青蒿为研究对象,采用HPLC法研究其各共有峰与体外抗氧化能力之间的关系,探究青蒿体外抗氧化作用的药效物质基础。结果显示,异绿原酸A、异绿原酸B、异绿原酸C和滨蒿内酯与自由基清除率呈正相关,提示这些成分是青蒿体外抗氧化的药效物质基础。青蒿素是青蒿中的重要成分,有文献研究发现其具有抗氧化的作用[12],也有文献研究发现其可以激活氧化应激[13],而本研究发现青蒿素的抗氧化作用并不明显。推测原因可能在于本研究所用的是基于清除自由基的抗氧化测试方法,青蒿素可能是通过清除自由基之外的途径起到抗氧化作用[14],仍有待今后深入研究。
Study on spectrum-effect relationship based on antioxidant activity of Artemisiae Annuae Herba
-
摘要:
目的 通过考察11批青蒿的高效液相色谱(HPLC)指纹图谱与体外抗氧化活性的谱效关系,筛选出青蒿体外抗氧化作用的药效物质基础成分。 方法 色谱柱为Aglient C18(250 mm×4.6 mm, 5 μm)色谱柱,流动相为0.2%磷酸水-甲醇,流速为1 ml /min;柱温为室温;检测波长为220 nm;进样量为10 μl。以异绿原酸A为参照,采用《中药指纹图谱相似度评价系统》(2012版)确定并记录11批青蒿样品的共有峰。检测不同青蒿样品对DPPH自由基和ABTS自由基的清除效率,作为其抗氧化评价,利用SIMCA14.1软件构建PLSR模型并分析谱效关系。 结果 11批青蒿样品中共检测出48个共有峰,鉴定11个成分,分别为东莨菪内酯、滨蒿内酯、异绿原酸B、异绿原酸A、异绿原酸C、木犀草素、芹菜素、猫眼草黄素、青蒿素、艾黄素和青蒿酸。检测11批青蒿样品的DPPH自由基和ABTS自由基的清除能力,谱效关系显示,异绿原酸A、B、C和滨蒿内酯峰面积与青蒿的DPPH自由基和ABTS自由基清除能力正相关,且变量投影值大于1,表明这些成分在青蒿的体外抗氧化方面有显著贡献。 结论 本研究考察了青蒿中不同物质的体外抗氧化能力,证明异绿原酸A、B、C和滨蒿内酯为青蒿的体外抗氧化活性的药效物质基础。 Abstract:Objective To screen the pharmacodynamic material basic components of Artemisiae Annuae Herba and study its antioxidant activity in vitro by investigating the spectrum-effect relationship between the HPLC fingerprints of 11 batches of Artemisiae Annuae Herba (dried aerial part of Artemisia annua L.). Methods The determination was performed on Aglient C18 column (250 mm×4.6 mm, 5 μm) with mobile phase consisted of 0.2% phosphoric acid solution-Methanol (gradient elution) at the flow rate of 1.0 ml/min. The column temperature was indoor temperature, and detection wavelength was 220 nm, with sample size of 10 μl. Using isochlorogenic acid A as reference, HPLC fingerprints of 11 batches of samples were determined. The common peaks of 11 batches of samples were identified and recorded through TCM chromatographic fingerprint similarity evaluation system (2012 edition). Using scavenging rate of DPPH and ABTS free radical as pharmacodynamic indicators of antioxidant effects, SIMCA 14.1 analysis software was used for PLSR to establish the spectra-effect relationship. Results There were 48 common peaks on 11 batches of sample, 11 components were identified as scopoletin, scoparone, isochlorogenic acid B, A, C, luteolin, apigenin, chrysosplenetin, artemisinin, artemisetin and artemisinic acid. The scavenging activity of 11 batches of samples to DPPH and ABTS free radicals was detected. The spectrum-effect relationship showed that isochlorogenic acid A, B, C and scoparone were positively associated with its antioxidant capacity, and variable projection value was greater than 1. It was suggested that these components were the material basis of antioxidant effect in Artemisiae Annuae Herba. Conclusion This study investigates the antioxidant capacity of different substances in Artemisiae Annuae Herba in vitro, and proves that isochlorogenic acid A,B, C and scoparone play a major role for the antioxidant capacity. -
神经损伤是世界范围内致残和导致死亡的主要原因,神经损伤疾病患病率的大幅增加导致了全社会的健康负担加重[1]。神经损伤主要包括颅脑损伤(TBI)和缺血性脑卒中(CI)等,其中TBI是最常见的神经损伤类型[2],分为急性和慢性两个阶段,炎症是这两个阶段的共同特征,目前还没有有效治疗TBI的药物和方法,迫切需要寻找具有更广泛作用的药物,以缓解TBI后炎症反应[3]。脑缺血是神经损伤患者死亡的最常见病因之一[4],大脑因供血中断而致脑缺血,进而导致中风等神经损伤性疾病[5]。CI诱导了多种细胞死亡形式,如兴奋性毒性、酸毒性和离子失衡、氧化/氧化应激、炎症[6]、凋亡和梗死周围去极化等。目前CI最有效的治疗手段是静脉溶栓和血管内取栓以达到快速再灌注,这两者都能降低患者致残率,但都需要在发病4小时内尽快完成[4],目前尚无有效的药物治疗CI患者。
中药具有多途径、多靶点的特点,已有2000多年的发展历史和临床用药经验[7],如唐·孙思邈所著《备急千金方》中“小续命汤治卒中风欲死”和“大秦艽汤(金·刘完素)治中风”等。因此,阐明在临床上广泛使用的中药的作用机制是本文关注的重点。益母草来自唇形科植物益母草(Leonurus japonicus Houtt)的新鲜或干燥地上部分,临床上主要用于子宫收缩和镇静[8]。现代药理学研究发现其具有子宫收缩、抗炎、镇痛和抗氧化作用等[9]。值得引起关注的是,益母草对神经损伤也有保护作用[10]。然而,关于益母草治疗神经损伤的物质基础和作用机制的研究还未见报道。因此有必要阐明益母草治疗神经损伤的物质基础和作用机制。
本研究旨在利用网络药理学预测益母草的活性成分、靶点及相关通路来探讨其治疗神经损伤的潜在分子机制,为益母草的药理机制深入研究和临床应用提供参考。
1. 材料与方法
1.1 数据库及软件
中药系统药理学分析平台(TCMSP)和中药分子机制的生物信息学分析工具(BATMAN-TCM);活性成分靶标预测数据库(SwissTargetPrediction, STP);人类基因注释数据库(GeneCards);疾病靶点标准化数据库(Uniprot);京都基因与基因组百科全书; 蛋白-蛋白相互作用网络平台(STRING 11.0);Venny2.1软件、Cytoscape 3.6.0软件和在线作图工具微生信。
1.2 益母草活性成分的筛选
通过TCMSP和BATMAN-TCM数据库输入“yimucao”,搜索得到益母草的活性成分, 然后,在TCMSP中设置口服生物利用度(OB)≥30%及药物相似性(DL)≥0.18;在BATMAN-TCM中设置“药物-靶点”相似性模型阀值≥20,调节P值≤0.05,筛选活性成分。
1.3 活性成分靶点的预测和筛选
在获得益母草活性成分的基础上,检索TCMSP和STP数据库,限定种属为“Homo sapiens(人类)”,获取活性成分的作用靶点。通过PubChem数据库来确证收集到的活性成分,将其标准化并下载 SMILES序列。再通过TCMSP数据库搜索确证后的活性成分的靶点,将搜索的靶点按照度值从大到小排列后得到益母草的潜在靶点。在数据库STP中,搜索SMILE式,筛选条件为“概率>0”,删除重复值后预测得到药物的潜在靶点。此外,由于益母草中葫芦巴碱已被证实具有较好的治疗神经损伤作用,故将该化合物也纳入活性成分范围内[11],并通过TCMSP和STP数据库获取其成分靶点。
1.4 疾病相关靶点的筛选
通过GeneCards、DisGenet、OMIM数据库以疾病名称“cerebral ischemia”和“traumatic brain injury”进行检索,获得神经损伤相关靶标。
1.5 药物靶点与疾病靶点标准化及PPI网络构建
利用疾病靶点标准化数据库Uniprot,分别上传上述得到的益母草潜在靶点与神经损伤相关靶点名,获取其靶点的标准基因名以及Uniprot ID。为明确益母草治疗神经损伤疾病的潜在靶点,将二者的靶点上传至Venny 2.1 软件绘制韦恩图,并导出交集的基因。再将筛选得到的共有靶标蛋白上传至STRING平台,选择“multiple proteins”模式,建立药物靶蛋白-疾病靶蛋白相互作用网络,结合分值取中等“medium confidence(≥0.4)”,其余参数默认,利用 Cytoscape3.6.0软件构建益母草治疗神经损伤的PPI网络。利用cytoHubba插件计算 PPI网络每个节点的度值,筛选益母草治疗神经损伤的核心靶点。
1.6 富集分析
在上述STRING中的结果下,选择“Analysis”,点击下载“Biological Process(GO)”“Molecular Function(GO)”“Cellular Component(GO)”“KEGG Pathways”。阈值设置为P≤0.01, 并按照涉及的靶点数目多少进行排序,得到GO气泡图和 KEGG 信号通路条形图。
2. 结果
2.1 益母草活性成分的筛选
通过TCMSP数据库检索到益母草已报道的化学成分,以ADME参数OB≥30%、DL≥0.18进行筛选,得到益母草活性成分8个;BATMAN-TCM数据库检索到10个益母草活性成分;加上文献检索的1个化合物共19个(表1)。再将这19个活性成分输入TCMSP以及STP数据库,搜索的结果经过筛选去除重复项后共得到654个益母草潜在靶点。
表 1 益母草筛选所得活性成分序号 化合物 来源数据库 1 没食子酸 BATMAN-TCM 2 水苏糖 BATMAN-TCM 3 芦丁 BATMAN-TCM 4 月桂酸 BATMAN-TCM 5 水苏碱 BATMAN-TCM 6 益母草素 BATMAN-TCM 7 西班牙夏罗草酮 BATMAN-TCM 8 鸟嘌呤 BATMAN-TCM 9 益母草碱 BATMAN-TCM 10 4-胍基丁醇 BATMAN-TCM 11 鼬瓣花二萜 TCMSP 12 ZINC04073977 TCMSP 13 前益母草二萜 TCMSP 14 异前益母草二萜 TCMSP 15 槲皮苷 TCMSP 16 花生四烯酸 TCMSP 17 异鼠李素 TCMSP 18 山奈酚 TCMSP 19 葫芦巴碱 文献 2.2 疾病靶点的筛选
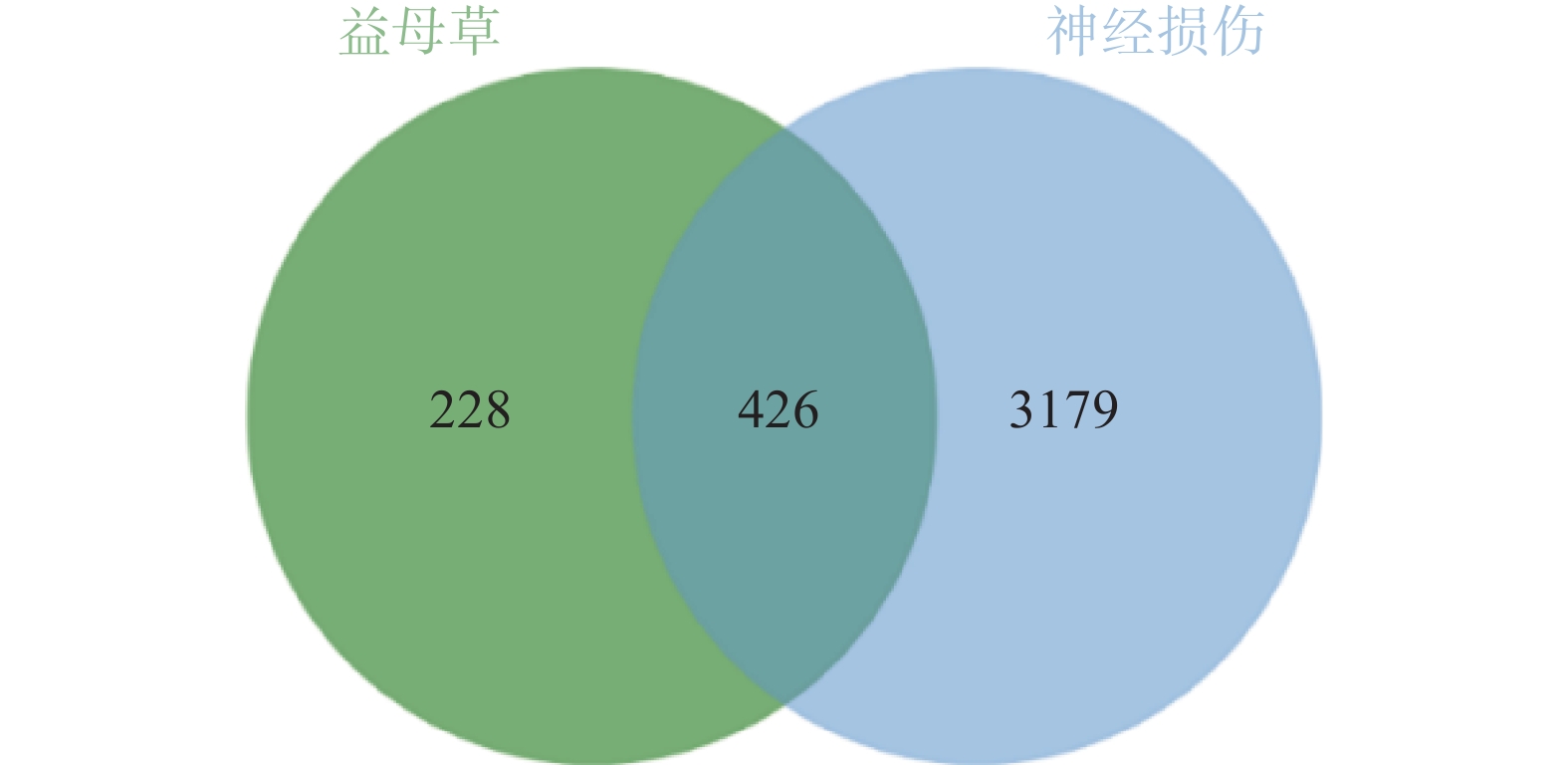
通过GeneCards、DisGenet和OMIM数据库以疾病名称为“cerebral ischemia”和“traumatic brain injury”分别进行检索,在DisGenet数据库中没有检测到TBI靶点,删除重复值后,得到神经损伤的靶点3605个,将疾病相关的靶点与益母草靶点进行Venn交集分析,筛选得到益母草治疗神经损伤的潜在靶点426个,并获得药物-疾病共同靶点基因韦恩图(图1)。
2.3 PPI 网络分析
将益母草治疗神经损伤的426个潜在靶点,导入STRING数据库,将相互作用靶点的结果导入Cytoscape 3.6.0进行可视化分析,得到由331个节点、6955条边共同组成的网络(图2),同时得到网络中关键靶点的度值(表2)。如图2所示,与神经损伤相关度较高的靶点(度值≥139)为丝氨酸/苏氨酸蛋白激酶1(AKT1)、白细胞介素6(IL-6)受体、血管内皮生长因子A(VEGFA)、半胱氨酸蛋白酶3(CASP3)、肿瘤蛋白P53(TP53)、基质金属蛋白酶-9 (MMP9)。度值大的靶点提示在网络调控中起关键作用,这些度值大的靶点很可能是益母草治疗神经损伤的关键靶点。
表 2 益母草治疗神经损伤相关靶点信息基因 度值 靶点名称 数据库中代码 AKT1 225 丝氨酸/苏氨酸蛋白激酶 P31749 IL6 217 白介素6 P05231 VEGFA 196 血管内皮生长因子A P15692 TNF 187 肿瘤生长因子 P01375 TP53 186 细胞肿瘤抗原P53 P04637 SRC 165 原癌基因酪氨酸受体激酶 P12931 CASP3 163 胱天蛋白酶-3 P42574 MAPK1 160 丝裂原活化蛋白激酶1 P28482 CXCL8 157 白介素8 P10145 EGFR 153 表皮生长因子受体 P00533 EGF 150 前表皮生长因子 P01133 PTGS2 146 牛前列腺素G/H合成酶2 P35354 MAPK8 146 丝裂原活化蛋白激酶8 P45983 MYC 146 原癌基因蛋白Myc P01106 JUN 145 转录因子AP-1 P05412 STAT3 143 信号传导及转录激活子3 P40763 FOS 143 原癌基因c-Fos P01100 MMP9 139 基质金属蛋白酶9 P14780 IL-1β 133 白介素1β P01584 2.4 GO生物过程和KEGG通路富集分析
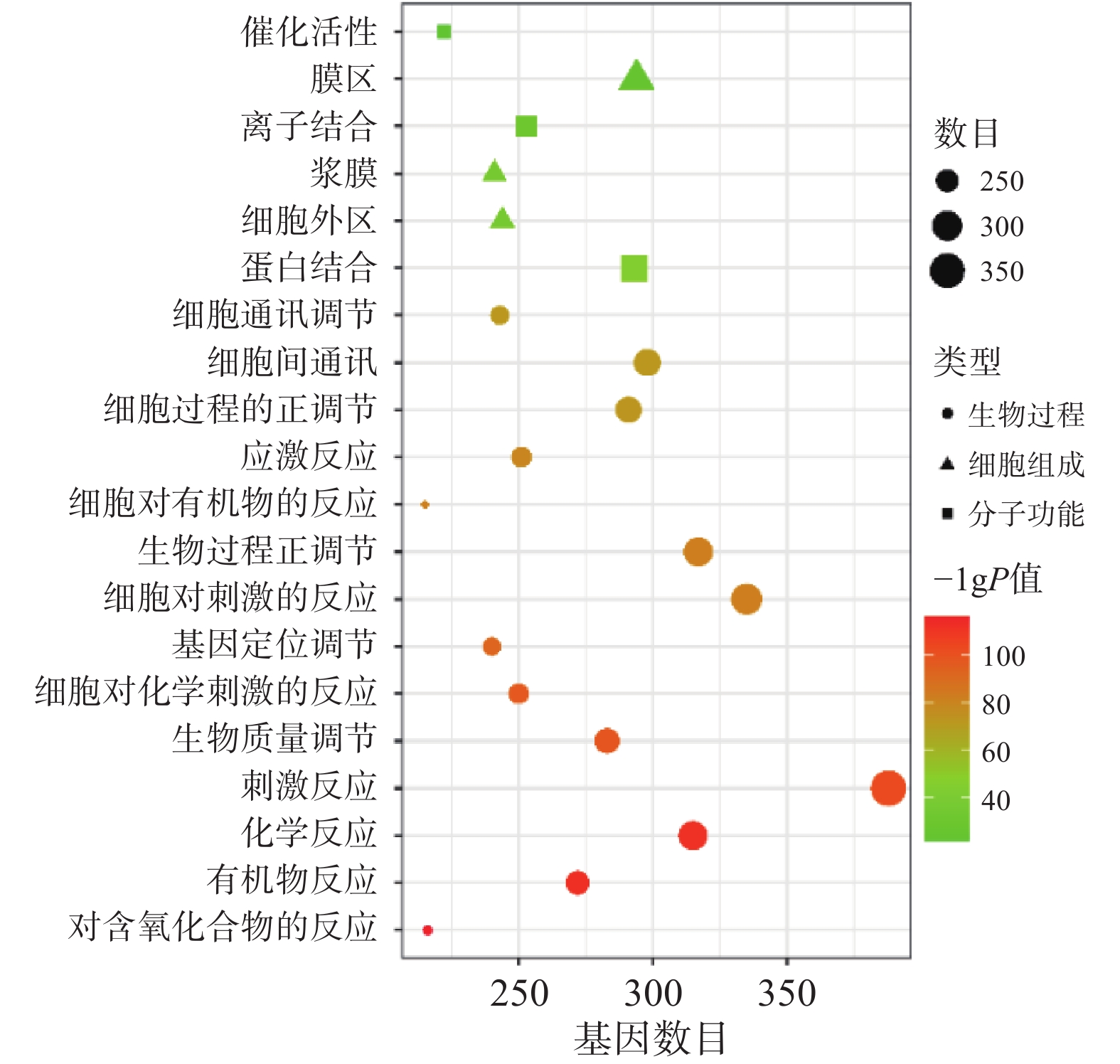
将“2.2” 项下获取的426个潜在的治疗神经损伤的靶点通过STRING进行生物过程(BP)、细胞组分(CC)和分子功能(MF)分析,以 P<0.01为条件,筛选靠前的GO富集分析,如图3所示。图中纵坐标表示富集条目,横坐标表示基因计数,颜色深浅代表-log10(p)值大小。其中 GO-BP 主要为应激反应、生物调节和细胞通讯等;GO-CC主要为细胞膜等;GO-MF主要为蛋白质结合、离子结合和催化还原活性等。
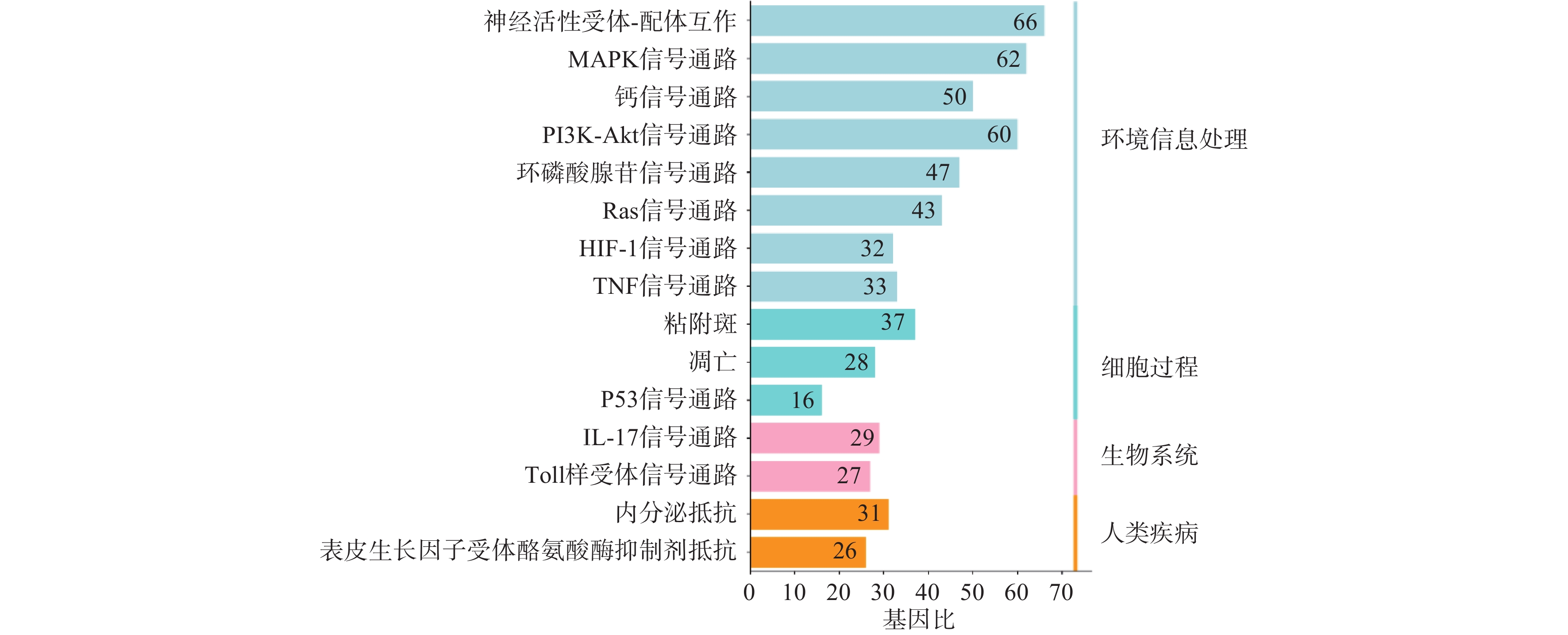
利用STRING数据库对益母草治疗神经损伤的潜在的426个靶点进行富集分析,筛选出显著的前16条信号通路(P<0.01),主要涉及的信号通路为MAPK、Toll样受体、PI3K-Akt、肿瘤坏死因子、IL-17和凋亡等信号通路(图4)。
2.5 药物“活性成分-靶点”网络的构建与分析
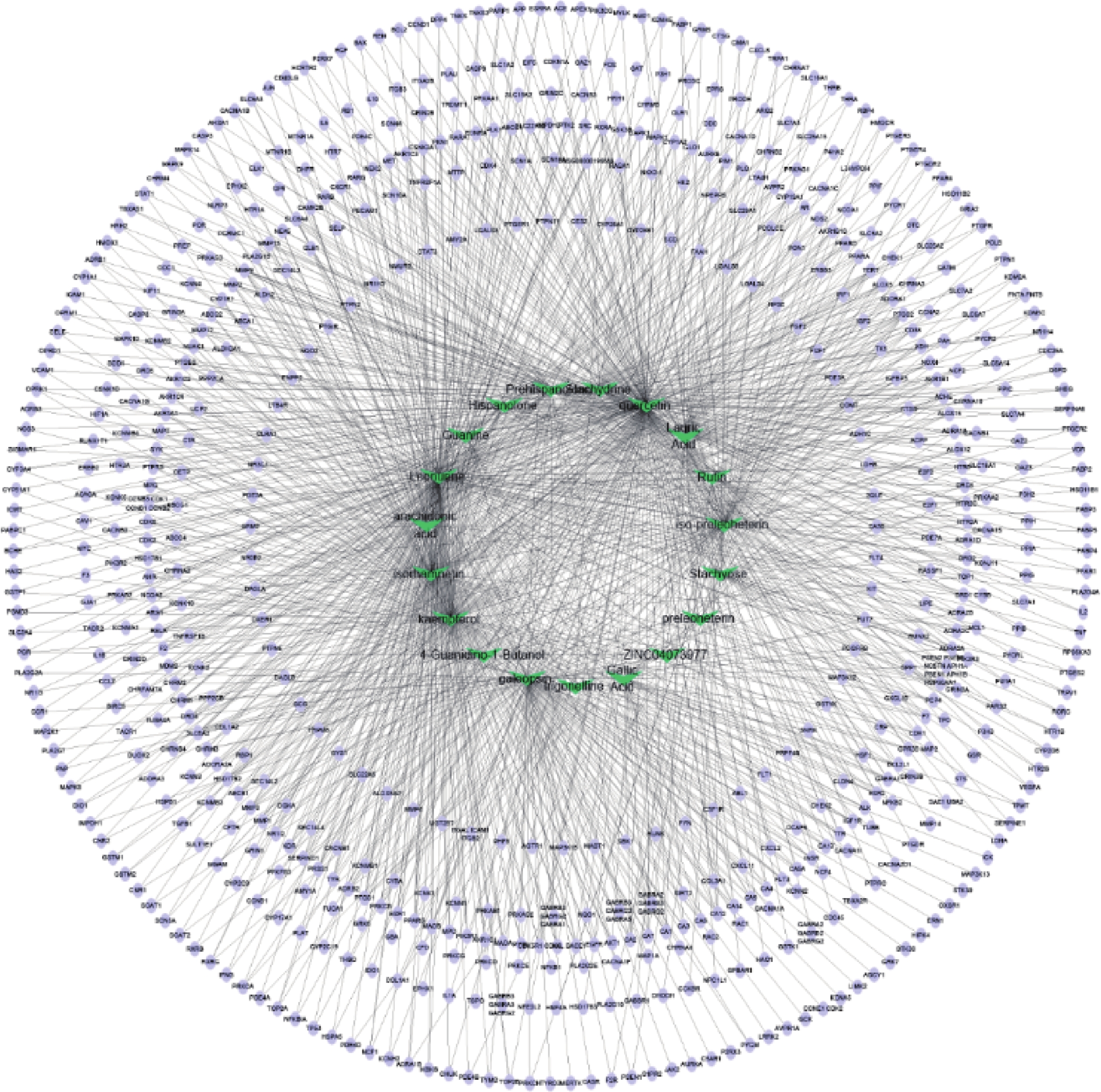
通过Cytoscape3.6.0软件得到药物“活性成分-靶点”的网络(图5)。网络中化合物19个,靶点426个。在图5中,箭头节点代表益母草中化合物,椭圆形节点代表靶点,结果可以明显看出益母草中度值相对较高的化合物有槲皮素、益母草碱、山奈酚、异鼠李素、水苏碱、葫芦巴碱等,这些化合物可能是益母草治疗神经损伤的关键化合物。
3. 讨论
本研究采用网络药理学方法,借助相关数据库以及各种绘图软件对益母草治疗神经损伤的物质基础和作用机制进行研究。共筛选出益母草有效活性成分19个,对应活性成分靶点654个。其中,益母草与神经损伤的共同基因有426个,“药物活性成分-共同靶点”网络与PPI网络结合分析,结果发现,益母草治疗神经损伤的关键活性成分有槲皮素、益母草碱、山奈酚、异鼠李素、水苏碱、葫芦巴碱等,其中槲皮素对脑缺血的作用最为突出。槲皮素通过发挥抗氧化[12]、抗炎和抗凋亡作用[13]对脑缺血的病理学改变产生了积极的治疗作用。益母草碱通过抗氧化、抗凋亡、保护线粒体和激活Nrf-2/HO-1信号通路发挥血脑屏障保护作用[14]。山萘酚具有抗氧化、抗炎、抗癌和预防心血管疾病等多种药理活性[15]。异鼠李素具有保护心脑血管、抗肿瘤、抗炎、抗氧化、保护器官、预防肥胖等作用[16]。水苏碱通过多种分子机制(包括TGF-β、ers介导的细胞凋亡、MMPs/TIMPs、NF-κB和JAK/STAT)抑制细胞外基质(ECM)沉积、降低炎症和氧化应激,以及血管生成保护血管等发挥神经保护作用[17]。葫芦巴碱具有抗凋亡、抗炎、抗氧化、神经保护等多种药理作用,具有改善认知能力的潜力。
根据益母草靶蛋白互作网络图分析可知,益母草治疗神经损伤的核心靶点主要为:AKT1,IL-6,VEGFA,CASP3, TP53,MMP-9。AKT1能够通过丝氨酸和/或苏氨酸磷酸化介导调节细胞代谢、增殖、细胞存活、胰岛素信号传导、生长和血管生成过程。据报道[18]阿托伐他汀通过抑制JNK3/cJun/caspase-3,增强Akt-nNOS信号通路,抑制脑缺血大鼠脑内细胞凋亡,对脑缺血再灌注有保护作用。IL-6可调节多种细胞的生长与分化,具有调节免疫应答、急性期反应及造血功能,并在机体的抗感染免疫反应中起重要作用。IL-6作为促炎细胞因子在脑缺血中的作用可能是通过NF-κB通路来实现的[19]。据报道,LncRNA MEG8通过miR-130a-5p/VEGFA信号靶向减轻缺血性中风后的脑缺血[20],通过靶向VEGFA,下调microRNA-195促进血管生成[21]。Caspase-3(CASP3)是细胞凋亡途径中最关键的酶类之一,与癌症的发生、衰老、心脑血管疾病的发生等有着重要联系。Nahid等[22]研究发现通过降低Bax/Bcl-2比值和caspase-3活化,可减轻脑缺血后海马CA1神经元损伤,改善脑缺血损伤引起的功能和记忆丧失。TP53是神经元凋亡的主要调节因子,任何降低TP53稳定性及其向线粒体迁移的方法都可以减轻缺血性脑区的神经元损失[23]。MMP-9是一种明胶酶,大脑中许多细胞都能分泌MMP-9。MMP-9降解细胞外基质成分,从而引发中风,Zinnhardt等[24]研究发现脑缺血的发生会促进基质金属蛋白酶(MMPs)的产生,尤其是MMP-9,另外MMP-9的激活又可引起血脑屏障受损。
GO功能富集分析发现,益母草治疗神经损伤的基因功能主要体现在生物调节、氧化应激反应、细胞通讯等生物学过程以及蛋白质结合、离子结合和催化还原等。KEGG信号通路富集分析显示,益母草治疗神经损伤所涉及的TNF信号通路、MAPK信号通路、TP53信号通路、PI3K-Akt信号通路的P值较小,被显著富集。TNF具有促进细胞生长、分化、凋亡及诱发炎症等生物学效应。TNF-α可以激活JNK,Caspase蛋白酶和转录因子NF-kB这三条信号通路,实现其免疫调节和细胞凋亡的生物学功能,从而对脑缺血产生影响。级联p38-MAPK的转导通路位于中枢神经系统,在缺血、缺氧等条件刺激下可被激活。可通过p38 MAPK和c-Jun抑制炎症反应,对损伤后的神经有保护作用[25]。Yao等[26]发现通过抑制MAPK信号通路的激活,恢复神经功能,减轻血脑屏障通透性破坏,对脑缺血产生保护作用。缺血神经元释放的内源性配体激活TLR信号通路,导致大量炎症细胞因子TNF-α、IL-1β、iNOS的产生,从而引起脑缺血后继发性炎症损伤。TLRs介导的缺血耐受可作为预防和治疗脑缺血的重要靶点[27]。TP53是一个肿瘤抑制蛋白,调节各种各样基因的表达,包括细胞凋亡等,此外TP53可不依赖其活性,仅作为一个转录因子来引发凋亡通路。抑制NF-κB及下游TP53可显著减轻神经元自噬和凋亡,具有显著的神经保护作用。NF-κB、TP53及其介导的自噬和凋亡在脑缺血再灌注损伤恶化中也起关键作用[28]。PI3K/AKT信号通路是一条与增殖,分化和凋亡相关的信号通路[29]。
综上所述,本研究应用网络药理学的方法预测了益母草治疗神经损伤的主要活性成分和潜在分子机制,但由于所使用平台的数据收录,更新相对滞后,中药活性成分筛选条件口服生物利用度与类药性并不是唯一的标准,因而,研究预测的结果有其局限性。需要在今后的实验研究中进一步阐明和验证益母草中活性成分的作用靶点,从而完善其治疗神经损伤的有效化学成分及作用机制。
-
表 1 药材样品来源信息
序号 产地 序号 产地 S1 河北邯郸 S7 安徽亳州 S2 安徽亳州 S8 江西赣州 S3 河南驻马店 S9 四川自贡 S4 安徽亳州 S10 河南南阳 S5 湖北恩施 S11 重庆市 S6 安徽亳州 表 2 11批中药青蒿样品HPLC图谱共有峰的相对保留时间
编号 S1 S2 S3 S4 S5 S6 S7 S8 S9 S10 S11 RSD(%) 峰1 0.071 0.071 0.071 0.071 0.070 0.070 0.070 0.071 0.070 0.072 0.072 1.060 峰2 0.075 0.075 0.075 0.075 0.075 0.074 0.075 0.075 0.074 0.075 0.075 0.540 峰3 0.303 0.308 0.308 0.309 0.309 0.309 0.310 0.311 0.310 0.310 0.309 0.680 峰4 0.396 0.401 0.401 0.401 0.400 0.401 0.401 0.402 0.402 0.403 0.402 0.450 峰5 0.418 0.423 0.423 0.424 0.424 0.423 0.424 0.425 0.424 0.425 0.425 0.460 峰6 0.433 0.437 0.437 0.437 0.436 0.436 0.436 0.437 0.437 0.439 0.438 0.340 峰7 0.468 0.472 0.472 0.472 0.472 0.472 0.472 0.473 0.473 0.473 0.473 0.300 峰8 0.662 0.667 0.667 0.667 0.667 0.666 0.667 0.668 0.667 0.668 0.668 0.250 峰9 0.717 0.723 0.723 0.723 0.723 0.722 0.724 0.724 0.724 0.724 0.724 0.280 峰10 0.731 0.739 0.738 0.738 0.741 0.737 0.738 0.738 0.738 0.738 0.740 0.340 峰11 0.794 0.796 0.796 0.796 0.796 0.795 0.797 0.797 0.796 0.797 0.797 0.120 峰12 0.810 0.815 0.815 0.815 0.809 0.814 0.815 0.815 0.814 0.817 0.817 0.310 峰13 0.823 0.825 0.825 0.825 0.825 0.824 0.826 0.827 0.825 0.826 0.826 0.130 峰14 0.912 0.912 0.912 0.913 0.911 0.912 0.914 0.914 0.913 0.913 0.914 0.110 峰15 0.983 0.982 0.983 0.983 0.982 0.982 0.983 0.985 0.982 0.984 0.983 0.100 峰16 1.000 1.000 1.000 1.000 1.000 1.000 1.000 1.000 1.000 1.000 1.000 0 峰17 1.038 1.037 1.037 1.037 1.037 1.037 1.037 1.038 1.037 1.038 1.038 0.050 峰18 1.058 1.056 1.058 1.058 1.060 1.060 1.061 1.062 1.060 1.059 1.059 0.160 峰19 1.078 1.079 1.078 1.078 1.075 1.074 1.078 1.079 1.075 1.078 1.079 0.170 峰20 1.133 1.131 1.131 1.131 1.131 1.129 1.130 1.131 1.129 1.132 1.132 0.110 峰21 1.157 1.154 1.157 1.155 1.155 1.156 1.156 1.157 1.154 1.158 1.156 0.110 峰22 1.190 1.190 1.189 1.189 1.190 1.192 1.188 1.189 1.187 1.189 1.192 0.130 峰23 1.199 1.198 1.198 1.198 1.198 1.198 1.199 1.199 1.197 1.198 1.198 0.050 峰24 1.215 1.214 1.214 1.214 1.213 1.213 1.213 1.215 1.212 1.214 1.214 0.070 峰25 1.246 1.244 1.244 1.244 1.243 1.242 1.243 1.244 1.242 1.244 1.245 0.100 峰26 1.307 1.306 1.306 1.307 1.306 1.305 1.306 1.308 1.306 1.306 1.308 0.070 峰27 1.452 1.453 1.450 1.450 1.450 1.450 1.450 1.453 1.449 1.448 1.449 0.110 峰28 1.464 1.462 1.463 1.463 1.464 1.463 1.464 1.465 1.461 1.461 1.460 0.110 峰29 1.497 1.493 1.495 1.495 1.492 1.492 1.495 1.500 1.492 1.494 1.494 0.160 峰30 1.656 1.655 1.656 1.653 1.648 1.645 1.648 1.649 1.647 1.658 1.659 0.300 峰31 1.665 1.665 1.672 1.663 1.659 1.657 1.657 1.658 1.656 1.667 1.667 0.320 峰32 1.718 1.718 1.717 1.716 1.711 1.709 1.710 1.711 1.708 1.719 1.721 0.270 峰33 1.752 1.752 1.751 1.748 1.743 1.738 1.738 1.740 1.739 1.754 1.756 0.400 峰34 1.770 1.770 1.769 1.767 1.762 1.758 1.758 1.759 1.758 1.772 1.775 0.360 峰35 1.833 1.834 1.833 1.830 1.825 1.821 1.821 1.822 1.820 1.835 1.838 0.360 峰36 1.893 1.894 1.893 1.890 1.884 1.879 1.879 1.880 1.879 1.896 1.900 0.420 峰37 1.942 1.943 1.942 1.939 1.932 1.927 1.927 1.928 1.928 1.945 1.949 0.430 峰38 1.950 1.950 1.949 1.946 1.939 1.934 1.934 1.935 1.935 1.953 1.956 0.430 峰39 2.027 2.027 2.026 2.023 2.015 2.010 2.009 2.011 2.011 2.030 2.034 0.460 峰40 2.036 2.036 2.032 2.031 2.024 2.019 2.018 2.016 2.020 2.039 2.043 0.470 峰41 2.102 2.102 2.101 2.097 2.090 2.084 2.084 2.085 2.085 2.105 2.109 0.450 峰42 2.117 2.116 2.114 2.111 2.103 2.097 2.097 2.097 2.098 2.119 2.122 0.470 峰43 2.156 2.155 2.153 2.149 2.141 2.135 2.134 2.135 2.136 2.157 2.161 0.490 峰44 2.226 2.224 2.223 2.219 2.211 2.204 2.204 2.205 2.205 2.226 2.230 0.470 峰45 2.233 2.232 2.230 2.226 2.218 2.212 2.211 2.213 2.212 2.234 2.238 0.470 峰46 2.267 2.265 2.263 2.259 2.250 2.243 2.243 2.244 2.244 2.265 2.270 0.490 峰47 2.329 2.327 2.325 2.321 2.312 2.306 2.304 2.306 2.306 2.328 2.332 0.480 峰48 2.363 2.362 2.36 2.355 2.346 2.339 2.338 2.340 2.340 2.363 2.367 0.490 共有峰/总峰 0.837 0.815 0.778 0.821 0.811 0.834 0.864 0.776 0.823 0.806 0.838 表 3 11批中药青蒿样品HPLC图谱共有峰的相对峰面积
编号 S1 S2 S3 S4 S5 S6 S7 S8 S9 S10 S11 RSD(%) 峰1 0.221 0.718 0.167 0.215 6.001 18.615 0.134 0.037 0.545 0.046 0.033 232.240 峰2 0.539 2.042 0.539 0.505 11.735 36.124 0.337 0.055 1.571 0.192 0.041 223.380 峰3 0.065 0.102 0.060 0.131 0.300 0.356 0.050 0.035 0.070 0.032 0.028 100.170 峰4 0.066 0.061 0.059 0.088 0.121 0.476 0.033 0.015 0.064 0.021 0.026 139.490 峰5 0.134 0.056 0.104 0.130 0.183 0.339 0.145 0.084 0.080 0.054 0.073 64.820 峰6 0.391 0.338 0.288 0.344 0.243 0.408 0.321 0.169 0.271 0.131 0.077 39.430 峰7 0.987 0.201 0.214 0.514 0.385 0.315 0.850 0.405 0.308 0.251 0.482 57.330 峰8 0.375 0.295 0.217 0.584 0.686 0.903 0.376 0.150 0.338 0.143 0.305 59.310 峰9 0.533 0.646 0.316 0.766 2.647 4.610 0.201 0.130 0.674 0.112 0.332 139.510 峰10 0.223 0.058 0.024 0.137 0.259 0.464 0.189 0.008 0.051 0.039 0.023 104.800 峰11 0.225 0.203 0.202 0.236 0.365 0.952 0.079 0.120 0.145 0.112 0.069 101.160 峰12 0.119 0.213 0.234 0.245 0.516 0.872 0.116 0.072 0.117 0.055 0.049 105.050 峰13 0.197 0.181 0.207 0.214 0.376 1.106 0.085 0.107 0.143 0.111 0.061 116.600 峰14 0.055 0.151 0.081 0.096 0.132 0.242 0.064 0.129 0.067 0.047 0.058 57.120 峰15 0.125 0.315 0.186 0.226 0.295 0.477 0.109 0.138 0.179 0.062 0.126 58.660 峰16 1.000 1.000 1.000 1.000 1.000 1.000 1.000 1.000 1.000 1.000 1.000 0 峰17 1.130 0.724 0.667 1.118 0.879 0.891 1.175 0.356 0.943 0.466 0.849 31.770 峰18 0.104 0.101 0.185 0.115 0.241 0.060 0.089 0.224 0.053 0.108 0.087 51.150 峰19 0.551 0.465 0.406 0.497 1.441 1.610 0.265 0.566 0.291 0.253 0.229 79.600 峰20 0.050 0.093 0.222 0.077 0.080 0.171 0.041 0.214 0.047 0.079 0.029 69.220 峰21 0.086 0.169 0.206 0.138 0.095 0.248 0.085 0.079 0.120 0.066 0.058 50.140 峰22 0.096 0.098 0.081 0.120 0.130 0.177 0.105 0.050 0.112 0.069 0.078 33.720 峰23 0.251 0.842 0.321 0.530 0.626 0.594 0.206 0.256 0.418 0.121 0.353 52.610 峰24 0.237 0.280 0.147 0.286 0.324 0.264 0.244 0.138 0.289 0.122 0.176 30.790 峰25 0.445 0.565 0.441 0.730 0.725 0.619 0.486 0.121 0.558 0.243 0.306 40.560 峰26 0.175 0.211 0.243 0.279 0.427 0.832 0.121 0.107 0.199 0.093 0.120 83.960 峰27 0.050 0.045 0.030 0.090 0.161 0.245 0.056 0.006 0.071 0.028 0.027 95.860 峰28 0.063 0.243 0.054 0.177 0.170 0.123 0.049 0.036 0.127 0.018 0.080 68.020 峰29 0.107 0.125 0.092 0.177 0.361 0.428 0.091 0.015 0.109 0.053 0.041 90.430 峰30 0.080 0.390 0.063 0.298 1.373 1.312 0.065 0.019 0.113 0.026 0.030 148.400 峰31 0.071 0.216 0.066 0.163 0.244 0.216 0.065 0.023 0.100 0.030 0.158 64.710 峰32 0.027 0.071 0.019 0.054 0.303 0.210 0.030 0.014 0.032 0.017 0.018 131.430 峰33 0.160 0.445 0.234 0.380 1.852 2.801 0.146 0.036 0.261 0.087 0.075 151.790 峰34 0.114 0.280 0.166 0.312 0.777 1.295 0.117 0.019 0.159 0.054 0.055 128.230 峰35 0.336 1.630 0.399 1.267 6.102 5.469 0.423 0.117 0.603 0.123 0.317 141.670 峰36 0.070 0.330 0.042 0.260 1.421 1.875 0.063 0.004 0.116 0.013 0.021 167.530 峰37 0.153 0.999 0.269 0.774 3.799 5.304 0.195 0.088 0.399 0.071 0.106 159.420 峰38 0.304 0.702 0.221 0.534 3.139 3.099 0.303 0.068 0.400 0.101 0.143 140.610 峰39 0.090 0.447 0.148 0.331 1.801 2.513 0.123 0.022 0.194 0.042 0.033 159.710 峰40 0.084 0.285 0.091 0.199 1.102 1.365 0.043 0.076 0.122 0.021 0.016 151.000 峰41 0.190 0.366 0.232 0.172 1.131 2.101 0.068 0.033 0.226 0.055 0.039 152.190 峰42 0.157 0.322 0.185 0.229 1.672 2.273 0.121 0.028 0.231 0.047 0.052 155.930 峰43 0.065 0.137 0.091 0.109 0.535 1.037 0.049 0.017 0.093 0.027 0.027 157.670 峰44 0.059 0.108 0.068 0.049 0.303 0.650 0.019 0.012 0.062 0.017 0.014 156.080 峰45 0.110 0.234 0.138 0.113 0.747 1.344 0.045 0.020 0.135 0.033 0.025 153.940 峰46 0.083 0.114 0.089 0.161 0.705 1.559 0.064 0.024 0.127 0.032 0.049 170.940 峰47 0.108 0.285 0.176 0.201 1.054 2.412 0.039 0.039 0.161 0.037 0.038 175.050 峰48 0.389 0.878 0.171 0.854 4.399 5.353 0.419 0.045 0.356 0.065 0.162 155.940 表 4 自由基标准回归曲线方程
自由基 标准回归曲线方程 r DPPH Y=0.021 8X+0.005 7 0.999 9 ABTS Y=0.447 6X+0.012 4 0.997 3 表 5 青蒿抗氧化活性检测(mmol/L Trolox)
编号 DPPH清除能力 ABTS清除能力 S1 2.725 6.243 S2 1.336 2.025 S3 2.765 4.521 S4 3.110 7.190 S5 1.617 2.848 S6 0.970 0.853 S7 5.057 8.641 S8 6.477 10.453 S9 2.025 2.575 S10 4.731 8.313 S11 5.321 9.848 -
[1] 张兴. 认识身边的中药: 青蒿[J]. 中医健康养生, 2021, 7(4):26-27. [2] 徐明霞. 青蒿素及其衍生物在动物生产中的应用研究[J]. 饲料研究, 2021, 44(4):147-149. [3] SKOWYRA M, GALLEGO M G, SEGOVIA F, et al. Antioxidant properties of Artemisia annua extracts in model food emulsions[J]. Antioxidants (Basel), 2014, 3(1):116-128. doi: 10.3390/antiox3010116 [4] 赖立勇, 徐圣焱, 夏天爽, 等. 基于抗氧化机制的中药及其化学成分在骨质疏松中的应用[J]. 海军军医大学学报, 2022(8):943-950. [5] 国家药典委员会. 中华人民共和国药典-一部: 2020年版[M]. 北京: 中国医药科技出版社, 2020. [6] 张秋红, 朱子微, 李晋, 等. 中药青蒿化学成分与种植研究现状[J]. 中国医药导报, 2011, 8(19):10-12. doi: 10.3969/j.issn.1673-7210.2011.19.004 [7] WANG Q, XIAO L. Isochlorogenic acid A attenuates acute lung injury induced by LPS via Nf-κB/NLRP3 signaling pathway[J]. Am J Transl Res, 2019, 11(11):7018-7026. [8] SROKA Z, CISOWKI W. Hydrogen peroxide scavenging, antioxidant and anti-radical activity of some phenolic acids[J]. Food Chem Toxicol, 2003, 41(6):753-758. doi: 10.1016/S0278-6915(02)00329-0 [9] WITAICENIS A, SEITO L N, DA SILVEIRA CHAGAS A, et al. Antioxidant and intestinal anti-inflammatory effects of plant-derived coumarin derivatives[J]. Phytomedicine, 2014, 21(3):240-246. doi: 10.1016/j.phymed.2013.09.001 [10] 刘晓燕, 蒋益萍, 张嘉宝等. 啤酒花的HPLC指纹图谱建立及其抗氧化作用谱效关系研究[J]. 中国药房, 2020, 31(02):138-143. doi: 10.6039/j.issn.1001-0408.2020.02.03 [11] 朱亚莹, 吴啟南, 段慧芳等. 青蒿UPLC指纹图谱的建立与多种成分含量测定[J]. 中药材, 2019, 42(10):2323-2329. [12] YAN F X, WANG H T, GAO Y, et al. Artemisinin protects retinal neuronal cells against oxidative stress and restores rat retinal physiological function from light exposed damage[J]. ACS Chem Neurosci, 2017, 8(8):1713-1723. doi: 10.1021/acschemneuro.7b00021 [13] EFFERTH T. From ancient herb to modern drug: Artemisia annua and artemisinin for cancer therapy[J]. Semin Cancer Biol, 2017, 46:65-83. doi: 10.1016/j.semcancer.2017.02.009 [14] JONE D P. Radical-free biology of oxidative stress[J]. Am J Physiol Cell Physiol, 2008, 295(4):C849-68. doi: 10.1152/ajpcell.00283.2008 -





 下载:
下载:

 下载:
下载: