-
核糖体蛋白(RP)是指构成核糖体的蛋白质,其与rRNA或核糖体亚基紧密连接,需高浓度盐和强解离剂(如3 mol/L LiCl或4 mol/L 尿素)才能将其分离。目前,已发现的RP有80多种,根据大小亚基的不同,RP可分为核糖体大亚基蛋白(RPL)和核糖体小亚基蛋白(RPS)[1]。RP主要有两种作用,一是参与核糖体的组装和蛋白质的生物合成,二是具有独立于核糖体的功能,称为核糖体外功能[2]。
-
RP是核糖体的重要组成部分,在核糖体生物合成和蛋白质翻译中起关键作用。根据蛋白质的结构特点,RP可分为α-蛋白质、β-蛋白质、α/β-蛋白质和α+β-蛋白质[3]。RP与rRNAs的几个结构域相互作用,形成域间连接,有助于维持核糖体组装的结构完整性[3]。
所有RP mRNA都具有5’末端寡嘧啶(TOP)片段,因此,调控TOP mRNA的翻译,可影响RP的表达[4]。研究发现,La蛋白能与TOP mRNA物理结合;microRNA、miR-10a等表观遗传因子能与5’非翻译区结合来促进翻译[4]。除此之外,许多RP还会经历包括磷酸化、泛素化、甲基化、乙酰化和SUMO化等翻译后修饰[5],这些翻译后修饰可能受环境因素的影响,也可能是基础性的,它们会赋予RP核糖体外功能。
-
RP除了参与核糖体的组装之外,还具有许多核糖体外功能,如调控基因表达、细胞增殖、分化、凋亡、DNA修复和其他多种细胞过程。
-
据报道,RP能调控特定基因的表达,如与病毒蛋白反应,阻碍病毒的转录或翻译过程[6]。除此之外,RP也能通过反馈机制,调节其自身基因的表达。有研究证明,RPL10a可直接与保守的特定元件结合,在负反馈过程中调节其自身pre mRNA的选择性剪接[7]。除此之外,RPS3、RPL11、RPL7等也具有调控基因表达的作用。
-
RP可影响细胞周期进程。细胞周期分为间期和有丝分裂期两个阶段,其中间期又分为DNA合成前期(G1期)、DNA合成期(S期)与DNA合成后期(G2期)。据报道,RPS3、RPL7、RPL15、RPS9等与细胞周期紊乱密不可分。RPS3在细胞周期的G2/M期能够与α-微管蛋白相互作用,其异常会破坏α-微管蛋白动力学,如RPS3低表达会出现有丝分裂中纺锤体形成异常、子细胞无法完全分离和脱落的现象[8],从而影响细胞周期进程。
-
细胞凋亡是细胞抵抗内在和外在压力造成不可修复损伤的主要防御机制之一。RPS29、RPL35a、RPS3等能够调控细胞凋亡。未磷酸化的RPS6可通过肿瘤坏死因子相关凋亡诱导配体(TNF-related apoptosis-inducing ligand,TRAIL),诱导细胞凋亡[9]。在调节细胞凋亡时,有些RP具有促凋亡的作用,而有一些RP是细胞凋亡的负调节剂。在高危骨髓增生异常综合征患者中,RPL23的表达与CD34+骨髓细胞凋亡呈负相关,其低表达能诱导细胞凋亡,引起G1/S细胞周期阻滞,抑制SKM-1/K562细胞活力[10]。
-
DNA的任何损伤都会破坏基因组的完整性,这对细胞来说是致命的,因此,DNA损伤修复过程至关重要。据报道,RP如RPS3、RPL3、RPL6、RPS27等可作为DNA损伤调节因子,参与DNA损伤修复过程。RPS3位于氧化性DNA损伤位点,能够与BER、APEX1和8-氧鸟嘌呤DNA糖基化酶(8-oxoguanine DNA glycosylase-1,OGG1)相互作用,增加OGG1糖基化酶的活性,有助于DNA的损伤修复[11]。
-
细胞增殖是生物体的重要生命特征,RP对细胞增殖的调节作用与癌症发生和进展联系密切。体外研究发现,RPL34是肿瘤细胞增殖所必需的,其能够促进胶质母细胞瘤细胞的存活,加重肿瘤恶性程度[12]。此外,RPL22的低表达能够激活MDM2-p53信号传导,促进MKN-45细胞的增殖[13]。许多研究证明,RPL23、RPS5、RPS15a等也可影响细胞增殖过程。
-
RP在调节细胞迁移和侵袭中发挥着不可或缺的作用。研究表明,RPLP1在肝细胞癌组织中高表达,其下调能显著抑制人肝癌细胞Hep3b细胞的迁移和侵袭[14]。此外,下调RPL34可明显降低胶质瘤细胞中p-JAK和p-STAT3的水平,其低表达可能是通过诱导JAK/STAT3信号通路的失活,抑制胶质瘤细胞的增殖和迁移[15]。据报道,RPS27、RPL23、RPS6等RP也可介导细胞的迁移与侵袭。
-
据报道,RP的失调与细胞恶性转化有关。在人类急性T淋巴细胞白血病中,RPL22单等位基因的缺失诱导T系祖细胞转化,最终加速胸腺淋巴瘤的发展。除此之外,RPLP1、RPL36a、RPL34也可诱导细胞转化,使疾病进一步恶化[16]。
-
血管生成,是从预先存在的脉管系统中形成新血管,与疾病的进展密切相关。许多RP如RPS19、RPL29、RPS6、RPS15a等能够通过调控血管生成来影响疾病的发展。研究表明,RPS15a可通过增强Wnt/β-catenin诱导的FGF18表达,促进肝细胞肝癌中的血管生成。[17]体外研究发现,诱导Huh7细胞过表达RPS15a,其能够以旁分泌方式,增加HUVEC的血管生成潜力。体内实验证明,抑制肝细胞肝癌异种移植瘤中RPS15a的表达,能够抑制肿瘤血管生成,进而阻碍肿瘤生长。
-
由于RP在蛋白质合成中起着至关重要的作用,而蛋白质是组织的基本构成要素,因此,编码RP的基因异常会影响器官形成、红细胞生成和其他多种生理功能,引起不同器官或系统疾病。
-
RP是形成组织或器官所必需的,因此,其能够影响特定组织的发育过程。据报道,RPL23和RPL6是胰腺正常发育所必需的,其突变会导致严重的发育缺陷,引起胚胎致死[18]。此外,果蝇基因组编码的RPS5旁系同源物RPS5b的缺失会导致雌性不育,从而引起卵室发育停滞、卵黄生成中断和后卵泡细胞增生[19]。在斑马鱼实验中,研究发现大量敲除RP如RPS19、RPS24、RPL22、RPL11同样会导致发育异常[20-23]。
-
一些RP与心血管和代谢疾病的发生和发展有关。蛋白质相互作用网络发现,RPL9和RPL26可能是急性心肌梗死(AMI)的关键蛋白。RT-PCR检测发现,相较于对照组,AMI组外周血中RPL9和RPL26的表达水平均降低,这与生物信息学分析一致[24]。S4Y1在人脐静脉内皮细胞中的过表达能够诱导细胞凋亡,产生炎症反应并抑制细胞迁移和血管形成,导致高糖诱导的功能障碍[25],因此,S4Y1可能是治疗糖尿病并发症的潜在治疗靶点。除此之外,与心血管和代谢疾病密切相关的RP还有多种,如RPL17、RPL23、RPS6、RPS19、RPS24、RPL23a等。
-
由RP或与Pol I转录和rRNA加工相关的基因突变,导致核糖体生物合成或功能缺陷,引发的疾病,称为核糖体病。核糖体病是一组罕见的遗传性疾病,包括先天性纯红细胞再生障碍性贫血(Diamond-Blackfan Anemia,DBA)、散发型先天性无脾(isolated congenital asple- nia,ICA)和骨髓增生异常综合征的亚型5q综合征等。
编码RP的基因的突变,影响核糖体的组装和rRNA的加工,从而引发核糖体病。在ICA和5q综合征中,RP基因突变会使得pre 40S核糖体亚基组装和18S rRNA加工受到影响,如RPS14的单倍体不足是导致5q综合征的关键因素,其下调使30S pre-rRNA种类增多,降低18S/18SE rRNA水平,增加30S/18SE比率,影响18S pre-rRNA加工[26],RPSA的外显子突变能够影响蛋白质翻译,进而导致ICA等[27];RPS19编码基因的突变是DBA中最先发现的,也是最常见的突变,而RPL5、RPS26和RPL11等编码基因的突变,同样与DBA密切相关[2],在DAB中,RP基因突变会影响pre 40S和pre 60S核糖体亚基组装,以及破坏pre rRNA加工。
-
鼠双微蛋白2(mouse double minute 2,MDM2)/p53信号通路在细胞生长、增殖以及凋亡过程中发挥关键作用,RP可通过作用于该信号通路影响癌症的发生与发展。MDM2是导致p53降解的泛素连接酶,可与包括RPL15、RPS27a、RPS7、RPL11等特异性结合。P53在细胞生长和分裂过程中维持基因组稳定至关重要,在大多数人类癌症中,存在p53突变或活性丧失。研究发现,RPL15的低表达能够抑制MDM2的泛素化,使p53激活,从而导致p53依赖性细胞的增殖、集落形成、迁移和侵袭[28],最终抑制癌细胞的生长。因此,RP可通过调控MDM2/p53通路,进而影响癌细胞的生长。此外,RPS27a的低表达能够削弱RPS27a和RPL11之间的相互作用,并以RPL11依赖性方式稳定p53,抑制细胞活力,从而导致细胞周期停滞和细胞凋亡[29]。除了激活p53通路外,一些RP还可以通过调节癌基因c-Myc或与其他信号通路如mTOR、NF-κB、wnt/β-catenin和let-7a等相互作用影响癌症的发生和发展[30]。
除上所述,新生血管可以有效地促进营养和氧气的供应,并处理肿瘤代谢废物,对癌细胞的生存同样至关重要。RPL17是一种血管平滑肌细胞(VSMC)生长抑制剂,能够抑制VSMC细胞周期进程和生长,可能在抑制血管生成中发挥作用[31],具有潜在的抗肿瘤作用,但其机制仍有待阐明。
-
RP参与细胞生长、增殖和代谢,可作为人类疾病诊断和预后潜在的生物标志物和治疗靶点。
-
目前,许多癌症中均存在RP差异表达的现象[32]。据报道,RPL23a、RPS2、RPL39等多种RP在肝细胞肝癌中表达上调。此外,目前已发现RPS8、RPS9、RPS27a和RPL23这四种RP基因在鼻咽癌细胞系中表达下调。不仅如此,RP在肺癌中也起着关键作用,如RPL9在不同类型的肺癌组织中过表达,尤其在小细胞肺癌中表达最高。除此之外,在其他癌症中包括结直肠癌、前列腺癌、乳腺癌等也发现RP的异常表达。因此,RP可作为癌症的生物标志物。
-
许多DBA患者表现出RPS19缺陷,研究发现,EFS-RPS19可用于RPS19缺陷型DBA患者的临床基因治疗[33]。此外,临床上治疗DBA的药物,如达那唑,能够抑制垂体促性腺激素,对DBA患者的血红蛋白水平有积极作用,可用于治疗DBA。除了达那唑,L-亮氨酸、Sotatercept、TFP和EPAG也已经在进行临床试验中[34]。对于5q综合征患者,目前主要使用来那度胺,其能够通过增加MDM2 Ser166/186的磷酸化,使p53降解增加,从而达到治疗的目的[35]。然而,长期p53失活可能增加各种癌症的患病风险,因此,迫切需要寻找其替代方案。
-
据报道,核糖体蛋白与缺血性脑卒中的发病率密切相关,RPS3、RPS15可能是调控急性缺血性脑卒中的关键调节蛋白[36]。研究发现,RPS3能够通过与E2F1转录因子相互作用,诱导促凋亡蛋白BH3-only、Bim和D p5/HRK的表达,导致神经元凋亡。此外,研究还发现,RP与帕金森病的发展联系密切。LRRK2中的G2019S突变会导致翻译缺陷,而磷酸化的RPS15能够与LRRK2结合,增强神经元5'UTR的mRNA的翻译,缓解哺乳动物大脑中的钙失调[37]。
-
RPS19能够通过降低MIF活性,激活ERK和NF-κB信号通路,抑制肾小球新月体形成、肾小球坏死和进行性肾功能障碍,从而阻断肾小球基底膜和肾小球肾炎的发展[38]。此外,RPS19也能够通过下调TNF-α和MCP-1的表达,减少F4/80+巨噬细胞、中性粒细胞和CD3+T细胞在肾脏中的浸润,抑制MIF/CD74/NF-κB介导的肾脏炎症,从而减轻顺铂诱导的急性肾损伤[39]。
-
pol I调控rDNA转录生成rRNA,是核糖体生物合成的限速步骤,在癌症的进展中起着核心作用。pol I活性异常增加,会破坏核仁的核糖体外功能,使核糖体合成不受控制,导致细胞恶性增殖。因此,pol I是选择性抑制癌细胞生长的极佳靶标。目前已研究出几种Pol I 转录抑制剂用于癌症治疗,包括ML-246、CX-3543、CX-5461、BMH-21。CX-5461是第一个完成I期临床试验的pol I抑制剂,其主要通过与起始前复合蛋白SL1竞争rDNA启动子来抑制Pol I转录。BMH-21是最新发现的pol I抑制剂,其通过结合rDNA,抑制转录起始和延伸[40]。
如前所述,调控RP表达可影响癌细胞的生长。MiR-449a受到PEG10的负调控,并靶向下调RPS2,进而抑制神经母细胞瘤细胞增殖、迁移和侵袭,减缓癌症的发展[41]。除此之外,靶向调控其他RP如RPS9、RPL23、RPL15a等也可用于癌症的治疗。
-
RP能够调节MDM2-p53通路,参与癌症的发生和发展。最新研究发现,WDR74在黑色素瘤进展和转移中起重要作用,其低表达能够上调RPL5蛋白水平,下调MDM2,使p53免受MDM2诱导的泛素化降解[42]。此外,与MDM2结合的其他RP如RPL15、RPS27a、RPS7等,也能够调节RP-MDM2-p53通路,用于癌症的治疗。
-
线粒体核糖体是一类独特的核糖体,位于线粒体的基质,在调节细胞呼吸中起关键作用。线粒体核糖体蛋白(mitochondrial ribosomal protein,MRP)是构成线粒体核糖体的重要组成部分。线粒体55S核糖体由39S和28S两个亚基组成。39S亚基由16S线粒体rRNA(mitochondrial ribosomal-rRNAs,mt-rRNAs)和50个MRP组成,28S亚基由12S mt-rRNAs和29个MRP组成[43]。
与胞质RP类似,MRP也具有核糖体外功能,包括细胞增殖、凋亡、迁移和自噬等细胞过程。据报道,MRPS23的低表达能够抑制乳腺癌细胞的增殖,在乳腺癌异种移植大鼠模型中,靶向MRPS23的shRNA能够阻断肿瘤血管生成,抑制肿瘤增殖和转移[44];MRPL42的低表达能够引起细胞周期阻滞,激活caspase3/7活性,诱导细胞凋亡[45];MRPL35的低表达能够增加ROS积累,并作用于线粒体,破坏线粒体膜电位,从而诱导细胞凋亡和自噬[46];在胶质瘤中,MRPS16的过表达能够通过激活PI3K/Akt/Snail信号通路,促进细胞的迁移和侵袭等[47]。
许多研究报道,MRP与各种疾病的发生和发展相关,可用作多种疾病发展诊断的标志物。研究发现,MRPL39能够通过靶向胃癌中的miR-130发挥抑癌作用,可作为胃癌诊断和预后的生物标志物[48];MRPS2、MRPL23、MRPS12、MRPL12和MRPS34可能是异硫氰酸苄酯治疗胶质母细胞瘤潜在的生物标志物[49];最新研究发现MRPL3是急性高山病相关的枢纽基因之一,未来可作为生物标志物和治疗靶点进行疾病诊断和治疗[50]。然而,目前MRP与各类疾病进展的确切机制研究尚不够深入,因此需进一步进行探索和确证。
-
RP是构成核糖体的重要成分,除了参与核糖体的组装之外,还具有核糖体外功能。RP能够调控基因表达、细胞周期、增殖、凋亡、迁移、侵袭、转化以及血管生成,进而影响疾病的进展。RP的生物合成及核糖体外功能的执行是极其复杂的过程,随着人们对RP与疾病的深入研究,现已揭示RP在许多疾病中的作用,并成为潜在的治疗靶标,因此,深入研究RP在疾病发生和发展中的作用机制,靶向RP调控其核糖体外功能,有望改善疾病的预后。目前,临床上已有药物通过调控RP的表达控制疾病的进展,但存在副作用较大、无法根治等问题,因此,减少药物的副作用,提高药物的疗效,是未来开发临床药物的目标。
Research progress on ribosomal proteins and their functions in diseases
-
摘要: 核糖体蛋白(RP)是核糖体的重要组成部分,在核糖体生物合成和蛋白质翻译中起关键作用。除此之外,核糖体蛋白还具有许多核糖体外功能,如调控基因表达、细胞增殖、分化、凋亡、DNA修复和其他多种细胞过程。RP的功能紊乱与包括血液、代谢、心血管疾病以及肿瘤在内的多种疾病的发生、发展密切相关,是多种疾病潜在的治疗靶点。本文将对RP的研究进展,包括RP的基本功能、核糖体外特性以及与人类疾病的联系进行综述,并探讨其作为生物标记物及在疾病治疗中的潜力。Abstract: Ribosomal proteins (RP) are important components of ribosomes and play key roles in ribosome biogenesis and protein translation. In addition, ribosomal proteins also possess many extra-ribosomal functions, such as regulation of gene expression, cell proliferation, differentiation, apoptosis, DNA repair, and many other cellular processes. The dysfunction of RP is closely related to the occurrence and development of various diseases including blood, metabolism, cardiovascular diseases and tumors, and RP might become potential therapeutic targets for a variety of diseases. The research progress on RP, including the basic functions of RP, extra-ribosomal properties, and the connections with human diseases were reviewed and their potential as biomarkers and therapeutic targets in diseases were discussed in this paper.
-
Key words:
- ribosomal protein /
- disease /
- extra-ribosomal function
-
临床药物研究需要严格、标准、规范的数据管理[1],众多文献阐述了统计分析前临床试验数据核查的相关问题及改进措施[1-4],然而,对于统计分析所得数据的核查却鲜有报道。本文以生物等效性(BE)研究为例,介绍统计分析数据核查的要点,包括:试验分组的随机数字表、药代动力学(PK)主要参数以及BE的分析计算数据和结果在相应的软件中是否能够重现、与原统计分析报告是否一致。同时,统计专业人员对核查提出的问题进行敏感性分析,并出具相关报告。
1. 资料与方法
1.1 资料来源
本文所使用的数据来自我部于2019-2021年间所接受的18项BE研究统计分析数据核查的结果,所测试的药物分别为抗病毒、抗菌药物以及治疗心脑血管疾病、糖尿病等疾病的药物。
1.2 统计学方法
1.2.1 采用SAS软件运行得出随机数字表
随机指利用SAS软件中的随机化功能,事先给出种子数,进行随机化分组。该方法简便易行、可重复、符合随机化要求[5]。通过SAS系统的“PROC PLAN SEED=种子数”过程实现两组等比例随机化。例如,将001~010这10个数随机分配为A、B两组,种子数设定为20200506,则生成的结果A组为002、003、006、008和009,B组为001、004、005、007和010。核查时,只要采用试验时设定的种子数,则通过SAS运行得到的A组和B组的数据不变。用同样的随机种子,通过SAS程序运行,能够得出相同的随机表。由此证明研究对象进入试验组和对照组机会均等。
1.2.2 采用WinNonlin软件计算主要PK参数、SAS软件进行BE评价
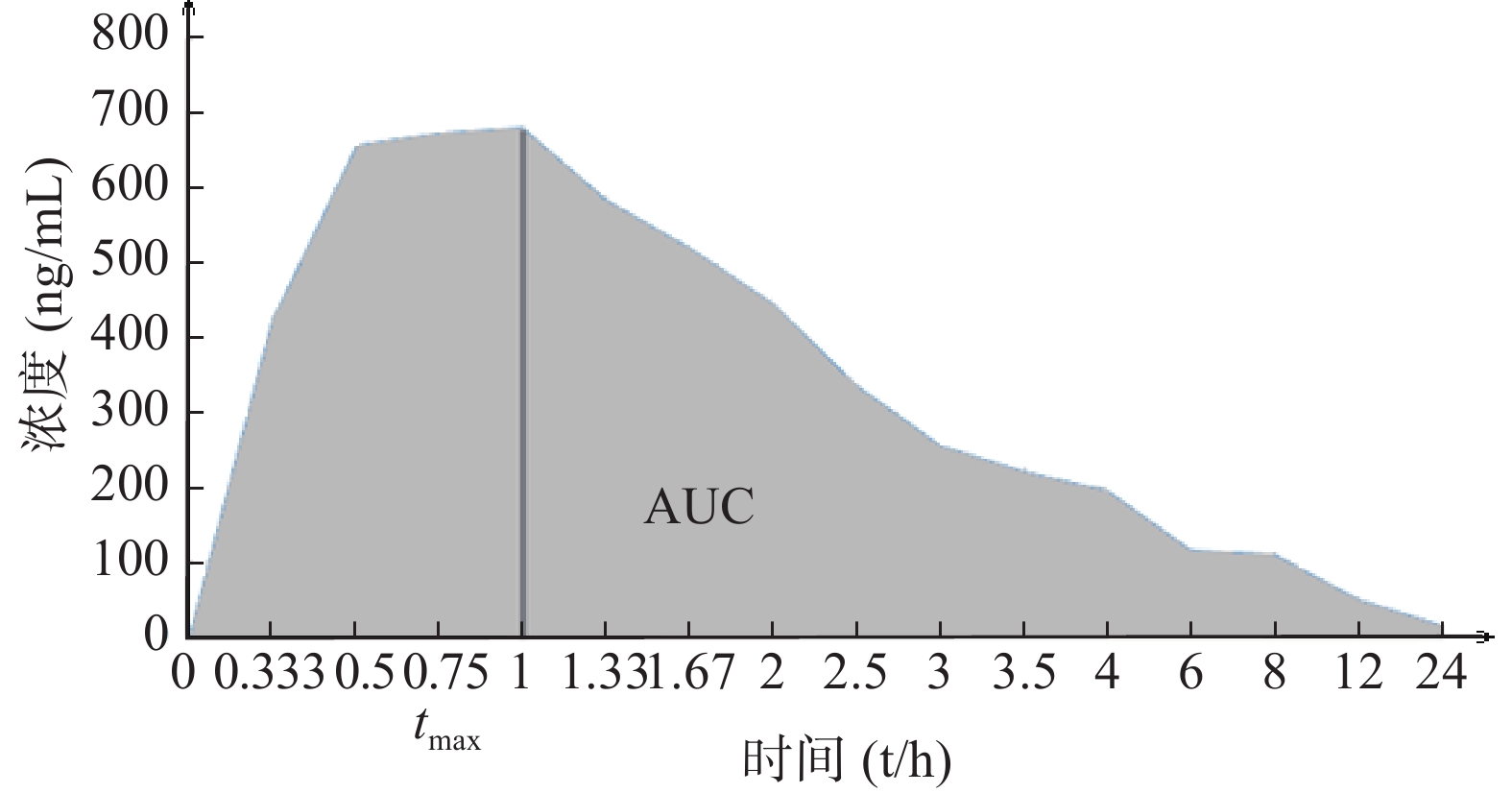
BE指药学等效制剂或可替换药物在相同的试验条件下,给予相同的剂量,其活性成分吸收速度和程度的差异无统计学意义[6]。BE研究给药后,通过测量不同时间点的生物样本(全血、血浆、血清等)药物浓度,得出药物浓度-时间曲线,经过计算得出血药浓度-时间曲线下面积(AUC)、药物达峰浓度(cmax)、达峰时间(tmax)(图1)等PK参数后,再通过统计学分析比较,判断两种制剂是否生物等效。
目前,BE评价方法是置信区间法。当主要PK参数AUC和cmax的几何均值比值的90%置信区间在80%~125%内时,受试制剂吸收的速度和程度与参比制剂相当,视为生物等效[7]。
核查时,首先需要核对申办方提供的统计分析前的原始数据。统计专业人员向核查人员展示数据传输协议(由申办方提供);然后,根据原始样本浓度数据,现场使用WinNonlin 8.1软件处理各组血药浓度测定数据,采用非房室模型计算出主要PK参数,包括AUC0-t、AUC0-∞、cmax,其他数据则使用SAS 9.4软件分析。如果受试制剂与参比制剂的AUC0-t、AUC0-∞和cmax几何均数比值的90%置信区间均落在80%~125%范围内,则两种制剂生物等效;否则,两种制剂不存在生物等效。将核查所得结果和结论与原统计分析报告核对,检查一致性。
2. 结果
2.1 一般情况
18项BE研究的分组随机数字表均可重现;18项研究均符合生物等效的判定标准,且BE评价结果与原统计分析报告一致;其中有13项研究的PK参数与原统计分析报告相同,其余5项研究的PK参数则有差异,见“2.2”项。
2.2 问题及处理结果
有12项研究存在个别样本采样时间偏差,其中,2项研究被要求补充敏感性分析,3项研究的分析数据集被要求进行受试者数据的重新纳入或剔除后,也进行了敏感性分析。
上述5项研究敏感性分析的结果显示:PK参数AUC0-t、AUC0-∞和cmax的几何均值比值的90%置信区间虽在数值上有所变化,但仍然在80%~125%范围内,维持原统计分析报告的BE评价。
3. 讨论
3.1 BE研究中随机化和等效性评价的意义
BE试验通常采用随机交叉等试验设计,随机和盲法因其有效控制偏倚而成为BE试验注册和核查的关键内容[8]。由于随机化即随机分配的优点,随机对照试验被广泛认为是评价新的药物、新的医疗器械或新的治疗方法疗效的最佳设计[9],是评价医学新疗法的金标准[10]。
在过去的二十年里,许多第一代专利药品的专利和上市许可的到期,导致了仿制药的兴起。进行BE研究被认为是确定仿制药与专利药具有相同的有效性和安全性的关键[7]。BE研究在化学药物仿制药的申请、新药评价以及已上市药物的变更申请中,具有不可替代的作用[6, 8, 11]。
3.2 核查发现的问题
3.2.1 采样时间偏差
在药物临床试验方案中,试验期间各个样本采集的时间点有严格规定。由于操作技术、环境及其它因素的影响,可能导致样本采集的时间与计划采样时间有所偏差、且超过了方案允许的偏差范围,这种情况视为超窗[12]。超窗会否影响统计分析的结果,需要通过敏感性分析予以证明。
敏感性分析指通过改变方法、模型、未测量的变量值等考查结果的改变程度,以确定评估方法的稳健性。敏感性分析结果与主要分析结果一致,表明主要分析的结果稳健,反之亦然[13]。对BE研究而言,考查的关键便是生物等效这一评估结果对PK参数的变化是否敏感。
核查发现,有2项BE研究分别存在个别受试者采血时间超窗问题。例如,在某研究中,某受试者计划采血时间为给药后5 min,方案规定的允许偏差范围为30s之内,但实际采血时间为5min32s,即超窗2s。在原统计分析报告中,PK参数按照计划采血时间加2s,即5min2s计算。核查人员要求按照实际采血时间重新计算主要PK参数,即按照5min32s计算,并做敏感性分析,与原统计分析结果进行比较,考查所得结论的一致性。
由此可见,对样本采集的环节进行严格、科学的管理非常重要。另外,无论采样时间是否存在偏差甚至超窗,应尽可能获取所有数据,真实记录采样时间,并做出敏感性分析报告。
3.2.2 受试者数据重新剔除或纳入
临床试验有效性分析应涵盖随机化分组后的所有受试者,而不仅限于实际完成的受试者数据。按照这种意向性治疗原则所做的分析是最好的分析。
BE研究的统计分析集除全分析集(FAS)和安全数据集(SS)外,最主要的数据集为PK参数集(PKPS)和BE集(BES)[14],BES是推断受试制剂和参比制剂是否生物等效的数据集。
在撰写统计报告时,如果剔除了某受试者数据,或者有受试者出现种种事故但没有被剔除,核查时可能被要求重新纳入或剔除受试者的数据,并进行敏感性分析,以考查是否对最终结果造成影响。例如,某BE试验对照组某受试者第二周期无给药后3.50 h、3.75 h、4.00 h、4.25 h、4.50 h及以后共13个时间段的血药浓度数据,原报告将该受试者纳入PKPS与BES,在核查时,将该受试者第二周期剔除PKPS与BES;或者,原报告将类似受试者剔除PKPS与BES,核查时又将该受试者重新纳入PKPS与BES。
需要注意的是,BE研究通常样本量相对较小,受各种原因数据剔除造成数据缺失的影响相对较大,可能对BE统计分析结果的稳健性带来挑战。因此,BE研究须严格质量管理,事先没有规定的不做剔除处理[11]。
4. 结论
统计分析数据是临床研究结果的呈现,是撰写统计分析报告和临床研究报告的依据。为确保临床研究最终结果和结论没有争议,国家药品监督管理局核查中心对药物临床研究的统计分析数据进行核查非常必要。
本文从统计学角度介绍了BE研究统计分析数据现场核查的主要内容,并对相关统计方法、核查发现的问题、原因和对策进行逐一分析和讨论。考虑到BE研究通常样本量较小,采样时间出现偏差、剔除或纳入数据可能影响统计结果的稳健性,因此,敏感性分析在BE研究中尤为重要,用于评估主要分析结果和结论的稳健性。敏感性分析和主要分析结果一致,则补充、巩固和加强研究结论,进一步证实试验药物的有效性和安全性[15-17]。本文建议,BE研究在统计分析计划的制定与统计分析报告的撰写中,对核查的内容、可能涉及敏感性分析的相关问题,特别是敏感性数据集PKPS和BES的调整,应予以充分考虑,以便在数据分析阶段采用多种敏感性分析方法,综合考虑结果的稳健性,为评估不同制剂临床治疗的可替换性提供扎实的研究数据。
-
[1] PEDERSON T. The ribosome: A structural biology triumph offering new horizons[J]. Faseb j, 2019, 33(4): 4655-4656. doi: 10.1096/fj.190401ufm [2] KANG J, BRAJANOVSKI N, CHAN K T, et al. Ribosomal proteins and human diseases: Molecular mechanisms and targeted therapy[J]. Signal Transduct Target Ther, 2021, 6(1): 323. doi: 10.1038/s41392-021-00728-8 [3] NISSEN P, HANSEN J, BAN N, et al. The structural basis of ribosome activity in peptide bond synthesis[J]. Science, 2000, 289(5481): 920-930. doi: 10.1126/science.289.5481.920 [4] PETIBON C, MALIK GHULAM M, CATALA M, et al. Regulation of ribosomal protein genes: An ordered anarchy[J]. Wiley Interdiscip Rev RNA, 2021, 12(3): e1632. [5] DALLA VENEZIA N, VINCENT A, MARCEL V, et al. Emerging role of eukaryote ribosomes in translational control[J]. Int J Mol Sci, 2019, 20(5): 1226. doi: 10.3390/ijms20051226 [6] ROFEAL M, EL-MALEK F A. Ribosomal proteins as a possible tool for blocking sars-cov 2 virus replication for a potential prospective treatment[J]. Med Hypotheses, 2020, 143: 109904. doi: 10.1016/j.mehy.2020.109904 [7] TAKEI S, TOGO-OHNO M, SUZUKI Y, et al. Evolutionarily conserved autoregulation of alternative pre-mrna splicing by ribosomal protein L10a[J]. Nucleic Acids Res, 2016, 44(12): 5585-5596. doi: 10.1093/nar/gkw152 [8] KIM J, KIM Y S. Effect of HIV-1 Tat on the formation of the mitotic spindle by interaction with ribosomal protein S3[J]. Sci Rep, 2018, 8(1): 8680. doi: 10.1038/s41598-018-27008-w [9] YI Y W, YOU K S, PARK J S, et al. Ribosomal protein S6: a potential therapeutic target against cancer?[J]. Int J Mol Sci, 2021, 23(1): 48. doi: 10.3390/ijms23010048 [10] QI Y K, LI X, CHANG C K, et al. Ribosomal protein L23 negatively regulates cellular apoptosis via the RPL23/Miz-1/c-Myc circuit in higher-risk myelodysplastic syndrome[J]. Sci Rep, 2017, 7(1): 2323. doi: 10.1038/s41598-017-02403-x [11] OGAWA L M, BASERGA S J. Crosstalk between the nucleolus and the DNA damage response[J]. Mol Biosyst, 2017, 13(3): 443-455. doi: 10.1039/C6MB00740F [12] DU C W, WANG T N, JIA J N, et al. Suppression of RPL34 inhibits tumor cell proliferation and promotes apoptosis in glioblastoma[J]. Appl Biochem Biotechnol, 2022, 194(8): 3494-3506. doi: 10.1007/s12010-022-03857-0 [13] SUN Z Q, QIU Z G, WANG Z K, et al. Silencing ribosomal protein L22 promotes proliferation and migration, and inhibits apoptosis of gastric cancer cells by regulating the murine double minute 2-protein 53 (mdm2-p53) signaling pathway[J]. Med Sci Monit, 2021, 27: e928375. [14] XIE C J, CAO K, PENG D X, et al. RPLP1 is highly expressed in hepatocellular carcinoma tissues and promotes proliferation, invasion and migration of human hepatocellular carcinoma Hep3b cells[J]. Exp Ther Med, 2021, 22(1): 752. doi: 10.3892/etm.2021.10184 [15] JI P G, WANG L, LIU J H, et al. Knockdown of rpl34 inhibits the proliferation and migration of glioma cells through the inactivation of jak/stat3 signaling pathway[J]. J Cell Biochem, 2019, 120(3): 3259-3267. doi: 10.1002/jcb.27592 [16] MICALIZZI D S, EBRIGHT R Y, HABER D A, et al. Translational regulation of cancer metastasis[J]. Cancer Res, 2021, 81(3): 517-524. doi: 10.1158/0008-5472.CAN-20-2720 [17] GUO P Y, WANG Y, DAI C X, et al. Ribosomal protein S15a promotes tumor angiogenesis via enhancing Wnt/β-catenin-induced fgf18 expression in hepatocellular carcinoma[J]. Oncogene, 2018, 37(9): 1220-1236. doi: 10.1038/s41388-017-0017-y [18] NI C, BUSZCZAK M. Ribosome biogenesis and function in development and disease[J]. Development, 2023, 8(1): 15. [19] JANG S, LEE J, MATHEWS J, et al. The drosophila ribosome protein S5 paralog RpS5b promotes germ cell and follicle cell differentiation during oogenesis[J]. Development, 2021, 148(19): dev199511. doi: 10.1242/dev.199511 [20] DANILOVA N, WILKES M, BIBIKOVA E, et al. Innate immune system activation in zebrafish and cellular models of Diamond Blackfan anemia[J]. Sci Rep, 2018, 8(1): 5165. doi: 10.1038/s41598-018-23561-6 [21] DANILOVA N, BIBIKOVA E, COVEY T M, et al. The role of the DNA damage response in zebrafish and cellular models of Diamond Blackfan anemia[J]. Dis Model Mech, 2014, 7(7): 895-905. [22] SONG B, ZHANG Q, ZHANG Z, et al. Systematic transcriptome analysis of the zebrafish model of Diamond-Blackfan anemia induced by RPS24 deficiency[J]. BMC Genomics, 2014, 15(1): 759. doi: 10.1186/1471-2164-15-759 [23] ANTUNES A T, GOOS Y J, PEREBOOM T C, et al. Ribosomal protein mutations result in constitutive p53 protein degradation through impairment of the akt pathway[J]. PLoS Genet, 2015, 11(7): e1005326. doi: 10.1371/journal.pgen.1005326 [24] XUE J Q, CHEN L, CHENG H, et al. The identification and validation of hub genes associated with acute myocardial infarction using weighted gene Co-expression network analysis[J]. J Cardiovasc Dev Dis, 2022, 9(1): 30. doi: 10.3390/jcdd9010030 [25] CHEN Y, CHEN Y H, TANG C H, et al. RPS4Y1 promotes high glucose-induced endothelial cell apoptosis and inflammation by activation of the p38 MAPK signaling[J]. Diabetes Metab Syndr Obes, 2021, 14: 4523-4534. doi: 10.2147/DMSO.S329209 [26] LEE J H, LIST A, SALLMAN D A. Molecular pathogenesis of myelodysplastic syndromes with deletion 5q[J]. Eur J Haematol, 2019, 102(3): 203-209. doi: 10.1111/ejh.13207 [27] BOLZE A, BOISSON B, BOSCH B, et al. Incomplete penetrance for isolated congenital asplenia in humans with mutations in translated and untranslated rpsa exons[J]. Proc Natl Acad Sci USA, 2018, 115(34): E8007-e8016. [28] SHI R, LIU Z R. RPL15 promotes hepatocellular carcinoma progression via regulation of RPs-MDM2-p53 signaling pathway[J]. Cancer Cell Int, 2022, 22(1): 150. doi: 10.1186/s12935-022-02555-5 [29] LI H Y, ZHANG H, HUANG G M, et al. Loss of RPS27a expression regulates the cell cycle, apoptosis, and proliferation via the RPL11-MDM2-p53 pathway in lung adenocarcinoma cells[J]. J Exp Clin Cancer Res, 2022, 41(1): 33. doi: 10.1186/s13046-021-02230-z [30] ORŠOLIĆ I, BURSAĆ S, JURADA D, et al. Cancer-associated mutations in the ribosomal protein L5 gene dysregulate the HDM2/p53-mediated ribosome biogenesis checkpoint[J]. Oncogene, 2020, 39(17): 3443-3457. doi: 10.1038/s41388-020-1231-6 [31] SMOLOCK E M, KORSHUNOV V A, GLAZKO G, et al. Ribosomal protein L17, RpL17, is an inhibitor of vascular smooth muscle growth and carotid intima formation[J]. Circulation, 2012, 126(20): 2418-2427. doi: 10.1161/CIRCULATIONAHA.112.125971 [32] EL KHOURY W, NASR Z. Deregulation of ribosomal proteins in human cancers[J]. Biosci Rep, 2021, 41(12): BSR20211577. doi: 10.1042/BSR20211577 [33] LIU Y, DAHL M, DEBNATH S, et al. Successful gene therapy of Diamond-Blackfan anemia in a mouse model and human CD34(+) cord blood hematopoietic stem cells using a clinically applicable lentiviral vector[J]. Haematologica, 2022, 107(2): 446-456. [34] ORGEBIN E, LAMOUREUX F, ISIDOR B, et al. Ribosomopathies: new therapeutic perspectives[J]. Cells, 2020, 9(9): 2080. doi: 10.3390/cells9092080 [35] PARK I, PHAN T M, FANG J. Novel molecular mechanism of lenalidomide in myeloid malignancies independent of deletion of chromosome 5q[J]. Cancers, 2021, 13(20): 5084. doi: 10.3390/cancers13205084 [36] WU Z K, WEI W Y, FAN H Z, et al. Integrated analysis of competitive endogenous RNA networks in acute ischemic stroke[J]. Front Genet, 2022, 13: 833545. doi: 10.3389/fgene.2022.833545 [37] KIM J W, YIN X L, MARTIN I, et al. Dysregulated mRNA translation in the G2019S LRRK2 and LRRK2 knock-out mouse brains[J]. eNeuro, 2021, 8(6): ENEURO. 0310-ENEURO. 0321.2021. [38] LV J, HUANG X R, KLUG J, et al. Ribosomal protein s19 is a novel therapeutic agent in inflammatory kidney disease[J]. Clin Sci (Lond), 2013, 124(10): 627-637. doi: 10.1042/CS20120526 [39] KONG Y Z, CHEN Q Y, LAN H Y. Macrophage migration inhibitory factor (MIF) as a stress molecule in renal inflammation[J]. Int J Mol Sci, 2022, 23(9): 4908. doi: 10.3390/ijms23094908 [40] JACOBS R Q, HUFFINES A K, LAIHO M, et al. The small-molecule BMH-21 directly inhibits transcription elongation and DNA occupancy of rna polymerase i in vivo and in vitro[J]. J Biol Chem, 2022, 298(1): 101450. doi: 10.1016/j.jbc.2021.101450 [41] ZHANG J, LIU W, JI P, et al. Silencing of long chain noncoding RNA paternally expressed gene (PEG10) inhibits the progression of neuroblastoma by regulating microRNA-449a (miR-449a)/ribosomal protein s2 (RPS2) axis[J]. Bioengineered, 2022, 13(3): 6309-6322. doi: 10.1080/21655979.2022.2042999 [42] LI Y M, ZHOU Y, LI B F, et al. WDR74 modulates melanoma tumorigenesis and metastasis through the RPL5-MDM2-p53 pathway[J]. Oncogene, 2020, 39(13): 2741-2755. doi: 10.1038/s41388-020-1179-6 [43] PECORARO A, PAGANO M, RUSSO G, et al. Ribosome biogenesis and cancer: overview on ribosomal proteins[J]. Int J Mol Sci, 2021, 22(11): 5496. doi: 10.3390/ijms22115496 [44] GAO Y, LI F Y, ZHOU H, et al. Down-regulation of MRPS23 inhibits rat breast cancer proliferation and metastasis[J]. Oncotarget, 2017, 8(42): 71772-71781. doi: 10.18632/oncotarget.17888 [45] HAO C Y, DUAN H B, LI H, et al. Knockdown of mrpl42 suppresses glioma cell proliferation by inducing cell cycle arrest and apoptosis[J]. Biosci Rep, 2018, 38(2): BSR20171456. doi: 10.1042/BSR20171456 [46] ZHANG L, LU P, YAN L, et al. MRPL35 is up-regulated in colorectal cancer and regulates colorectal cancer cell growth and apoptosis[J]. Am J Pathol, 2019, 189(5): 1105-1120. doi: 10.1016/j.ajpath.2019.02.003 [47] WANG Z, LI J J, LONG X B, et al. MRPS16 facilitates tumor progression via the PI3K/AKT/Snail signaling axis[J]. J Cancer, 2020, 11(8): 2032-2043. doi: 10.7150/jca.39671 [48] YU M J, ZHAO N, SHEN H B, et al. Long noncoding RNA MRPL39 inhibits gastric cancer proliferation and progression by directly targeting miR-130[J]. Genet Test Mol Biomarkers, 2018, 22(11): 656-663. doi: 10.1089/gtmb.2018.0151 [49] TANG N Y, CHUEH F S, YU C C, et al. Benzyl isothiocyanate alters the gene expression with cell cycle regulation and cell death in human brain glioblastoma GBM 8401 cells[J]. Oncol Rep, 2016, 35(4): 2089-2096. doi: 10.3892/or.2016.4577 [50] CHANG Y, HE J G, TANG J Q, et al. Investigation of the gene co-expression network and hub genes associated with acute mountain sickness[J]. Hereditas, 2020, 157(1): 13. doi: 10.1186/s41065-020-00127-z -

 点击查看大图
点击查看大图
计量
- 文章访问数: 8779
- HTML全文浏览量: 10431
- PDF下载量: 147
- 被引次数: 0




 下载:
下载:

 下载:
下载:
