-
侵袭性真菌感染(IFI)是免疫功能低下患者日益严峻的临床问题。中国血液病抗真菌治疗评估(CAESAR)研究显示,造血干细胞移植后IFI(包括确诊、临床诊断和拟诊)的总发生率为26.7%[1]。IFI与高病死率密切相关,给患者和社会都带来了沉重的经济负担[2]。为尽早开展治疗,确保疗效并降低死亡风险,在确定IFI病原体前,对于接受造血干细胞移植或因血液恶性肿瘤接受化疗等免疫功能低下患者,当其出现持续粒细胞缺乏伴发热,且广谱抗生素治疗4~7 d无效后,通常会开始经验治疗,或辅以计算机断层扫描、半乳甘露聚糖试验(GM试验)等检测技术,启动诊断驱动治疗[3-4]。
在免疫功能低下患者所面临的IFI中,由曲霉等真菌所引起的侵袭性霉菌病(IMD),应被视为优先关注的对象并获得高度重视[1,5-6]。经验治疗或诊断驱动治疗需要选择广谱抗真菌药物[4]。长期以来,伏立康唑是一线治疗的经典药物。泊沙康唑是第二代三唑类抗真菌药物,其抗菌谱广,对曲霉、毛霉等多种真菌表现出良好的活性[7-8]。2021年6月,泊沙康唑肠溶片及注射液被美国食品药品管理局(FDA)批准用于治疗成人和13岁及以上儿童患者的IMD。一项国际化、多中心、Ⅲ期、随机对照、非劣效临床试验(NCT01782131)表明,泊沙康唑治疗侵袭性曲霉感染在疗效和生存率方面与伏立康唑相当[9]。此外,泊沙康唑还具有其他优势:①在重度肝功能不全患者中,泊沙康唑无需剂量调整,而伏立康唑在该人群中的安全性尚不明确,缺乏剂量推荐;②泊沙康唑对曲霉和毛霉均具有活性,而伏立康唑的抗真菌谱并不包括毛霉,泊沙康唑的出现为IMD的临床治疗带来了更广阔的选择空间。2023年1月13日,国家医保局发布了《国家基本医疗保险、工伤保险和生育保险药品目录(2022年)》,泊沙康唑肠溶片和注射液通过竞价形式被纳入该目录。同年2月24日,上海市发布文件贯彻执行国家医保目录政策,泊沙康唑肠溶片和注射液的价格分别下降了55%和25%[10]。为节约医疗资源并减轻患者负担,当务之急是确定治疗IMD最具经济性的给药方案。目前,国内外均缺乏泊沙康唑对比伏立康唑治疗IMD的经济性评价研究。本研究从我国卫生体系角度出发,评价在病原体未确定的情况下,泊沙康唑对比伏立康唑经验治疗或诊断驱动治疗免疫功能低下患者IMD的经济性,以促进医疗资源的合理使用。
-
本研究的目标人群与NCT01782131研究(泊沙康唑对比伏立康唑治疗IMD的Ⅲ期临床试验)[9]中的一致,主要为疑似IMD的免疫功能低下患者。且患者曾接受造血干细胞移植,或患有长期中性粒细胞减少症(中性粒细胞计数<500×106/L,持续10 d以上),或长期使用糖皮质激素(激素剂量≥0.3 mg·kg−1·d−1,使用超过3周),或在过去90 d内应用过T细胞免疫抑制剂(如环孢素A、肿瘤坏死因子等),属于IMD的高危人群。
-
使用TreeAge Pro 2011软件构建决策树模型,模型结构参考已发表的模型[11-13],其在多个国家被用于免疫功能低下患者治疗IMD的经济学评价。
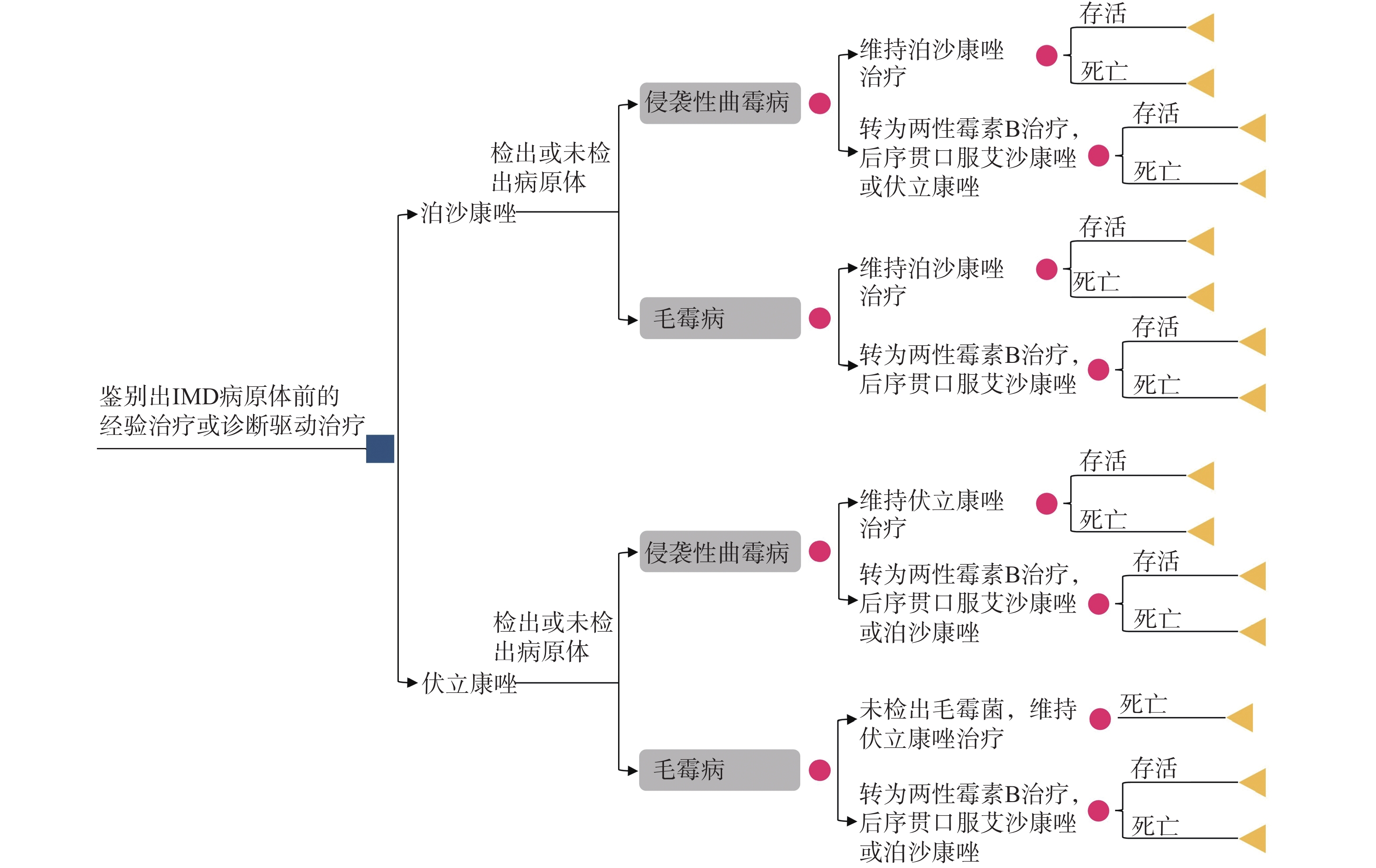
模拟1 000名疑似IMD的患者进入模型,在获得病原体信息前开始经验治疗或诊断驱动治疗。患者被分配到泊沙康唑序列或伏立康唑序列。由于免疫抑制状态、近期使用过抗真菌药物、真菌培养困难或样本采集时机不合适等因素,假定仅50%的患者可以确定病原体,其中曲霉占92.2%,毛霉占7.8%[12-13]。在治疗期间,根据患者的临床反应、药物耐受情况及其他因素,患者可改用两性霉素B脂质体(L-AmB)。考虑到伏立康唑对毛霉没有抗菌活性,如果在治疗过程中明确致病菌为毛霉,患者需要转用L-AmB,否则维持伏立康唑治疗。决策树模型结构参见图1。
本研究的产出指标为总成本和质量调整生命年(QALYs),通过计算增量成本-效果比(ICER)进行成本-效果分析。
$ QALYs=\sum {Y}_{i}\times {U}_{i} $ ,$ {Y}_{i} $ 表示时间区间,$ {U}_{i} $ 表示时间区间$ {Y}_{i} $ 的生命质量效用值。$ ICER = \dfrac{\text{(泊沙康唑组的总成本} - \text{伏立康唑组的总成本)}}{\text{(泊沙康唑组的}QALYs - \text{伏立康唑组的}QALYs\text{)}} $ 。将2022年3倍中国人均GDP(257 094元)作为意愿支付值(WTP)。 -
假设进入模型的患者肝、肾功能正常或无需调整剂量。其中,75%的患者最初接受静脉治疗,随后转为口服序贯治疗;而25%的患者开始就接受口服治疗。无论是静脉还是口服给药,泊沙康唑第1天使用300 mg,每天2次,随后每天300 mg,每天1次;伏立康唑第1天使用400 mg,每天2次,随后200 mg,每天2次。L-AmB每日用量为5 mg/kg,根据中国血液恶性肿瘤及造血干细胞移植患者的平均体质量(60 kg)计算日总剂量[14-15]。在首选方案疗效不佳、无法耐受或其他原因转用L-AmB的患者中,当进行序贯口服治疗时,按50%和50%的比例使用除初始用药外的其他2种三唑类药物。例如,首选泊沙康唑后转用L-AmB的患者,当序贯口服治疗时,可选用伏立康唑或艾沙康唑。然而,接受泊沙康唑治疗的毛霉菌病患者,只允许口服艾沙康唑序贯L-AmB治疗。
-
泊沙康唑和伏立康唑的全因病死率以及转为L-AmB治疗的比例来自几项大型临床研究和相关文献[9,16-17]。针对泊沙康唑治疗毛霉菌病的全因病死率,参考了一项单臂、开放标签的研究结果[18],该研究表明艾沙康唑治疗毛霉菌病的全因病死率为43.2%。这一假设的原因是体外药物敏感性试验显示泊沙康唑具有与艾沙康唑相似的抗菌活性[19-20],并且一些单中心的回顾性研究表明泊沙康唑治疗毛霉菌病的病死率与艾沙康唑相似[21-23]。
模型中,侵袭性曲霉感染的疗程为67 d(其中包括静脉注射9 d)[9],而毛霉菌病的治疗时间为149 d(其中包括静脉注射15.5 d)[18]。对首选方案无改善的患者,通常在第21天更换治疗药物,因为大多数无改善者在治疗的第1天至第42天之间更换了治疗方案[9,18,24]。然而,对于首选伏立康唑,后来被诊断为毛霉菌病的患者,在第11天就会改变治疗方案[25]。在首选治疗失败后,使用L-AmB治疗侵袭性曲霉感染需要至少14.5 d[26],而治疗毛霉菌病需要至少27.2 d[18]。
-
本研究从我国卫生体系角度出发,主要考虑直接医疗成本,包括药物成本、不良事件处置成本、疾病管理成本、随访检测成本等。药物成本包括泊沙康唑(Noxafil®)、伏立康唑(Vfend®)以及L-AmB(安必速®)的费用。严重的肝毒性被认为是唯一需要强化治疗并影响成本的不良事件,其发生率基于Ⅲ期临床试验和公开的数据库的数据。按照《药物性肝损伤诊治指南》的建议[27],严重肝毒性定义为急性或亚急性肝衰竭,需要人工肝支持系统治疗,且只产生1次治疗成本[28]。疾病管理成本包括实验室检测费用(如血常规、血生化)、病原学检验费用(如细菌/真菌涂片检查、培养鉴定、药敏试验、GM试验等),以及其他费用(如胸部计算机断层扫描、治疗药物监测等)。药品价格来源于2023年上海市医疗机构网络采购平台的药品零售价,其他费用参照2020年上海市医疗机构医疗服务项目和价格汇编。效用值来自Leunis A的文献[29]。决策树模型的输入参数见表1。
表 1 决策树模型的输入参数
参数 确定值 DSA变化范围 PSA分布 来源 下限 上限 概率(%) 侵袭性曲霉感染 泊沙康唑转L-AmB的比例 42.7 38.4 47.0 Beta 文献[9] 伏立康唑转L-AmB的比例 38.3 34.5 42.1 Beta 文献[9] 泊沙康唑42 d全因病死率 19.0 17.1 20.9 Beta 文献[9] 伏立康唑42 d全因病死率 19.0 17.1 20.9 Beta 文献[9] 曲霉感染转L-AmB的全因病死率 65.0 58.5 71.5 Beta 文献[29] 毛霉感染 毛霉感染率 7.8 7.0 8.6 Beta 文献[12-13] 泊沙康唑转L-AmB的比例 35.1 31.6 38.6 Beta 文献[18] 伏立康唑转L-AmB的比例 100.0 90.0 110.0 Beta 专家意见 泊沙康唑42 d全因病死率 43.2 38.9 47.5 Beta 文献[18] 伏立康唑42 d全因病死率 100.0 90.0 110.0 Beta 专家意见 毛霉感染转L-AmB的全因病死率 82.9 74.6 91.2 Beta 文献[17] 严重肝损伤发生率 泊沙康唑 3.1 2.8 3.4 Beta 文献[9] 伏立康唑 2.4 2.2 2.6 Beta 文献[9] 效用值 0.82 0.62 1 Beta 文献[29] 疗程、住院天数和其他时长(d) 侵袭性曲霉感染 初始方案(泊沙康唑/伏立康唑) 67 50.3 83.8 Gamma 文献[9] 转L-AmB治疗的使用时长 14.5 10.9 18.1 Gamma 文献[25] 初始方案转L-AmB的平均时长 21 15.8 26.3 Gamma 文献[9,18,23] 初始治疗住院天数(泊沙康唑/伏立康唑) 19.7 14.8 24.6 Gamma 文献[9] 诊断出曲霉感染到死亡的时间 37 27.8 46.3 Gamma 专家意见 毛霉感染 初始方案(泊沙康唑或伏立康唑) 149 111.8 186.3 Gamma 文献[18] 转L-AmB治疗的使用时长 27.2 20.4 34 Gamma 文献[18] 泊沙康唑转L-AmB的平均时长 21 15.8 26.3 Gamma 文献[9][18][23] 伏立康唑转L-AmB的平均时长 11 8.3 13.8 Gamma 文献[24] 初始治疗住院天数(泊沙康唑) 19.3 14.5 24.1 Gamma 文献[18] 诊断出毛霉感染到死亡的时间 28 21.0 35 Gamma 专家意见 费用(元) 药品成本(单位价格) 泊沙康唑注射液(300 mg/瓶) 1 420 1 065 1 775 Gamma 采购平台 泊沙康唑肠溶片(100 mg/片) 120 90 150 Gamma 采购平台 注射用伏立康唑(200 mg/瓶) 651.32 488.49 814.15 Gamma 采购平台 伏立康唑片(200 mg/片) 262.45 196.84 328.06 Gamma 采购平台 注射用两性霉素B脂质体(50 mg/瓶) 590 442.50 737.50 Gamma 采购平台 其他成本 药物性肝损行人工肝治疗一次性成本 26 800 20 100 33 500 Gamma 汇编 单次实验室检测费 691 518.25 863.75 Gamma 汇编 单次微生物检测费 580 435 725 Gamma 汇编 单次GM试验费 150 112.5 187.5 Gamma 汇编 单次影像学检查费 200 150 250 Gamma 汇编 其他每日住院费 148 111 185 Gamma 汇编 单次门诊随访费用 25 18.75 31.25 Gamma 汇编 -
为评估模型的稳健性,进行了单因素敏感性分析和概率敏感性分析。单因素敏感性分析用于研究在给定范围内改变参数对结果的影响。成本、效用和疗程参数的变化范围是±25%,概率参数的变化范围是±10%。旋风图用于显示单因素敏感性分析的结果。
概率敏感性分析通过进行10 000次Monte Carlo模拟实施,概率和效用服从Beta分布,成本和疗程服从Gamma分布。成本-效果可接受性曲线用于展示概率敏感性分析的结果,该曲线反映了在 WTP 阈值范围内药物具有成本效果优势的概率。
-
情境分析用于检验模型在不同情景或假设情况下的结果。评估了伏立康唑不同剂型的药价动态变化对结果的影响。考虑到国内缺乏毛霉菌的流行病学数据,分别采用较高的感染率(14%)和较低的感染率(0%)来测试该参数对结果的影响。
-
如表2所示,对疑似IMD的免疫功能低下患者启动经验治疗或诊断驱动治疗时,泊沙康唑是一种更经济、有效的方案。相对于伏立康唑,泊沙康唑少花费1 711.24元,但效用却增加
0.0327 QALYs,ICER为−52 272.41元/QALY,具有绝对优势。表 2 两组治疗方案的成本-效果分析
治疗方案 成本(元) QALYs 增量成本
(元)增量QALYs ICER
(元/QALY)曲霉 毛霉 总和 曲霉 毛霉 总和 伏立康唑 66 843.72 5 450.98 72 294.70 7.6743 0.0104 7.6847 − − − 泊沙康唑 64 669.13 5 914.33 70 583.46 7.6793 0.0382 7.7175 −1 711.24 0.0327 −52 272.41 注:QALYs和ICER存在的计算误差是因模型进行的精确计算,而列表时数据四舍五入。 -
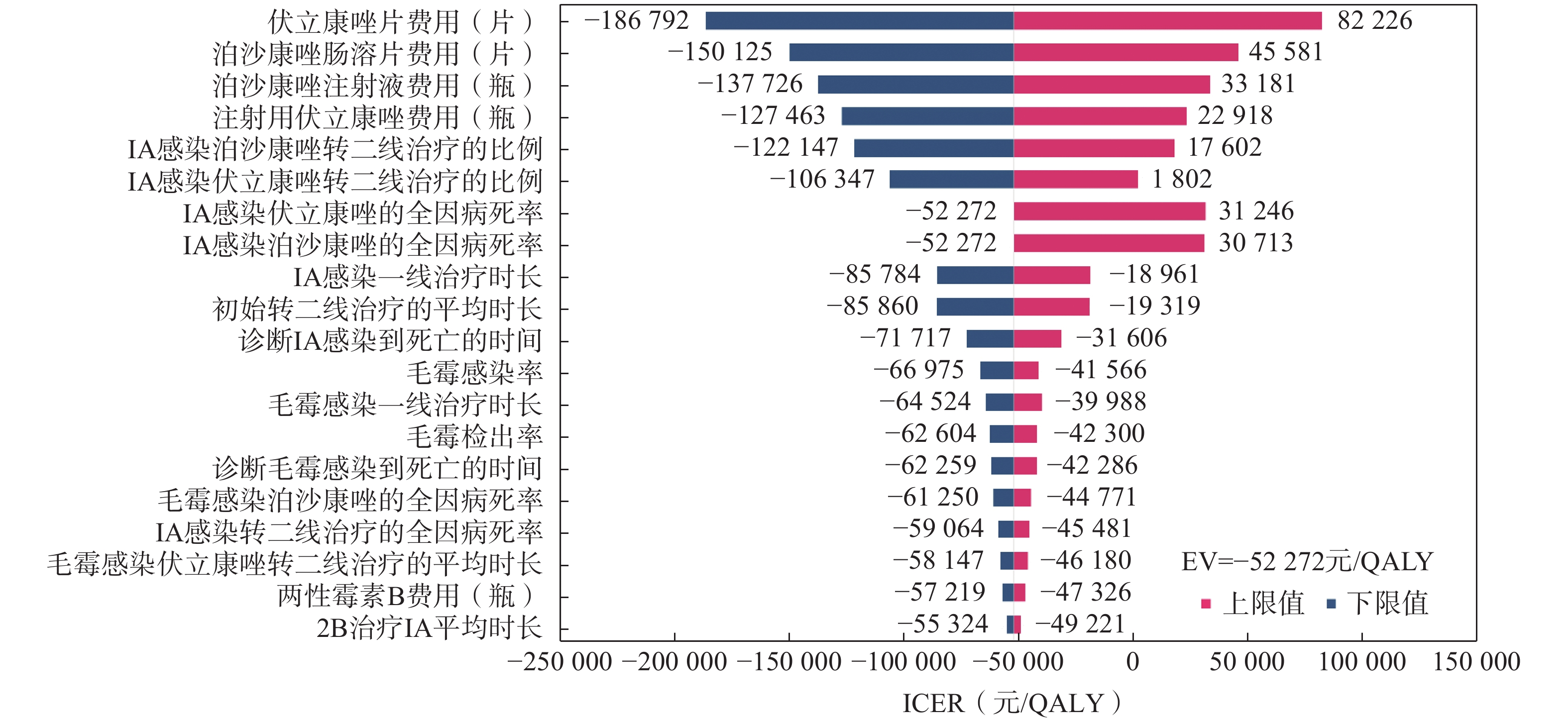
在单因素敏感性分析中,最终选取对模型结果影响较大的前20个参数,以旋风图的形式呈现(图2)。伏立康唑片、泊沙康唑肠溶片、泊沙康唑注射液以及注射用伏立康唑费用对ICER影响较大。但是所有参数的变化均未改变ICER<WTP(257 094元)的结果,表明模型是稳健的。
-
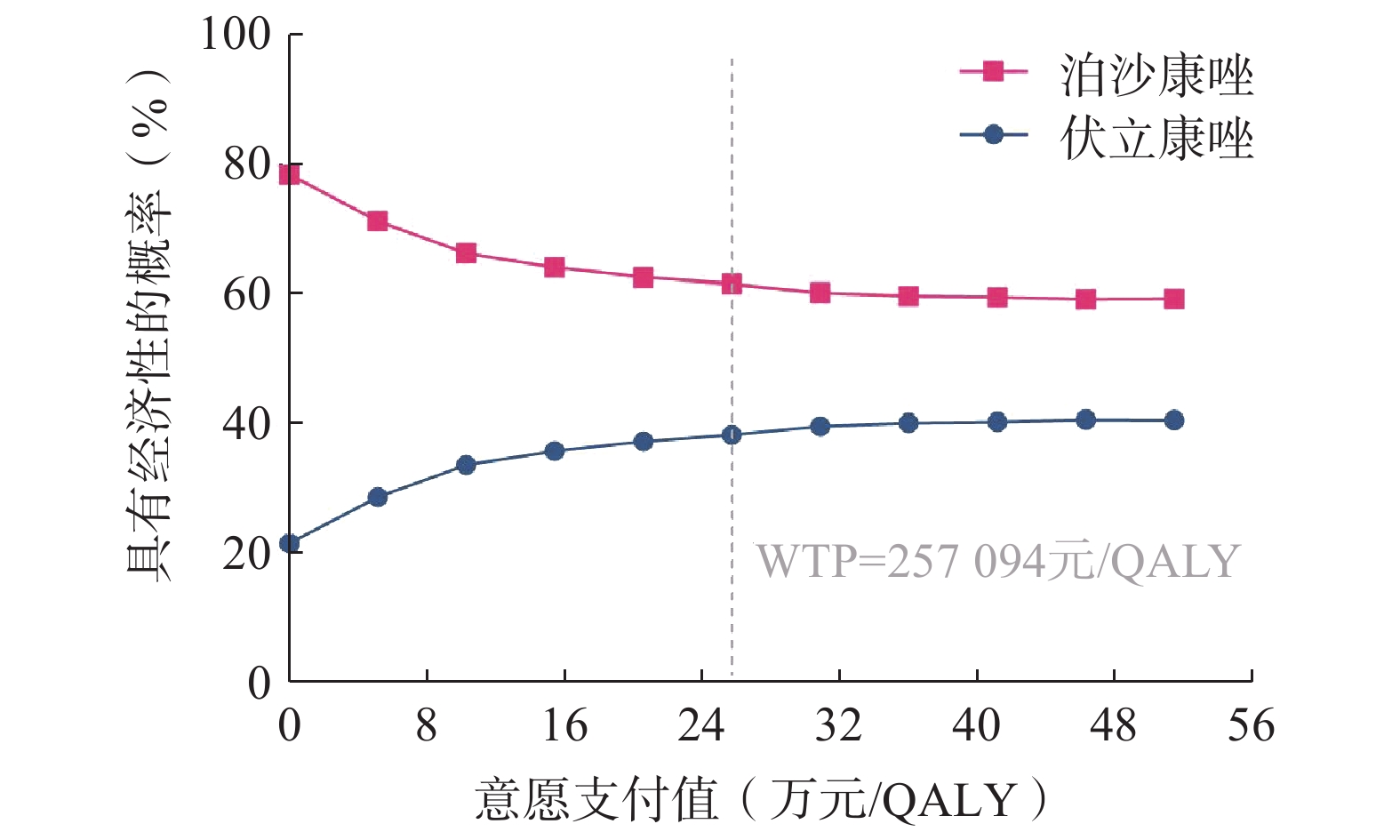
成本-效果可接受曲线(图3)显示,在不同的WTP下,泊沙康唑更具经济性优势的可能性始终大于伏立康唑。但随着WTP增加,泊沙康唑的绝对优势有所下降,最低降至59.4%。概率敏感性分析同样表明基础分析结果是稳定的。
-
尽管缺少中国毛霉菌病的流行病学数据,但通过调整毛霉感染率,情境分析结果表明毛霉感染率对基础模型结果并未产生影响。无毛霉感染时,两药QALYs一样,但泊沙康唑花费更低;而当毛霉感染率较高(14%)时,ICER为−11 347.04元/QALY。此外,考虑到伏立康唑是治疗侵袭性曲霉感染的经典一线药物,而泊沙康唑显示出的经济性可能是因为近期失去市场独占性后价格下调所致。因此,针对伏立康唑价格动态变化进行了情境分析。情境分析结果表明,当伏立康唑片降价20%、注射用伏立康唑降价30%,或两种剂型各降价15%时,伏立康唑将显示出明显的成本-效果优势,具体见表3。
表 3 情境分析结果
情境 增量成本
(元)增量
QALYsICER
(元/QALY)基础模型 −1 711.24 0.0327 −52 272.41 伏立康唑片降价20% 1 811.26 0.0327 55 327.54 注射用伏立康唑降价30% 1 242.56 0.0327 37 955.73 注射用伏立康唑及伏立康唑片
各降价15%2 407.50 0.0327 73 540.60 -
本研究首次对比了泊沙康唑和伏立康唑经验治疗或诊断驱动治疗免疫功能低下患者IMD的经济性。基础分析结果显示,泊沙康唑是一种更经济、有效的方案。尽早开始抗真菌治疗对于有效控制免疫功能低下患者的IMD至关重要,但药物选择却充满挑战[1]。由于曲霉感染和毛霉感染在肺部呈非特异性表现,很难进行区分[30]。这两种疾病都迅速进展,并有极高的致死率[17,31]。值得注意的是,伏立康唑对毛霉菌缺乏抗真菌活性,延迟治疗将显著增加病死率[32]。另外,相同剂型,泊沙康唑注射液的治疗费用高于伏立康唑,而肠溶片的费用却低于伏立康唑,这使得医生在直接选择一种既有效又经济的治疗方案时面临一定的困难。本研究的优势在于,模型高度仿真了真实世界中IMD高危患者从经验治疗或诊断驱动治疗到明确病原体后转为目标治疗的全过程。模型涵盖了多种治疗选择,包括不同的药物和剂型,具有高度多样性。通过详细数据的展示,来捕捉不同治疗选择的影响。因此,本研究的结果不仅为医疗决策和资源分配提供了依据,而且通过丰富的信息有助于启发医生的治疗选择,从而改善患者的预后。
-
新医保目录实施后,泊沙康唑价格大幅下降,而伏立康唑由于进入中国市场早,价格下调空间有限,同期仅注射液降价30%。IMD通常需要长期治疗(6~12周),尤其是对于免疫功能低下的患者[4]。当静脉治疗数日后患者病情得到明显改善,继续维持静脉治疗可能导致一系列问题,如频繁穿刺静脉可能导致静脉通路受损或丢失,或者出现静脉炎、导管相关感染等[33]。因此,口服序贯合适的抗真菌药物变得尤为必要,能够减少住院时长,节省患者前往医院接受静脉治疗的费用等。考虑到泊沙康唑每日口服费用低于伏立康唑,这使得泊沙康唑在本研究中具有经济优势。值得注意的是,情境分析显示伏立康唑一定程度降价后结果将发生逆转。
此外,毛霉菌病在免疫功能低下患者中的临床重要性显著,其病死率通常超过50%。基于血液系统恶性肿瘤患者尸检的研究显示,毛霉菌病是唯一在研究期间患病率有所增加的霉菌感染,从1983−1993年的0.06/100例增加到2004−2008年的0.18/100例(P=0.04)[34]。虽然缺乏中国高危人群毛霉菌病的流行病学数据,但情境分析表明,增加或降低毛霉菌病的感染率均不影响分析结果。
-
本研究也存在一定的局限性。首先,可用数据的质量限制了模型的无限外推。模型中病死率主要来自NCT01782131研究,该研究纳入了26个国家的患者,这使得研究人群的特征和感染比例可能在不同国家之间存在差异。对于该研究以外的人群,由于数据不足,外推结果的确定性可能受到一定程度的限制。其次,由于缺乏探讨IMD对生活质量影响的研究,效用值未能全面考虑这一方面,可能存在一定的偏倚。最后,本研究仅考虑了严重肝毒性的治疗成本。在实际临床中,当出现肝损伤时,医生可能会使用部分保肝药,而这部分成本并未纳入模型。然而,单因素敏感性分析显示,严重肝毒性的治疗成本对结果影响极小。因此,是否使用保肝药物对结果的影响可能较为有限。
综上,泊沙康唑经验治疗或诊断驱动治疗免疫功能低下患者IMD具有成本-效果优势,但作为经典老药的伏立康唑,如果一定程度下调价格也将具有经济性。该研究结果可以为中国卫生体系下的医疗决策和资源分配提供依据,助力治疗方案的优化,最终改善患者的预后。
Cost-effectiveness analysis of posaconazole versus voriconazole in the empiric or diagnostic-driven treatment of invasive mould diseases in immunocompromised patients
-
摘要:
目的 从中国卫生体系角度评估泊沙康唑对比伏立康唑经验治疗或诊断驱动治疗免疫功能低下患者侵袭性霉菌病(IMD)的经济性。 方法 基于一项Ⅲ期临床试验和其他公开可用的数据建立决策树模型,评价泊沙康唑相对于伏立康唑所产生的增量成本-效果比(ICER),并对结果进行单因素敏感性分析、概率敏感性分析以及情境分析。 结果 基础分析结果显示,在3倍我国人均GDP的意愿支付值(WTP)下,泊沙康唑比伏立康唑多获得 0.0327 个质量调整生命年(QALYs)且少花费1 711.24元,具有绝对优势。敏感性分析结果显示,伏立康唑、泊沙康唑的费用对ICER影响较大;在不同的WTP下,泊沙康唑经济性优势的概率始终大于伏立康唑。情境分析显示,毛霉的感染率并未影响结果。但如果伏立康唑一定程度降价后,将显示出成本-效果优势。结论 相比伏立康唑,使用泊沙康唑经验治疗或诊断驱动治疗免疫功能低下患者IMD是一种兼具有效性和经济性的选择。 Abstract:Objective To evaluate the cost-effectiveness of posaconazole compared with voriconazole in the empiric or diagnostic-driven treatment of invasive mould diseases (IMD) in immunocompromised patients from the perspective of Chinese health system. Methods A decision tree model was constructed based on a phase Ⅲ clinical trial and other publicly available data to evaluate the incremental cost-effectiveness ratio (ICER) of posaconazole versus voriconazole. One-way sensitivity analysis, probability sensitivity analysis, and scenario analysis were conducted. Results The results of base-case analysis indicated that, at a willingness-to-pay (WTP) threshold of 3 times Chinese GDP per capita, posaconazole gained 0.0327 quality-adjusted life years (QALYs) with the cost savings of CNY 1 711.24, demonstrating a clear cost-effectiveness advantage. Sensitivity analysis revealed that the cost of voriconazole and posaconazole significantly influenced the ICER. Under different WTP thresholds, posaconazole consistently maintained its economic advantage over voriconazole. Scenario analysis showed that the incidence of mucormycosis did not impact the results, but a price reduction in voriconazole could change result.Conclusion In the empiric or diagnostic-driven treatment of IMD in immunocompromised patients, posaconazole was both an effective and economically viable choice when compared to voriconazole. -
侵袭性真菌感染(IFI)是免疫功能低下患者日益严峻的临床问题。中国血液病抗真菌治疗评估(CAESAR)研究显示,造血干细胞移植后IFI(包括确诊、临床诊断和拟诊)的总发生率为26.7%[1]。IFI与高病死率密切相关,给患者和社会都带来了沉重的经济负担[2]。为尽早开展治疗,确保疗效并降低死亡风险,在确定IFI病原体前,对于接受造血干细胞移植或因血液恶性肿瘤接受化疗等免疫功能低下患者,当其出现持续粒细胞缺乏伴发热,且广谱抗生素治疗4~7 d无效后,通常会开始经验治疗,或辅以计算机断层扫描、半乳甘露聚糖试验(GM试验)等检测技术,启动诊断驱动治疗[3-4]。
在免疫功能低下患者所面临的IFI中,由曲霉等真菌所引起的侵袭性霉菌病(IMD),应被视为优先关注的对象并获得高度重视[1,5-6]。经验治疗或诊断驱动治疗需要选择广谱抗真菌药物[4]。长期以来,伏立康唑是一线治疗的经典药物。泊沙康唑是第二代三唑类抗真菌药物,其抗菌谱广,对曲霉、毛霉等多种真菌表现出良好的活性[7-8]。2021年6月,泊沙康唑肠溶片及注射液被美国食品药品管理局(FDA)批准用于治疗成人和13岁及以上儿童患者的IMD。一项国际化、多中心、Ⅲ期、随机对照、非劣效临床试验(NCT01782131)表明,泊沙康唑治疗侵袭性曲霉感染在疗效和生存率方面与伏立康唑相当[9]。此外,泊沙康唑还具有其他优势:①在重度肝功能不全患者中,泊沙康唑无需剂量调整,而伏立康唑在该人群中的安全性尚不明确,缺乏剂量推荐;②泊沙康唑对曲霉和毛霉均具有活性,而伏立康唑的抗真菌谱并不包括毛霉,泊沙康唑的出现为IMD的临床治疗带来了更广阔的选择空间。2023年1月13日,国家医保局发布了《国家基本医疗保险、工伤保险和生育保险药品目录(2022年)》,泊沙康唑肠溶片和注射液通过竞价形式被纳入该目录。同年2月24日,上海市发布文件贯彻执行国家医保目录政策,泊沙康唑肠溶片和注射液的价格分别下降了55%和25%[10]。为节约医疗资源并减轻患者负担,当务之急是确定治疗IMD最具经济性的给药方案。目前,国内外均缺乏泊沙康唑对比伏立康唑治疗IMD的经济性评价研究。本研究从我国卫生体系角度出发,评价在病原体未确定的情况下,泊沙康唑对比伏立康唑经验治疗或诊断驱动治疗免疫功能低下患者IMD的经济性,以促进医疗资源的合理使用。
1. 资料与方法
1.1 目标人群
本研究的目标人群与NCT01782131研究(泊沙康唑对比伏立康唑治疗IMD的Ⅲ期临床试验)[9]中的一致,主要为疑似IMD的免疫功能低下患者。且患者曾接受造血干细胞移植,或患有长期中性粒细胞减少症(中性粒细胞计数<500×106/L,持续10 d以上),或长期使用糖皮质激素(激素剂量≥0.3 mg·kg−1·d−1,使用超过3周),或在过去90 d内应用过T细胞免疫抑制剂(如环孢素A、肿瘤坏死因子等),属于IMD的高危人群。
1.2 模型结构及评价指标
使用TreeAge Pro 2011软件构建决策树模型,模型结构参考已发表的模型[11-13],其在多个国家被用于免疫功能低下患者治疗IMD的经济学评价。
模拟1 000名疑似IMD的患者进入模型,在获得病原体信息前开始经验治疗或诊断驱动治疗。患者被分配到泊沙康唑序列或伏立康唑序列。由于免疫抑制状态、近期使用过抗真菌药物、真菌培养困难或样本采集时机不合适等因素,假定仅50%的患者可以确定病原体,其中曲霉占92.2%,毛霉占7.8%[12-13]。在治疗期间,根据患者的临床反应、药物耐受情况及其他因素,患者可改用两性霉素B脂质体(L-AmB)。考虑到伏立康唑对毛霉没有抗菌活性,如果在治疗过程中明确致病菌为毛霉,患者需要转用L-AmB,否则维持伏立康唑治疗。决策树模型结构参见图1。
本研究的产出指标为总成本和质量调整生命年(QALYs),通过计算增量成本-效果比(ICER)进行成本-效果分析。
$ QALYs=\sum {Y}_{i}\times {U}_{i} $ ,$ {Y}_{i} $ 表示时间区间,$ {U}_{i} $ 表示时间区间$ {Y}_{i} $ 的生命质量效用值。$ ICER = \dfrac{\text{(泊沙康唑组的总成本} - \text{伏立康唑组的总成本)}}{\text{(泊沙康唑组的}QALYs - \text{伏立康唑组的}QALYs\text{)}} $ 。将2022年3倍中国人均GDP(257 094元)作为意愿支付值(WTP)。1.3 治疗方案
假设进入模型的患者肝、肾功能正常或无需调整剂量。其中,75%的患者最初接受静脉治疗,随后转为口服序贯治疗;而25%的患者开始就接受口服治疗。无论是静脉还是口服给药,泊沙康唑第1天使用300 mg,每天2次,随后每天300 mg,每天1次;伏立康唑第1天使用400 mg,每天2次,随后200 mg,每天2次。L-AmB每日用量为5 mg/kg,根据中国血液恶性肿瘤及造血干细胞移植患者的平均体质量(60 kg)计算日总剂量[14-15]。在首选方案疗效不佳、无法耐受或其他原因转用L-AmB的患者中,当进行序贯口服治疗时,按50%和50%的比例使用除初始用药外的其他2种三唑类药物。例如,首选泊沙康唑后转用L-AmB的患者,当序贯口服治疗时,可选用伏立康唑或艾沙康唑。然而,接受泊沙康唑治疗的毛霉菌病患者,只允许口服艾沙康唑序贯L-AmB治疗。
1.4 临床数据
泊沙康唑和伏立康唑的全因病死率以及转为L-AmB治疗的比例来自几项大型临床研究和相关文献[9,16-17]。针对泊沙康唑治疗毛霉菌病的全因病死率,参考了一项单臂、开放标签的研究结果[18],该研究表明艾沙康唑治疗毛霉菌病的全因病死率为43.2%。这一假设的原因是体外药物敏感性试验显示泊沙康唑具有与艾沙康唑相似的抗菌活性[19-20],并且一些单中心的回顾性研究表明泊沙康唑治疗毛霉菌病的病死率与艾沙康唑相似[21-23]。
模型中,侵袭性曲霉感染的疗程为67 d(其中包括静脉注射9 d)[9],而毛霉菌病的治疗时间为149 d(其中包括静脉注射15.5 d)[18]。对首选方案无改善的患者,通常在第21天更换治疗药物,因为大多数无改善者在治疗的第1天至第42天之间更换了治疗方案[9,18,24]。然而,对于首选伏立康唑,后来被诊断为毛霉菌病的患者,在第11天就会改变治疗方案[25]。在首选治疗失败后,使用L-AmB治疗侵袭性曲霉感染需要至少14.5 d[26],而治疗毛霉菌病需要至少27.2 d[18]。
1.5 成本和效应参数
本研究从我国卫生体系角度出发,主要考虑直接医疗成本,包括药物成本、不良事件处置成本、疾病管理成本、随访检测成本等。药物成本包括泊沙康唑(Noxafil®)、伏立康唑(Vfend®)以及L-AmB(安必速®)的费用。严重的肝毒性被认为是唯一需要强化治疗并影响成本的不良事件,其发生率基于Ⅲ期临床试验和公开的数据库的数据。按照《药物性肝损伤诊治指南》的建议[27],严重肝毒性定义为急性或亚急性肝衰竭,需要人工肝支持系统治疗,且只产生1次治疗成本[28]。疾病管理成本包括实验室检测费用(如血常规、血生化)、病原学检验费用(如细菌/真菌涂片检查、培养鉴定、药敏试验、GM试验等),以及其他费用(如胸部计算机断层扫描、治疗药物监测等)。药品价格来源于2023年上海市医疗机构网络采购平台的药品零售价,其他费用参照2020年上海市医疗机构医疗服务项目和价格汇编。效用值来自Leunis A的文献[29]。决策树模型的输入参数见表1。
表 1 决策树模型的输入参数参数 确定值 DSA变化范围 PSA分布 来源 下限 上限 概率(%) 侵袭性曲霉感染 泊沙康唑转L-AmB的比例 42.7 38.4 47.0 Beta 文献[9] 伏立康唑转L-AmB的比例 38.3 34.5 42.1 Beta 文献[9] 泊沙康唑42 d全因病死率 19.0 17.1 20.9 Beta 文献[9] 伏立康唑42 d全因病死率 19.0 17.1 20.9 Beta 文献[9] 曲霉感染转L-AmB的全因病死率 65.0 58.5 71.5 Beta 文献[29] 毛霉感染 毛霉感染率 7.8 7.0 8.6 Beta 文献[12-13] 泊沙康唑转L-AmB的比例 35.1 31.6 38.6 Beta 文献[18] 伏立康唑转L-AmB的比例 100.0 90.0 110.0 Beta 专家意见 泊沙康唑42 d全因病死率 43.2 38.9 47.5 Beta 文献[18] 伏立康唑42 d全因病死率 100.0 90.0 110.0 Beta 专家意见 毛霉感染转L-AmB的全因病死率 82.9 74.6 91.2 Beta 文献[17] 严重肝损伤发生率 泊沙康唑 3.1 2.8 3.4 Beta 文献[9] 伏立康唑 2.4 2.2 2.6 Beta 文献[9] 效用值 0.82 0.62 1 Beta 文献[29] 疗程、住院天数和其他时长(d) 侵袭性曲霉感染 初始方案(泊沙康唑/伏立康唑) 67 50.3 83.8 Gamma 文献[9] 转L-AmB治疗的使用时长 14.5 10.9 18.1 Gamma 文献[25] 初始方案转L-AmB的平均时长 21 15.8 26.3 Gamma 文献[9,18,23] 初始治疗住院天数(泊沙康唑/伏立康唑) 19.7 14.8 24.6 Gamma 文献[9] 诊断出曲霉感染到死亡的时间 37 27.8 46.3 Gamma 专家意见 毛霉感染 初始方案(泊沙康唑或伏立康唑) 149 111.8 186.3 Gamma 文献[18] 转L-AmB治疗的使用时长 27.2 20.4 34 Gamma 文献[18] 泊沙康唑转L-AmB的平均时长 21 15.8 26.3 Gamma 文献[9][18][23] 伏立康唑转L-AmB的平均时长 11 8.3 13.8 Gamma 文献[24] 初始治疗住院天数(泊沙康唑) 19.3 14.5 24.1 Gamma 文献[18] 诊断出毛霉感染到死亡的时间 28 21.0 35 Gamma 专家意见 费用(元) 药品成本(单位价格) 泊沙康唑注射液(300 mg/瓶) 1 420 1 065 1 775 Gamma 采购平台 泊沙康唑肠溶片(100 mg/片) 120 90 150 Gamma 采购平台 注射用伏立康唑(200 mg/瓶) 651.32 488.49 814.15 Gamma 采购平台 伏立康唑片(200 mg/片) 262.45 196.84 328.06 Gamma 采购平台 注射用两性霉素B脂质体(50 mg/瓶) 590 442.50 737.50 Gamma 采购平台 其他成本 药物性肝损行人工肝治疗一次性成本 26 800 20 100 33 500 Gamma 汇编 单次实验室检测费 691 518.25 863.75 Gamma 汇编 单次微生物检测费 580 435 725 Gamma 汇编 单次GM试验费 150 112.5 187.5 Gamma 汇编 单次影像学检查费 200 150 250 Gamma 汇编 其他每日住院费 148 111 185 Gamma 汇编 单次门诊随访费用 25 18.75 31.25 Gamma 汇编 1.6 敏感性分析
为评估模型的稳健性,进行了单因素敏感性分析和概率敏感性分析。单因素敏感性分析用于研究在给定范围内改变参数对结果的影响。成本、效用和疗程参数的变化范围是±25%,概率参数的变化范围是±10%。旋风图用于显示单因素敏感性分析的结果。
概率敏感性分析通过进行10 000次Monte Carlo模拟实施,概率和效用服从Beta分布,成本和疗程服从Gamma分布。成本-效果可接受性曲线用于展示概率敏感性分析的结果,该曲线反映了在 WTP 阈值范围内药物具有成本效果优势的概率。
1.7 情境分析
情境分析用于检验模型在不同情景或假设情况下的结果。评估了伏立康唑不同剂型的药价动态变化对结果的影响。考虑到国内缺乏毛霉菌的流行病学数据,分别采用较高的感染率(14%)和较低的感染率(0%)来测试该参数对结果的影响。
2. 结果
2.1 基础分析结果
如表2所示,对疑似IMD的免疫功能低下患者启动经验治疗或诊断驱动治疗时,泊沙康唑是一种更经济、有效的方案。相对于伏立康唑,泊沙康唑少花费1 711.24元,但效用却增加
0.0327 QALYs,ICER为−52 272.41元/QALY,具有绝对优势。表 2 两组治疗方案的成本-效果分析治疗方案 成本(元) QALYs 增量成本
(元)增量QALYs ICER
(元/QALY)曲霉 毛霉 总和 曲霉 毛霉 总和 伏立康唑 66 843.72 5 450.98 72 294.70 7.6743 0.0104 7.6847 − − − 泊沙康唑 64 669.13 5 914.33 70 583.46 7.6793 0.0382 7.7175 −1 711.24 0.0327 −52 272.41 注:QALYs和ICER存在的计算误差是因模型进行的精确计算,而列表时数据四舍五入。 2.2 单因素敏感性分析
在单因素敏感性分析中,最终选取对模型结果影响较大的前20个参数,以旋风图的形式呈现(图2)。伏立康唑片、泊沙康唑肠溶片、泊沙康唑注射液以及注射用伏立康唑费用对ICER影响较大。但是所有参数的变化均未改变ICER<WTP(257 094元)的结果,表明模型是稳健的。
2.3 概率敏感性分析
成本-效果可接受曲线(图3)显示,在不同的WTP下,泊沙康唑更具经济性优势的可能性始终大于伏立康唑。但随着WTP增加,泊沙康唑的绝对优势有所下降,最低降至59.4%。概率敏感性分析同样表明基础分析结果是稳定的。
2.4 情境分析
尽管缺少中国毛霉菌病的流行病学数据,但通过调整毛霉感染率,情境分析结果表明毛霉感染率对基础模型结果并未产生影响。无毛霉感染时,两药QALYs一样,但泊沙康唑花费更低;而当毛霉感染率较高(14%)时,ICER为−11 347.04元/QALY。此外,考虑到伏立康唑是治疗侵袭性曲霉感染的经典一线药物,而泊沙康唑显示出的经济性可能是因为近期失去市场独占性后价格下调所致。因此,针对伏立康唑价格动态变化进行了情境分析。情境分析结果表明,当伏立康唑片降价20%、注射用伏立康唑降价30%,或两种剂型各降价15%时,伏立康唑将显示出明显的成本-效果优势,具体见表3。
表 3 情境分析结果情境 增量成本
(元)增量
QALYsICER
(元/QALY)基础模型 −1 711.24 0.0327 −52 272.41 伏立康唑片降价20% 1 811.26 0.0327 55 327.54 注射用伏立康唑降价30% 1 242.56 0.0327 37 955.73 注射用伏立康唑及伏立康唑片
各降价15%2 407.50 0.0327 73 540.60 3. 讨论
3.1 泊沙康唑与伏立康唑的成本-效果比较
本研究首次对比了泊沙康唑和伏立康唑经验治疗或诊断驱动治疗免疫功能低下患者IMD的经济性。基础分析结果显示,泊沙康唑是一种更经济、有效的方案。尽早开始抗真菌治疗对于有效控制免疫功能低下患者的IMD至关重要,但药物选择却充满挑战[1]。由于曲霉感染和毛霉感染在肺部呈非特异性表现,很难进行区分[30]。这两种疾病都迅速进展,并有极高的致死率[17,31]。值得注意的是,伏立康唑对毛霉菌缺乏抗真菌活性,延迟治疗将显著增加病死率[32]。另外,相同剂型,泊沙康唑注射液的治疗费用高于伏立康唑,而肠溶片的费用却低于伏立康唑,这使得医生在直接选择一种既有效又经济的治疗方案时面临一定的困难。本研究的优势在于,模型高度仿真了真实世界中IMD高危患者从经验治疗或诊断驱动治疗到明确病原体后转为目标治疗的全过程。模型涵盖了多种治疗选择,包括不同的药物和剂型,具有高度多样性。通过详细数据的展示,来捕捉不同治疗选择的影响。因此,本研究的结果不仅为医疗决策和资源分配提供了依据,而且通过丰富的信息有助于启发医生的治疗选择,从而改善患者的预后。
3.2 泊沙康唑的经济优势与应用
新医保目录实施后,泊沙康唑价格大幅下降,而伏立康唑由于进入中国市场早,价格下调空间有限,同期仅注射液降价30%。IMD通常需要长期治疗(6~12周),尤其是对于免疫功能低下的患者[4]。当静脉治疗数日后患者病情得到明显改善,继续维持静脉治疗可能导致一系列问题,如频繁穿刺静脉可能导致静脉通路受损或丢失,或者出现静脉炎、导管相关感染等[33]。因此,口服序贯合适的抗真菌药物变得尤为必要,能够减少住院时长,节省患者前往医院接受静脉治疗的费用等。考虑到泊沙康唑每日口服费用低于伏立康唑,这使得泊沙康唑在本研究中具有经济优势。值得注意的是,情境分析显示伏立康唑一定程度降价后结果将发生逆转。
此外,毛霉菌病在免疫功能低下患者中的临床重要性显著,其病死率通常超过50%。基于血液系统恶性肿瘤患者尸检的研究显示,毛霉菌病是唯一在研究期间患病率有所增加的霉菌感染,从1983−1993年的0.06/100例增加到2004−2008年的0.18/100例(P=0.04)[34]。虽然缺乏中国高危人群毛霉菌病的流行病学数据,但情境分析表明,增加或降低毛霉菌病的感染率均不影响分析结果。
3.3 研究局限性及数据限制
本研究也存在一定的局限性。首先,可用数据的质量限制了模型的无限外推。模型中病死率主要来自NCT01782131研究,该研究纳入了26个国家的患者,这使得研究人群的特征和感染比例可能在不同国家之间存在差异。对于该研究以外的人群,由于数据不足,外推结果的确定性可能受到一定程度的限制。其次,由于缺乏探讨IMD对生活质量影响的研究,效用值未能全面考虑这一方面,可能存在一定的偏倚。最后,本研究仅考虑了严重肝毒性的治疗成本。在实际临床中,当出现肝损伤时,医生可能会使用部分保肝药,而这部分成本并未纳入模型。然而,单因素敏感性分析显示,严重肝毒性的治疗成本对结果影响极小。因此,是否使用保肝药物对结果的影响可能较为有限。
综上,泊沙康唑经验治疗或诊断驱动治疗免疫功能低下患者IMD具有成本-效果优势,但作为经典老药的伏立康唑,如果一定程度下调价格也将具有经济性。该研究结果可以为中国卫生体系下的医疗决策和资源分配提供依据,助力治疗方案的优化,最终改善患者的预后。
-
表 1 决策树模型的输入参数
参数 确定值 DSA变化范围 PSA分布 来源 下限 上限 概率(%) 侵袭性曲霉感染 泊沙康唑转L-AmB的比例 42.7 38.4 47.0 Beta 文献[9] 伏立康唑转L-AmB的比例 38.3 34.5 42.1 Beta 文献[9] 泊沙康唑42 d全因病死率 19.0 17.1 20.9 Beta 文献[9] 伏立康唑42 d全因病死率 19.0 17.1 20.9 Beta 文献[9] 曲霉感染转L-AmB的全因病死率 65.0 58.5 71.5 Beta 文献[29] 毛霉感染 毛霉感染率 7.8 7.0 8.6 Beta 文献[12-13] 泊沙康唑转L-AmB的比例 35.1 31.6 38.6 Beta 文献[18] 伏立康唑转L-AmB的比例 100.0 90.0 110.0 Beta 专家意见 泊沙康唑42 d全因病死率 43.2 38.9 47.5 Beta 文献[18] 伏立康唑42 d全因病死率 100.0 90.0 110.0 Beta 专家意见 毛霉感染转L-AmB的全因病死率 82.9 74.6 91.2 Beta 文献[17] 严重肝损伤发生率 泊沙康唑 3.1 2.8 3.4 Beta 文献[9] 伏立康唑 2.4 2.2 2.6 Beta 文献[9] 效用值 0.82 0.62 1 Beta 文献[29] 疗程、住院天数和其他时长(d) 侵袭性曲霉感染 初始方案(泊沙康唑/伏立康唑) 67 50.3 83.8 Gamma 文献[9] 转L-AmB治疗的使用时长 14.5 10.9 18.1 Gamma 文献[25] 初始方案转L-AmB的平均时长 21 15.8 26.3 Gamma 文献[9,18,23] 初始治疗住院天数(泊沙康唑/伏立康唑) 19.7 14.8 24.6 Gamma 文献[9] 诊断出曲霉感染到死亡的时间 37 27.8 46.3 Gamma 专家意见 毛霉感染 初始方案(泊沙康唑或伏立康唑) 149 111.8 186.3 Gamma 文献[18] 转L-AmB治疗的使用时长 27.2 20.4 34 Gamma 文献[18] 泊沙康唑转L-AmB的平均时长 21 15.8 26.3 Gamma 文献[9][18][23] 伏立康唑转L-AmB的平均时长 11 8.3 13.8 Gamma 文献[24] 初始治疗住院天数(泊沙康唑) 19.3 14.5 24.1 Gamma 文献[18] 诊断出毛霉感染到死亡的时间 28 21.0 35 Gamma 专家意见 费用(元) 药品成本(单位价格) 泊沙康唑注射液(300 mg/瓶) 1 420 1 065 1 775 Gamma 采购平台 泊沙康唑肠溶片(100 mg/片) 120 90 150 Gamma 采购平台 注射用伏立康唑(200 mg/瓶) 651.32 488.49 814.15 Gamma 采购平台 伏立康唑片(200 mg/片) 262.45 196.84 328.06 Gamma 采购平台 注射用两性霉素B脂质体(50 mg/瓶) 590 442.50 737.50 Gamma 采购平台 其他成本 药物性肝损行人工肝治疗一次性成本 26 800 20 100 33 500 Gamma 汇编 单次实验室检测费 691 518.25 863.75 Gamma 汇编 单次微生物检测费 580 435 725 Gamma 汇编 单次GM试验费 150 112.5 187.5 Gamma 汇编 单次影像学检查费 200 150 250 Gamma 汇编 其他每日住院费 148 111 185 Gamma 汇编 单次门诊随访费用 25 18.75 31.25 Gamma 汇编 表 2 两组治疗方案的成本-效果分析
治疗方案 成本(元) QALYs 增量成本
(元)增量QALYs ICER
(元/QALY)曲霉 毛霉 总和 曲霉 毛霉 总和 伏立康唑 66 843.72 5 450.98 72 294.70 7.6743 0.0104 7.6847 − − − 泊沙康唑 64 669.13 5 914.33 70 583.46 7.6793 0.0382 7.7175 −1 711.24 0.0327 −52 272.41 注:QALYs和ICER存在的计算误差是因模型进行的精确计算,而列表时数据四舍五入。 表 3 情境分析结果
情境 增量成本
(元)增量
QALYsICER
(元/QALY)基础模型 −1 711.24 0.0327 −52 272.41 伏立康唑片降价20% 1 811.26 0.0327 55 327.54 注射用伏立康唑降价30% 1 242.56 0.0327 37 955.73 注射用伏立康唑及伏立康唑片
各降价15%2 407.50 0.0327 73 540.60 -
[1] SUN Y Q, MENG F Y, HAN M Z, et al. Epidemiology, management, and outcome of invasive fungal disease in patients undergoing hematopoietic stem cell transplantation in China: a multicenter prospective observational study[J]. Biol Blood Marrow Transplant, 2015, 21(6):1117-1126. [2] TISSOT F, AGRAWAL S, PAGANO L, et al. ECIL-6 guidelines for the treatment of invasive candidiasis, aspergillosis and mucormycosis in leukemia and hematopoietic stem cell transplant patients[J]. Haematologica, 2017, 102(3):433-444. doi: 10.3324/haematol.2016.152900 [3] PAGANO L, CAIRA M, NOSARI A, et al. The use and efficacy of empirical versus pre-emptive therapy in the management of fungal infections: the HEMA e-Chart Project[J]. Haematologica, 2011, 96(9):1366-1370. doi: 10.3324/haematol.2011.042598 [4] 中国医师协会血液科医师分会, 中国侵袭性真菌感染工作组. 血液病/恶性肿瘤患者侵袭性真菌病的诊断标准与治疗原则(第六次修订版)[J]. 中华内科杂志, 2020, 59(10):754-763. doi: 10.3760/cma.j.cn112138-20200627-00624 [5] GODOY M C B, FERREIRA DALLA PRIA H R, TRUONG M T, et al. Invasive fungal pneumonia in immunocompromised patients[J]. Radiol Clin North Am, 2022, 60(3):497-506. doi: 10.1016/j.rcl.2022.01.006 [6] BUSCA A, CINATTI N, GILL J, et al. Management of invasive fungal infections in patients undergoing allogeneic hematopoietic stem cell transplantation: the Turin experience[J]. Front Cell Infect Microbiol, 2021, 11:805514. [7] ALMYROUDIS N G, SUTTON D A, FOTHERGILL A W, et al. In vitro susceptibilities of 217 clinical isolates of zygomycetes to conventional and new antifungal agents[J]. Antimicrob Agents Chemother, 2007, 51(7):2587-2590. doi: 10.1128/AAC.00452-07 [8] CUENCA-ESTRELLA M, GOMEZ-LOPEZ A, MELLADO E, et al. Head-to-head comparison of the activities of currently available antifungal agents against 3, 378 Spanish clinical isolates of yeasts and filamentous fungi[J]. Antimicrob Agents Chemother, 2006, 50(3):917-921. [9] MAERTENS J A, RAHAV G, LEE D G, et al. Posaconazole versus voriconazole for primary treatment of invasive aspergillosis: a phase 3, randomised, controlled, non-inferiority trial[J]. Lancet, 2021, 397(10273):499-509. doi: 10.1016/S0140-6736(21)00219-1 [10] 上海市医疗保障局, 上海市人力资源和社会保障局, 上海市卫生健康委员会, 等. 关于印发《上海市基本医疗保险、工伤保险和生育保险药品目录(2022年)》的通知[EB/OL].(2023-02-24)[2023-10-10]. http://ybj.sh.gov.cn/qtwj/20230227/fb9048f18db94531bc59fe11e9e0b071.html. [11] FLOROS L, KUESSNER D, POSTHUMUS J, et al. Cost-effectiveness analysis of isavuconazole versus voriconazole for the treatment of patients with possible invasive aspergillosis in Sweden[J]. BMC Infect Dis, 2019, 19(1):134. doi: 10.1186/s12879-019-3683-2 [12] FLOROS L, PAGLIUCA A, TAIE A A, et al. The cost-effectiveness of isavuconazole compared to the standard of care in the treatment of patients with invasive fungal infection prior to differential pathogen diagnosis in the United Kingdom[J]. J Med Econ, 2020, 23(1):86-97. [13] AZANZA J R, GRAU S, VÁZQUEZ L, et al. The cost-effectiveness of isavuconazole compared to voriconazole, the standard of care in the treatment of patients with invasive mould diseases, prior to differential pathogen diagnosis in Spain[J]. Mycoses, 2021, 64(1):66-77. doi: 10.1111/myc.13189 [14] HUANG W K, ZHENG Y, HUANG H P, et al. External evaluation of population pharmacokinetic models for voriconazole in Chinese adult patients with hematological malignancy[J]. Eur J Clin Pharmacol, 2022, 78(9):1447-1457. doi: 10.1007/s00228-022-03359-2 [15] HUANG H P, LIU Q X, ZHANG X H, et al. External evaluation of population pharmacokinetic models of busulfan in Chinese adult hematopoietic stem cell transplantation recipients[J]. Front Pharmacol, 2022, 13:835037. doi: 10.3389/fphar.2022.835037 [16] RAAD I I, HANNA H A, BOKTOUR M, et al. Novel antifungal agents as salvage therapy for invasive aspergillosis in patients with hematologic malignancies: posaconazole compared with high-dose lipid formulations of amphotericin B alone or in combination with caspofungin[J]. Leukemia, 2008, 22(3):496-503. [17] CHAMILOS G, LEWIS R E, KONTOYIANNIS D P. Delaying amphotericin B-based frontline therapy significantly increases mortality among patients with hematologic malignancy who have zygomycosis[J]. Clin Infect Dis, 2008, 47(4):503-509. doi: 10.1086/590004 [18] MARTY F M, OSTROSKY-ZEICHNER L, CORNELY O A, et al. Isavuconazole treatment for mucormycosis: a single-arm open-label trial and case-control analysis[J]. Lancet Infect Dis, 2016, 16(7):828-837. doi: 10.1016/S1473-3099(16)00071-2 [19] CHOWDHARY A, SINGH P K, KATHURIA S, et al. Comparison of the EUCAST and CLSI broth microdilution methods for testing isavuconazole, posaconazole, and amphotericin B against molecularly identified mucorales species[J]. Antimicrob Agents Chemother, 2015, 59(12):7882-7887. doi: 10.1128/AAC.02107-15 [20] ESCRIBANO P, MESQUIDA A, LÓPEZ-MONTESINOS S, et al. Amphotericin B, itraconazole, posaconazole, and isavuconazole MICs against clinical Mucorales isolates obtained by visual inspection and spectrophotometric reading according to the EUCAST 9.4 procedure[J]. Med Mycol, 2023, 61(5):myad045. doi: 10.1093/mmy/myad045 [21] VEHRESCHILD J J, BIRTEL A, VEHRESCHILD M J G T, et al. Mucormycosis treated with posaconazole: review of 96 case reports[J]. Crit Rev Microbiol, 2013, 39(3):310-324. doi: 10.3109/1040841X.2012.711741 [22] GONZÁLEZ-RAMOS M M, BERTRÁN-PASARELL J, GUIOT H, et al. Clinical experience with posaconazole in patients with invasive mucormycosis: a case series[J]. P R Health Sci J, 2008, 27(4):328-332. [23] SOMAN R, CHAKRABORTY S, JOE G. Posaconazole or isavuconazole as sole or predominant antifungal therapy for COVID-19-associated mucormycosis. A retrospective observational case series[J]. Int J Infect Dis, 2022, 120:177-178. [24] MAERTENS J A, RAAD I I, MARR K A, et al. Isavuconazole versus voriconazole for primary treatment of invasive mould disease caused by Aspergillus and other filamentous fungi(SECURE): a phase 3, randomised-controlled, non-inferiority trial[J]. Lancet, 2016, 387(10020):760-769. doi: 10.1016/S0140-6736(15)01159-9 [25] XHAARD A, LANTERNIER F, PORCHER R, et al. Mucormycosis after allogeneic haematopoietic stem cell transplantation: a French Multicentre Cohort Study(2003−2008)[J]. Clin Microbiol Infect, 2012, 18(10):E396-E400. doi: 10.1111/j.1469-0691.2012.03908.x [26] LEENDERS A C A P, DAENEN S, JANSEN R L H, et al. Liposomal amphotericin B compared with amphotericin B deoxycholate in the treatment of documented and suspected neutropenia-associated invasive fungal infections[J]. Br J Haematol, 1998, 103(1):205-212. [27] 中华医学会肝病学分会药物性肝病学组. 药物性肝损伤诊治指南[J]. 临床肝胆病杂志, 2015, 31(11):1752-1769. doi: 10.3969/j.issn.1001-5256.2015.11.002 [28] 谢倩, 余泽波. 人工肝治疗慢加急性(亚急性)肝衰竭近期疗效及费效比分析[J]. 现代医药卫生, 2020, 36(17):2720-2722,2725. doi: 10.3969/j.issn.1009-5519.2020.17.018 [29] LEUNIS A, REDEKOP W K, UYL-DE GROOT C A, et al. Impaired health-related quality of life in acute myeloid leukemia survivors: a single-center study[J]. Eur J Haematol, 2014, 93(3):198-206. doi: 10.1111/ejh.12324 [30] DONNELLY J P, CHEN S C, KAUFFMAN C A, et al. Revision and update of the consensus definitions of invasive fungal disease from the European organization for research and treatment of cancer and the mycoses study group education and research consortium[J]. Clin Infect Dis, 2020, 71(6):1367-1376. [31] LIN S J, SCHRANZ J, TEUTSCH S M. Aspergillosis case-fatality rate: systematic review of the literature[J]. Clin Infect Dis, 2001, 32(3):358-366. doi: 10.1086/318483 [32] JEONG S J, LEE J U, SONG Y G, et al. Delaying diagnostic procedure significantly increases mortality in patients with invasive mucormycosis[J]. Mycoses, 2015, 58(12):746-752. doi: 10.1111/myc.12428 [33] PEREA J R, DÍAZ DE RADA B S, QUETGLAS E G, et al. Oral versus intravenous therapy in the treatment of systemic mycosis[J]. Clin Microbiol Infect, 2004, 10(Suppl 1):96-106. [34] LEWIS R E, CAHYAME-ZUNIGA L, LEVENTAKOS K, et al. Epidemiology and sites of involvement of invasive fungal infections in patients with haematological malignancies: a 20-year autopsy study[J]. Mycoses, 2013, 56(6):638-645. doi: 10.1111/myc.12081 -





 下载:
下载:
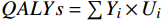
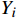
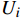
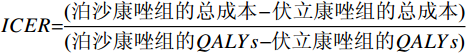
 下载:
下载:


