-
从2003年席卷全球的SARS疫情,到2009年爆发的H1N1甲型流感疫情,再到2020年起持续3年的新冠肺炎疫情,重大公共突发事件普遍具有传播速度快、感染范围广、防控难度大的特点[1-2]。中国政府非常重视突发公共事件的应急卫生物资保障,药品作为应急物资中最重要的,也是最特殊的部分,需要快速准确配送到使用单位,以保障人民群众生命安全。药物的研发具有资金投入大、研发周期长、成功率低的特点。药品的专利是国家在一定时间内对专利权人的保护,通常专利权人与被许可人之间是以协商签订合同来许可实施该专利,专利权人获得相应报酬。因此,当应急状态下缺乏某些有效预防或治疗药物时,为快速获得这些药品以保障公众健康,可能需要解决相关的药品专利强制许可问题。
-
在2007年出台的《中华人民共和国突发事件应对法》中,明确规定突发事件需要采取应急处置措施,国家应建立健全的应急物资储备保障制度,完善重要应急物资的生产、储备、调拨、紧急配送和监管体系[3]。我国作为仿制药大国,创新药品的技术专利长期由外国公司持有。现代社会的专利设置初衷是保护专利所有人对其发明专利的专有权,保护专利权人的利益,同时避免专利不当使用危害社会公众的利益。作为私有财产权的专利与公共利益之间存在一定的冲突性,在应急状态下,某些药品由于受到专利保护而无法让公众获得,这显然不符合《专利法》的立法初衷。因此,在这样的情况下,为了国家或公众的健康利益,启动专利强制许可程序,符合专利法律制度的初衷[4-5]。
-
现阶段我国药品专利相关的法律法规中,对药品专利强制许可的约定与国际上相关条款大体一致,而发达国家的典型代表美国则没有明文规定专利强制许可。在美国,法官拥有自由裁量权,可通过零散法条和司法判例实施专利强制许可(表1)。
表 1 中国、美国、印度和世界贸易组织关于专利强制许可法律法规
国家/地区 法律法规 颁发年份 条款 部门 条件 中国[9-11] 中华人民共和国专利法(2020年修订) 1985年4月1日起施行 第54条 国务院专利行政部门 在国家出现紧急状态或者非常情况时,或者为了公共利益的目的 专利实施强制许可办法(局令第64号) 2012年5月1日起施行 第6条 国务院有关主管部门建议国家知识产权局给与其指定的具备实施条件的单位强制许可 在国家出现紧急状态或者非常情况时,或者为了公共利益的目的 涉及公共健康问题的专利实施强制许可办法(局令第37号) 2006年1月1日起施行 第3条、第4条 国务院有关主管部门请求国家知识产权局授予实施该专利的强制许可 为了公共利益目的,或国家紧急状态 国际[12] 关于与贸易有关的知识产权协议与公共健康多哈宣言 2001年通过 − 世界贸易组织(WTO) 允许各国利用强制许可制度生产专利药品,明确没有制药能力的成员可以进口其他国家生产的被授予强制许可的专利药品 与贸易有关的知识产权协议(TRIPS) 2005年被纳入 WTO 公共利益、公共健康、紧急状态或其他紧急情况;公共非商业性使用、被确认为限制竞争的行为、专利不实施、因合理要求被拒绝许可、从属专利 印度[7] 专利法(2005年修订) 1970年实施 第84条 印度专利的主管部门专利局以及对专利局实施的专利许可具有复核权的印度知识产权上诉委员会 在公众的合理要求未能得到满足,或者公众无法以合理价格获得此专利发明的情况下;国家突发事件、其他非常紧急情况以及专利产品的公众非商业化使用扩大制造、出口已取得专利的药物产品强制许可范围,出口至无生产能力的地区、国家。 第92条第A款第(1)项 印度专利的主管部门专利局以及对专利局实施的专利许可具有复核权的印度知识产权上诉委员会 美国[13] 未有明文规定药品专利强制许可制度,通过其他零散法条规定和司法判例进行专利强制许可 − − 法官具有自由裁量权 针对滥用专利权的反垄断诉讼中会采用专利强制许可;一般采用审批、政府采购专案、医保等市场准入政策,以谈判协商为主要手段 新冠病毒疫情期间,美国辉瑞公司的Paxlovid作为口服新冠肺炎治疗新药,在临床研究中表现优秀,使新冠肺炎患者的住院或死亡风险降低了89%[6]。作为一款治疗新冠病毒的药物,Paxlovid于2022年2月在国内获批上市,且被纳入我国第九版、第十版新冠诊疗方案抗病毒治疗的推荐药物。然而,在2022年的医保谈判中,因企业报价过高,Paxlovid未能通过谈判纳入医保范畴,鉴于当年疫情形势放缓,我国未对该药品实施专利强制许可。
作为发展中国家且同样是仿制药大国的印度,通过强制性的行政干预,减少对新药的保护,使得本国的仿制药行业蓬勃发展。2008年,印度专利局批准了印度首个药品专利强制许可申请:拜耳公司的“多吉美”(索拉非尼,Nexavar)。拜尔公司2008年在印度取得索拉非尼的专利权,作为治疗晚期肾癌的新药,一位患者服用多吉美的每月费用大约需要5 700美元,远超人均年收入仅1 316美元的印度国民承受能力[7]。印度的仿制药公司Natco公司在与拜耳公司请求给予专利许可失败的情况下,以该药未在印度得到充分利用为由,向印度专利局提出该药的专利强制许可申请。2012年印度专利局以公众健康的需求和该药的定价过高为理由,授予Natco公司该药的专利强制许可[7-8]。
2001年,美国面临炭疽病毒威胁,德国拜耳公司的环丙沙星是市场上唯一可以治疗炭疽病毒的药物。但该药物的价格昂贵,不为普通民众所能承受。美国政府使用药品专利强制许可作为谈判筹码给德国拜耳公司施压,迫使其大幅度降价,民众得以购买此药。美国政府在未启动环丙沙星的药品专利强制许可的情况下,利用该制度实现药品价格的成功谈判,解决了公众健康危机[8]。
-
我国对专利强制许可已呈现基本法律设置,《中华人民共和国专利法》已明确规定申请专利强制许可的条件,国家专利局的部门规章《专利实施强制许可办法》和《涉及公共健康问题的专利实施强制许可办法》进一步明确了实施专利强制许可的执行要求,但启动药品专利强制许可的准入条件概念判定模糊,缺少可操作性[7]。若国家宣布进入应急状态后,何时启动专利强制许可以及具体执行步骤和责任机构均没有明确的专项规定。实际上我国至今从未实施药品专利强制许可,如遇应急情况,缺乏执行专利强制许可的案例参考。
-
现行专利相关的法律法规仅明确强制许可启动条件,未明确应急状态下专利强制许可的如何开展。当出现紧急情况,国家卫生健康委员会和国家药品监督管理局作为卫生医药管理部门,应当第一时间制定治疗方案,确定有无替代药品、该药品是否需要申请强制许可,并在治疗效果等方面给出专业意见。这是他们的权利,也是其责任。
-
批准药品专利强制许可条件如紧急状态、非常情况、公共利益的概念判定模糊。《中华人民共和国宪法》明确全国人大常委会有权宣布全国进入紧急状态,但我国从未动用过这一权力[14]。公共利益定义广泛,国务院有关主管部门对“公共利益”有很大的裁量权,对他们来说这也是一个挑战。因此,我国对于药品专利强制许可的批准使用持谨慎态度,至今从未实施药品专利强制许可。
-
一般情况下,专利许可通过与专利权人协商的方式进行,但协商的期限是无法控制的。如果在专利强制许可的情况下,遇专利权人不服时申请行政复议,诉讼程序漫长,诉讼结束时间也难以确定。
应急情况下,时间是最为重要的。但我国的《专利法》并未对专利强制许可的执行期限进行明确的规定,这将滞后公共利益的维护。此时这种“滞后”对相关利益人是致命的。未及时启动的专利强制许可,不能在应急状态时实现其应有的价值;或在应急状态结束后,未及时终止强制许可,也会影响正常的市场秩序。应急情况下,明确的强制许可执行期限决定其可行性和必要性。
-
实施专利强制许可只是实现应急药品的第一步,按照国家药品上市的现行规定,后续流程包括样品检测、现场核查、技术评审等均需要一定的时间来完成。当国家处于应急状态时,后续的上市流程则限制了药品何时能上市使用,甚至可能导致专利强制许可“前功尽弃”。药品管理部门需要对药品应急使用授权的操作做出明确规定。
-
药品专利强制许可的实施在一定程度抑制本国药企创新药物研发的积极性,同时可能造成国际纠纷,从而削弱本国对医药投资的吸引力。且药品专利涉及巨大经济利益,国家之间的政治、外交博弈,各国对国际条约的理解差异,决定了执行专利强制许可必然是谨慎的、艰难的,可能导致实施专利强制许可国家与被实施专利权人及其所属国家产生纠纷甚至冲突[7]。在应急情况下,如何避免引发上述问题,同时实现药品快速准确配送是我们需要去探索解决的。
-
国家政策明确指出药品保障的必要性,《中共中央关于制定国民经济和社会发展第十四个五年规划和二〇三五年远景目标的建议》指出,把保障人民健康放在优先发展的战略位置,健全物资保障体系,提高应对突发公共卫生事件能力,提高药品安全保障水平,完善国家应急管理体系[15]。
从应急管理体系的药品保障,到药品的专利强制许可制度,应急状态下药品的保障已形成基本框架。现行法律法规的操作流程较繁琐,并且仅局限在药品专利的范畴内,没有从药品管理方面进行细化。药品作为特殊的商品,建立药品专利强制许可的专属法规,以确保在应急情况下,专利强制许可的可执行性是十分必要的。
对于国家卫生健康委员会和国家药品监督管理局给出的建议,应当规定其具有一定的法律效力,专利主管部门在没有充分理由的情况下不得拒绝该建议。两家单位需从专业角度,对该药品的治疗效果、有无替代治疗药物、相关指定企业的生产和运输能力、药品的公共可及性等进行全方位评估。研发环节的审批、申报企业生产前现场核查等均应给与“绿色”通道,以提高审批效率。同时应加强仿制药的质量监管和一致性评价,仿制药的质量是应对应急情况的重要保障。考虑到应急情况下此类药品的紧缺,政府应该完善创新服务能力,该药品应由政府统筹后进行保障分配。
-
我国宪法规定全国人大常委会有权宣布全国进入紧急状态,但紧急状态的衡量标准并没有明文规定。以新型冠状病毒肺炎疫情为例,当出现疫情事件持续一定时间、受灾/患病人数达到一定数量并且呈现增长趋势,对社会稳定和发展的影响已到严重程度时[5],国家对实际情况进行研判,进而考虑宣布进入紧急状态。在紧急情况下,必然会出现医药产品供给的集中爆发,药品、医用耗材、医疗设备需在第一时间完成筹措并配送到使用单位。当目标药品因专利限制而无法投入使用,其专利强制许可申请则是会重点考虑的解决方案,以响应国家或公共健康需求。
-
专利强制许可是因紧急事件或应急情况产生的,在事件被控制后,强制许可亦失去了启用的前提。因此快速有效的启动并完成专利强制许可是极其重要的,同时,在事件结束后,及时终止专利强制许可也是极其重要的。
因时间上的紧迫性与应急性,要求强制许可需要简化专利审批程序。当强制许可决定做出后,要求立即生效,保证与后续的费用核定以及行政复议等分离,从程序上提高了专利强制许可的效率。在应急状态结束后,申请人和专利权人应在限定的时间内完成专利授权的磋商,避免影响正常的市场秩序,亦可避免产能过剩[14]。
-
通常优先考虑专利权人自愿向政府申请,同意第三人在支付相关费用后,可使用该专利。即避免了专利强制许可,又提高了专利的使用效率,解决了应急情况下的实际问题。
而专利涉及核心技术、经济利益、商业战略等多方面。因此应急情况的专利强制许可考虑对专利权人进行相应的经济补偿。《中华人民共和国专利法》第六十二条规定:“取得实施强制许可的单位或个人应当付给专利权人合理的使用费,其数额由双方协商,双方不能达成协议的,由国务院专利行政部门裁决” [9]。联合国开发计划署建议是以仿制药价格为基础,设置净销售额的4%为基本率,药品专利强制许可的最终使用费可根据药品专利的创新性和接收政府补贴的情况上下浮动2%,支付给专利权人以作为专利强制许可的经济补偿[16]。
-
为保障在应急状态下,目标药品能及时投入使用,在实施专利强制许可的基础上,探索药品的应急使用授权是十分必要的。例如美国国防部与美国食品药品监督管理局(FDA)进行了密切合作,为进一步提高紧急情况下获得相关医疗产品的可能,并签署了谅解备忘录,打破了百年来的惯例——医疗产品必须经过FDA注册审批的程序。2004年美国国会通过《联邦食品药品和化妆品法案》第564条的修订,建立了医药产品应急使用授权制度。该制度授权在美国公众面临严重或危及生命的应急状态下,FDA使用应急使用授权(EUA)允许使用未经FDA批准上市的医疗产品,或已批准上市用于未批准的适应证的医疗产品。2005年FDA发布了6项EUA应对炭疽恐怖袭击,2009年、2010年应对H1N1流感疫情发布了22项EUA,2018年,FDA授予冻干血浆的EUA。这对我们探索应急情况下药品应急使用授权具有很好的借鉴意义[17]。
该合作开创了应急状态药品使用的新局面,实现挽救生命的医疗用品的优先。确定应急状态后,在有充分数据保证药品安全性和有效性,且药品已知或潜在的收益大于风险时,药品的审批、制造、配送、发放、管理、使用等多个环节均可适用药品应急使用授权。
-
不同于院校和科研单位的主要经费来自于公共资金,且研究方向注重创新性,通常是某些利益创造低但极为重要的研究。企业的研发重点是创造经济效益。因此将企业、院校、科研单位等多主体纳入政府牵头的科研攻关项目中,实现企业与院校、科研单位的对接,最大限度发挥各个主体的作用和特长。专利权人可以通过内部交叉许可协议,有效解决专利实施过程中的授权问题。在应急情况下可以迅速实现技术的推广与应用[18]。
创新药品专利的研发成本高,且研发成功风险极高,应急事件中药品专利应用场景和时间都有局限性,对于企业来说缺乏研发吸引力。政府应对创新医药企业提供税收减免、补贴和融资支持等激励政策,激发企业自主创新的内在动力。在发展前景良好的生物医药行业以及我国独具特色的中药行业,应从激励数量增长转向激励高质量专利的产出。
-
应急情况下批准实施药品专利强制许可,是满足国家或公共健康利益的药品需求的首要步骤,对比国际上药品专利强制许可的执行现状,我们需要结合实际完善相关制度,明确部门分工,细化执行步骤,并出台政策措施鼓励企业,为药品专利强制许可的实施做好准备。
Some thoughts on compulsory licensing of pharmaceutical patents in emergency situations
-
摘要:
目的 探讨药品专利强制许可的条件以及实施药品专利强制许可的具体步骤。 方法 通过收集中国、美国、印度和世界贸易组织的药品专利强制许可的法律法规,分析我国执行药品专利强制许可的现状及面临的问题,比较药品专利强制许可的可行做法。 结果 我国需要完善药品专利强制许可制度,明确其执行细则,加强政策引导,鼓励政企合作等方式来保证应急状态时顺利执行药品专利强制许可。 结论 通过吸收国际组织和相关国家的药品专利强制许可的有益条款,补充和完善我国药品专利强制许可制度和执行细则,以实现应急状态下药品的供应保障,满足公众健康的需要。 Abstract:Objective To explore the conditions for compulsory licensing of pharmaceutical patents and the steps for implementing compulsory licensing of pharmaceutical patents. Methods The current situation and problem of compulsory licensing of pharmaceutical patents in China were analyzed by collecting the relevant laws and regulations in China, United States, India, and the World Trade Organization. The feasible practices of compulsory licensing of pharmaceutical patents among the other countries and organizations were compared. Results China needs to improve the system of compulsory licensing of pharmaceutical patents, clarify the implementation details, strengthen policy guidance, and encourage cooperation between government and enterprises to ensure the smooth implementation in emergency situations. Conclusion Compulsory licensing system and implementation rules in China for pharmaceutical patents should be supplemented and improved by absorbing the useful provisions of international organizations and relevant countries, so as to achieve the pharmaceutical supply in emergency situations and meet the needs of public health. -
Key words:
- patent compulsory licensing /
- emergency /
- medicine
-
口服给药是最简单的给药方式,药物是否适合口服给药取决于其在胃肠道中的有效吸收,因此,开发能准确预测口服药物吸收的方法对药物研发相关研究具有非常重要的意义。近几十年来,为了评估临床前开发过程中的口服药物吸收,研究人员们已经建立了多种药物肠吸收的研究方法,主要有体外试验法(in vitro)、在体试验法(in situ)和体内试验法(in vivo)等。动物模型可以模拟整个有机体的生理,但动物模型在肠道生理学以及肠道转运蛋白的表达模式和底物特异性方面与人类有很大不同[1]。2004年,美国FDA估计,92%通过动物试验的药物未能进入市场,原因是动物试验没有预测到的有效性和安全性问题。此外,动物模型往往具有伦理学争议。与动物模型相比,体外培养细胞模型具有操作简便、成本低、无伦理问题等优点[2],研究人员开发了Boyden Chamber和Transwell等模型来模拟肠道的复杂结构和功能。然而,传统的体外培养细胞模型通常缺乏体内特性,例如,流体流动、周期性蠕动、宿主与微生物之间的串扰以及组织之间的串扰[3]。随着微制造和3D打印技术的发展,肠芯片(gut-on-a-chip, GOC)为体外研究肠道疾病提供了新方法[4]。基于肠道功能,肠芯片引入了具有不同部件的模块,例如,用于流体流动的注射泵和用于机械变形的压力系统[5],用于模拟一些肠道功能,使其更具生理相关性。肠芯片突破了传统细胞培养和动物实验的局限性,具有体积小、高度集成化和高通量等特点。本文综述了目前国内外肠芯片模型以及与肠道相关的多器官耦合芯片模型的研究进展,介绍了基于微流控芯片的肠道模型在疾病建模、药物吸收和转运方面的应用。
1. 肠道基本结构与功能
1.1 小肠的结构
肠道是人体重要的消化器官,是从胃幽门至肛门中最长的一段,主要器官功能是进行消化、吸收、分泌和免疫[6]。肠上皮是人体最大的黏膜表面,覆盖约400 m2的表面积,单层细胞组织形成隐窝和绒毛结构[7]。隐窝和绒毛是肠道基本的、具有自我更新功能的结构单位。人体小肠和大肠体内肠隐窝的实际深度分别为135 μm和400 μm,小肠绒毛的高度为600 μm[8]。隐窝和绒毛分别包括干细胞增殖和分化细胞区域。在肠上皮的分化绒毛区域中,发现了3种主要类型的分化肠上皮细胞(IEC):肠上皮细胞、杯状细胞和肠内分泌细胞[9]。肠上皮细胞是肠上皮中最常见的细胞,负责消化和吸收肠腔中的营养物质[10]。杯状细胞分泌的黏液在肠上皮上维持一层连续的黏液,提供保护屏障并有助于润滑肠道内壁[11]。肠内分泌细胞产生多种激素并调节许多不同的功能[12]。
1.2 肠道屏障
肠道屏障是机体内部和外部之间的屏障,允许营养素和液体的吸收,同时阻止有毒、有害物质的侵入,对人体的健康起着重要作用。肠道屏障分为四类:机械屏障、化学屏障、生物屏障和免疫屏障[7]。机械屏障又称为物理屏障,它能有效阻止有害物质,如细菌、毒素等透过肠黏膜进入机体的其他部位造成肠道损伤引发各类疾病,是人体肠道的第一道防线[13]。物理屏障主要通过细胞间的紧密连接复合构成,维持肠上皮细胞的完整性和渗透性[14]。化学屏障由胃肠道各种分泌物包括黏液、胃酸以及各种消化酶、溶菌酶等组成[15-16]。生物屏障是肠黏膜屏障的重要组成部分,由肠道微生物群附着在肠黏膜层上形成的一个动态稳定的微生物屏障[15]。免疫屏障由肠道相关淋巴组织及肠上皮固有层中的免疫细胞组成,如潘氏细胞、巨噬细胞、树突状细胞、淋巴细胞等,可分泌各种抗菌肽、IgG和细胞因子,维持肠道内稳态[17]。
1.3 肠道吸收和转运与体内外肠道模型
药物在胃肠道黏膜上皮细胞的吸收过程是药物在生物膜两侧的跨膜转运过程,药物的跨膜转运方式主要分为被动转运、转运体介导的主动转运和膜动转运等。口服药物在肠道的吸收不仅是简单的被动转运,还通过肠道上皮细胞的药物转运体来实现,其中,转运体参与的主动转运在药物吸收过程中起关键作用[18]。根据底物的转运方向,可以将转运体分为摄入型转运体和外排型转运体两大类,它们控制着肠黏膜屏障的通透性,影响了药物的生物利用度[19]。
为了研究肠道屏障功能及药物吸收特征,研究人员开发了各种体外和离体肠道吸收模型。将细胞外基质(ECM)包被肠上皮细胞置于Transwell培养装置中,常用于研究肠道屏障功能或药物吸收。但这种2D培养模式没有介质流动或施加机械应变,不能再现肠细胞和组织形态或重建其他关键的肠分化功能,肠绒毛无法分化,肠道分泌功能受到抑制[20]。为实现3D肠道细胞模型的建立,研究人员使用不同支架包埋细胞。Li等[21]使用胶原凝胶作为支架,将共培养的Caco-2/HT29-MTX单层细胞和两种基质细胞(成纤维细胞和免疫细胞)合并到胶原凝胶中,与Caco-2细胞的单层培养相比,构建的3D模型显示出更多的生理相关特征。研究表明,使用胶原凝胶作为支架的3D肠道模型可能成为研究肠道内药物转运的有前景的工具。但其也有一定的局限性,在长时间培养过程中,由于胶原蛋白降解,细胞穿透基质形成多层细胞,导致Caco-2细胞在胶原支架上的培养,绒毛高度缩短[22]。另外一些离体模型,如外翻囊模型[23]、Ussing腔模型[24]和InTESTineTM[25]在生理学上高度相关,但这些模型的吞吐量和寿命往往有限(最长可达6~8 h)。
2. 基于微流控芯片的肠道吸收模型
常规的肠道体外模型缺乏对组织结构的真实模拟、缺乏微生物群,以及肠道功能的复杂性,例如蠕动和流动。随着微流控技术的飞速发展,基于微流控的肠芯片成为了模拟人体胃肠道的有效途径。如图1所示,肠道微环境的关键因素包括肠道的3D绒毛结构、蠕动运动和肠屏障功能等[26]。为了真实地模拟人体肠道,肠芯片模型应能实现以下功能:①通过体外拉伸细胞培养膜来模拟蠕动样运动;②通过控制流体来再现肠道复杂的3D绒毛结构;③通过控制微流体的设计结构和材料的渗透性来产生生理氧梯度:④通过多细胞共培养的方式,研究肠道与其他组织或肠道-微生物之间的互作关系。
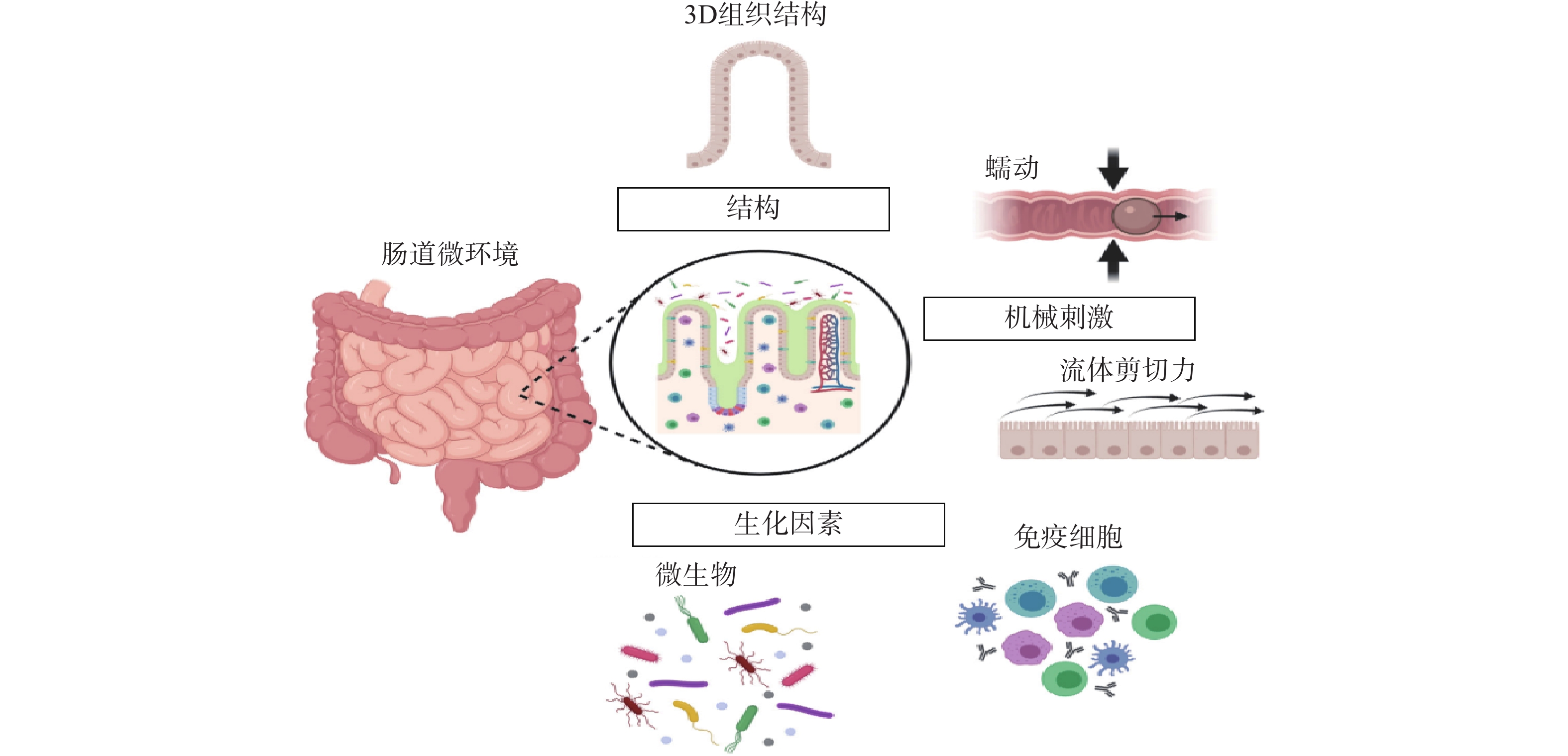 图 1 肠道微环境关键特征[26]
图 1 肠道微环境关键特征[26]2.1 肠道芯片设计
在过去的10年中,肠道芯片平台已经从简单的2D结构发展到包括更全面的功能,例如绒毛结构、肠道蠕动、氧梯度,甚至免疫系统。在肠道器官芯片发展的过程中,肠芯片的类型主要分为两种:二维夹膜肠芯片和三维绒毛肠芯片。
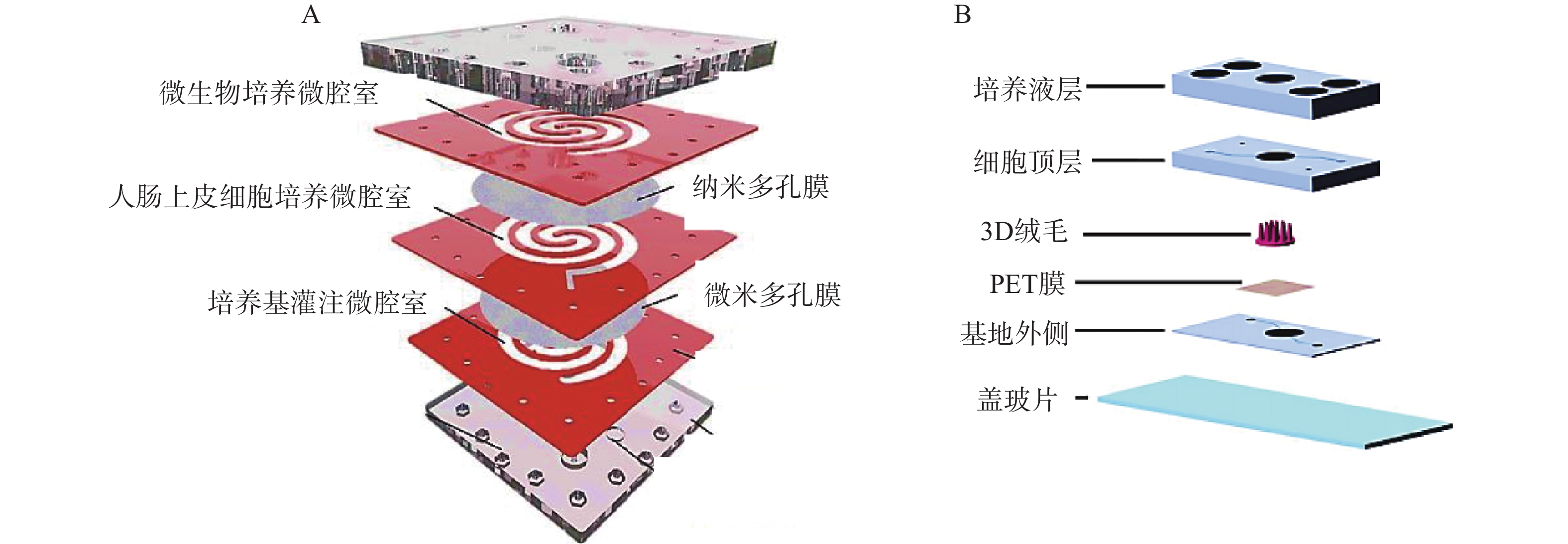
二维夹膜肠芯片最常见的设备结构包含两个通道(上部和下部),由半透膜(例如聚碳酸酯或聚酯材料)隔开,在膜上生长的肠上皮细胞形成单层上皮的顶端和基底外侧,这种简单的2D模型通常用于评估药物和营养吸收的体外药动学特性。Kimura等[27]开发了一种集成泵式循环装置和光学检测功能的微流控模型,该模型由被胶原蛋白涂层的半透膜分隔的两层通道组成,以抗癌药物环磷酰胺的渗透评价其吸收功能。Shah等[28]设计了一种基于微流控芯片的人类-微生物共培养模型“人与微生物交互系统”(HuMiX),见图2。培养基灌注微腔室与人肠上皮细胞培养微腔室之间用微米多孔膜(孔径1 μm)隔开,人肠上皮细胞培养微腔室与微生物培养微腔室之间用纳米多孔膜(孔径50 nm)隔开,每个微腔室有独立的进出口,该模型还集成了光电二极管用于监测溶解氧的浓度。2D肠道芯片模型可以模拟肠道细胞上的流体剪切应力,以减少对细胞和培养基的需求,但该模型仍缺乏模拟肠道组织关键特征的功能。
三维绒毛结构的实现对于构建体外肠道模型至关重要,肠道内的绒毛微结构不仅是肠上皮层的生理屏障,更重要的是增加了肠表面的吸收面积。虽然有报道称在平面基质上自发形成绒毛,但缺乏对绒毛尺寸和分布的控制,而且重复性差。微型3D支架的集成已经成为更好地再现人类肠道结构的解决方案。Shim等[29]植入了胶原蛋白支架,以重现肠道组织三维绒毛结构,绒毛高度为300 μm,绒毛间距为150 μm。3D条件下Caco-2细胞增殖良好,均能形成肠屏障。此外,将细胞置于灌注培养的3D培养条件下,可显著提高细胞的代谢活性。Costello等[30]利用激光雕刻翻模的技术制作了一种肠道芯片,在这种芯片中细胞依附于所制作的绒毛生长;但是激光雕刻在模具的制作中有一定局限性。激光雕刻利用激光垂直切割平面基底,制作出的模型多为柱状结构,较难制作出更为复杂的3D模型。张忆恒等[31]通过3D打印技术与表面微结构转移方法,成功地模拟了更为复杂的肠道绒毛。
2.2 流体控制
在肠道中,剪切力在细胞分化中起着重要作用,包括增强黏液产生、增加线粒体活性和提高药物吸收[32]。2D培养时细胞保持在静态条件下,动态参数不容易模拟。在微流控装置中,流体流动可以通过蠕动泵、注射器泵、重力或静水压力以及压力发生器产生,模拟体内液体流动的范围及其在细胞表面的相关剪切应力。与静态条件相比,在连续流动和循环应变下,Caco-2细胞经历细胞分化、极化、绒毛形成、屏障完整性维持、黏液产生等。GOC器件的剪切应力一般取值在0.01 ~ 0.06 dyn/cm2之间,大多数模型中的剪切应力是使用蠕动泵引入的,但这些装置体积庞大且吞吐量低。Tan等[33]用2个微型蠕动泵克服了低吞吐量的限制,每个泵有8个泵管路,允许流体通过16个微通道输送,通过测量微流控芯片中培养的Caco-2细胞氨肽酶活性评估其生长和分化速度,与第21天的静态培养的Transwell系统相比,微流控装置中的Caco-2细胞在第5天显示出更高的氨肽酶活性。尽管该系统具有简单、高通量的特点,但这些模型在重现定义的流速方面是有限的。Kim等[34]开发了一个具有流体流动和施加循环机械应变的肠芯片模型。该装置由两个微通道组成,两侧有两个空心腔室,在空心腔室中施加真空,使分离通道的多孔膜单向延伸。该研究发现,流体流动和周期性机械应变的结合导致了褶皱的形成,这些褶皱再现了肠绒毛的结构,并且该系统中使用的Caco-2细胞显示出极化柱状形态,大小与体内上皮细胞相似。
2.3 机械力刺激
在消化过程中,蠕动是由平滑肌与肠神经系统协同作用,在整个胃肠道内产生的食物的不自主的、周期性的推进。蠕动有助于食物消化、营养吸收和肠排空,但也对上皮产生剪切力和径向压力。研究表明,机械拉伸对于准确模拟人体肠道生理、允许细胞分化和防止细菌过度生长至关重要[35]。Jing等[36]提出并构建了一种基于循环变化流体压差原理的新型蠕动肠模型,通过使用多通道、计算机控制的气动泵同时实现了肠道微系统的流体流动和蠕动,考察了蠕动和流体流动对该装置肠上皮细胞生长和分化的影响。结果表明,微流体装置中的周期性蠕动加上流体流动显著促进了肠上皮细胞的增殖以及糖萼和微绒毛的分泌。此外,肠上皮细胞的屏障、吸收和代谢功能以及细胞分化也受到芯片上周期性蠕动和流体流动的影响。Fang等[37]开发另一款包含200个依次连接的横向微孔阵列芯片,通过调节微孔周围的气道内部气压,从而实现孔内类器官的周期性收缩与舒张,模拟肠道的蠕动。研究结果发现,在蠕动环境中长成的人结肠肿瘤类器官具有更均匀的尺寸分布,对该纳米胶束的摄入量显著降低。Grassart等[38]通过循环拉伸模拟肠道蠕动,研究蠕动状态是否会影响人类志贺菌在3D结肠上皮内的传染性。研究表明,与非机械刺激条件相比,拉伸力(蠕动)的应用显著提高了约50%的感染率,蠕动运动促进了细菌入侵。
2.4 氧气梯度产生
肠上皮富含含氧血液,对于增强绒毛的营养吸收和加速针对病原体的免疫反应至关重要。人体肠道是多种微生物群落的宿主,肠道微生物群在肠道的消化和吸收功能中发挥着重要作用[39]。HuMiX实现了肠道模型中氧气浓度梯度的变化,允许Caco-2细胞和厌氧菌之间的共培养,在体内重现转录、代谢和免疫特征[28]。Shin等[40]开发了一种缺氧-氧气接口(AOI芯片),将缺氧培养基从细菌生长的上通道灌注到肠细胞生长的下通道。实验结果表明,上皮细胞层的存在和管腔微通道中的流量依赖性调节对于在AOI芯片中产生稳态垂直氧梯度是必要且充分的。另一个包含高分辨率溶解氧监测的GOC模型是肠芯片,它有6个传感器盘,在模型的顶部和底部固定有氧淬灭荧光颗粒,允许实时监测氧水平。这种GOC模型有一个中央厌氧室,经常用饱和的5% CO2冲洗,维持上腔内低氧水平。使用这款厌氧肠道芯片,Jalili-Firoozinezhad等[41]也证明厌氧条件比好氧条件在生理上能保持更高的微生物多样性。表1概括了常见的肠道吸收芯片模型及其应用。
表 1 肠芯片模型的主要组成和应用细胞类型 共培养 膜材料 细胞外基质 剪切力 蠕动
(循环机械应变)氧气梯度 应用 Caco-2 否 聚对苯二甲酸(PET)膜 无 1 μl/h 否 否 肠道吸收的功能[42] Caco-2 鼠李糖乳杆菌GG (LGG) 聚碳酸酯(PC)膜 胶原蛋白 25 μl/h 否 是 宿主-微生物分子相互作用[28] Caco-2 人肠微血管内皮细胞 (HIMEC) 聚二甲基硅氧烷(PDMS)多孔膜 Ⅰ型胶原蛋白和Matrigel混合物 60 μl/h 否 是 概述疾病模型和对策药物筛选[41] Caco-2 LGG PDMS多孔膜 Ⅰ型胶原蛋白和Matrigel混合物 30 μl/h 10%;0.15 Hz 否 肠道的运输,吸收和毒性研究[34] Caco-2 大肠杆菌 PDMS膜 Ⅰ型胶原蛋白和Matrigel混合物 30 μl/h 10%;0.15 Hz 否 肠道-微生物相互作用和疾病模拟[35] Caco-2 人脐静脉内皮细胞 (HUVEC)、大肠杆菌细胞和巨噬细胞 PDMS膜 Ⅰ型胶原蛋白 60 μl/h 15%;0.17 Hz 否 模拟肠道炎症模型和药物筛选[43] 肠道活检类器官 HIMEC PDMS膜 Ⅰ型胶原蛋白和Matrigel混合物 60 μl/h 10%;0.2 Hz 否 模拟正常肠道生理学[44] 人十二指肠类器官(成人供体) HIMEC PDMS膜 Ⅳ型胶原蛋白和Matrigel混合物(上皮侧)、Ⅳ型胶原蛋白和纤连蛋白混合物(血管侧) 30 μl/h 10%;0.2 Hz 否 研究肠道代谢和药物转运[45] Caco-2 否 无 聚乙烯-醋酸乙
烯酯0.1 ml/min 否 否 高通量药物吸收分析和细菌-宿主相互作用的研究[30] 3. 肠道芯片模型的应用
3.1 肠炎模型的构建
肠炎是一种在发达国家和发展中国家都具有高发病率的疾病,炎症性肠病(IBD)已成为全球性问题,主要包括溃疡性结肠炎和克罗恩病两大类。研究人员发现通过添加细胞因子混合物,例如,白介素-1β、肿瘤坏死因子-α和干扰素γ[46-47],或通过与外周血单核细胞共培养可以在体外模拟肠道炎症[35]。
Kim等[35]在肠芯片中引入致病性大肠杆菌和人单核巨噬细胞构建了相应的肠炎病理模型,并且观察到黏液层损伤、屏障损伤及炎性因子大量表达等炎症反应。之后Shin等[48]又通过在肠腔引入葡聚糖硫酸钠(DSS),首次在体外构建了DSS肠炎损伤及恢复模型,利用该模型作者证明了氧化应激反应是炎症损伤的前提。研究发现蠕动的微流体模型可以重现在小鼠模型中相应的结肠炎,并能观察到的屏障完整性和绒毛结构的破坏。使用来自致病性大肠杆菌的脂多糖激活单核细胞,Caco-2细胞被诱导分泌促炎细胞因子,进而损害屏障完整性,从而模仿IBD病理学特征。此外,促炎信号可以促进中性粒细胞的募集,从而进一步加剧肠道损伤。重要的是,研究人员发现DSS暴露前给予益生菌可以维持肠道屏障,而在DSS后添加细菌时,肠道屏障功能会丧失[49]。这些结果表明,利用体外肠芯片建立肠炎病理模型,可以为肠炎病理机制研究及其治疗药物筛选提供更接近体内肠道环境的研究平台。
3.2 药物吸收和转运
与传统体外肠道模型相比,肠芯片具有高度还原人体肠道微环境、连续的液体流动和高通量筛选的优势[50]。Imura等[42]开发了一种基于微流控芯片的模拟肠道的系统,该芯片由载玻片、半透膜和PDMS组成。以荧光测定结果评价药物渗透性试验,结果显示环磷酰胺能渗透肠屏障,其渗透系数较高,而路西法黄不能在肠壁吸收,其渗透系数较低。这些结果与传统方法的结果一致,证明了该款芯片评估药物吸收的可行性。
Kulthong等[51]分别使用传统的Transwell(静态)和肠芯片(动态)模型,比较高渗透性化合物(安替比林、酮洛芬和地高辛)和低渗透性化合物(阿莫西林)的转运,并使用HPLC或LC-MS测定这些化合物在静态和动态条件下的转运结果。结果显示,相对于静态条件,肠芯片的药物摄取较低,其渗透性值与生物制药分类系(BCS)一致。同样,在接种Caco-2细胞的微流体装置中,几种化合物(姜黄素、甘露醇、葡聚糖、咖啡因和阿替洛尔)的吸收率与体内吸收的研究数据相当。
抗癌药物7-乙基-10-羟基喜树碱(SN-38)是伊立替康经羧酸酶转换后的活性代谢物,其抑制拓扑酶Ⅰ的活性远大于伊立替康,但其具有低水溶性和低跨黏膜通透性的缺点。研究人员发现将其合成为亲脂性前体药物能解决低口服生物利用度问题。Pocock等[52]开发了一款基于微流体的肠道芯片(IOAC)模型,该模型可用于研究亲脂性前药的结构-渗透性的关系(见图3)。IOAC模型利用外部机械力作用,诱导上皮细胞单层产生特异性分化,使细胞表面呈现微绒毛表达起伏形态的屏障功能,这比传统的Transwell模型更具生物相似性。用不同链长和不同分子位置的脂肪酸酯修饰SN-38,观察到SN-38前药溶解度与渗透性系数之间有良好的相关性。论证了模仿肠道上皮关键特征的IOAC 模型在筛选亲脂性前药方面具有显著潜力[52]。
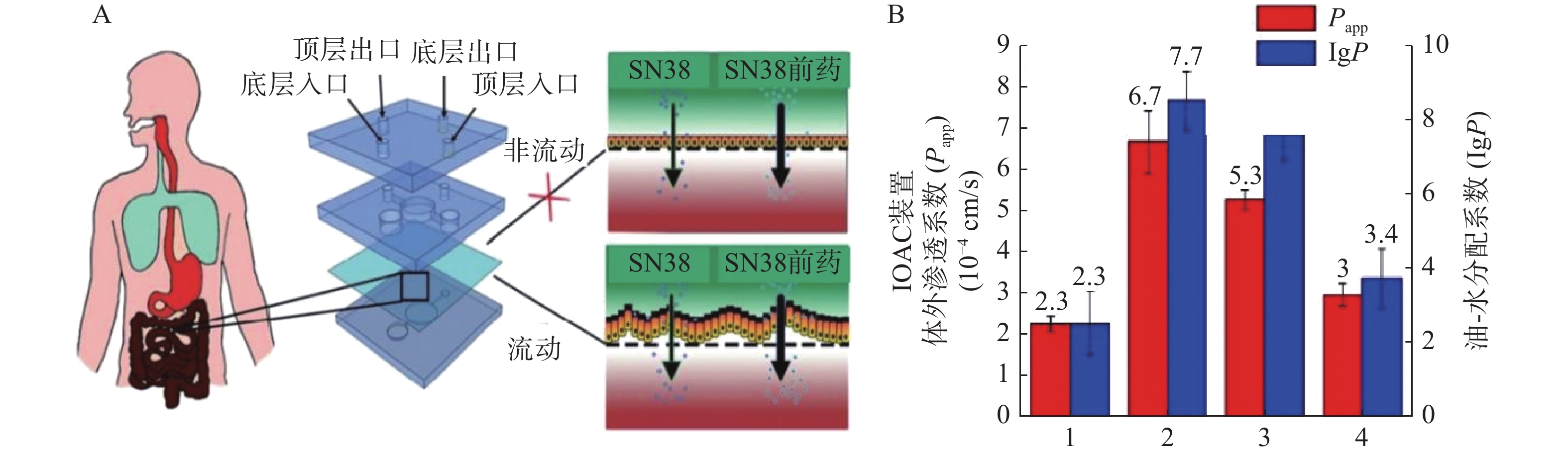 图 3 IOAC装置及对难溶SN38和前药的体外渗透系数与计算的油-水分配系数比较[52]A.IOAC装置示意图;B.SN38和前药的体外渗透性系数与计算的油-水分配系数比较;1. 7-乙基-10-羟基喜树碱;2. 7-乙基-10-羟基喜树碱-20-十一酸酯;3. 7-乙基-10-羟基喜树碱-10-十一酸酯;4. 7-乙基-10-羟基喜树碱-20-丙酸酯
图 3 IOAC装置及对难溶SN38和前药的体外渗透系数与计算的油-水分配系数比较[52]A.IOAC装置示意图;B.SN38和前药的体外渗透性系数与计算的油-水分配系数比较;1. 7-乙基-10-羟基喜树碱;2. 7-乙基-10-羟基喜树碱-20-十一酸酯;3. 7-乙基-10-羟基喜树碱-10-十一酸酯;4. 7-乙基-10-羟基喜树碱-20-丙酸酯4. 结论和展望
近年来,肠道芯片模型在芯片设计、微环境、微流体操控和细胞培养技术方面已经取得了重大进展,为胃肠道疾病机制研究和个体化治疗的发展提供了新的模型。但该技术本身仍然面临许多挑战。
肠上皮细胞的来源对于肠芯片的研究至关重要,Caco-2是目前应用最广泛的模拟肠上皮屏障的细胞系,但Caco-2细胞缺乏黏液生成层,很难控制其分化[53]。此外,Caco-2细胞表现出与人类肠道组织不同的转运蛋白表达[54]。因此,肠芯片还需要进一步研究,以确保上皮细胞系的代谢和转运蛋白活性与在体内观察到的相似。尽管微流控肠芯片模型模拟了人类肠道的许多不同表型和反应,但缺乏在某些疾病中发挥重要作用的特征。例如,平滑肌细胞表达Toll样受体,并且可以通过调节神经胶质源性神经营养因子的产生来调节神经元的完整性。因此,未来的肠道芯片模型构建中应考虑更多因素,例如肌肉和神经系统细胞[20],使得模型具有更多的肠道特征和功能,更接近真实的生理环境。
肠芯片研究的另一个挑战是材料的选用。尽管PDMS在微流控器官装置制备方面具有明显的优势,但PDMS可能吸附介质中存在的小分子、药物或其他荧光标记物,从而降低溶质分子浓度的重现性[55]。为了克服这一点,PDMS及其替代聚合物(例如聚氨酯、苯乙烯嵌段共聚物)的表面改性或基于ECM的材料更适用于预测药物生物利用度或吸收的研究[20]。目前,水凝胶广泛应用于肠道微流控模型,可以提供类似于体内细胞-细胞外基质相互作用的机械和生化环境,促进类组织结构的形成[55]。但其同时存在一些问题,如不稳定、易降解等。因此在未来的肠芯片研究中,寻找开发更优的PDMS替代材料也是非常有必要的。
-
表 1 中国、美国、印度和世界贸易组织关于专利强制许可法律法规
国家/地区 法律法规 颁发年份 条款 部门 条件 中国[9-11] 中华人民共和国专利法(2020年修订) 1985年4月1日起施行 第54条 国务院专利行政部门 在国家出现紧急状态或者非常情况时,或者为了公共利益的目的 专利实施强制许可办法(局令第64号) 2012年5月1日起施行 第6条 国务院有关主管部门建议国家知识产权局给与其指定的具备实施条件的单位强制许可 在国家出现紧急状态或者非常情况时,或者为了公共利益的目的 涉及公共健康问题的专利实施强制许可办法(局令第37号) 2006年1月1日起施行 第3条、第4条 国务院有关主管部门请求国家知识产权局授予实施该专利的强制许可 为了公共利益目的,或国家紧急状态 国际[12] 关于与贸易有关的知识产权协议与公共健康多哈宣言 2001年通过 − 世界贸易组织(WTO) 允许各国利用强制许可制度生产专利药品,明确没有制药能力的成员可以进口其他国家生产的被授予强制许可的专利药品 与贸易有关的知识产权协议(TRIPS) 2005年被纳入 WTO 公共利益、公共健康、紧急状态或其他紧急情况;公共非商业性使用、被确认为限制竞争的行为、专利不实施、因合理要求被拒绝许可、从属专利 印度[7] 专利法(2005年修订) 1970年实施 第84条 印度专利的主管部门专利局以及对专利局实施的专利许可具有复核权的印度知识产权上诉委员会 在公众的合理要求未能得到满足,或者公众无法以合理价格获得此专利发明的情况下;国家突发事件、其他非常紧急情况以及专利产品的公众非商业化使用扩大制造、出口已取得专利的药物产品强制许可范围,出口至无生产能力的地区、国家。 第92条第A款第(1)项 印度专利的主管部门专利局以及对专利局实施的专利许可具有复核权的印度知识产权上诉委员会 美国[13] 未有明文规定药品专利强制许可制度,通过其他零散法条规定和司法判例进行专利强制许可 − − 法官具有自由裁量权 针对滥用专利权的反垄断诉讼中会采用专利强制许可;一般采用审批、政府采购专案、医保等市场准入政策,以谈判协商为主要手段 -
[1] 王魁英. 大规模人员伤亡事件中军队医院医学救援处置流程构建及救治策略研究[D]. 重庆: 第三军医大学, 2017. [2] 魏晓瑜. 新冠肺炎疫情期间医疗物资市场乱象的成因与对策[J]. 社会科学前沿, 2021(1):1-4. [3] 中华人民共和国突发事件应对法[J]. 安全, 2007, 28(10): 60-63. [4] 刘义胜, 田侃. 根据《专利法》第49条研究药品专利强制许可的可执行性[J]. 中国新药杂志, 2016, 25(22):2581-2586. [5] 李宗辉. 论公共健康需求下的药品专利强制许可[J]. 中国发明与专利, 2021, 18(8):69-79. doi: 10.3969/j.issn.1672-6081.2021.08.010 [6] 王欢, 张铖. 口服新型冠状病毒肺炎治疗新药: Paxlovid[J]. 临床药物治疗杂志, 2022, 20(2):13-17. doi: 10.3969/j.issn.1672-3384.2022.02.003 [7] 周亮亮, 田侃, 姚银蓥. 印度药品专利强制许可制度及对我国的启示[J]. 南京中医药大学学报, 2019, 20(1):58-63. [8] 张武军, 张博涵. 新冠肺炎疫情下药品专利强制许可研究: 以瑞德西韦为例[J]. 科技进步与对策, 2020, 37(20):83-88. doi: 10.6049/kjjbydc.ZK202002107 [9] 国家知识产权局. 中华人民共和国专利法(2020年修订)[EB/OL]. (2020-11-23)[2023-09-19]. https://www.cnipa.gov.cn/art/2020/11/23/art_97_155167.html. [10] 国家知识产权局. 专利实施强制许可办法(局令第64号)[EB/OL]. (2012-03-15)[2023-09-19]. https://www.cnipa.gov.cn/art/2015/1/9/art_99_28229.html. [11] 国家知识产权局. 涉及公共健康问题的专利实施强制许可办法[J]. 司法业务文选, 2006(11):22-23. [12] 于良. 科技领域的强制实施实践与启示: 以各国强制专利许可、强制产能调配为例[J]. 科技中国, 2020(8):69-71. [13] 汪敏, 王洪友. 中美药品专利强制许可模式研究[J]. 中国卫生法制, 2023, 31(2):66-71,120. [14] 袁勤玮. 公共卫生危机中医疗防护用品专利的强制许可研究[J]. 医学与法学, 2022, 14(3):107-111. doi: 10.3969/j.issn.1674-7526.2022.03.021 [15] 中华人民共和国中央人民政府网. 中共中央关于制定国民经济和社会发展第十四个五年规划和二〇三五年远景目标的建议 [EB/OL].(2020-11-03)[2023-09-19]. http://www.gov.cn/zhengce/2020-11/03/content_5556991.htm. [16] 竹苗嘉. 浅析药品专利强制许可使用费的计算标准[J]. 广西政法管理干部学院学报, 2021, 36(3):31-35. [17] 仲宣惟, 韩若斯, 李波. 中美应对突发公共卫生事件医药产品应急政策分析与思考[J]. 中国药学杂志, 2020, 55(23):1979-1984. doi: 10.11669/cpj.2020.23.013 [18] 杨锋. 抗新冠肺炎药物专利布局及对突发公共卫生事件的政策启示[D]. 重庆: 西南政法大学, 2021. -





 下载:
下载:
 下载:
下载: 

