-
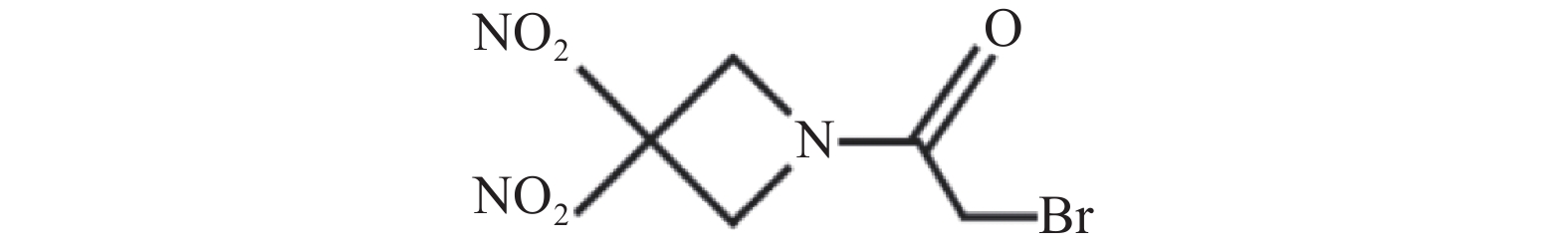
RRx-001化学名称为2-溴-1-(3, 3-二硝基氮杂环丁烷-1-基)乙烷-1-酮,结构如图1所示。RRx-001是由EpicentRx公司研发、具有首创潜质的小分子药物,经过美国食品药品监督管理局(FDA)批准,RRx-001作为孤儿药进入临床试验用于治疗小细胞癌、神经内分泌癌和胶质母细胞瘤的患者。另外,RRx-001作为放疗增敏剂也已进入临床试验。RRx-001不仅可作为单药用于临床,还可与化疗、放疗、靶向药物及其他免疫疗法联合使用[1, 2]。RRx-001具有较短的半衰期,体内代谢较快[3],临床试验采用口服给药或静脉给药[4]。作为一种新型抗肿瘤药物,RRx-001因其结构中包含的α-溴乙酰基片段,可通过双分子亲核取代反应机制与游离的巯基如还原性谷胱甘肽和血红蛋白β链上Cys93等发生选择性化学反应[5]。 RRx-001最常见的副作用是静脉输液相关疼痛,因此临床试验研究时将RRx-001与患者血液混合后给药,并且控制较慢的输注速度 [6, 7]。本文综述了RRx-001的作用机制研究最新进展,总结了近年来RRx-001临床试验的研究结果,为RRx-001进一步结构优化和临床应用研究提供了事实依据和指导方向。
-
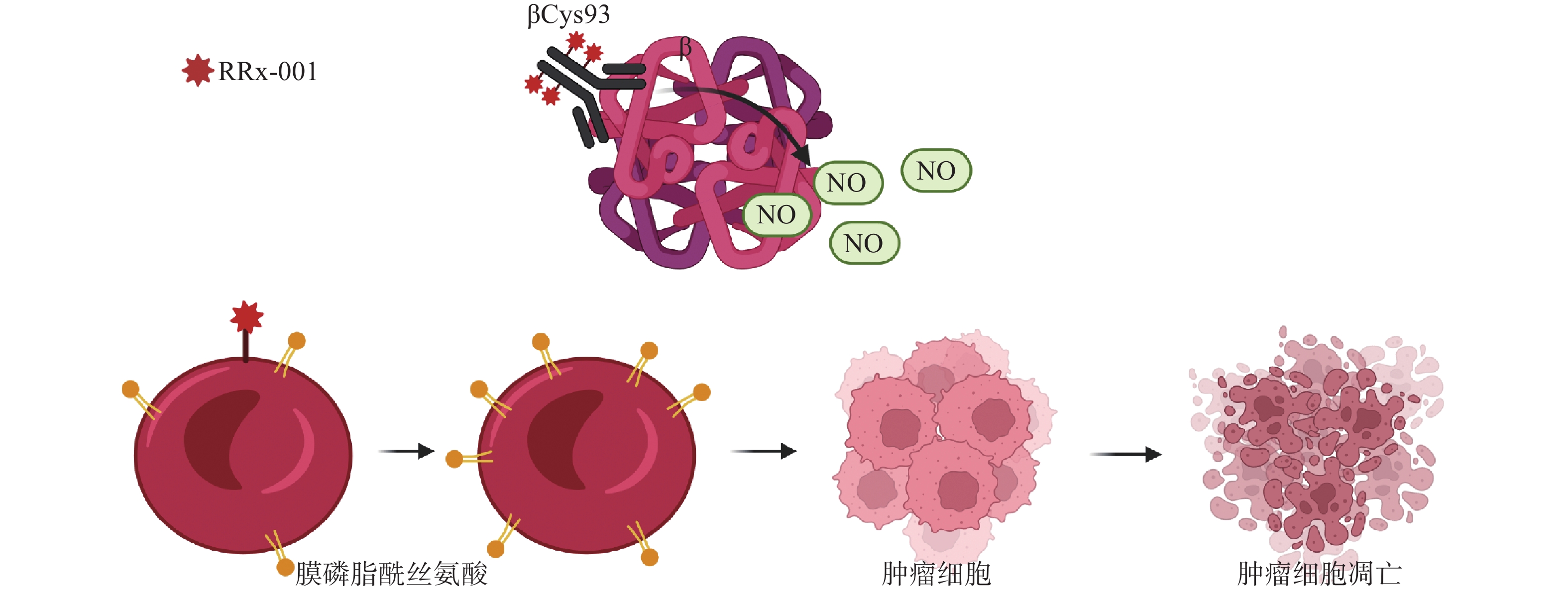
早期研究表明,RRx-001是一种NO拮抗剂,不仅可作为NO供体,而且能作为“红细胞吞噬免疫治疗剂”,可增加红细胞对肿瘤血管的依附性[8]。血红蛋白β链上的Cys93与RRx-001结合位后,释放出NO并入血。在缺氧条件下,RRx-001能增强脱氧血红蛋白亚硝酸盐还原酶的活性,使NO的生成大大增加[9]。RRx-001能选择性并不可逆地与血红蛋白β链上的Cys93结合[10],增加红细胞对内皮的黏附能力,提高红细胞膜磷脂酰丝氨酸表达量,并且可使红细胞优先定位到实体瘤 [11]。与RRx-001结合后的红细胞优先粘附在肿瘤血管内皮后,肿瘤便以“特洛伊木马”的方式内化和分解代谢,释放具有氧化还原活性的RRx-001和红细胞代谢物(图2)[12]。
此外,RRx-001是一种Myc蛋白抑制剂,通过抑制Myc可下调PD-L1的表达从而抑制免疫逃逸。研究表明,RRx-001还可作为Nrf2诱导剂发挥放化疗保护作用,Nrf2是bZip转录因子,属于调控蛋白,Nrf2能通过细胞氧化还原状态的改变而被激活,并通过上调抗氧化剂、异种生物代谢和其他细胞保护酶来恢复细胞内稳态[13]。RRx-001能促进Nrf2在人克隆结肠腺癌细胞(Caco-2细胞)核内的积累,导致血清HO-1的表达显著增加[14]。但RRx-001对Nrf2的调控具有“双刃剑”作用,Nrf2长期激活亦有促癌作用,可以诱导氧化应激,使老年人或慢性病患者OS水平升高[15]。抑制G6PD活性可能是RRx-001发挥抗肿瘤作用的另一个重要机制,研究发现,RRx-001能以浓度依赖的方式抑制G6PD [16]。作为一种有效的G6PD抑制剂,RRx-001已处于临床试验用于小细胞肺癌患者的治疗。并且,RRx-001与JQ1的联合治疗显著降低了皮下肿瘤组织中KEAP1的表达水平,通过调控KEAP1-Nrf2-G6PD轴,抑制小细胞肺癌细胞的氧化还原代谢[17]。
迄今为止,RRx-001的作用机制尚未明确。近年来研究表明,RRx-001除可能通过以上作用机制发挥抗肿瘤活性以外,还可能作为CD47小分子调节剂发挥抗肿瘤免疫活性。并且也可作为NLRP3抑制剂起到抗炎作用,进一步拓展其在抗肿瘤和抗炎药物开发的应用。
-
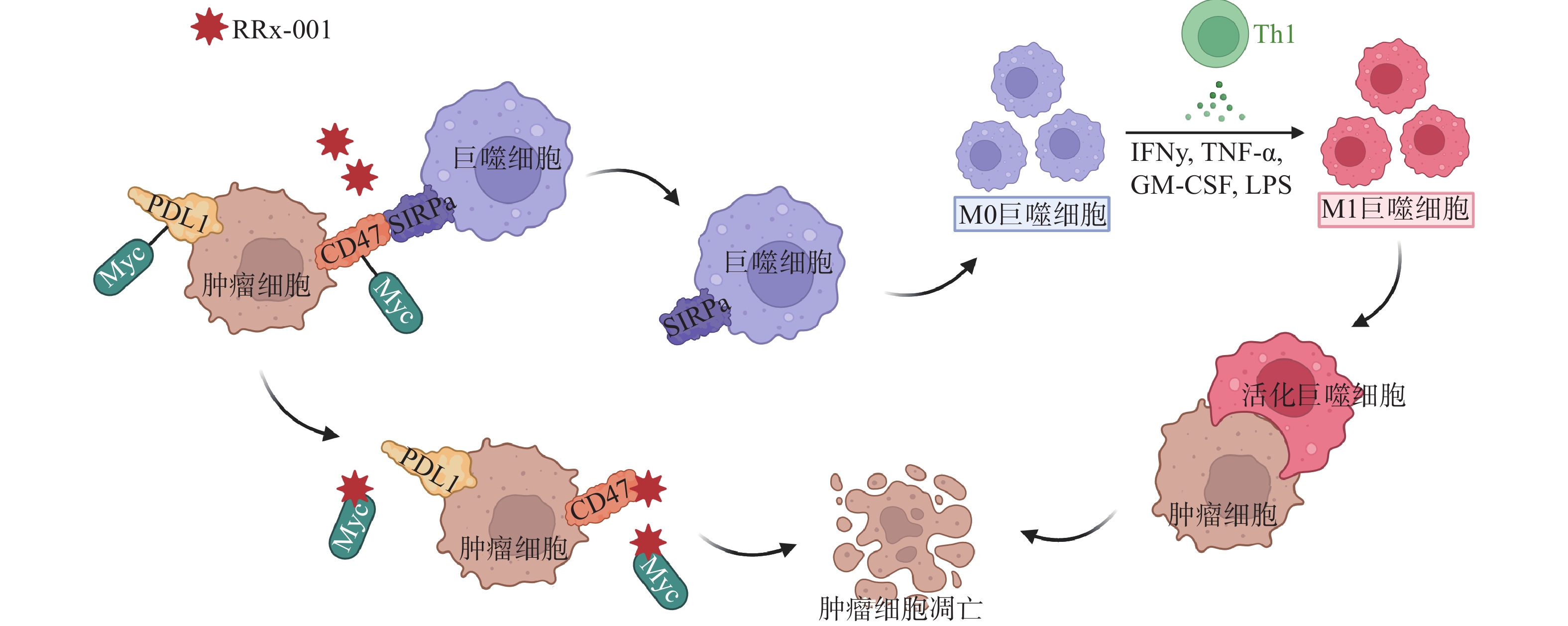
CD47是肿瘤细胞上一种广泛表达的细胞表面蛋白,能传递抗吞噬的信号从而阻止巨噬细胞介导的对肿瘤细胞的吞噬[18]。通过下调CD47的表达,可恢复巨噬细胞的作用,使巨噬细胞向M1巨噬细胞分化,刺激颗粒细胞瘤(GCT)的吞噬作用从而可达到杀灭肿瘤细胞的作用[19]。RRx-001是首个进入临床的CD47小分子调节剂,降低了肿瘤细胞和单核/巨噬细胞上CD47的表达水平,恢复了CD47-SIRPα相互作用导致的吞噬抑制功能(图3)。体内研究证实,肿瘤微环境中浸润巨噬细胞的存在是RRx-001具有抗肿瘤活性的必要条件[20]。研究表明,作为CD47小分子调节剂,RRx-001还可以与pH响应型纳米药物以及T型钙通道抑制剂联用,将药物输送到肺肿瘤中对肿瘤细胞起到杀伤作用[21]。
-
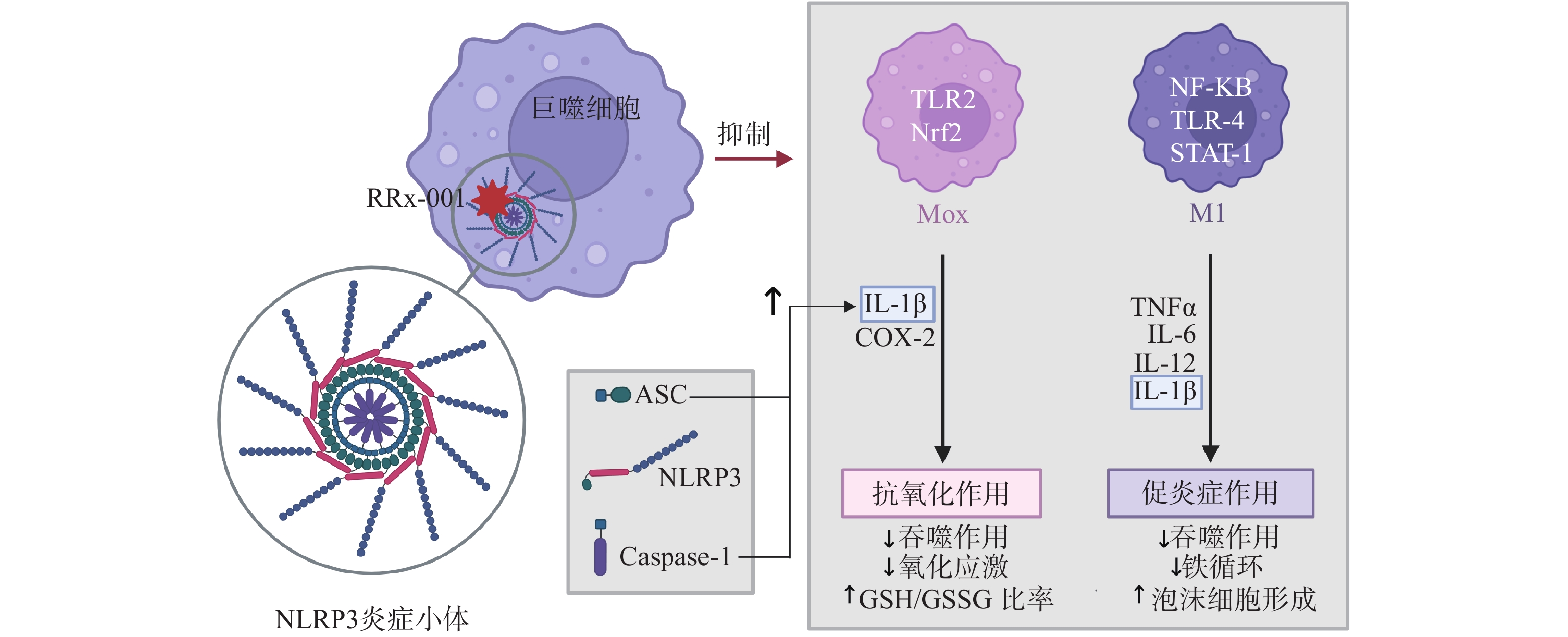
NLRP3炎症小体是固有免疫的主要组成成分之一,在机体免疫反应和炎症性疾病发生发展过程中起到了非常重要的作用,炎症小体激活的失调导致一些自身炎症性疾病如代谢综合征、2型糖尿病、阿尔兹海默病、心血管疾病、癌症等,这些疾病与较高水平的IL-1β和IL-18分泌有关[20]。RRx-001是NLRP3炎症小体的双重抑制剂,能选择性与NLRP3中心结构域的半胱氨酸结合[15],并且与NLRP3的结合能以级联的方式抑制巨噬细胞的极化,减少IL-1β的释放,阻滞增强的免疫反应和自身免疫的发生(图4)[14]。RRx-001还能剂量依赖性抑制ASC的聚合,直接抑制NEK7、NLRP3和ASC间的相互作用以及NEK7和NLRP3之间的相互作用,进而抑制NLRP3炎症小体的组装过程。[22]
-
RRx-001的临床研究主要是以肿瘤为适应症,进展最快的已进入Ⅲ期临床试验,研究较多的为小细胞肺癌和非小细胞肺癌,其他如结直肠癌、脑转移癌等研究亦有所涉及。除肿瘤外,因发现RRx-001可作为NLRP3抑制剂,一些炎症相关和神经保护的临床试验研究也正在开展,在今年热点COVID-9领域中的研究也证明了RRx-001对于新冠肺炎导致的急性呼吸道症状可能具有治疗作用[23-25]。综述[26]总结了RRx-001的3个主要临床试验:ROCKET、G-FORCE和QUADRUPLE THREAT,本文在此基础上,对RRx-001的临床试验进行了深入系统总结(表1)。
表 1 RRx-001部分临床试验
序号 名称 临床试验 临床阶段 试验时间 给药剂量 适应证 1 剂量依赖性试验 NCT01359982 Ⅰ期 2011.10至2013.03 推荐剂量16.7 mg/m2 肿瘤 2 PRIMETIME NCT02518958 Ⅰ期 2015.01至2015.11 剂量递增,最大剂量16 mg 晚期转移性癌症 3 G-FORCE-1 NCT02871843 Ⅰ期 2016.07至2018.05 推荐剂量4 mg 高级别胶质母细胞瘤 4 BRAINSTORM NCT02215512 Ⅰ/Ⅱ期 2015.02至2017.02 推荐剂量10 mg/m2 脑转移瘤全颅放疗 5 ROCKET NCT02096354 Ⅱ期 2014.06起 4 mg 三/四线转移性结直肠癌 6 QUADRUPLE THREAT NCT02489903 Ⅱ期 2015.06起 4 mg+自体静脉血12 ml 小细胞肺癌,EFGR突变的非小细胞肺癌,
高级别神经内分泌肿瘤,卵巢肿瘤7 PREVLAR NCT03515538 Ⅱ期 2018.07至2019.08 4 mg 口腔黏膜炎 8 REPLATINUM NCT03699956 Ⅲ期 2019.03起 4 mg 三线小细胞肺癌 -
剂量依赖性临床试验是一项较早开展,首次进入人体的开放式I期临床试验。研究评估了RRx-001的安全性、耐受性、剂量推荐和毒性反应情况。研究于2011-2013年共招募25例患者,给药剂量递增前有两周观察期,3名患者的起始剂量为10 mg/m2,剂量递增依次为 16.7、24.6、33、55 mg/m2和 83 mg/m2,每个剂量组中至少入组3名患者。治疗持续到病情进展或出现剂量依赖毒性反应或其他不良事件出现,每个治疗日都进行标准的血液检查和化学检查,同时观测治疗效果。从研究结果可以看出,RRx-001总体具有良好的耐受性,不良反应多为1~2级,主要不良反应为输液相关手臂疼痛,因而推荐每周16.7 mg/m²的剂量为Ⅱ期临床试验剂量[27]。
-
PRIMETIME是一项针对于晚期转移性癌症的I期先导性研究,研究采用了3+3的形式确定每个剂量水平的联合用药安全性。研究选用的给药方法是对于入选的晚期癌症患者每周使用一次递增剂量的RRx-001,同时与每隔一周3 mg/kg的纳武利尤单抗联合使用,RRx-001的最高剂量为16 mg,每6周评估一次治疗效果。由于样本量较小,研究结果暂无统计学意义,现有数据表明RRx-001参与的治疗总体耐受性良好,肿瘤相关巨噬细胞密度可能与RRx-001相关联。但是,RRx-001给药期间观察到假性进展即肿瘤先随着免疫细胞的渗透而增大,后因肿瘤细胞的清除退化趋于稳定。此项临床试验研究初步提供了RRx-001有效性的证据,以及进一步的临床研究方案依据[28]。
-
G-FORCE-1是一项非随机、开放式,分为两部分的I期临床试验,研究放疗时RRx-001和替莫唑胺剂量递增或固定剂量带来的临床治疗效果。临床试验包括6组患者,所有患者均接受了总剂量60 G,30次照射。前4组患者照射期间接受每日75 mg/m2剂量的替莫唑胺和每周递增剂量的RRx-001,依次为0.5、1、2、4 mg,最多治疗6次。替莫唑胺的剂量由放疗结束6周后开始,起始剂量变为150 mg/m2,28 d为一个周期,连续治疗5个周期,如无2级以上不良反应则增加到200 mg/m2,连续治疗6个周期。第5和第6组患者则是在照射期间接受每日75 mg/m2剂量的替莫唑胺和每周固定剂量的RRx-001(4 mg),放疗结束6周后,第5组患者开始接受100 mg/m2替莫唑胺和0.5 mg RRx-001,第6组患者接受100 mg/m2替莫唑胺和4 mg RRx-001,治疗结束的标准均为病情进展或完成6个周期的治疗。结果表明,在放疗和替莫唑胺治疗方案中添加RRx-001可以增加其治疗耐受性,提高受试者生活质量。并且,降低了毒性如血液学毒性的减少、部分骨髓保护作用[29]。
-
BRAINSTORM是一项单臂、多机构、开放式I/Ⅱ期临床试验,旨在研究RRx-001对于脑转移瘤患者全颅放疗的安全性和有效性。在此研究中,患者在全颅放疗前两周,每周两次,以及放疗前的第2天和第4天静脉给药RRx-001,并且在放疗疗程进行的第1、4、8、11天接受RRx-001治疗,剂量升级梯度为10、17、33、55 mg/m²。治疗期间使用磁共振对患者炉内病灶进行评估,对最佳颅内总反应率和总生存期进行计算评估。研究表明,RRx-001和全颅放疗之间具有潜在协同作用,RRx-001治疗总体耐受良好。尽管接受RRx-001治疗的患者颅内疾病控制率和仅接受全颅放疗的患者相比无统计学改善,并且总生存期也没有明显改变。但是,没有出现患者死于神经系统疾病,这一定程度上肯定了RRx-001对于脑的保护作用[30]。
-
ROCKET是一项旨在比较RRx-001 和伊立替康联合使用与瑞格菲尼单药在既往接受伊立替康治疗的三、四线结肠直肠癌患者中的安全性和有效性。34例患者以2∶1的比例接受RRx-001治疗,即RRx-001治疗组的患者先用4 mg的RRx-001作为“入门药”治疗两个月,若被认为临床适用则给予180 mg/m2的伊立替康。另一组则是患者接受160 mg瑞格菲尼,若被认为临床适用则再给予180 mg/m2的伊立替康。治疗后每周观察患者病情进展情况并计算患者的无进展生存期和总生存期。研究表明,在三、四线晚期结直肠癌的治疗中,先使用RRx-001,然后再给予伊立替康治疗可能是一种有效的治疗方案,这种方法比瑞格菲尼单药带来更好的疗效,显著改善无进展生存期和总生存期,并且毒性更低。但此研究规模较小,需要进一步扩大样本量确认RRx-001的有效性[31]。ROCKET实验后,动物实验又验证了RRx-001与瑞格菲尼联用的可能性,实验结果证明联合用药可以提升抗肿瘤活性并且减小副作用[32]。
-
QUADRUPLE THREAT是一项探索性、开放式Ⅱ期临床试验,评估了既往治疗过的小细胞肺癌、EGFR突变的非小细胞肺癌、恶性程度较高神经内分泌肿瘤和卵巢癌患者使用RRx-001后再进行铂类化疗的安全性和可行性。此项研究中患者接受每周一次4 mg的RRx-001混合自身12 ml自体静脉血共同输注,这是为了减少剂量增加后导致的凝血和溶血风险。在RRx-001治疗的过程中通过影像检查评估患者的肿瘤进展状况,若出现肿瘤进展或临床恶化则使用6个周期化疗药物治疗,如给予100 mg/m2的依托泊苷或60 mg/m2的顺铂。研究结果证明,RRx-001的耐受性良好并与既往治疗过的小细胞肺癌患者中对依托泊苷和其他铂类药物的后续反应相关。临床目前的标准治疗并不有效,对于接受临床三线及以上治疗的患者,RRx-001给此类患者的后续治疗提供了可能性[33]。动物实验将RRx-001的疗效和安全性与铂类药物进行对比,结果证明RRx-001的疗效明显高于其他铂类药物略低于顺铂,但毒性明显低于顺铂,与临床结果一致[3]。
-
PREVLAR是一项随机、无盲、开放式Ⅱa期临床试验,旨在研究RRx-001对头颈部癌症患者化放疗导致口腔黏膜炎的治疗方案安全性和有效性。在此研究中53名患者被分为4组,在以顺铂为基础的化放疗外,1~3组在开始化放疗两周前地塞米松处理后接受每周两次4 mg的RRx-001,第4组则不接受RRx-001的干预。1~3组在开始化放疗后进行不同处理,第2组在疗程的第2和第5周再接受两次4 mg的RRx-001,第3组则在疗程的前6周每周接受一次4 mg的RRx-001,第1组疗程内不接受RRx-001的干预。化放疗开始后每周对口腔黏膜炎进行两次评估,直至溃疡性口腔黏膜炎消除,此为观察结束终点。研究结果表明,接受RRx-001治疗后溃疡性口腔黏膜炎的病程缩短,严重程度和症状有明显减轻,因而体现出放疗保护作用。研究还指出RRx-001似乎不能降低放疗期间罹患溃疡性口腔黏膜炎的绝对风险,但可显著缩短其持续时间。并且,RRx-001治疗方案未见明显不良反应,耐受性良好。此研究使RRx-001获得FDA快速通道资格,可作为放疗保护剂预防或改善严重的口腔黏膜炎[15, 34]。
-
REPLATINUM是一项随机、开放式Ⅲ期临床试验,旨在分析RRx-001和铂类药物联合治疗与仅用铂类药物治疗三线小细胞肺癌的疗效差异。研究将患者1∶1随机分配到两组中,一组接受3周为一个周期、每周一次4 mg的RRx-001和第1~3天的依托泊苷100 mg/m2以及另一种铂类药物如顺铂60 mg/m2或卡铂治疗,若病情好转则交替使用连续两周每周一次4 mg的RRx-001和减量单药铂类药物维持治疗。另一组则仅接受21天为周期的第1~3天的依托泊苷100 mg/m2以及另一种铂类药物如顺铂60 mg/m2或卡铂治疗。治疗一个周期后通过CT评估,此后每两个治疗周期评估一次,安全性评估则贯穿整个治疗过程。目前此研究正在进行中,研究结果将揭示RRx-001对于铂类药物化疗的敏感性,以及和铂类药物交替使用的可行性和安全性[35]。
-
RRx-001作为一种首创小分子药物,主要作用机制除了NO拮抗剂、Myc抑制剂、G6PD抑制剂以及对于红细胞的作用以外,作用机制研究的热点是作为NLRP3抑制剂、Nrf2诱导剂、CD47抑制剂。目前,RRx-001已经进入了III期临床试验阶段,在此之前,I和Ⅱ期临床试验已经证实其在小细胞肺癌、结直肠癌、头颈部癌、脑转移和神经胶质瘤以及肺部炎症等的治疗效果以及放化疗的增敏和保护作用。尽管RRx-001还没有获批上市,现有临床试验一定程度上证实了RRx-001作为单药使用时以及与其他药物联用时的有效性和安全性,但仍需进一步扩大临床样本开展更大规模的临床试验证实。但是,基于现有临床数据,RRx-001有望成为治疗晚期癌症患者或是恶性程度较高癌症患者的治疗药物。
Clinical research progress on RRx-001
-
摘要: 恶性肿瘤、神经退行性疾病、血管性疾病等一直是临床治疗的难点,由于这些疾病的发病机制复杂性,找寻疗效高且副作用小的药物是治疗药物研究的热点。RRx-001作为潜在首创的小分子药物,有望成为肿瘤免疫治疗、放化疗增敏和保护的重要临床一线药物。目前,RRx-001已进入Ⅲ期临床研究阶段,Ⅱ期临床试验数据证实了RRx-001临床安全性和有效性,并且发现与临床肿瘤治疗一线药物联合用药的优越性。本文总结了RRx-001的作用机制研究新进展和主要临床试验研究结果,对后续针对RRx-001的优化设计和临床应用具有一定的指导意义。Abstract: It is difficult to treat malignant tumors, neurodegenerative diseases, and vascular diseases. For pathogenesis complexity of these diseases, researchers have focused on finding more drugs with high efficacy and low side effects. As a potential first-in-class drug, RRx-001 is expected to be an important first-line drug in tumor immunology, radiosensitizer and radio protecter. Currently, RRx-001 entered phase III clinical trials. The data of the phase II clinical trials demonstrated its safety and effectivity as a single agent and in combination with first-line clinical drugs. The novel mechanisms of RRx-001 and the result of main clinical trials were summarized, which could be valuable to further optimization and clinical application.
-
Key words:
- RRx-001 /
- tumor immunology /
- review /
- clinical trials
-
中药挥发性成分(VOCs)是指中药中一类具有芳香气并易挥发的成分,其化学组成复杂,主要包括挥发油类以及其他分子量较小、易挥发的化合物,例如萜类、脂肪族、芳香族化合物等。VOCs具有发汗解表、芳香开窍、镇咳祛痰、理气、驱风、抑菌、镇痛、杀虫等多种功效。作为中药学研究的热点之一,高效率、高标准的检测药材中VOCs十分关键。因此,利用现代化方法来实现对中草药挥发性成分的细致分析,意义巨大。
VOCs常用气相色谱-质谱联用(GC-MS)方法进行分析,虽分离能力强,但样品需要预处理且分析时间长。气相色谱-离子迁移谱(GC-IMS)法结合了GC突出的分离能力和IMS快速响应、高灵敏度的特点,具有样品准备简便、高灵敏度、高分辨率等显著优势,结合化学计量学分析中药材VOCs所呈现图谱,可实现对药材VOCs无损、快速区分[1]。
1. 气相色谱–离子迁移谱联用技术原理
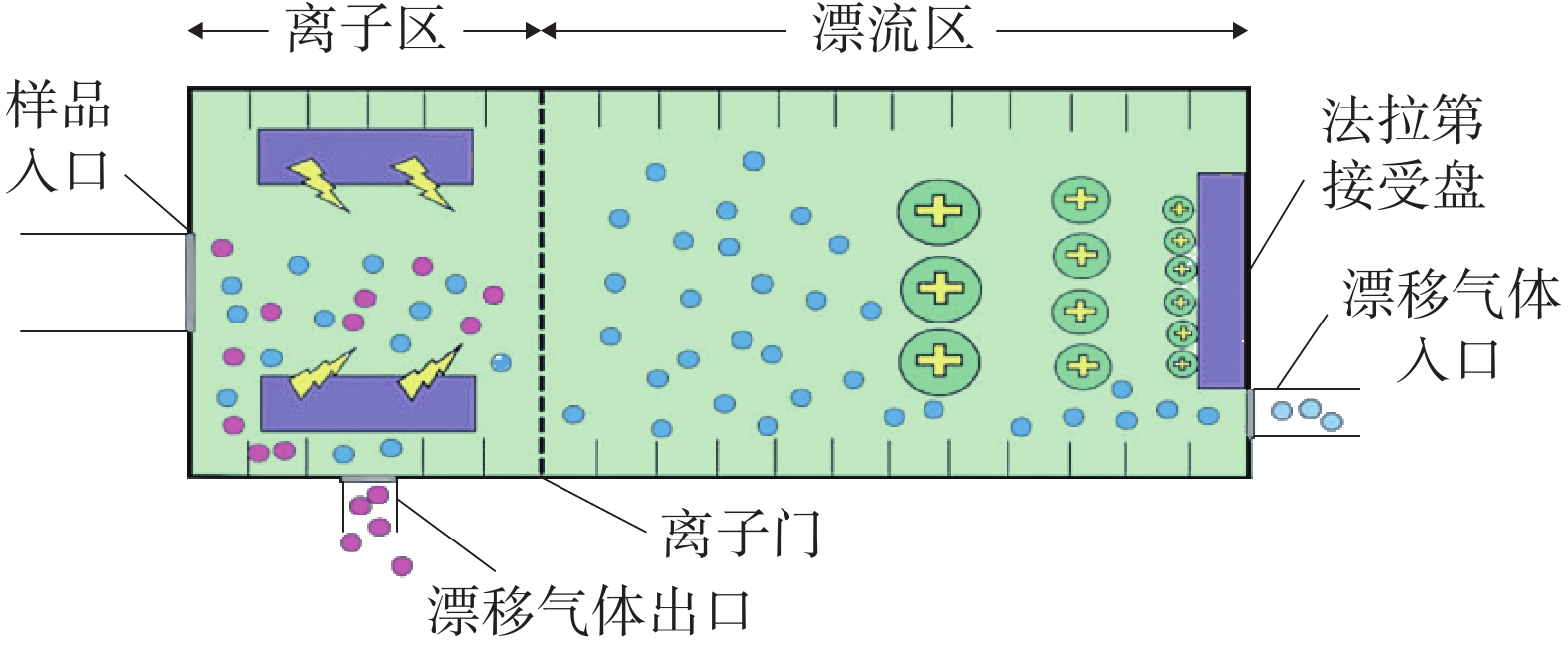
GC-IMS 技术的基本原理[2]是通过将样品混合物引进气相色谱仪进行分离,样品分子和载气分子在离子源放射性物质的作用下发生一系列反应形成产物离子,这些产物离子在不同的电场驱动下通过离子门进入迁移区,与逆向而来的中性迁移气体分子发生碰撞而损失能量。产物离子在电场中的迁移速率不同,到达检测器上的时间不同,从而使样品差异化分离(如图1),最后可得到一个包含有离子迁移时间(X轴),气相色谱保留时间(Y轴),离子强度(Z轴)的三维谱图(如图2)。
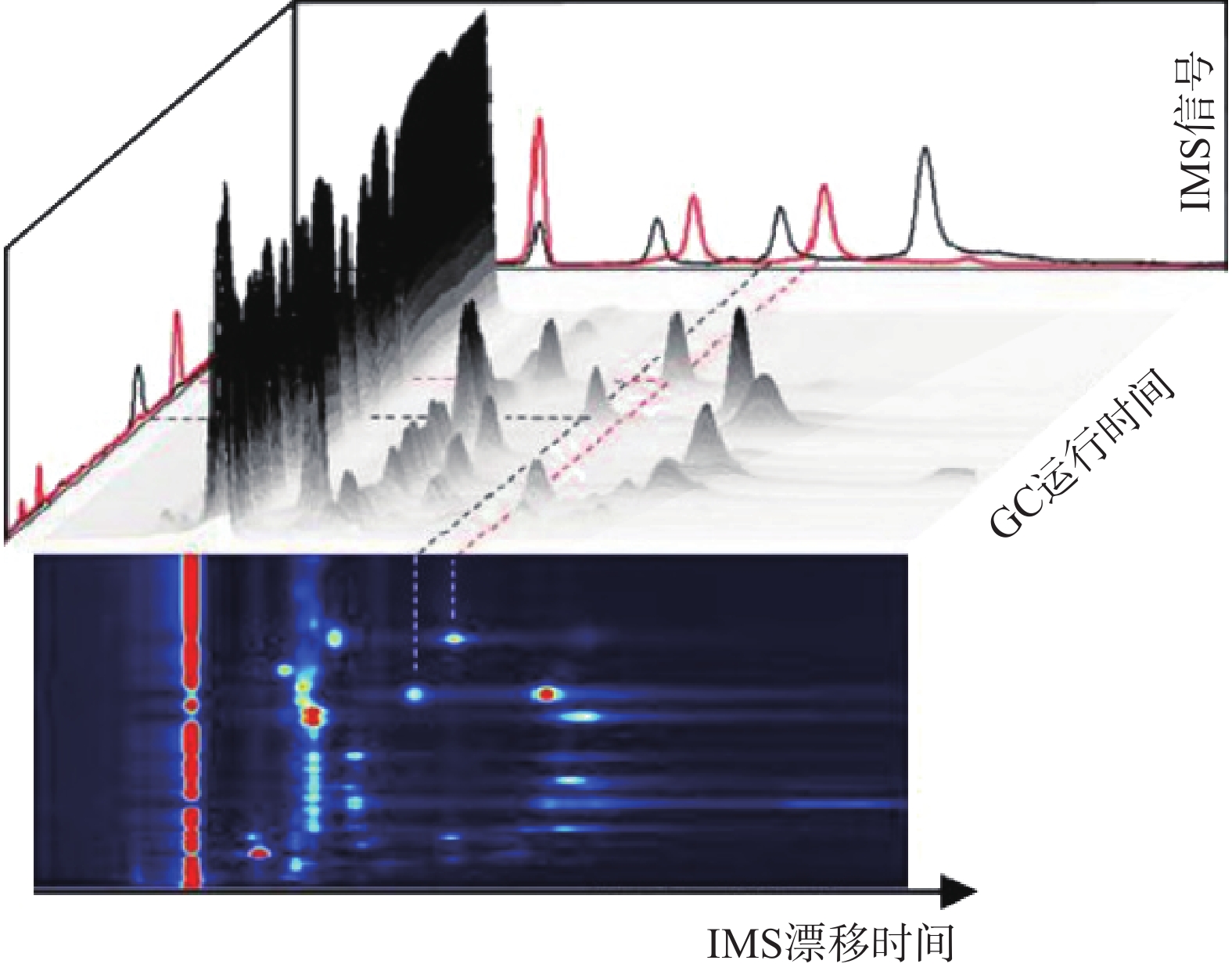 图 2 气相色谱-离子迁移谱联用技术结果三维谱图[3]
图 2 气相色谱-离子迁移谱联用技术结果三维谱图[3]顶空-气相色谱-离子迁移谱(HS-GC-IMS)是应用于检测药材中VOCs最为广泛的方式之一 [3]。其原理是首先将样品中的VOCs通过热孵育和振摇使之从药材中逸出,随后抽取顶空气体进行分析,避免复杂基质干扰,再使之进入气相色谱(GC)、离子迁移谱(IMS)中,得到相应谱图。HS-GC-IMS无需样品预处理,在分析复杂样品或需要快速检测场景方面更具优势。
自从1972年第一张经过GC分离的IMS谱图出现[2],早期主要用于军事领域(如化学战剂检测)和毒品筛查的先进技术逐渐面向市场,应用于研究(如图3),引进国内后广泛使用于中药研究。现阶段,通过GC-IMS捕捉到中药材中的微量VOCs,将其应用于区分中药的不同种类和产地、监控中药炮制过程以及中药复方组分分析等[4],为中药材的产地及真伪鉴别提供可靠的依据,同时也为质量控制和药效研究等方面提供数据支持。
2. 在中药鉴定中的应用
2.1 同属不同种的中药鉴别
同属不同种之间的中药材亲缘关系比较接近,在VOCs种类差异上不显著,利用GC-IMS技术善于捕捉挥发性化合物种类微小差异的特点,可对样品进行品种鉴别。
陈皮中主要含有三萜类、挥发油类等几百种成分,有平喘止咳、调节血管等药理作用[5-6],刘主洁等[7]和Lv等[8]采用HS-GC-IMS对陈皮和广陈皮样品中VOCs进行研究,分析二者的特征信号,以邻氨基苯甲酸二甲酯为广陈皮最明显的特征标记物,柠檬烯、癸醛等也可作为广陈皮的特征信号,利用这些特征信号可对陈皮和广陈皮进行区分。山莓是覆盆子的混淆品之一,为保证用药安全有效,有必要对两者进行区分[9],严爱娟等[10]采用GC-IMS技术检测山莓和覆盆子VOCs,明确鉴定出覆盆子特征成分较山莓多,其中癸醛、1-辛烯-3-醇等在覆盆子样品中的含量更高,苯甲醛、2-丁酮等在山莓样品中的含量更高,以此来实现山莓和覆盆子的区分。彭旭阳等[11]采用GC-IMS分析新疆和田地区“梭梭”和“红柳”肉苁蓉这两种不同寄主肉苁蓉挥发性物质之间的不同,找到了二者主要差异物质为苯甲醛、庚醛等。
2.2 中药不同产地鉴别
道地药材是指生长在特定的自然生态环境中,经过一系列技术培育和加工而成,且被公认为比其他地方生产的同种药材的质量和治疗效果好的药材[12]。但随着产地的迁移、品种的引入,在外观性状上对道地药材和其他产地的中药进行简单鉴别已经不能满足需求。
王振洲等[13]采用GC-IMS对来自不同产区的人参VOCs进行检测,发现2,5-二甲基吡嗪和2,6-二甲基吡嗪等VOCs在吉林集安四年生人参中含量较高,而吉林敦化四年生人参中含量相对较低,由此鉴别四年生吉林集安和敦化的人参。西洋参同属于五加科人参属,成功引种进入我国后,辽宁、吉林和山东是其主产区[14],王燕等[15]使用GC-IMS技术对美国、加拿大、山东等五个不同产地的西洋参进行研究,共鉴定出53种VOCs,其中美国西洋参中2-庚酮等成分的含量较高,而加拿大产α-蒎烯等成分的含量显著高于其它产区,中国产芳樟醇等成分的含量较高,其中吉林产地的含量是辽宁、山东产地的2.60和3.60倍,通过这些显著差异可对西洋参进行产地溯源和鉴别。
李曼祎等[16]使用GC-IMS技术对新疆、宁夏、内蒙古、青海四个主要产区的枸杞进行化学成分测定,分析出了四个地区含量差异较大的16种物质,发现内蒙古枸杞区别于另外三个产地特有的物质为正丁醇,同时筛选出了叶醇等五种标记性物质对枸杞产地进行区分。Li[17]等分别采用HS-SPME-GC-MS和HS-GC-IMS检测河北、河南、江苏、浙江、安徽以及山东6个不同地区的五味子,结果显示安徽的五味子萜类物质含量较高,同时该研究也证明了HS-GC-IMS对样品的分类效果优于HS-SPME-GC-MS。山东为瓜萎的道地产区[18],河北也是瓜萎的重要产区,不同产地的瓜萎可能在品质及所含成分上有所差别,从而对药效也会产生一定的影响[19-20]。张敏敏等[19]采用GC-IMS在瓜萎皮样品中共鉴定出醛类和醇类等88种VOCs,分析发现山东瓜蒌皮中2-庚酮、正壬醛等物质的含量低于河北瓜蒌皮,但1-己醇、糠醇等含量更高的结论,通过这些差异基本实现了两地区瓜萎皮的区分。Li等[21]采用HS-GC-IMS联合PCA建立松茸特征图谱,对分别来自云南和四川的松茸样品以及它们的菌盖和菌柄进行研究,发现虽然指纹图谱相似度较高,但各自也有其特征性挥发物:苯乙醛和糠醇等仅在云南产松茸的菌柄中被发现,戊烷仅在四川产松茸的菌柄中被发现,戊醛仅在云南产松茸的菌盖中检出,甲基吡嗪仅在四川产松茸的菌盖中检出,通过特征性挥发物的不同,可对分别产自云南和四川的松茸进行区分。
2.3 中药复方中主成分的鉴别
中药复方成分众多且复杂,确保其质量符合标准、疗效可靠、使用安全是关键,采用HPLC特征图谱进行分析是目前公认的良好方法之一[22]。GC-IMS检测灵敏度高、分离效果好,是对HPLC表征中药复方质量分析的有益补充。
Yuan等[23]设置了对照组、慢性不可预测轻度应激(CUMS)组和CUMS+百合鸡子黄汤组,采用HS-GC-IMS等方法对百合鸡子黄汤治疗CUMS大鼠粪便中挥发性化合物含量进行研究,鉴定出了11个生物标志物,找出了对照组大鼠粪便样品中甲硫醚含量较高,而CUMS组则较低,同时百合子鸡汤组抑郁表现出保护性干预作用;Yin等[24]采用HS-GC-IMS对开心散中的挥发性化合物进行分析,鉴别出β-细辛酮等十种VOCs可作为开心散的质量标记物,进一步为开心散质量控制及药效机制等的相关研究奠定基础;李巍等[25]利用HS-GC-IMS对清感秋饮中的VOCs进行定性定量分析,共鉴定出120种VOCs,其中,紫苏属酮、β-石竹烯等可能为其主要药效成分。
3. 在中药加工炮制中的应用
中药的加工炮制是提高临床疗效的重要手段,也是保证临床用药安全的重要措施[26]。应用不同的炮制方法可能会引起中药中的化学成分发生含量加减、成分转化与破坏等变化,采用GC-IMS技术对中药加工炮制过程中的VOCs进行动态监控,对于炮制工艺的规范、制定更优炮制方案等具有指导意义。
干燥是中药材和饮片加工制备过程中的重要且关键的环节之一,而中药中的VOCs易受干燥工艺的影响,对于富含VOCs的中药,准确控制干燥工艺有利于减少有效成分的损失。陈树鹏等[27]采用GC-IMS等技术确定烘干样品的整体香气属性优于晒干样品,这可能是由于烘干工艺对环境温度的调整使得烘干过程更有利于果香、柑橘香以及甜香香气保留。其中苯乙酸乙酯、乙酸乙酯等 12 种物质为晒干主要成分,2-甲基-1-丁醇、(E)-2-己烯-1-醇等为烘干主要成分;Wang等[24]在8S-GC-IMS技术的辅助下,了解了柑橘皮干燥以及不同条件下挥发性成分情况,研究柑橘皮各成分在不同干燥温度下的缺失,其中,70 ℃下干燥会导致2,2-苯基-1-苦基肼基和铁还原抗氧化能力显著降低。Yu等[29]通过GC-MS比较总离子色谱图中的峰面积与苯乙酸乙酯的峰面积,将VOCs的含量进行半定量再通过GC-IMS呈现图谱对结果进行比较,确定VOCs的身份,从而证实晒干有利于两个品种的网纹柑橘中萜醇类化合物的保存,热风干燥有利于脂肪族醛和倍半萜的保存,而冷冻干燥是保存酯类和酚类物质的最佳方法;Zhou等[30]对肉苁蓉进行酒制增效后粉碎、超微粉碎、醇提、水提等处理,采用HS-GC-IMS方法检测其VOCs并建立指纹图谱,发现增效处理的肉苁蓉VOCs的种类和含量有所减少,分析原因可能为各种化学物质之间在处理过程中会发生化学变化,而新鲜肉苁蓉则保存了更多种类的VOCs,超微粉碎处理和水提处理后的肉苁蓉挥发性化合物主要以醛类为主。除此之外,将其它中药基于GC-IMS技术在不同炮制方法中的应用汇总于表1。
表 1 GC-IMS技术在炮制研究方面的应用作者 药材及炮制方法 采用方式 实例 高以丹等 [31] 柴达木枸杞
冷冻干燥、自然阴干、热风烘干GC-IMS 从枸杞样品中鉴定出反-2-壬烯醛、2,4-庚二烯醛等52种VOCs,表明冷冻干燥法比自然阴干、热风烘干以及微波干燥更好,能够有效保留枸杞中的VOCs,使枸杞保持较高的品质。 时海燕等 [32] 六神曲
生品、炒品、焦品HS-GC-IMS 从六神曲生品、炒品和焦品中鉴别出60种化合物通过比较种类和差异,得出炒神曲比焦神曲健胃消食的效果更好。 林秀敏等 [33] 当归
酒洗、酒炙、酒浸GC-IMS 2-十一烯醛、丙酮等为酒洗与酒浸当归的主要差异性物质,2-十一烯醛、丙酮等为酒洗与酒炙当归的主要差异性物质,2-十一烯醛、辛酸乙酯等为酒浸与酒炙当归的主要差异性物质。 武旭等 [34] 胆南星
发酵炮制GC-IMS 发酵炮制有助于胆南星矫味矫臭 王雨晨等 [35] 太子参
常温晾干、晒干、热风干燥、
真空冷冻干燥GC-IMS 40 ℃热风干燥可以有效保留太子参样品中的VOCs,与晒干、晾干样品无差异,但真空冷冻干燥对太子参挥发性成分的影响较大,会造成挥发性成分以及风味的损失 焦焕然等 [36] 侧柏叶
常温晾干、晒干,热风干燥、
变温干燥GC-IMS 40 ℃和60 ℃热风干燥能够较好地保留瓜蒌样品中的核苷类和黄酮类成分 4. 与电子鼻联用
国内外也有许多采用GC-IMS与电子鼻联用对中药挥发性成分进行研究。电子鼻是一种通过模拟人嗅觉系统对检测物质进行品质评价的感官仪器,其原理是通过传感器阵列对气味分子进行检测和响应,将产生的信号经过预处理后送入模式识别系统,通过指纹图谱对挥发性成分或是气体进行定量或定性分析[37]。两种技术的联用为实验的结果研究提供了更高的准确度。
Feng等 [38]采用GC-IMS、GC-MS对不同地理标志的八种花椒的VOCs进行测定,证明了两种方法均可用于对不同花椒的分类,但相较之下GC-IMS操作时间更短,且有能够检测到含量很低物质,结果表明红花椒比青花椒能够释放出更多的萜烯、酯类和更少的醇类,同时该研究还与电子鼻联用表征花椒中的香气物质,W1W、W2W和W5S传感器对花椒样品VOCs的响应更强,说明花椒产品中可能含有更高丰度的萜烯、有机硫化物和氮氧化物。陈小爱等 [39]利用GC-MS、GC-IMS和电子鼻技术联用,分析老香黄在发酵期间的VOCs变化,GC-MS共鉴别出包括醇类等八个种类的46种VOCs,GC-IMS则检测出包括杂环类等九个类别的38种VOCs,同时电子鼻PCA有效区分了不同发酵时间的样品,发现发酵6个月后老香黄挥发性组分开始发生较大的变化,其中柠檬烯等14种是发酵期间含量较高且相对稳定的成分,发酵过程中产生的庚醛、糠醛等是构成老香黄特有气味的特征性成分。王世丽等 [40]通过电子鼻辨识南北柴胡气味特征物质与GC-IMS检测其挥发性成分,发现南北柴胡中短链烷烃、醛类等物质差异较大,癸醛、异戊烯醛等可作为南柴胡的特征物质,2-甲基丙酸、3-甲基丁醇可作为北柴胡的特征物质,此外乙酸、乙酸甲酯等成分在北柴胡中显著高于南柴胡。
5. 总结和展望
GC-IMS在中药研究中的应用前景非常广阔,不仅可以对同属不同种、不同产地来源、不同采收期以及不同贮存时间的中药VOCs进行分析鉴别,还可以帮助分析炮制前后中药VOCs含量变化以及在复方中寻找质量标志物,为药物质量控制与药效研究提供帮助。另外,随着技术的不断进步和中药现代化需求的增加,GC-IMS可以与特征图谱相结合,构建特征指纹图谱;也可以与电子鼻等其他分析手段融合,发挥出新的效果,让其所能提供的信息更加全面。但该项技术作为新兴科技仍需解决许多问题,比如应探索融合数据库的体系架构[41]。目前,GC-IMS通常使用的数据库为NIST出版的标准质谱图,对于中药VOCs的专业数据库搭建还不全面,部分VOCs需要自行判断建立文档保存入库,对实验进程造成不便。由于中药挥发性成分复杂,GC-IMS可能因峰重叠导致部分成分无法准确定性,例如分析复方丹参片时,GC-IMS仅能明确鉴定其中60%的化合物,需GC-MS辅助验证。而且GC-IMS对象单一,无法检测多糖、生物碱等非挥发性成分,难以全面评价中药质量。
总的来说,GC-IMS技术为中药研究提供了一种新的科学工具,有利于推动中药科学研究深入,也为中药产业的发展走向国际化和标准化提供支持。
-
表 1 RRx-001部分临床试验
序号 名称 临床试验 临床阶段 试验时间 给药剂量 适应证 1 剂量依赖性试验 NCT01359982 Ⅰ期 2011.10至2013.03 推荐剂量16.7 mg/m2 肿瘤 2 PRIMETIME NCT02518958 Ⅰ期 2015.01至2015.11 剂量递增,最大剂量16 mg 晚期转移性癌症 3 G-FORCE-1 NCT02871843 Ⅰ期 2016.07至2018.05 推荐剂量4 mg 高级别胶质母细胞瘤 4 BRAINSTORM NCT02215512 Ⅰ/Ⅱ期 2015.02至2017.02 推荐剂量10 mg/m2 脑转移瘤全颅放疗 5 ROCKET NCT02096354 Ⅱ期 2014.06起 4 mg 三/四线转移性结直肠癌 6 QUADRUPLE THREAT NCT02489903 Ⅱ期 2015.06起 4 mg+自体静脉血12 ml 小细胞肺癌,EFGR突变的非小细胞肺癌,
高级别神经内分泌肿瘤,卵巢肿瘤7 PREVLAR NCT03515538 Ⅱ期 2018.07至2019.08 4 mg 口腔黏膜炎 8 REPLATINUM NCT03699956 Ⅲ期 2019.03起 4 mg 三线小细胞肺癌 -
[1] NICHOLAS A S , LOUIS F C , PING L , MICHAEL P K, DAVID M R, et al. Methods of synthesizing and isolating N -(Bromoacetyl)-3, 3-Dinitroazetidine and a composition including the same[P]. Patent Application Publication, US 2011/0195947 A1. [2] NICHOLAS A S, LOUIS F C. , PING L, MICHAEL P K., DAVID M R, et al. Methods of synthesizing and isolating N-(Bromoacetyl)-3, 3-Dinitroazetidine and a composition including the same[P]. W. I. P. Organization, WO 2011/100090 A1. [3] ORONSKY B, GUO X N, WANG X H, et al. Discovery of RRx-001, a myc and CD47 downregulating small molecule with tumor targeted cytotoxicity and healthy tissue cytoprotective properties in clinical development[J]. J Med Chem, 2021, 64(11):7261-7271. doi: 10.1021/acs.jmedchem.1c00599 [4] BEDNARSKI M D, OEHLER L R L M, KNOX S, et al. Cyclic nitro compounds, pharmaceutical compositions thereof and uses thereof: US8299053[P]. 2012-10-30. [5] ORONSKY B T, REID T, KNOX S J, et al. The scarlet letter of alkylation: a mini review of selective alkylating agents[J]. Transl Oncol, 2012, 5(4):226-229. doi: 10.1593/tlo.12187 [6] CAROEN S, ORONSKY B, REID T, et al. Superficial venous-associated inflammation from direct IV administration of RRx-001 in rats[J]. Int J Med Sci, 2022, 19(11):1628-1630. doi: 10.7150/ijms.76615 [7] CAROEN S, ORONSKY B, CARTER C, et al. Rationale and necessity for delivery of RRx-001, a Myc and CD47 antagonist, by intravenous blood mix[J]. Expert Opin Drug Deliv, 2020, 17(6):741-742. doi: 10.1080/17425247.2020.1761787 [8] SCICINSKI J, ORONSKY B, TAYLOR M, et al. Preclinical evaluation of the metabolism and disposition of RRx-001, a novel investigative anticancer agent[J]. Drug Metab Dispos, 2012, 40(9):1810-1816. doi: 10.1124/dmd.112.046755 [9] SCICINSKI J, ORONSKY B, NING S C, et al. NO to cancer: the complex and multifaceted role of nitric oxide and the epigenetic nitric oxide donor, RRx-001[J]. Redox Biol, 2015, 6:1-8. doi: 10.1016/j.redox.2015.07.002 [10] ORONSKY B, CARTER C A, CAROEN S, et al. RRx-001, a first-in-class small molecule inhibitor of MYC and a downregulator of CD47, is an “erythrophagoimmunotherapeutic”[J]. Oncoimmunology, 2020, 9(1):1746172. doi: 10.1080/2162402X.2020.1746172 [11] JANI V P, ASARO R, ORONSKY B, et al. RRx-001 increases erythrocyte preferential adhesion to the tumor vasculature[J]. Int J Mol Sci, 2021, 22(9):4713. doi: 10.3390/ijms22094713 [12] ORONSKY B, SCICINSKI J, NING S C, et al. RRx-001, A novel dinitroazetidine radiosensitizer[J]. Invest New Drugs, 2016, 34(3):371-377. doi: 10.1007/s10637-016-0326-y [13] BAIRD L, DINKOVA-KOSTOVA A T. The cytoprotective role of the Keap1-Nrf2 pathway[J]. Arch Toxicol, 2011, 85(4):241-272. doi: 10.1007/s00204-011-0674-5 [14] JAYABALAN N, ORONSKY B, CABRALES P, et al. A review of RRx-001: a late-stage multi-indication inhibitor of NLRP3 activation and chronic inflammation[J]. Drugs, 2023, 83(5):389-402. doi: 10.1007/s40265-023-01838-z [15] ORONSKY B, TAKAHASHI L, GORDON R, et al. RRx-001: a chimeric triple action NLRP3 inhibitor, Nrf2 inducer, and nitric oxide superagonist[J]. Front Oncol, 2023, 13:1204143. doi: 10.3389/fonc.2023.1204143 [16] ORONSKY B, SCICINSKI J, REID T, et al. RRx-001, a novel clinical-stage chemosensitizer, radiosensitizer, and immunosensitizer, inhibits glucose 6-phosphate dehydrogenase in human tumor cells[J]. Discov Med, 2016, 21(116):251-265. [17] LV Y, LV X T, ZHANG J H, et al. BRD4 targets the KEAP1-Nrf2-G6PD axis and suppresses redox metabolism in small cell lung cancer[J]. Antioxidants, 2022, 11(4):661. doi: 10.3390/antiox11040661 [18] ORONSKY B, CABRALES P, CAROEN S, et al. RRx-001, a downregulator of the CD47- SIRPα checkpoint pathway, does not cause anemia or thrombocytopenia[J]. Expert Opin Drug Metab Toxicol, 2021, 17(4):355-357. doi: 10.1080/17425255.2021.1876025 [19] NIU S D, CHENG K X, JIA L Z, et al. Lineage tracing of mutant granulosa cells reveals in vivo protective mechanisms that prevent granulosa cell tumorigenesis[J]. Cell Death Differ, 2023, 30(5):1235-1246. doi: 10.1038/s41418-023-01132-1 [20] CABRALES P. RRx-001 acts as a dual small molecule checkpoint inhibitor by downregulating CD47 on cancer cells and SIRP-α on monocytes/macrophages[J]. Transl Oncol, 2019, 12(4):626-632. doi: 10.1016/j.tranon.2018.12.001 [21] GUO Y D, BAO Q Q, HU P, et al. Nanomedicine-based co-delivery of a calcium channel inhibitor and a small molecule targeting CD47 for lung cancer immunotherapy[J]. Nat Commun, 2023, 14(1):7306. doi: 10.1038/s41467-023-42972-2 [22] 陈昀. NLRP3炎症小体抑制剂的发现、药理机制及疾病干预策略研究[D]. 中国科学技术大学, 2021. [23] MA M, LI G Y, QI M H, et al. Inhibition of the inflammasome activity of NLRP3 attenuates HDM-induced allergic asthma[J]. Front Immunol, 2021, 12:718779. doi: 10.3389/fimmu.2021.718779 [24] ORONSKY B, KNOX S, CABRALES P, et al. Desperate times, desperate measures: the case for RRx-001 in the treatment of COVID-19[J]. Semin Oncol, 2020, 47(5):305-308. doi: 10.1053/j.seminoncol.2020.07.002 [25] HAMMOND T C, LEE R C, ORONSKY B, et al. Clinical course of two patients with COVID-19 respiratory failure after administration of the anticancer small molecule, RRx-001[J]. Int Med Case Rep J, 2022, 15:735-738. [26] GUO X N, WANG X H, SHEN S, et al. Subset analysis of safety and efficacy in Asian patients treated with RRx-001 across three clinical trials[J]. Am J Cancer Res, 2022, 12(9):4448-4457. [27] REID T, ORONSKY B, SCICINSKI J, et al. Safety and activity of RRx-001 in patients with advanced cancer: a first-in-human, open-label, dose-escalation phase 1 study[J]. Lancet Oncol, 2015, 16(9):1133-1142. doi: 10.1016/S1470-2045(15)00089-3 [28] REID T, ORONSKY B, CAROEN S, et al. Phase 1 pilot study of RRx-001 + nivolumab in patients with advanced metastatic cancer(PRIMETIME)[J]. Front Immunol, 2023, 14:1104753. doi: 10.3389/fimmu.2023.1104753 [29] FINE H, REID T, CAROEN S, et al. A multicenter, phase 1, dose escalation clinical trial(G-FORCE-1)of XRT, RRx-001 and temozolomide followed by temozolomide +/- RRx-001 in newly diagnosed glioblastoma[J]. Front Oncol, 2023, 13:1176448. doi: 10.3389/fonc.2023.1176448 [30] KIM M M, PARMAR H A, SCHIPPER M, et al. BRAINSTORM: a multi-institutional phase 1/2 study of RRx-001 in combination with whole brain radiation therapy for patients with brain metastases[J]. Int J Radiat Oncol, 2020, 107(3):478-486. doi: 10.1016/j.ijrobp.2020.02.639 [31] REID T R, ABROUK N, CAROEN S, et al. ROCKET: phase II randomized, active-controlled, multicenter trial to assess the safety and efficacy of RRx-001 + irinotecan vs. single-agent regorafenib in third/fourth line colorectal cancer[J]. Clin Colorectal Cancer, 2023, 22(1):92-99. doi: 10.1016/j.clcc.2022.11.003 [32] REID T, ORONSKY B, ABROUK N, et al. The small molecule NLRP3 inhibitor RRx-001 potentiates regorafenib activity and attenuates regorafenib-induced toxicity in mice bearing human colorectal cancer xenografts[J]. Am J Cancer Res, 2022, 12(4):1912-1918. [33] MORGENSZTERN D, ROSE M, WAQAR S N, et al. RRx-001 followed by platinum plus etoposide in patients with previously treated small-cell lung cancer[J]. Br J Cancer, 2019, 121(3):211-217. doi: 10.1038/s41416-019-0504-8 [34] BONOMI M, BLAKAJ D M, KABARRITI R, et al. PREVLAR: phase 2a randomized trial to assess the safety and efficacy of RRx-001 in the attenuation of oral mucositis in patients receiving head and neck chemoradiotherapy[J]. Int J Radiat Oncol Biol Phys, 2023, 116(3):551-559. doi: 10.1016/j.ijrobp.2022.12.031 [35] ORONSKY B, REID T R, LARSON C, et al. REPLATINUM Phase III randomized study: RRx-001 + platinum doublet versus platinum doublet in third-line small cell lung cancer[J]. Future Oncol, 2019, 15(30):3427-3433. doi: 10.2217/fon-2019-0317 -





 下载:
下载:
 下载:
下载: