-
冻伤是由寒冷、潮湿或大风引起的,会导致周围组织的损伤、丧失和残疾,尤其是手、脚、鼻子、脸颊和耳朵[1]。冻伤可引起微血管收缩,红细胞聚集,小动脉口径减小,硬度增大,毛细血管通透性升高,从而增加血液黏度,增大血流阻力,引起局部组织血流量减少,最终导致微循环障碍,使组织细胞由于缺血缺氧而坏死[2-3],临床早期主要通过血管阻塞症状和软组织缺血边界来判断冻伤程度[4-5]。因此,课题组着手研发一种由肌醇烟酸酯(IN)和肝素钠组成的冻伤膏,直接涂在易冻伤的四肢上,用于预防和治疗冻伤,降低冻伤程度。该冻疮膏对早期冻伤、皲裂、湿疹及软组织损伤均有很好的治疗效果[6]。其中,IN是一种外周血管扩张剂,温和持久,能选择性扩张病变部位及冷刺激敏感部位的血管,具有溶栓抗凝、缓解血管痉挛、改善小血管循环、降低毛细血管脆性的作用[7]。此外,它还具有止痒、止痛、消肿的作用。在此处方中,肌醇烟酸酯还可缓解长期使用肝素钠引起的局部血肿血栓和皮肤过敏,有效减少全身凝血功能障碍的副作用。
分析药物在体内血药浓度随时间变化的动态过程,是传统药动学的研究方法。然而,对于经皮给药,药物入血浓度往往很低,难以定量。故本研究采用活体分时采样法,直接在大鼠皮肤上涂药,在不同时间点测定皮肤组织匀浆中的药物浓度。目前,已有研究对人或大鼠血浆中肌醇烟酸酯进行药代动力学研究[8-9],但是,没有可用于定量分析大鼠皮肤组织匀浆样品中肌醇烟酸酯的含量。因此,本研究旨在建立一种快速、灵敏、重现性好、经济简便的HPLC法,定量分析大鼠皮肤中肌醇烟酸酯,用于大鼠经皮给药肝素钠肌醇烟酸酯乳膏后肌醇烟酸酯的药动学研究。
-
W501型高效液相色谱仪(Waters);KQ3200型超声波清洗器(昆山市超声仪器有限公司,功率150 W,频率40 kHz);FLUKO MODE组织匀浆器(上海弗鲁克流体机械制造有限公司);XW-80A微型旋涡混合器(上海沪西分析仪器厂有限公司);离心机(ABBOTT LABORATORIES Germany);剃须刀(上海飞科电器有限公司);AUW120D型电子分析天平(SHIMADZU公司)。
-
肌醇烟酸酯(天津中瑞药业有限公司,纯度:99.5%);甲苯咪唑对照品(中国食品药品检定研究院;纯度:99.9%);肝素钠肌醇烟酸酯乳膏(北部战区总医院药剂科自制,批号:
20150108 );盐酸(分析纯,天津市凯信化学工业有限公司);乙腈(色谱纯,Sigma公司);甲醇(色谱纯,Sigma公司);四氢呋喃(色谱纯,Sigma公司);水为纯化水;其他试剂均为分析纯。 -
SD清洁级雄性大鼠(体重230~250 g):由辽宁长生生物技术有限公司提供,许可证号:SCXK(辽)2010-0001。
-
Kromasil ODS C18 色谱柱(4.6 mm× 250 mm,5 μm);流动相为甲醇-水-四氢呋喃(35∶55∶10,V/V/V);检测波长为262 nm;流速1.0 ml/min;柱温25 ℃;进样量20 μl。
-
精密称取肌醇烟酸酯对照品12.5 mg(现用现配),置于10 ml量瓶中,加入适量0.5 mol/L盐酸水溶液,超声溶解,0.5 mol/L盐酸水稀释至刻度,即得浓度为1 250 μg/ml的对照品储备液。精密量取对照品储备液适量,置于10 ml量瓶中,分别用0.5 mol/L盐酸水稀释成系列溶液,即得到浓度为5.00、10.00、20.00、50.00、100.00、200.00和400.00 μg/ml的系列对照品溶液。同法配制浓度分别为10.00、50.00、300.00 μg/ml的低、中、高对照品溶液。
-
精密吸取低、中、高对照品溶液各50 μl,分别加入到1 ml空白皮肤匀浆液中,分别得到浓度为0.50、2.50和15.00 μg/ml的质控样品(QC)。
-
取甲苯咪唑对照品适量,精密称定,加2%盐酸甲醇溶液超声溶解并定量稀释制成浓度为12 μg/ml的内标溶液。
-
根据非临床药动学研究技术指导原则及《中国药典》生物样品定量分析方法验证指导原则的有关要求[10-11],对定量研究方法进行方法学验证。
-
取72只健康SD大鼠,雄性,体重(230~250)g,于实验条件下饲养5 d(22±2) ℃,相对湿度(50±10)%。试验开始前1 d,用电动理发器对腹部皮肤进行脱毛(4 cm×4 cm,不要损伤皮肤),禁食不禁水。其中6只大鼠作为空白组,涂抹空白乳膏基质。其余大鼠将临床3倍用量的肝素钠肌醇烟酸酯乳膏均匀涂抹于腹部脱毛处皮肤,剂量为0.2 g/只,于给药后0.25、0.5、l、2、3、4、6、8、10、12、24 h各时间点分别取6只大鼠,给药皮肤表面用生理盐水反复擦拭,以棉签擦干,剥离剪取固定面积的皮肤,去除附着的肌肉,备用。皮肤样品的处理:精密称取皮肤样品0.07 g,加入1 ml 甲醇-0.5mol/L盐酸(50:50,V/V),组织匀浆机研磨后超声处理20 min,离心10 min(转速为10 000 r/min),取300 μl上清液,加入50 μl内标溶液,再加入1 ml乙腈,涡旋混匀1 min,离心10 min(转速为10 000 r/min),取上清液,空气流吹干,加200 μl流动相涡旋1 min复溶,离心5 min(转速为10 000 r/min),取上清液,20 μl进样。
-
采用DAS 2.0药动学软件处理,以统计矩方法计算药动学参数。
-
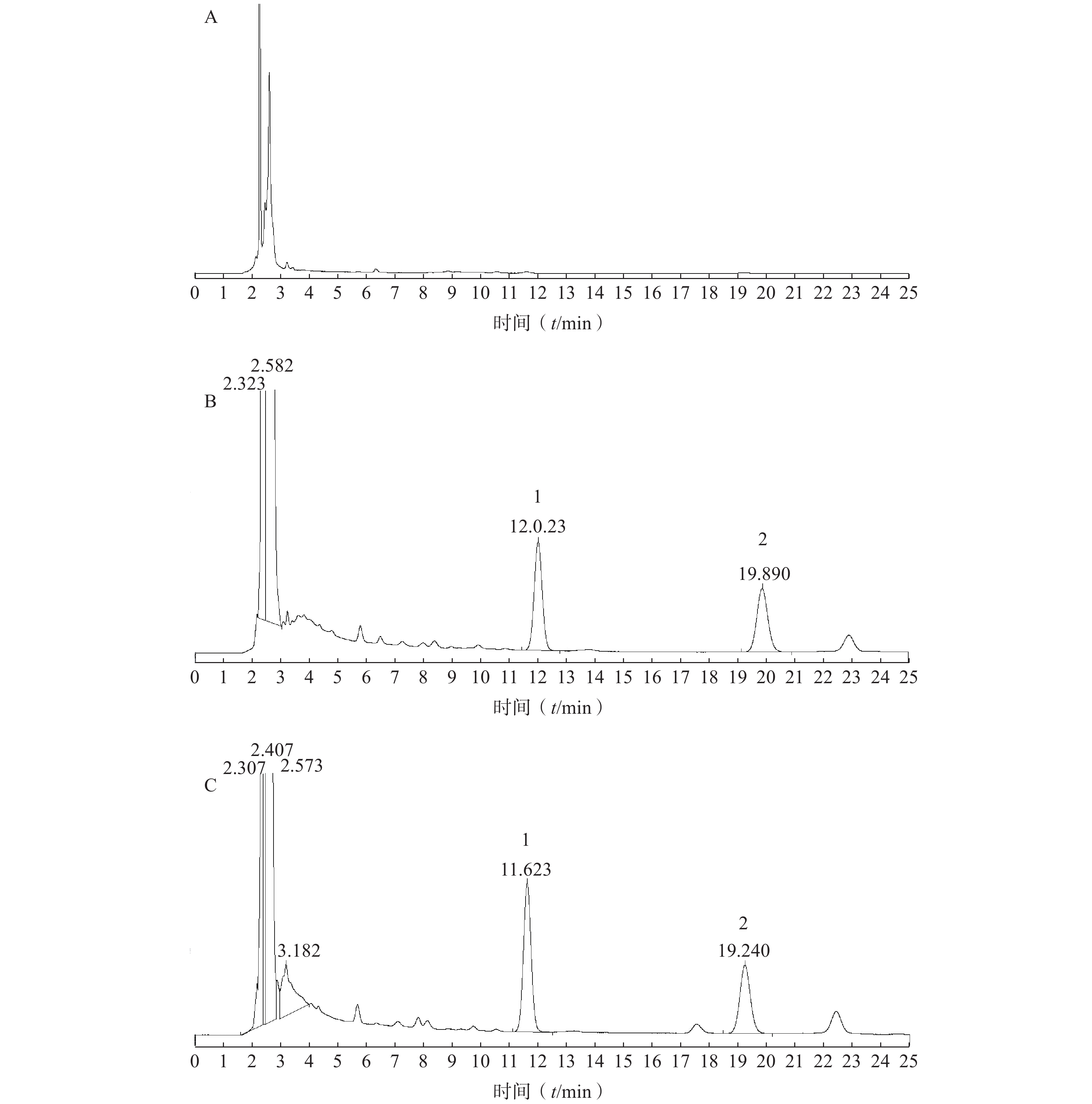
取涂抹空白乳膏基质的大鼠皮肤和给药后大鼠皮肤经处理后,分别进样20 μl,记录色谱图,考察是否有内源性物质干扰肌醇烟酸酯的测定。结果见图1。由实验结果可知,在此色谱条件下,皮肤中内源性物质和空白乳膏基质不干扰肌醇烟酸酯和内标的定量测定。
-
精密吸取系列对照品溶液各50 μl,分别加入到1 ml空白皮肤匀浆液中,分别得到待测物浓度为0.25、0.50、1.00,2.50,5.00,10.00和20.00 μg/ml的系列溶液,按“2.4”项下操作后进样分析,记录峰面积,以肌醇烟酸酯的浓度(X)为横坐标,以肌醇烟酸酯(A)与内标物(B)的峰面积比值(Y)为纵坐标,进行线性回归计算,得回归方程为Y=0.172X+0.002(r=0.999 9),线性范围0.25~20.00 μg/ml,定量下限为0.25 μg/ml(S/N≥10)。
-
取低、中、高不同浓度的QC样品及定量下限,按“2.4”项下方法操作。每个浓度配制6份样品,配制3个分析批,连续测定3 d。计算定量下限和QC样品的日间和日内的准确度RE%和精密度RSD%,见表1,该方法的精密度和准确度均符合生物样品分析要求。
表 1 肌醇烟酸酯在皮肤样品中的精密度和准确度(n=6)
质量浓度
(ρB/μg·ml−1)日内精密度 日间精密度 实测浓度
(ρB/μg·ml−1)RSD
(%)RE
(%)实测浓度
(ρB/μg·ml−1)RSD
(%)RE
(%)0.25 0.24±0.020 8.20 −3.44 0.24±0.025 10.38 −3.18 0.5 0.50±0.042 8.53 −0.87 0.51±0.039 7.65 1.61 2.5 2.37±0.068 2.85 −5.25 2.33±0.12 5.15 −7.00 15 14.67±0.66 4.49 −2.22 13.99±0.85 6.07 −6.73 -
取低、中、高不同浓度的QC样品,按“2.4”项下方法操作,记录峰面积(A1)。另外,将1 ml空白皮肤匀浆液按“2.4”项下方法操作,提取后,加入3种不同浓度的QC样品各50 μl,空气流吹干,加200 μl流动相涡旋1 min复溶,离心(10 000 r/min,5 min),取上清液,20 μl进样,记录峰面积(A2)。将两者相比,即得QC样品的提取回收率。结果见表2。肌醇烟酸酯的平均提取回收率为96.18%,甲苯咪唑的平均提取回收率为90.65%,RSD均<15%,表明该提取方法具有较好的稳定性和重现性。
表 2 样品提取回收率考察结果(n=6)
成分 质量浓度
(ρB/μg·ml−1)回收率( % ) mean±SD RSD( % ) 肌醇烟酸酯 0.5 94.26±4.11 4.36 2.5 96.76±5.02 5.19 15 97.52±2.20 2.26 甲苯咪唑 1.70 90.65±3.17 4.35 -
取低、高不同浓度的QC样品,按照“2.4”项下皮肤样品的处理方法操作,分别考察低、高2个浓度的QC样品在室温下放置12 h、−4 ℃放置12 h、反复冻融3次(−20 ℃)和冷冻贮存2周(−80 ℃)的稳定性。数据结果见表3。结果表明,各生物样品在上述条件下稳定性均良好。
表 3 肌醇烟酸酯在不同贮存条件下的稳定性(n=3)
稳定性条件 质量浓度
(ρB/μg·ml−1)实测值
(ρB/μg·ml−1)RSD
(%)室温下放置12 h 0.5 0.47±0.037 7.94 15 14.56±0.63 4.36 −4 ℃乙腈中放置12 h 0.5 0.46±0.034 7.40 15 16.71±0.50 3.03 −20 ℃反复冻融3次 0.5 0.50±0.019 3.75 15 16.73±0.16 0.96 −80 ℃冷冻贮存2周 0.5 0.47±0.038 8.24 15 13.21±0.75 5.69 -
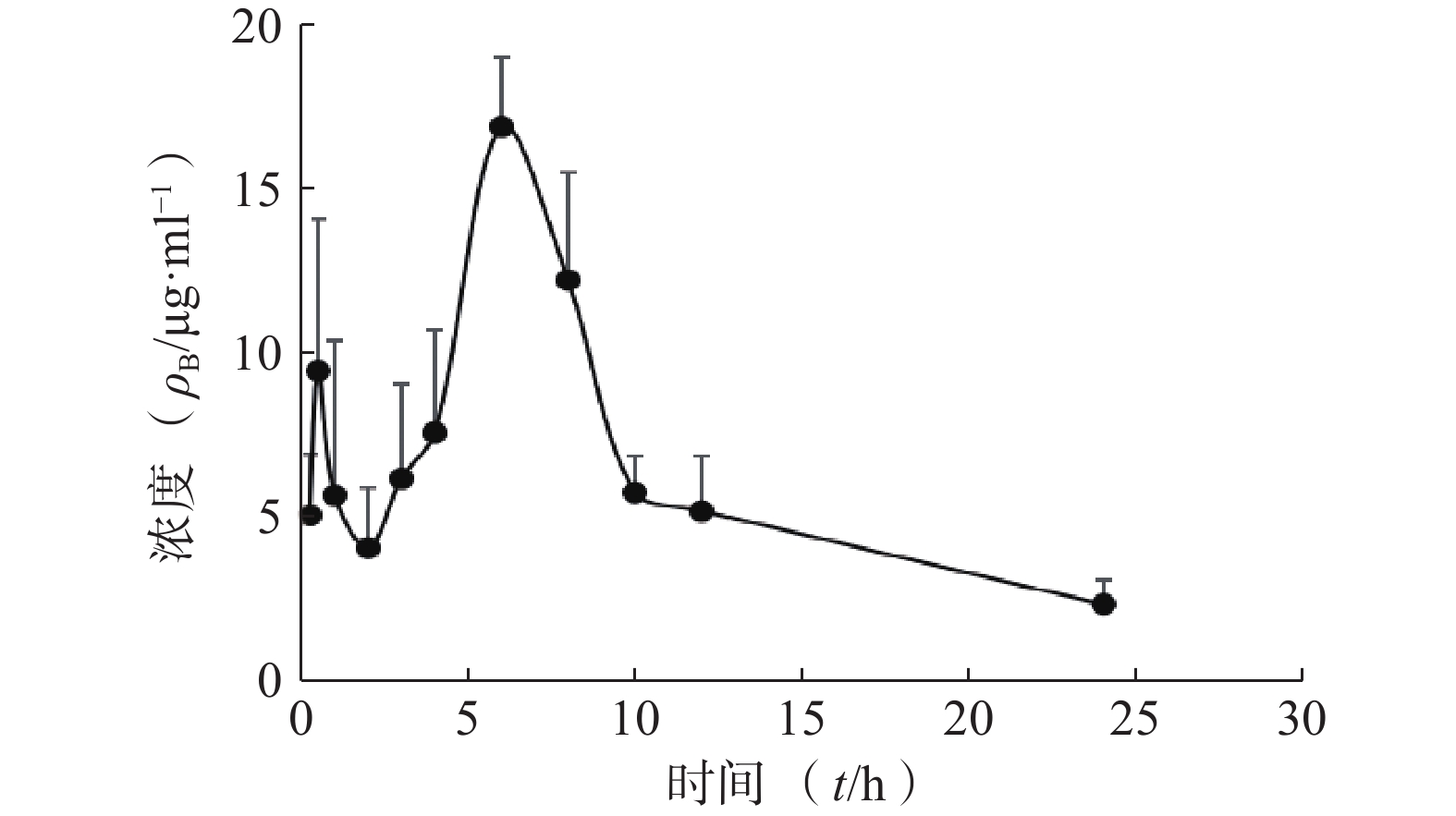
采用DAS 2.0软件,以非房室模型分析待测物的药动学数据。皮肤中药物浓度数据以(mean±SD)表示,绘制了平均药物浓度时间曲线,各时间点含药浓度的计算分别伴随行标曲及QC。将给药后不同时间血药浓度和时间数据用DAS 2.0药动学软件处理,以统计矩方法计算药动学参数。详见图2和表4。
表 4 大鼠经皮给药后肌醇烟酸酯的主要药动学参数(mean±SD, n=6)
统计矩参数 单位 肌醇烟酸酯参数值 t1/2 h 4.555±2.054 Tmax h 6±0 Cmax mg/L 16.929±2.153 AUC0-t mg·h /L 150.665±16.568 AUC0-∞ mg·h /L 161.074±23.917 MRT(0−t) h 9.044±0.618 MRT(0−∞) h 10.444±1.91 CLz/F L/(h·kg) 0.19±0.03 Vz/F L/(h·kg) 1.19±0.437 -
本实验采用在体给药分时取样法,在不同时间点取皮制备成匀浆测定皮肤中药物浓度。该方法线性关系良好、所测匀浆样品的精密度、准确度等方法学均符合生物样品定量分析要求,其专属性强、灵敏度高、简便、快速高效,可以用于大鼠皮肤中IN的含量测定,对IN在体皮肤浓度测定以及相关药理研究有一定的参考价值。由上述结果可知,IN能迅速渗透进入皮肤,并能长时间蓄积在皮肤局部,有利于IN在病变部位长时间发挥药效。HPLC分析方法快速、准确、回收率高、重现性好,可成功的用于测定GJR中IN在皮肤中的含量,表明在体给药分时取样法能较好地反映药物在大鼠体内的经皮代谢过程,适用于临床前外用药物的皮肤药动学筛选与评价,为临床用药方案的确定提供参考。
Skin pharmacokinetics of inositol nicotinate in heparin sodium inositol nicotinate cream
-
摘要:
目的 建立HPLC法测定大鼠皮肤中肌醇烟酸酯(IN)的浓度,并研究肝素钠肌醇烟酸酯乳膏在大鼠经皮给药后IN的药动学特征。 方法 采用HPLC法建立简便快速的测定给药后不同时间点大鼠皮肤中IN浓度的分析方法,并用建立的方法开展肝素钠肌醇烟酸酯乳膏在大鼠经皮给药后IN的药动学研究,采用DAS软件拟合药物动力学参数。 结果 该分析方法在0.25 ~ 20 μg/ml浓度范围内线性良好,定量限为0.25 μg/ml,平均加样回收率为96.18%。肝素钠肌醇烟酸酯乳膏皮肤给药后IN的药动学参数t1/2 为(4.555±2.054) h、Tmax为(6±0) h、Cmax为(16.929±2.153) mg/L、AUC0−t为(150.665±16.568) mg·h /L、AUC0−∞为(161.074±23.917) mg·h /L、MRT(0−t)为(9.044±0.618) h、MRT(0−∞)为(10.444±1.91) h、CLz/F 为(0.19±0.03) L/(h·kg)、Vz/F 为(1.190±0.437) L/(h·kg)。 结论 IN能迅速渗透进入皮肤,并能够长时间蓄积在皮肤局部,有利于IN在病变部位长时间发挥药效。该方法简便、快速、专属性强、重复性好,可应用于大鼠腹部皮肤给药后IN的药动学研究。 -
关键词:
- 肝素钠肌醇烟酸酯乳膏 /
- 皮肤药动学 /
- 肌醇烟酸酯
Abstract:Objective To establish an HPLC method to determine the concentration of inositol nicotinate(IN) in rat skin, and study the pharmacokinetic characteristics of IN after transdermal administration of heparin sodium inositol nicotinate cream in rats. Methods HPLC method was used to establish a simple and rapid analytical method for the determination of IN concentration in the skin of rats at different time points after administration. The established method was used to study the pharmacokinetics of IN after transdermal administration of heparin sodium inositol nicotinate cream in rats, and the pharmacokinetic parameters were fitted with DAS software. Results The linearity of the analytical method was good in the concentration range of 0.25-20 μg/ml, the quantitative limit was 0.25 μg/ml, and the average recovery rate was 96.18%. The pharmacokinetic parameters of IN after transdermal administration of heparin sodium inositol nicotinate cream in rats were as follows: t1/2 was (4.555±2.054) h, Tmax was (6±0)h, Cmax was (16.929±2.153)mg/L, AUC0−t was (150.665±16.568) mg·h /L ,AUC0−∞ was (161.074±23.917) mg·h /L, MRT(0−t) was (9.044±0.618)h, MRT(0−∞) was (10.444±1.91) h, CLz/F was (0.19±0.03) L/(h·kg), and Vz/F was (1.19±0.437) L/(h·kg). Conclusion IN could quickly penetrate the skin and accumulate in the skin for a long time, which was beneficial to the pharmacological action of drugs on the lesion site for a long time. The method is simple, rapid, specific and reproducible, which could be successfully applied to the pharmacokinetic study of IN after transdermal administration in rats. -
胶质瘤是成人最常见的原发性脑肿瘤之一,占恶性脑肿瘤的70%以上,具有恶性程度高、侵袭性强、治疗效果及预后差等特点,临床主要治疗手段为手术切除、放化疗或两者联合治疗[1]。然而,血脑屏障(BBB)的选择通透性以及肿瘤细胞的多药耐药(MDR)特点给胶质瘤的治疗带来了挑战[2]。
BBB指的是位于中枢神经系统的一种无孔微血管结构,主要由血管内皮细胞以及位于内皮细胞层囊腔表面的壁细胞组成[3]。BBB的主要功能是维护大脑内环境的稳态,严格管控物质进出大脑,保障大脑功能的正常运行。然而,这种保护作用限制了很多药物进入脑内,使得一些治疗脑部疾病的药物难以在病灶部位达到有效药物浓度,成为药物治疗脑部疾病的重要制约因素[3-4]。
冰片属芳香开窍类中药,又名2-茨醇,属于小分子脂溶性双环单萜类物质,其主要有效成分为龙脑。在《中国药典》2020版中,收录的冰片有两种:一种通过人工合成而得,名为冰片,又名合成龙脑;另一种为经樟科植物樟[Cinnamomum cam phora(L.)Presl]的新鲜枝、叶提取加工而得的天然冰片,又名右旋龙脑[5]。现代药理学研究表明冰片具有促进药物透过各种体内外屏障,抗菌、保护心脑血管、镇痛抗炎以及防止血栓等多种药理作用[6-7]。近年来,许多研究表明冰片与抗胶质瘤的化疗药物联合应用,可以明显提高化疗药物的生物利用度和治疗疗效,本文就近年来冰片对胶质瘤化疗的辅助治疗临床前研究作一综述,以期为胶质瘤的临床治疗提供新的思路。
1. 冰片与化疗药物联用辅助治疗胶质瘤
冰片作为一种新型的单萜类化学增敏剂,可以增加体内外BBB的通透性,当冰片与化疗药物联用时,可促进化疗药物顺利透过BBB进入肿瘤部位,从而提高化疗药物的生物利用度和疗效。
冰片能改善化疗药物的药动学,提高药物在肿瘤部位的蓄积。例如,段美美等[8]在考察天然冰片对顺铂在大鼠原位C6脑胶质瘤模型体内药动学及脑组织分布的影响中发现,在血浆中,与0.5%CMC-Na的溶媒对照组相比,冰片高剂量联用组t1/2β、Cmax显著增大,AUC显著减小;而在脑组织中,与溶媒对照组相比,冰片高、低剂量联用组AUC均显著增大,这说明天然冰片使顺铂更多的向脑组织转运,提高了顺铂在脑组织的生物利用度。此外,组织病理学观察发现,联用组的胶质瘤细胞核密度降低,细胞凋亡率升高。类似地,郭军洽等[9]同样证明了天然冰片可促进甲氨蝶呤(MTX)透过BBB,提高其在病灶部位的生物利用度,并且发现MTX药动学参数的改变与冰片呈剂量相关性,高剂量冰片能显著提高MTX的瘤区脑组织生物利用度。由此可见,冰片可以有效提高化疗药物的BBB透过率,改善药物在脑组织的生物利用度,为促进化疗药物增效提供有力的依据。
吉西他滨是一种临床上用于非小细胞肺癌和胰腺癌的化疗药物,有研究发现,瘤腔内直接注射吉西他滨对脑胶质瘤的治疗效果良好[10],但由于该药水溶性较大,因此静脉给药后吉西他滨难以透过血脑屏障,脑部的生物利用度很低。张帆等[11]考察了冰片对吉西他滨药动学的影响,通过构建大鼠原位9Lacz胶质瘤模型,采用微透析法收集给药后脑肿瘤部位的脑脊液,实时监测冰片对吉西他滨在大鼠脑组织的浓度变化。结果发现,与单用吉西他滨组比较,吉西他滨联合冰片给药组Cmax及AUC均增加,t1/2延长,表明冰片提高了吉西他滨在9Lacz脑胶质瘤模型大鼠脑肿瘤区域的生物利用度。
为客观评价药动学的改善带来的确切疗效,进一步探究冰片对化疗药物抗胶质瘤的促进作用,有学者进行了两者联合用药的药效学研究。范成普等[12]在大鼠C6脑胶质瘤模型中将冰片和替莫唑胺联合应用,探讨了冰片对替莫唑胺疗效的影响。结果发现,与空白对照组、单用替莫唑胺组以及单用冰片组相比,冰片联合替莫唑胺组的肿瘤体积显著减小;另外,肿瘤组织HE染色显示,肿瘤细胞核密度以及细胞凋亡率与其它三组相比最低,细胞增殖受到抑制。该实验说明了冰片可以促进肿瘤细胞凋亡、减小肿瘤体积,增强替莫唑胺的抗胶质瘤作用。
冰片还可以与纳米药物联合应用提高药物的靶向性。CCKRK肽是一种与肿瘤新生血管内皮细胞的硫酸乙酰肝素受体高度亲和的配体[13]。Lv等[14]将冰片与CCKRK肽修饰的紫杉醇前药自组装氧化还原响应纳米粒(CGKRK-PSNPs)联用,结果发现,冰片可增强CGKRK-PSNPs在体外血脑屏障模型中的转运;在裸鼠颅内U87MG胶质瘤中,通过实时荧光图像观察到CGKRK-PSNPs与冰片联用时药物的较高积累,且裸鼠中位生存期(39天)延长,这表明冰片促进了CGKRK-PSNPs纳米粒进入BBB,从而提高其抗胶质瘤疗效。
以上研究通过构建动物胶质瘤模型,通过灌胃冰片结合化疗药物注射的方式将两者联合应用研究了冰片对化疗药物的影响。一方面,从药动学的角度阐明了冰片可以有效促进化疗药物透过BBB,提高脑组织生物利用度;另一方面,通过药效学实验结果证明了冰片可以提高化疗药物的抗胶质瘤效果。
2. 冰片与化疗药物共载增效
研究发现,纳米递药系统能够帮助药物更好地穿过BBB,在中枢神经系统发挥治疗作用[15]。因此,在基于冰片能促进药物跨BBB的基础上,有学者尝试将冰片与化疗药物共载于纳米递药系统中,形成冰片药物复合纳米粒,以期更方便更高效地将化疗药物靶向递送至脑组织。
经冰片修饰的多柔比星纳米粒能提高其在小鼠体内的抗胶质瘤效果。Meng等[16]将冰片与DSPE-PEG(2000)-COOH结合,合成了一种新型载体DSPE-PEG(2000)-BO,并将多柔比星载入其中,利用该载体通过静电自组装法制备了冰片修饰的负载阿霉素的纳米胶束(DOX BO-PMs)。体外研究结果显示,DOX BO-PMs显著提高了多柔比星通过BBB的运输效率以及抑制胶质瘤细胞增殖的作用;体内药效学研究显示,DOX BO-PMs显著抑制胶质母细胞瘤的生长和转移。
研究发现,冰片与京尼平苷经鼻灌注联合给药,京尼平苷的生物利用度增加[17],这说明冰片可以促进药物在鼻腔的吸收。赵等[18]采用乳化-溶剂挥发法制备出一种载多西紫杉醇的经鼻给药纳米靶向系统(DTX-Bo-RGD-NPs) ,该给药系统由冰片与精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp, RGD)共同修饰。利用荧光染料Dir与纳米粒结合,经大鼠C6胶质瘤模型评价了DTX-Bo-RGD-NPs的体内靶向性,结果发现,DTX-Bo-RGD-NPs中的Dir在脑肿瘤组织中的荧光强度是未加冰片修饰的(DTX-RGD-NPs)1.74倍;C6大鼠脑胶质瘤原位模型药效学结果显示,DTX-RGD-NPs组荷瘤大鼠生存期为18.5天,而DTX-Bo-RGD-NPs组的生存期为21天;DTX-Bo-RGD-NPs的肿瘤细胞凋亡率是DTX-RGD-NPs的1.40倍。这说明冰片与化疗药物共载显著提高经鼻给药的纳米药物向脑组织转运,有望为难治性疾病脑胶质瘤的治疗提供一种新型的经鼻给药治疗手段, 提高难治性脑胶质瘤的治疗效果。
冰片与化疗药物共载制备成纳米给药系统相比普通单一药物的纳米粒表现出更强的脑靶向作用。与直接联用相比,共载的形式将更方便于临床使用,但是冰片与药物物理混合还是共修饰或共载的效果比较还有待研究。
3. 冰片辅助化疗增效机制
3.1 诱导活性氧产生
活性氧(ROS)是由线粒体和其他细胞器产生的一组寿命较短、高活性的含氧分子,可诱导DNA损伤[19]。癌细胞区别于正常细胞的特征之一是它们能够产生更多的ROS,以及它们对抗氧化防御系统的依赖性增强[20]。许多化疗药物可通过诱导ROS产生,促进胶质瘤细胞的凋亡[7,21-23],现在一些研究发现冰片也具有相同促进作用。
冰片与化疗药物联用可增加ROS的产生达到增强抗胶质瘤效果。Cao等[24]发现天然冰片联用顺铂使U251细胞活力降低,亚G1期细胞数量增加;免疫印迹实验表明天然冰片通过激活含半胱氨酸的天冬氨酸蛋白水解酶(Caspases) 和触发ROS过度产生来促进顺铂诱导肿瘤细胞凋亡;郭源源等[25]也同样发现冰片通过增加细胞ROS水平增强紫杉醇的抗U87细胞作用。Liu等[26]利用冰片增强ROS产生的特点,将天然冰片与抗胶质瘤药物替莫唑胺联用,发现裸鼠U251胶质瘤模型的肿瘤体积相比对照组显著减小。
3.2 打开BBB的紧密连接
紧密连接是维持BBB功能的重要组成部分,控制着依靠浓度梯度被动运输进入大脑的物质。紧密连接由闭锁蛋白(occludin)、闭合蛋白(claudins)、连接黏附分子家族(JAM)以及与它们相连的紧密连接蛋白(ZO)组成[27]。
冰片可逆性开放紧密连接。陈艳明等[28]在体外血脑屏障模型的研究中发现,冰片能使细胞间紧密连接变得松散、细胞吞饮囊泡增大、数量增多,而移除冰片24 h后上述作用消失,这说明冰片开放BBB的作用可逆。
Duan等[29]在大鼠C6胶质瘤模型中研究了天然冰片对BBB通透性的影响,通过顺铂在大鼠脑内的浓度变化评价天然冰片对BBB的开放程度,结果发现,与对照组相比,冰片低剂量组和高剂量组中顺铂在脑组织的生物利用度显著提高;免疫组化及ELISA实验表明冰片可逆下调了ZO-1和纤维型肌动蛋白(F-actin)的表达水平。这说明冰片可能通过下调紧密连接相关蛋白的表达增加了BBB的通透性,从而促进了顺铂进入脑内。
3.3 抑制P-糖蛋白的活性,逆转化疗药物耐药
P-糖蛋白(P-gp)是一种由MDR基因编码的糖蛋白,主要存在于血管内皮细胞中,参与各种药物和毒素的外排,P-gp在肿瘤细胞中大量表达是导致肿瘤细胞耐药的主要原因,后续研究发现P-gp在血脑屏障毛细血管上也有大量表达[30-32]。因此,克服P-gp的外排作用一方面可以使化疗药物更多的透过血脑屏障,提高并维持药物在脑脊液的浓度;另一方面也可以减少肿瘤细胞的耐药性。
维拉帕米是一种P-gp抑制剂,研究发现维拉帕米能够在体外逆转P-gp引起的耐药性[33]。陈艳明等[34]研究表明冰片可以通过抑制细胞膜上P-gp的活性明显地增强长春新碱所致人宫颈癌细胞系(Hela)和犬肾细胞系(MDCK)的细胞毒性,而这种作用与P-gp拮抗剂维拉帕米相似。Tang等[35]制备出一种共载冰片和紫杉醇的脂质白蛋白纳米粒(BOR/PTX LANs) ,以P-gp抑制剂环孢霉素A作为阳性对照,发现冰片通过抑制P-gp的外排作用增加C6细胞对紫杉醇的摄取。
Wang等[36]以维拉帕米作为阳性对照,以罗丹明123(Rh123)的大鼠肠吸收参数和表观渗透系数(Papp)为考察指标研究冰片对P-gp的影响。结果发现,冰片显著增加Caco-2细胞对Rh123的吸收,提高Rh123在大鼠空肠和回肠的吸收速率和Papp,该实验证实了冰片可以抑制肠道中P-gp的表达。Yu等[37]发现大鼠口服冰片后海马体和下丘脑中的Rh123明显增加,说明冰片对这两个区域中P-gp的抑制作用较强。进一步通过蛋白表达实验和逆转录聚合酶链反应(RT-PCR)发现冰片对P-gp的抑制作用与降低海马体和下丘脑中多药耐药基因1a(MDR1a)、多药耐药蛋白基因1b(MDR1b)、多药耐药蛋白1(Mrp1)有关。
3.4 下调缺氧诱导因子-1α的表达
缺氧诱导因子-1α(HIF-1α)是一种转录因子,在肿瘤细胞的缺氧微环境中被激活,有研究发现HIF-1α的表达水平与胶质瘤的病理分级呈正相关[38]。
合成冰片通过靶向mTORC1/eIF4E通路下调HIF-1α表达,诱导原发胶质瘤细胞凋亡从而抑制肿瘤生长。Wang等[39]研究了合成冰片对大鼠C6胶质瘤移植模型以及人原发性胶质瘤细胞增殖的抑制作用。研究结果表明,与对照组相比,冰片组显著地抑制了肿瘤生长,诱导胶质瘤细胞凋亡,且具有浓度依赖性;蛋白印迹实验表明冰片可以下调Bcl-2的表达,上调Bax和caspase-3的表达;而在细胞转染了过表达HIF-1α的质粒后,这种作用被逆转,这说明冰片是通过HIF-1α介导诱导人原代培养胶质瘤细胞凋亡。此外,还发现mTORC1 siRNA抑制了eIF4E的表达,eIF4E siRNA抑制了HIF-1α的表达,提示mTORC1/eIF4E通路参与缺氧条件下人脑胶质瘤原代培养细胞HIF-1α的表达调控。
4. 结语
冰片与化疗药物联用增加药物透过BBB,提高病灶部位有效药物浓度,增强抗胶质瘤效果;冰片与化疗药物共载制备成冰片药物复合纳米粒使纳米粒的靶向性进一步增强,给药更加方便。冰片增效作用机制主要包括诱导ROS产生,增强对肿瘤细胞的DNA损伤作用;打开BBB的紧密连接,提高化疗药物生物利用度;抑制P-gp,有效逆转肿瘤细胞的MDR;下调HIF-1α的表达,诱导胶质瘤细胞凋亡等。冰片的辅助作用有效地改善化疗药物对胶质瘤细胞的多药耐药性,降低血脑屏障对化疗药物的阻碍与外排作用。但值得注意的是,基于冰片与化疗药物联合应用于胶质瘤的研究还处在临床前研究阶段,目前也暂无相关制剂上市,要实现从实验室到临床的转变还需解决一些问题,比如冰片种类的选择、冰片增效的安全有效剂量范围等。冰片与化疗药物联用及共载达到靶向增效目的是一种新型的给药策略,有望为胶质瘤的临床治疗提供新的思路与方法,具有广阔的开发前景。
-
表 1 肌醇烟酸酯在皮肤样品中的精密度和准确度(n=6)
质量浓度
(ρB/μg·ml−1)日内精密度 日间精密度 实测浓度
(ρB/μg·ml−1)RSD
(%)RE
(%)实测浓度
(ρB/μg·ml−1)RSD
(%)RE
(%)0.25 0.24±0.020 8.20 −3.44 0.24±0.025 10.38 −3.18 0.5 0.50±0.042 8.53 −0.87 0.51±0.039 7.65 1.61 2.5 2.37±0.068 2.85 −5.25 2.33±0.12 5.15 −7.00 15 14.67±0.66 4.49 −2.22 13.99±0.85 6.07 −6.73 表 2 样品提取回收率考察结果(n=6)
成分 质量浓度
(ρB/μg·ml−1)回收率( % ) mean±SD RSD( % ) 肌醇烟酸酯 0.5 94.26±4.11 4.36 2.5 96.76±5.02 5.19 15 97.52±2.20 2.26 甲苯咪唑 1.70 90.65±3.17 4.35 表 3 肌醇烟酸酯在不同贮存条件下的稳定性(n=3)
稳定性条件 质量浓度
(ρB/μg·ml−1)实测值
(ρB/μg·ml−1)RSD
(%)室温下放置12 h 0.5 0.47±0.037 7.94 15 14.56±0.63 4.36 −4 ℃乙腈中放置12 h 0.5 0.46±0.034 7.40 15 16.71±0.50 3.03 −20 ℃反复冻融3次 0.5 0.50±0.019 3.75 15 16.73±0.16 0.96 −80 ℃冷冻贮存2周 0.5 0.47±0.038 8.24 15 13.21±0.75 5.69 表 4 大鼠经皮给药后肌醇烟酸酯的主要药动学参数(mean±SD, n=6)
统计矩参数 单位 肌醇烟酸酯参数值 t1/2 h 4.555±2.054 Tmax h 6±0 Cmax mg/L 16.929±2.153 AUC0-t mg·h /L 150.665±16.568 AUC0-∞ mg·h /L 161.074±23.917 MRT(0−t) h 9.044±0.618 MRT(0−∞) h 10.444±1.91 CLz/F L/(h·kg) 0.19±0.03 Vz/F L/(h·kg) 1.19±0.437 -
[1] 陶冶, 顾伟杰, 晋亮, 等. 高原高寒地区官兵冻伤发生情况调查及相关因素分析[J]. 临床军医杂志, 2023, 51(3):243-245. [2] 张莉, 蔺兴遥, 尚芸, 等. 冻伤的病理机制及治疗研究进展[J]. 中国临床药理学与治疗学, 2023, 28(3):347-354. [3] 焦明克, 楼林, 胡劼, 等. 普通冻伤与高原冻伤血液微循环恢复的差异[J]. 解放军医学杂志, 2017, 42(1):66-69. doi: 10.11855/j.issn.0577-7402.2017.01.13 [4] 毕婷, 冯晓东, 张巍, 等. 寒区军人冻伤发病现状及预测模型研究进展[J]. 创伤与急危重病医学, 2020, 8(2):134-136. [5] 刘清宇, 刘松春, 程治铭, 等. 寒区冻伤预防及诊疗研究进展[J]. 人民军医, 2021, 64(2):147-150. doi: 10.3969/j.issn.1000-9736.2021.02.014 [6] 马宏达, 吴琼, 崔亚玲, 等. 不同促透剂对肝素钠肌醇烟酸酯乳膏透皮吸收影响[J]. 临床军医杂志, 2017, 45(8):771-775. [7] 崔亚玲, 刘小虎, 许子华, 等. 肝素钠肌醇烟酸酯乳膏对兔皮肤冻伤的治疗作用及刺激性研究[J]. 东南国防医药, 2021, 23(05):449-454. doi: 10.3969/j.issn.1672-271X.2021.05.001 [8] LIANG D, MA J, WEI B, et al. Determination of inositol hexanicotinate in rat plasma by high performance liquid chromatography with UV detection[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2008, 863(1):172-176. doi: 10.1016/j.jchromb.2007.12.024 [9] MILTON S G, ROBINSON K, MA J, et al. Biotransformation and pharmacokinetics of inositol hexanicotinate in rats[J]. Xenobiotica, 2013, 43(9):817-822. doi: 10.3109/00498254.2012.762591 [10] CDE. 药物非临床药代动力学研究技术指导原则. [DB/OL].(2014-05-13). https://www.nmpa.gov.cn/xxgk/ggtg/ypggtg/ypqtggtg/20140513120001448.html. [11] 国家药典委员会. 中华人民共和国药典: 四部[M]. 北京: 中国医药科技出版社, 2020. -





 下载:
下载: