-
结直肠癌(CRC)是最常见的消化道恶性肿瘤,在中国的发病率仅次于肺癌,且呈逐年升高的趋势[1]。结直肠癌的发病机制具有多因素、多阶段、多基因突变等特点[2-3]。结直肠癌早期发现的概率低,多数患者出现明显症状后才被确诊,此时手术通常已无法完全控制肿瘤进展,需化疗控制病情[4]。结直肠癌患者最常用的化疗药物为奥沙利铂和五氟尿嘧啶(5-FU),分别是DNA合成抑制剂和胸苷酸合成酶抑制剂,影响细胞DNA复制和转录,最终导致细胞死亡[5-7]。近年来,复发或难治性结直肠癌患者数量逐渐升高,对多数化疗药无应答,其5年生存率低于10%[8-9]。结直肠癌患者耐药情况越来越严重,解决耐药问题的首要条件为阐明结直肠癌患者化疗耐药的机制。
随着人们对肠道微生物研究的深入,已明确表明其与多种肠道疾病相关,其中具核梭杆菌(Fn)与结直肠癌发生、发展的关系研究最透彻[10-13]。在口腔、胃肠道、呼吸道等环境内均明确发现Fn,是一种专性厌氧性、G−菌,可黏附、侵入细胞,获得适合生存的环境[14-16]。Fn可以产生毒力因子、提升白介素17(IL-17)和肿瘤坏死因子(TNF)等促炎因子水平、抑制自然杀伤细胞的细胞毒活性、招募肿瘤浸润性骨髓细胞等,促进肿瘤发生、发展和耐药机制的产生[11-13, 17-19]。例如,Fn促进了CRC的进展,并使奥沙利铂和5-FU化疗耐药[20]。因此,解决Fn高富集后促进CRC进展并产生化疗耐药的问题,有望提升结直肠癌患者化疗的有效率。
本研究首先在类器官层面验证Fn促结直肠癌增殖作用,其次比较考察前期筛选获得的抗Fn化合物在Fn与结肠癌HCT116细胞共孵育条件下对其体外抗癌活性的影响,最后优选高活性化合物开展其对Fn灌胃干预下裸鼠结肠癌HCT116移植瘤抗癌药效评价,为新型抗结直肠癌药物研发提供先导化合物。
-
基于市售化合物库(上海陶术生物科技有限公司)中5073个化合物针对Fn的表型筛选结果,选择9个不同结构类型、不同作用机制、不同活性的化合物作为本研究的实验材料;鼠源PD-1(程序性死亡受体1)抗体(武汉艾美捷科技有限公司);布氏肉汤、脑心浸出液(BHI)肉汤(美国BD公司);结直肠癌类器官基础培养基、培养基补充液B、培养基补充液C、类器官培养型基质胶、肿瘤组织消化液和红细胞裂解液(伯桢生物科技公司);直肠癌组织(海军军医大学第一附属医院肛肠科);DMEM培养基、CCK-8检测试剂盒、胎牛血清(上海翌圣生物科技股份有限公司);人结直肠癌细胞HCT116(上海中国科学院细胞中心);具核梭杆菌(ATCC 23726
, 美国模式菌种收集中心);裸鼠(上海吉辉实验动物饲养有限公司);xCELLigence RTCA DP实时无标记细胞分析仪(安捷伦科技有限公司)。 -
①实验前准备:首先,配置完全培养基(结直肠癌类器官基础培养基∶培养基补充B∶培养基补充C=976∶20∶4);其次,将−20℃保存的类器官基质胶放置于4℃融化(室温下不超过30 s);最后,将肿瘤组织消化液置于37℃的水浴锅内预热。②组织收集与处理:直肠癌组织用类器官基础培养基清洗2遍,置于盛有PBS的无菌培养皿中,无菌剪刀剪碎组织至直径小于1 mm,然后用适量的肿瘤组织消化液重悬,并转移至离心管内,于37℃、100 r/min的恒温振荡培养箱中消化30 min,在消化完成的组织悬液中加入胎牛血清(FBS)至终浓度达1%~5%,减缓消化作用,同时轻轻吹打5~10次。③筛选细胞:用100 μm细胞过滤器过滤组织悬液,将穿过的滤液转移至离心管中,450 r/min离心3 min,吸去上清液。④细胞收集:用类器官基础培养基清洗细胞2次,加入红细胞裂解液裂解1 min,300 r/min离心3 min,吸去上清液。⑤3D培养板细胞接种:按每孔2×103个细胞用20 μl基质胶于冰浴条件下混匀,然后用移液器将基质胶和细胞的混合液移至细胞培养24孔板底部中央位置,于37℃、5% CO2细胞培养箱中孵育15 min。⑥加液培养:待培养24孔板基质胶凝固至不再流动后,沿孔壁缓缓加入完全培养基,于37℃、5% CO2培养箱中培养。⑦加Fn菌液:培养72 h后,观察类器官成型且稳定,采用完全培养基重悬Fn使其浓度分别为1×108 CFU/ml和1×104 CFU/ml,加入24孔板中,同时在不同孔中加入同体积PBS。⑧观察:每天在同一视野、同一放大倍数下分别对PBS、浓度为1×104 CFU/ml和1 × 108 CFU/ml的Fn作用下的直肠癌类器官进行拍照记录,观察类器官生长变化,共4 d。
-
①细胞培养:用8 ml含10%胎牛血清和1%双抗的DMEM培养基培养HCT116细胞。待细胞生长至 90% 左右时,弃上清液,加入2 ml PBS清洗,2 ml胰酶消化1.0 min,加入3 ml含10%胎牛血清和1%双抗的DMEM培养基吹打均匀,1 000 r/min离心5 min后,弃去上清液,加入4 ml含10%胎牛血清和1%双抗的DMEM培养基再次吹打均匀,取10 μl细胞悬液稀释10倍至100 μl,置于细胞计数板上计数。②细胞铺板:将HCT116细胞按照浓度为每孔7 × 103个/ml加100 μl于96孔板中,37℃、5% CO2细胞培养箱中孵育12 h。③受试药物与细胞或与细胞和Fn共孵育:吸出培养基,每孔加入100 μl不同浓度的受试化合物,将生长良好的Fn培养液用4 000 r/min离心10 min,弃上清液,加入无胎牛血清、无双抗的DMEM培养基混匀,比浊仪将菌的浓度调至0.5麦氏浊度[(1~2)×108 CFU/ml]制得Fn菌液,然后再加入100 μl感染系数(MOI)为1 000∶1的上述Fn菌液或新鲜无胎牛血清和双抗的DMEM培养基,于37℃、5% CO2细胞培养箱中培养72 h。④测定IC50:吸出培养基,加入100 μl浓度为10%的CCK-8溶液,35℃孵育0.5 h,在450 nm波长的条件下读取A值;用GraphPad Prism 7软件拟合出受试药物对HCT116细胞或与Fn共孵育HCT116细胞的IC50值。
-
①HCT116细胞培养和Fn菌液准备同“2.2”项。②按实时无标记细胞分析仪的规范操作程序完成名称、目的、分组、时长等输入。③以50 μl含5%胎牛血清、无双抗DMEM培养基进行基线矫正。④每孔加入7×103个/ml 的HCT116细胞,在室温下放置 30 min后,放置于测试台中。⑤ 18 h后暂停设备,吸出培养基,加入含5%胎牛血清、无双抗DMEM培养基的Fn菌液100 μl,使得MOI=1 000∶1,加入浓度在最小抑菌浓度(MIC)上下的受试化合物100 μl,放入测试台中继续培养72 h,实时观察记录HCT116细胞数量变化。
-
①裸鼠在动物房无操作下饲养5 d,然后在裸鼠饮用水中加入链霉素和克林霉素使其浓度分别为5 g/L和0.1 g/L,继续饲养7 d以清理裸鼠肠道微生物,减少其他微生物对实验结果的影响。②以皮下注射方式,接种浓度为1.0×107个/ml的人源HCT116细胞。③待皮下肿瘤大小长至50 mm3时,将浓度为1×108 CFU/ml(BHI溶解)的Fn菌液灌胃,每2 d给予1次,500 μl/只,共4次。④将荷瘤裸鼠随机分为4组,对照组和PD-1组每组5只,甲氨蝶呤组和联合用药组每组3只。对照组:每3 d给予Fn灌胃1次;PD-1组:除每3 d Fn灌胃1次外,另外给予鼠源PD-1抗体腹腔注射100 μl,首周3次,次周2次,每次给药剂量为5 mg/kg;受试药物组:除每3 d给予Fn灌胃1次外,再给予甲氨蝶呤灌胃500 μl,剂量为0.5 mg/kg,每天给药1次;联合用药组:采用同样的给药频率和剂量,同时给予甲氨蝶呤和PD-1抗体。⑤裸鼠体质量和肿瘤体积监测:每天监测荷瘤裸鼠体质量和皮下肿瘤体积变化,观测15 d后断颈处死裸鼠。肿瘤体积计算公式为V=1/2×a×b2,式中a为肿瘤长径,b为肿瘤短径。抑瘤率(%)=(对照组平均体积−实验组平均体积)/对照组平均体积×100%。
-
实验处理及统计图表的绘制利用GraphPad Prism软件完成。符合正态分布计量资料用(
$ \bar{x}\pm \mathrm{s} $ )描述,进行方差分析或t检验,计数资料采用$ {\chi ^2} $ 检验。P<0.05为有统计学差异。 -
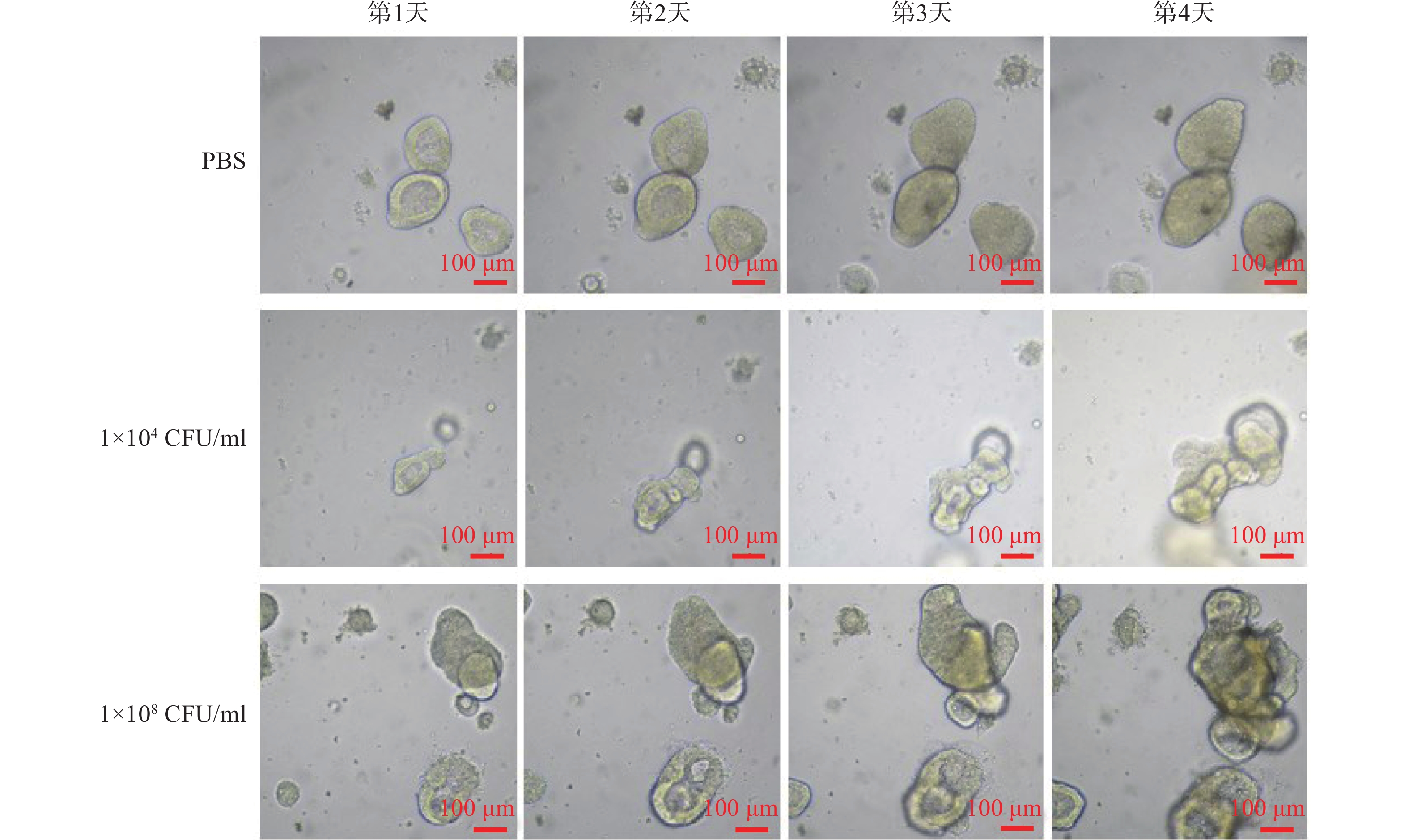
连续4 d对PBS和不同浓度Fn干预下的固定位置直肠癌类器官生长情况的拍照观察结果显示,PBS阴性对照组的直肠癌类器官随时间呈缓慢生长;但是,1×104 CFU/ml浓度的Fn干预下的直肠癌类器官随时间呈急速生长,且呈浓度依赖(图1)。
-
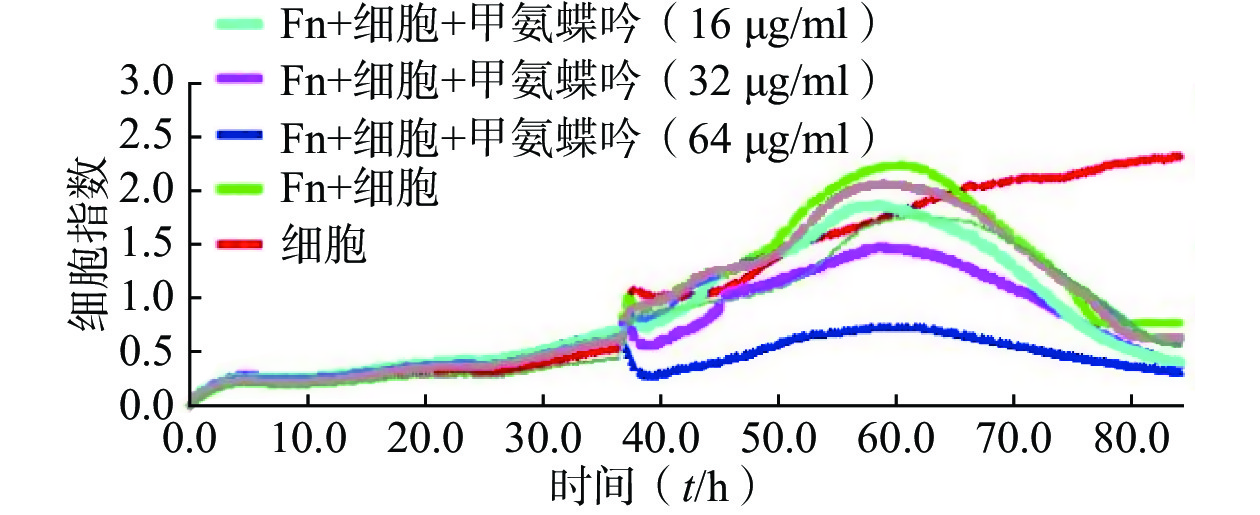
用CCK-8法分别比较测定了前期筛选获得的9个MIC达2.0~32 μg/ml的抗Fn活性化合物对人结直肠癌HCT116细胞及在最优MOI条件下与Fn共孵育的人结直肠癌HCT116细胞的体外IC50,结果显示,9个受试化合物均能显著提升Fn与结肠癌细胞共孵育条件下的体外抗肿瘤活性,其中甲氨蝶呤提升幅度最大,达143倍(表1)。
表 1 Fn对抗Fn化合物(MIC)的体外抗癌活性(IC50)的影响
名称 MIC
(μg/ml)HCT116
(IC50,μmol/L)HCT116 + Fn
(IC50,μmol/L)新鱼腥草素钠 32 0.48 0.12 对甲氧基苯甲醛 32 4.22 1.77 PA-824 32 9.62 5.62 甲氨蝶呤 32 4.30 0.03 吲哚-3-甲酸 16 8.86 2.72 己烯雌酚 32 23.10 9.35 2'-脱氧胞嘧啶核苷 8 0.78 0.07 5-硝基-8-羟基喹啉 2 22.85 3.93 特地唑胺 2 4.29 1.42 通过实时无标记肿瘤细胞分析技术检测了优选抗Fn活性化合物甲氨蝶呤在Fn与HCT116细胞共孵育条件下对肿瘤细胞生长的影响,实时检测结果显示,甲氨蝶呤也能显著抑制Fn的促肿瘤细胞生长作用,且呈浓度依赖性(图2)。
综上所述,优选甲氨蝶呤开展后续Fn灌胃干预下裸鼠人结肠癌HCT116移植瘤的体内抗癌药效评价。
-
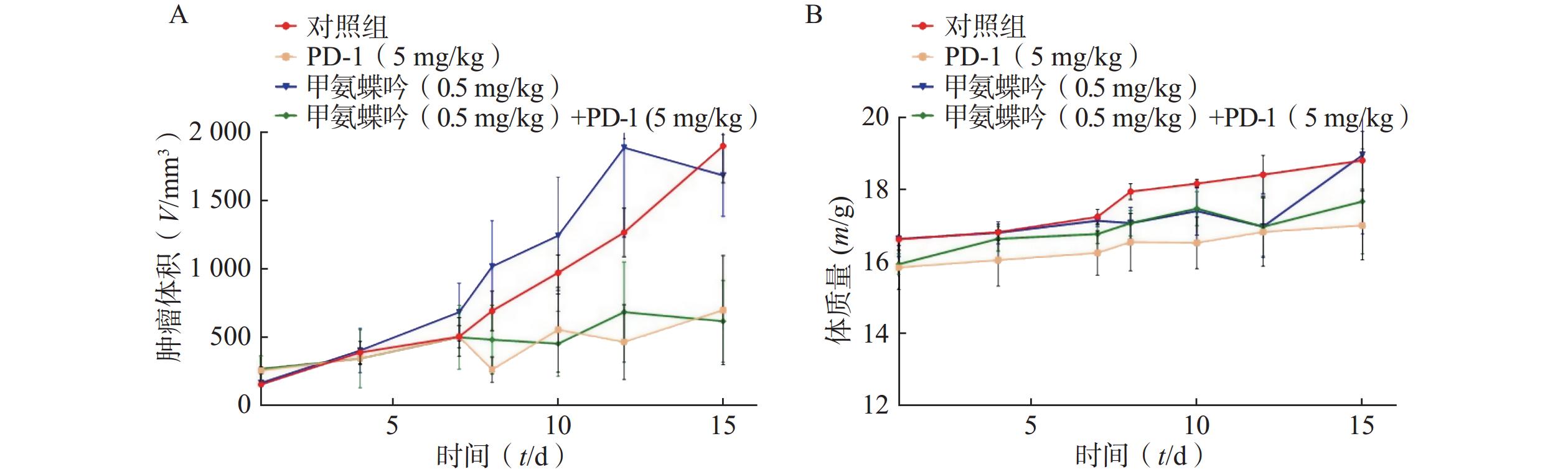
在Fn灌胃干预下,抗Fn优选化合物甲氨蝶呤(0.5 mg/kg) 以及PD-1抗体 (5.0 mg/kg) 单独用药的抑瘤率分别为 11.39%、 53.95%; 当甲氨蝶呤 (0.5 mg/kg)与PD-1抗体(5.0 mg/kg)联用后,其抑瘤率可显著提升至67.46%(见图3A)。给药组荷瘤裸鼠的体质量无显著变化,与对照组相似(见图3B)。
-
本文研究表明:①Fn(1 × 104 CFU/ml)可显著促进直肠癌类器官增殖,且呈浓度依赖(图1),患者衍生的类器官模型表明,Fn的高富集可促进直肠癌的发展,加重病情,严重威胁患者的生命安全,由此可知,在体内抑制Fn的复制、繁殖等可能会为患者带来好处。② 9个抗Fn活性化合物(MIC= 2.0~32 μg/ml)均能显著提升与Fn共孵育结肠癌HCT116细胞的体外抗肿瘤活性,甲氨蝶呤提升抗癌活性幅度最大,达143倍(表1),同时,实时无标记肿瘤细胞生长分析实验显示,甲氨蝶呤也能显著抑制Fn促结肠癌HCT116细胞生长作用,且呈浓度依赖特性(图2)。Fn、细胞、化合物共孵育实验表明,部分化合物在抵抗Fn促增殖作用的同时,可提升其体外抗肿瘤活性,其中,甲氨蝶呤作为经典的抗肿瘤药物,在抗Fn、抗肿瘤细胞以及抗Fn和肿瘤细胞共孵育中均表现出不俗的效果,但产生此效果的机制尚需进一步研究。③优选活性化合物甲氨蝶呤(0.5 mg/kg)与PD-1抗体(5.0 mg/kg)联用,对Fn灌胃干预下裸鼠人结肠癌HCT116移植瘤具有显著的抑制活性,其抑瘤率达67.46%,分别优于相同给药剂量的甲氨蝶呤和PD-1抗体单独用药的抑瘤活性,且对荷瘤裸鼠的体质量无显著影响。从体内实验结果中可知,在Fn高富集的情况下,甲氨蝶呤联合应用PD-1抗体后表现出更好的治疗效果。本研究首先在类器官层面验证了Fn促进直肠癌增殖的效果,其次探索了Fn、细胞同时存在情况下,化合物体外抗肿瘤效果变化,最后根据实验结果优选经典化疗药物甲氨蝶呤,利用裸鼠人结肠癌HCT116移植瘤模型验证了体内效果,并得出基于抗致病具核梭杆菌开发抗结直肠癌的药物具有应用前景的结论。
本研究可为后续抗Fn类抗结直肠癌药物结构衍生提供先导化合物,并有望拓展甲氨蝶呤的新适应证。同时,本文研究仍有部分缺陷,如体内实验没有设置无Fn灌胃干预组,观察无Fn干预情况下裸鼠移植瘤的肿瘤增殖情况,因此,这也为后续深入结构优化所得高抗Fn活性化合物的体内抗结直肠癌活性研究提供改进策略。
Screening and anti-colorectal activity of small molecule inhibitors of Fusobacterium nucleatum
-
摘要:
目的 基于市售化合物库的表型筛选获得抗具核梭杆菌(Fn)活性化合物,评价其在Fn干预下的抗结直肠癌活性,为新型抗结直肠癌药物研发提供先导化合物。 方法 首先验证Fn促结直肠癌类器官增殖效应;其次,比较考察抗Fn化合物在Fn与结肠癌HCT116细胞共孵育下对其体外抗癌活性的影响;最后,评价高活性化合物对Fn灌胃干预下裸鼠结肠癌HCT116移植瘤的体内抗癌药效。 结果 Fn可显著促进直肠癌类器官增殖;9个抗Fn化合物均能显著提升Fn与HTC116细胞共孵育下的体外抗癌活性,其中甲氨蝶呤抗癌活性最强,IC50达0.03 μmol/L;甲氨蝶呤(0.5 mg/kg)与PD-1(5.0 mg/kg)联用能显著抑制Fn灌胃干预下裸鼠人结肠癌HCT116移植瘤的生长,抑瘤率达67.46%,抑瘤效果优于单药。 结论 Fn小分子抑制剂甲氨蝶呤对有Fn干预的结直肠癌细胞和裸鼠移植瘤具有良好的体内外抗癌活性,为后续结构优化打下基础,并有望拓展甲氨蝶呤的新适应证。 Abstract:Objective To screen small molecule inhibitors of Fusobacterium nucleatum (Fn) based on commercially available compound libraries, and investigate their anti-colorectal cancer activities under Fn intervention in order to obtain novel anti-colorectal cancer lead compounds. Methods The promotion of colorectal cancer proliferation on organoid was validated by Fn. Secondly, the effects of anti-Fn compounds on their in vitro anticancer activity under Fn’s co-incubation with colorectal cancer HCT116 cell were comparative investigated. Finally, in vivo anticancer efficacy of highly active compounds on nude mouse colon cancer HCT116 transplanted tumor under the intervention of Fn was evaluated by gavage. Results Fn could significantly promote the proliferation of rectal cancer organoids. 9 anti-Fn active compounds could significantly enhance their in vitro anticancer activity under Fn’s co-incubation with HCT116 cells. Methotrexate had the strongest anti-cancer activity with IC50 as 0.03 μmol/L. The combined use of methotrexate (0.5 mg/kg) and PD-1 (5.0 mg/kg) had a stronger anti-tumor effect than their standalone use. Conclusion As new small molecule inhibitor of Fn, methotrexate exhibited good in vitro and in vivo anti-colorectal cancer activity against HCT116 cells and nude mouse xenografts under Fn intervention, which showed the foundation for subsequent structural optimization, and could be expected to expand the new indications of methotrexate. -
Key words:
- Fusobacterium nucleatum /
- phenotypic screening /
- anti-CRC /
- organoids /
- methotrexate
-
胶质瘤是成人最常见的原发性脑肿瘤之一,占恶性脑肿瘤的70%以上,具有恶性程度高、侵袭性强、治疗效果及预后差等特点,临床主要治疗手段为手术切除、放化疗或两者联合治疗[1]。然而,血脑屏障(BBB)的选择通透性以及肿瘤细胞的多药耐药(MDR)特点给胶质瘤的治疗带来了挑战[2]。
BBB指的是位于中枢神经系统的一种无孔微血管结构,主要由血管内皮细胞以及位于内皮细胞层囊腔表面的壁细胞组成[3]。BBB的主要功能是维护大脑内环境的稳态,严格管控物质进出大脑,保障大脑功能的正常运行。然而,这种保护作用限制了很多药物进入脑内,使得一些治疗脑部疾病的药物难以在病灶部位达到有效药物浓度,成为药物治疗脑部疾病的重要制约因素[3-4]。
冰片属芳香开窍类中药,又名2-茨醇,属于小分子脂溶性双环单萜类物质,其主要有效成分为龙脑。在《中国药典》2020版中,收录的冰片有两种:一种通过人工合成而得,名为冰片,又名合成龙脑;另一种为经樟科植物樟[Cinnamomum cam phora(L.)Presl]的新鲜枝、叶提取加工而得的天然冰片,又名右旋龙脑[5]。现代药理学研究表明冰片具有促进药物透过各种体内外屏障,抗菌、保护心脑血管、镇痛抗炎以及防止血栓等多种药理作用[6-7]。近年来,许多研究表明冰片与抗胶质瘤的化疗药物联合应用,可以明显提高化疗药物的生物利用度和治疗疗效,本文就近年来冰片对胶质瘤化疗的辅助治疗临床前研究作一综述,以期为胶质瘤的临床治疗提供新的思路。
1. 冰片与化疗药物联用辅助治疗胶质瘤
冰片作为一种新型的单萜类化学增敏剂,可以增加体内外BBB的通透性,当冰片与化疗药物联用时,可促进化疗药物顺利透过BBB进入肿瘤部位,从而提高化疗药物的生物利用度和疗效。
冰片能改善化疗药物的药动学,提高药物在肿瘤部位的蓄积。例如,段美美等[8]在考察天然冰片对顺铂在大鼠原位C6脑胶质瘤模型体内药动学及脑组织分布的影响中发现,在血浆中,与0.5%CMC-Na的溶媒对照组相比,冰片高剂量联用组t1/2β、Cmax显著增大,AUC显著减小;而在脑组织中,与溶媒对照组相比,冰片高、低剂量联用组AUC均显著增大,这说明天然冰片使顺铂更多的向脑组织转运,提高了顺铂在脑组织的生物利用度。此外,组织病理学观察发现,联用组的胶质瘤细胞核密度降低,细胞凋亡率升高。类似地,郭军洽等[9]同样证明了天然冰片可促进甲氨蝶呤(MTX)透过BBB,提高其在病灶部位的生物利用度,并且发现MTX药动学参数的改变与冰片呈剂量相关性,高剂量冰片能显著提高MTX的瘤区脑组织生物利用度。由此可见,冰片可以有效提高化疗药物的BBB透过率,改善药物在脑组织的生物利用度,为促进化疗药物增效提供有力的依据。
吉西他滨是一种临床上用于非小细胞肺癌和胰腺癌的化疗药物,有研究发现,瘤腔内直接注射吉西他滨对脑胶质瘤的治疗效果良好[10],但由于该药水溶性较大,因此静脉给药后吉西他滨难以透过血脑屏障,脑部的生物利用度很低。张帆等[11]考察了冰片对吉西他滨药动学的影响,通过构建大鼠原位9Lacz胶质瘤模型,采用微透析法收集给药后脑肿瘤部位的脑脊液,实时监测冰片对吉西他滨在大鼠脑组织的浓度变化。结果发现,与单用吉西他滨组比较,吉西他滨联合冰片给药组Cmax及AUC均增加,t1/2延长,表明冰片提高了吉西他滨在9Lacz脑胶质瘤模型大鼠脑肿瘤区域的生物利用度。
为客观评价药动学的改善带来的确切疗效,进一步探究冰片对化疗药物抗胶质瘤的促进作用,有学者进行了两者联合用药的药效学研究。范成普等[12]在大鼠C6脑胶质瘤模型中将冰片和替莫唑胺联合应用,探讨了冰片对替莫唑胺疗效的影响。结果发现,与空白对照组、单用替莫唑胺组以及单用冰片组相比,冰片联合替莫唑胺组的肿瘤体积显著减小;另外,肿瘤组织HE染色显示,肿瘤细胞核密度以及细胞凋亡率与其它三组相比最低,细胞增殖受到抑制。该实验说明了冰片可以促进肿瘤细胞凋亡、减小肿瘤体积,增强替莫唑胺的抗胶质瘤作用。
冰片还可以与纳米药物联合应用提高药物的靶向性。CCKRK肽是一种与肿瘤新生血管内皮细胞的硫酸乙酰肝素受体高度亲和的配体[13]。Lv等[14]将冰片与CCKRK肽修饰的紫杉醇前药自组装氧化还原响应纳米粒(CGKRK-PSNPs)联用,结果发现,冰片可增强CGKRK-PSNPs在体外血脑屏障模型中的转运;在裸鼠颅内U87MG胶质瘤中,通过实时荧光图像观察到CGKRK-PSNPs与冰片联用时药物的较高积累,且裸鼠中位生存期(39天)延长,这表明冰片促进了CGKRK-PSNPs纳米粒进入BBB,从而提高其抗胶质瘤疗效。
以上研究通过构建动物胶质瘤模型,通过灌胃冰片结合化疗药物注射的方式将两者联合应用研究了冰片对化疗药物的影响。一方面,从药动学的角度阐明了冰片可以有效促进化疗药物透过BBB,提高脑组织生物利用度;另一方面,通过药效学实验结果证明了冰片可以提高化疗药物的抗胶质瘤效果。
2. 冰片与化疗药物共载增效
研究发现,纳米递药系统能够帮助药物更好地穿过BBB,在中枢神经系统发挥治疗作用[15]。因此,在基于冰片能促进药物跨BBB的基础上,有学者尝试将冰片与化疗药物共载于纳米递药系统中,形成冰片药物复合纳米粒,以期更方便更高效地将化疗药物靶向递送至脑组织。
经冰片修饰的多柔比星纳米粒能提高其在小鼠体内的抗胶质瘤效果。Meng等[16]将冰片与DSPE-PEG(2000)-COOH结合,合成了一种新型载体DSPE-PEG(2000)-BO,并将多柔比星载入其中,利用该载体通过静电自组装法制备了冰片修饰的负载阿霉素的纳米胶束(DOX BO-PMs)。体外研究结果显示,DOX BO-PMs显著提高了多柔比星通过BBB的运输效率以及抑制胶质瘤细胞增殖的作用;体内药效学研究显示,DOX BO-PMs显著抑制胶质母细胞瘤的生长和转移。
研究发现,冰片与京尼平苷经鼻灌注联合给药,京尼平苷的生物利用度增加[17],这说明冰片可以促进药物在鼻腔的吸收。赵等[18]采用乳化-溶剂挥发法制备出一种载多西紫杉醇的经鼻给药纳米靶向系统(DTX-Bo-RGD-NPs) ,该给药系统由冰片与精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp, RGD)共同修饰。利用荧光染料Dir与纳米粒结合,经大鼠C6胶质瘤模型评价了DTX-Bo-RGD-NPs的体内靶向性,结果发现,DTX-Bo-RGD-NPs中的Dir在脑肿瘤组织中的荧光强度是未加冰片修饰的(DTX-RGD-NPs)1.74倍;C6大鼠脑胶质瘤原位模型药效学结果显示,DTX-RGD-NPs组荷瘤大鼠生存期为18.5天,而DTX-Bo-RGD-NPs组的生存期为21天;DTX-Bo-RGD-NPs的肿瘤细胞凋亡率是DTX-RGD-NPs的1.40倍。这说明冰片与化疗药物共载显著提高经鼻给药的纳米药物向脑组织转运,有望为难治性疾病脑胶质瘤的治疗提供一种新型的经鼻给药治疗手段, 提高难治性脑胶质瘤的治疗效果。
冰片与化疗药物共载制备成纳米给药系统相比普通单一药物的纳米粒表现出更强的脑靶向作用。与直接联用相比,共载的形式将更方便于临床使用,但是冰片与药物物理混合还是共修饰或共载的效果比较还有待研究。
3. 冰片辅助化疗增效机制
3.1 诱导活性氧产生
活性氧(ROS)是由线粒体和其他细胞器产生的一组寿命较短、高活性的含氧分子,可诱导DNA损伤[19]。癌细胞区别于正常细胞的特征之一是它们能够产生更多的ROS,以及它们对抗氧化防御系统的依赖性增强[20]。许多化疗药物可通过诱导ROS产生,促进胶质瘤细胞的凋亡[7,21-23],现在一些研究发现冰片也具有相同促进作用。
冰片与化疗药物联用可增加ROS的产生达到增强抗胶质瘤效果。Cao等[24]发现天然冰片联用顺铂使U251细胞活力降低,亚G1期细胞数量增加;免疫印迹实验表明天然冰片通过激活含半胱氨酸的天冬氨酸蛋白水解酶(Caspases) 和触发ROS过度产生来促进顺铂诱导肿瘤细胞凋亡;郭源源等[25]也同样发现冰片通过增加细胞ROS水平增强紫杉醇的抗U87细胞作用。Liu等[26]利用冰片增强ROS产生的特点,将天然冰片与抗胶质瘤药物替莫唑胺联用,发现裸鼠U251胶质瘤模型的肿瘤体积相比对照组显著减小。
3.2 打开BBB的紧密连接
紧密连接是维持BBB功能的重要组成部分,控制着依靠浓度梯度被动运输进入大脑的物质。紧密连接由闭锁蛋白(occludin)、闭合蛋白(claudins)、连接黏附分子家族(JAM)以及与它们相连的紧密连接蛋白(ZO)组成[27]。
冰片可逆性开放紧密连接。陈艳明等[28]在体外血脑屏障模型的研究中发现,冰片能使细胞间紧密连接变得松散、细胞吞饮囊泡增大、数量增多,而移除冰片24 h后上述作用消失,这说明冰片开放BBB的作用可逆。
Duan等[29]在大鼠C6胶质瘤模型中研究了天然冰片对BBB通透性的影响,通过顺铂在大鼠脑内的浓度变化评价天然冰片对BBB的开放程度,结果发现,与对照组相比,冰片低剂量组和高剂量组中顺铂在脑组织的生物利用度显著提高;免疫组化及ELISA实验表明冰片可逆下调了ZO-1和纤维型肌动蛋白(F-actin)的表达水平。这说明冰片可能通过下调紧密连接相关蛋白的表达增加了BBB的通透性,从而促进了顺铂进入脑内。
3.3 抑制P-糖蛋白的活性,逆转化疗药物耐药
P-糖蛋白(P-gp)是一种由MDR基因编码的糖蛋白,主要存在于血管内皮细胞中,参与各种药物和毒素的外排,P-gp在肿瘤细胞中大量表达是导致肿瘤细胞耐药的主要原因,后续研究发现P-gp在血脑屏障毛细血管上也有大量表达[30-32]。因此,克服P-gp的外排作用一方面可以使化疗药物更多的透过血脑屏障,提高并维持药物在脑脊液的浓度;另一方面也可以减少肿瘤细胞的耐药性。
维拉帕米是一种P-gp抑制剂,研究发现维拉帕米能够在体外逆转P-gp引起的耐药性[33]。陈艳明等[34]研究表明冰片可以通过抑制细胞膜上P-gp的活性明显地增强长春新碱所致人宫颈癌细胞系(Hela)和犬肾细胞系(MDCK)的细胞毒性,而这种作用与P-gp拮抗剂维拉帕米相似。Tang等[35]制备出一种共载冰片和紫杉醇的脂质白蛋白纳米粒(BOR/PTX LANs) ,以P-gp抑制剂环孢霉素A作为阳性对照,发现冰片通过抑制P-gp的外排作用增加C6细胞对紫杉醇的摄取。
Wang等[36]以维拉帕米作为阳性对照,以罗丹明123(Rh123)的大鼠肠吸收参数和表观渗透系数(Papp)为考察指标研究冰片对P-gp的影响。结果发现,冰片显著增加Caco-2细胞对Rh123的吸收,提高Rh123在大鼠空肠和回肠的吸收速率和Papp,该实验证实了冰片可以抑制肠道中P-gp的表达。Yu等[37]发现大鼠口服冰片后海马体和下丘脑中的Rh123明显增加,说明冰片对这两个区域中P-gp的抑制作用较强。进一步通过蛋白表达实验和逆转录聚合酶链反应(RT-PCR)发现冰片对P-gp的抑制作用与降低海马体和下丘脑中多药耐药基因1a(MDR1a)、多药耐药蛋白基因1b(MDR1b)、多药耐药蛋白1(Mrp1)有关。
3.4 下调缺氧诱导因子-1α的表达
缺氧诱导因子-1α(HIF-1α)是一种转录因子,在肿瘤细胞的缺氧微环境中被激活,有研究发现HIF-1α的表达水平与胶质瘤的病理分级呈正相关[38]。
合成冰片通过靶向mTORC1/eIF4E通路下调HIF-1α表达,诱导原发胶质瘤细胞凋亡从而抑制肿瘤生长。Wang等[39]研究了合成冰片对大鼠C6胶质瘤移植模型以及人原发性胶质瘤细胞增殖的抑制作用。研究结果表明,与对照组相比,冰片组显著地抑制了肿瘤生长,诱导胶质瘤细胞凋亡,且具有浓度依赖性;蛋白印迹实验表明冰片可以下调Bcl-2的表达,上调Bax和caspase-3的表达;而在细胞转染了过表达HIF-1α的质粒后,这种作用被逆转,这说明冰片是通过HIF-1α介导诱导人原代培养胶质瘤细胞凋亡。此外,还发现mTORC1 siRNA抑制了eIF4E的表达,eIF4E siRNA抑制了HIF-1α的表达,提示mTORC1/eIF4E通路参与缺氧条件下人脑胶质瘤原代培养细胞HIF-1α的表达调控。
4. 结语
冰片与化疗药物联用增加药物透过BBB,提高病灶部位有效药物浓度,增强抗胶质瘤效果;冰片与化疗药物共载制备成冰片药物复合纳米粒使纳米粒的靶向性进一步增强,给药更加方便。冰片增效作用机制主要包括诱导ROS产生,增强对肿瘤细胞的DNA损伤作用;打开BBB的紧密连接,提高化疗药物生物利用度;抑制P-gp,有效逆转肿瘤细胞的MDR;下调HIF-1α的表达,诱导胶质瘤细胞凋亡等。冰片的辅助作用有效地改善化疗药物对胶质瘤细胞的多药耐药性,降低血脑屏障对化疗药物的阻碍与外排作用。但值得注意的是,基于冰片与化疗药物联合应用于胶质瘤的研究还处在临床前研究阶段,目前也暂无相关制剂上市,要实现从实验室到临床的转变还需解决一些问题,比如冰片种类的选择、冰片增效的安全有效剂量范围等。冰片与化疗药物联用及共载达到靶向增效目的是一种新型的给药策略,有望为胶质瘤的临床治疗提供新的思路与方法,具有广阔的开发前景。
-
表 1 Fn对抗Fn化合物(MIC)的体外抗癌活性(IC50)的影响
名称 MIC
(μg/ml)HCT116
(IC50,μmol/L)HCT116 + Fn
(IC50,μmol/L)新鱼腥草素钠 32 0.48 0.12 对甲氧基苯甲醛 32 4.22 1.77 PA-824 32 9.62 5.62 甲氨蝶呤 32 4.30 0.03 吲哚-3-甲酸 16 8.86 2.72 己烯雌酚 32 23.10 9.35 2'-脱氧胞嘧啶核苷 8 0.78 0.07 5-硝基-8-羟基喹啉 2 22.85 3.93 特地唑胺 2 4.29 1.42 -
[1] SUNG H, FERLAY J, SIEGELR L, et al. Global cancer statistics 2020: GLOBOCANestimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3):209-249. doi: 10.3322/caac.21660 [2] RAWLA P, SUNKARA T, BARSOUK A. Epidemiology of colorectal cancer: incidence, mortality, survival, and risk factors[J]. Prz Gastroenterol, 2019, 14(2):89-103. [3] KIMJ Y, HE F, KARIN M. From liver fat to cancer: perils of the western diet[J]. Cancers, 2021, 13(5):1095. doi: 10.3390/cancers13051095 [4] JIA F J, YU Q, WANG R L, et al. Optimized antimicrobial peptide jelleine-I derivative Br-J-I inhibits Fusobacterium nucleatum to suppress colorectal cancer progression[J]. Int J Mol Sci, 2023, 24(2):1469. doi: 10.3390/ijms24021469 [5] BENSONA B, VENOOK A P, AL-HAWARY M M, et al. Colon cancer, version 2.2021, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2021, 19(3):329-359. [6] KELLAND L. The resurgence of platinum-based cancer chemotherapy[J]. Nat Rev Cancer, 2007, 7(8):573-584. doi: 10.1038/nrc2167 [7] WALKOC M, LINDLEY C. Capecitabine: a review[J]. Clin Ther, 2005, 27(1):23-44. doi: 10.1016/j.clinthera.2005.01.005 [8] CHU D K, ZHANG Z X, LI Y M, et al. Prediction of colorectal cancer relapse and prognosis by tissue mRNA levels of NDRG2[J]. Mol Cancer Ther, 2011, 10(1):47-56. doi: 10.1158/1535-7163.MCT-10-0614 [9] DAHAN L, SADOK A, FORMENTOJ L, et al. Modulation of cellular redox state underlies antagonism between oxaliplatin and cetuximab in human colorectal cancer cell lines[J]. Br J Pharmacol, 2009, 158(2):610-620. doi: 10.1111/j.1476-5381.2009.00341.x [10] FAÏS T, DELMAS J, COUGNOUX A, et al. Targeting colorectal cancer-associated bacteria: a new area of research for personalized treatments[J]. Gut Microbes, 2016, 7(4):329-333. doi: 10.1080/19490976.2016.1155020 [11] HARUKI K, KOSUMI K, HAMADA T, et al. Association of autophagy status with amount of Fusobacterium nucleatum in colorectal cancer[J]. J Pathol, 2020, 250(4):397-408. doi: 10.1002/path.5381 [12] CHEN Y Y, CHEN Y, ZHANG J X, et al. Fusobacterium nucleatum promotes metastasis in colorectal cancer by activating autophagy signaling via the upregulation of CARD3 expression[J]. Theranostics, 2020, 10(1):323-339. doi: 10.7150/thno.38870 [13] MÁRMOL I, SÁNCHEZ-DE-DIEGO C, PRADILLADIESTE A, et al. Colorectal carcinoma: ageneral overview and future perspectives in colorectal cancer[J]. Int J Mol Sci, 2017, 18(1):197. doi: 10.3390/ijms18010197 [14] GUO S H, CHEN J, CHEN F F, et al. Exosomes derived from Fusobacterium nucleatum-infected colorectal cancer cells facilitate tumour metastasis by selectively carrying miR-1246/92b-3p/27a-3p and CXCL16[J]. Gut, 2020: gutjnl-gu2020-321187. [15] XUE Y, XIAO H, GUO S H, et al. Indoleamine 2, 3-dioxygenase expression regulates the survival and proliferation of Fusobacterium nucleatum in THP-1-derived macrophages[J]. Cell Death Dis, 2018, 9(3):355. doi: 10.1038/s41419-018-0389-0 [16] BROOK I. Fusobacterial infections in children[J]. Curr Infect Dis Rep, 2013, 15(3):288-294. doi: 10.1007/s11908-013-0340-6 [17] COCHRANE K, ROBINSONA V, HOLTR A, et al. A survey of Fusobacterium nucleatum genes modulated by host cell infection[J]. Microb Genom, 2020, 6(2):e000300. [18] HASHEMI GORADEL N, HEIDARZADEH S, JAHANGIRI S, et al. Fusobacterium nucleatum and colorectal cancer: a mechanistic overview[J]. J Cell Physiol, 2019, 234(3):2337-2344. doi: 10.1002/jcp.27250 [19] KOSTICA D, CHUN E, ROBERTSON L, et al. Fusobacterium nucleatum potentiates intestinal tumorigenesis and modulates the tumor-immune microenvironment[J]. Cell Host Microbe, 2013, 14(2):207-215. doi: 10.1016/j.chom.2013.07.007 [20] HUI B Q, ZHOU C C, XU Y T, et al. Exosomes secreted by Fusobacterium nucleatum-infected colon cancer cells transmit resistance to oxaliplatin and 5-FU by delivering hsa_circ_0004085[J]. J Nanobiotechnology, 2024, 22(1):62. doi: 10.1186/s12951-024-02331-9 -





 下载:
下载: