-
松科(Pinaceae)植物马尾松(Pinusmassoniana Lamb.)主要产于江苏、安徽、河南、陕西及长江中下游各省区,资源丰富[1]。松叶“味苦,温;暖,无毒”,具有祛风燥湿、杀虫、止痒之功用。水煎、浸酒以外用或内服[2]用于治风湿痿痹、跌打损伤、湿疮、疥癣、慢性气管炎等症以及预防感冒、流脑。文献报道马尾松叶中的主要化学成分为挥发油、黄酮、多糖、木脂素和树脂等,现代药理研究表明马尾松叶提取物具有抗氧化、抗衰老、抑菌等多方面活性[3-15]。
近年来由于抗生素的滥用、器官移植、免疫抑制剂以及HIV患者的增多,深部真菌感染发病率逐年上升,其中白念珠菌是最主要的致病菌。氮唑类药物氟康唑是临床上首选的抗白念珠菌(Candida albicans)感染药物。但是长期和重复给药导致白念珠菌对氟康唑耐药越来越强。目前联合用药是恢复耐药真菌对治疗药物的敏感度,提高耐药菌对氟康唑的敏感性,治疗深部耐药菌感染的一种有效的治疗途径。从天然活性成分中寻找与现有的抗真菌药物联合发挥协同作用的小分子化合物是近年来的研究方向之一[16-20]。本文选用接近“传统水煎或浸酒法”的传统中药提取方法,用乙醇加热提取后,石油醚再萃取的方法得到马尾松叶低极性部位,通过测定马尾松叶低极性部位协同氟康唑抗耐药白念珠菌的MIC80值,同时,采用气相色谱-质谱的方法对低极性部位的化学成分进行分析鉴定,初步探究其联合氟康唑的体外抗真菌活性。
-
Thermo Trace GC Ultra气相色谱、Thermo DSQ Ⅱ质谱、Xcalibur工作站(美国赛默飞世尔公司);马尾松叶(浙江东阳市,经海军军医大学黄宝康教授鉴定为马尾松Pinusmassoniana Lamb.);所有试剂均为分析纯;水为重蒸水;载气为高纯氦气。
氟康唑注射液(上海信谊金朱药业有限公司);黄芩素(上海历鼎生物技术有限公司);二甲基亚砜(DMSO,中国医药集团上海化学试剂公司);白念珠菌103(Candida albicans103,海军军医大学长海医院真菌室提供)。
-
取干燥马尾松叶,粉碎,称取二份,每份50.0 g,分别用150 ml石油醚和80%乙醇加热回流提取1h,滤过;滤渣再分别用150 ml石油醚和80%乙醇加热回流提取1 h,滤过。分别合并两次滤液,滤液用旋转蒸发仪减压浓缩,回收溶剂,得石油醚提取物(简称醚提取物)2.5 g和80%乙醇提取物(简称醇提取物)8.0 g。取干燥后的醇提取物5.0 g,加入水100 ml混溶,获得混悬液。混悬液用50 ml石油醚萃取3次,合并浓缩石油醚萃取液,获得石油醚浸膏(简称醚浸膏)即马尾松叶低极性部位0.8 g。取125 mg醚浸膏,置于100 ml量瓶中,加入80%甲醇,超声、加热使其几近完全溶解,放置、冷却;再加入80%甲醇定容,摇匀、放置;吸取1 ml定容后的浸膏液,微孔滤膜过滤后待测。
-
色谱柱TR - 35MS石英毛细管(30 m×0.25 mm,0.25 μm),程序升温,起始温度40 ℃,保持2 min后以10 ℃/min的速度升至300 ℃并保持5 min;汽化温度250 ℃,进样量1 μl;分流比10∶1。载气为高纯氦气,流速1.0 ml/min。离子源:EI源;离子源温度为250 ℃;电子能量:70 eV;扫描范围:50~650 m/z。
-
菌株选用临床分离耐药菌株白念珠菌103(氟康唑的MIC80>128.0 μg/ml)。采用美国临床和实验室标准协会(CLSI)提出的RPMI1640 培养基微量稀释法,取无菌96孔板,于每排1号孔加RPMI1640液体培养基100 μl作空白对照;3~12号孔各加新鲜配制的菌液100 μl,菌液浓度范围为(1~5)×103cfu/ml;2号孔分别加菌液160 μl和受试药物溶液40 μl;12号孔不含药物,只加菌液100 μl作阳性生长对照。2~11号孔进行倍比稀释,使各孔的最终药物(醚提取物、醇提取物和醚浸膏)浓度分别为250.0、125.0、62.5、31.25、15.63、7.81、3.91、1.95、0.98和0.49 μg/ml,对照品黄芩素浓度分别为128.0、64.0、32.0、16.0、8.0、4.0、2.0、1.0、0.5和0.25 μg/ml,各孔中DMSO含量均低于1%,氟康唑溶液的终浓度为8.0 μg/ml。96孔板于30℃恒温培养箱培养24 h后取出,读取受试药物与氟康唑(8.0 μg/ml)联用时的MIC80值。微量稀释法测试结果见表1。
表 1 马尾松叶3种提取物与氟康唑联用对体外白念珠菌103活性(MIC80)试验结果
化合物 MIC80 联合抑菌浓度
分数指数
(FICI)联合作用 单用(μg/ml) 与氟康唑联用(μg/ml)* 醚提取物 >250.0 >250.0 1.031 无关 醇提取物 >250.0 7.81 0.047 协同 醚浸膏 >250.0 31.25 0.094 协同 黄芩素 16.0 4.0 0.281 协同 氟康唑 >128.0 − − − *与8 μg/ml 氟康唑联合使用 协同药效的判定采用联合抑菌浓度分数指数(FICI),即联用抑菌时每种药物所需最低抑菌浓度(MIC)与单用这种药物抑菌时所需MIC的比值的和。当FICI≤0.5时,两种药物的相互作用效果被定义为具有协同作用;当FICI>0.5时,认为两种药物无相互作用。
-
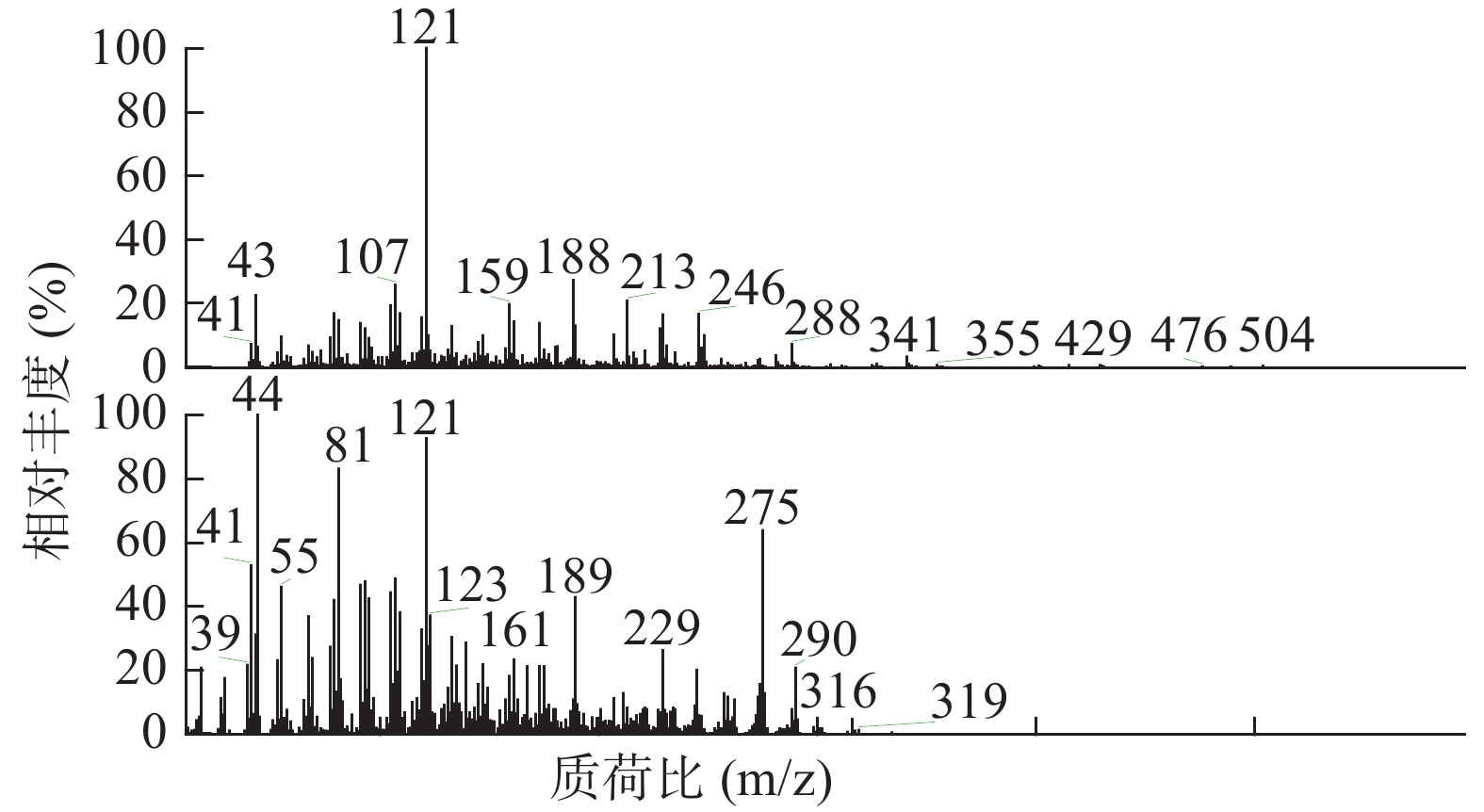
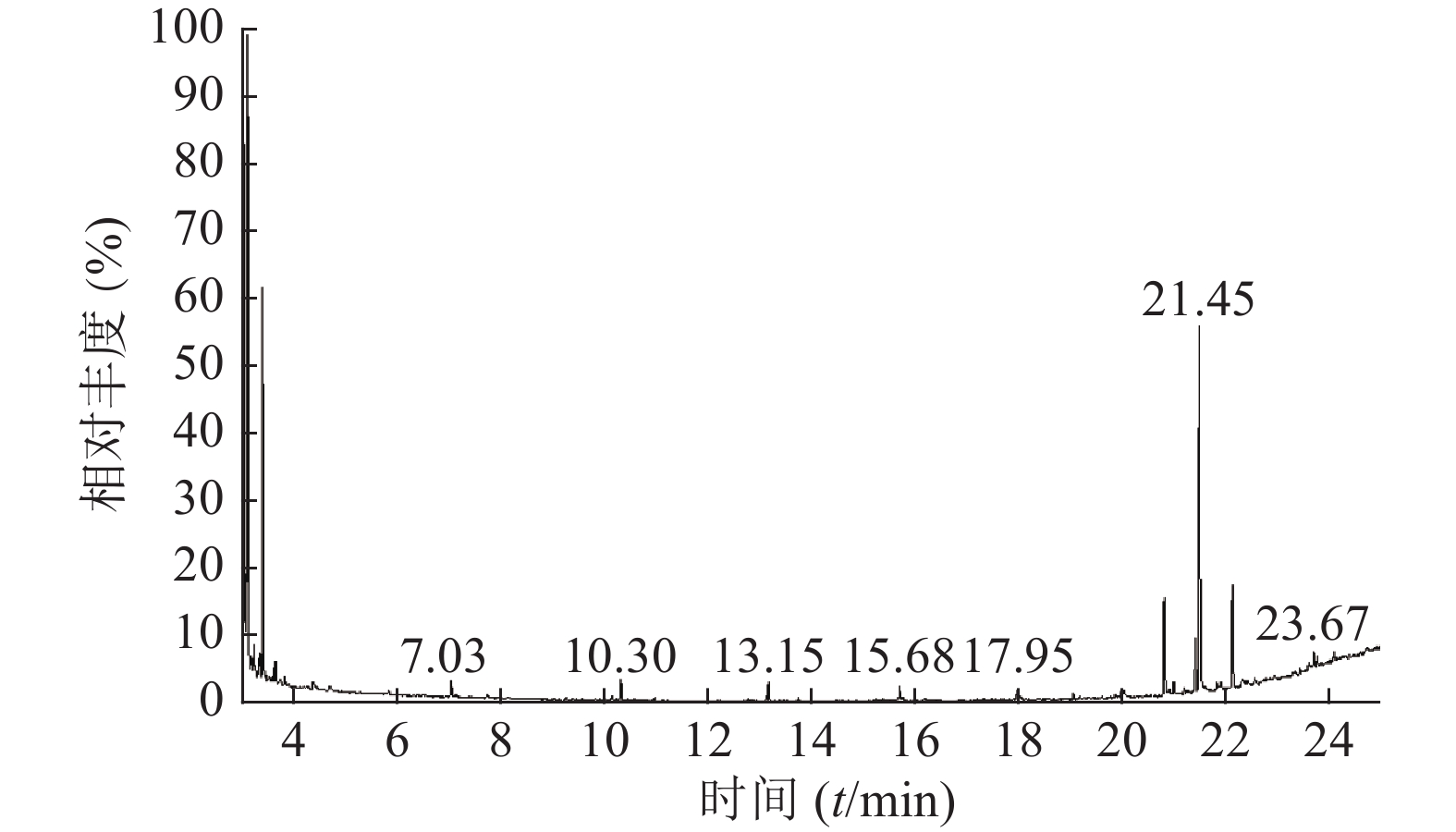
按“1.3”项下实验条件对马尾松叶低极性部位进行分析,25 min得到马尾松叶低极性化学成分的总离子流图(图1)。共检测出30个峰,通过检索NIST08光谱数据库,按60%以上匹配率(SI和RSI均大于600,最大值1 000),并结合质谱裂解规律确定其化学成分。运用峰面积归一法通过Xcalibur化学工作站数据处理系统,测得各个化学成分在石油醚部位中的质量百分数。
-
由表1可见,各受试药物单用时,对照品黄芩素的MIC80为16.0 μg/ml,提示了其具有一定的抗菌活性,其他的化合物的MIC80均大于250 μg/ml。各受试药物与氟康唑(8.0 μg/ml)联用后,对照品黄芩素、醇提取物及醚浸膏的MIC80降至4.0~31.25 μg/ml,相应的FICI值均小于0.5,显示黄芩素、醇提取物、醚浸膏分别与氟康唑联用对耐药白念珠菌均具有协同活性,但醇提取物和醚浸膏的协同活性不及对照品黄芩素,醚浸膏协同活性小于醇提取物。醚提取物单用及与氟康唑联用的MIC80均大于250 μg/ml,FICI大于0.5,显示其单用及与氟康唑联用均没有协同氟康唑抗耐药白念珠菌活性。
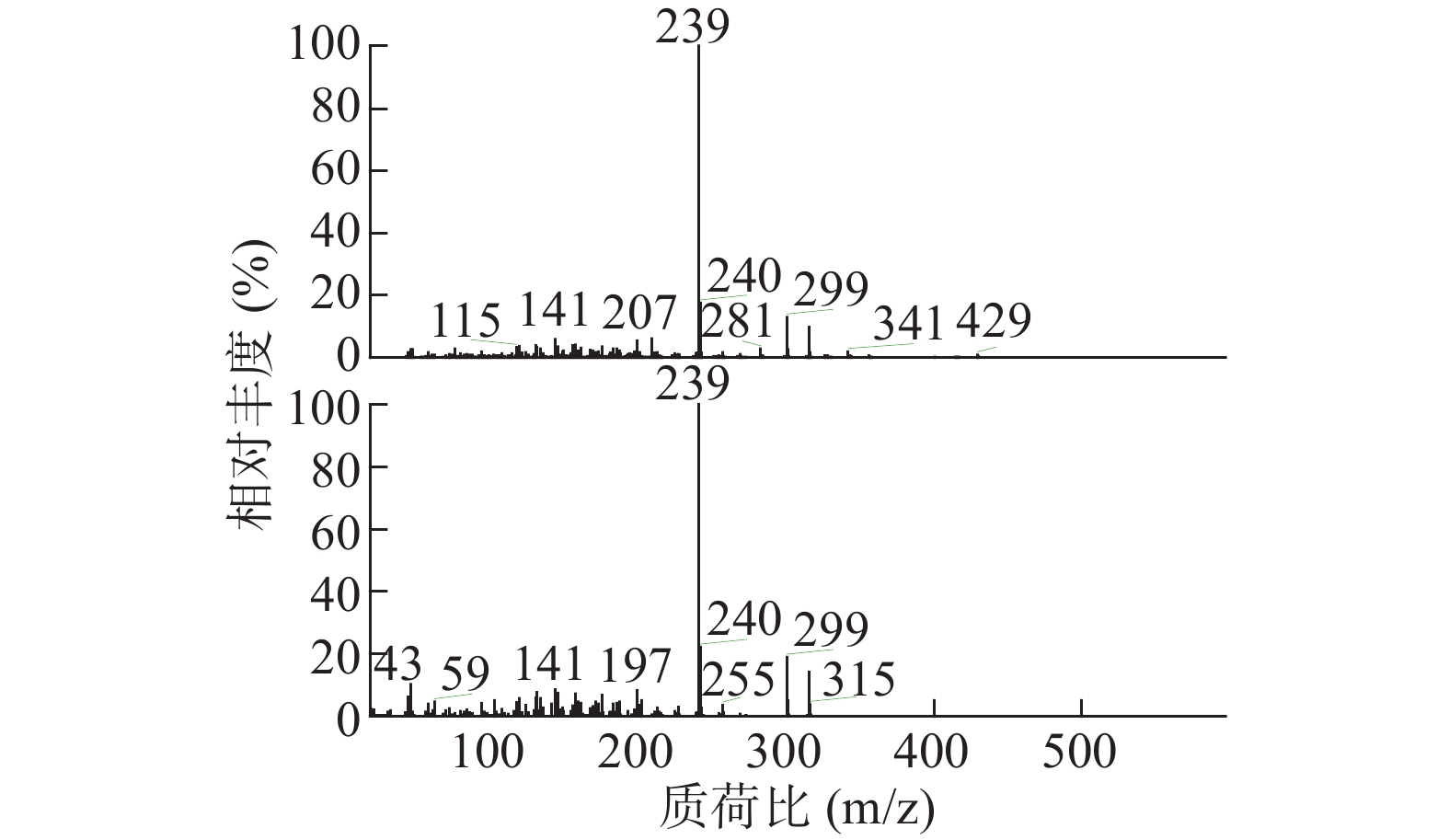
如表2所示,本次GC-MS检测出30种成分,鉴定出17个化合物。统计出本次所测马尾松叶的低极性化学成分中含有烷烃4个(6.1%),甾烷类5个(4%),脂肪酸1个(0.75%),二萜5个(53.99%),其他峰均提示为聚硅氧烷(35.16%),其中含量较高的化学成分是:玛瑙酸(8.38%,见图2)、脱氢枞酸甲酯(8.41%,见图3)。
表 2 马尾松叶低极性化学成分分析结果
序号 保留时间(min) 相似度SI值 相似度RSI值 化合物 含量(%) 1 10.30 821 850 正十五烷 1.52 2 13.15 797 840 2,6,11,15-四甲基-十六烷 2.23 3 15.68 781 822 2,6,10-三甲基-十四烷 1.37 4 17.95 709 727 3-乙基-5-(2-乙基丁基)-十八烷 0.98 5 19.03 661 770 泪柏醚 0.68 6 19.96 641 684 1-单烯丙基甘油三甲基硅醚 0.75 7 20.00 639 670 3,3-亚乙基二氧基-5β-胆甾烷 1.00 8 20.78 688 700 玛瑙酸/贝壳杉萘甲酸 8.38 9 20.88 621 690 N-[24-氧代-3α-(三甲基硅氧基)-5β-胆安-24-基]甘氨酸甲酯 0.51 10 20.96 636 739 24, 25-二羟基维生素D3 / 24R, 25-二羟胆钙化醇 1.11 11 21.16 609 633 17-乙酰氧基-4,4,10,13-四甲基-7-氧代-2,3,4,7,8,9,10,11,12,13,14,15,16,17-十四氢-1H-环戊烷(a)菲-3-基,乙酸 0.61 12 21.38 777 915 隐青霉酸甲酯 / 山莨菪碱酸甲酯 /海松酸甲酯 4.62 13 21.45 626 636 3-羟基-2,5,5,8a-四甲基-1,4,4a,5,6,7,8,8a-八氢萘-1-羧酸,2-三甲基硅乙基酯 31.90 14 21.79 645 662 3,11,18-三乙酰氧基-3,19:14,15-二环氧孕烷-20-酮 0.77 15 21.87 625 765 1,1,3,3,5,5,7,7,9,9,11,11,13,13,15,15-十六甲基八硅氧烷 1.50 16 22.09 841 889 脱氢枞酸甲酯 8.41 17 22.29 676 788 1,1,3,3,5,5,7,7,9,9,11,11,13,13-十四甲基七硅氧烷 1.30 -
近年来研究发现马尾松叶提取物具有抗真菌活性:马尾松叶石油醚、氯仿等溶剂的提取物以及不同比例的乙醇水提取物可以抑制曲霉、青霉、啤酒酵母的生长;马尾松叶乙醇提取物对枯萎病、灰霉菌有显著的抑菌活性;马尾松叶水提物对白色念珠菌有较弱抑菌性[21-25]。但马尾松叶提取物对氟康唑耐药白念珠菌的协同抗菌活性未见报道。
本研究发现,马尾松叶的醇提取物和醚浸膏单独使用时均不及黄芩素,没有抗耐药白念珠菌活性,但联用氟康唑(8 μg/ml)后,醇提取物和醚浸膏均表现出协同活性,醇提取物的活性更好,而醚提取物无论是单独使用还是联用氟康唑都没有抗耐药白念珠菌活性。醚浸膏与醚提取物相比,提取方法的改变,导致了提取物抑菌效果的有无。醚浸膏的活性应该源于乙醇加热提取获得的更丰富、含量更高的化学成分,尽管醚浸膏的主要成分也是低极性成分,但与醚提取物相比无论在含量和组成上均应不同。醚提取物含有更丰富的挥发油等低极性成分,但是可能缺少了一些重要的活性抗真菌成分,导致其没有协同抗耐药真菌作用。我们进一步对活性部位醚浸膏进行了GC-MS化学成分分析,结果表明,其化学成分与文献报道的采用水蒸气和超临界CO2提取法获得的马尾松叶挥发油成分相比差异大。活性部位醚浸膏中化合物结构类型和数量比文献报道的直接提取的挥发油少,且没有以蒎烯、莰烯为主的单萜和以石竹烯等为主的倍半萜,仅有烷烃类少量化合物重合[26-31]。活性部位醚浸膏采用了乙醇加热提取后,再经石油醚萃取得到,加热提取可能导致了蒎烯、莰烯、石竹烯等低沸点萜类化合物的丢失,但分子量更大的二萜类化学成分含量升高(53.99%)。二萜类化学成分中脱氢枞酸甲酯、海松酸甲酯是主要化学成分,两者也是松香酸的主要成分。有文献报道松香酸具有抗赤霉菌、灰霉菌等多种抗真菌活性[32-35]。因此,醚浸膏中的二萜类化合物可能是其协同氟康唑抗耐药白念珠菌作用的重要活性成分,值得进一步研究。此外,Zuzana研究发现云杉提取物中的β-谷甾醇抑制微生物生长,同时低浓度的脱氢枞酸甲酯破坏细胞壁,两者相互协同可能是云杉提取物对青霉菌、链格孢菌、米根霉的抑菌活性的关键[36]。本研究获得的醚浸膏中也含有丰富的树脂酸(13.03%)和甾烷(4%)。树脂酸和甾烷的协同可能也是醚浸膏具有协同氟康唑抗耐药白念珠菌活性的原因,这一点也值得进一步研究。
综上所述,本文首次报道了马尾松叶乙醇提取物以及马尾松叶低极性部位具有协同氟康唑抗耐药白念珠菌作用,并首次对马尾松叶低极性部位进行了GC-MS分析,鉴别的化合物除了烷烃、脂肪酸、脱氢枞酸甲酯外其它11种成分都是首次从该植物中发现,丰富了马尾松叶的化学成分。
GC-MS analysis of low polarity extracts from Pinusmassoniana Lamb. leaves and study on their synergetic activity of fluconazole against fluconazole-resistant Candida albicans
-
摘要:
目的 研究马尾松叶低极性部位的主要化学成分,以及其与氟康唑联用对氟康唑耐药白念珠菌的抗真菌活性。 方法 马尾松叶经80%乙醇热提取后,用石油醚萃取得到低极性部位,运用GC-MS法检测其化学成分,所测结果与标准谱库进行比对分析,用峰面积归一法计算各个成分的相对含量。采用棋盘式微量稀释法测试低极性部位协同氟康唑对耐药白念珠菌的最小抑菌浓度(MIC80)。 结果 从低极性部位中检测出30种成分,鉴定了17个化学成分;马尾松叶80%乙醇提取物、低极性部位及石油醚提取物协同氟康唑对耐药白念珠菌的最小抑菌浓度(MIC80)分别为7.81 μg/ml、31.25 μg/ml、>250 μg/ml。 结论 马尾松叶80%乙醇提取物及低极性部位具有协同氟康唑抗耐药白念珠菌活性;马尾松叶低极性部位协同氟康唑抗耐药白念珠菌活性的有效成分可能是其中的二萜类化合物(53.99%)。 Abstract:Objective To investigate the main chemical constituents of the low polarity extracts from pinusmassoniana Lamb. leaves and their synergetic activity with fluconazole against fluconazole-resistant Candida albicans. Methods The pinusmassoniana leaves were extracted with 80% ethanol, and then the extracts were extracted by petroleum ether to obtain the low polarity extracts. The chemical components were detected by GC-MS and elucidated by the comparison with the standard mass spectral data. The relative contents in percentage were calculated using the area normalization method. The minimal inhibitory concentrations (MIC80) of fluconazole-resistant Candida albicans strains by the low polarity extracts in combination with fluconazole were determined by checkerboard microdilution assay. Results 30 components were detected from the low polarity extracts, and 17 components were identified. The minimum inhibitory concentration (MIC80) of the 80% ethanol extracts, the low polarity extracts and the petroleum ether extracts from the pinusmassoniana leaves combined with fluconazole against fluconazole-resistant Candida albicans were 7.81 μg/ml, 31.25 μg/ml and >250 μg/ml, respectively. Conclusion The 80% ethanol extracts of pinusmassoniana leaves and its low polarity extracts have synergistic activity combined with fluconazole onfluconazole-resistant Candida albicans. The diterpenoids (53.99%) may be the effective components of the low polarity extracts. -
随着人类预期寿命的延长,人口老龄化问题日趋严重,阿尔兹海默症等神经退行性疾病的发病率也大幅上升[1]。学习记忆障碍作为阿尔兹海默症的主要临床表现之一,贯穿阿尔兹海默症疾病发展的全过程,并呈进行性加重,严重降低患者的生活质量,成为亟待解决的公共卫生问题[2]。海龙(Syngnathus)系为海龙科动物刁海龙Solenognathus hardwickii(Gy)、尖海龙Syngnathoides biaculeatus(Bloch)、拟海龙Syngnathus acus Linnaeus的干燥体,具有温肾壮阳、散结消肿的作用[3]。现代研究表明海龙富含多种脂肪酸、氨基酸以及甾体化合物,具有抗衰老、抗骨质疏松、性激素样等药理作用[4]。DHA作为海龙脂肪酸的重要成分之一,具有促进神经元细胞生长发育、抑制神经炎症及氧化应激的作用[5]。目前尚无治疗阿尔兹海默症的特效药物,海龙在改善学习记忆损伤方面的研究亦属空白。本研究拟探讨海龙对D-半乳糖诱导衰老小鼠学习记忆损伤的保护作用,并测定海龙中DHA含量,初步阐明海龙改善学习记忆损伤的作用机制。
1. 材料
1.1 实验动物
3月龄雄性ICR小鼠,体重(28±2)g,清洁级,购自昭衍(苏州)新药研究中心有限公司,合格证编号:No.202009910;许可证号:SCXK(苏)2008-0006。动物饲养于海军军医大学药学系实验动物中心,室温控制在(24±0.5) ℃,12 h光照/12 h黑暗,自由饮水、饮食。
1.2 试剂与仪器
D-半乳糖、羧甲基纤维素钠(Sigma公司);脂质过氧化物丙二醛(MDA)试剂盒、总超氧化物歧化酶(SOD)试剂盒、BCA蛋白检测试剂盒、蛋白酶磷酸酶抑制剂混合物(上海碧云天生物技术有限公司);AKT、p-AKT、FOXO1、SOD2、GAPDH抗体(CST公司);二十二碳六烯酸(DHA,纯度≥98%)购自上海麦克林生化科技有限公司。
2. 方法
2.1 海龙提取物制备
海龙(购自安徽亳州药材市场)经海军军医大学药学系生药学教研室辛海量教授鉴定为刁海龙。精密称取干燥海龙生药,剪碎,以料液比为1:10的80%乙醇浸泡12 h,80%乙醇冷凝回流提取2次,90%乙醇冷凝回流提取1次,每次回流提取2 h,过滤,合并滤液,减压浓缩干燥为浸膏。
2.2 海龙中DHA含量测定
2.2.1 色谱条件
色谱柱:AcclaimTM120 C18(4.6 mm×250 mm,5 μm);流动相:乙腈-0.05%磷酸水溶液梯度洗脱;流速:0.6 ml/min;柱温:30 ℃;检测波长:203 nm;进样量:20 μl。
2.2.2 样品及对照品制备
精密称定海龙乙醇提取物浸膏,配制成0.04 g/ml(以生药计)乙醇溶液;精密称取DHA对照品,溶解配置成0.5 mg/ml乙醇溶液。供试品溶液及对照品溶液均经0.45 μm微孔滤膜过滤除菌,备用。
2.3 动物分组及处理
将24只小鼠随机分为空白组、模型组、海龙低剂量组、海龙高剂量组,每组6只。对照组腹腔注射生理盐水,其余3组小鼠均腹腔注射D-gal(150 mg/kg),每周3次,复制衰老动物模型。海龙低、高剂量组给药剂量为1、2 g/kg(以生药计),空白组、模型组灌胃CMC-Na溶液,每周灌胃给药6 d。给药体积为0.1 ml/10 g,每周称重1次,给药量随体重变化增减,连续造模给药12周。
2.4 Morris水迷宫测试
水迷宫实验的前1~4 d为定位航行测试,第5天为空间探索实验。定位航行测试:将各组小鼠从水池4个象限放入水中,记录60 s内小鼠从入水至达平台并停留超过3 s所需时间(即逃避潜伏期),测试4 d,观察各组小鼠逃避潜伏期时间变化。空间探索实验:Morris水迷宫测试第5天,移除平台后,将小鼠从原平台对侧象限放入水中,记录小鼠60 s内的活动轨迹,并分析数据。
2.5 小鼠海马组织氧化抗氧化指标检测
水迷宫试验结束后处死小鼠,冰上迅速摘取小鼠海马组织。取部分海马组织加入生理盐水匀浆、离心,收集匀浆上清液,BCA法测定蛋白浓度后调整各样本蛋白浓度至一致,严格按照说明书检测小鼠海马组织匀浆上清液中MDA含量及SOD活性。
2.6 蛋白免疫印迹法检测海马组织AKT/FOXO1/SOD相关蛋白表达
以细胞裂解液制备海马组织匀浆,离心后收集上清液,并以BCA法测定蛋白浓度。海马组织上清液蛋白加热变性后进行十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE),PVDF膜转印后,室温下5%脱脂牛奶封闭1 h。一抗(1∶1 000)4 ℃孵育过夜,次日TBST洗膜3次,每次10 min。二抗(1∶10 000)室温孵育1 h后,TBST洗膜3次,每次10 min。ECL化学发光法显影,ImageJ软件对目的条带进行分析。
2.7 统计学分析
实验结果以(
$ \bar x \pm s $ )表示,采用SPSS 21.0软件进行数据分析,选用单因素方差分析法进行组间变量分析,LSD-t法比较组间差异。以 P <0.05表示有显著性差异,以 P <0.01表示有极显著性差异。3. 结果
3.1 海龙中DHA含量测定结果
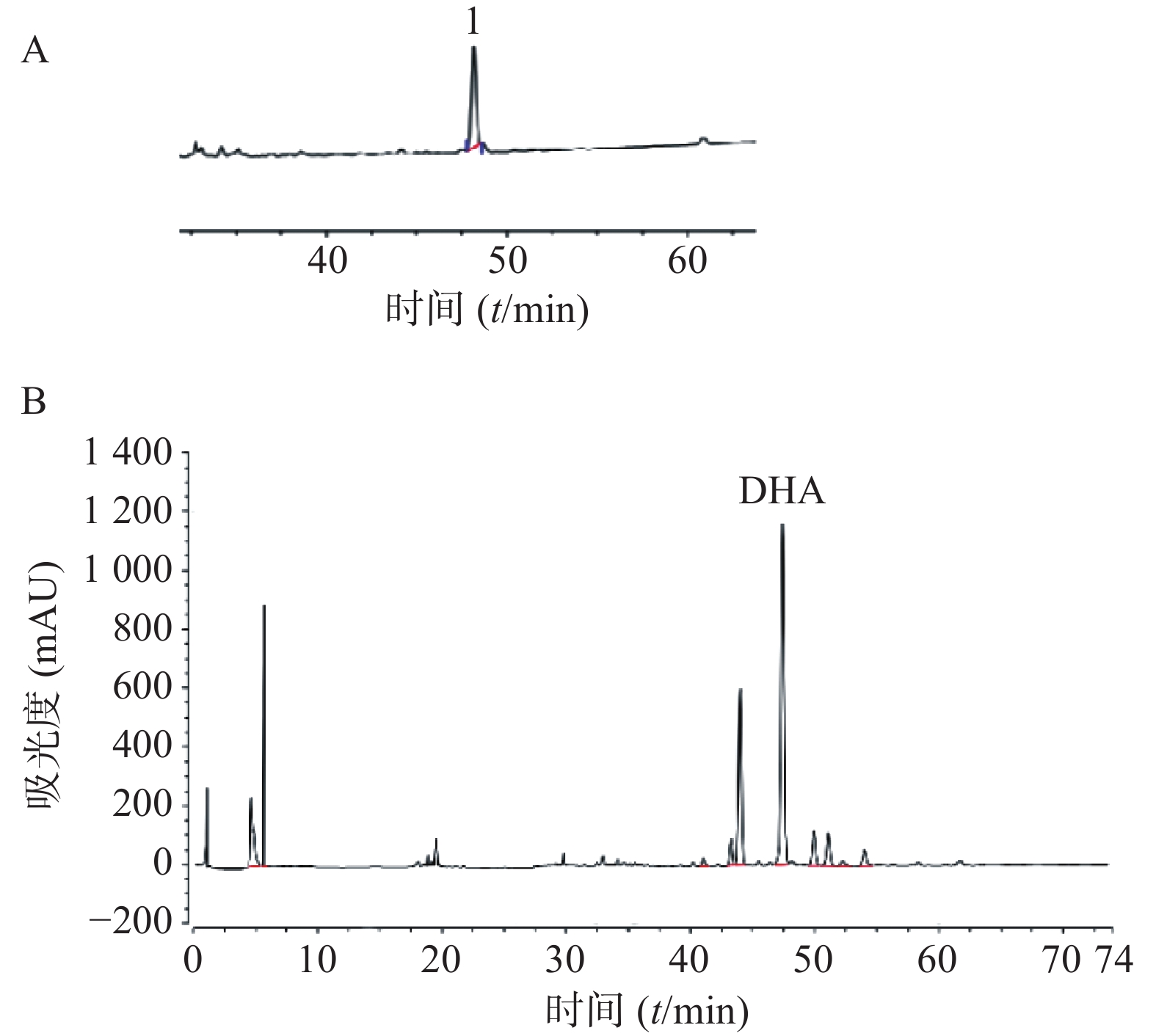
取对照品溶液,按照“2.2.1”项下方法进样测定。以峰面积为纵坐标、对照品浓度为横坐标进行回归处理,得DHA回归方程:Y=1 085.8X+4.799 9,相关系数r=0.999 9,线性范围0.034~0.41 mg/ml;取供试品液,按照“2.2.1”项下方法进样测定,并计得含量为7.761 3 mg/g(以生药计),见图1。
3.2 小鼠Morris水迷宫实验结果
小鼠定位航行实验结果:与空白组相比,模型组小鼠在定位航行实验第4天逃避潜伏期明显延长(P<0.01);与模型组比较,海龙低剂量组、高剂量组小鼠逃避潜伏期均显著缩短(P<0.01),见图2。
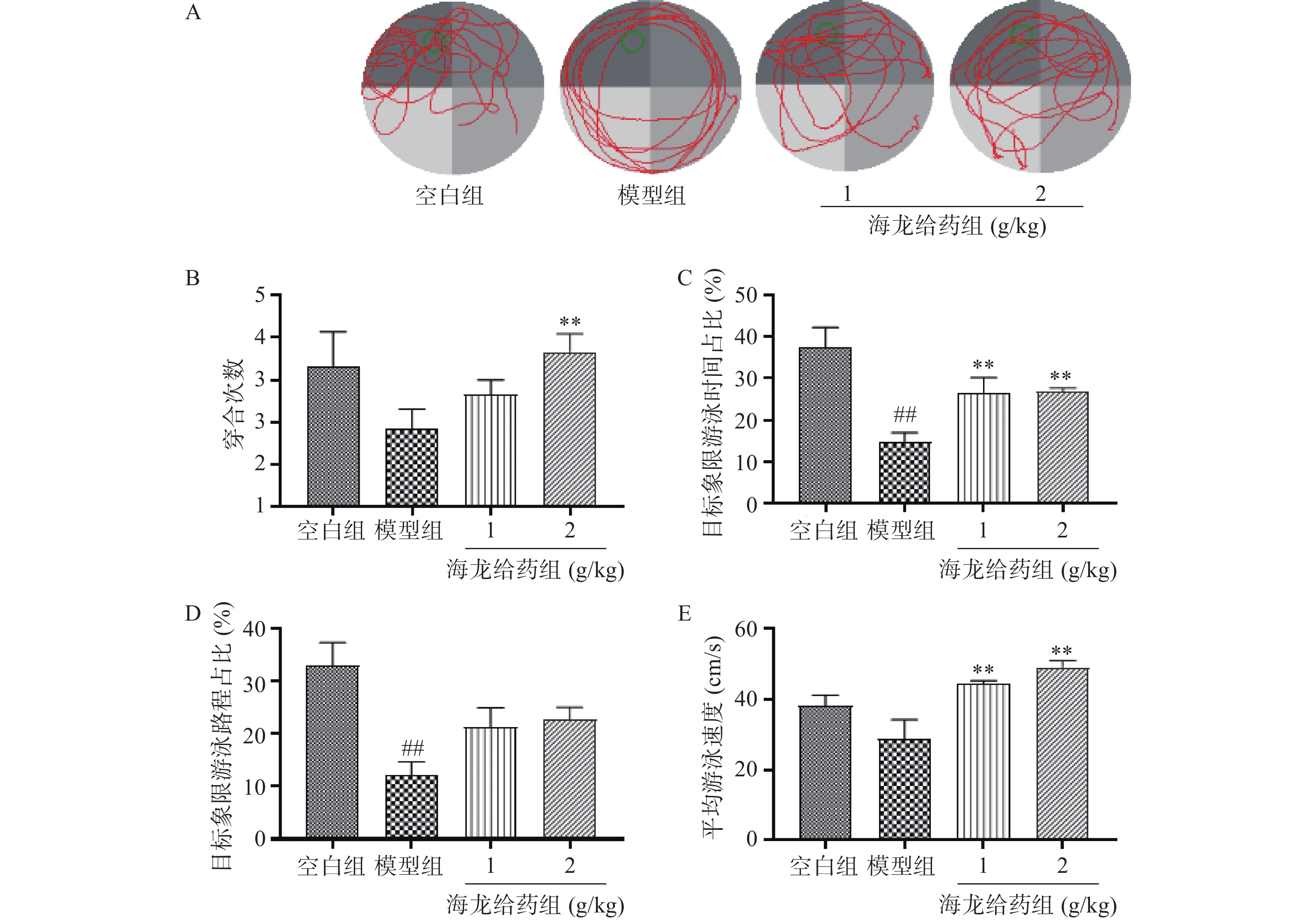
空间探索实验结果:与空白组比较,模型组小鼠目标象限游泳时间占比和游泳路程占比显著降低;与模型组比较,海龙高剂量组穿台次数显著增加(P<0.01);海龙低剂量组、海龙高剂量组目标象限游泳时间占比和游泳速度显著提高(P<0.01),见图3。
3.3 各组小鼠海马组织MDA含量及SOD活力
与空白组相比,模型组海马组织MDA含量显著升高,SOD活力显著降低(P<0.01);与模型组比较,海龙低剂量组、海龙高剂量组海马组织MDA含量显著降低(P<0.01),SOD活力显著升高(P<0.05, P<0.01),且高剂量组小鼠海马组织氧化损伤程度较低,见图4。
3.4 各组小鼠海马组织AKT/FOXO1/SOD蛋白表达
与空白组相比,模型组小鼠海马组织p-AKT/AKT比值、FOXO1、SOD2蛋白表达降低;海龙给药组可显著上调D-gal诱导记忆损伤小鼠海马组织中p-AKT、FOXO1、SOD2蛋白表达,激活AKT/FOXO1/SOD2通路(图5A-C),改善学习记忆损伤小鼠海马组织氧化损伤。
4. 讨论
氧化应激损伤与衰老密切相关。研究发现,氧化应激致机体衰老的主要机制是因过量的ROS导致线粒体损伤、脂质过氧化、抗氧化酶活力降低,进而诱导细胞周期停滞甚至细胞凋亡[6-7];同时自由基也会导致氧化损伤,并且自由基清除酶活力随年龄增长而降低,进一步导致机体氧化损伤加剧[8-9]。海马组织作为负责短时记忆储存转换与空间导航的器官[10],与学习记忆能力密切相关。研究发现[11],过量D-gal可诱导小鼠体内氧化应激加剧,导致海马组织神经元细胞损伤,从而导致动物学习记忆能力降低。本研究发现,经海龙给药干预后,小鼠海马组织MDA含量显著降低,SOD活力显著提高,学习记忆能力显著提高。表明海龙可通过降低海马组织氧化损伤改善D-gal诱导衰老小鼠学习记忆损伤。
PI3K/AKT/FOXO1信号通路是经典的抗氧化通路,能拮抗多种原因引起的氧化应激。AKT信号通过磷酸化活化激活下游mTOR、FOXOs家族蛋白表达[12],从而发挥抗氧化作用。FOXO1作为PI3K/AKT信号通路的重要作用底物,在细胞抗氧化应激反应中发挥重要作用。研究发现,FOXO1激活可以促进其下游抗氧化蛋白SOD2、CAT表达[13]。此外,FOXOs转录因子表达的减少也增加了氧化应激诱导细胞凋亡的易感性[14]。本研究发现,D-gal模型组小鼠海马组织p-AKT/AKT比值、FOXO1、SOD2蛋白表达降低,海龙给药组小鼠海马组织p-AKT/AKT比值、FOXO1、SOD2蛋白表达显著提高。表明海龙可通过激活AKT/FOXO1/ SOD2信号通路改善小鼠海马组织氧化损伤,进而改善D-gal诱导衰老小鼠学习记忆能力。
海龙为海龙科硬骨鱼类,富含多种脂肪酸、氨基酸、甾体类成分。研究发现[15-16],鱼类所含的不饱和脂肪酸类代表成分DHA可促进大脑神经元细胞发育,并通过激活Nrf2/HO-1通路、FOXO3a/SOD通路,促进抗氧化相关蛋白及基因表达,降低活性氧水平,从而减轻神经元细胞氧化及炎症损伤,改善记忆损伤。此外,DHA可通过上调包括小胶质细胞和星形胶质细胞在内的神经胶质细胞AKT、Nrf2、HO-1等氧化应激相关蛋白表达,提高抗氧化酶活性从而抑制细胞凋亡,间接防止神经元细胞损伤[17-18]。本研究通过建立海龙HPLC图谱,发现DHA为海龙主要化学成分之一,约占总成分的47%,推测海龙改善小鼠学习记忆损伤作用可能与其富含DHA有关,其作用机制有待进一步研究。
-
表 1 马尾松叶3种提取物与氟康唑联用对体外白念珠菌103活性(MIC80)试验结果
化合物 MIC80 联合抑菌浓度
分数指数
(FICI)联合作用 单用(μg/ml) 与氟康唑联用(μg/ml)* 醚提取物 >250.0 >250.0 1.031 无关 醇提取物 >250.0 7.81 0.047 协同 醚浸膏 >250.0 31.25 0.094 协同 黄芩素 16.0 4.0 0.281 协同 氟康唑 >128.0 − − − *与8 μg/ml 氟康唑联合使用 表 2 马尾松叶低极性化学成分分析结果
序号 保留时间(min) 相似度SI值 相似度RSI值 化合物 含量(%) 1 10.30 821 850 正十五烷 1.52 2 13.15 797 840 2,6,11,15-四甲基-十六烷 2.23 3 15.68 781 822 2,6,10-三甲基-十四烷 1.37 4 17.95 709 727 3-乙基-5-(2-乙基丁基)-十八烷 0.98 5 19.03 661 770 泪柏醚 0.68 6 19.96 641 684 1-单烯丙基甘油三甲基硅醚 0.75 7 20.00 639 670 3,3-亚乙基二氧基-5β-胆甾烷 1.00 8 20.78 688 700 玛瑙酸/贝壳杉萘甲酸 8.38 9 20.88 621 690 N-[24-氧代-3α-(三甲基硅氧基)-5β-胆安-24-基]甘氨酸甲酯 0.51 10 20.96 636 739 24, 25-二羟基维生素D3 / 24R, 25-二羟胆钙化醇 1.11 11 21.16 609 633 17-乙酰氧基-4,4,10,13-四甲基-7-氧代-2,3,4,7,8,9,10,11,12,13,14,15,16,17-十四氢-1H-环戊烷(a)菲-3-基,乙酸 0.61 12 21.38 777 915 隐青霉酸甲酯 / 山莨菪碱酸甲酯 /海松酸甲酯 4.62 13 21.45 626 636 3-羟基-2,5,5,8a-四甲基-1,4,4a,5,6,7,8,8a-八氢萘-1-羧酸,2-三甲基硅乙基酯 31.90 14 21.79 645 662 3,11,18-三乙酰氧基-3,19:14,15-二环氧孕烷-20-酮 0.77 15 21.87 625 765 1,1,3,3,5,5,7,7,9,9,11,11,13,13,15,15-十六甲基八硅氧烷 1.50 16 22.09 841 889 脱氢枞酸甲酯 8.41 17 22.29 676 788 1,1,3,3,5,5,7,7,9,9,11,11,13,13-十四甲基七硅氧烷 1.30 -
[1] 中国科学院中国植物志编辑委员会. 中国植物志: 第七卷[M]. 北京: 科学出版社, 1978. [2] 江苏新医学院. 中药大辞典(上册)[M]. 上海: 上海科学技术出版社, 1995. [3] 刘东彦, 石晓峰. 药用松针的研究进展[J]. 中药材, 2012, 35(10):1701-1705. [4] MITSUYOSHI YATAGAI, YONG HONG. Chemical composition of the essential oil of Pinusmassoniana Lamb[J]. JE OR,1997,9(4):485-487. [5] SHEN Z B, THEANDER O. Flavonoid glycosides from needles of Pinusmassoniana[J]. Phytochemistry,1985,24(1):155-158. doi: 10.1016/S0031-9422(00)80826-2 [6] 肖靖萍, 任宇红. 松针抑菌作用的研究[J]. 食品科学, 1994, 15(2):52. [7] 杨天明, 夏德超, 朱景申. 松针的研究进展[J]. 中国药师, 2002, 5(12):748-749. doi: 10.3969/j.issn.1008-049X.2002.12.025 [8] 张万里, 乔润香, 尹飞, 等. 13种植物提取物对5种果蔬病原真菌的抑菌活性[J]. 华南农业大学学报, 2009, 30(2):40-43. doi: 10.3969/j.issn.1001-411X.2009.02.011 [9] 赵桂芝, 寿旦, 俞忠明, 等. 松针提取物的药理学研究进展[J]. 现代医院, 2010, 10(10):14-16. doi: 10.3969/j.issn.1671-332X.2010.10.005 [10] 周文美, 程兰香, 赵辰路, 等. 马尾松松针中莽草酸的提取工艺研究[J]. 江苏农业科学, 2013, 41(11):314-316. doi: 10.3969/j.issn.1002-1302.2013.11.122 [11] 王晓梅, 张忠山, 吴酬飞, 等. 马尾松松针多酚的提取及其抗氧化活性[J]. 湖州师范学院学报, 2018, 40(4):30-34. doi: 10.3969/j.issn.1009-1734.2018.04.007 [12] 高治平, 刘刚, 刘玉玲, 等. 马尾松松针儿茶素提取工艺研究[J]. 应用化工, 2011, 40(3):420-421, 424. doi: 10.3969/j.issn.1671-3206.2011.03.014 [13] 冯卫生, 王彦志, 郑晓珂, 等. 马尾松松针中化学成分的分离与结构鉴定[J]. 药学学报, 2004, 39(3):190-193. doi: 10.3321/j.issn:0513-4870.2004.03.008 [14] 郑光耀, 宋强, 周维纯, 等. 马尾松松针甾醇的精制及气相色谱-质谱分析[J]. 林产化学与工业, 2009, 29(S1):210-212. [15] 毕跃峰, 郑晓珂, 刘宏民, 等. 马尾松松针化学成分的研究[J]. 药学学报, 2001, 36(11):832-835. doi: 10.3321/j.issn:0513-4870.2001.11.007 [16] 申玲, 姜远英, 曹永兵. 植物成分协同抗真菌作用的研究进展[J]. 中国真菌学杂志, 2013, 8(1):55-60. doi: 10.3969/j.issn.1673-3827.2013.01.014 [17] 董怀怀, 王元花, 廖泽彬, 等. 芒果苷协同氟康唑抗耐药白念珠菌作用研究[J]. 中国真菌学杂志, 2017, 12(2):78-82, 85. doi: 10.3969/j.issn.1673-3827.2017.02.004 [18] 郝雨濛, 蔡瞻, 倪廷峻弘, 等. 新型协同氟康唑抗耐药白念珠菌化合物的设计合成及活性研究[J]. 解放军药学学报, 2018, 34(6):477-483. [19] 赵晶, 李冉, 代黎, 等. 协同氟康唑抗耐药白念珠菌化合物的设计合成及活性研究[J]. 药学实践杂志, 2016, 34(2):129-134. doi: 10.3969/j.issn.1006-0111.2016.02.009 [20] 王元花, 阎芳, 金永生. 甘草有效成分的提取及协同氟康唑抗真菌活性研究[J]. 药学服务与研究, 2017, 17(3):218-222. [21] 刘康柯, 曹小燕. 松针有效成分提取及药理活性研究进展[J]. 广州化工, 2018, 46(13):6-8. doi: 10.3969/j.issn.1001-9677.2018.13.004 [22] 曾维才, 贾利蓉. 松针提取物抑菌作用的研究[J]. 食品科学, 2009, 30(7):87-90. doi: 10.3321/j.issn:1002-6630.2009.07.020 [23] 徐丽珊, 张萍华, 张敏欢. 松针提取物的抑菌作用初探[J]. 食品科学, 2009, 30(1):38-41. doi: 10.3321/j.issn:1002-6630.2009.01.008 [24] 刘文朵, 于新, 刘淑宇, 等. 马尾松针系统溶剂提取物的抑菌活性比较研究[J]. 中国食品学报, 2013, 13(9):133-138. [25] 张卫丽. 马尾松松针有效成分的提取及药理活性研究[D]. 广州: 广东工业大学, 2013. [26] 胡文杰, 李阁, 李冠喜. 马尾松松针挥发油化学成分及抗氧化活性研究[J]. 中国粮油学报, 2018, 33(12):42-48. doi: 10.3969/j.issn.1003-0174.2018.12.008 [27] 张扬, 章建民, 马相锋, 等. 不同采集时间对马尾松针中主要成分的影响[J]. 中华中医药杂志, 2013, 28(2):516-519. [28] 李洪玉, 寿旦, 李亚平, 等. 不同产地马尾松针挥发油的GC-MS分析[J]. 中华中医药学刊, 2011, 29(1):78-81. [29] 郝强, 哈成勇. 南方马尾松松针挥发油成分的气相色谱/质谱分析[J]. 分析化学, 2000, 28(3):300-302. doi: 10.3321/j.issn:0253-3820.2000.03.009 [30] 张晓月, 杨晓芳, 肖培云, 等. 超临界CO2萃取不同产地云南松松针挥发油及其GC-MS分析[J]. 中国实验方剂学杂志, 2020, 26(11):161-169. [31] 王焱, 叶建仁. 固相微萃取法和水蒸气蒸馏法提取马尾松枝条挥发物的比较[J]. 南京林业大学学报(自然科学版), 2007, 31(1):78-80. [32] 钱珊, 高成, 马兴梅, 等. 松香酸及其衍生物的生物活性研究进展[J]. 西华大学学报(自然科学版), 2020, 39(6):108-114. doi: 10.12198/j.issn.1673-159X.3358 [33] 罗云龙, 沈明贵, 王丹, 等. 脱氢枞酸及其衍生物生物活性的研究进展[J]. 化学通报, 2018, 81(2):122-128. [34] XIN Z Y, LU Y L, XING X L, et al. Synthesis of (−)-agathic acid and (−)-copalic acid from andrographolide via a regioselective Barton-McCombiereaction[J]. Tetrahedron,2016,72(4):555-562. [35] ZHOU Z, WANG X, ZHOU T T. Synthesis and antibacterial activity of benzenesulfonylhydrazone derivatives of methyl dehydroabietate[J]. Russ J Gen Chem,2019,89(4):819-823. [36] BURČOVÁ Z, KREPS F, GREIFOVÁ M, et al. Antibacterial and antifungal activity of phytosterols and methyl dehydroabietate of Norway spruce bark extracts[J]. J Biotechnol,2018,282:18-24. doi: 10.1016/j.jbiotec.2018.06.340 -





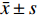
 下载:
下载:

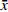
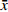

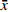

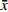
 下载:
下载: