-
恩施巴戟,也叫湖北巴戟、鄂西巴戟,系茜草科虎刺属植物四川虎刺(Damnacanthus officinarum Huang)的干燥根,它与茜草科巴戟天属的南药巴戟天(Morinda officinalis How)在成分和功效上有诸多相似之处[1-4],在湖北恩施地区常被作为巴戟天的替代品用于临床[5],并作为土家族药材被收载进《湖北省中药材质量标准》(2009年版)[6]。由于产地偏僻、资源贫乏等原因[7],使得恩施巴戟的药用价值没有得到应有的重视和合理的开发,应用范围十分有限,相关研究所见甚少。为了更好地开发和利用恩施巴戟的药用价值,本实验研究了恩施巴戟环烯醚萜苷类成分的最佳提取条件,并对其体外抗氧化活性进行初步探讨。
-
LC-20A 高效液相色谱仪;UV-1800紫外-可见分光光度计;BS 224 S型万分之一天平;CPA225D型十万分之一天平;HH-S型水浴锅。
-
恩施巴戟采于湖北省恩施市,经本课题组阮金兰教授鉴定为茜草科虎刺属植物四川虎刺(Damnacanthus officinarus Huang)的根;水晶兰苷对照品(批号:111870-201303)购自中国食品药品检定研究院;DPPH(1, 1-二苯基-2-三硝基苯肼,批号:W30O8E46572)购自源叶生物;甲醇、磷酸为色谱纯,水为超纯水,其他试剂均为分析纯。
-
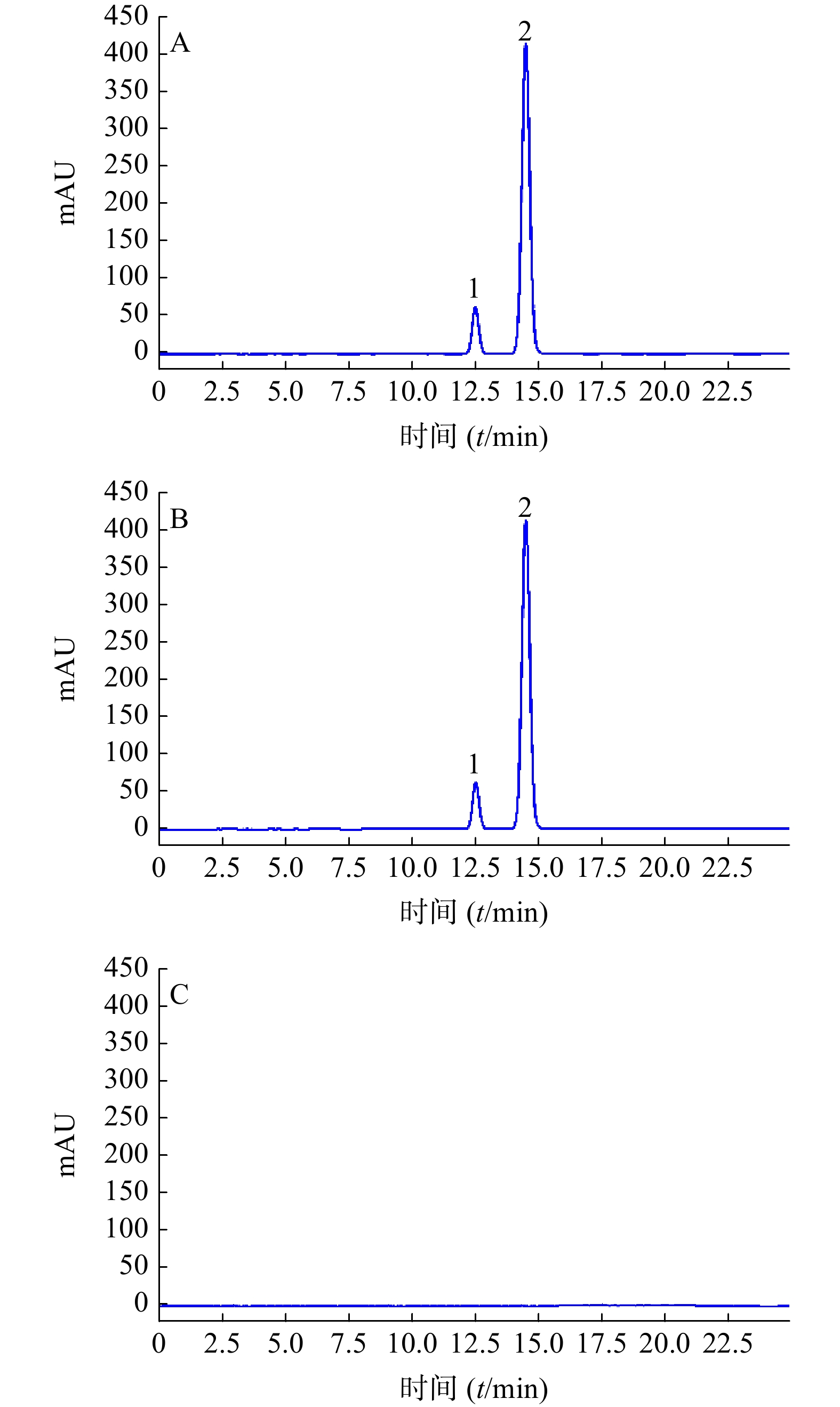
色谱柱:Ultimate LP-C18(250 mm×4.6 mm,5 μm);流动相:甲醇−0.1%磷酸水溶液(5:95);检测波长:231 nm;流速1 ml/min;柱温:25 ℃;进样量:5 μl。在上述条件下, 供试品溶液中水晶兰苷色谱峰与其他峰分离良好, 分离度大于1.5, 峰形对称, 保留时间约为8.5 min。理论板数按水晶兰苷峰计不低于3 000。
-
精密称取水晶兰苷对照品9.40 mg,加水定容至10 ml,配制成0.940 mg/ml的水晶兰苷对照品储备液。
-
取恩施巴戟药材粗粉10.0 g,精密称定,用6倍量60%的乙醇浸泡过夜后,80 ℃加热回流提取1 h,放冷过滤,滤液减压浓缩后60 ℃真空干燥至恒重。浸膏以水定容至50 ml,从中取出1 ml以水稀释至25 ml,即得。
-
精密吸取“2.1.2”项中对照品储备液100、200、300、400、500 μl分别加水稀释至1 ml,配成系列对照品溶液,按“2.1.1”项下色谱条件进样5 μl,记录对照品的峰面积。以峰面积(Y)为纵坐标,水晶兰苷的质量浓度(X,mg/ml)为横坐标,进行线性拟合,得回归方程为Y=5×106X+11 555,r=1.000 0,水晶兰苷在0.089 6~0.447 9 mg/ml范围内呈良好线性关系。
-
取同一对照品溶液按上述色谱条件连续进样6次,测定水晶兰苷峰面积,计算得峰面积RSD为0.65%,表明仪器的精密度良好。
-
精密称取同一恩施巴戟药材粗粉6份,按“2.1.3”项下制备供试品溶液,测得水晶兰苷峰面积,RSD为1.54%,表明该方法重复性良好。
-
取同一供试品溶液,室温放置,分别在 0、2、4、8、12、24 h 后测定峰面积,RSD为0.33%,结果表明样品溶液在24 h内稳定。
-
精密吸取已知含量的供试品溶液6份,分别与已知浓度的水晶兰苷对照品溶液等体积混合,测定混合后水晶兰苷的峰面积并计算平均回收率为100.29%,RSD为0.66%。
-
本试验采用常用的加热回流提取法,结合L9(33)正交试验表,优选提取工艺。选择乙醇体积分数(A)、溶剂倍量(B)、提取时间(C)为考察因素,每个因素选取 3 个水平,以浸膏得率、水晶兰苷质量分数的综合评分为评价指标,权重系数分别为 0.3、0.7,综合评分=浸膏得率/浸膏得率最大值×30% +水晶兰苷质量分数/水晶兰苷质量分数最大值×70%。药材取样量及提取液的处理同“2.1.3”项。具体试验方案见表1,正交试验设计及结果见表2,方差分析见表3。
表 1 因素水平表
水平 因素 A(%) B(倍) C(h) 1 60 6 1 2 70 8 2 3 80 10 3 表 2 正交试验设计及结果
试验
序号A B C 浸膏得率
(%)水晶兰苷含量
(%)综合
评分1 1 1 1 6.98 1.650 0.895 2 1 2 2 7.59 1.854 0.996 3 1 3 3 7.70 1.768 0.968 4 2 1 2 7.21 1.761 0.946 5 2 2 3 6.07 1.655 0.861 6 2 3 1 6.70 1.749 0.922 7 3 1 3 5.88 1.614 0.838 8 3 2 1 5.59 1.401 0.747 9 3 3 2 5.92 1.620 0.842 K1 2.858 2.679 2.563 K2 2.728 2.603 2.784 K3 2.427 2.731 2.677 R 0.431 0.128 0.220 表 3 方差分析结果
方差来源 离均差平方和 自由度 方差 F P A 0.016 3 2 0.032 6 9.398 2 <0.05 B 0.001 4 2 0.002 8 0.797 7 >0.05 C 0.004 0 2 0.008 1 2.341 8 >0.05 误差 0.001 7 4 注:F0.01(2,4)=18.00,F0.05(2,4)=6.94 由直观分析可知,各因素对恩施巴戟环烯醚萜苷类成分提取效果的影响大小排序为A>C>B。方差分析中发现极差最小的B因素的离均差平方和小于误差效应,故将其合并到误差效应中,用合并后的误差效应做F检验,自由度变大,灵敏度更高。分析结果显示,A因素的影响具有显著性差异,因素B和C则无显著性影响,结合生产成本等,确定最佳提取工艺为A1B1C2,即6倍量的60%乙醇回流提取2 h。
称取3份恩施巴戟药材粗粉,按所得最优工艺条件进行验证试验,结果浸膏得率平均值为6.93%,RSD为1.31%,水晶兰苷得率平均值为1.872%,RSD为1.06%。说明该工艺稳定可行,具有较好的提取效果。
-
恩施巴戟提取液减压浓缩后,与硅藻土均匀拌样,分别用乙酸乙酯、正丁醇、甲醇进行固液萃取得到3个不同极性部位,减压浓缩后得到乙酸乙酯部位(F1)、正丁醇部位(F2)、甲醇部位(F3)以及总膏(E)共4个样品。称取适量样品溶于70%的乙醇得到一定浓度的样品溶液用于后续实验。抗氧化试验均以抗坏血酸Vc作为阳性对照。
-
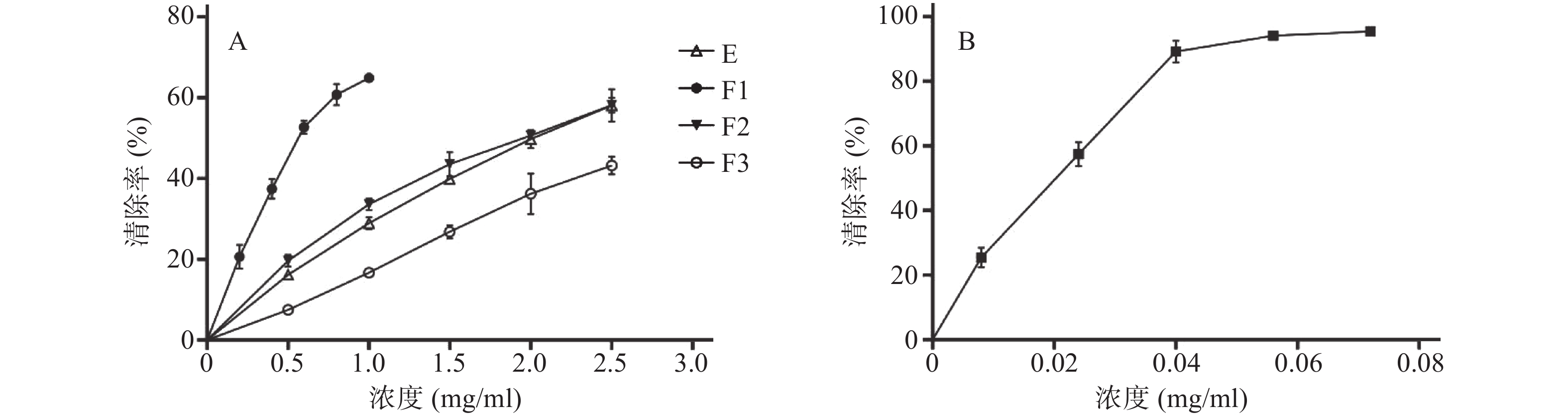
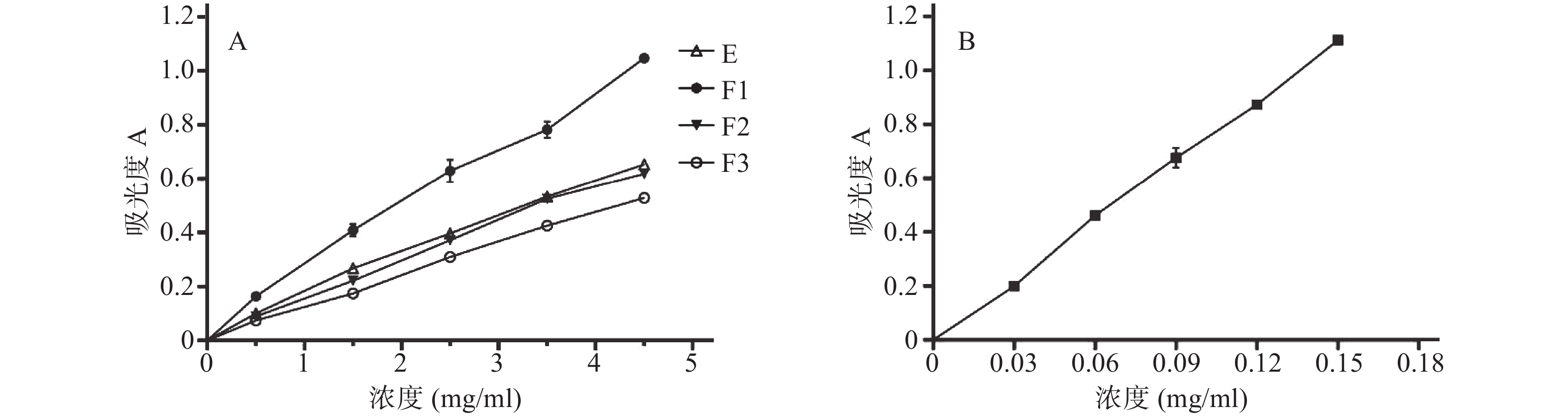
参照文献[13]方法,于700 nm处测定吸光度值,吸光度越高,说明还原能力越强,结果如图1。由图1可知,恩施巴戟不同极性的提取物均有不同程度的还原能力,且呈明显的量效关系。以吸光度为0.5时的样品浓度为EC50,E、F1、F2、F3的EC50分别为3.299、2.003、3.493、4.205 mg/ml,抗坏血酸的EC50为0.06792 mg/ml,即各极性提取物的还原能力大小顺序为F1>E≈F2>F3,结果表明乙酸乙酯部位的还原能力最强。
-
参照文献[13-14]方法,测定恩施巴戟对DPPH自由基的清除能力,结果如图2。由图2可知恩施巴戟不同极性的提取物都对DPPH自由基有一定的清除能力,且呈一定的量效关系。以清除率为50%的样品浓度为EC50,E,F1、F2、F3的EC50分别为2.045、0.648 5、1.971、2.812 mg/ml,抗坏血酸的EC50为0.019 79 mg/ml,可见恩施巴戟不同极性提取物对DPPH清除能力的大小顺序为F1>F2≈E>F3,即乙酸乙酯部位对DPPH有最佳清除效果。
-
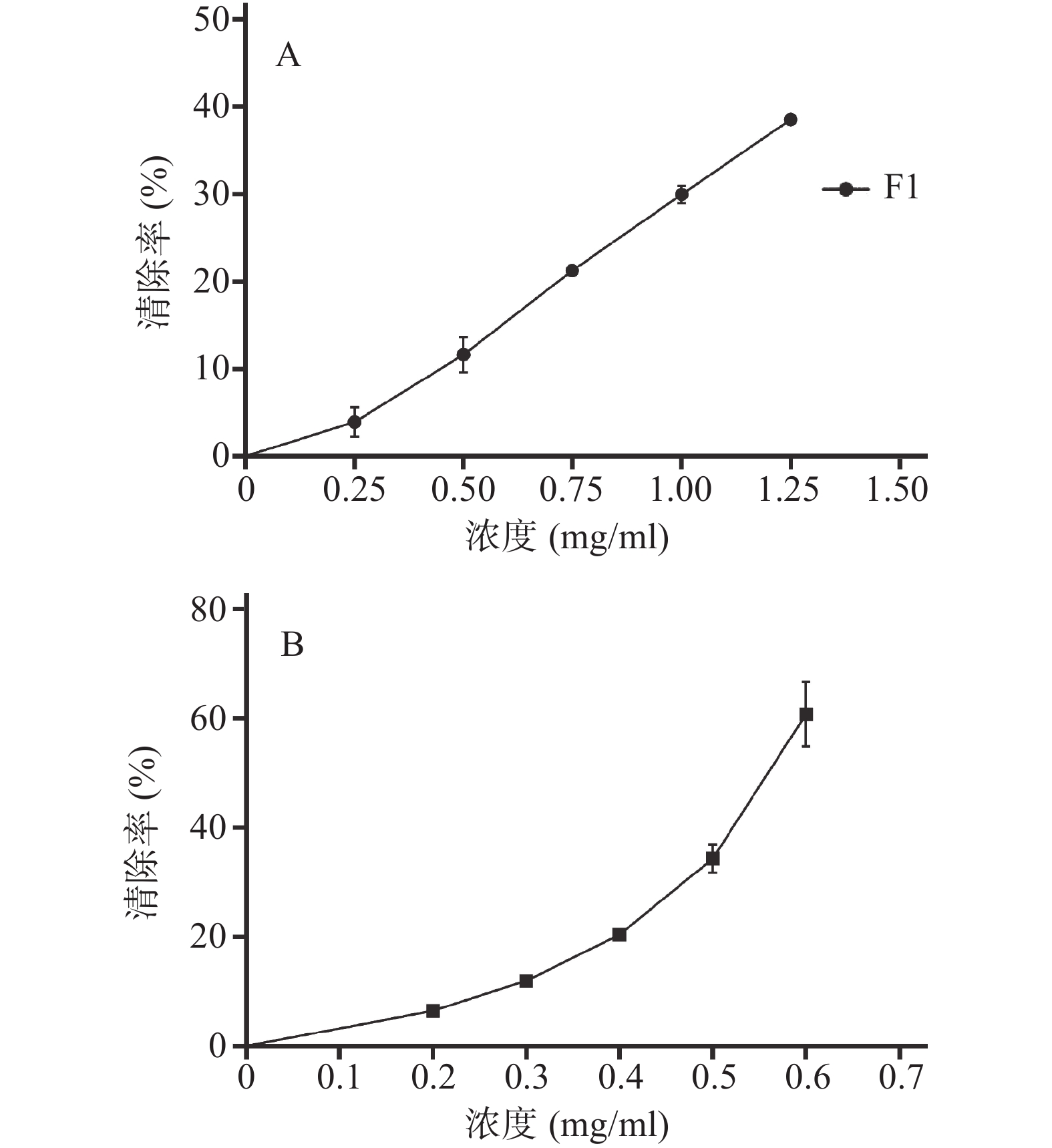
参照文献[15-16]方法,并做适当改进。取1 ml不同浓度样品溶液于试管中,分别加入0.2 mol/L磷酸盐缓冲溶液(pH7.4)、1.5 mmol/L邻菲罗啉、1.5 mmol/L硫酸亚铁溶液各1 ml,最后加入10 mmol/L的过氧化氢溶液1 ml,37 ℃水浴保温1 h,于510 nm处测定吸光度为Ax,样品以溶剂代替测得吸光度为A损伤,样品和过氧化氢均以对应溶剂代替测得吸光度为A未损伤。清除率=(Ax-A损伤)/(A未损伤-A损伤),结果如图3。由图3可知,在所选浓度范围(0.25~1.25 mg/ml)内,恩施巴戟提取物中只有F1表现出对羟自由基的清除能力,其EC50为1.576 mg/ml,阳性对照抗坏血酸的EC50为0.576 7 mg/ml,可见恩施巴戟提取物中仅乙酸乙酯部位对羟自由基有较好的清除效果。
-
环烯醚萜苷类物质为恩施巴戟的主要活性成分之一,本研究以水晶兰苷为指标性成分结合浸膏得率,采用综合评分,设计正交试验对加热回流过程中的几个关键因素进行了考察,确定了恩施巴戟环烯醚萜苷类成分的最佳提取工艺,同时建立了恩施巴戟中水晶兰苷含量测定的方法,为相关质量标准的建立奠定了基础。
体外抗氧化试验对恩施巴戟不同极性部位的总还原能力、清除DPPH自由基和清除羟自由基的能力分别进行了考察,得出了较一致的结果,即恩施巴戟具有一定的抗氧化活性,且主要活性部位在乙酸乙酯部位,为恩施巴戟的活性物质基础研究和资源开发利用提供了参考。
Study on extraction process and antioxidant activity of iridoid glycosides in Damnacanthus officinarum Huang
-
摘要:
目的 优化恩施巴戟中主要环烯醚萜苷类成分提取工艺,评价恩施巴戟体外抗氧化活性。 方法 选择经典的加热回流提取法,以乙醇体积分数、溶剂倍量、提取时间为考察因素,以浸膏得率和水晶兰苷含量的综合评分为评判指标,设计正交试验筛选最佳提取工艺条件;测定总还原能力、DPPH清除率、羟自由基清除率,检测其体外抗氧化活性。 结果 最佳提取工艺条件为6倍量的60%的乙醇加热回流2 h;恩施巴戟具有一定的抗氧化能力,乙酸乙酯部位活性最佳。 结论 优化的提取工艺稳定可行,可用于提取恩施巴戟的环烯醚萜苷类成分,该研究初步证明了恩施巴戟具有一定的抗氧化活性。 Abstract:Objective To optimize the extraction process of main iridoid glycosides in Damnacanthus officinarum Huang and evaluate the antioxidant activity of Damnacanthus officinarum Huang in vitro. Methods The classical heating-reflux extraction method was selected. The volume fraction of ethanol, the volume of solvent and extraction time were taken as the evaluation factors. The comprehensive score of extraction yield and the monotropein content were used as the evaluation indexes. An orthogonal test was designed to select the best extraction conditions. The total reducing capacity, DPPH clearance rate and hydroxyl radical scavenging rate were measured to determine its antioxidant activity in vitro. Results The optimal extraction process was the reflux with 6 times volume of 60% ethanol for 2 hours. Damnacanthus officinarum Huang has certain antioxidant capacity, and the activity of ethyl acetate part had the best effect. Conclusion The optimized extraction process is stable and feasible, which can be used for extraction of the iridoid glycosides from Damnacanthus officinarum Huang. This study has proved that Damnacanthus officinarum Huang has certain antioxidant activity. -
Key words:
- Damnacanthus officinarum Huang /
- Monotropein /
- orthogonal test /
- HPLC /
- antioxidant activity
-
氯新酮乳膏为解放军联勤保障部队第九八三医院的特色制剂,处方由酮康唑、哈西奈德和硫酸新霉素等组成,具有抗真菌、细菌感染及抗炎作用[1-2]。酮康唑为咪唑类抗真菌药,能降低真菌细胞色素 P450 的活性,妨碍真菌细胞膜合成类固醇,从而破坏真菌细胞膜结构,导致细胞内物质外泄;硫酸新霉素为氨基糖苷类抗生素;哈西奈德为皮质激素类药物,具有高效的抗炎作用。该药主要用于体癣、股癣、手足癣、皮肤念珠菌病、接触性皮炎、虫咬皮炎、神经性皮炎、湿疹及脓疱疮等皮肤病[2-4],在临床应用多年,疗效确切。为了很好的控制该药质量,我们对其质量标准进行了完善和修订,重新建立了硫酸新霉素的含量测定方法,现报道如下。
1. 仪器与试药
Agilent 1260高效液相色谱仪,OpenLAB CDS色谱工作站,ZORBAX SB-C18(4.6 mm×250 mm,5 μm)色谱柱;酮康唑对照品(含量99.0%,批号:100296-201302)、哈西奈德对照品(含量99.2%,批号:100146-201504)、新霉素标准品(652单位/mg,批号:130309-201512)均购自中国食品药品检定所;甲醇为色谱纯,水为超纯水,其余试剂均为分析纯。氯新酮乳膏[批号:20190620,20190624,20190628,规格:10 g/支,其中:酮康唑1%(g/g),哈西奈德0.1%(g/g),硫酸新霉素5 000单位/g]由本院制剂室提供。
2. 方法与结果
2.1 TLC鉴别
2.1.1 氯新酮乳膏中哈西奈德、酮康唑的TLC鉴别
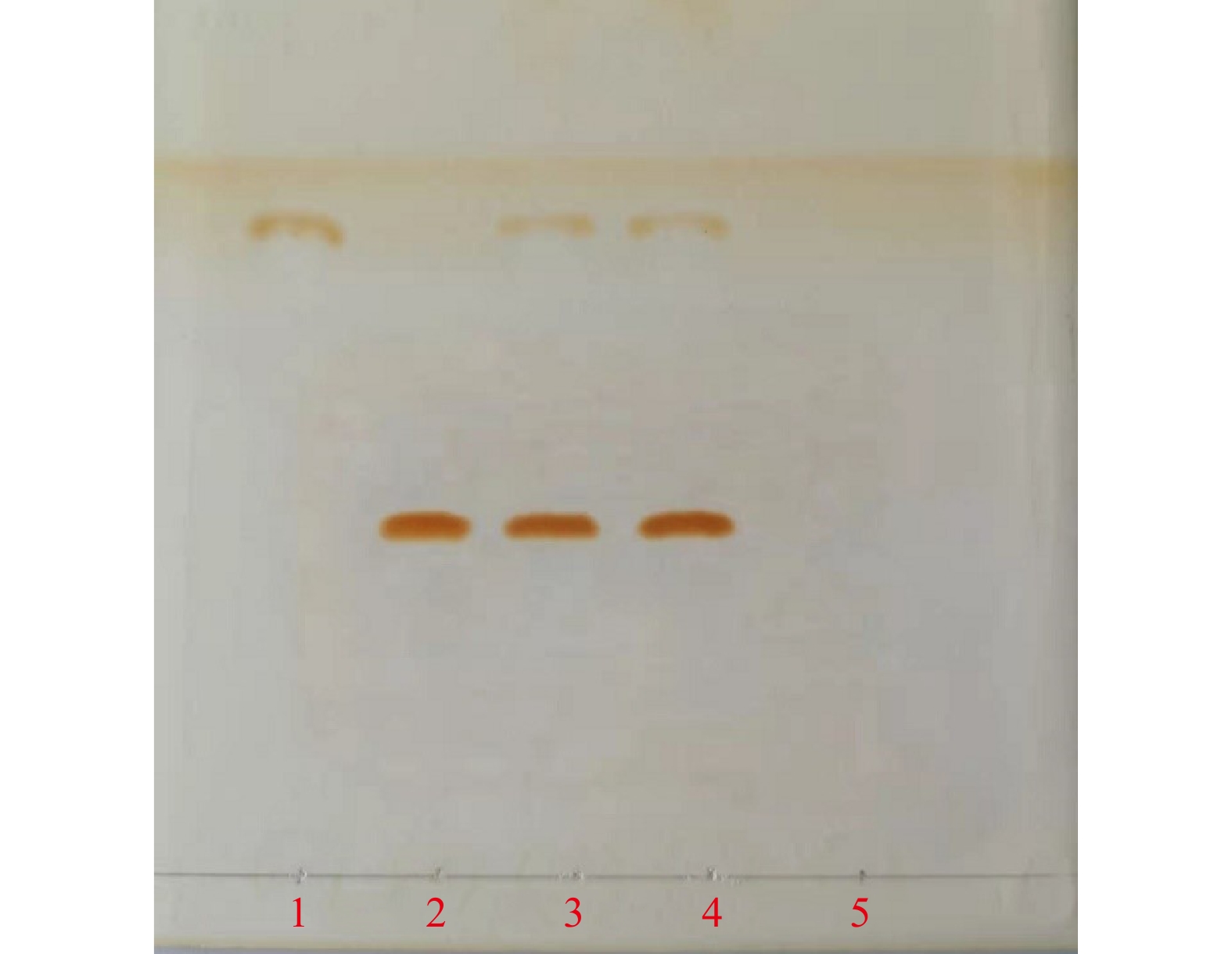
取本品1.0 g,加甲醇3 ml,搅拌2 min,分取甲醇溶液并过滤,于水浴上蒸发至干,向残渣加入甲醇0.5 ml,搅拌1 min,置离心管中,于冰水浴中冷却1 h,取出后迅速离心,取上清液作为供试品溶液。另取哈西奈德对照品1 mg、酮康唑10 mg分别加甲醇0.5 ml,振摇使溶解(必要时超声),作为对照品溶液。照薄层色谱法(《中国药典》2020版四部通则0502)试验,吸取供试品溶液、对照品溶液各10 µl,分别点于同一硅胶G薄层板上,以三氯甲烷-乙酸乙酯-甲醇(3∶1∶0.5)为展开剂,展开,以碘蒸汽显色,供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点,阴性样品未见干扰(见图1)。
2.1.2 氯新酮乳膏中硫酸新霉素的TLC鉴别
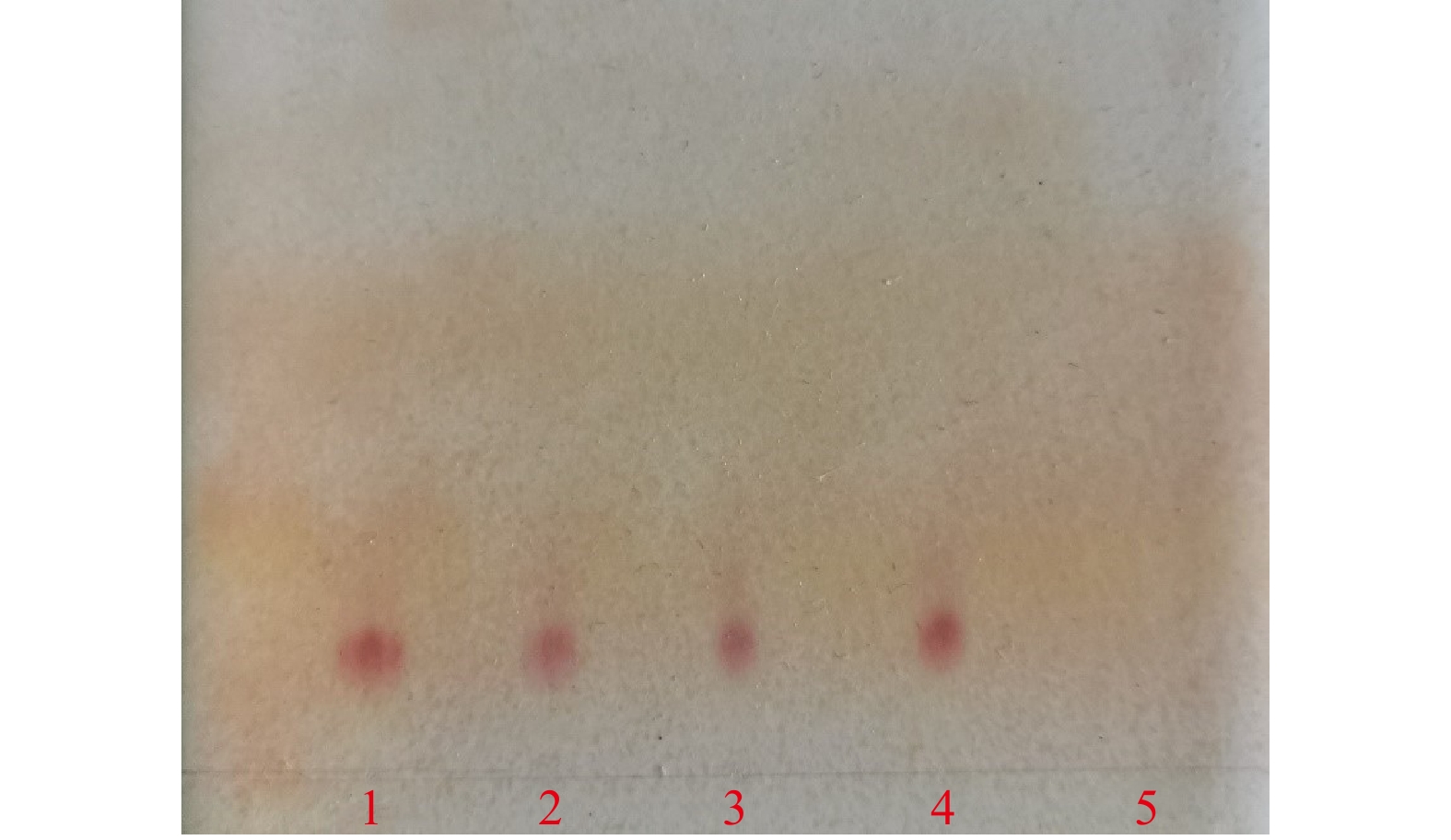
取本品约1.5 g(相当于硫酸新霉素7 500单位),置具塞离心管中,加三氯甲烷10 ml与水15 ml,强烈振摇,离心,取上层清液,作为供试品溶液。另取硫酸新霉素标准品,加水制成每1 ml约含2 mg的溶液作为标准品溶液。照薄层色谱法(《中国药典》2020版四部通则0502)试验,吸取上述两种溶液各10 µl,分别点于同一硅胶G薄层板上,以甲醇-三氯甲烷-氨水(13.5 mol/L)(60∶20∶40)为展开剂,展开,晾干,喷以1%茚三酮正丁醇溶液,在105 ℃加热2 min,供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点,阴性样品未见干扰(见图2)。
2.2 含量测定
2.2.1 溶液的配制
2.2.1.1 对照品溶液的制备
哈西奈德和酮康唑对照品溶液:精密称取酮康唑对照品49.98 mg,哈西奈德对照品10.02 mg,置25 ml量瓶中,用甲醇稀释至刻度,制备对照品溶液(酮康唑为1.999 mg/ml,哈西奈德为0.400 8 mg/ml)。
新霉素标准品溶液:精密称取新霉素标准品约250.08 mg于25 ml的量瓶中,加水适量溶解并定容至刻度,摇匀,即为新霉素储备液10.00 mg/ml,相当于6 520单位/ml。精密量取储备液0.5、1.0、2.0、3.0、5.0、10.0 ml,置25 ml量瓶中,用水稀释至刻度,摇匀,获得浓度分别为130.4、260.8、521.6、782.4、1 304、2 608单位/ml的标准品溶液。
2.2.1.2 供试品溶液的制备
哈西奈德和酮康唑供试品:取本品约2.5 g,精密称定,置50 ml量瓶中,加90%甲醇30 ml至80 ℃水浴中加热2 min,振摇使溶解,放冷至室温,加水8.3 ml,再加90%甲醇至刻度,摇匀,于冰水浴中冷却2 h,取出后迅速滤过,弃去初滤液,取续滤液,离心,放至室温,即得。
硫酸新霉素供试品:精密称取本品约7.0 g于锥形瓶中,加三氯甲烷10 ml,振摇使基质分散,加3%盐水10 ml振摇后转移至100 ml分液漏斗中,强力振摇后,静置分层,分取水层置25 ml量瓶中,同法用水提取2次,每次5 ml,合并水层,用水定容至刻度,摇匀,取适量于离心管中,4 000 r/min离心15 min,取上清液,即得。
2.2.1.3 阴性对照溶液的制备
酮康唑和哈西奈德的阴性对照溶液:按照样品制备方法制备缺酮康唑和哈西奈德乳膏,按照2.2.1.2方法制备阴性对照溶液。
硫酸新霉素的阴性对照溶液:按照样品制备方法制备缺硫酸新霉素的乳膏,按照2.2.1.2方法制备阴性对照溶液。
2.2.2 酮康唑和哈西奈德的含量测定
2.2.2.1 色谱条件
色谱条件与系统适用性试验:ZORBAX SB-C18(4.6 mm×250 mm,5 μm)色谱柱;以甲醇-磷酸盐缓冲液(pH=7.40)75∶25为流动相,检测波长235 nm,流速1.0 ml/min。
2.2.2.2 专属性试验
分别精密吸取对照品溶液、供试品溶液及阴性对照溶液各10 μl,注入高效液相色谱仪,结果见图3,供试品溶液中特征峰与对照品峰具有相同保留时间,阴性对照对应位置无干扰。
2.2.2.3 标准曲线的制备
分别精密吸取对照品溶液1、2、4、5、6、8、10和20 μl,依次进样,测定峰面积,以峰面积(Y)为纵坐标,浓度(X)为横坐标,绘制标准曲线,并进行线性回归得,酮康唑:Y=78 309X−180.73,r=0.999 9(n=8);哈西奈德: Y=18 716X−50.475,r=0.999 9(n=8)。结果表明,酮康唑在1.999~39.98 μg的范围内, 哈西奈德在0.400 8~8.016 μg的范围内呈良好的线性关系。
2.2.2.4 精密度试验
精密吸取同一混合对照品溶液10 μl,按2.2.2.1项下色谱条件连续进样6次,按峰面积计算,结果哈西奈德和酮康唑的日内精密度RSD值分别为1.1%和0.7%(n=6);连续进样5 d,记录峰面积,得哈西奈德和酮康唑的日间精密度RSD值为1.2%和0.8%(n=5),表明仪器精密度良好。
2.2.2.5 稳定性试验
取同一批样品溶液(批号:20190620),分别于0、1、2、3、4、5、7和10 h测定,记录峰面积,哈西奈德和酮康唑的RSD为2.1%和1.8%(n=6),表明供试品溶液在10 h内稳定。
2.2.2.6 重复性试验
取同一批样品6份(批号:20190620),按供试品溶液制备方法项下制备,依法测定,记录色谱图并计算含量。酮康唑和哈西奈德的平均标示百分含量分别为98.21%、103.0%,RSD为1.3%和1.1%,表明方法的重复性良好。
2.2.2.7 回收率试验
精密称取9份不含酮康唑和哈西奈德的阴性乳膏样品2.5 g,分别按照标示量的80%、100%、120%加入酮康唑(约20、25、30 mg)和哈西奈德(约2、2.5、3 mg)对照品适量,测定含量,计算样品回收率。结果酮康唑的平均回收率为97.75%,RSD为0.77%(n=9),哈西奈德的平均回收率为97.57%,RSD为0.84%(n=9),具体见表1。
表 1 氯新酮乳膏中酮康唑和哈西奈德回收率试验结果(n=9)待测物 样品量
(g)加入量
(μg/ml)测得量
(μg/ml)回收率
(%)平均值
(%)RSD
(%)酮康唑 2.501 2 399.6 395.6 99.00 97.75 0.77 2.498 2 399.6 392.2 98.15 2.483 3 399.6 391.5 97.97 2.510 6 503.1 486.1 96.62 2.508 7 503.1 489.6 97.32 2.496 4 503.1 488.8 97.16 2.501 2 591.3 578.4 97.82 2.486 9 591.3 583.2 98.63 2.993 7 591.3 574.3 97.12 哈西奈德 2.501 2 40.12 38.78 96.66 97.57 0.84 2.498 2 40.12 39.12 97.51 2.483 3 40.12 39.15 97.58 2.510 6 49.53 48.78 98.49 2.508 7 49.53 48.36 97.64 2.496 4 49.53 49.12 99.17 2.501 2 59.77 57.97 96.99 2.486 9 59.77 57.74 96.60 2.993 7 59.77 58.26 97.47 2.2.2.8 含量测定
3批样品(20190620、20190624、20190628),按供试品溶液制备方法项下制备,依法测定,记录色谱图。结果3批样品哈西奈德的标示量百分含量分别为102.2%、104.5%、99.8%(n=3),酮康唑的标示量百分含量分别为99.2%、98.6%、102.5%(n=3)。
2.2.3 硫酸新霉素的含量测定
2.2.3.1 方法专属性
用旋光法对阴性对照溶液进行测定,旋光度为0,表明样品中其他成分和辅料不干扰硫酸新霉素的测定。
2.2.3.2 线性考察
取不同浓度的标准品溶液分别测定,以旋光度(Y)为纵坐标,浓度(单位/ml)为横坐标(X),绘制标准曲线,并进行线性回归,得:Y = 8.60E-05 X,r=0.999 8(n=6)。结果表明,新霉素在130.4~2 608单位/ml的范围内呈良好的线性关系。
2.2.3.3 精密度试验
对同一标准品溶液连续测定6次,旋光度值分别为0.109 6、0.109 8、0.109 2、0.109 5、0.109 5、0.109 8,RSD为1.1%(n=6),表明方法精密度良好。
2.2.3.4 重复性试验
取同一批样品6份(批号:20190620),按供试品溶液制备方法项下制备,依法测定。计算得到硫酸新霉素平均含量为4 525.7单位/g,RSD为1.6%(n=6),表明方法重复性良好。
2.2.3.5 稳定性试验
取同一批样品溶液(批号:20190620),分别于0、0.5、1、1.5、2、4、6 h测定,计算得到旋光度的RSD为1.1%(n=7),表明在6 h内方法稳定性良好。
2.2.3.6 加样回收率
取氯新酮乳膏(批号:20190620)约3.5 g,共9份,分别加入新霉素标准品20、25、30 mg,每个浓度制备3份,按照规定制备样品溶液,以标准曲线计算得到的新霉素加标量和实际加入新霉素的量的比值作为回收率,结果见表2。测得百分回收率平均值为98.8%,RSD为2.6%。表明该方法准确率可达到要求。
表 2 新霉素回收率试验结果(n=9)序号 样品重(g) 已知量(单位) 加入量
(单位)测得量
(单位)回收率
(%)平均值
(%)RSD
(%)1 3.549 16 628.6 13 437.7 29 644.1 96.9 98.8 2.6 2 3.526 16 520.9 13 659.4 30 504.0 102.3 3 3.519 16 488.1 13 059.6 28 987.1 97.4 4 3.498 16 389.7 16 586.9 32 649.1 98.0 5 3.618 16 951.9 16 860.7 33 412.4 97.6 6 3.529 16 534.9 16 345.6 32 639.4 98.5 7 3.511 16 450.6 19 644.8 35 547.8 97.2 8 3.546 16 614.6 20 114.2 36 040.6 97.2 9 3.489 16 347.5 19 696.9 36 736.3 104.3 2.2.3.7 含量测定
3批样品,按供试品溶液制备方法项下制备,依法测定,结果见表3。
表 3 3批样品硫酸新霉素含量测定结果(n=3)批号 含量(单位/g) 标示量(%) 20190620 4 685.4 93.7 20190624 4 617.1 95.3 20190628 4 604.3 92.1 3. 讨论
3.1 酮康唑、哈西奈德和硫酸新霉素鉴别方法的建立
参照药典及文献[3-4],对处方中的酮康唑、哈西奈德和硫酸新霉素分别进行了TLC鉴别研究,对样品的前处理方法、展开剂的比例等因素分别进行了考察,确立了最终的TLC方法。结果显示,斑点显色清晰稳定,专属性强,准确性好,基质和溶剂均无干扰,可用于氯新酮乳膏鉴别项下质量控制。
3.2 酮康唑、哈西奈德含量测定方法的建立
参考药典和文献[5-9],经紫外扫描,酮康唑和哈西奈德在235 nm处均有最大吸收,故选235 nm作为检测波长。酮康唑和哈西奈德均不溶于水,溶于甲醇、氯仿等,本实验采用甲醇提取,水浴加热,冰浴冷却的方法,可有效除去乳膏剂中的杂质并提取完全。对于流动相的选择,考察了甲醇-水和甲醇-磷酸盐缓冲液为流动相,发现选用甲醇-磷酸盐缓冲液(pH=7.40)75∶25为流动相时,峰形较好,无拖尾。流动相pH值对于两峰的分离度影响较大,如果处理不好会造成峰的重叠,经研究发现甲醇-磷酸盐缓冲液(pH=7.40)为流动相时,可以达到分离效果,且峰形较好。
3.3 硫酸新霉素含量测定方法的摸索和建立
据文献报道,硫酸新霉素的测定方法主要有微生物法、免疫分析法、色谱法、分光光度法、荧光分析法、电化学分析法、共振散射色谱法和比色法等[9-15]。药典采用微生物鉴定法,该法操作繁琐,时间较长,重现性很差。硫酸新霉素在紫外区无特征吸收,采用色谱法和分光光度法时,需先进行衍生化处理,但衍生化试剂存在吸收峰,干扰严重,很难分离测定,而HPLC-ELSD法对检测器要求较高。硫酸新霉素具有旋光性,采用旋光法对硫酸新霉素含量进行测定,简单灵便。采用旋光法测定乳膏剂时,将待测药品从基质中提取出来,且保证其他药物无干扰是关键。实验研究发现,在提取过程中加入少量的氯仿溶液强力振摇破乳,使乳膏基质充分分散,有利于药物提取完全;同时,利用三种药物在水中溶解度的区别,硫酸新霉素极易溶于水,酮康唑和哈西奈德几乎不溶于水,采用水提取,4 000 r/min离心15 min,进行样品溶液的制备,可将硫酸新霉素充分分离提取。用旋光法对缺硫酸新霉素的阴性样品溶液进行测定,旋光度为0,验证了样品中的其他成分对硫酸新霉素的测定无干扰,可达到检测目的。经方法学考察,本方法操作简单、结果准确、重复性好、专属性强,可作为氯新酮乳膏中硫酸新霉素的质量控制方法。分别对3批样品的含量进行了测定,3批样品均能达到要求,但含量相对偏低,考虑可能因素是提取过程造成部分损失,以及硫酸新霉素的稳定性等因素造成,需要我们进一步考察研究。
-
表 1 因素水平表
水平 因素 A(%) B(倍) C(h) 1 60 6 1 2 70 8 2 3 80 10 3 表 2 正交试验设计及结果
试验
序号A B C 浸膏得率
(%)水晶兰苷含量
(%)综合
评分1 1 1 1 6.98 1.650 0.895 2 1 2 2 7.59 1.854 0.996 3 1 3 3 7.70 1.768 0.968 4 2 1 2 7.21 1.761 0.946 5 2 2 3 6.07 1.655 0.861 6 2 3 1 6.70 1.749 0.922 7 3 1 3 5.88 1.614 0.838 8 3 2 1 5.59 1.401 0.747 9 3 3 2 5.92 1.620 0.842 K1 2.858 2.679 2.563 K2 2.728 2.603 2.784 K3 2.427 2.731 2.677 R 0.431 0.128 0.220 表 3 方差分析结果
方差来源 离均差平方和 自由度 方差 F P A 0.016 3 2 0.032 6 9.398 2 <0.05 B 0.001 4 2 0.002 8 0.797 7 >0.05 C 0.004 0 2 0.008 1 2.341 8 >0.05 误差 0.001 7 4 注:F0.01(2,4)=18.00,F0.05(2,4)=6.94 -
[1] 饶鸿宇, 陈滔彬, 何彦, 等. 南药巴戟天化学成分与药理研究进展[J]. 中南药学, 2018, 16(11):1567-1574. [2] ZHANG J H, XIN H L, XU Y M, et al. Morinda officinalis How. - A comprehensive review of traditional uses, phytochemistry and pharmacology[J]. J Ethnopharmacol,2018,213:230-255. doi: 10.1016/j.jep.2017.10.028 [3] YANG X L, ZHANG P, WU J Z. Chemical constituents from the root of Damnacanthus offficinarum Huang[J]. Biochem Syst Ecol,2014,52:49-52. doi: 10.1016/j.bse.2013.12.001 [4] YANG X L, ZHANG P, WU J Z, et al. The neuroprotective and lifespan-extension activities of Damnacanthus officinarum extracts in Caenorhabditis elegans[J]. J Ethnopharmacol,2012,141(1):41-47. doi: 10.1016/j.jep.2012.01.025 [5] 杨曦亮. 湖北巴戟天抗衰老化学成分及作用机制的研究[D]. 武汉: 华中科技大学, 2012. [6] 葛月宾, 万定荣. 《湖北省中药材质量标准》拟收载部分土家族药材的成分和药理研究进展[J]. 中南民族大学学报(自然科学版), 2008, 27(4):50-55. [7] 乔智胜, 苏中武, 李承祜. 巴戟天应用的名实沿革考[J]. 广西植物, 1993, 13(3):252-256. [8] 张建花, 许月明, 何玉琼, 等. 巴戟天环烯醚萜苷类成分含量测定和提取方法的研究[J]. 药学实践杂志, 2017, 35(4):328-333. doi: 10.3969/j.issn.1006-0111.2017.04.010 [9] 赵明波, 屠鹏飞. RP-HPLC法测定鹿衔草中水晶兰苷[J]. 中草药, 2010, 41(10):1725-1726. [10] 刘东阳, 张雨晨, 刁婷婷, 等. 桂籽环烯醚萜苷的提取纯化及含量测定[J]. 湖北科技学院学报(医学版), 2018, 32(3):188-191, 180. [11] 谭朝阳, 尤昭玲. 茜草提取工艺的研究[J]. 中草药, 2004, 35(4):399-401. doi: 10.3321/j.issn:0253-2670.2004.04.017 [12] 张轲, 张东, 梁彩霞, 等. 白花蛇舌草中环烯醚萜苷类成分的提取工艺优选[J]. 中国实验方剂学杂志, 2015, 21(20):38-40. [13] 杨阳, 巫永华, 陈安徽, 等. 黄精提取物不同极性组分的体外抗氧化活性研究[J]. 食品工业, 2016, 37(4):42-45. [14] 韦献雅, 殷丽琴, 钟成, 等. DPPH法评价抗氧化活性研究进展[J]. 食品科学, 2014, 35(9):317-322. doi: 10.7506/spkx1002-6630-201409062 [15] 程艳刚, 李国艳, 谭金燕, 等. 锦鹤养心方总黄酮提取工艺优化及抗氧化活性考察[J]. 中华中医药学刊, 2018, 36(5):1157-1160. [16] 孙兰凤, 李本俊, 潘琦. 分光光度法测定羟自由基的捕捉剂比较研究[J]. 辽宁化工, 2013, 42(12):1503-1506. -





 下载:
下载:
 下载:
下载: