-
新型冠状病毒(SARS-CoV-2)感染在武汉爆发后,WHO将这一病毒导致的疾病命名为COVID-19(coronavirus disease in 2019)。近期,在已发表的COVID-19研究病例中,除呼吸系统疾病外,还表现出各种程度的肝损伤临床特征[1-2]。2020年1月30日发表的文章指出[3],在99例COVID-19患者中,有43例患者出现了不同程度的肝功能异常。目前,对COVID-19引起患者肝功能异常的原因尚不清楚。本文从COVID-19患者肝功能异常为切入点,通过查阅相关文献报道,试图分析造成肝损伤的因素及机制,对已出现肝功能异常的COVID-19患者,如何用药及开展相应的药学监护提供参考。
-
Huang等[4]发现COVID-19患者多以继发性肝损伤为主。其主要诱因与全身炎症反应、多器官功能障碍、急性呼吸窘迫综合征(ARDS)及药物相关性肝损伤等非病毒因素有关。
-
细胞因子风暴是机体受到外界刺激所呈现的高炎症反应状态,是大量表达相应的细胞因子如细胞介素、干扰素、肿瘤坏死因子等的现象[5-6]。细胞因子可控制细胞增殖、分化,调节免疫和炎症反应[7-8]。当机体受到各种因素的刺激,促炎和抗炎细胞因子的平衡紊乱,导致细胞因子风暴。
细胞因子风暴是COVID-19患者发生肝损伤的重要原因之一。SARS-CoV-2感染可激活人体免疫细胞,造成免疫细胞的过度聚集、促炎性细胞因子大量释放,进而导致多器官功能损害[9]。在近期的COVID-19患者救治中,发现随着疾病进展,大量的细胞因子(如IL-4和IL-10等)分泌[10-11],患者后期会很快启动细胞因子风暴,进入多器官功能衰竭状态。重症COVID-19患者绝大多数存在细胞因子风暴[12]。细胞因子风暴的机制还不清楚,有认为是免疫系统对新的、高致病的病原体如SARS-CoV-2产生的过激反应,使得多种细胞因子异常升高,进而导致细胞因子风暴,最终导致COVID-19及急性呼吸宭迫综合征(ARDS)[13]的发生。与此同时,全身细胞因子风暴会进一步引起全身脏器的功能障碍[14],包括肝功能的损伤。此外,患者出现ARDS时的缺氧,引发氧化应激反应,促使活性氧不断增加,激活对氧化还原敏感的转录因子,进一步启动多种促炎因子的释放继而诱发肝损伤。
-
近期有报道发现SARS-CoV-2的受体ACE2在肝细胞中低表达(2.6%),在胆管细胞中高表达[15],提示COVID-9有可能会损伤胆管细胞,并推测COVID-19患者的肝损伤可能是由于胆管细胞损伤引起的。Chai等研究发现,SARS-CoV-2可能直接与ACE2阳性胆管细胞结合,通过攻击胆管而导致肝损伤。SARS-CoV-2病毒与ACE2阳性胆管细胞结合可能引起胆汁瘀积,进一步激发炎性反应,继而诱发肝脏损伤。
-
药物性肝损伤可能是COVID-19患者肝功能异常的重要原因之一。目前常用治疗COVID-19的药物中可引起肝功能异常的药物有莫西沙星、洛匹那韦/利托那韦、阿比多尔、糖皮质激素、氯喹、藿香正气胶囊、连花清瘟胶囊、血必净以及清肺排毒汤等。Chalasani等[16]报道,莫西沙星可能引起急性重型肝炎,导致肝功能衰竭等严重后果,从而危及生命。宣自学等[17]研究了两例可疑药物性肝损伤的COVID-19轻症病例,提示抗病毒药物洛匹那韦/利托那韦、阿比多尔可引起肝功能指标异常,停药保肝治疗后,恢复正常。陈丹龙等[18]临床证实洛匹那韦对SARS-CoV-2病毒有效,但洛匹那韦/利托那韦经肝脏CYP3A4酶代谢,较易引起血清转氨酶水平升高[19]。阿比多尔也有肝损的不良反应,主要表现包括血清转氨酶增高。在COVID-19患者的发病中、后期,尤其是出现多器官脏器功能下降或衰竭时,以及有基础病的老年患者,在合并应用其他调脂、降糖、降压药物时,应用洛匹那韦/利托那韦应密切监测肝功能。若必须使用时,应合并保肝药物治疗,并且监测血药浓度。临床发现,慢性乙肝和丙肝患者应用干扰素可能导致病情恶化[20],有慢性肝病患者应慎用干扰素。另一项临床研究[21]指出,长时间服用利巴韦林治疗丙肝感染可能出现严重的药物肝毒性反应。因此,有病毒性肝炎基础病史的患者应慎用利巴韦林。糖皮质激素在COVID-19治疗中可抑制过度的细胞免疫来减少原发性肝损伤,但在肝衰竭终末期则会加速病情发展,甚至恶化[22-23],必须确保短时间应用。长期和超量使用糖皮质激素,不仅没有明显受益,反而有增加肝损伤甚至诱发多脏器损伤的风险。值得注意的是,甲泼尼龙主要经CYP3A4酶代谢,与洛匹那韦/利托那韦合用时会增加肝损的风险[24]。Ginee等[25]研究发现,氯喹可引起超敏反应进而导致肝损伤。一项研究[26]发现,氯喹在预防流感的临床试验中可引起头痛、头晕、恶心、腹泻和视物模糊等不良反应,且发生1例怀疑氯喹相关的肝炎严重不良事件。在引起肝损伤[27-32]的中药和中成药方面,藿香正气胶囊有易致肝损的成分(苍术、半夏);连花清瘟胶囊中大黄会干扰胆红素代谢途径导致黄疸,贯众和麻黄也能引起肝毒性。血必净也可引起消化系统方面的不良反应,包括肝功能异常,其肝毒性成分可能是丹参。清肺排毒汤中麻黄、泽泻、茯苓、柴胡、黄苓、姜半夏等均可引起肝损伤。
-
根据《肝脏炎症及其防治专家共识》[33],抗炎保肝药物的使用在COVID-19肝损伤患者的保肝治疗中非常重要。近日也有一种观点认为在COVID-19住院患者中预防性给予保肝药物治疗也很重要[34],具体的保肝治疗药物有以下几类。
-
代表药物有甘草酸二铵肠溶胶囊、异甘草酸镁注射液。该类药物适用于不适宜用糖皮质激素等免疫抑制剂的肝损伤患者,有轻度抑制免疫的作用,抗炎保肝,在患者机体炎症和免疫反应较重时优先使用,其药理作用机制为甘草酸类抗炎药物具有类似鸟嘌呤和胞嘧啶(GC)的非特异性抗炎作用,同时可以使肝功能有所改善[35]。该类药物主要在炎症通路发挥作用,通过抑制外源刺激引起的炎症反应,从而减少肝脏损害,改善已经受损的肝细胞功能[36-37]。在临床上,可以改善各种病因引起的肝脏炎症所导致的血清氨基转移酶升高,同时减轻肝脏的病理损害,改善受损的肝细胞功能。甘草酸类药物分为口服和静脉两种途径,两种途径作用有一定差异,当肝衰竭等严重肝功能损伤时多以静脉给药为主。
-
代表药物是多烯磷脂酰胆碱。其药理作用机制为具有肝细胞膜的天然成分多元不饱和磷脂胆碱,该成分可以恢复受损的肝细胞功能和酶的活性,同时通过调节肝脏代谢促进肝细胞的再生。另外,还可以使氧的应激及脂质的过氧化水平相应的减少,抑制肝细胞的凋亡,使炎症反应和肝纤维化水平降低,从多方面保护肝细胞的功能。
-
代表药物有谷胱甘肽、N-乙酰半胱氨酸和硫普罗宁等。其药理作用机制为谷胱甘肽参与体内三羧酸循环及糖代谢,改善肝脏的合成,可以解毒和灭活激素,并且促进胆酸的代谢,适当给予谷胱甘肽可以预防、减轻组织细胞的损伤,还具有一定的抗病毒作用。N-乙酰半胱氨酸可以作用于氧自由基,并使谷胱甘肽合成增多,解毒作用增强,维持肝细胞内膜结构的稳定,提高肝细胞内谷胱甘肽的合成。对谷胱甘肽缺失时的肝损伤,N-乙酰半胱氨酸可以起到保护肝脏的作用,同时也能维护缺血-再灌注损伤时肝脏的完整性。值得注意的是,硫普罗宁可引起发热、皮疹等不良反应,用药期间应关注患者的临床表现。
-
代表药物有水飞蓟素类和双环醇。抗氧化类药物还包括一些中药,如扶正化瘀胶囊、安络化纤丸、复方鳖甲软肝片等。水飞蓟宾主要用于毒蕈中毒的肝衰竭患者,能快速的解毒,同时,还具有抗病毒的作用。双环醇可以使脂质过氧化水平降低,减少线粒体的损伤,从而促进肝细胞合成,抑制肝细胞的凋亡。中药可以通过降低氧化应激反应和脂质过氧化水平,阻止肝脏炎性的发展、恶化。
-
代表药物有熊去氧胆酸和S腺苷蛋氨酸。熊去氧胆酸可以增加胆汁酸以及磷脂的含量,改变胆盐的成分,减轻胆汁酸的毒性,保护肝细胞膜和利胆。熊去氧胆酸的生理活性药物牛磺熊去氧胆酸是一种更安全、高效,可取代熊去氧胆酸的治疗药物。它的特点是安全性和生物利用度更高,分泌和转运更快,毒性更低,水溶性更好,对保护肝细胞更有效,但目前临床应用的证据尚不够充分。S腺苷蛋氨酸可以促进肝细胞的恢复,利于淤积胆汁的排泄,可以用于胆汁代谢障碍及淤胆型肝损伤。
-
甘草酸类抗炎药物和抗氧化类药物可以同时作用于炎症因子产生的各阶段,两种药物联合使用一方面可以减少炎症因子的产生,避免使肝损伤继续的加重;另一方面对于已经产生的炎症因子可以起到中和作用,减轻已造成的肝脏炎性损害。此外,甘草酸类、还原型谷胱甘肽等抗炎解毒药物与细胞膜保护剂联合用药也可从不同环节起到保肝作用。
COVID-19以免疫损伤为主,“炎性反应细胞浸润”是肝脏损伤的共同特征,无论何种原因所致的肝损伤均存在肝脏炎性反应[34]。因此,无论是SARS-CoV-2病毒本身所致的肝损伤,还是药物性肝损伤,抗病毒治疗的同时应进行抗炎保肝治疗。目前常用的抗炎保肝药物主要有甘草酸类抗炎药物、肝细胞膜修复保护类药物、利胆类保肝药物,如S-腺苷蛋氨酸、熊去氧胆酸等,其中甘草酸类抗炎药物是一线抗炎保肝药物,尤其是异甘草酸镁,是治疗急性药物性肝损伤的首选药物。Chen等[38]研究证明甘草酸可以与新冠病毒受体(ACE2)结合,从而抑制SARS-CoV-2病毒。当前需要密切关注COVID-19患者是否有肝功能异常,及时给予甘草酸制剂、多烯磷脂酰胆碱等保肝抗炎药物治疗。在危重症患者,根据肝功能损伤情况推荐1~2种药物即可,不建议使用过多种类保肝药物。
-
据目前研究推测,COVID-19患者出现的肝损伤可能是由于细胞因子风暴引发各器官脏器衰竭,继发的肝损伤。同时不排除SARS-CoV-2可能直接与ACE2阳性胆管细胞结合,通过攻击胆管激发炎性反应而导致肝损伤。另外,药物性的肝毒性也可引起肝损伤。本文对各种因素诱导的COVID-19患者继发性肝损伤及其相应的机制进行了初步探究,为进一步深入研究提供指引与思路。同时提示,对已出现肝损伤的COVID-19患者保肝药物治疗及其早期预防非常重要,值得临床上的进一步研究。
Causes of liver injury in patients with COVID-19 and treatment with hepatoprotective drugs
-
摘要: 新型冠状病毒(SARS-CoV-2)感染引起的新型冠状病毒肺炎(COVID-19)患者临床表现出不同程度的肝损伤。一系列研究表明细胞因子风暴、SARS-CoV-2病毒所致的胆管细胞损伤以及药物性肝毒性可以诱导继发性肝损伤,对不同因素所致的肝损伤的机制以及保肝药物治疗进行综述,以期为后续深入揭示该方面的研究提供参考支持。Abstract: COVID-19 patients infected with SARS-CoV-2 showed different degrees of liver injury. A series of studies have shown that cytokine storm, bile duct cell injury caused by SARS-CoV-2 and drug-induced hepatotoxicity can induce secondary liver injury. This article will review the mechanism of liver injury caused by different factors and the treatment of hepatoprotective drugs, in order to provide reference support for further research in this field.
-
Key words:
- SARS-CoV-2 /
- COVID-19 /
- liver injury /
- inflammation /
- cytokine storm
-
紫茶生长于非洲肯尼亚海拔1 500~2 000 m的地区,主要成分为多酚类物质。现代药理研究表明,天然植物中的多酚具有抗肿瘤[1]、抗氧化[2]、抗菌[3]、抗衰老[4]等功效。课题组前期研究发现,紫茶提取物中多酚的纯度不高,直接影响相关制剂的开发。近年来,大孔吸附树脂的应用越来越广泛,尤其是在天然药物有效成分分离和纯化方面具有显著优势[5-8]。本实验以紫茶为研究对象,探索大孔吸附树脂对紫茶总多酚的纯化工艺,以期制备出纯度较高的紫茶总多酚,为其进一步开发利用提供理论依据。
1. 仪器与试药
UV-2550型紫外分光光度计(日本岛津);AUX220型电子分析天平(精度:0.1 mg,日本岛津);HH-2数显恒温水浴锅(江苏金坛市友联仪器研究所)。KQ-500B型超声波清洗器(昆山超声仪器有限公司)。
肯尼亚紫茶(批号:20181030,火烈鸟茶叶有限公司);没食子酸对照品(批号:110831-201605,中国食品药品检定研究院);铁氰化钾(温州市化学用料厂);ADS-17、D101、D301、AB-8、X-5型大孔吸附树脂(安徽三星树脂科技有限公司);氯化铁、盐酸、乙醇等试剂(西陇科学股份有限公司),以上试剂均为分析纯,水为纯化水。5种大孔吸附树脂的物理参数详见表1。
表 1 5种型号大孔吸附树脂物理参数型号 外观 极性 粒径(l/nm) 比表面积(m2/g) 平均孔径(l/μm) ADS-17 白色不透明球状颗粒 氢键 0.3~1.25 90~150 25~30 D101 白色半透明球状颗粒 非极性 0.3~1.25 480~520 25~28 D301 浅黄色半透明球状颗粒 中极性 0.3~1.25 550~600 48~58 AB-8 白色不透明球状颗粒 弱极性 0.3~1.25 480~520 130~140 X-5 白色不透明球状颗粒 非极性 0.3~1.25 500~600 290~300 2. 方法与结果
2.1 紫茶总多酚的含量测定
2.1.1 对照品溶液的制备
精密称取干燥至恒重的没食子酸对照品28.4 mg,置于100 ml量瓶中,加纯化水溶解并稀释至刻度,摇匀制备成母液。精密吸取1 ml母液置10 ml量瓶中,加纯化水稀释至刻度,配制成浓度为28.4 μg/ml的对照品溶液,置于冰箱中2~8 ℃避光保存。
2.1.2 供试品溶液的制备
称取紫茶粉末5.0 g,置于圆底烧瓶中,加入50%乙醇500 ml,加热回流提取30 min,放冷至室温,将药液滤过除去沉淀,滤液用50%乙醇补足减失的重量并稀释至500 ml。精密吸取1 ml稀释液,置于100 ml量瓶中,加水稀释至刻度,即得。
2.1.3 线性关系及方法学考察
分别精密吸取浓度为28.4 μg/ml的没食子酸对照品溶液0.2、0.3、0.5、0.8、1.0和1.2 ml于25 ml量瓶中,依次加入0.1 mol/L FeCl3溶液1.0 ml、1%K3[Fe(CN)6]溶液2.0 ml和0.1 mol/L HCl溶液0.5 ml,用纯化水稀释至刻度,摇匀,于室温下避光放置60 min。以相应试剂为空白,在775 nm处测定吸光度。以没食子酸质量浓度(X,μg/ml)为横坐标,以吸光度(Y)为纵坐标,绘制标准曲线,得回归方程:Y=0.769 9X+0.027 3(r=0.999 7),表明没食子酸浓度在0.227~1.363 μg/ml范围内与吸光度呈良好的线性关系。方法学考察结果表明,专属性良好,平均回收率为100.28%,RSD为2.09%;精密度和重复性试验的RSD小于3%。显示本方法准确可靠。
2.2 大孔吸附树脂的预处理
取5种不同型号的大孔吸附树脂在95%乙醇中浸泡24 h,使其充分溶胀,将浸泡后的树脂装柱,用95%乙醇以5 ml/min的体积流量冲洗,直至流出液澄清,之后用2倍体积的4%盐酸溶液浸泡3 h,用纯化水以5 ml/min的体积流量冲洗至中性,再用2倍体积的5%氢氧化钠溶液浸泡3 h,用纯化水以5 ml/min的体积流量冲洗至中性,最后用95%乙醇浸泡保存,临用时以5 ml/min体积流量的纯化水冲洗至中性。
2.3 静态吸附行为考察
2.3.1 大孔吸附树脂的筛选
取预处理后的ADS-17、D101、D301、AB-8、X-5型大孔吸附树脂约1 g,精密称定,共5份,置于50 ml具塞磨口锥形瓶中。加入质量浓度为50 μg/ml(以多酚含量计)的紫茶总多酚提取液20 ml,在30 ℃水浴的条件下振荡吸附24 h。吸附结束后,滤过,取续滤液按照“2.1”项下方法测定总多酚的含量,计算各树脂在30 ℃下对紫茶总多酚的吸附量和吸附率。然后,将上述吸附饱和的大孔树脂取出,用纯化水清洗后,分别加入70%乙醇20 ml,在30 ℃水浴的条件下振荡24 h,进行静态解吸,计算其解吸率,结果见表2。计算公式如下:
表 2 不同类型大孔树脂对紫茶总多酚的静态吸附率和解吸率树脂型号 吸附量(μg/g) 吸附率(%) 解吸量(μg/g) 解吸率(%) ADS-17 554.9 68.98 459.0 82.72 D101 621.6 77.74 341.4 54.93 D301 817.4 100.00 107.4 13.14 AB-8 701.8 82.20 598.2 86.73 X-5 727.8 89.90 600.8 81.13 吸附量=(C0−C1)V1/M
吸附率=(C0−C1)/C0
解吸量= C2 V2/M
解吸率=C2 V2/[(C0−C1)V]
其中,C0、C1为吸附前和吸附后吸附液中多酚的质量浓度,C2为解吸附后多酚的质量浓度,V1和V2分别为吸附液和解吸液体积,M为大孔树脂的质量。
由表2结果可知,大孔树脂D301对紫茶总多酚具有较强的吸附效果,其吸附率达到100%,其余4种树脂的吸附率从高到低依次是X-5、AB-8、D101、ADS-17。由此可见,不同类型的树脂对紫茶总多酚的吸附性能各不相同。这可能是由于树脂的内部结构、分子极性以及多酚的溶解度等对树脂吸附多酚能力的影响。多酚由于分子中酚羟基的存在,其分子极性较低,因而在与极性较弱或者非极性的树脂进行吸附时效果更好。采用50%的乙醇进行解吸,可以看出5种树脂的解吸率差异较大,AB-8树脂的解吸效果最好,解吸率达86.73%,X-5树脂次之。综合紫茶总多酚提取液的静态吸附和解吸试验,AB-8型树脂和X-5型树脂对紫茶总多酚的吸附效果和解吸效果均较好,而AB-8型树脂价格相对低廉,从节省成本的角度考虑,优先采用AB-8型树脂对其进行纯化。
2.3.2 静态吸附和解吸曲线的绘制
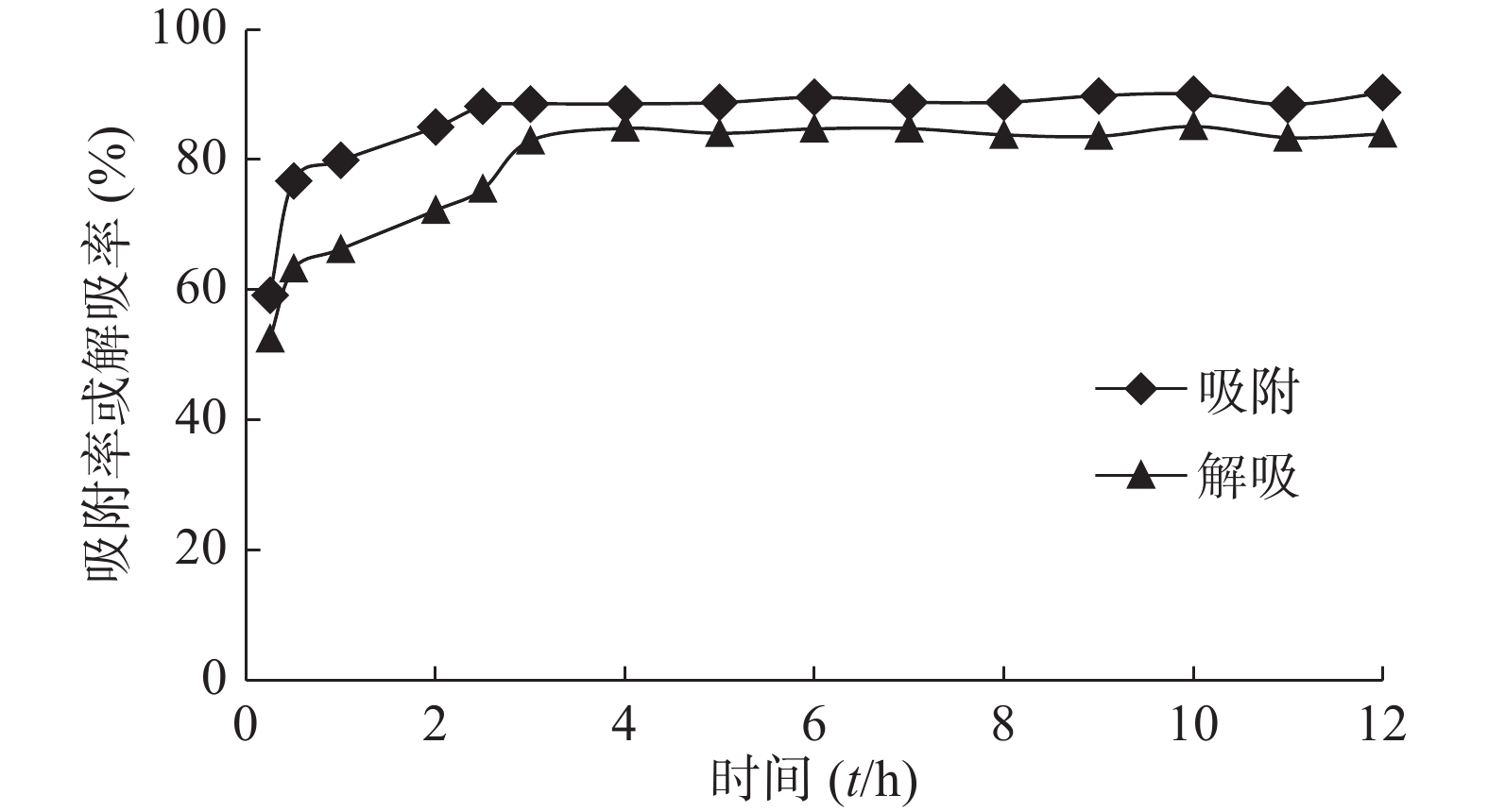
取预处理后的AB-8型大孔吸附树脂约1 g,精密称定,共15份,分别置于50 ml具塞磨口锥形瓶中,加入质量浓度为50 μg/ml的紫茶总多酚提取液20 ml,在25 ℃水浴的条件下振荡吸附12 h,每隔一段时间取出1个磨口锥形瓶,测定其总多酚的质量浓度,计算对应时间的吸附率,绘制静态吸附动力学曲线。然后,采用静态解吸试验的方法处理已吸附结束的树脂,进行静态解吸动力学试验,同样每隔一段时间取出1个磨口锥形瓶,测定其总多酚的质量浓度,计算对应时间的解吸率,绘制静态解吸动力学曲线,结果见图1。
由图1可知,在测定的时间点内,AB-8型大孔吸附树脂对紫茶总多酚的吸附量随着时间的延长而逐渐增多,经过2.5 h以后,树脂对紫茶总多酚的吸附量趋于平衡,对应的吸附率为88.27%。在0~5 h内,树脂的解吸率呈上升趋势,并在4 h达到最大值84.86%,在随后的时间里,解吸率随着时间的延长变化不大。
2.3.3 吸附液pH值对吸附率的影响
取预处理好的AB-8型大孔吸附树脂1 g,精密称定,共7份,分别置于50 ml具塞磨口锥形瓶中,分别加入质量浓度为50 μg/ml并用0.1 mol/L的盐酸和0.1 mol/L的氢氧化钠溶液调节pH值为2、3、4、5、6、7、8的紫茶总多酚提取液,在30 ℃水浴的条件下振荡吸附2.5 h,测定吸附液中紫茶总多酚的质量浓度,计算吸附率,结果见表3。
表 3 pH值对紫茶总多酚吸附率和解吸率的影响pH值 吸附量(μg/g) 吸附率(%) 2 702.4 89.79 3 712.4 90.79 4 700.3 87.77 5 706.3 89.07 6 652.5 85.71 7 641.7 83.19 8 558.4 71.54 由表3可知,吸附液pH值对紫茶总多酚的吸附率有较大影响。在pH值为2时,AB-8型大孔吸附树脂对此质量浓度下的紫茶总多酚吸附率达89.79%。因此,确定上样液的pH值为2。
2.4 动态吸附行为考察
2.4.1 泄露曲线的绘制
取预处理后的AB-8型树脂10 g,精密称定,室温下将质量浓度为250.0 μg/ml(调至pH为2)的紫茶总多酚提取液(供试品溶液用水稀释)以1.0 ml/min体积流量湿法加至树脂柱中,分段收集流出液,流出液每20 ml收集1份,测定吸光度,计算对应的总多酚含量,绘制泄露曲线。当流出液中总多酚的质量浓度达到上样液质量浓度的1/10,达到泄露点,认为此时为最佳上柱体积,结果见图2。在第2份流出液时,紫茶总多酚已经开始泄露,在第3份流出液中,总多酚的质量浓度为26.5 μg/ml,达到上样液质量浓度的1/10,因此选择上柱体积为60 ml,即3 BV。
2.4.2 上样液质量浓度的影响
取预处理好的AB-8型树脂10 g,精密称定,装入1.5 cm×20 cm的层析柱中,共5份,分别加入质量浓度为250、375、500、625、750、1 000 μg/ml的上样液(pH为2)各60 ml(3 BV),以1.0 ml/min的流速上柱,收集流出液,按“2. 1”项下方法测定总多酚含量,计算各质量浓度下的吸附率,确定最佳上样质量浓度。结果显示,各上样质量浓度下的吸附率分别为74.50%、77.56%、69.77%、60.59%、56.73%、43.61%。由此可见,上样液质量浓度对大孔吸附树脂吸附性能有显著影响,在考察范围内吸附率总体呈现出先上升后下降的趋势。当质量浓度小于375 μg/ml时,随着上样液质量浓度增加,动态吸附率呈现上升的趋势;分析原因可能是在此较低的浓度范围内,紫茶多酚有较大的机会与大孔树脂的内表面接触,进而加速扩散至树脂孔道内,形成吸附作用。而当质量浓度大于375 μg/ml时,随着质量浓度继续增加,位于孔道内的紫茶总多酚分子的扩散运动受到抑制,导致树脂对多酚的吸附能力降低。因此,选择上样液质量浓度为375 μg/ml。
2.4.3 上样液体积流量的影响
取预处理的AB-8型大孔吸附树脂10 g,精密称定,以湿法上柱法装入1.5 cm ×20 cm的层析柱中,共4份,轻敲柱壁,使柱内树脂平衡,打开下端阀门,控制体积流量使柱内纯化水流出,在液面距树脂1 cm时,将紫茶总多酚上样液(质量浓度为375 μg/ml,pH为2,上样量为3 BV)分别以1.0、2.0、3.0、4.0 ml/min的体积流量上柱,同时收集下端流出液,测定吸光度,计算吸附率,确定最佳上样体积流量。结果显示,吸附率分别为79.37%、79.78%、72.73%、64.73%,当上样体积流量为2.0 ml/min时,AB-8型大孔吸附树脂对紫茶总多酚的吸附率最大,故选择上样体积流量为2.0 ml/min。
2.4.4 径高比对动态吸附性能的影响
取预处理的AB-8型大孔吸附树脂10 g,精密称定,以湿法上柱法装入1.5 cm ×40 cm的层析柱中,分别设置径高比(柱直径与树脂填充高度比值)为1∶6、1∶9、1∶12、1∶15,将紫茶总多酚上样液(质量浓度为375 μg/ml,pH为2)分别以2.0 ml/min的体积流量上柱,对应的药液上样量分别为3、4.5、6、9 BV,收集下端流出液,测定吸光度,计算吸附率,确定最佳径高比。结果显示,吸附率分别为79.81%、78.37%、76.73%、68.54%。径高比1∶6和1∶9对吸附率影响不大。此后,在考察范围内,随着径高比值的降低,吸附率也呈现下降的趋势,可能是由于树脂层过高导致上样液穿透能力差所致。
2.4.5 洗脱剂体积分数的影响
取预处理后的AB-8型大孔吸附树脂10 g,精密称定,共5份,以湿法缓慢装入1.5 cm×20 cm的层析柱(径高比为1∶6,下同),将质量浓度为375 μg/ml上样液(调节pH为2)3 BV以2.0 ml/min的体积流量通过树脂柱,待吸附饱和后,分别用纯化水及25%、50%、75%、90%乙醇溶液各3 BV以1.0 ml/min的流速进行洗脱,收集洗脱液,测定其吸光度,计算解吸率,确定最佳洗脱剂体积分数。结果:解吸率分别为17.52%、62.96%、91.04%、81.41%、84.67%,由此可见,50%乙醇对紫茶总多酚的解吸作用最强,故选择洗脱剂的体积分数为50%。
2.4.6 洗脱剂用量的影响
取预处理后的AB-8型大孔吸附树脂10 g,精密称定,以湿法缓慢装入1.5 cm×20 cm的层析柱中,将375 μg/ml的上样液(pH为2)3 BV以2 ml/min的体积流量通过树脂柱,待吸附饱和后,用50%乙醇以1.0 ml/min的流速进行洗脱,洗脱溶剂用量分别为1、2、3、4、5 BV,收集洗脱液,测定其吸光度,计算洗脱率,确定最佳洗脱剂用量。结果:解吸率分别为54.68%、83.37%、90.29%、91.48%、91.45%,表明当50%乙醇用量在1~3 BV时,随着用量的增加,对紫茶总多酚的解吸率呈上升的趋势,随后继续增加洗脱剂的用量,解吸率不再增加,表明此时树脂上吸附的总多酚已被充分洗脱,没有必要再增加洗脱剂的用量,故确定洗脱剂的用量为4 BV。
2.4.7 洗脱剂体积流量对洗脱效果的影响
取预处理后的AB-8型大孔吸附树脂约10 g,精密称定,以湿法缓慢装入1.5 cm×20 cm的层析柱中,将375 μg/ml上样液(pH为2)3 BV以2.0 ml/min的体积流量通过树脂柱,待吸附饱和后,用50%乙醇溶液4 BV分别以1.0、2.0、4.0、6.0 ml/min的体积流量进行洗脱,计算解吸率,确定最佳体积流量。结果:对应的解吸率分别为92.47%、93.76%、91.97%、85.18%,表明紫茶总多酚的洗脱率随着洗脱体积流量的加大先升高后减小,故选择最佳洗脱体积流量为2 ml/min。
2.5 最佳工艺的验证
称取4份预处理后的大孔吸附树脂约10 g,精密称定,以湿法缓慢装入1.5 cm×20 cm层析柱中(径高比为1∶6),将紫茶提取物预先用石油醚(60~90 ℃)除去脂溶性色素,参考“2.1.2”项下方法加水稀释以制备浓度为375 μg/ml(pH为2)的紫茶总多酚溶液3 BV(总多酚质量为22.5 mg,质量分数40.2%,干膏56.0 mg),并以2 ml/min体积流量上样,待吸附饱和后,先用3 BV水去除杂质,然后用50%乙醇溶液4 BV以2 ml/min的体积流量洗脱,分别收集洗脱液,按照紫茶总多酚定量测定方法,计算总多酚洗脱量及洗脱率,再将洗脱液水浴蒸干,低温烘至恒重,计算干膏的量;精密称取干膏适量,测定总多酚的含量。结果见表4。
表 4 纯化工艺验证结果编号 加入量
(m/mg)纯化前 洗脱量
(m/mg)洗脱率
(%)纯化后 干膏量(m/mg) 质量分数(%) 干膏量(m/mg) 质量分数(%) 平均质量分数(%) RSD(%) 1 22.5 56.0 40.2 20.8 92.4 29.4 70.7 69.8 1.27 2 21.0 93.3 30.6 68.6 3 20.9 92.8 30.0 69.7 4 20.6 91.6 29.4 70.1 由纯化工艺验证结果可见,经过4次验证试验,50%乙醇洗脱条件下总多酚的平均洗脱率为92.5%,紫茶总多酚干膏量由56.0 mg减少至平均29.9 mg,质量分数从40.2%升至平均69.8%,表明建立的纯化工艺对紫茶总多酚有较好的分离、纯化效果。
3. 讨论
大孔吸附树脂是一种具有多孔立体结构和选择性吸附功能的高分子材料,目前已广泛应用于中药的活性成分如黄酮、皂苷、生物碱及多酚等成分的分离与纯化。其中,目前采用大孔树脂对多酚类成分进行纯化的有天麻总多酚[9]、白簕叶总多酚[10]、过岗龙总多酚[11]、茶梗中茶多酚[12]等,这都提示了大孔树脂精制多酚类有效成分的可行性。影响大孔树脂的分离纯化有多方面的因素,在选择合适的大孔树脂时,应综合考虑各种影响因素,如树脂的极性、比表面积以及上样液的质量浓度、洗脱液浓度等,以获得最佳的分离效果。在利用大孔树脂纯化时,应尽量滤去上样液中的沉淀,这样既能提高总多酚的纯化率,也能提高树脂的使用寿命。本研究中的样品采用50%乙醇提取后用纯化水进行稀释,当样品溶于水中时,由于多酚类物质能被大孔树脂吸附,而色素及多糖等物质不能吸附而被洗脱掉。而在改为乙醇洗脱时,树脂的吸附效果减弱,被吸附的多酚能被乙醇洗脱。
本研究通过对5种不同型号的大孔吸附树脂的吸附和解吸进行考察,确定了AB-8型大孔吸附树脂纯化紫茶总多酚的最佳工艺条件,为该产品的进一步开发奠定了基础。
-
[1] PAN F, YE T H, SUN P, et al. Time course of lung changes on chest CT during recovery from 2019 novel coronavirus (COVID-19) pneumonia[J]. Radiology,2020,295(3):200370. [2] DU Z W, WANG L, CAUCHEMEZ S, et al. Risk for transportation of 2019 Novel Coronavirus Disease from Wuhan to other cities in China[J]. Emerg Infect Dis,2020,26(5):1049-1052. doi: 10.3201/eid2605.200146 [3] CHEN N S, ZHOU M, DONG X, et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study[J]. Lancet,2020,395(10223):507-513. doi: 10.1016/S0140-6736(20)30211-7 [4] HUANG C L, WANG Y M, LI X W, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China[J]. Lancet,2020,395(10223):497-506. doi: 10.1016/S0140-6736(20)30183-5 [5] ICHIYAMA T, ISUMI H, OZAWA H, et al. Cerebrospinal fluid and serum levels of cytokines and soluble tumor necrosis factor receptor in influenza virus-associated encephalopathy[J]. Scand J Infect Dis,2003,35(1):59-61. doi: 10.1080/0036554021000026986 [6] 刘必成, 高月明. “细胞因子风暴综合征”如何识别和处理[N]. 健康报, 2020-02-20(008). [7] JENNIFER R T, MARCUS J K, CAMERON P S, et al. Into the eye of the cytokine storm[J]. Microbiol Mol Biol Rev,2012,76(1):16. doi: 10.1128/MMBR.05015-11 [8] CHOUSTERMAN B G, SWIRSKI F K, WEBER G F. Cytokine storm and Sepsis disease pathogenesis[J]. Semin Immunopathol,2017,39(5):517-528. doi: 10.1007/s00281-017-0639-8 [9] XU X W, WU X X, JIANG X G, et al. Clinical findings in a group of patients infected with the 2019 novel coronavirus (SARS-Cov-2) outside of Wuhan, China: retrospective case series[J]. BMJ,2020,368:m606. [10] 张竞文, 胡欣, 金鹏飞. 新型冠状病毒引起的细胞因子风暴及其药物治疗[J]. 中国药学杂志, 2020, 55(5):333-336. [11] 任越, 姚美村, 霍晓乾, 等. 抗新型冠状病毒方剂基于花生四烯酸代谢通路防治“细胞因子风暴”的研究[J]. 中国中药杂志, 2020, 45(6):1225-1231. [12] 何黎黎, 龚普阳, 封玥, 等. 中药在抗新型冠状病毒肺炎(COVID-19)引起的细胞因子风暴中的应用分析[J/OL]. 中草药, 2020, [2020-03-03]. http://kns.cnki.net/kcms/detail/12.1108.R.20200302.0944.004.html. [13] ZHANG Y L, JIANG C Y. Cytokine storms: the dominant hand in acute respiratory distress syndrome[J]. Life Sci(生命科学),2015,27(5):554-557. [14] SHINYA K, GAO Y W, CILLONIZ C, et al. Integrated clinical, pathologic, virologic, and transcriptomic analysis of H5N1 influenza virus-induced viral pneumonia in the rhesus macaque[J]. J Virol,2012,86(11):6055-6066. doi: 10.1128/JVI.00365-12 [15] CHAI X, HU L, ZHANG Y, et al. Specific ACE2 expression in cholangiocytes may cause liver damage after 2019-nCoV infection[J]. bioRxiv, (2020-02-15)[2020-01-13]. http://www.instrument.com.cn/download/shtml/932534.shtml. [16] CHALASANI N, BONKOVSKY H L, FONTANA R, et al. Features and outcomes of 899 patients with drug-induced liver injury: the DILIN prospective study[J]. Gastroenterology,2015,148(7):1340-1352. doi: 10.1053/j.gastro.2015.03.006 [17] 宣自学, 张国兵, 叶晓兰, 等. 新型冠状病毒肺炎患者肝损的原因分析[J]. 中国药理学通报, 2020, 36(4):591-592. doi: 10.3969/j.issn.1001-1978.2020.04.026 [18] 陈丹龙, 杨芳, 罗志英, 等. 全球抗新型冠状病毒药物研发现状和瓶颈[J]. 中国药理学通报, 2020, 36(4):459-469. doi: 10.3969/j.issn.1001-1978.2020.04.003 [19] LAN N T N, THU N T N, BARRAIL-TRAN A, et al. Randomised pharmacokinetic trial of rifabutin with lopinavir/ritonavir-antiretroviral therapy in patients with HIV-associated tuberculosis in Vietnam[J]. PLoS One,2014,9(1):e84866. doi: 10.1371/journal.pone.0084866 [20] 杨瑾, 莫国栋, 卢志军, 等. 我院107例干扰素注射液不良反应特点分析[J]. 今日药学, 2017, 27(3):199-201. doi: 10.12048/j.issn.1674-229X.2017.03.016 [21] DYSON J K, HUTCHINSON J, HARRISON L, et al. Liver toxicity associated with sofosbuvir, an NS5A inhibitor and ribavirin use[J]. J Hepatol,2016,64(1):234-238. doi: 10.1016/j.jhep.2015.07.041 [22] 聂青和. 糖皮质激素在肝衰竭治疗中的地位[J]. 中华肝脏病杂志, 2012, 20(6):414-415. [23] 聂青和. 肝衰竭综合治疗进展[J]. 实用肝脏病杂志, 2013, 16(1):17-19. [24] COTTIN J, PIERRE S, PIZZOGLIO V, et al. Methylprednisolone-related liver injury: a descriptive study using the French pharmacovigilance database[J]. Clin Res Hepatol Gastroenterol,2020-pii:S2210-7401(19)30270-0. [25] GALVAÑ V G, OLTRA M R, RUEDA D, et al. Severe acute hepatitis related to hydroxychloroquine in a woman with mixed connective tissue disease[J]. Clin Rheumatol,2007,26(6):971-972. doi: 10.1007/s10067-006-0218-1 [26] PATON N I, LEE L, XU Y, et al. Chloroquine for influenza prevention: a randomised, double-blind, placebo controlled trial[J]. Lancet Infect Dis,2011,11(9):677-683. doi: 10.1016/S1473-3099(11)70065-2 [27] 孙蓉, 黄伟, 李素君, 等. 关于“柴胡劫肝阴”的源流发展与初步实验研究[J]. 中国药物警戒, 2009, 6(10):577-580. doi: 10.3969/j.issn.1672-8629.2009.10.001 [28] 孙蓉, 杨倩. 柴胡挥发油对大鼠肝能量代谢的影响[J]. 中国药理学与毒学杂志, 2011, 25(3):310-313. [29] 孙蓉, 吕丽莉, 王丽, 等. 柴胡致大鼠肝毒性氧化损伤机制研究[J]. 中药药理与临床, 2009, 25(1):49-51. [30] 张丽美, 鲍志烨, 黄幼异, 等. 半夏水提组分对小鼠肝毒性“量-时-毒”关系研究[J]. 中国药物警戒, 2011, 8(1):11-15. doi: 10.3969/j.issn.1672-8629.2011.01.003 [31] 黄伟, 张作平, 黄幼异, 等. 提取工艺对半夏急性毒性与相关物质基础含量的影响研究[J]. 中国药物警戒, 2010, 7(11):656-660. doi: 10.3969/j.issn.1672-8629.2010.11.006 [32] GEORGIOU M, SIANIDOU L, HATZIS T, et al. Hepatotoxicity due to Atractylis gummifera-L[J]. J Toxicol Clin Toxicol,1988,26(7):487-493. doi: 10.3109/15563658809038564 [33] 中华医学感染病学分会. 肝脏炎症及其防治专家共识[J]. 中国实用内科杂志, 2014, 7(1):4-12. [34] 褚扬, 周王谊, 吴江, 等. 新型冠状病毒肺炎治疗中应关注肝损伤及防治中药概述[J/OL]. 世界中医药. http://kns.cnki.net/kcms/detail/11.5529.R.20200221.0904.006.html. [35] 缪晓辉. 抗结核化疗诱导药物性肝损伤的护肝治疗[J]. 中华结核和呼吸杂志, 2013, 36:729-731. doi: 10.3760/cma.j.issn.1001-0939.2013.10.006 [36] WANG C Y, KAO T C, LO W H, et al. Glycyrrhizic acid and 18β-glycyrrhetinic acid modulate lipopolysaccharide-induced inflammatory response by suppression of NF-κB through PI3K p110δ and p110γ inhibitions[J]. J Agric Food Chem,2011,59(14):7726-7733. doi: 10.1021/jf2013265 [37] SCHROFELBAUER B, RAFFETSEDER J, HAUNER M, et al. Glycyrrhizin, the main active compound in liquorice, attenuates pro-inflammatory responses by interfering with membrane-dependent receptor signaling[J]. Biochem J,2009,421(3):473-482. doi: 10.1042/BJ20082416 [38] CHEN H S, DU Q H. Potential natural compounds for preventing SARS-CoV-2 (2019-nCoV) infection[EB/OL]. 2020. DOI: 10.20944/preprints202001.0358.v3 -

 点击查看大图
点击查看大图
计量
- 文章访问数: 6702
- HTML全文浏览量: 3724
- PDF下载量: 57
- 被引次数: 0




 下载:
下载:


 下载:
下载:
