-
新型冠状病毒(SARS-CoV-2)感染在武汉爆发后,WHO将这一病毒导致的疾病命名为COVID-19(coronavirus disease in 2019)。近期,在已发表的COVID-19研究病例中,除呼吸系统疾病外,还表现出各种程度的肝损伤临床特征[1-2]。2020年1月30日发表的文章指出[3],在99例COVID-19患者中,有43例患者出现了不同程度的肝功能异常。目前,对COVID-19引起患者肝功能异常的原因尚不清楚。本文从COVID-19患者肝功能异常为切入点,通过查阅相关文献报道,试图分析造成肝损伤的因素及机制,对已出现肝功能异常的COVID-19患者,如何用药及开展相应的药学监护提供参考。
-
Huang等[4]发现COVID-19患者多以继发性肝损伤为主。其主要诱因与全身炎症反应、多器官功能障碍、急性呼吸窘迫综合征(ARDS)及药物相关性肝损伤等非病毒因素有关。
-
细胞因子风暴是机体受到外界刺激所呈现的高炎症反应状态,是大量表达相应的细胞因子如细胞介素、干扰素、肿瘤坏死因子等的现象[5-6]。细胞因子可控制细胞增殖、分化,调节免疫和炎症反应[7-8]。当机体受到各种因素的刺激,促炎和抗炎细胞因子的平衡紊乱,导致细胞因子风暴。
细胞因子风暴是COVID-19患者发生肝损伤的重要原因之一。SARS-CoV-2感染可激活人体免疫细胞,造成免疫细胞的过度聚集、促炎性细胞因子大量释放,进而导致多器官功能损害[9]。在近期的COVID-19患者救治中,发现随着疾病进展,大量的细胞因子(如IL-4和IL-10等)分泌[10-11],患者后期会很快启动细胞因子风暴,进入多器官功能衰竭状态。重症COVID-19患者绝大多数存在细胞因子风暴[12]。细胞因子风暴的机制还不清楚,有认为是免疫系统对新的、高致病的病原体如SARS-CoV-2产生的过激反应,使得多种细胞因子异常升高,进而导致细胞因子风暴,最终导致COVID-19及急性呼吸宭迫综合征(ARDS)[13]的发生。与此同时,全身细胞因子风暴会进一步引起全身脏器的功能障碍[14],包括肝功能的损伤。此外,患者出现ARDS时的缺氧,引发氧化应激反应,促使活性氧不断增加,激活对氧化还原敏感的转录因子,进一步启动多种促炎因子的释放继而诱发肝损伤。
-
近期有报道发现SARS-CoV-2的受体ACE2在肝细胞中低表达(2.6%),在胆管细胞中高表达[15],提示COVID-9有可能会损伤胆管细胞,并推测COVID-19患者的肝损伤可能是由于胆管细胞损伤引起的。Chai等研究发现,SARS-CoV-2可能直接与ACE2阳性胆管细胞结合,通过攻击胆管而导致肝损伤。SARS-CoV-2病毒与ACE2阳性胆管细胞结合可能引起胆汁瘀积,进一步激发炎性反应,继而诱发肝脏损伤。
-
药物性肝损伤可能是COVID-19患者肝功能异常的重要原因之一。目前常用治疗COVID-19的药物中可引起肝功能异常的药物有莫西沙星、洛匹那韦/利托那韦、阿比多尔、糖皮质激素、氯喹、藿香正气胶囊、连花清瘟胶囊、血必净以及清肺排毒汤等。Chalasani等[16]报道,莫西沙星可能引起急性重型肝炎,导致肝功能衰竭等严重后果,从而危及生命。宣自学等[17]研究了两例可疑药物性肝损伤的COVID-19轻症病例,提示抗病毒药物洛匹那韦/利托那韦、阿比多尔可引起肝功能指标异常,停药保肝治疗后,恢复正常。陈丹龙等[18]临床证实洛匹那韦对SARS-CoV-2病毒有效,但洛匹那韦/利托那韦经肝脏CYP3A4酶代谢,较易引起血清转氨酶水平升高[19]。阿比多尔也有肝损的不良反应,主要表现包括血清转氨酶增高。在COVID-19患者的发病中、后期,尤其是出现多器官脏器功能下降或衰竭时,以及有基础病的老年患者,在合并应用其他调脂、降糖、降压药物时,应用洛匹那韦/利托那韦应密切监测肝功能。若必须使用时,应合并保肝药物治疗,并且监测血药浓度。临床发现,慢性乙肝和丙肝患者应用干扰素可能导致病情恶化[20],有慢性肝病患者应慎用干扰素。另一项临床研究[21]指出,长时间服用利巴韦林治疗丙肝感染可能出现严重的药物肝毒性反应。因此,有病毒性肝炎基础病史的患者应慎用利巴韦林。糖皮质激素在COVID-19治疗中可抑制过度的细胞免疫来减少原发性肝损伤,但在肝衰竭终末期则会加速病情发展,甚至恶化[22-23],必须确保短时间应用。长期和超量使用糖皮质激素,不仅没有明显受益,反而有增加肝损伤甚至诱发多脏器损伤的风险。值得注意的是,甲泼尼龙主要经CYP3A4酶代谢,与洛匹那韦/利托那韦合用时会增加肝损的风险[24]。Ginee等[25]研究发现,氯喹可引起超敏反应进而导致肝损伤。一项研究[26]发现,氯喹在预防流感的临床试验中可引起头痛、头晕、恶心、腹泻和视物模糊等不良反应,且发生1例怀疑氯喹相关的肝炎严重不良事件。在引起肝损伤[27-32]的中药和中成药方面,藿香正气胶囊有易致肝损的成分(苍术、半夏);连花清瘟胶囊中大黄会干扰胆红素代谢途径导致黄疸,贯众和麻黄也能引起肝毒性。血必净也可引起消化系统方面的不良反应,包括肝功能异常,其肝毒性成分可能是丹参。清肺排毒汤中麻黄、泽泻、茯苓、柴胡、黄苓、姜半夏等均可引起肝损伤。
-
根据《肝脏炎症及其防治专家共识》[33],抗炎保肝药物的使用在COVID-19肝损伤患者的保肝治疗中非常重要。近日也有一种观点认为在COVID-19住院患者中预防性给予保肝药物治疗也很重要[34],具体的保肝治疗药物有以下几类。
-
代表药物有甘草酸二铵肠溶胶囊、异甘草酸镁注射液。该类药物适用于不适宜用糖皮质激素等免疫抑制剂的肝损伤患者,有轻度抑制免疫的作用,抗炎保肝,在患者机体炎症和免疫反应较重时优先使用,其药理作用机制为甘草酸类抗炎药物具有类似鸟嘌呤和胞嘧啶(GC)的非特异性抗炎作用,同时可以使肝功能有所改善[35]。该类药物主要在炎症通路发挥作用,通过抑制外源刺激引起的炎症反应,从而减少肝脏损害,改善已经受损的肝细胞功能[36-37]。在临床上,可以改善各种病因引起的肝脏炎症所导致的血清氨基转移酶升高,同时减轻肝脏的病理损害,改善受损的肝细胞功能。甘草酸类药物分为口服和静脉两种途径,两种途径作用有一定差异,当肝衰竭等严重肝功能损伤时多以静脉给药为主。
-
代表药物是多烯磷脂酰胆碱。其药理作用机制为具有肝细胞膜的天然成分多元不饱和磷脂胆碱,该成分可以恢复受损的肝细胞功能和酶的活性,同时通过调节肝脏代谢促进肝细胞的再生。另外,还可以使氧的应激及脂质的过氧化水平相应的减少,抑制肝细胞的凋亡,使炎症反应和肝纤维化水平降低,从多方面保护肝细胞的功能。
-
代表药物有谷胱甘肽、N-乙酰半胱氨酸和硫普罗宁等。其药理作用机制为谷胱甘肽参与体内三羧酸循环及糖代谢,改善肝脏的合成,可以解毒和灭活激素,并且促进胆酸的代谢,适当给予谷胱甘肽可以预防、减轻组织细胞的损伤,还具有一定的抗病毒作用。N-乙酰半胱氨酸可以作用于氧自由基,并使谷胱甘肽合成增多,解毒作用增强,维持肝细胞内膜结构的稳定,提高肝细胞内谷胱甘肽的合成。对谷胱甘肽缺失时的肝损伤,N-乙酰半胱氨酸可以起到保护肝脏的作用,同时也能维护缺血-再灌注损伤时肝脏的完整性。值得注意的是,硫普罗宁可引起发热、皮疹等不良反应,用药期间应关注患者的临床表现。
-
代表药物有水飞蓟素类和双环醇。抗氧化类药物还包括一些中药,如扶正化瘀胶囊、安络化纤丸、复方鳖甲软肝片等。水飞蓟宾主要用于毒蕈中毒的肝衰竭患者,能快速的解毒,同时,还具有抗病毒的作用。双环醇可以使脂质过氧化水平降低,减少线粒体的损伤,从而促进肝细胞合成,抑制肝细胞的凋亡。中药可以通过降低氧化应激反应和脂质过氧化水平,阻止肝脏炎性的发展、恶化。
-
代表药物有熊去氧胆酸和S腺苷蛋氨酸。熊去氧胆酸可以增加胆汁酸以及磷脂的含量,改变胆盐的成分,减轻胆汁酸的毒性,保护肝细胞膜和利胆。熊去氧胆酸的生理活性药物牛磺熊去氧胆酸是一种更安全、高效,可取代熊去氧胆酸的治疗药物。它的特点是安全性和生物利用度更高,分泌和转运更快,毒性更低,水溶性更好,对保护肝细胞更有效,但目前临床应用的证据尚不够充分。S腺苷蛋氨酸可以促进肝细胞的恢复,利于淤积胆汁的排泄,可以用于胆汁代谢障碍及淤胆型肝损伤。
-
甘草酸类抗炎药物和抗氧化类药物可以同时作用于炎症因子产生的各阶段,两种药物联合使用一方面可以减少炎症因子的产生,避免使肝损伤继续的加重;另一方面对于已经产生的炎症因子可以起到中和作用,减轻已造成的肝脏炎性损害。此外,甘草酸类、还原型谷胱甘肽等抗炎解毒药物与细胞膜保护剂联合用药也可从不同环节起到保肝作用。
COVID-19以免疫损伤为主,“炎性反应细胞浸润”是肝脏损伤的共同特征,无论何种原因所致的肝损伤均存在肝脏炎性反应[34]。因此,无论是SARS-CoV-2病毒本身所致的肝损伤,还是药物性肝损伤,抗病毒治疗的同时应进行抗炎保肝治疗。目前常用的抗炎保肝药物主要有甘草酸类抗炎药物、肝细胞膜修复保护类药物、利胆类保肝药物,如S-腺苷蛋氨酸、熊去氧胆酸等,其中甘草酸类抗炎药物是一线抗炎保肝药物,尤其是异甘草酸镁,是治疗急性药物性肝损伤的首选药物。Chen等[38]研究证明甘草酸可以与新冠病毒受体(ACE2)结合,从而抑制SARS-CoV-2病毒。当前需要密切关注COVID-19患者是否有肝功能异常,及时给予甘草酸制剂、多烯磷脂酰胆碱等保肝抗炎药物治疗。在危重症患者,根据肝功能损伤情况推荐1~2种药物即可,不建议使用过多种类保肝药物。
-
据目前研究推测,COVID-19患者出现的肝损伤可能是由于细胞因子风暴引发各器官脏器衰竭,继发的肝损伤。同时不排除SARS-CoV-2可能直接与ACE2阳性胆管细胞结合,通过攻击胆管激发炎性反应而导致肝损伤。另外,药物性的肝毒性也可引起肝损伤。本文对各种因素诱导的COVID-19患者继发性肝损伤及其相应的机制进行了初步探究,为进一步深入研究提供指引与思路。同时提示,对已出现肝损伤的COVID-19患者保肝药物治疗及其早期预防非常重要,值得临床上的进一步研究。
Causes of liver injury in patients with COVID-19 and treatment with hepatoprotective drugs
-
摘要: 新型冠状病毒(SARS-CoV-2)感染引起的新型冠状病毒肺炎(COVID-19)患者临床表现出不同程度的肝损伤。一系列研究表明细胞因子风暴、SARS-CoV-2病毒所致的胆管细胞损伤以及药物性肝毒性可以诱导继发性肝损伤,对不同因素所致的肝损伤的机制以及保肝药物治疗进行综述,以期为后续深入揭示该方面的研究提供参考支持。Abstract: COVID-19 patients infected with SARS-CoV-2 showed different degrees of liver injury. A series of studies have shown that cytokine storm, bile duct cell injury caused by SARS-CoV-2 and drug-induced hepatotoxicity can induce secondary liver injury. This article will review the mechanism of liver injury caused by different factors and the treatment of hepatoprotective drugs, in order to provide reference support for further research in this field.
-
Key words:
- SARS-CoV-2 /
- COVID-19 /
- liver injury /
- inflammation /
- cytokine storm
-
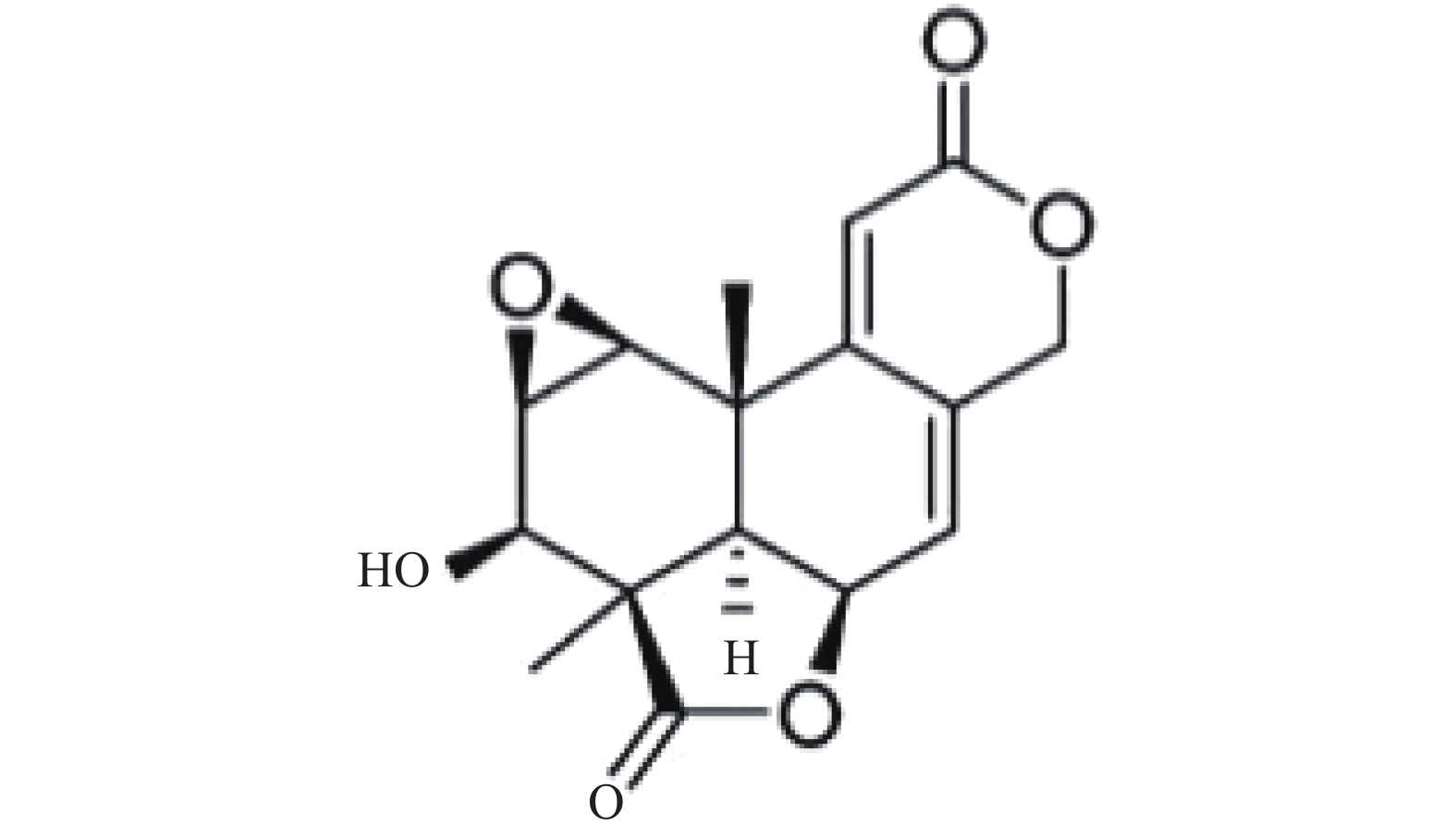
Wentilactone A(WA)是从海洋微生物中分离得到的去甲二萜类小分子化合物,对小细胞肺癌细胞系NCI-H460和NCI-H446细胞的增殖具有抑制作用,可诱导小细胞肺癌细胞系NCI-H446和NCT-H1688细胞凋亡[1]。对小细胞肺癌细胞系NCT-H1688细胞的细胞迁移和集落形成具有抑制作用[2]。WA作为一种有效抗肿瘤候选物,已从制备工艺、理化性质、急性毒性、生殖毒性等方面证明其良好的成药性[3]。遗传毒性安全性实验更是对其临床前研究全面性的补充,为提高临床用药的安全性,为了验证其是否具有遗传毒性,本实验应用微生物回复突变试验(Ames试验)、体外培养CHO细胞染色体畸变试验和小鼠骨髓微核试验方法对WA的遗传毒性进行了系统的研究,为WA的临床前毒性评价提供资料[4]。
1. 材料与方法
1.1 材料
1.1.1 化合物WA
Ames试验用WA(含量:99.9%,批号:20121115,黄色粉末)、体外培养CHO细胞染色体畸变试验用(规格:10 ml,含量:50.8 mg/ml,批号:20130506,黄色澄明溶液)、小鼠骨髓微核试验用WA(规格:10 ml/支:100mg,含量:10.2 mg/ml,批号:20130407,黄色澄明溶液),均由海军军医大学基础医学院生物化学与分子生物学教研室提供。WA的化学结构见图1。
1.1.2 菌株
组氨酸缺陷型鼠伤寒沙门菌(S. typhimurium)TA97、TA98、TA100、TA102和TA1535共5支菌株,复旦大学公共卫生学院环境卫生教研室赠予。实验前对其进行鉴定(R因子和自发回变数鉴定),均符合规定标准。
1.1.3 细胞
中国仓鼠卵巢(CHO)细胞由复旦大学公共卫生学院毒理教研室赠予。
1.1.4 动物
ICR小鼠(SPF级)共60只,每组10只,雌雄各半,5~6周龄,购入时体重16.5~20.8 g,由上海西普尔-必凯实验动物有限公司提供,动物质量合格证号:2008001629237。自购入起3天进行检疫,给药时体重20.3~23.6 g。
1.2 试验方法
按《新药(西药)临床前研究指导原则汇编》[5-6]的设计要求,分别应用Ames试验[7]、体外培养CHO细胞染色体畸变试验[8]和小鼠骨髓微核试验[9]检测WA的遗传毒性。检测终点覆盖了基因突变、染色体畸变和细胞有丝分裂异常。
1.3 实验步骤
1.3.1 Ames实验
根据《药物遗传毒性研究技术指导原则》的要求,应用S. typhimurium TA97、TA98、TA100、TA102和TA1535共5支菌株,设每皿5 000、500、50、5、0.5 μg 5个剂量组。此外,设空白对照、溶剂对照和阳性对照组(具体剂量见表1)。采用标准平板掺入法,使细菌在加和不加代谢活化系统S9的条件下接触受试物,每皿均加入供试品或溶剂对照DMSO 0.1 ml,每个剂量组及对照组均设3个平行皿。并用最低极限的琼脂培养基培养48 h后,先用显微镜观察平皿上的菌苔生长情况,确定受试物无明显的抑菌或杀菌作用,再人工计数每皿回复突变的菌落数,记录原始数据,并计算每组的均值和标准差,与溶剂对照组进行比较,重复实验一次。
表 1 阳性对照品名称及浓度组别 菌株 阳性对照品 溶液终浓度(μg/皿) 加入量(μl/皿) 浓度(μg/ml) -S9组 TA97 敌克松 50 100 500 TA98 敌克松 50 100 500 TA100 甲基磺酸甲酯 1 100 10 TA102 甲基磺酸甲酯 1 100 10 TA1535 4-硝基喹啉-N-氧化物 0.5 100 5 +S9组 TA97 2-氨基芴 10 100 100 TA98 2-氨基芴 10 100 100 TA100 2-氨基芴 10 100 100 TA102 1,8-二羟基蒽醌 50 100 500 TA1535 环磷酰胺 50 100 500 1.3.2 染色体畸变试验
在加和不加代谢活化系统S9的条件下,体外培养的CHO细胞中加入相应浓度的供试品或对照品,反应体系总体积为10 ml。低、中、高剂量组供试品终浓度分别为23.74、47.48和94.96 μg/ml,阳性对照组丝裂霉素C和环磷酰胺的终浓度分别为0.5 μg/ml、60 μg/ml,另设溶剂对照组分别作用于细胞4 h后换液继续培养至24 h,和药物作用细胞24 h后收集细胞。收获细胞前4 h,加入终浓度0.2 μg/ml秋水仙素,培养结束收集细胞,经离心、低渗处理、固定、离心、制片和Giemsa染色,每个剂量组制备2~3张玻片标本。
镜检时每组观察200个染色体中分散良好、数目完整的中期分裂相细胞(若观察到大量染色体畸变细胞,如阳性对照组,分析细胞数可相应减少为至少100个细胞)。计数染色体或染色单体的断裂、缺失及其他类型结构异常的数目(裂隙和核内复制一般不作为畸变类型),记录原始数据计算畸变率。
1.3.3 小鼠骨髓微核实验
检疫期结束后分别按低、中、高组小鼠给药,分别予100、200、400 mg/kg剂量给药,其中高剂量组设两组分别在药物作用24 h和48 h后处死,并设阳性对照组和溶剂对照组。分别在药物作用24 h和48 h后处死小鼠,取股骨骨髓制成骨髓涂片,每只动物制2张涂片,经甲醇固定后用pH6.8的Giemsa染液染色。
每只动物镜检约2000个骨髓嗜多染红细胞(PCE),计数含微核的PCE数(MNPCE),计算微核发生率,同时记录200个PCE计数过程中观察到的正染红细胞(NCE)的数目,并计算PCE/NCE值。
1.4 剂量设计
对于易溶无毒的化合物,细菌实验最高浓度应达到5 mg/皿[10]。Ames试验设每皿5 000、500、50、5、0.5 μg 5个剂量组,每皿均加入相应浓度的供试品溶液0.1 ml,另设空白对照、溶剂对照和阳性对照。在哺乳动物细胞体外遗传实验中,毒性水平应高于50%细胞抑制率或细胞融合率[11]。通过预实验确定供试品的IC50为94.96 μg/ml。染色体畸变试验的低、中、高剂量组为23.74、47.48和94.96 μg/ml,试验时在10 ml的试验体系中分别加入0.1 ml各剂量组的应用液,另设阳性对照组和溶剂对照。ICR小鼠的微核试验采用小鼠经尾静脉注射给药,总剂量分别为100、200、400 mg/kg(单次给药剂量分别为50、100、200 mg/kg,分上、下午两次经尾静脉注射给药),给药容积为20 ml/kg体重;同时设阳性对照组和溶剂对照组。阳性对照组以40 mg/kg体重的剂量腹腔注射环磷酰胺,给药容量为10 ml/kg体重;溶剂对照组给药方式与受试物组相同,以20 ml/kg体重的容积经尾静脉注射生理盐水。
1.5 统计方法
Ames试验结果的评价是以溶剂对照组的回复突变菌落数为基础,与受试物各剂量组相比较。若某剂量组回复突变菌落数为溶剂对照组的2倍以上,呈现可重复性,并在一定的剂量范围内存在着剂量-反应关系,则判断为阳性[12]。染色体畸变试验和小鼠骨髓微核试验均采用卡方检验或方差分析方法研究给药组与对照组之间是否具有统计学意义[13]。
2. 结果与分析
2.1 Ames试验结果
受试物各剂量组和对照组的平皿均可见背景菌苔生长。5支菌株的自发回复突变菌落数以及阳性对照品诱发的回复突变菌落数均在历史参考范围内,并且各菌株阳性对照组的回复突变菌落与空白对照组相比数目显著增加,提示本试验系统符合要求。在最高剂量已达到5 000 μg/皿的受试条件下,未观察到受试物的抑菌现象。各剂量组受试物在加或不加S9时对TA97、TA98、TA100、TA102和TA1535所诱发的回复突变菌落数均与自发的突变菌落数相近,未观察到明显的剂量-反应关系。结果见表2和表3。
表 2 WA对5支菌株的回变菌落数试验结果(个/皿,${\rm{\bar x}}$ ±s)(第1次)组别(μg/皿) TA97 TA98 TA100 TA102 TA1535 +S9 -S9 +S9 -S9 +S9 -S9 +S9 -S9 +S9 -S9 5 000 36±5 40±4 21±3 21±2 131±26 93±17 177±21 185±25 25±3 14±2 500 36±5 39±8 17±4 20±3 114±22 90±23 195±8 207±7 23±1 19±1 50 39±10 35±5 21±7 21±3 115±21 97±8 196±33 179±18 19±8 16±4 5 41±6 40±3 21±5 22±4 114±15 87±19 195±21 193±8 19±2 14±1 0.5 37±6 39±3 20±3 19±3 128±15 91±12 201±14 205±14 20±6 16±4 空白对照组 40±7 36±5 17±2 19±4 99±17 89±9 213±30 197±34 21±7 19±4 溶剂对照组 40±6 34±1 22±5 26±2 95±8 89±9 193±8 199±29 23±3 14±1 阳性对照组 839±24 841±47 936±56 1 077±55 968±27 1 111±66 1 101±17 1 024±53 342±44 345±13 表 3 WA对5支菌株的回变菌落数试验结果(个/皿,${\rm{\bar x}}$ ±s)(第2次)组别(μg/皿) TA97 TA98 TA100 TA102 TA1535 +S9 -S9 +S9 -S9 +S9 -S9 +S9 -S9 +S9 -S9 5 000 38±5 34±5 20±5 21±5 128±24 105±26 179±21 189±19 20±4 20±3 500 39±7 34±3 21±2 20±7 108±13 92±28 192±16 187±30 16±3 19±4 50 38±9 30±3 19±3 18±1 117±14 102±5 197±5 196±22 17±3 18±1 5 37±8 29±4 18±2 17±1 111±5 98±33 206±24 191±21 16±1 20±2 0.5 35±6 33±8 24±2 23±3 107±7 97±8 203±6 193±10 15±4 15±4 空白对照组 38±3 41±4 22±3 23±4 96±12 93±8 205±17 186±19 18±2 18±4 溶剂对照组 38±3 37±8 22±3 23±4 98±7 100±12 202±15 197±10 18±2 19±4 阳性对照组 881±18 876±35 900±11 1 077±111 964±113 996±8 1 024±37 1 011±8 392±8 392±22 2.2 染色体畸变试验结果
染色体分析结果显示,阳性对照组能够诱发受试细胞染色体的畸变率明显增高,24 h在+ S9和-S9的情况下染色体畸变率分别为11%和11%,与溶剂对照组相比,均有统计学差异(P<0.05);23.74、47.48和94.96 μg/ml受试物在24 h、+S9条件下染色体畸变率分别为1%、1%和0.5%,24 h、-S9条件下染色体畸变率分别为0%、0.5%和0%;4 h、-S9条件下染色体畸变率分别为0%、0%和0%。综上,受试物各剂量组细胞染色体畸变率均小于5%,与溶剂对照组结果相比,其差异均无统计学意义(P>0.05)。结果见表4~6。
表 4 WA对24 h体外培养CHO细胞的染色体畸变试验结果(+S9)组别 观察细胞数
(个)各类染色体畸变数 畸变细胞数
(个)畸变率
(%)断裂 断片 双着丝粒 三辐体 四辐体 碎片或微小体 环状 多倍体 23.74 μg/ml 200 1 1 0 0 0 0 0 1 2 1 47.48 μg/ml 200 2 2 0 0 0 0 0 0 2 1 94.96 μg/ml 200 0 0 0 0 0 0 0 0 1 0.5 溶剂对照组 200 200 0 0 0 0 0 3 3 3 1.5 阳性对照组 100 9 0 0 1 3 3 0 0 14 14 注:阳性对照组:+S9、环磷酰胺(60 mg/ml);溶剂对照组:DMSO;* P<0.05,与溶剂对照组比较。 表 5 WA对24 h体外培养CHO细胞的染色体畸变试验结果(-S9)组别 观察细胞数
(个)各类染色体畸变数 畸变细胞数
(个)畸变率
(%)断裂 断片 双着丝粒 三辐体 四辐体 碎片或微小体 环状 多倍体 23.74 μg/ml 200 0 0 0 0 0 0 0 0 0 0 47.48 μg/ml 200 1 0 0 0 0 0 0 0 1 0.5 94.96 μg/ml 200 0 0 0 0 0 0 0 0 0 0 溶剂对照组 200 0 0 0 0 0 0 0 0 0 0 阳性对照组 100 4 4 0 0 0 0 4 0 12 12* 注:阳性对照组:-S9、丝裂霉素C(0.5 mg/ml);溶剂对照组:DMSO;*P<0.05,与溶剂对照组比较。 表 6 WA对4 h体外培养CHO细胞的染色体畸变试验结果(-S9/4 h)组别 观察细胞数
(个)各类染色体畸变数 畸变细胞数
(个)畸变率
(%)断裂 断片 双着丝粒 三辐体 四辐体 碎片或微小体 环状 多倍体 23.74 μg/ml 200 0 0 0 0 0 0 0 0 0 0 47.48 μg/ml 200 0 0 0 0 0 0 0 0 0 0 94.96 μg/ml 200 0 0 0 0 0 0 0 0 0 0 溶剂对照组 200 阳性对照组 * P<0.05,与溶剂对照组比较。 2.3 小鼠骨髓微核试验的结果
试验结果经统计学分析表明,WA在100、200、400 mg/kg剂量下未观察到对小鼠骨髓的抑制作用,溶媒对照组和阳性对照组雌、雄性小鼠骨髓PCE微核发生率分别为2.10‰和21.36‰、1.90‰和20.88‰,两组相比差异均有统计学意义(P<0.05),验证了本次试验系统的有效性。WA 100和2 000 mg/kg剂量24 h采样组雌、雄小鼠骨髓PCE微核率分别为1.60‰和1.80‰、1.90‰和1.60‰;400 mg/kg剂量24 h和48 h采样组雌、雄小鼠骨髓PCE微核率分别为2.10‰和2.80‰、2.40‰和1.29‰,与溶媒对照组相比均无显著差异(P>0.05)。结果见表7。
表 7 WA对小鼠骨髓嗜多染红细胞的微核效应试验结果组别 性别 动物数(只) 观察PCE数(个) PCE/NCE(${\rm{\bar x}}$±s) 微核率(${\rm{\bar x}}$±s, ‰) 100 mg/kg 雌 5 10 020 2.40±0.89 1.60±0.96 200 mg/kg 雌 5 10 010 1.63±0.40 1.80±1.31 400 mg/kg (24 h采样) 雌 5 10 016 1.95±0.40 2.10±1.20 400 mg/kg (48 h采样) 雌 5 10 009 1.58±0.44 2.80±1.81 溶媒对照组 雌 5 10 009 2.37±0.69 2.10±1.20 阳性对照组 雌 5 9 095 2.18±0.30 21.36±7.84* 100 mg/kg 雄 5 10 016 1.56±0.30 1.90±1.28 200 mg/kg 雄 5 10 009 1.52±0.28 1.60±0.70 400 mg/kg (24 h采样) 雄 5 10 006 1.40±0.73 2.40±2.01 400 mg/kg (48 h采样) 雄 5 8 802 1.43±0.63 1.29±1.26 溶媒对照组 雄 5 9 029 2.13±0.58 1.90±1.45 阳性对照组 雄 5 10 011 1.62±0.42 20.88±4.94* *P<0.05,与溶剂对照组比较。 3. 讨论
沙门菌回复突变试验(Ames试验)被研究者广为采用,该法的特点是快速、简便、敏感、经济,是经典的测试化学物质或药物致突变性实验[10]。染色体畸变分析是采用中国仓鼠卵巢(CHO)细胞体外培养的方法进行的。CHO细胞在加或不加代谢活化系统的条件下,与受试物接触一定时间后再于收集染色体4 h前用秋水仙碱处理,使细胞的有丝分裂停止在中期相。然后收集细胞,经低渗、固定、涂片和染色后,在显微镜下观察染色体数量和结构的改变,检测受试物的诱变性[7]。微核试验是检测化合物对染色体损伤作用的重要方法。凡能使染色体发生断裂或使染色体和纺锤体联结损伤的化合物,微核试验都可检测[8]。
本研究采用遗传毒性研究经典组合的方法,分别从原核系统到真核系统,从体外试验系统到体内试验系统,体外试验中包含了加与不加代谢活化系统,能检测基因突变、染色体畸变等多个遗传学终点,符合国际标准化的要求[5-6]。
本研究结果显示,本试验条件下,采用标准平板掺入法,WA在每皿5 000、500、50、5、0.5 μg的受试剂量下,加或不加S9时对组氨酸缺陷型鼠伤寒沙门菌均无致突变性;对CHO细胞,在23.74、47.48、94.96 μg/ml 3个剂量组,加或不加S9,于24 h和48 h诱发的细胞染色体畸变率均小于5%,与溶剂对照组结果相比较其差异均无统计学意义(P>0.05),表明WA在受试剂量下无致CHO细胞染色体畸变效应;WA在100、200、400 mg/kg 3个剂量下,对ICR小鼠的微核诱发率与溶剂对照组比较均无显著差异,表明其在受试剂量下对ICR小鼠无致微核效应[14]。上述结果提示WA没有遗传毒性和潜在致癌性。
此前有文献表明WA对小细胞肺癌的增殖有抑制作用,但对于遗传毒性未见报道。本研究对降低WA在研发过程中用于临床试验和疾病治疗的用药风险发挥重要作用。
-
[1] PAN F, YE T H, SUN P, et al. Time course of lung changes on chest CT during recovery from 2019 novel coronavirus (COVID-19) pneumonia[J]. Radiology,2020,295(3):200370. [2] DU Z W, WANG L, CAUCHEMEZ S, et al. Risk for transportation of 2019 Novel Coronavirus Disease from Wuhan to other cities in China[J]. Emerg Infect Dis,2020,26(5):1049-1052. doi: 10.3201/eid2605.200146 [3] CHEN N S, ZHOU M, DONG X, et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study[J]. Lancet,2020,395(10223):507-513. doi: 10.1016/S0140-6736(20)30211-7 [4] HUANG C L, WANG Y M, LI X W, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China[J]. Lancet,2020,395(10223):497-506. doi: 10.1016/S0140-6736(20)30183-5 [5] ICHIYAMA T, ISUMI H, OZAWA H, et al. Cerebrospinal fluid and serum levels of cytokines and soluble tumor necrosis factor receptor in influenza virus-associated encephalopathy[J]. Scand J Infect Dis,2003,35(1):59-61. doi: 10.1080/0036554021000026986 [6] 刘必成, 高月明. “细胞因子风暴综合征”如何识别和处理[N]. 健康报, 2020-02-20(008). [7] JENNIFER R T, MARCUS J K, CAMERON P S, et al. Into the eye of the cytokine storm[J]. Microbiol Mol Biol Rev,2012,76(1):16. doi: 10.1128/MMBR.05015-11 [8] CHOUSTERMAN B G, SWIRSKI F K, WEBER G F. Cytokine storm and Sepsis disease pathogenesis[J]. Semin Immunopathol,2017,39(5):517-528. doi: 10.1007/s00281-017-0639-8 [9] XU X W, WU X X, JIANG X G, et al. Clinical findings in a group of patients infected with the 2019 novel coronavirus (SARS-Cov-2) outside of Wuhan, China: retrospective case series[J]. BMJ,2020,368:m606. [10] 张竞文, 胡欣, 金鹏飞. 新型冠状病毒引起的细胞因子风暴及其药物治疗[J]. 中国药学杂志, 2020, 55(5):333-336. [11] 任越, 姚美村, 霍晓乾, 等. 抗新型冠状病毒方剂基于花生四烯酸代谢通路防治“细胞因子风暴”的研究[J]. 中国中药杂志, 2020, 45(6):1225-1231. [12] 何黎黎, 龚普阳, 封玥, 等. 中药在抗新型冠状病毒肺炎(COVID-19)引起的细胞因子风暴中的应用分析[J/OL]. 中草药, 2020, [2020-03-03]. http://kns.cnki.net/kcms/detail/12.1108.R.20200302.0944.004.html. [13] ZHANG Y L, JIANG C Y. Cytokine storms: the dominant hand in acute respiratory distress syndrome[J]. Life Sci(生命科学),2015,27(5):554-557. [14] SHINYA K, GAO Y W, CILLONIZ C, et al. Integrated clinical, pathologic, virologic, and transcriptomic analysis of H5N1 influenza virus-induced viral pneumonia in the rhesus macaque[J]. J Virol,2012,86(11):6055-6066. doi: 10.1128/JVI.00365-12 [15] CHAI X, HU L, ZHANG Y, et al. Specific ACE2 expression in cholangiocytes may cause liver damage after 2019-nCoV infection[J]. bioRxiv, (2020-02-15)[2020-01-13]. http://www.instrument.com.cn/download/shtml/932534.shtml. [16] CHALASANI N, BONKOVSKY H L, FONTANA R, et al. Features and outcomes of 899 patients with drug-induced liver injury: the DILIN prospective study[J]. Gastroenterology,2015,148(7):1340-1352. doi: 10.1053/j.gastro.2015.03.006 [17] 宣自学, 张国兵, 叶晓兰, 等. 新型冠状病毒肺炎患者肝损的原因分析[J]. 中国药理学通报, 2020, 36(4):591-592. doi: 10.3969/j.issn.1001-1978.2020.04.026 [18] 陈丹龙, 杨芳, 罗志英, 等. 全球抗新型冠状病毒药物研发现状和瓶颈[J]. 中国药理学通报, 2020, 36(4):459-469. doi: 10.3969/j.issn.1001-1978.2020.04.003 [19] LAN N T N, THU N T N, BARRAIL-TRAN A, et al. Randomised pharmacokinetic trial of rifabutin with lopinavir/ritonavir-antiretroviral therapy in patients with HIV-associated tuberculosis in Vietnam[J]. PLoS One,2014,9(1):e84866. doi: 10.1371/journal.pone.0084866 [20] 杨瑾, 莫国栋, 卢志军, 等. 我院107例干扰素注射液不良反应特点分析[J]. 今日药学, 2017, 27(3):199-201. doi: 10.12048/j.issn.1674-229X.2017.03.016 [21] DYSON J K, HUTCHINSON J, HARRISON L, et al. Liver toxicity associated with sofosbuvir, an NS5A inhibitor and ribavirin use[J]. J Hepatol,2016,64(1):234-238. doi: 10.1016/j.jhep.2015.07.041 [22] 聂青和. 糖皮质激素在肝衰竭治疗中的地位[J]. 中华肝脏病杂志, 2012, 20(6):414-415. [23] 聂青和. 肝衰竭综合治疗进展[J]. 实用肝脏病杂志, 2013, 16(1):17-19. [24] COTTIN J, PIERRE S, PIZZOGLIO V, et al. Methylprednisolone-related liver injury: a descriptive study using the French pharmacovigilance database[J]. Clin Res Hepatol Gastroenterol,2020-pii:S2210-7401(19)30270-0. [25] GALVAÑ V G, OLTRA M R, RUEDA D, et al. Severe acute hepatitis related to hydroxychloroquine in a woman with mixed connective tissue disease[J]. Clin Rheumatol,2007,26(6):971-972. doi: 10.1007/s10067-006-0218-1 [26] PATON N I, LEE L, XU Y, et al. Chloroquine for influenza prevention: a randomised, double-blind, placebo controlled trial[J]. Lancet Infect Dis,2011,11(9):677-683. doi: 10.1016/S1473-3099(11)70065-2 [27] 孙蓉, 黄伟, 李素君, 等. 关于“柴胡劫肝阴”的源流发展与初步实验研究[J]. 中国药物警戒, 2009, 6(10):577-580. doi: 10.3969/j.issn.1672-8629.2009.10.001 [28] 孙蓉, 杨倩. 柴胡挥发油对大鼠肝能量代谢的影响[J]. 中国药理学与毒学杂志, 2011, 25(3):310-313. [29] 孙蓉, 吕丽莉, 王丽, 等. 柴胡致大鼠肝毒性氧化损伤机制研究[J]. 中药药理与临床, 2009, 25(1):49-51. [30] 张丽美, 鲍志烨, 黄幼异, 等. 半夏水提组分对小鼠肝毒性“量-时-毒”关系研究[J]. 中国药物警戒, 2011, 8(1):11-15. doi: 10.3969/j.issn.1672-8629.2011.01.003 [31] 黄伟, 张作平, 黄幼异, 等. 提取工艺对半夏急性毒性与相关物质基础含量的影响研究[J]. 中国药物警戒, 2010, 7(11):656-660. doi: 10.3969/j.issn.1672-8629.2010.11.006 [32] GEORGIOU M, SIANIDOU L, HATZIS T, et al. Hepatotoxicity due to Atractylis gummifera-L[J]. J Toxicol Clin Toxicol,1988,26(7):487-493. doi: 10.3109/15563658809038564 [33] 中华医学感染病学分会. 肝脏炎症及其防治专家共识[J]. 中国实用内科杂志, 2014, 7(1):4-12. [34] 褚扬, 周王谊, 吴江, 等. 新型冠状病毒肺炎治疗中应关注肝损伤及防治中药概述[J/OL]. 世界中医药. http://kns.cnki.net/kcms/detail/11.5529.R.20200221.0904.006.html. [35] 缪晓辉. 抗结核化疗诱导药物性肝损伤的护肝治疗[J]. 中华结核和呼吸杂志, 2013, 36:729-731. doi: 10.3760/cma.j.issn.1001-0939.2013.10.006 [36] WANG C Y, KAO T C, LO W H, et al. Glycyrrhizic acid and 18β-glycyrrhetinic acid modulate lipopolysaccharide-induced inflammatory response by suppression of NF-κB through PI3K p110δ and p110γ inhibitions[J]. J Agric Food Chem,2011,59(14):7726-7733. doi: 10.1021/jf2013265 [37] SCHROFELBAUER B, RAFFETSEDER J, HAUNER M, et al. Glycyrrhizin, the main active compound in liquorice, attenuates pro-inflammatory responses by interfering with membrane-dependent receptor signaling[J]. Biochem J,2009,421(3):473-482. doi: 10.1042/BJ20082416 [38] CHEN H S, DU Q H. Potential natural compounds for preventing SARS-CoV-2 (2019-nCoV) infection[EB/OL]. 2020. DOI: 10.20944/preprints202001.0358.v3 -

 点击查看大图
点击查看大图
计量
- 文章访问数: 6699
- HTML全文浏览量: 3720
- PDF下载量: 57
- 被引次数: 0




 下载:
下载:



 下载:
下载:
