-
基本药物制度是我国药物政策的核心,基本药物目录(简称“基药目录”)是基本药物制度的基石。2012年版基药目录[1]对目录内药品的剂型、规格做了具体的规定;2018年版基药目录在2012年版基础上进一步规范了药品剂型和规格,685种药品涉及剂型1 110余个,规格1 810余个[2-3]。不同剂型发挥药效的速度不同,所适应的人群也有所差别;药物规格的选择受到药物临床使用的影响,只有选择合适的规格,才能在最大程度上保障药物的合理使用,避免浪费。张闪闪[4]通过比较分析2012及2018年版基药目录的调整情况,指出2018年版目录剂型调整充分关注到儿童用药的需求,在原通用名下增加适宜儿童使用的剂型等。薛慧颖等[5]对比2018年版以及2012年版基药目录剂型规格变化,指出2018年版基药目录对于剂型、规格的增补充分考虑了特殊人群用药的适应性,但我国仍缺少儿童用药的专用剂型和规格。历版基药目录收录药品上市分析的文献中,从批准上市企业及采购平台挂网企业的数量进行可获得性分析以及从价格进行可负担性分析的研究较少。据调查[6-7]显示,我国每年约3万例儿童因用药不当致聋,儿童药物不良反应发生率是成人的2倍,在每年死于用药不当的人群中,儿童占1/3。电解质和解热镇痛药为儿童最常用的药物,因此,本课题以此为研究对象,研究基药目录收录药品的不同剂型、规格的可获得性和可负担性。
笔者通过系统检索国家药品监督管理局官方网站获准生产上市药品的数据库及相关药学网站,统计分析纳入2018年版基药目录中电解质和解热镇痛药西药的相关信息,为进一步完善和提高基药目录遴选标准,促进基本药物可及性提供数据参考。
-
在国家药品监督管理局网站(https://www. nmpa.gov.cn/)国产药品和进口药品数据查询窗口,选取2018年版《国家基本药物目录》中调节水、电解质及酸碱平衡药以及镇痛、解热药,以2018年版《国家基本药物目录》中品种名称为检索词,检索各品种下具体获准上市情况,检索时间截至2019年11月。纳入主要化学成分名称一致的药品,包括不同的酸根或不同盐基,摘录其产品名称、剂型、规格,并统计出相同产品名称的批准文号(注册证号)数以及各个规格的批准文号数,逐一录入Excel表。在河南省公共资源交易中心(http:// www.hnggzy.com/hnsggzy/)医药采购平台-目录管理-河南省药品交易目录中,逐一对2018年版基药目录收载调节水、电解质和酸碱平衡药以及镇痛、解热、抗炎、抗风湿、抗痛风药进行查询,统计各个药品的品种、剂型和规格的生产企业在河南省挂网的数量,逐一录入Excel表。另外,对其中需要价格查询的药品,利用药智网,查询其最小单位制剂在2017、2018以及2019年的中标价格,从而与相应的基本药物做对比分析。
-
采用Excel软件做进一步的数据处理和统计分析,当所录入的某一产品具有不同的规格时,将其不同的规格按批准文号数由多到少排序,最后标注出所有的基本药物;采用SPSS 25.0软件对部分药品的同一年份不同规格中标价格进行t检验。
-
调节水、电解质及酸碱平衡药是临床常用的一类药品,涉及各种疾病和各个年龄段的患者。该部分共收录8个药品,经统计,批准文号数多的产品基本上都是基本药物,但氯化钾注射液的遴选并不符合这一规律。小规格的药品更适合儿童使用,不易造成浪费,但50 ml的葡萄糖没有入选基药。
-
氯化钾注射液为临床上常用的补钾药,可治疗各种原因引起的低血钾症[8-9],在我国上市的有10 ml∶1 g和10 ml∶1.5 g两种规格,其批准文号数分别是85和16。2018年版基药目录收录规格为10 ml∶1.5 g,而批准文号数较多的10 ml∶1 g不是基本药物。氯化钾注射液供应情况及价格见表1,部分省份中标价格见表2。
表 1 氯化钾注射液的可及性
氯化钾注射液规格 批准文号数 挂网企业数 2017年中标价格(元) 2018年中标价格(元) 2019年中标价格(元) 平均值 中位数 平均值 中位数 平均值 中位数 10 ml∶1.5 g① 16 10 0.99 0.95 1.34 0.80 2.80 1.44 10 ml∶1 g 85 26 0.76 0.50 0.86* 0.52 1.62* 0.84 注:“①”代表基药;*P<0.05,与基药规格比较。 表 2 部分省份氯化钾注射液中标价格(元)
药品规格 省份 2017年 2018年 2019年 平均价 中位数 平均价 中位数 平均价 中位数 10 ml∶1.5 g① 辽宁 1.15 1.11 1.64 1.64 0.85 0.85 湖南 0.45 0.45 − − 0.57 0.45 广西 − − 5.95 5.95 10.20 15.00 10 ml∶1 g 辽宁 0.66 0.63 0.82 0.59 0.29 0.29 湖南 0.49 0.21 0.54 0.21 0.39 0.22 广西 1.72 1.80 1.17 0.80 2.83 2.40 注:“①”代表基药;“−”代表未查询到该价格。 批准文号数越多,该药的供应保障能力越强,通常情况下价格相对合理,这符合国家基本药物的遴选原则。同样,省级药品集中采购平台上,国家基本药物的挂网情况可以在一定程度上反映各省对基药的配备和供应情况。
在临床使用中,其一般用法为将10%氯化钾注射液10~15 ml加入5%葡萄糖注射液500 ml中滴注[8-9]。与10 ml∶1.5 g的氯化钾注射液相比,10 ml∶1 g为更常用的规格,更便于计算和剂量的调整;从全国中标价格可以看出,10 ml∶1 g规格的氯化钾在2018、2019年的价格显著低于基药剂型。因此,从临床使用便利性、生产供应及价格等角度考虑,建议将10 ml∶1 g氯化钾注射液列入基药目录。针对表2中各省份之间中标价格差别较大,广西中标价格较辽宁、湖南高的现象。经查询发现,广西中标企业数较少,且中标价格相对较高,例如:2019年10 ml∶1.5 g氯化钾在广西中标企业共3家,2家企业中标平均价均高达15元,导致该地区中标价格较高;而湖南中标企业共5家,其中4家企业中标平均价均低于0.5元,甚至某企业中标平均价低至0.09元;10 ml∶1 g氯化钾也存在同样的问题:2019年广西4个中标企业中,有2个中标平均价均在4元以上,湖南8个中标企业中,只有2个企业中标平均价高于1元。
-
葡萄糖注射液是临床最常用的一种注射制剂,可以补充能量和体液,也可以用于治疗低血糖症和高血钾症[8]。2018年版国家基本药物目录收录有5%、10%、25%和50%葡萄糖注射液20、100、250、500和1 000 ml,而在临床使用中,50 ml的葡萄糖注射液更适合儿童使用,不易造成浪费,使用也更加方便。其生产供应及价格与基药100和250 ml的葡萄糖注射液比较,详见表3(因未查询到2018年葡萄糖注射液的中标价格,故表3只列出2017和2019年数据)。从临床使用便利性、生产供应及价格等角度考虑,建议将50 ml葡萄糖注射液纳入基药目录。
表 3 葡萄糖注射液的可及性
规格 批准文号数 挂网企业数 2017年(元) 2019年(元) 平均价 中位数 平均价 中位数 50 ml 125 31 4.14 3.70 3.06 2.72 100 ml① 414 58 4.22 3.90 2.60 2.08 250 ml① 476 57 5.64 5.12 − − 注:“①”代表基药;“−”代表未查询到该价格。 -
对乙酰氨基酚为临床上常用的解热镇痛药,用于普通感冒或流行性感冒引起的发热,也用于缓解轻度至中度疼痛,是WHO推荐用于2个月以上小儿首选解热药,疗效较好,不良反应少,耐受性好且用药安全[10]。由表4可见,对乙酰氨基酚在国内上市了大量的剂型和规格。我国2012、2018年版的基药目录收录了片剂(0.5 g)、颗粒剂(0.1 g)、口服溶液剂(100 ml∶2.4 g)、干混悬剂和混悬液,可见其考虑到了儿童和有吞咽困难患者的用药需要。但本课题组通过临床调查并咨询医生及药师发现,除了基药目录中这几种适合于儿童使用的剂型、规格之外,滴剂也是临床上十分常用的剂型,栓剂、糖浆剂、泡腾颗粒和泡腾片等在临床实际应用中也各有优势。
表 4 对乙酰氨基酚上市剂型统计
序号 剂型 批准文号数 挂网企业数 1 片剂① 921 43 2 栓剂 55 4 3 口服溶液剂① 25 5 4 注射液 17 0 5 胶囊剂 12 1 6 颗粒剂① 11 1 7 滴剂 9 4 8 糖浆剂 9 0 9 灌肠剂 8 0 10 颗粒剂 7 1 11 泡腾片 5 1 12 咀嚼片 5 0 13 干混悬剂① 4 2 14 缓释片 2 2 15 分散片 2 0 16 口腔崩解片 2 0 17 混悬液① 2 1 18 片剂 1 1 19 软胶囊 1 0 20 丸剂 1 0 21 混选滴剂 1 0 22 口服混悬剂 1 0 23 凝胶剂 1 0 24 制剂中间体 1 0 注:“①”代表基药。 (1)对乙酰氨基酚栓:由表4可见,对乙酰氨基酚栓剂有55个批准文号,仅次于片剂;在河南省挂网目录上,有4个厂家供应,仅次于排名第一的片剂和第二的口服溶液剂,说明其市场供应能力较强。由表5可知,与口服溶液剂和干混悬剂相比栓剂价格更为便宜,2017、2018、2019年各栓剂规格全国中标价格均显著低于口服溶液剂,2018年各栓剂全国中标价格显著低于干混悬剂,且栓剂属于医保乙类[11-12]。栓剂适用于儿童或进食困难患者,而且可避免首过效应,减少不良反应,且起效快。郭春彦等[13]指出,根据儿童用药特点,新生儿应首选栓剂;婴幼儿首选滴剂和糖浆剂。卢梦情等[14] 对比《国家基本药物目录(2018年版)》(NEML)以及《世界卫生组织儿童基本药物标准清单》(WHO EMLc)发现,WHO EMLc中,对乙酰氨基酚剂型除口服溶液剂、干混悬剂、混悬液外,还收录有对乙酰氨基酚栓剂,便于儿童使用。综上,从临床使用便利性、生产供应及价格等角度综合考虑,建议将对乙酰氨基酚栓剂列入基药目录。
表 5 对乙酰氨基酚不同剂型的可及性[中标价(元)]
剂型与规格 批准文号数(个) 2017年 2018年 2019年 医保类别 平均价 中位数 平均价 中位数 平均价 中位数 口服溶液100 ml∶2.4 g① 17 11.19 10.54 11.71 12.71 12.03 12.71 乙类 颗粒0.1 g① 2 1.00 1.00 0.42 0.42 0.45 0.43 甲类 干混悬剂1.01 g∶0.3 g① 1 1.93 1.75 1.93 1.67 1.73 1.66 乙类 栓剂0.3 g 21 0.88* 0.31 0.85*# 0.60 0.70* 0.41 乙类 栓剂0.125 g 1 0.27* 0.18 0.35*# 0.33 0.17* 0.17 乙类 栓剂0.15 g 27 0.80* 0.74 0.65*# 0.40 0.66* 0.28 乙类 滴剂15 ml∶1.5 g(10%) 2 10.37 8.70 8.99△ 8.70 8.49△ 8.69 乙类 泡腾片0.3 g 1 1.97 1.72 1.78 1.68 1.68 1.68 无 分散片0.1 g 2 0.66 0.66 0.63 0.60 0.66 0.66 甲类 糖浆剂100 ml∶2.4 g 5 15.10 14.40 14.40 14.40 14.40 14.40 乙类 咀嚼片0.16 g 2 0.62 0.60 0.59 0.58 0.39 0.39 无 注:“①”表示基药;*P<0.05,与口服溶液剂比较;#P<0.05,与干混悬剂比较;△P<0.05,与口服溶液比较。 (2)对乙酰氨基酚滴剂:由表4可知,在对乙酰氨基酚已上市的24种剂型中,对乙酰氨基酚滴剂的批准文号数有9个,排第7位。在河南省挂网目录上,供应厂家数仅次于排在第一、第二的片剂和口服溶液剂,这与临床使用情况的调查结果相一致。从这两个结果可以看出,滴剂具有较强的市场供应能力,其应用也较为广泛。
由表5可知,对乙酰氨基酚滴剂平均每克只比口服溶液贵1元左右,价格相对合理,而且属于医保乙类[11-12]。从全国中标价格来看,除2017年外,对乙酰氨基酚滴剂中标价格均显著低于口服溶液剂。王晓玲等[15]通过对国外儿童用药剂型规格现状进行分析时指出,儿童用药辅料一般应采用其可接受的添加剂,以保障儿童用药的顺应性。在临床实际应用中,对乙酰氨基酚滴剂一般是水果香味澄清液体,配有滴管,剂量准确,使用方便、简单。从临床使用便利性、生产供应及价格等角度综合考虑,建议将对乙酰氨基酚滴剂列入基药目录。
表 6 部分省份对乙酰氨基酚中标价格(元)
剂型与规格 省份 2018年 2019年 平均价 中位数 平均价 中位数 口服液100 ml∶2.4 g① 浙江 9.88 8.90 − − 山东 13.05 13.70 11.12 12.89 干混悬剂1.01 g∶0.3 g① 浙江 1.78 1.78 1.71 1.71 山东 1.66 1.66 1.66 1.66 栓剂0.3 g 浙江 0.27 0.27 0.27 0.27 山东 − − 0.53 0.53 栓剂0.125 g 浙江 0.17 0.17 0.17 0.17 山东 − − − − 栓剂0.15 g 浙江 0.20 0.18 0.20 0.18 山东 0.87 1.17 1.20 1.32 滴剂15 ml∶1.5 g(10%) 浙江 9.45 9.45 8.33 8.33 山东 7.97 7.97 7.97 7.97 注:“①”代表基药;“−”代表未查询到该价格。 (3)对乙酰氨基酚片0.3 g:如表7所示,对乙酰氨基酚片0.3 g是批准文号数最多的规格,而2018年版国家基药目录收录的是0.5 g。在河南省挂网目录中,0.3 g和0.5 g的对乙酰氨基酚片分别有16和27个厂家供应,可见0.3 g也是临床常用剂量,其价格相对合理。
表 7 对乙酰氨基酚片不同规格的可及性[中标价(元)]
对乙酰氨基酚片规格 批准文号数 挂网企业数 2017年 2018年 2019年 平均价 中位数 平均价 中位数 平均价 中位数 0.5 g① 367 27 0.51 0.17 0.30 0.16 0.62 0.46 0.3 g 411 16 0.24 0.15 0.17 0.11 0.47 0.48 0.1 g 143 0 0.39 0.40 − − 0.35 0.35 注:“①”代表基药;“−”代表未查询到该价格。 从表7可以看出,除了0.5 g和0.3 g片剂之外,对乙酰氨基酚还存在0.1 g的规格。但由于片剂在临床使用中并不适合于儿童,已被口服液体剂型所取代,因此,本课题组不推荐其进入基药目录。
-
布洛芬为解热镇痛类非甾体抗炎药,是世界卫生组织和美国FDA唯一共同推荐的儿童退烧药,是公认的儿童首选抗炎药,适用于6个月以上儿童和成人[16]。现已上市的适合儿童使用的布洛芬剂型中,不仅有2018年版基药目录中的颗粒剂和混悬液,还有非基药剂型糖浆剂、栓剂、口腔崩解片、混悬滴剂和口服溶液、干混悬剂等。现将已上市的布洛芬所有剂型情况汇总如下(表8)。
表 8 布洛芬已上市剂型统计
序号 剂型 批准文号数 挂网企业数 1 片剂① 422 21 2 胶囊剂① 37 3 3 颗粒剂① 11 6 4 混悬液① 11 13 5 缓释胶囊① 22 8 6 缓释片① 6 2 7 糖浆剂 6 1 8 颗粒剂(精氨酸布洛芬颗粒) 4 1 9 栓剂(小儿布洛芬栓) 4 2 10 口腔崩解片 3 1 11 软胶囊 3 0 12 搽剂 3 0 13 咀嚼片 2 0 14 分散片 2 0 15 混悬滴剂 2 3 16 口服溶液剂 2 2 17 凝胶剂 2 0 18 乳膏剂 2 0 19 注射液 2 1 20 泡腾片 1 0 21 散剂(精氨酸布洛芬散) 1 0 22 干混悬剂 1 1 23 缓释混悬液 1 1 注:“①”代表基药。 根据调查并向临床医生咨询表8中布洛芬各剂型临床使用情况,发现除了基药收录的颗粒剂和混悬液比较适用于儿童外,非基药剂型如混悬滴剂、糖浆剂、口服液和干混悬剂同样适合儿童使用。但结合表9数据发现,这些剂型的批准文号数相对较少且价格较高,因此认为这些非基药剂型可及性不高。
表 9 布洛芬不同剂型的可及性[中标价(元)]
序号 剂型与规格 批准文号数 2017年 2018年 2019年 医保类别 平均价 中位数 平均价 中位数 平均价 中位数 1 片剂0.2 g① 142 0.32 0.25 0.13 0.10 0.40 0.20 甲类 2 颗粒剂0.2 g① 8 1.11 1.01 1.1 1.17 1.08 1.16 乙类 3 胶囊0.2 g① 37 0.91 0.50 0.35 0.34 0.57 0.49 甲类 4 混悬液1.2 g① 1 8.44 6.50 8.62 7.47 6.57 5.25 乙类 5 缓释片0.3 g① 4 0.75 0.71 0.88 1.00 0.86 0.94 乙类 6 分散片0.2 g 1 0.43 0.40 0.19 0.11 0.43 0.29 无 7 糖浆剂1.2 g 1 19.60 19.60 18.60 18.60 20.15 18.60 无 8 小儿栓剂0.1 g 1 7.83 7.84 7.43 7.39 7.10 7.10 甲类 9 口腔崩解片0.1 g 2 1.72 1.59 1.72 1.61 1.59 1.59 无 10 混悬滴剂0.6 g 2 10.32 9.71 9.73 9.55 9.33 9.55 无 11 口服溶液0.1 g 2 3.23 1.95 2.81 2.35 2.16 1.88 乙类 12 干混悬剂1.2 g 1 16.62 14.43 16.41 14.89 14.48 14.35 乙类 注:“①”代表基药。 在临床使用中,基药剂型中的片剂、胶囊、缓释片和缓释胶囊等剂型适合普通成人患者,颗粒剂和混悬剂适用于儿童和吞咽困难的患者。曹勇[17]曾指出,布洛芬混悬液口感较好,患儿易于接受,这一结果表明,在遴选布洛芬剂型进入基药目录时,已考虑到其作为世界公认的儿童退烧药,其主要针对人群的特点。因此可以认为基药目录已考虑不同患者情况将剂型涵盖完全,根据表8中数据可以看出:在布洛芬现已上市的23种剂型中,6种基药剂型的批准文号数和挂网企业数均占据前6位,说明布洛芬的基药剂型市场供应能力强,体现了临床首选,保障了药品的供应,有利于医联体和分级诊疗等政策的推进。结合表9中数据分析发现,基药剂型的价格明显低于非基药剂型,而且均被纳入医保范围,有效降低了患者负担。以上分析可以看出,基药中布洛芬药品不仅剂型涵盖全面,而且与医保有效衔接,让病患有药可用、用得起药。
2018年版基药目录进一步规范了剂型、规格,体现了临床首选,并考虑了特殊人群,部分药品剂型、规格的收录仍有待商榷,建议基药目录收录药品剂型及规格的遴选应从药品的批准文号数、各省医药采购平台挂网企业数、价格以及特殊人群的临床需要等方面予以综合评价。
Dosage form and specification analysis on electrolytes and antipyretic analgesics in 2018 National Essential Medicines List
-
摘要:
目的 为完善我国基本药物目录中电解质和解热镇痛药收录药品剂型和规格的遴选标准提供数据参考,以提高该部分药品对儿童的适用性及基本药物的可及性。 方法 通过系统检索电解质及解热镇痛药相关药品上市及价格情况,使用Excel软件对数据进行处理,对不同剂型规格进行对比和分析。 结果 水、电解质及酸碱平衡药共收录8个品种,镇痛、解热、抗炎、抗风湿、抗痛风药共收录16个品种。该部分基药的剂型和规格大多具有批准文号数多、医药采购平台挂网企业多且考虑儿童用药所需的特点,同时这些药品也考虑到了不同剂型、规格之间价格的适宜性,但氯化钾注射液、葡萄糖注射液和对乙酰氨基酚所收录的剂型和规格还有待完善。 结论 基药目录收录药品剂型及规格的遴选应从基药的批准文号数、各省医药采购平台挂网企业数及价格和特殊人群的临床需要综合评价,建议将10 ml:1 g氯化钾注射液、50 ml葡萄糖注射液、对乙酰氨基酚栓剂及滴剂纳入基药目录。 Abstract:Objective To provide data reference for improving the selection criteria of the dosage forms and specifications of the electrolytes and antipyretic analgesics in the Essential Medicines List, and to improve the applicability of these medicines to children and the availability of essential medicines. Methods The market and prices of electrolytes and antipyretic analgesics were retrieved by the system. The data were processed by Excel software, and the different dosage forms were compared and analyzed. Results 8 medication classes were included for adjusting water, electrolytes and acid-base balance, and another 16 classes were analgesic, antipyretic, anti-inflammatory, anti-rheumatic and anti-gout drugs. Those medications were characterized with many registered approval numbers, manufacturers and some considerations for pediatric uses. The proper prices were given for different dosage forms and specifications. There is a room for improvement regarding the specifications of potassium, glucose injections, and acetaminophen preparations. Conclusion The selection of pharmaceutical dosage forms and specifications in the Essential Medicines List should be comprehensively evaluated from the registered approval numbers of base medicines, the manufacturers and related prices in pharmaceutical procurement platforms from various provinces, and the clinical needs for special populations. It is recommended that 10 ml: 1 g potassium chloride injection, 50 ml glucose injection, acetaminophen suppositories and drops were included in the Essential Medicines List. -
疲劳的定义为机体生理过程不能维持其机能在一特定水平上,或不能维持预定的运动强度[1]。由于疲劳的分子机制并不清楚,目前并无真正官方认可的抗疲劳药物。一些天然产物,如人参、红景天、大蒜等,以及营养补充剂,如维生素、矿物质和肌酸等,报道有抵抗肌肉疲劳、提高运动成绩的效应,但是效果缓慢而不显著[2];苯丙胺、莫达非尼、咖啡因等药物虽能快速改善疲劳,但实质为中枢兴奋药,存在成瘾、耐受、改变生物节律等问题[3]。因此,抗疲劳药物的进一步研发,对改善生活质量、提升运动成绩、提高军事作业能力有重要意义。
组织糖原含量与疲劳的发生密切相关[4]。本课题组通过大规模化合物合成和筛选,获得了一个全新小分子化合物HMS-01,可以通过促进肝脏和肌肉组织糖原的储存,改善疲劳后组织损伤,显著增加肌肉耐力,发挥抗疲劳的作用。为了进一步了解HMS-01的药动学特点以及在组织中的分布,本课题组采用液相色谱-串联质谱(LC-MS/MS)技术[5-6],研究建立灵敏、特异的测定血浆等生物样品中HMS-01浓度的分析方法,并开展HMS-01在大鼠体内的药动学研究,为后续药物研发提供理论依据。
1. 仪器与试药
1.1 仪器
Agilent 1290 InfinityⅡ液相色谱仪(Agilent Technologies,美国)、4000 Q-Trap型串联质谱仪(AB Sciex,美国);低温高速离心机(Thermo,德国);XW 80A型涡旋混合器(医大仪器,上海);Mettler AE240十万分之一电子天平(梅特勒-托利多,瑞士);Millipore-Q超纯去离子水净化仪(Millipore,美国)。
1.2 试药
HMS-01(西安秦申嘉合药物研究有限公司,批号HMS-1-1010-3);罗红霉素(Sigma,CAS:2058-46-0);乙腈(色谱纯,Fisher Chemical);甲酸(色谱纯,Fisher Chemical);其他试剂为市售分析纯。
2. 方法与结果
2.1 色谱条件
色谱柱为Gemini C18(50 mm×2.0 mm, 5 μm),流动相:含5 mmol甲酸铵及1 mmol甲酸的水溶液(A)-含1 mmol甲酸的乙腈(B),梯度洗脱,洗脱程序如下:0~2 min,90% A;2~6 min,5% A;6~8 min,90% A。流速:0.35 ml/min,柱温:25 ℃,进样量5μl,运行时间8 min。
2.2 质谱条件
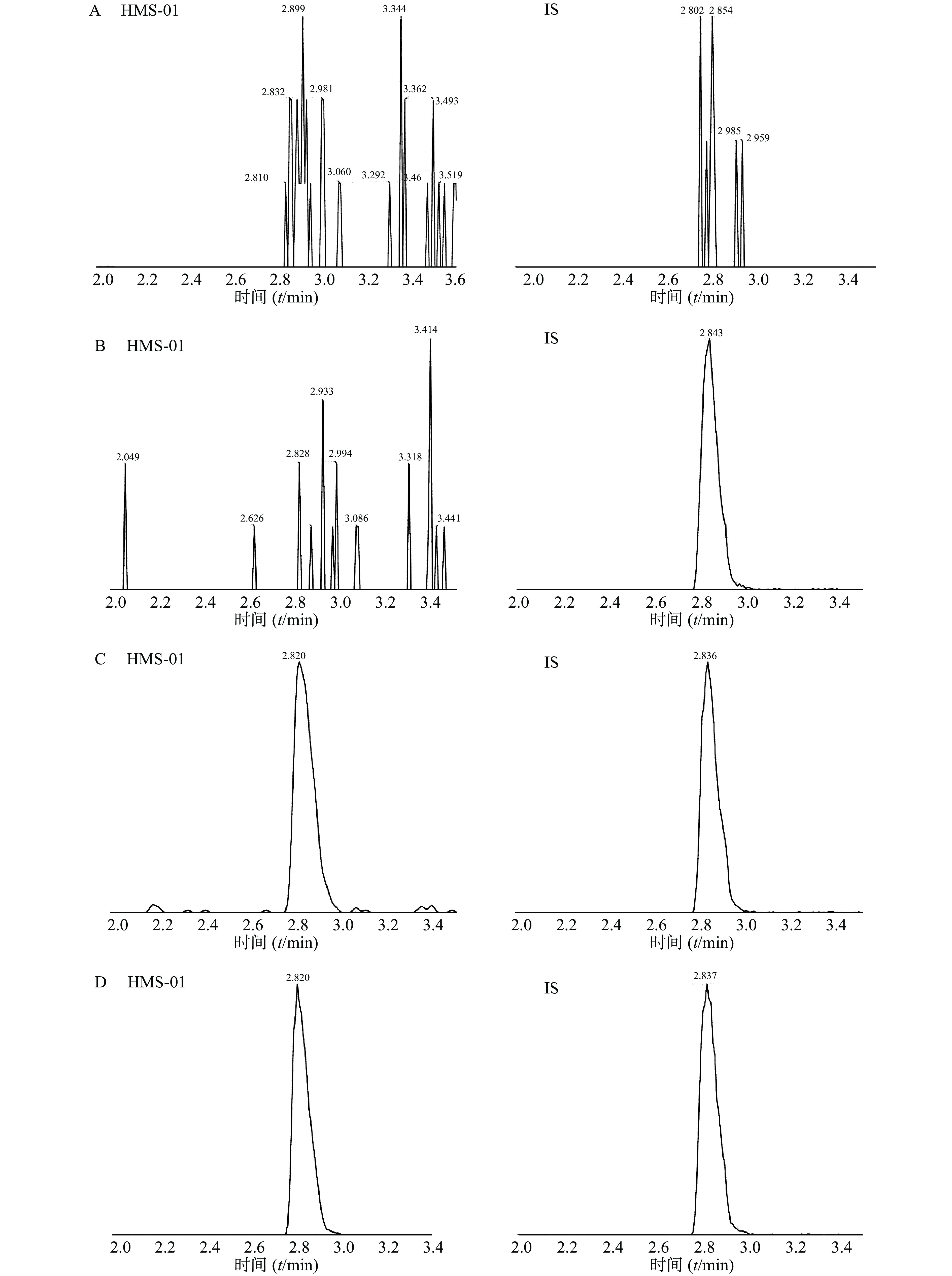
采用ESI正离子模式,多反应离子监测模式(MRM)进行二级扫描;动态反应监测的离子对参数:HMS-01 772.5→614.5;罗红霉素(IS)837.5→158.1。离子源参数设置:干燥气温度350 ℃;干燥气流速10 L/min;雾化器压力40 psi;鞘气温度400 ℃;鞘气流速11 L/min;毛细管电压4 000 V;喷嘴电压500 V。HMS-01保留时间为2.834 min,罗红霉素保留时间为2.839 min,色谱图如图1所示。
2.3 标准曲线溶液的配制和质控样品的制备
精密称取HMS-01对照品772.5 mg,置于10 ml容量瓶中,加甲醇溶解并稀释至刻度,摇匀,得质量浓度为77.25 mg/ml对照品储备液。再采用逐级稀释法配置质量浓度为772.5、386.25、193.125、96.563、48.281、24.141、12.070、6.035、3.018、1.509、0.754 ng/ml的系列含对照品血浆溶液;随行质控样品中HMS-01的低、中、高质量浓度分别为3.09、30.9、618 ng/ml。以上溶液置于4 ℃冰箱备用。
2.4 血浆样品前处理方法
取50 μl血浆样品于离心管中,加入200 μl(含41.875 ng/ml的IS内标)乙腈溶液,涡旋60 s,4 ℃条件下3 000×g离心10 min,取上清液进样。
2.5 线性关系考察
按“2.3”项和“2.4”项中的方法制备标准曲线,平行操作5份,按上述LC-MS/MS条件,连续进样分析,以对照品浓度(X)为横坐标,HMS-01的峰面积与内标的峰面积比值(Y)为纵坐标,进行线性回归,得线性方程:
Y=0.009 3 X+0.005 08, r = 0.999 3,
线性范围为0.976~1 000 ng/ml,以信噪比为3或5时测得HMS-01的最低定量限均为976 pg/ml。
2.6 精密度试验
按“2.3”项和“2.4”项中的方法制备低、中、高3种浓度的质控样品,平行操作5份,连续3 d,计算实测浓度。如表1所示,精密度用相对标准偏差(RSD)表示,结果日内精密度RSD≤12%,日间精密度RSD≤9%;准确度以相对回收率表示,实测浓度与理论加入浓度的比值即为相对回收率。结果表明日内、日间结果准确度范围在87%~106%。
表 1 HMS-01在大鼠血浆中的精密度和准确度(n=5)浓度(ng/ml) 日内 日间 实测浓度(ng/ml) 精密度(%) 准确度(%) 实测浓度(ng/ml) 精密度(%) 准确度(%) 3.09 2.71±0.27 7.7 87.9 2.71±0.27 7.5 87.9 30.9 31.4±4.8 11.8 102 32.6±3.6 8.4 106 618 618±46 5.8 100 618±46 5.4 98.4 2.7 基质效应和提取回收率
按“2.3”项和“2.4”项中的方法制备低、高2种浓度含药血浆,平行操作6份;取空白血浆按“2.4”项下处理,甲醇代替内标溶液,取处理好的空白血浆样品加入相应浓度对照品溶液,使之浓度与待测物的峰面积理论浓度一致,分别制备6份;将待测化合物标准溶液用甲醇稀释,使之与待测物的峰面积理论浓度一致,进样6次。基质效应等于(含基质样品的峰面积)/(80%乙腈溶液的峰面积),提取回收率等于(待测物的峰面积)/(含基质样品的峰面积),考察内标的基质效应和提取回收率操作步骤同上。低、高两种浓度待测物及内标提取回收率均在60%~75%之间,基质效应均在5.6%~6.1%之间,具体结果见表2。
表 2 待测物基质效应和提取回收率(n=6)待测物 浓度(ng/ml) 提取回收率(%) 基质效应(%) HMS-01 3.09 68±3 6.1 618 63±4 5.7 内标 3.35 73±2 6.1 670 73±2 5.6 2.8 稳定性试验
按“2.3”项和“2.4”项中的方法制备低、高2种浓度含药血浆,分别考察样品前处理后室温放置24 h,3次冻融循环以及-70 ℃保存30 d的稳定性,测定样品浓度,计算平均值,并计算RSD(%)及相对偏差RE(%),计算公式:RE%=(实测值−真实值)/真实值×100%。结果见表3。测定结果的RE范围为2%~17%,RSD均小于7%,表明样本稳定性良好。
表 3 样品稳定性(n =3)条件 浓度(ng/ml) RSD(%) RE(%) 室温24 h 3.09 3.7 16.5 618 1.0 2.6 3次冻融循环 3.09 6.7 4.5 618 0.6 5.9 –70 ℃保存30 d 3.06 6.8 8.7 6.18 0.6 10.1 2.9 HMS-01药动学研究
SD大鼠12只,分成2组,每组6只,雌雄各半。给药前禁食12 h,自由饮水。按30 mg/kg的剂量单次灌胃、1 mg /kg的剂量单次静注给药。灌胃给药的,于给药前和给药后5、10、20、30 min和1、1.5、2、4、6、8、10、12、24 h分别眼眶采血约100 µl;静注给药的,于给药前和给药后3、8、15、30 min和1、2、3、4、6、8、10、12、24 h分别眼眶采血约100 µl。血液用1%肝素抗凝,8 000×g离心5 min,分离血浆。–70 ℃保存待测。采血过程冰浴避光,以防止光对药物稳定性产生影响。
大鼠单次静注给予1 mg/kg HMS-01后的药动学参数(非房室模型)总结于表4。大鼠静脉注射1 mg/kg HMS-01后,雄、雌大鼠药动学参数血浆浓度-时间曲线下面积(AUC)、平均清除率(CL)显示有极显著性差异(P<0.01),药动学参数血浆消除半衰期(t1/2)、表观分布容积(V)均呈显著性差异(P<0.05)。雄性大鼠AUC0-t为221 ng·h/ml,CL为4.53 L/h·kg,为大鼠肝脏血流量(约3.3 L/h·kg)的137%,体内清除快, t1/2约为0.786 h,V为5.13 L/kg;雌性大鼠AUC0-t为409 ng·h/ml,CL为2.41 L/h·kg,为大鼠肝脏血流量的73%,体内清除较快, t1/2约为1.27 h,V为3.82 L/kg。
表 4 大鼠静注1 mg/kg HMS-01后血浆药动学参数($ \bar { x}\pm { s}$ ,n=6)性别 AUC0-t (ng·h/ml) AUC0-∞ (ng·h/ml) MRT0-∞ (t/h) t1/2z (t/h) CLz (L/h·kg) Vz (L/kg) cmax (ng/ml) 雄性 221±12.6 221±12.4 0.776±0.022 0.786±0.039 4.53±0.252 5.13±0.388 491±112 雌性 409±23.3** 416±21.0** 1.270±0.115 1.090±0.141* 2.41±0.120** 3.82±0.666* 571±55.1 合计 315±105 319±108 1.030±0.282 0.940±0.193 3.47±1.17 4.47±0.871 531±90.3 大鼠单次灌胃给予30 mg/kg HMS-01后的药动学参数(非房室模型)总结见表5。灌胃给予30 mg/kg HMS-01后,雄、雌大鼠药动学参数AUC显示有极显著性差异(P<0.01),药动学参数CL、F显示有显著性差异(P<0.05)。在大鼠体内血浆浓度达峰时间tmax为1.17 h,达峰浓度cmax为1 243 ng/ml,消除半衰期t1/2为2.00 h。雄、雌大鼠AUC0-t分别为2 271和8 529 ng·h/ml,生物利用度分别为34.3%和69.5%。
表 5 大鼠灌胃30 mg/kg HMS-01后血浆药代动力学参数($\bar { x}\pm { s}$ ,n=6)性别 AUC0-t (ng·h/ml) AUC0-∞ (ng·h/ml) MRT0-∞ (t/h) t1/2z (t/h) tmax (t/h) CLz/F (L/h·kg) Vz/F (L/kg) cmax (ng/ml) F(%) 雄性 2 271±666 2 279±667 2.58±0.156 1.43±0.130 1.17±0.289 14.00±4.31 28.5±7.04 729±263 34.3±10.1 雌性 8 529±1 920** 9 071±1 529** 4.79±1.39 2.58±1.060 1.17±0.289 3.38±0.629* 13.1±7.78 1757±584 69.5±15.6* 合计 5 400±3 661 5 675±3 867 3.68±1.50 2.00±0.924 1.17±0.258 8.69±6.44 20.8±10.7 1 243±694 51.9±22.6 3. 讨论
HMS-01在大鼠体内的药动学过程存在显著的性别差异。口服吸收的比较,雌性大鼠的生物利用度远高于雄性,体内的清除速率方面,雌性比雄性慢,与此同时,HMS-01在雌性体内的半衰期也更长。存在性别差异的原因有待进一步深入研究。本实验采用的分析方法的特异性、灵敏性、准确性、精密度及稳定性均满足定量分析的要求。鉴于HMS-01在大鼠血浆中不稳定的情况,在做动物实验时,课题组将采取以下措施:全血采集后立刻在4 ℃下离心2 min获取血浆,随即立刻取50 µl血浆样品加入至200 µl含内标的乙腈中,从而阻断血浆中的水解酶对化合物进行水解。
-
表 1 氯化钾注射液的可及性
氯化钾注射液规格 批准文号数 挂网企业数 2017年中标价格(元) 2018年中标价格(元) 2019年中标价格(元) 平均值 中位数 平均值 中位数 平均值 中位数 10 ml∶1.5 g① 16 10 0.99 0.95 1.34 0.80 2.80 1.44 10 ml∶1 g 85 26 0.76 0.50 0.86* 0.52 1.62* 0.84 注:“①”代表基药;*P<0.05,与基药规格比较。 表 2 部分省份氯化钾注射液中标价格(元)
药品规格 省份 2017年 2018年 2019年 平均价 中位数 平均价 中位数 平均价 中位数 10 ml∶1.5 g① 辽宁 1.15 1.11 1.64 1.64 0.85 0.85 湖南 0.45 0.45 − − 0.57 0.45 广西 − − 5.95 5.95 10.20 15.00 10 ml∶1 g 辽宁 0.66 0.63 0.82 0.59 0.29 0.29 湖南 0.49 0.21 0.54 0.21 0.39 0.22 广西 1.72 1.80 1.17 0.80 2.83 2.40 注:“①”代表基药;“−”代表未查询到该价格。 表 3 葡萄糖注射液的可及性
规格 批准文号数 挂网企业数 2017年(元) 2019年(元) 平均价 中位数 平均价 中位数 50 ml 125 31 4.14 3.70 3.06 2.72 100 ml① 414 58 4.22 3.90 2.60 2.08 250 ml① 476 57 5.64 5.12 − − 注:“①”代表基药;“−”代表未查询到该价格。 表 4 对乙酰氨基酚上市剂型统计
序号 剂型 批准文号数 挂网企业数 1 片剂① 921 43 2 栓剂 55 4 3 口服溶液剂① 25 5 4 注射液 17 0 5 胶囊剂 12 1 6 颗粒剂① 11 1 7 滴剂 9 4 8 糖浆剂 9 0 9 灌肠剂 8 0 10 颗粒剂 7 1 11 泡腾片 5 1 12 咀嚼片 5 0 13 干混悬剂① 4 2 14 缓释片 2 2 15 分散片 2 0 16 口腔崩解片 2 0 17 混悬液① 2 1 18 片剂 1 1 19 软胶囊 1 0 20 丸剂 1 0 21 混选滴剂 1 0 22 口服混悬剂 1 0 23 凝胶剂 1 0 24 制剂中间体 1 0 注:“①”代表基药。 表 5 对乙酰氨基酚不同剂型的可及性[中标价(元)]
剂型与规格 批准文号数(个) 2017年 2018年 2019年 医保类别 平均价 中位数 平均价 中位数 平均价 中位数 口服溶液100 ml∶2.4 g① 17 11.19 10.54 11.71 12.71 12.03 12.71 乙类 颗粒0.1 g① 2 1.00 1.00 0.42 0.42 0.45 0.43 甲类 干混悬剂1.01 g∶0.3 g① 1 1.93 1.75 1.93 1.67 1.73 1.66 乙类 栓剂0.3 g 21 0.88* 0.31 0.85*# 0.60 0.70* 0.41 乙类 栓剂0.125 g 1 0.27* 0.18 0.35*# 0.33 0.17* 0.17 乙类 栓剂0.15 g 27 0.80* 0.74 0.65*# 0.40 0.66* 0.28 乙类 滴剂15 ml∶1.5 g(10%) 2 10.37 8.70 8.99△ 8.70 8.49△ 8.69 乙类 泡腾片0.3 g 1 1.97 1.72 1.78 1.68 1.68 1.68 无 分散片0.1 g 2 0.66 0.66 0.63 0.60 0.66 0.66 甲类 糖浆剂100 ml∶2.4 g 5 15.10 14.40 14.40 14.40 14.40 14.40 乙类 咀嚼片0.16 g 2 0.62 0.60 0.59 0.58 0.39 0.39 无 注:“①”表示基药;*P<0.05,与口服溶液剂比较;#P<0.05,与干混悬剂比较;△P<0.05,与口服溶液比较。 表 6 部分省份对乙酰氨基酚中标价格(元)
剂型与规格 省份 2018年 2019年 平均价 中位数 平均价 中位数 口服液100 ml∶2.4 g① 浙江 9.88 8.90 − − 山东 13.05 13.70 11.12 12.89 干混悬剂1.01 g∶0.3 g① 浙江 1.78 1.78 1.71 1.71 山东 1.66 1.66 1.66 1.66 栓剂0.3 g 浙江 0.27 0.27 0.27 0.27 山东 − − 0.53 0.53 栓剂0.125 g 浙江 0.17 0.17 0.17 0.17 山东 − − − − 栓剂0.15 g 浙江 0.20 0.18 0.20 0.18 山东 0.87 1.17 1.20 1.32 滴剂15 ml∶1.5 g(10%) 浙江 9.45 9.45 8.33 8.33 山东 7.97 7.97 7.97 7.97 注:“①”代表基药;“−”代表未查询到该价格。 表 7 对乙酰氨基酚片不同规格的可及性[中标价(元)]
对乙酰氨基酚片规格 批准文号数 挂网企业数 2017年 2018年 2019年 平均价 中位数 平均价 中位数 平均价 中位数 0.5 g① 367 27 0.51 0.17 0.30 0.16 0.62 0.46 0.3 g 411 16 0.24 0.15 0.17 0.11 0.47 0.48 0.1 g 143 0 0.39 0.40 − − 0.35 0.35 注:“①”代表基药;“−”代表未查询到该价格。 表 8 布洛芬已上市剂型统计
序号 剂型 批准文号数 挂网企业数 1 片剂① 422 21 2 胶囊剂① 37 3 3 颗粒剂① 11 6 4 混悬液① 11 13 5 缓释胶囊① 22 8 6 缓释片① 6 2 7 糖浆剂 6 1 8 颗粒剂(精氨酸布洛芬颗粒) 4 1 9 栓剂(小儿布洛芬栓) 4 2 10 口腔崩解片 3 1 11 软胶囊 3 0 12 搽剂 3 0 13 咀嚼片 2 0 14 分散片 2 0 15 混悬滴剂 2 3 16 口服溶液剂 2 2 17 凝胶剂 2 0 18 乳膏剂 2 0 19 注射液 2 1 20 泡腾片 1 0 21 散剂(精氨酸布洛芬散) 1 0 22 干混悬剂 1 1 23 缓释混悬液 1 1 注:“①”代表基药。 表 9 布洛芬不同剂型的可及性[中标价(元)]
序号 剂型与规格 批准文号数 2017年 2018年 2019年 医保类别 平均价 中位数 平均价 中位数 平均价 中位数 1 片剂0.2 g① 142 0.32 0.25 0.13 0.10 0.40 0.20 甲类 2 颗粒剂0.2 g① 8 1.11 1.01 1.1 1.17 1.08 1.16 乙类 3 胶囊0.2 g① 37 0.91 0.50 0.35 0.34 0.57 0.49 甲类 4 混悬液1.2 g① 1 8.44 6.50 8.62 7.47 6.57 5.25 乙类 5 缓释片0.3 g① 4 0.75 0.71 0.88 1.00 0.86 0.94 乙类 6 分散片0.2 g 1 0.43 0.40 0.19 0.11 0.43 0.29 无 7 糖浆剂1.2 g 1 19.60 19.60 18.60 18.60 20.15 18.60 无 8 小儿栓剂0.1 g 1 7.83 7.84 7.43 7.39 7.10 7.10 甲类 9 口腔崩解片0.1 g 2 1.72 1.59 1.72 1.61 1.59 1.59 无 10 混悬滴剂0.6 g 2 10.32 9.71 9.73 9.55 9.33 9.55 无 11 口服溶液0.1 g 2 3.23 1.95 2.81 2.35 2.16 1.88 乙类 12 干混悬剂1.2 g 1 16.62 14.43 16.41 14.89 14.48 14.35 乙类 注:“①”代表基药。 -
[1] 中华人民共和国卫生部. 《国家基本药物目录》(2012年版): 卫生部令第93号[EB/OL]. (2013-03-15)[2018-11-09]. http://www.moh.gov.cn/mohywzc/s3580/201303/f01fcc9623284509953620abc2ab189e.shtml. [2] 中华人民共和国国家卫生健康委员会, 中华人民共和国国家中医药管理局. 关于印发国家基本药物目录(2018年版)的通知: 国卫药政发〔2018〕31号[EB/OL]. (2018-10-25)[2018-11-09]. http://www.nhc.gov.cn/yaozs/s7656/201810/c18533e22a3940d08d996b588d941631.shtml. [3] 中华人民共和国国家卫生健康委员会药物政策与基本药物制度司. 国家基本药物目录(2018年版)解读[EB/OL]. (2018-10-25)[2018-11-09]. http://www.nhc.gov.cn/yaozs/s3582/201810/de12303b26a046e49d725f375fb31315.shtml. [4] 张闪闪, 吴天, 张冉, 等. 2018年版《国家基本药物目录》调整解读[J]. 卫生经济研究, 2019(6):47-50. [5] 薛慧颖, 李娟. 解读2018年版《国家基本药物目录》[J]. 医药导报, 2019, 38(1):1-8. [6] 周瑞瑞, 谢晓慧, 陈哲, 等. 第5版和第6版《WHO儿童基本药物标准清单》及其与《国家基本药物目录》(2012年版)的对比分析及启示[J]. 中国新药杂志, 2018, 27(19):2221-2226. [7] 赵瑞玲, 张占慧, 张冠东. CFDA发布的药品不良反应信息通报中儿童用药典型病例分析[J]. 中国药物警戒, 2018, 15(2):121-124. doi: 10.3969/j.issn.1672-8629.2018.02.013 [8] 国家药典委员会. 中华人民共和国药典临床用药须知-化学药和生物制品卷: 2015年版分辑名: 化学药和生物制品卷[M]. 北京: 中国医药科技出版社, 2017. [9] 陈新谦, 金有豫, 汤光. 新编药物学[M]. 18版. 北京: 人民卫生出版社, 2018: 951-952. [10] 魏林林, 许昂, 兰丽, 等. 发热及小儿解热药的运用[J]. 药学与临床研究, 2015, 23(3):283-286. [11] 中华人民共和国人力资源和社会保障部. 关于印发国家基本医疗保险、工伤保险和生育保险药品目录(2017年版)的通知: 人社部发[2017]15号[EB/OL]. (2017-02-21)[2018-11-09]. http:// www.gov.cn/xinwen/2017-02/23/content_5170392.htm. [12] 中华人民共和国国家医保局人力资源社会保障部. 关于印发《国家基本医疗保险、工伤保险和生育保险药品目录》的通知: 医保发〔2019〕46号[EB/OL]. (2019-08-20)[2019-11-09]. http://www.nhsa.gov.cn/art/2019/8/20/art_37_1666.html. [13] 郭春彦, 王晓玲. 我国儿童药物剂型和规格的现状[J]. 儿科药学杂志, 2013, 19(8):53-55. [14] 卢梦情, 陈亮江, 何思瑜, 等. 《国家基本药物目录(2018年版)》中儿童用药的分析与思考[J]. 中国药房, 2019, 30(17):2311-2316. [15] 王晓玲, 郭春彦. 儿童用药剂型与规格的国外现状分析[J]. 中国药学杂志, 2013, 48(17):1316-1320. [16] 张柏枝. 布洛芬和对乙酰氨基酚在小儿感染性发热中的疗效分析[J]. 中国医药指南, 2014, 12(13):151-152. [17] 曹勇. 常见小儿退热药物的儿童药物利用指数评价[J]. 中国药业, 2018, 27(9):89-91. doi: 10.3969/j.issn.1006-4931.2018.09.029 -





 下载:
下载:
 下载:
下载: 

