-
痛风颗粒是上海中医药大学附属岳阳中西医结合医院名老中医夏涵教授的经典经验方,组方精良,仅由茵陈、连钱草和伸筋草三味中药组成,具有清热利湿、通络的功效,临床多用于治疗痛风性关节炎。在前期研究中发现该方对于缓解患者患处的疼痛有显著的效果[1]。疼痛是一种因组织损伤或潜在的组织损伤而产生的痛苦感觉,它既是机体的一种保护性机制,提醒机体避开或处理伤害,也是临床许多疾病的常见症状。本方组成中单味药的研究发现,茵陈[2]、连钱草和伸筋草[3]均有抗炎镇痛的效果。本研究旨在通过痛风颗粒各有效成分及总有效成分对佐剂性关节炎大鼠模型抗炎镇痛作用机制研究,为中药在镇痛方面的研究提供一定的基础和参考依据。
-
健康SD大鼠56只,雄性,SPF级,购自常州卡文斯实验动物有限公司,实验动物生产许可证号SCXK(苏)2016-0010。
-
茵陈、连钱草、伸筋草按1∶1∶1混合,提取总黄酮、总生物碱和总有机酸,所得各部位质量分数均>50%(上海中医药大学中药所);茵陈(上海上药华宇药业有限公司,批号:2017121503);连钱草(批号:171201)、伸筋草(批号:180201)均购自上海同济堂药业有限公司;痛风颗粒(上海中医药大学附属岳阳中西医结合医院委托上海宝龙药业有限公司配制,批号:181001);苯溴马隆(立加利仙,50 mg/片,德国赫曼大药厂,批号:190612)。
-
完全弗氏佐剂(CFA,BioFroxx公司,批号:2203ML010);水合氯醛(上海展云化工有限公司,批号:190920);白细胞介素-6(IL-6)、白细胞介素10(IL-10)、肿瘤坏死因子-α(TNF-α)酶联免疫吸附测定(ELISA)试剂盒(批号:2019101803)购自武汉益承生物科技有限公司。
-
IX71光学显微镜(OLYMPUS);DNM-9602酶标仪(北京普朗新技术有限公司);AC8洗板机(芬兰Thermo Lab systems);TGL-16M离心机(上海卢湘仪离心机仪器有限公司);GNP-9080隔水式恒温培养箱(苏州江东精密仪器有限公司);吉尔森P型移液器(Pipetman)。
-
模型组及对照组大鼠,采用完全弗氏佐剂诱导关节炎大鼠模型[4-5]。取弗氏佐剂(每支10 ml),在冰浴下与卡介苗混合,配制成含卡介苗10 mg/ml的水包油乳剂,对大鼠右后足趾皮下进针至踝关节,注射弗氏佐剂0.1 ml致炎,诱导关节炎发生;空白组于相同位置注射0.1 ml生理盐水。
-
SD大鼠56只,雄性,体重(180±20)g,随机分为空白组、模型组、总黄酮组、总有机酸组、总生物碱组、痛风颗粒组、阳性对照组(苯溴马隆)等7组,每组8只,适应性饲养1周,模型组和对照组进行造模,于造模后第15天开始给药,空白组、模型组每日给予蒸馏水1 ml灌胃;痛风颗粒组给予相当于生药6.88 g/kg的痛风颗粒煎剂;总黄酮组给予相当于生药150 mg/kg的总黄酮提取物;总有机酸组给予相当于生药110 mg/kg的总有机酸提取物;总生物碱组给予相当于生药90 mg/kg的总生物碱的提取物;阳性对照组给予5.25 mg/kg苯溴马隆。每天灌胃一次,连续灌胃30 d。
-
在各组大鼠右后足踝关节上同一位置划一标记线,分别于造模前及造模后第15、25、35、45 d测量并记录各组大鼠右后足的标记线以下足容积(ml3),记录结果,计算足趾肿胀率,[足趾肿胀率=(致炎后足趾体积-致炎前足趾体积)/致炎前足趾体积]。
-
造模后第44天,禁食禁水12 h,末次给药2 h后将大鼠用10%水合氯醛0.3 ml/100 g腹腔注射麻醉后,腹主动脉取血2 ml测定大鼠血常规。
-
将“2.3.2”项下大鼠腹主动脉取血5 ml,静置0.5 h后,4 ℃保存,以3000 r/min,离心10 min,取血清保存于−20 ℃条件下备用。采用ELISA试剂盒测定并计算IL-6、IL-10和TNF-α水平。
-
取大鼠踝关节标本置于10%甲醛溶液固定48 h,置于5%稀硝酸溶液,脱钙48 h;在室温下进行梯度乙醇脱水,二甲苯透明,石蜡包埋,切片后进行HE染色,显微镜下观察大鼠关节组织病理变化。
-
采用SPSS 23.0统计软件进行分析,踝关节肿胀实验采用重复测量和多变量过程分析,计量资料比较采用单因素方差分析,组间均数的两两比较采用最小显著差别(LSD)法,计量资料用平均数±标准差(
$\bar {\rm{x}}$ ±s)表示。 -
由表1所示,与空白组相比,模型组大鼠在造模后第15、25、35、45 天时均有显著性差异(P<0. 01),提示造模成功。与模型组相比,痛风颗粒各有效部位群、痛风颗粒、阳性对照组在第25、35、45 天均具有显著性差异(P<0.01),提示各治疗组能不同程度减轻弗氏佐剂关节炎大鼠的踝关节肿胀程度。造模后第25天,与痛风颗粒组比较,总生物碱组无显著性差异(P>0. 05),提示造模后第25天总生物碱组与痛风颗粒全方组在缓解弗氏佐剂关节炎大鼠的踝关节肿胀程度的疗效上相近。造模后第35天,与阳性对照组比较,痛风颗粒组无显著性差异(P>0.05),提示造模后第35天痛风颗粒组与阳性对照组在缓解弗氏佐剂关节炎大鼠的踝关节肿胀程度的疗效上相近。
表 1 痛风颗粒及其各有效部位群对弗氏佐剂致炎大鼠踝关节肿胀的影响(n=8,
$ {\rm{\bar x}} \pm {\rm{s}}$ )组别 肿胀率(%) 造模前 造模后15 d 造模后25 d 造模后35 d 造模后45 d 空白组 1.57±0.22 6.43±0.21 8.53±0.47 11.79±0.57 10.93±0.55 模型组 1.47±0.29 74.40±1.33* 77.47±1.59* 72.71±1.23* 61.91±1.53* 总黄酮组 1.53±0.30 75.50±2.04 68.96±1.96#△▲ 61.53±0.97#△▲ 51.91±1.43#△▲ 总有机酸组 1.46±0.28 75.66±2.22 67.56±1.47#△▲ 63.24±1.30#△▲ 49.50±3.43#△▲ 总生物碱组 1.57±0.33 75.76±2.57 57.37±0.93#▲ 52.16±0.67#△▲ 47.93±1.88#△▲ 痛风颗粒组 1.46±0.24 76.01±1.38 57.15±2.59#▲ 48.10±1.23# 43.10±1.10#▲ 阳性对照组 1.49±0.28 74.53±2.77 52.86±1.17# 47.30±0.97# 37.58±1.56# *P<0.01,模型组与空白组比较;#P<0.01,各治疗组与模型组比较;△P<0.01,各有效部位群组与痛风颗粒组比较;▲P<0.01,痛风颗粒及各有效部位群组与阳性对照组比较。 -
由表2所示,痛风颗粒各有效部位群对致炎大鼠血液中白细胞计数(WBC)影响结果提示,总有机酸组、总生物碱组、痛风颗粒组及阳性对照组大鼠血液中白细胞计数有下降的趋势,但与模型组比较,无显著性差异(P>0.05)。痛风颗粒各有效部位群对致炎大鼠血液中中性粒细胞百分比(N%)的影响结果提示,总黄酮组、痛风颗粒组和阳性对照组大鼠血液中中性粒细胞百分比含量有下降的趋势,但与模型组比较,无显著性差异(P>0.05)。
表 2 痛风颗粒及其各有效部位群对弗氏佐剂致炎大鼠血液中白细胞计数及中性粒细胞百分比的影响(n=8,
$ {\rm{\bar x}} \pm {\rm{s}}$ )组别 WBC(×109/L) N(%) 空白组 4.45±0.40 28.05±5.30 模型组 5.52±0.75 31.17±4.41 总黄酮组 5.13±1.67 26.80±3.31 总有机酸组 4.70±1.07 29.05±5.95 总生物碱组 4.62±1.51 29.63±7.00 痛风颗粒组 4.52±0.87 26.35±4.82 阳性对照组 4.48±0.92 26.32±2.62 -
由表3所示,与空白组比较,模型组对弗氏佐剂致炎大鼠血清中IL-6、IL-10和TNF-α的含量有显著性差异,有统计学意义(P<0.01),提示造模成功。与模型组比较,各组均有显著性差异(P<0.05,P<0.01),提示痛风颗粒各有效部位群能显著降低模型大鼠的血清IL-6、TNF-α水平,升高IL-10水平。大鼠血清IL-6、TNF-α水平与阳性对照组比较,总黄酮组、总有机酸组和总生物碱组有显著性差异(P<0.05,P<0.01),痛风颗粒组无显著性差异(P>0.05),提示痛风颗粒组降低大鼠血清IL-6、TNF-α水平与阳性对照组相似。大鼠血清IL-10水平,与阳性对照组比较,总黄酮组、总有机酸组有显著性差异(P<0.01),总生物碱组和痛风颗粒组无显著性差异(P>0.05),提示总生物碱组和痛风颗粒组在升高IL-10水平上与阳性对照组疗效相似。
表 3 痛风颗粒及其各有效部位群对弗氏佐剂致炎大鼠血清中IL-6、IL-10和TNF-α的影响(n=8,
$ {\rm{\bar x}} \pm {\rm{s}}$ )组别 IL-6(ng/L) TNF-α(ng/L) IL-10(ng/L) 空白组 96.46±14.39 57.96±6.68 62.93±2.10 模型组 191.58±9.04** 136.03±9.16** 34.29±2.98** 总黄酮组 141.04±12.45##△△ 98.37±6.46##△△ 37.87±3.43#△△ 总有机酸组 154.11±9.47##△△ 97.59±5.18##△△ 38.07±5.55#△△ 总生物碱组 110.65±7.40##△ 85.33±8.06##△△ 50.62±1.97## 痛风颗粒组 98.84±8.55## 65.14±4.96## 48.15±2.97## 阳性对照组 97.35±13.63## 58.95±8.61## 47.63±1.88## **P<0.01,模型组与空白组比较;#P<0.05,##P<0.01,各治疗组与模型组比较;△P<0.05,△△P<0.01,痛风颗粒及各有效部位群组与阳性对照组比较。 -
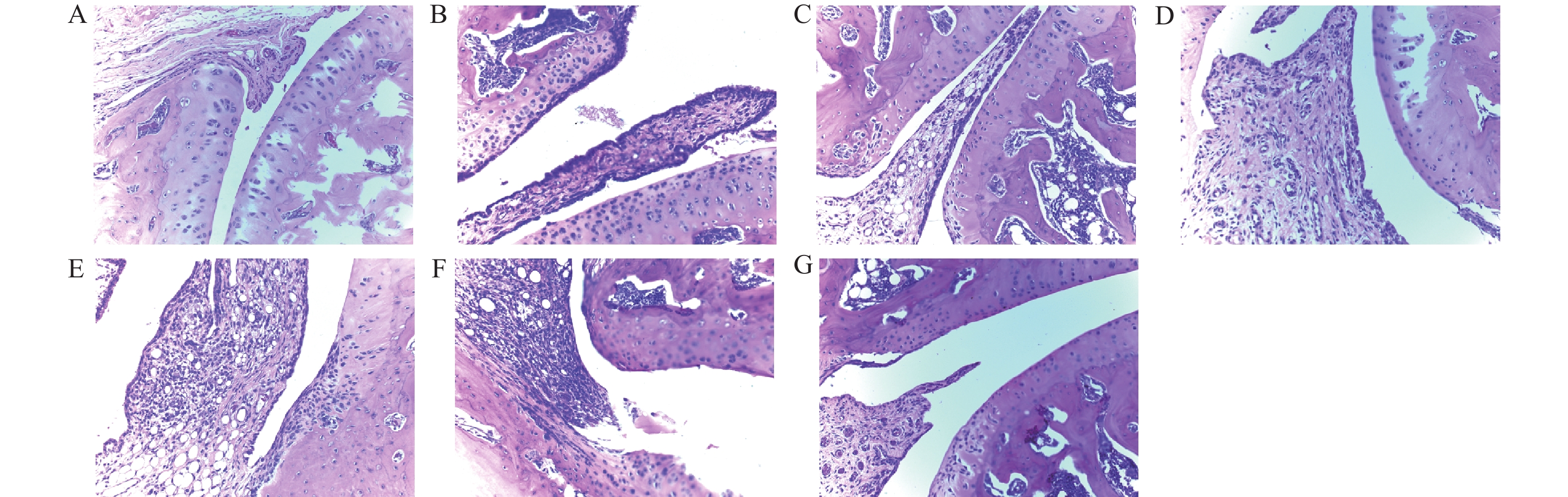
由图1所示,正常组大鼠骨、骨关节、滑膜组织未见明显病理性改变,滑膜组织结构清晰,无炎性细胞浸润。模型组骨关节表面软骨破坏,大量纤维组织增生、滑膜增生,炎细胞浸润。与模型组比较,总黄酮组骨关节表面软骨破坏、纤维组织增生减轻、滑膜水肿;总有机酸组骨关节表面软骨破坏和纤维组织增生减轻;总生物碱组骨关节表面软骨破坏,纤维组织增生减轻;痛风颗粒组骨关节软骨无异常,滑膜细胞增生和周围软组织炎症减轻;阳性对照组骨关节表面软骨破坏和纤维组织增生减轻,滑膜仅有轻度增生。
-
痛风是一组嘌呤代谢异常的疾病,其临床特征多表现为关节红肿,疼痛难忍,且多反复性发作[6]。在中医学中类似于“痹证”“历节”等病症,多为因内伤气血亏虚,外感风寒湿邪,以致痰瘀流注筋脉,久病入络,痹阻关节所致[7]。痛风颗粒中以茵陈作为君药,有通利关节、清利湿热的功效;臣药连钱草,具有利湿通淋、清热解毒、散瘀消肿的功效,取其消石之功,防止痛风性尿路结石的产生;伸筋草有除湿消肿、舒筋活络的功效。三药配伍可以增强清利湿热、通络的作用。
本研究结果显示,痛风颗粒及其各有效部位群能明显抑制佐剂性关节炎大鼠的踝关节肿胀,用药25 d后,总生物碱组对大鼠肿胀率的抑制率与痛风颗粒全组方组接近,研究表明伸筋草中的生物碱类主要有石松碱(lycopodine)型、石松定碱(lycodine)型和法氏石松碱(fawcettimine)型三种[8],可通过免疫调节机制对佐剂性关节炎发挥治疗作用[9],这与课题组对伸筋草中生物碱的研究结果相一致[10]。用药第35天,痛风颗粒组与阳性对照组在缓解弗氏佐剂关节炎大鼠的踝关节肿胀程度的作用上相似,这与痛风颗粒在临床使用的结果相一致[11]。用药45 d后,痛风颗粒及其有效部位群均能不同程度降低弗氏佐剂关节炎大鼠的关节肿胀,关节炎的病理变化表现在滑膜细胞的炎性浸润,各治疗组病理形态学结果提示痛风颗粒组和阳性对照组能减轻滑膜细胞增生,总黄酮组、总有机酸组和总生物碱组能减轻纤维组织增生,这与关节肿胀实验结果相一致,提示痛风颗粒及其有效部位群对弗氏佐剂关节炎大鼠具有抗炎镇痛的作用。
各组关节炎大鼠白细胞计数及中性粒细胞百分比无显著性差异,但经痛风颗粒及其各有效部位群干预后,均有不同程度的下降趋势。这可能是由于WBC和N%的测定在造模后第45天进行,大鼠的炎症反应有所降低,而致该炎性指标不敏感,在今后的实验设计中宜进一步进行分时检测。
当痛风由急性期转变为慢性期时,会出现关节损害[12]。其机制可能与破骨细胞数量增多有关[13],核转录因子-κB受体(RANK)与核因子κB活化因子配体(RANKL)结合情况对破骨细胞的生成具有密切的联系[14]。促炎细胞因子如IL-6有致痛和痛觉增敏的作用,在痛风时和间质浸润中表达增高,可导致痛风性关节炎的加重;促炎因子TNF-α是关节炎早期的关键调控因子,其水平升高能引起滑膜炎症和关节破坏[15];抗炎因子IL-10具有抑制促炎细胞因子的产生[16]及下调促炎因子受体表达的作用。因此,降低血清TNF-α、IL-6[17],升高IL-10含量能减弱对疼痛传入神经系统的刺激,达到抗炎镇痛的作用。本研究采用ELISA法测定血清TNF-α、IL-6和IL-10分泌水平,模型组大鼠的TNF-α、IL-6水平显著升高、IL-10水平显著降低,各治疗组能抑制TNF-α、IL-6的分泌,促进IL-10的生成,从而减少关节的炎症产生和减轻关节组织的破坏。结果表明痛风颗粒及其有效部位群可能通过促炎因子及上调抗炎因子达到保护关节的作用。其中痛风颗粒组和阳性对照组在抑制TNF-α、IL-6分泌的程度相当,表明痛风颗粒全方组的抑制促炎因子作用优于各有效部位群。生物碱组和痛风颗粒组在上调IL-10的作用程度相当,说明生物碱的上调抗炎因子作用与全方组相当。有研究表明,生物碱类成分能够激活NF-κB信号通路,促使其进入调控下游靶基因如IL-10发挥抗炎作用[18]。
综上所述,痛风颗粒及其有效部位群能通过调控IL-6、TNF-α和IL-10水平来降低炎性因子,达到抗炎镇痛,缓解痛风性关节炎的作用。痛风颗粒的调控要优于各有效部位群,其中总生物碱在调控IL-10水平上不劣于痛风颗粒,但其作用机制较为复杂,有待进一步探究。
Study on the anti-inflammatory and analgesic effects of active fractions of Tongfeng granule on arthritis rats
-
摘要:
目的 通过痛风颗粒各有效部位群对完全弗氏佐剂诱导的关节炎大鼠抗炎镇痛作用差异,探讨痛风颗粒及其各有效部位群可能的抗炎镇痛作用机制。 方法 将健康SD大鼠56只,随机分为空白组、模型组、总黄酮组、总有机酸组、总生物碱组、痛风颗粒组和阳性对照组,除空白组外,其余6组均建立关节炎的病理模型。造模成功15 d后,连续灌胃给药30 d。测定关节炎大鼠的踝关节肿胀、白细胞计数、嗜中性粒细胞百分比、血清白细胞介素6(IL-6)、白细胞介素10(IL-10)以及肿瘤坏死因子-α(TNF-α)水平以及关节组织病理形态学。 结果 与模型组相比,痛风颗粒各有效部位群、痛风颗粒及阳性对照组的踝关节肿胀率均显著下降(P<0.01)。痛风颗粒各有效部位群、痛风颗粒及阳性对照组能减轻纤维组织增生,与模型组相比,痛风颗粒各有效部位群、痛风颗粒及阳性对照组的血液中白细胞计数(WBC)和中性粒细胞百分比(N%)无显著性差异(P>0.05)。与模型组相比,痛风颗粒各有效部位群、痛风颗粒及阳性对照组能显著降低模型大鼠的血清IL-6、TNF-α水平,升高IL-10水平(P<0.05,P<0.01)。 结论 该研究明确了痛风颗粒有效部位群的抗炎镇痛作用,为进一步临床用药和制剂开发提供依据。 Abstract:Objective To investigate the anti-inflammatory and analgesic effects of the active fractions of Tongfeng granules on rats with arthritis induced by complete Freund's adjuvant. Methods 56 SD rats were randomly divided into seven groups, blank group, model group, total flavonoids group, total organic acid group, total alkaloid group, Tongfeng granule group and positive control group. Except for the blank group, the remaining 6 groups established joints pathological model of inflammation. 15 days after the successful modeling, intragastric drug administration was continued for 30 days. The swelling of ankle joint, WBC, N%, IL-6, IL-10, TNF-α and the histopathology of joint were measured. Results Comparing with the model group, each effective fraction group of Tongfeng granules, Gout granules and positive control group decreased the ankle joint swelling rate significantly (P<0.01) and reduced fibrous tissue proliferation. There was no significant difference in WBC and N% of neutrophils. They significantly reduce the level of serum IL-6 and TNF-α, and increase the level of IL-10 (P<0.05, P<0.01). Conclusion This study clarifies the anti-inflammatory and analgesic effects of active fractions of Tongfeng granules and provides a basis for further clinical medication and preparation development. -
Key words:
- gout granule /
- active fractions /
- anti-inflammation /
- analgesia
-
雀梅藤Sageretia thea(Osbeck)Johnst又名雀梅刺、对角刺、碎米子等,为鼠李科雀梅藤属植物,主要分布地区包括云南、安徽、江苏等[1-2]。根、茎、叶均可入药,其性甘、淡、平,具有降气化痰、祛风利湿等功效[3]。民间常用雀梅藤药材煎汤或浸酒内服治疗乳腺肿瘤、淋巴结肿大和水肿等疾病,具有较好效果[4]。现代药理研究表明,雀梅藤具有抗结直肠癌、抗炎、抗氧化、抗病毒、抗菌和肝保护等活性[5-6],但尚未见雀梅藤对乳腺癌等其他肿瘤影响的报道。该研究通过多种体外实验观察雀梅藤对乳腺癌细胞增殖及凋亡的影响,并初步探索其作用机制,以证实民间应用该药材治疗乳腺肿瘤的合理性,为进一步的药物开发奠定基础。
1. 材料和仪器
1.1 试剂和仪器
CCK8 试剂盒(大连美仑生物技术有限公司);Spark酶标仪(瑞士Tecan公司);二氧化碳培养箱(Thermo Fisher);96孔培养板(泰坦);电子分析天平(塞多利斯 BSA2245-CW);细胞计数仪(Corning 6749);倒置相差显微镜(奥林巴斯 IX73)。
1.2 药材提取
雀梅藤药材购自昆明井田药业有限公司,生产许可证号:滇20160155。经海军军医大学药学系生药学教研室辛海量教授鉴定为鼠李科雀梅藤属植物雀梅藤Sageretia thea(Osbeck)Johnst.的茎。取雀梅藤干燥药材660 g,粉碎后用8倍量75%乙醇回流提取3次,每次1.5 h。合并提取液,过滤后回收溶剂,得乙醇提取物。乙醇提取物用水溶解混悬,加入等体积的石油醚萃取3次,收集萃取液,通过旋转蒸发得到石油醚萃取部位。进一步采用真空冷冻干燥机在−80 ℃下冻干,分别称重,获得乙醇和石油醚提取物质量为57 g和0.91 g,提取得率分别为8.63%和0.13%。
1.3 提取物溶解
称取20 mg雀梅藤石油醚提取物溶于1 ml的DMSO溶剂中,然后用培养液稀释成不同药物浓度,药物最高剂量下的DMSO浓度不超过0.3%。同时,对照组培养液中添加0.3%的DMSO作为阴性对照。
1.4 细胞株
三阴性人乳腺癌细胞株MDA-MB-231、BT549购自中国科学院上海细胞库;人脐静脉血管内皮细胞株购自上海赋望实业有限公司。
2. 方法
2.1 细胞活力分析
分别取对数生长期的人三阴性乳腺癌细胞株MDA-MB-231和BT549及人脐静脉血管内皮细胞株(HUVEC)并计数,以每孔5×103个的细胞密度接种到96孔板,在37 ℃的细胞培养箱中过夜培养至细胞贴壁。实验分为对照组和给药组,对照组以正常培养基培养,给药组以不同浓度含药培养基孵育细胞24 h。随后按试剂盒说明书进行操作,每孔加入10%的CCK8试剂,在培养箱中孵育2 h后,用酶标仪在450 nm处检测各孔的吸光度(OD)值。对照组细胞活力换算为100%,其余各给药组按以下公式计算:细胞增殖抑制率(%)=[(对照组A值−实验组A值)/(对照组A值−空白组A值)]×100%。
2.2 平板克隆试验
取上述对数生长期的人三阴性乳腺癌细胞株,以每孔500个细胞的密度均匀接种在12孔板内,过夜,使细胞贴壁,随后加入雀梅藤提取物孵育24 h。吸弃培养基,用含10%的胎牛血清培养基继续培养,当培养皿中出现肉眼可见的克隆形成时,终止培养。吸弃上清液,用PBS小心浸洗,然后甲醇固定。去除固定液,加入适量的结晶紫染色液进行染色,采用PBS多次轻轻洗去周边染色液,干燥后拍照,随后用Image J软件进行统计分析。
2.3 活死细胞分析
将两种乳腺癌细胞接种于96孔板,放置培养箱中过夜,随后加入提取物孵育24 h。吸弃培养基,用PBS温和洗涤细胞一次,每孔加入100 μl的Calcein AM/PI染色工作液,放入37 ℃培养箱中避光孵育15 min后,用高内涵系统采集图像。
2.4 细胞周期分析
取对数生长期乳腺癌细胞株,以每孔40万个细胞接种于6孔板,培养箱中过夜,待细胞贴壁后,用含不同浓度提取物的培养基处理24 h,消化,离心收集细胞,以预冷的70%乙醇混悬固定过夜。离心,去除乙醇,用PBS清洗一次,加入500 μl的碘化丙啶染色工作液,避光染色30 min后用流式细胞仪分析细胞周期。
2.5 流式凋亡分析
将对数生长期的三阴性乳腺癌细胞株以每孔40万个接种于6孔板中,过夜,待细胞贴壁后,用含不同浓度提取物的培养基孵育24 h。消化,离心收集细胞,用100 μl的1×结合缓冲液混悬后加入FITC Annexin V 和PI各5 μl,轻微振荡,室温下避光孵育15 min,流式细胞仪分析凋亡率。
2.6 DAPI染色分析
将上述对数生长期的人三阴性乳腺癌细胞株以每孔20万个接种于6孔板,过夜,待细胞贴壁后,用含不同浓度提取物的培养基孵育24 h,吸弃培养基,每孔加入1 ml稀释过的DAPI染液孵育细胞10 min,PBS清洗2遍后采用Cytation 5拍照。
2.7 线粒体膜电位(MMP)分析
将对数生长期的人三阴性乳腺癌细胞株以每孔20万个接种于6孔板,过夜,待细胞贴壁后,用含不同浓度提取物的培养基孵育细胞24 h。吸弃培养液,PBS洗涤细胞之后每孔加入1 ml的JC-1染液,在37 ℃培养箱中孵育20 min。吸除上清液,用缓冲液洗涤细胞3次后加入2 ml细胞培养液,高内涵系统拍照。
2.8 活性氧(ROS)含量检测
取上述对数生长期细胞株,以每孔20万个的细胞密度接种于6孔板,过夜,待细胞贴壁后,用含不同浓度提取物的培养基孵育24 h。吸弃培养基,每孔加入1 ml含DCFH-DA的新鲜培养基孵育细胞20~30 min,DAPI复染,采用高内涵系统拍照。
2.9 统计学处理
使用Graphpad Prism 8.0.1分析软件对所获得的实验数据进行统计学分析,组间比较采用单因素方差分析,两组比较采用t检验,以P<0.05为差异有统计学意义。
3. 结果
3.1 抑制乳腺癌细胞生长
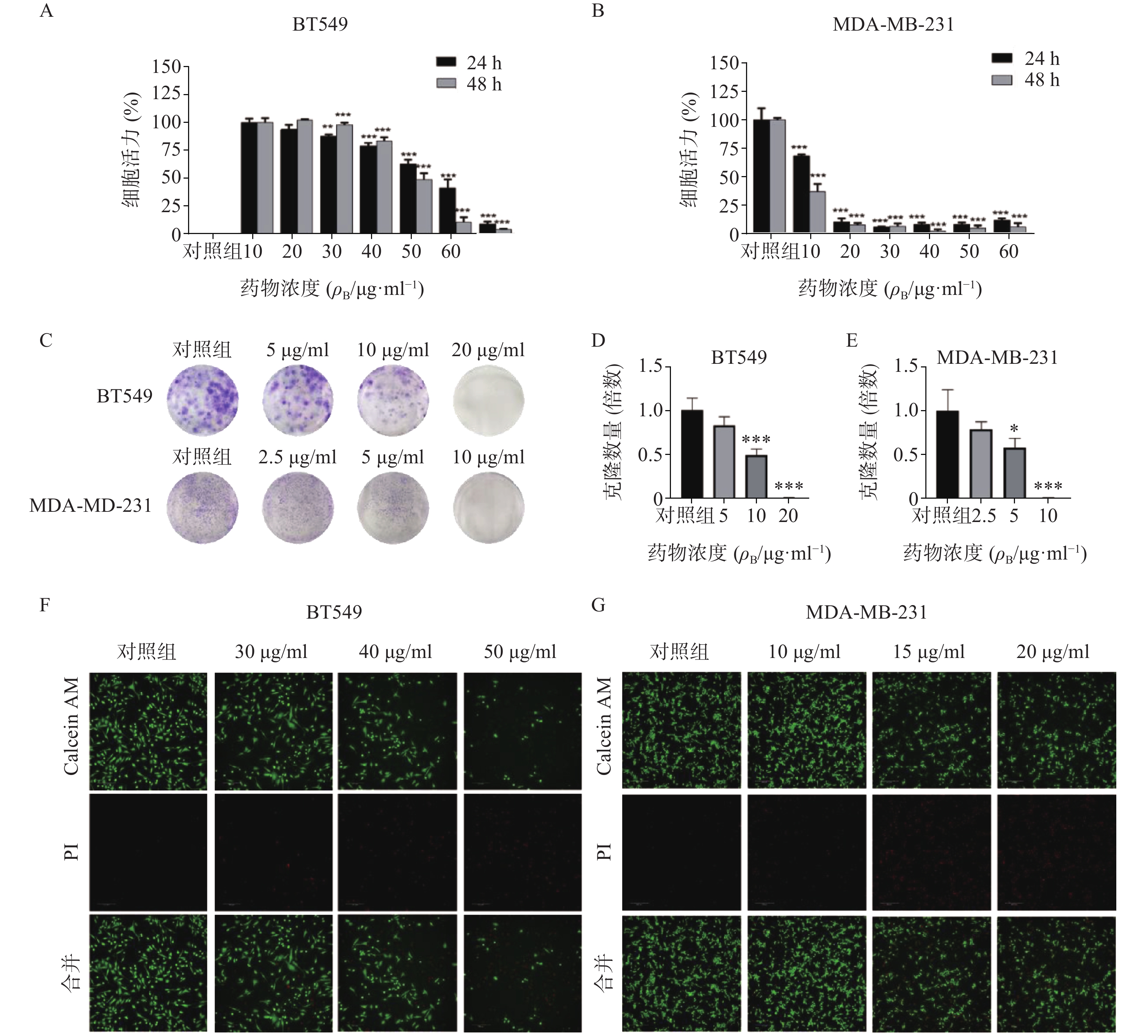
通过细胞活力分析发现,雀梅藤石油醚提取部位对多种癌细胞均有明显细胞毒性,其中对乳腺癌细胞株抑制作用最强,而且明显强于乙醇提取物。结合临床应用,实验选择两种人三阴性乳腺癌系(BT549和MDA-MB-231)进一步研究(见图1)。CCK8结果表明(图1A-B),雀梅藤石油醚提取物以剂量和时间依赖的方式抑制乳腺癌细胞活力,作用24 h和48 h的IC50值分别为45.40、12.23 μg/ml和38.87、7.60 μg/ml。平板克隆实验结果显示(图1C-E),随着雀梅藤石油醚提取物剂量的增加,两种乳腺癌细胞生长均被显著抑制。浓度分别在10 μg/ml和20 μg/ml时,MDA-MA-231和BT549细胞株的生长被完全抑制。Calcein AM/PI活死细胞染色显示(图1F-G),随着药物剂量增加,活细胞(绿色)数量较对照组显著减少,而死亡细胞(红色)数量则显著增加,与对照组比较有极显著差异。
3.2 诱导乳腺癌细胞周期阻滞
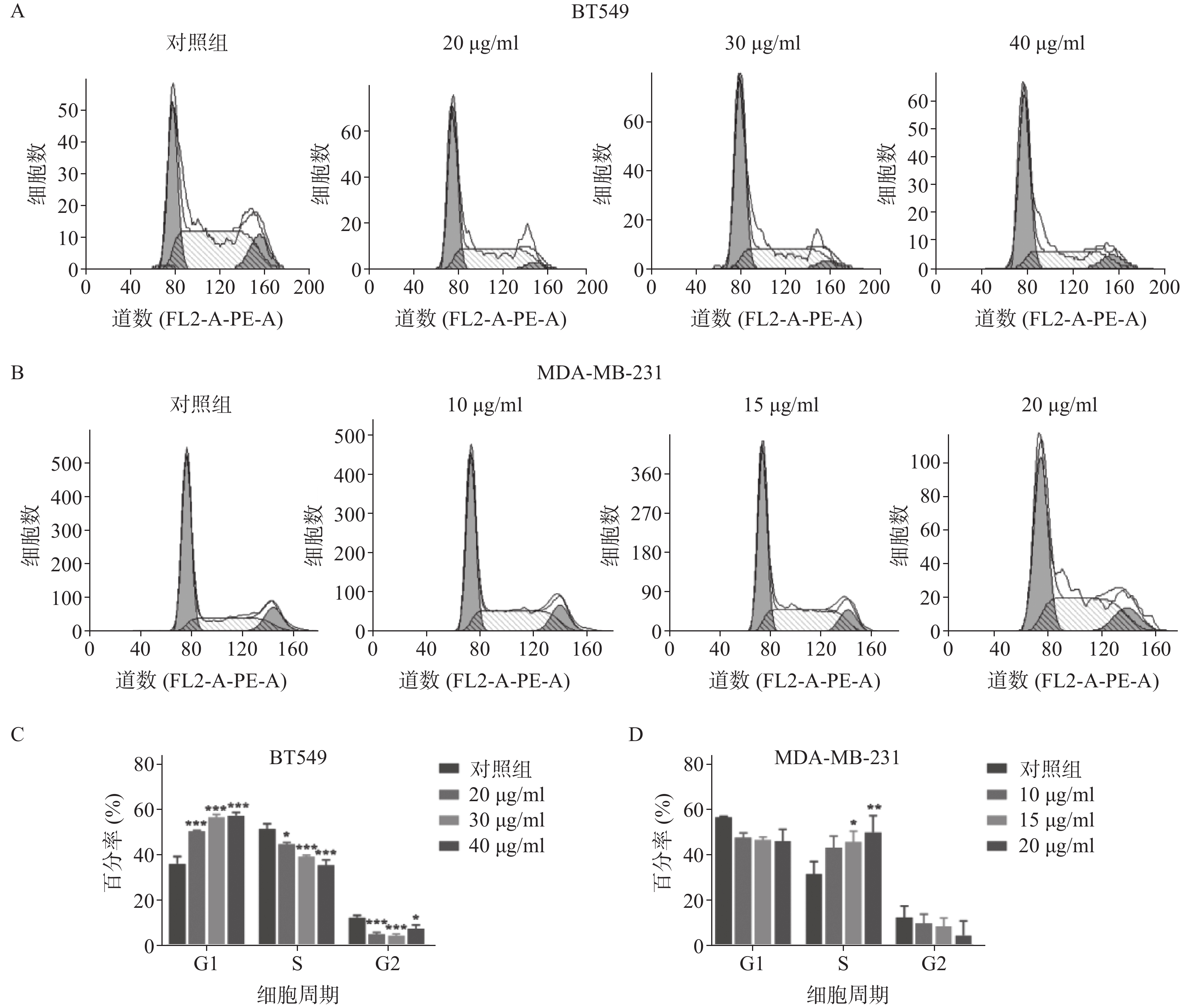
雀梅藤石油醚提取物孵育乳腺癌细胞24 h后,采用流式细胞仪测定细胞的增殖周期情况(见图2)。结果显示,药物明显阻滞两种乳腺癌细胞株的细胞周期,但对两种细胞阻滞周期不同,BT549细胞阻滞在G1期(图2A和2C,给药组G1期细胞比率较对照组显著升高),MDA-MA-231细胞阻滞在S期(图2B和2D,给药组S期细胞比率较对照组显著升高),提示石油醚提取物对两种细胞株的细胞周期阻滞可能存在不同机制。
3.3 诱导乳腺癌细胞凋亡
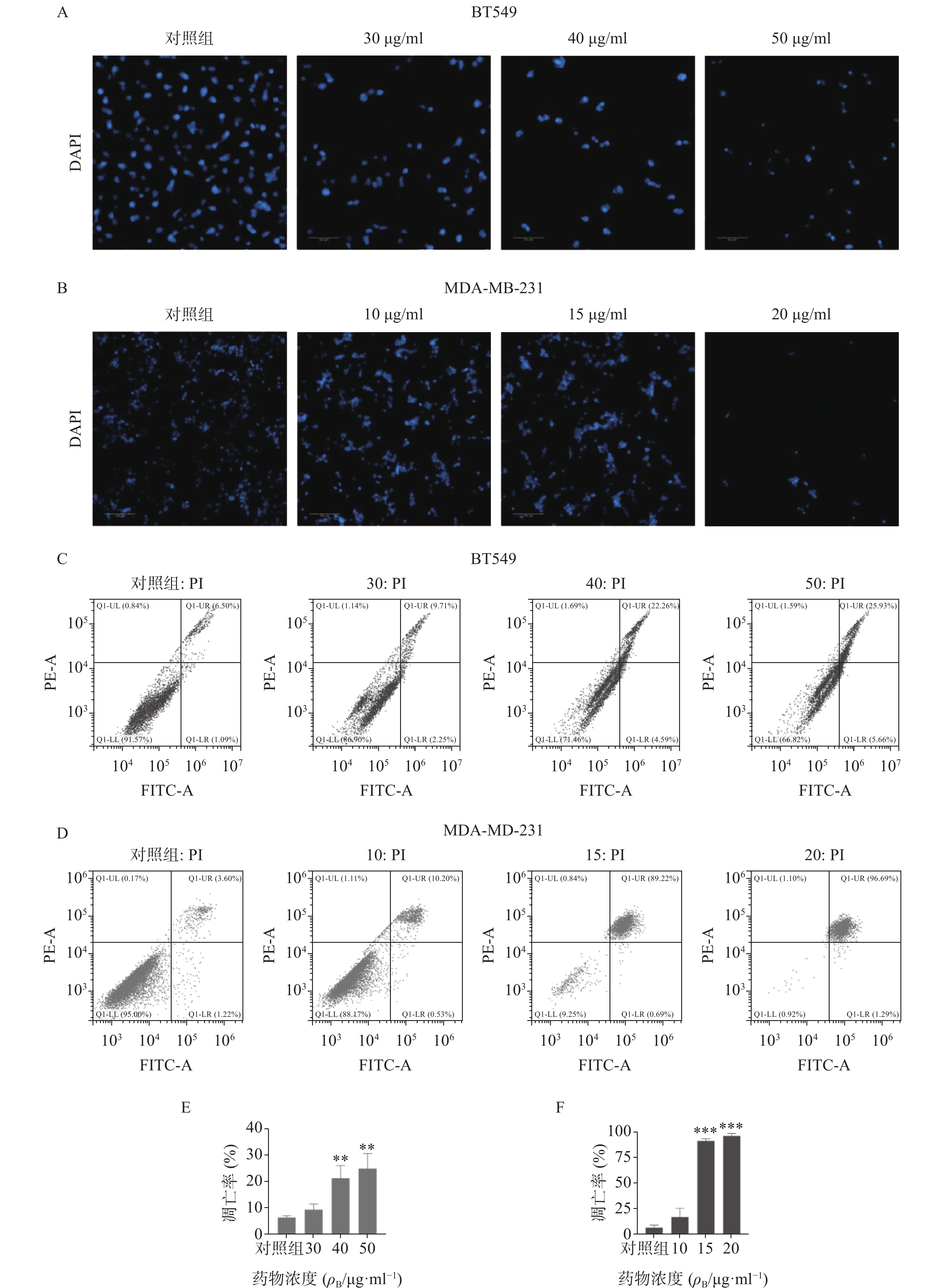
采用DAPI染色方法对细胞核形态进行分析(见图3)。如图3A-B所示,正常对照组乳腺癌细胞核呈均匀的圆形浅蓝色,药物处理后细胞核质固缩或碎裂成凋亡小体,且呈剂量依赖性。流式细胞仪凋亡定量分析显示(图3C-F),石油醚提取物显著增加两种乳腺癌细胞的凋亡率,与对照组比较有显著性差异,其中尤以MDA-MA-231细胞株明显,20 μg/ml浓度下几乎诱导细胞全部凋亡。
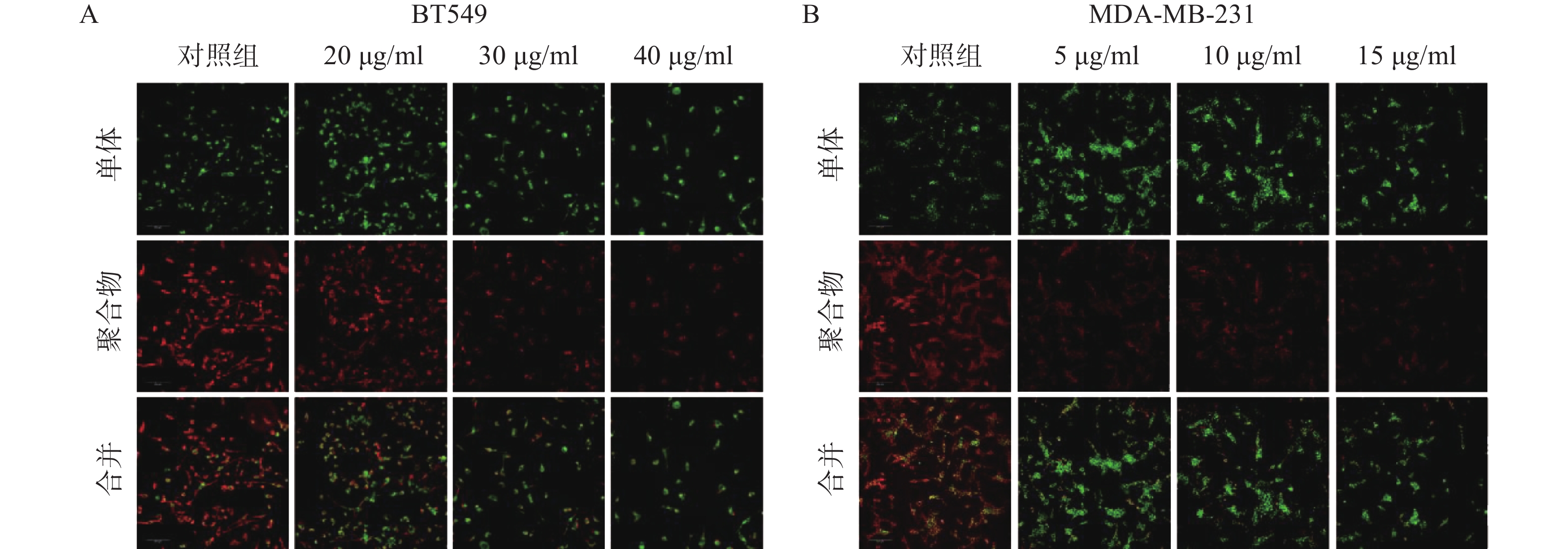
3.4 诱导线粒体膜电位坍塌
线粒体通路是肿瘤细胞最常见的凋亡途径,最典型的特征是线粒体膜电位(MMP)水平显著下降。因此,研究采用JC-1免疫荧光染色检测线粒体膜电位水平。结果如图4所示,给药组红色荧光随剂量增加明显减弱,绿色荧光则明显增强,说明给药组线粒体膜电位显著下降。实验结果提示,雀梅藤石油醚提取物可能通过损伤线粒体而促进了乳腺癌细胞凋亡。
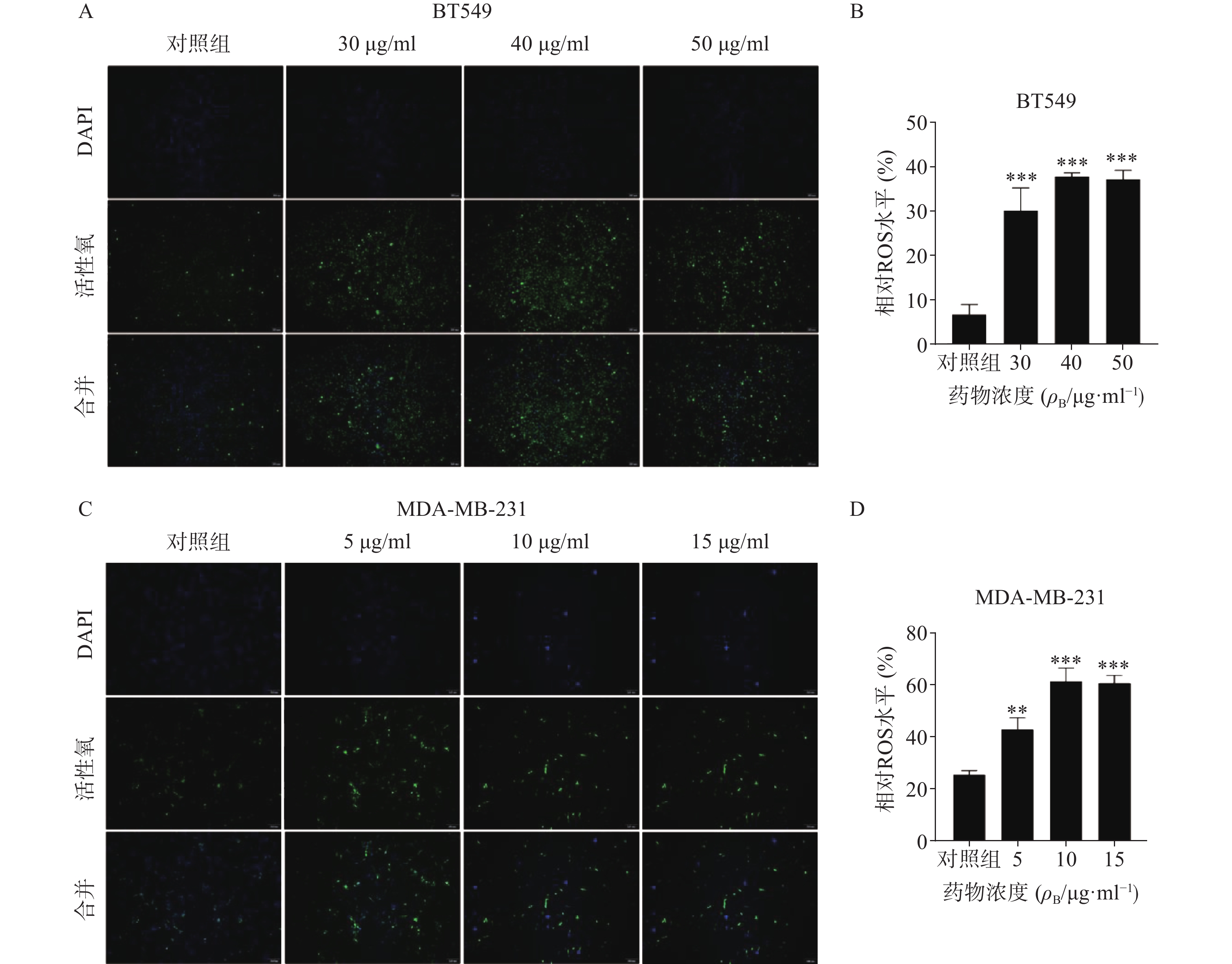
3.5 促进乳腺癌细胞活性氧生成
ROS升高是激活线粒体通路诱导肿瘤细胞凋亡的重要原因之一,因此进一步检测了药物处理24 h后ROS含量变化(图5)。结果代表ROS水平的绿色荧光在对照组仅有少量表达,而在给药组则显著增加,经统计学处理有显著性差异,其中尤以BT549细胞株明显,提示药物可能通过促进ROS生成而诱导了乳腺癌细胞凋亡。
3.6 对正常血管内皮细胞活力的影响
为了确定雀梅藤提取物是否对正常细胞产生毒性,进一步采用同样剂量对人正常脐静脉血管内皮细胞(HUVEC)进行CCK8细胞活力分析。结果提取物孵育24 h后,即使在60 μg/ml的最高浓度下亦未观察到内皮细胞活力受到影响,与对照组比较无明显差异(图6),提示雀梅藤石油醚提取物对正常细胞并不产生毒性,具有较好的安全性。
4. 讨论
雀梅藤为云南等地民间常用中药,临床观察发现其对乳腺瘤生长有明显抑制作用[7],且毒性较小[4, 8]。研究前期对雀梅藤的乙醇、石油醚、乙酸乙酯、二氯甲烷、正丁醇等5个部位提取物进行了多种肿瘤细胞活性筛选,结果显示,对多数癌细胞,如乳腺癌、结肠癌、肝癌等,都具有明显杀伤作用,其中以石油醚部位提取物对癌细胞作用最为显著。进一步实验发现,雀梅藤石油醚提取物时间和剂量依赖地抑制乳腺癌细胞活力,显著减少细胞克隆形成率,阻滞细胞周期在G1/S期,明显增加癌细胞凋亡率,但并不影响正常血管内皮细胞活力,提示其细胞毒性具有明显的选择性。
引起细胞凋亡的途径包括线粒体通路、死亡受体通路和内质网应激通路,其中线粒体通路是药物诱导肿瘤细胞凋亡的最常见途径[9],因此研究人员进一步观察了雀梅藤石油醚提取物是否通过损伤线粒体诱导乳腺癌细胞凋亡。结果通过JC-1染色发现,两种乳腺癌细胞的线粒体膜电位均显著降低,提示雀梅藤提取物诱导了细胞线粒体途径的凋亡。
ROS的主要来源之一是线粒体内膜的呼吸链底物端,ROS升高会引起线粒体内膜损伤,造成细胞毒性,从而促进肿瘤细胞凋亡[10]。研究人员用荧光探针方法检测雀梅藤石油醚提取物孵育BT549和MDA-MB-231细胞后的ROS水平,结果发现代表ROS的绿色荧光逐渐增强,表明石油醚提取物显著升高了线粒体内ROS水平。这些结果提示,石油醚提取物可能通过升高线粒体内ROS水平,造成ROS累积,损伤了线粒体,导致线粒体内容物如细胞色素c等流出到细胞质,进而激活caspase级联瀑布反应,从而诱导了细胞凋亡[9,11]。
虽然雀梅藤提取物在体外研究中表现出较好的抗乳腺癌细胞生长作用,但是凋亡信号转导通路和作用靶点尚不明确,线粒体中蛋白表达的变化犹未可知,因此具体作用机制尚需进一步研究。此外,已有研究人员从雀梅藤药材中鉴定出43种化学成分,可分为有机酸类、黄酮类及其他类,有机酸类包括儿茶素及其衍生物等,黄酮类包括异槲皮素等[12]。但是雀梅藤提取物中究竟何种成分发挥主要抗癌作用仍需进一步证实。
-
表 1 痛风颗粒及其各有效部位群对弗氏佐剂致炎大鼠踝关节肿胀的影响(n=8,
$ {\rm{\bar x}} \pm {\rm{s}}$ )组别 肿胀率(%) 造模前 造模后15 d 造模后25 d 造模后35 d 造模后45 d 空白组 1.57±0.22 6.43±0.21 8.53±0.47 11.79±0.57 10.93±0.55 模型组 1.47±0.29 74.40±1.33* 77.47±1.59* 72.71±1.23* 61.91±1.53* 总黄酮组 1.53±0.30 75.50±2.04 68.96±1.96#△▲ 61.53±0.97#△▲ 51.91±1.43#△▲ 总有机酸组 1.46±0.28 75.66±2.22 67.56±1.47#△▲ 63.24±1.30#△▲ 49.50±3.43#△▲ 总生物碱组 1.57±0.33 75.76±2.57 57.37±0.93#▲ 52.16±0.67#△▲ 47.93±1.88#△▲ 痛风颗粒组 1.46±0.24 76.01±1.38 57.15±2.59#▲ 48.10±1.23# 43.10±1.10#▲ 阳性对照组 1.49±0.28 74.53±2.77 52.86±1.17# 47.30±0.97# 37.58±1.56# *P<0.01,模型组与空白组比较;#P<0.01,各治疗组与模型组比较;△P<0.01,各有效部位群组与痛风颗粒组比较;▲P<0.01,痛风颗粒及各有效部位群组与阳性对照组比较。 表 2 痛风颗粒及其各有效部位群对弗氏佐剂致炎大鼠血液中白细胞计数及中性粒细胞百分比的影响(n=8,
$ {\rm{\bar x}} \pm {\rm{s}}$ )组别 WBC(×109/L) N(%) 空白组 4.45±0.40 28.05±5.30 模型组 5.52±0.75 31.17±4.41 总黄酮组 5.13±1.67 26.80±3.31 总有机酸组 4.70±1.07 29.05±5.95 总生物碱组 4.62±1.51 29.63±7.00 痛风颗粒组 4.52±0.87 26.35±4.82 阳性对照组 4.48±0.92 26.32±2.62 表 3 痛风颗粒及其各有效部位群对弗氏佐剂致炎大鼠血清中IL-6、IL-10和TNF-α的影响(n=8,
$ {\rm{\bar x}} \pm {\rm{s}}$ )组别 IL-6(ng/L) TNF-α(ng/L) IL-10(ng/L) 空白组 96.46±14.39 57.96±6.68 62.93±2.10 模型组 191.58±9.04** 136.03±9.16** 34.29±2.98** 总黄酮组 141.04±12.45##△△ 98.37±6.46##△△ 37.87±3.43#△△ 总有机酸组 154.11±9.47##△△ 97.59±5.18##△△ 38.07±5.55#△△ 总生物碱组 110.65±7.40##△ 85.33±8.06##△△ 50.62±1.97## 痛风颗粒组 98.84±8.55## 65.14±4.96## 48.15±2.97## 阳性对照组 97.35±13.63## 58.95±8.61## 47.63±1.88## **P<0.01,模型组与空白组比较;#P<0.05,##P<0.01,各治疗组与模型组比较;△P<0.05,△△P<0.01,痛风颗粒及各有效部位群组与阳性对照组比较。 -
[1] 陈娜, 张明, 王一飞. 茵连痛风颗粒治疗间歇期痛风性关节炎临床观察[J]. 中国中西医结合杂志, 2017, 37(07):883-885. [2] 田晓卉. 滨蒿抗炎化学成分的研究[D]. 北京: 北京化工大学, 2016. [3] 张妍妍, 毕悦, 尹丽颖, 等. 伸筋草总生物碱的提取纯化与急性毒性及抗炎活性研究[J]. 中医药学报, 2020, 48(06):14-18. [4] 陈莹, 杨路, 冼培凤, 等. 不同蜂针剂量对佐剂性类风湿性关节炎大鼠血清TNF-α、IL-1β、IL-6的影响[J]. 中华中医药学刊, 2017, 35(05):1151-1154. [5] 李福安, 魏全嘉, 李晓良, 等. 秦艽汤对大鼠佐剂性关节炎模型滑膜病理的影响[J]. 青海医学院学报, 2005, 26(1):36-39, 56. [6] SHEKELLE P G, NEWBERRY S J, FITZGERALD J D, et al. Management of gout: a systematic review in support of an American college of physicians clinical practice guideline[J]. Ann Intern Med,2017,166(1):37-51. doi: 10.7326/M16-0461 [7] 李海昌, 温成平, 谢志军, 等. 间歇期及慢性期痛风中医证候的文献研究[J]. 中华中医药杂志, 2012,27(10):2530-2534. [8] 蔡卓亚, 周自桂, 李萍, 等. 伸筋草化学成分及药理作用研究进展[J]. 中草药, 2015, 46(2):297-304. [9] 苗兵, 杨金, 周忠光, 等. 伸筋草乙醇提取物对佐剂性关节炎大鼠类风湿因子和血清细胞因子的影响[J]. 中医药信息, 2008, 25(3):22-24. [10] 刘静, 年华, 徐熠, 等. 伸筋草生物碱对佐剂性关节炎大鼠的抗炎作用及机制研究[J]. 药物评价研究, 2019, 42(05):869-872. [11] 周蜜, 王一飞, 周茹, 等. 系列痛风颗粒联合金黄膏分期治疗痛风性关节炎疗效观察[J]. 中国中西医结合杂志, 2013, 33(12):1603-1607. [12] 孙益, 童培建, 李象钧, 等. 循经论治法对急性痛风性关节炎大鼠的Toll样受体4/NF-κB信号通路影响机制研究[J]. 中华中医药学刊, 2015, 33(09):2195-2200. [13] 沈径仿, 鲁晓勇, 吴华香. 慢性痛风骨侵蚀的形成机制[J]. 中华内科杂志, 2013, 52(11):987-988. [14] DALBETH N, CHHANA A. Mechanisms of bone erosion in chronic gout: lessons learned from other erosive arthropa- thies[J]. Curr Rheumatol Rev,2011,7(2):152-161. doi: 10.2174/157339711795304979 [15] 向导, 袁林, 苏林冲, 等. 金边祛风饮对类风湿关节炎滑膜细胞IL-1β、TNF-α及MMP-3表达的影响[J]. 中国免疫学杂志, 2013, 29(9):952-954, 959. [16] 任大宾, 孙仁宇. 白介素-10的抗炎功能及其分子机制[J]. 国外医学.呼吸系统分册, 2005, 25(3):175-178. [17] 赵用, 刘佳, 马宝东, 等. 苓泽合剂对急性痛风性关节炎大鼠血清IL-6、TNF-α含量的影响[J]. 湖南中医药大学学报, 2019, 39(1):28-31. [18] 蒋晓梅, 刘翀, 朱延焱. 黄连总生物碱对溃疡性结肠炎模型大鼠肠黏膜损伤及p38-PPARγ/NF-κB通路的影响[J]. 中国药师, 2019, 22(12):2188-2193. -





 下载:
下载:
 下载:
下载:






