-
在美国疾病预防控制中心耐碳青霉烯类肠杆菌(CRE)控制指南(2012年版)中,定义耐碳青霉烯肺炎克雷伯菌 (CRKP),是指在药敏试验中至少对厄他培南、美罗培南或亚胺培南其中之一者耐药,且对头孢曲松、头孢噻肟及头孢他啶耐药的肺炎克雷伯菌(KP)。CRKP引发的血流感染 (BSI) 因药物选择有限,致死率高达54.3%[1]。长期规律血液透析(HD)的尿毒症患者CRKP血流感染时,因HD的特殊性,更增加了治疗难度,特别是使用氨基糖苷类药物开展治疗时。临床药师需要根据HD患者代谢和排出的实际情况,结合药动学/药效学(PK/PD)理论对药物选择、剂量计算、以及给药时间进行优化。本文以1例 HD尿毒症患者为例,探讨阿米卡星在治疗合并CRKP血流感染的透析患者时的经验和体会。
-
患者男性,64岁,农民,身高176 cm,体重65 kg。主诉“间断发热2 d”,于2019年10月21日入院。既往高血压病史20余年,多囊肾、多囊肝病史30余年,癫痫病史1年余,尿毒症病史4年,无尿状态,规律血液透析4年(每周一、三、五,2次血液透析+1次血液透析滤过),右侧颈静脉留置导管。2019年1月至9月,患者因“多囊肝伴感染”多次入院治疗,血培养多次报告超广谱β内酰胺酶(ESBLs)阳性的KP,曾多次接受哌拉西林他唑巴坦、替加环素、米诺环素、美罗培南、法罗培南等治疗。入院前2 d,患者再次无明显诱因出现发热,体温最高37.5 ℃,伴畏寒寒战,腰痛及呃逆,无明显咳嗽咳痰,服用“法罗培南”无明显改善,为求进一步诊治再次入院。入院查体:体温(T)38.6 ℃、脉搏(P)112次/min、呼吸频率(R)22次/min、血压(BP)117/97 mmHg。患者呈慢病面容,被动体位,查体欠合作,双肺呼吸音清,未闻及干湿啰音,腹部膨隆,无压痛及反跳痛,移动性浊音阳性,肝肾区无叩痛。辅助检查:血常规:白细胞计数(WBC) 10.74×109/L、中性粒细胞百分比(N%) 85.8%、血红蛋白(Hb) 109 g/L、血小板(PLT) 117×109/L;血生化:尿素氮(BUN) 30.8 mmol/L、肌酐(Cr) 912μmol/L、丙氨酸氨基转移酶(ALT) 6 U/L、天冬氨酸氨基转移酶(AST) 8 U/L;C-反应蛋白(CRP) 254 mg/L、降钙素原(PCT) 17.35 ng/ml、血沉(ESR) 95 mm/h。腹部核磁示肝右叶多发片状DWI异常信号影,多囊肝,双侧多囊肾。胸部CT未见异常。入院诊断:肝囊肿合并感染、尿毒症、血液透析状态、慢性左心功能不全、心功能Ⅲ级、心律失常、阵发性房颤。
-
入院当日抽取静脉血做细菌培养,经验性给予美罗培南0.5 g,1次/d。治疗期间,患者仍间断发热,体温在37~38 ℃波动。10月26日化验结果显示:WBC 5.35×109/L、N% 71.2%、BUN 18.41 mmol/L、Cr 631μmol/L、CRP 179 mg/L、PCT 16.97 ng/ml、ESR 96 mm/h。10月26日细菌血培养为产丝氨酸碳青霉烯酶(KPC)的CRKP (药敏见表1)。导管内血培养阴性。临床药师对导管相关感染进行评估:患者导管处皮肤干燥,无渗液,考虑血流感染与多囊肝伴发的感染可能性更大。药敏结果示病原菌对氨基糖苷类药物敏感。经确认,患者本人及家族成员无氨基糖苷类药物的过敏史与不良反应史。临床药师建议:选择美罗培南联合敏感药物阿米卡星抗感染治疗。美罗培南剂量增加至0.5 g每12 h给药1次,延长滴注时间至2 h。阿米卡星首次剂量给予0.8 g,维持剂量0.2 g,于每次透析后给药,滴注时间不少于30 min。
表 1 患者肺炎克雷伯菌血培养和药敏结果
抗生素 敏感度(mg/L) 抗生素 敏感度(mg/L) 复方新诺明 ≤20敏感 美罗培南 ≥16耐药 粘菌素 ≤0.5敏感 亚胺培南 ≥16耐药 替加环素 ≥8耐药 氨曲南 ≥64耐药 米诺环素 ≥16耐药 头孢泊肟酯 ≥32耐药 多西环素 ≥16耐药 头孢哌酮舒巴坦 ≥64耐药 左氧氟沙星 ≥8耐药 头孢他啶 ≥32耐药 环丙沙星 ≥4耐药 哌拉西林他唑巴坦 ≥128耐药 妥布霉素 ≤1敏感 替卡西林克拉维酸钾 ≥128耐药 阿米卡星 ≤2敏感 10月27日,患者体温恢复正常,病情缓解,查体:T 35.9 ℃、P 60次/min、R 16次/min、BP 148/93 mmHg。10月29日WBC 5.7×109/L、N% 59%、CRP 30.25 mg/L、PCT 3.92 ng/ml、ESR 67 mm/h。10月30日,患者血培养结果阴性,病情平稳,未诉不适。11月4日,患者体温、炎性指标等检测指标均正常,在院期间,患者未出现头晕、耳鸣等不良反应。11月8日,患者遵医嘱出院。两周后电话随访,患者未再出现发热。
-
CRKP是一类具有较厚荚膜且大多数存在菌毛的
${\rm{G}}^- $ 菌,较厚的荚膜与高耐药性相关[2]。近5年来,CRKP的抗菌治疗一般局限于头孢他啶/阿维巴坦、美罗培南/维博巴坦、多粘菌素、替加环素、磷霉素、碳青霉烯类以及氨基糖苷类等药物[3-7]。氨基糖苷类药物因存在神经毒性和肾毒性,较少用于一线治疗,因此对许多耐药菌仍有一定的敏感性,常常用于耐药${\rm{G}}^- $ 菌的联合治疗。多项研究表明,氨基糖苷类与β-内酰胺类药物联合治疗${\rm{G}}^- $ 菌感染的休克患者时,尤其以碳青霉烯类药物为基础的联合方案与任何一种单药治疗方案相比可显著降低患者病死率[8-9, 10-11]。根据药敏结果,药师建议美罗培南抗感染治疗联合药敏敏感且价格低廉的阿米卡星作为治疗方案。阿米卡星可破坏KP胞浆膜的完整性,通过抑制致病菌蛋白质的合成发挥抑菌作用,对KP的敏感率为85.7%[12]。 -
氨基糖苷类药物是浓度依赖性的静止期杀菌剂,有3个PK/PD特点:①预测疗效的PK/PD指标主要为血药峰浓度/最小抑菌浓度(cmax/MIC)≥8~10[13]或0~24 h药时曲线下面积/最小抑菌浓度(AUC0~24/MIC) ≥100[14];②抗菌药物后效应(PAE)较长,阿米卡星对KP的PAE>12 h[15];③有耐药适应性,即接触药物暴露后细菌杀灭率降低,可能是细菌对药物的摄取下调导致的[9]。氨基糖苷类药物最理想的体内过程,是获得高的cmax,以及一段时间的无药期,以减少适应耐药性。这是氨基糖苷类药物提高给药剂量、延长给药间隔的理论基础。对于肾脏功能正常的人群,氨基糖苷类药物推荐的给药方式多为每日剂量一次给予[9, 14]。
-
氨基糖苷类药物是中等分子量(465~600)的化合物,蛋白结合低,分布体积较小。HD可以有效清除氨基糖苷类药物。HD患者,传统的给药方式是首剂给予肾功能正常患者的推荐剂量,每次透析后补充正常剂量的一半。有新的观点提倡,每次HD之前给予正常剂量[16-17],或在透析过程中给药,以获得体内较高的cmax,随后由透析过程将体内药物浓度降低。但是这种给药方式也有局限性:①必须依赖于准确的HD疗程将药物浓度降低,否则,会导致药物蓄积,加重不良反应。②对于可能因意外情况而中断HD的患者以及不能进行血药浓度监测的医疗机构,有一定的风险。③HD患者无法完全排出体内的氨基糖苷类药物,不存在无药期,不能减少细菌获得性耐药产生[18]。临床药师结合本例患者的癫痫病史,且我院尚未开展阿米卡星血药浓度监测的实际情况,仍建议选择传统的透析后补充低剂量的策略,医生采纳。
-
根据桑德福《抗微生物指南》(第48版)推荐,阿米卡星尿毒症患者行血液透析的给药方案为:①2次/d给药方案:7.5 mg/kg,间隔48 h再次给药,做透析后额外增加3.75 mg/kg。②1次/d给药方案:首剂(推荐剂量15 mg/kg),间隔72 h+透析后额外补充3 mg/kg。根据PK/PD理论,本例患者选择1次/d的给药方式。
Hideo[19]等对阿米卡星PK/PD评价发现:对于MIC≤2 mg/L,10 mg/kg可获得>90%的治疗目标。本例患者校正体重68.8 kg,负荷剂量选择10 mg/kg给药,给药剂量0.69 g。根据制剂规格0.2 g/支,给予0.8 g(11.6 mg/kg),每日一次。维持剂量:每周一、三、五规律血透,每次透析后给药0.2 g(3 mg/kg)。患者用药后,第2天体温下降至正常。
-
氨基糖苷类药物可导致听觉、前庭毒性和肾脏毒性以及神经肌肉阻滞。氨基糖苷类耳毒性发生率为15%~20%,通常表现为听力下降或损失,以及前庭损害,同时使用其他肾毒性药物时[20],须关注耳毒性反应。
氨基糖苷类药物存在肾损害、神经肌肉病、食物中毒、低钙血症,同时使用肌松药时,需关注可能出现呼吸衰竭等严重不良反应[21]。神经肌肉阻滞的发生与滴速有关,滴注时间至少30 min以上。本例患者未出现听力损伤及神经肌肉阻滞不良反应。
-
-
粉-液双室袋是采用特定工艺将药物和注射用溶剂独立封装在不同的两个腔室中的一种静脉注射用产品,在医护人员紧缺或战备、紧急救援等情况下,其优势突出[1]。1996年,日本研制出世界首个粉-液双室袋产品——头孢唑林钠氯化钠注射剂[2]。2015年,原中国食品药品监督管理总局出台首个《粉液双室袋产品技术审评要点》[3],国内首个粉-液双室袋产品(注射用头孢他啶/氯化钠注射液)于2019年获得药品注册批件,正式上市。粉-液双室袋因其结构上的创新,给药预处理步骤简化在使用上具有独特的优势,因此粉-液双室袋产品自上市后就受到了广泛的关注。但对于这样一个新产品,是否真正安全有效,是否具有成本-效益,与市场上正在使用的传统粉针剂相比是否具有明显的优势等问题目前均未得到解答,利益各方大都采取观望的态度。
为促进粉-液双室袋产品临床合理应用,依据国家卫健委2020年发布的《药品临床综合评价管理指南(试行)》[4],通过对文献资料进行调研,提取粉-液双室袋常用评价指标,以传统粉针产品为对照,从安全性、有效性、经济性、适宜性、可及性、创新性6个维度对粉-液双室袋产品进行综合评价。
1. 资料和方法
1.1 文献检索策略
以“双室袋” “双腔袋” “多室袋” “多腔袋” “Multi chamber bag”和“dual chamber bag”等为关键词,在中国知网、万方数据、维普、PubMed 、Web of Science等数据库中进行系统文献检索,对发表年度不设限制。表1为具体的检索式及相应检索结果。
表 1 检索式及检索结果检索条件 各数据库检索结果 中国知网 万方数据 维普 PubMed Web of Science (主题=双室袋 + 粉液双室袋)OR(主题=双腔袋)
OR(主题=多室袋)OR(主题=多腔袋)80 ((((任意字段=双室袋 OR 任意字段=粉液双室袋)OR 任意字段=多室袋)OR 任意字段=双腔袋)OR 任意字段=多腔袋) 189 主题=(双室袋)OR 主题=(粉液双室袋)OR 主题=(多室袋)
OR 主题=(双腔袋)OR 主题=(多腔袋)6740 (Multi chamber bag)OR(dual chamber bag) 42 (Multi chamber bag)OR (dual chamber bag) 166 1.2 纳入与排除标准
纳入标准:①研究对象为粉-液双室袋;②内容为安全性、有效性、经济性、适用性、创新性、可及性的研究;③文献类型为随机对照试验或观察实验;④有参考价值的多室袋研究文献。
排除标准:①研究对象为液-液双室袋;②内容为生产工艺、设备、分装技术和其他无关内容;③文献类型为综述、会议论文、专利、成果;④重复文献、不可下载文献。
1.3 文献筛选和信息提取
文献由2名研究员独立、同步进行筛选。参考中国医药包装协会发布的《基础输液临床使用评估指南(试行)》[5]和国家卫健委发布的《药品临床综合评价管理指南(试行)》[4]提取文献中的可用指标。如产生争议,由课题组成员讨论决定。
2. 结果
2.1 文献检索与筛选结果
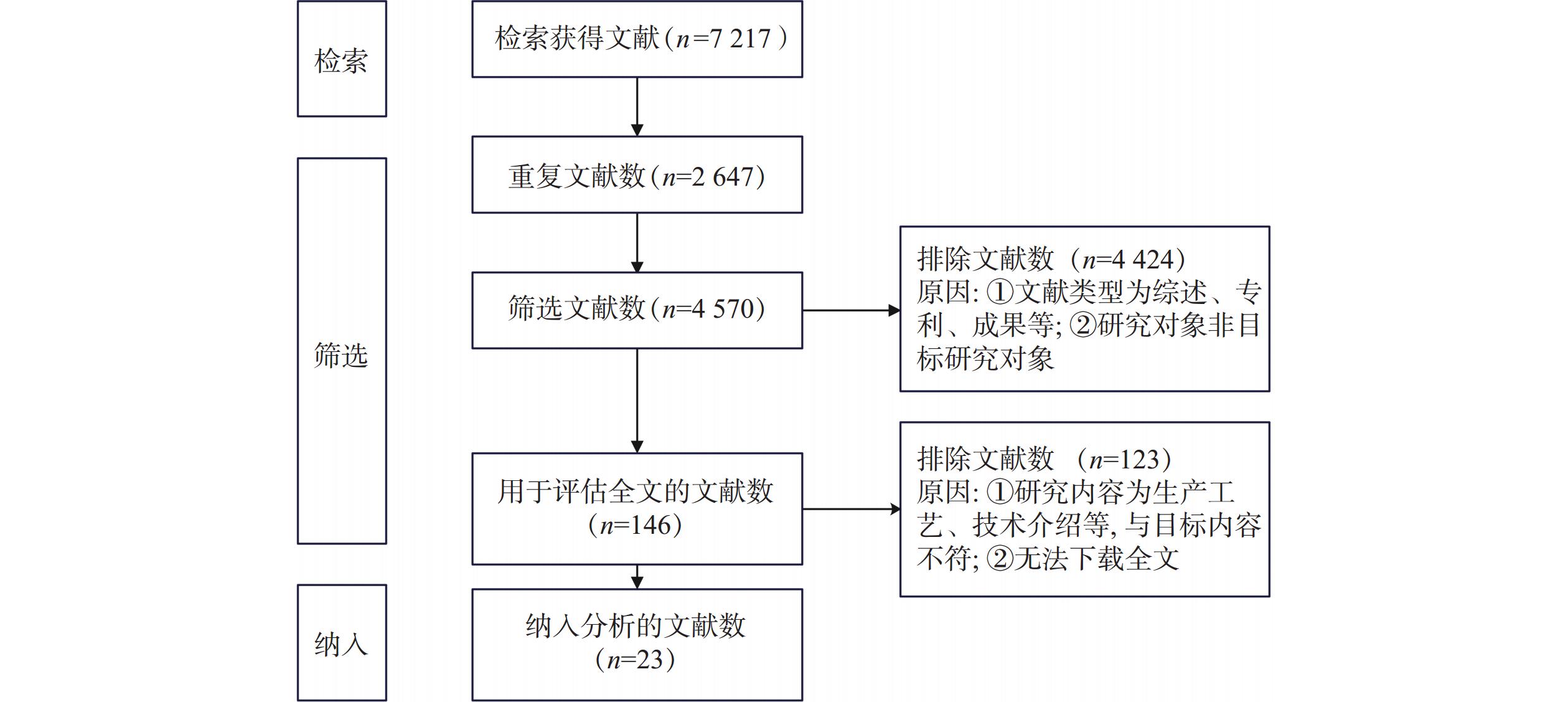
系统检索文献得
7217 篇,排除重复文献2647 篇、文献类型为综述、会议论文等4424 篇、文献内容为生产工艺和技术介绍等123篇,最终纳入分析文献23篇,其中英文文献2篇,中文文献21篇。具体筛选过程如图1。2.2 指标提取及评估结果
2.2.1 评价指标
文献中使用的评价指标涉及5个维度,经过整合、汇总,见表2。由于双室袋产品和传统粉针剂的药物成分、给药途径一致,仅包装和给药预处理存在区别,故有效性、安全性两个维度仅包括与包装和给药预处理相关的指标。其中,虽配制过程刺伤、划伤等为操作失误,但双室袋产品简化了药液配制过程,无需使用注射器辅助配制,可完全避免意外伤害,与传统粉针剂存在差异,故纳入为安全性指标。
表 2 已发表文献使用的评价指标评价维度 判别可用指标 有效性 药液稳定性、配制浓度准确性、药液残留量 安全性 不溶性微粒、刺伤划伤等意外事情发生率 经济性 配制成本a、废弃物重量、住院成本、血液感染发生率 适宜性 配制时间、平均医护人员人力占用、包装重量和
储运体积b、环境适应性、废弃物处理难易程度可及性 生产厂家数量、产品原材料供应能力、患者可负担性 a:为药液成本、配制用品以及配制人工成本的总和;b:包括药液配制过程所需用品储运体积总和,传统粉针剂产品的配制用品包括注射器、西林瓶粉针、配制用溶剂等,粉-液双室袋产品仅包括产品本身。 2.2.2 有效性
于庆坤等[6-12]研究结果显示,与传统粉针剂相比,双室袋产品的药液含量随时间变化小,配制的实际浓度更接近理论浓度,无残留药液,具体见表3和表4。
表 3 药液配置后5 h的稳定性对比[7]产品名称 不同温度时的百分含量(%) 4℃ 25℃ 非PVC粉-液双室袋产品 96.33 96.32 玻璃瓶粉针产品 95.37 95.79 2.2.3 安全性
静脉输液中的不溶性微粒会造成血栓和静脉炎[13],药典规定用于静脉注射、滴注的药品需检查不溶性微粒。双室袋法配制过程不溶性微粒无明显增加[8,10,14-15],详见表5。以18名护士为观察对象,粉针配制过程1名护士被划伤,双室袋配制过程无人员刺伤、划伤[10]。粉-液双室袋以非PVC多层共挤膜为膜材,其强光照射实验表明0.9%氯化钠、5%葡萄糖、葡萄糖氯化钠、复方氯化钠注射液与膜材相容性良好,稳定性试验表明非PVC多层共挤膜的水蒸气渗透、透光率、pH、易氧化物检测均符合规定[14,16]。
表 5 配制过程不溶性微粒比较文献作者 样品 不溶性微粒数(个/ml) ≥5 ≥8 ≥10 ≥12 ≥25 ≥100 李英等[15]a 粉针输液产品 318 66 21 6 0 0 配制增加微粒数b 285 55 15 3 0 0 双室袋输液产品 2 0 0 0 0 0 双室袋增加微粒数c 0 0 0 0 0 0 沈敏娜等[16]a 粉针输液产品 322 68 23 7 0 0 配制增加微粒数 289 55 17 5 0 0 双室袋输液产品 3 1 0 0 0 0 双室袋增加微粒数c 0 0 0 0 0 0 王宇航等[8]a 粉针输液产品 240 326.5 43 24 7 0 双室袋输液产品 240 2 0 0 0 0 罗莉等[10]d 粉针输液产品 219.52±84.73 43.93±21.68 14.93±7.96 4.05±2.60 0.01±0.04 双室袋输液产品 3.49±0.95 0.39±0.19 0.20±0.11 0.13±0.09 0.03±0.03 a:实验重复配制(均≥100份),由于数据资料不服从正态分布,选中位数表征平均水平,表中均为中位数值;b:增加微粒数=溶液微粒数−(粉体+液体),表示溶配方法增加的不溶性微粒;c:双室袋法配置的不溶性微粒增加数计算结果为负值,由于混合前为取出粉末后在非封闭的环境中进行溶解测试,而混合后则是在封闭的袋内进行开通溶解后测试,从而导致粉体检测结果高于混合液的情况出现,因此即配型双室袋法配置的不溶性微粒增加数视为零;d:本实验所取数据为不溶性微粒数范围值。 2.2.4 经济性
在纳入的双室袋产品相关经济性研究[8,17-18]中考虑到的成本指标包括配制成本(包括配制环境、设备以及环境维护费、人工成本、耗材成本)、废弃物重量,效果/效益以血液感染(BSI)为指标。采用双室袋输液,药液配制过程得到简化,一方面可节省储存场所、人工及耗材成本,一方面产生的废弃物减少,废弃物处理费会有所减少。王宇航等[8]通过计算发现按照4.82元/kg的垃圾清理费算,每年可减少废弃物处理费约7万元。此外,双室袋输液配制过程减少与空气的接触,可在一定程度上减少输液后血液感染的发生率。苗雅楠等[17]发现在
1000 例患者中,输液系统由半开放式转换为全密闭输液系统可减少172例血液感染。已上市的粉-液双室袋产品与对应的传统粉针相比,有效期相同,对于储备来说,两者轮换周期一致。2.2.5 适宜性
对于易溶于水但在水溶液中不稳定的药物一般选择制成注射用无菌粉针,此类产品在使用前需要与特定的配制用溶剂临时配制注射用溶液。与粉针剂西林瓶产品运用的药液配制方法相比,双室袋法输液预处理环节有所简化,能明显缩短药液配制时间[8,10,19],具体见表6,在医护资源匮乏(如应急医学救援)时,可减少医护人员人力的占用。此外双室袋为全密闭输液系统,对环境的耐受性强。
2.2.6 可及性
可及性包括可获得和可负担两方面的要求。双室袋产品的药液与传统粉针一致,包装材料有所不同,目前双室袋包材审批通过已登记的有15项(1项为进口),双室袋产品生产厂家超过5家,产品大都为头孢类抗感染药物,在生产供应方面,可以满足可及性的要求。此外,2022年《国家基本医疗保险药品目录》的协议期内谈判药品部分有5个粉-液双室输液产品被纳入,为医保乙类药品,可达到患者可负担的要求。
2.2.7 创新性
截止到2023年4月,与粉-液双室输液袋有关的发明专利有22项,实用新型专利89项,外观专利5项,包括生产、灌装、检漏等方面。粉-液双室袋产品能缩短配液时间,简化输液预处理过程,降低了输液对环境的要求,顺应了突发事件应急医学救援与创伤急救的需求。
3. 讨论
本研究采用系统综述的方法对现有文献信息分析提取,得到的指标可作为评价指标池的一部分,后续可用于建立粉-液双室袋产品综合评价指标体系。
粉-液双室袋产品与传统粉针药效成分、给药途径相同,我国对药品上市后包装变更无临床试验的要求[20],已发表文献中均未报告其有效性、安全性的临床结局指标,且两者仅在包材和给药预处理方面存在差异,故纳入的有效性指标只包括药物学工艺重现性,安全性指标只包括不良事件或风险的比较指标。除列出指标外,安全性评价还需考虑渗漏隐患、破损率、误配、错配发生率等。经济性评价具有时间性,存在偏倚风险,仍需对此类产品进行更为可靠的经济学研究。适用性的考查应注重产品在紧急救援使用时缩短抢救时间,节约医护资源的能力。粉-液双室袋的技术壁垒较高,可及性方面不如传统粉针剂,但符合可及性的基本要求。
粉-液双室袋属于全封闭式输液系统,无空气通路,细菌污染降低,减少了输液反应的发生[21]。药液配制时间明显缩短,提高救援成功率[22];无需临时计算溶剂用量,配制准确度高,无药液残留,且对环境、技术要求不高,降低了人工、设施及耗材成本;无需借助注射器反复穿刺橡胶塞,不溶性微粒显著减少,刺伤、划伤等意外事情可避免。虽单价高于传统粉针产品,但其在废弃物处理成本、人工成本以及输液后静脉炎发生率的减少方面展现出了一定的优势。此外国内双室袋产品的生产企业超过5家,且在原材料上摆脱了对进口的依赖,5种粉-液双室袋产品已纳入医保目录,符合可及性要求。
粉-液双室袋为新兴产品,仅有23篇符合纳入条件。外文文献较少,仅纳入2篇。因多室袋与双室袋原理一致,故将以多室袋为研究对象的文献也纳入。期待随着粉-液双室袋在我国广泛应用,未来可获得高质量、精细化的研究数据,以开展更全面、可靠的综合评价研究。
-
表 1 患者肺炎克雷伯菌血培养和药敏结果
抗生素 敏感度(mg/L) 抗生素 敏感度(mg/L) 复方新诺明 ≤20敏感 美罗培南 ≥16耐药 粘菌素 ≤0.5敏感 亚胺培南 ≥16耐药 替加环素 ≥8耐药 氨曲南 ≥64耐药 米诺环素 ≥16耐药 头孢泊肟酯 ≥32耐药 多西环素 ≥16耐药 头孢哌酮舒巴坦 ≥64耐药 左氧氟沙星 ≥8耐药 头孢他啶 ≥32耐药 环丙沙星 ≥4耐药 哌拉西林他唑巴坦 ≥128耐药 妥布霉素 ≤1敏感 替卡西林克拉维酸钾 ≥128耐药 阿米卡星 ≤2敏感 -
[1] XU L, SUN X, MA X. Systematic review and meta-analysis of mortality of patients infected with carbapenem-resistant Klebsiella pneumoniae[J]. Ann Clin Microbiol Antimicrob,2017,16(1):18. doi: 10.1186/s12941-017-0191-3 [2] LEE S, HAN S W, KIM K W, et al. Third-generation cephalosporin resistance of community-onset Escherichia coli and Klebsiella pneumoniae bacteremia in a secondary hospital[J]. Korean J Intern Med,2014,29(1):49-56. doi: 10.3904/kjim.2014.29.1.49 [3] CANI E, MOUSSAVI F, OCHERETYANER E, et al. Carbapenem-resistant Klebsiella pneumoniae vertebral osteomyelitis in a renal transplant recipient treated with ceftazidime-avibactam[J]. Transpl Infect Dis,2018,20(2):e12837. doi: 10.1111/tid.12837 [4] MILLS J P, WILCK M B, WEIKERT B C, et al. Successful treatment of a disseminated infection with extensively drug-resistant Klebsiella pneumoniae in a liver transplant recipient with a fosfomycin-based multidrug regimen[J]. Transpl Infect Dis,2016,18(5):777-781. doi: 10.1111/tid.12578 [5] HANRETTY A M, KAUR I, EVANGELISTA A T, et al. Pharmacokinetics of the meropenem component of meropenem-vaborbactam in the treatment of KPC-producing Klebsiella pneumoniae blood stream infection in a pediatric patient[J]. Pharmacother: J Hum Pharmacol Drug Ther,2018,38(12):e87-e91. doi: 10.1002/phar.2187 [6] DE SANCTIS J, TEIXEIRA L, VAN DUIN D, et al. Complex prosthetic joint infections due to carbapenemase-producing Klebsiella pneumoniae: a unique challenge in the era of untreatable infections[J]. Int J Infect Dis,2014,25:73-78. doi: 10.1016/j.ijid.2014.01.028 [7] RANA M M, STURDEVANT M, PATEL G, et al. Klebsiella necrotizing soft tissue infections in liver transplant recipients: a case series[J]. Transpl Infect Dis,2013,15(4):E157-E163. doi: 10.1111/tid.12103 [8] 王硕, 刘明亮. 氨基糖苷类抗生素治疗重度革兰阴性菌感染方案的优化[J]. 国外医药(抗生素分册), 2013, 34(1):16-20. [9] TUMBARELLO M, VIALE P, VISCOLI C, et al. Predictors of mortality in bloodstream infections caused by Klebsiella pneumoniae carbapenemase-producing K. pneumoniae: importance of combination therapy[J]. Clin Infect Dis,2012,55(7):943-950. doi: 10.1093/cid/cis588 [10] CANTÓN R, CANUT A, MOROSINI M I, et al. Breakpoints for carbapenemase-producing Enterobacteriaceae: is the problem solved?[J]. Enferm Infecc Microbiol Clin, 2014, 32(Suppl 4): 33-40. [11] QURESHI Z A, PATERSON D L, POTOSKI B A, et al. Treatment outcome of bacteremia due to KPC-producing Klebsiella pneumoniae: superiority of combination antimicrobial regimens[J]. Antimicrob Agents Chemother,2012,56(4):2108-2113. doi: 10.1128/AAC.06268-11 [12] 胡付品, 郭燕, 朱德妹, 等. 2017年CHINET中国细菌耐药性监测[J]. 中国感染与化疗杂志, 2018, 18(3):241-251. [13] TURNIDGE J. Pharmacodynamics and dosing of aminoglycosides[J]. Infect Dis Clin North Am,2003,17(3):503-528. doi: 10.1016/S0891-5520(03)00057-6 [14] LORENZO M P, HOUSMAN E L, HOUSMAN S T, et al. Once-daily amino glycosides[J]. Am J Health Syst Pharm,2016,73(8):529-530. doi: 10.2146/ajhp150756 [15] CRAIG W A. Optimizing aminoglycoside use[J]. Crit Care Clin,2011,27(1):107-121. doi: 10.1016/j.ccc.2010.11.006 [16] MATSUO H, HAYASHI J, ONO K, et al. Administration of aminoglycosides to hemodialysis patients immediately before dialysis: a new dosing modality[J]. Antimicrob Agents Chemother,1997,41(12):2597-2601. doi: 10.1128/AAC.41.12.2597 [17] O'SHEA S, DUFFULL S, JOHNSON D W. Aminoglycosides in hemodialysis patients: is the current practice of post dialysis dosing appropriate?[J]. Semin Dial, 2009, 22(3): 225-230. [18] ESCHENAUER G A, LAM S W, MUELLER B A. Dose timing of aminoglycosides in hemodialysis patients: a pharmacology view[J]. Semin Dial,2016,29(3):204-213. doi: 10.1111/sdi.12458 [19] KATO H, HAGIHARA M, HIRAI J, et al. Evaluation of amikacin pharmacokinetics and pharmacodynamics for optimal initial dosing regimen[J]. Drugs R D,2017,17(1):177-187. doi: 10.1007/s40268-016-0165-5 [20] JIANG M, KARASAWA T, STEYGER P S. Aminoglycoside-induced cochleotoxicity: a review[J]. Front Cell Neurosci,2017,11:308. [21] PASQUALE T R, TAN J S. Nonantimicrobial effects of antibacterial agents[J]. Clin Infect Dis,2005,40(1):127-135. doi: 10.1086/426545 -





 下载:
下载:
 下载:
下载: 


