-
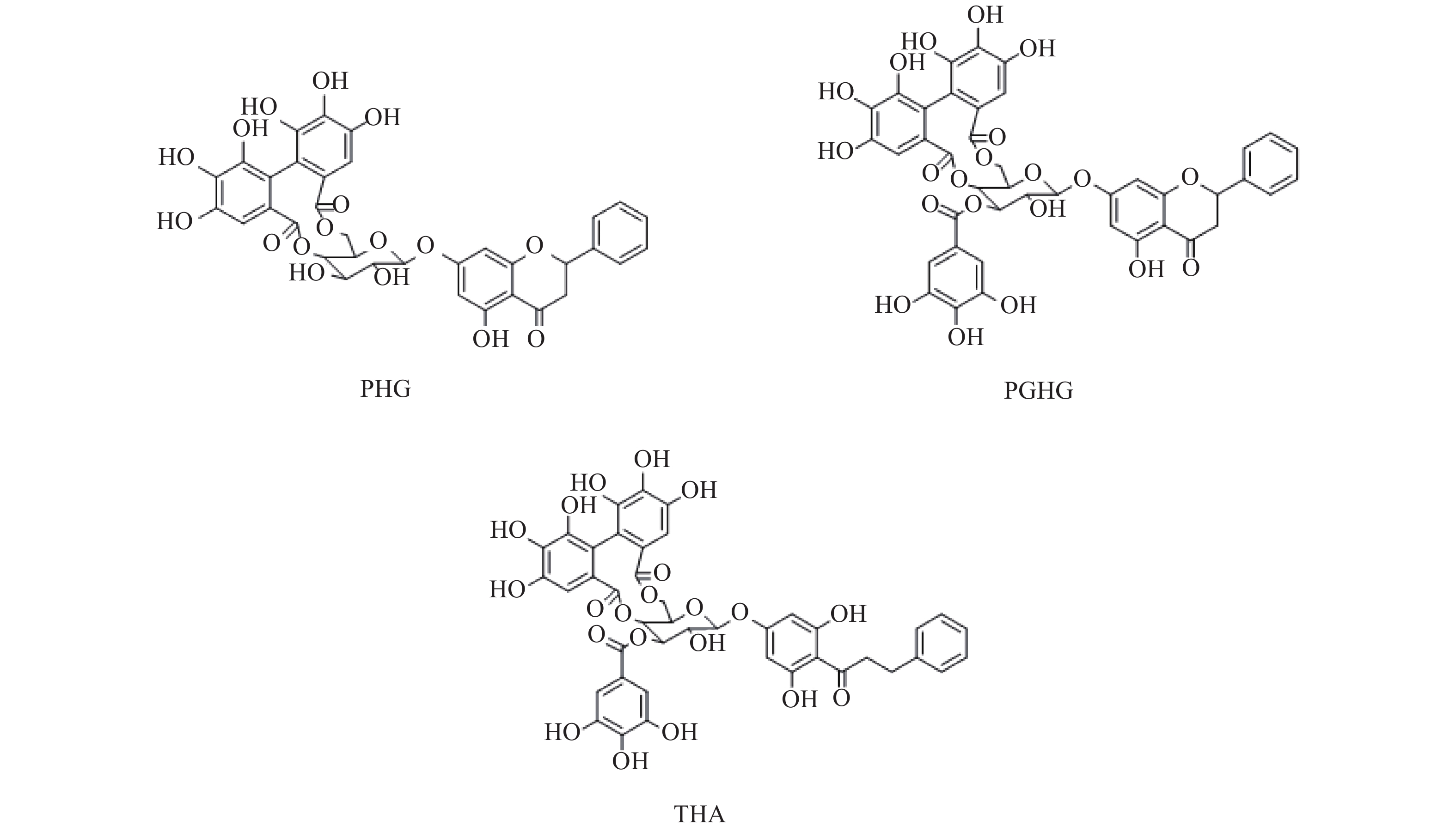
赶黄草(Penthori Chinensis Herba)在民间又名水泽兰、水杨柳等,以其为原料制成的单味成方制剂肝苏颗粒现收载于《中华人民共和国卫生部部颁标准中药成方制剂十三册》附录[1]。赶黄草是苗族的传统药物,主产于四川古蔺,具有清热、利湿、解毒、活血、平肝、健脾等功效[2],可用于酒精性、非酒精性脂肪肝,淤积性、酒精性及其他诱导因素引起的肝损伤的保护和治疗[3-13]。赶黄草中化学成分类型众多,以黄酮类、萜类、酚酸类为其主要活性成分[14]。其中,具有以黄酮苷连接没食子酰基结构的大环多酚类化合物(图1)乔松素-7-O-[4'', 6''-(S)-六羟基二苯甲酰基]-β-D-葡萄糖苷(pinocembrin-7-O-[4'',6''-(S)-hexahydroxydiphenoyl]-β-D-glucose,PHG)、乔松素-7-O-[3''-O-没食子酰基-4'', 6''-(S)-六羟基二苯甲酰基]-β-D-葡萄糖苷(pinocembrin-7-O-[3''-O-galloyl-4",6''-(S)-hexahydroxydiphenoyl]-β-D-glucose,PGHG)、乔松素二氢查耳酮-7-O-[3''-O-没食子酰基-4'', 6''-(S)-六羟基二苯甲酰基]-β-D-葡萄糖苷(pinocembrin dihydrochalcone-7-O-[3''-O-galloyl-4'',6''-(S)-hexahydroxydiphenoyl]-β-D-glucose or thonningianin A,THA)的肝保护及抗肝纤维化活性较强[15-17],同时也具有较好的降糖活性[18],有较高的开发价值,故本实验建立HPLC法同时测定该3种化合物的含量,并通过正交试验优选其提取工艺,为该类成分的进一步开发研究提供前期基础。
-
从四川收集3批赶黄草药材(表1),药材经课题组孙连娜副教授鉴定为虎耳草科植物扯根菜(Penthorum chinense Pursh)的干燥地上部分。各批次药材均留样于上海中医药大学中药资源与生物技术研究中心。
表 1 赶黄草药材来源信息表
样品编号 采集地区 批号 提供单位 S1 四川古蔺 18110803 四川古蔺肝苏药业有限公司 S2 四川古蔺 18110804 四川古蔺肝苏药业有限公司 S3 四川古蔺 19050701 四川新荷花中药饮片有限公司 -
XS105DU 电子天平(瑞士Mettler Toledo公司);XS104 电子天平(瑞士Mettler Toledo公司);HDM-10000B 数显电热套(上海利闻科学仪器有限公司);N-1300旋转蒸发仪(东京理化器械株式会社);Milli-Q纯水机(美国Millipore公司);1200型高效液相色谱仪(美国 Agilent 公司);Centrifuge 5810R高速台式冷冻离心机(德国Eppendorf公司)。
PHG对照品(批号:20181117)、PGHG对照品(批号:20181103)、THA对照品(批号:20181103)均由本实验室制备,且经HPLC归一化法检测表明纯度均在98%以上;水为超纯水;甲酸(色谱纯,上海麦克林生化科技有限公司);乙腈(色谱纯,美国Thermo Fisher公司);乙醇、甲醇(分析纯,上海泰坦科技股份有限公司 )。
-
精密称定PHG、PGHG、THA对照品,加80%甲醇分别制成对照品储备液,质量浓度分别为0.610 4、0.604 4、0.485 2 mg/ml。
-
取赶黄草药材粉末(过3号筛)1 g,精密称定后转移至250 ml锥形瓶中,精密移取并加入80%甲醇水溶液100 ml,称重确定初始重量,回流提取1 h,放至常温,加溶剂补至初始重量,摇匀,取样,过膜,取续滤液作供试品溶液。
-
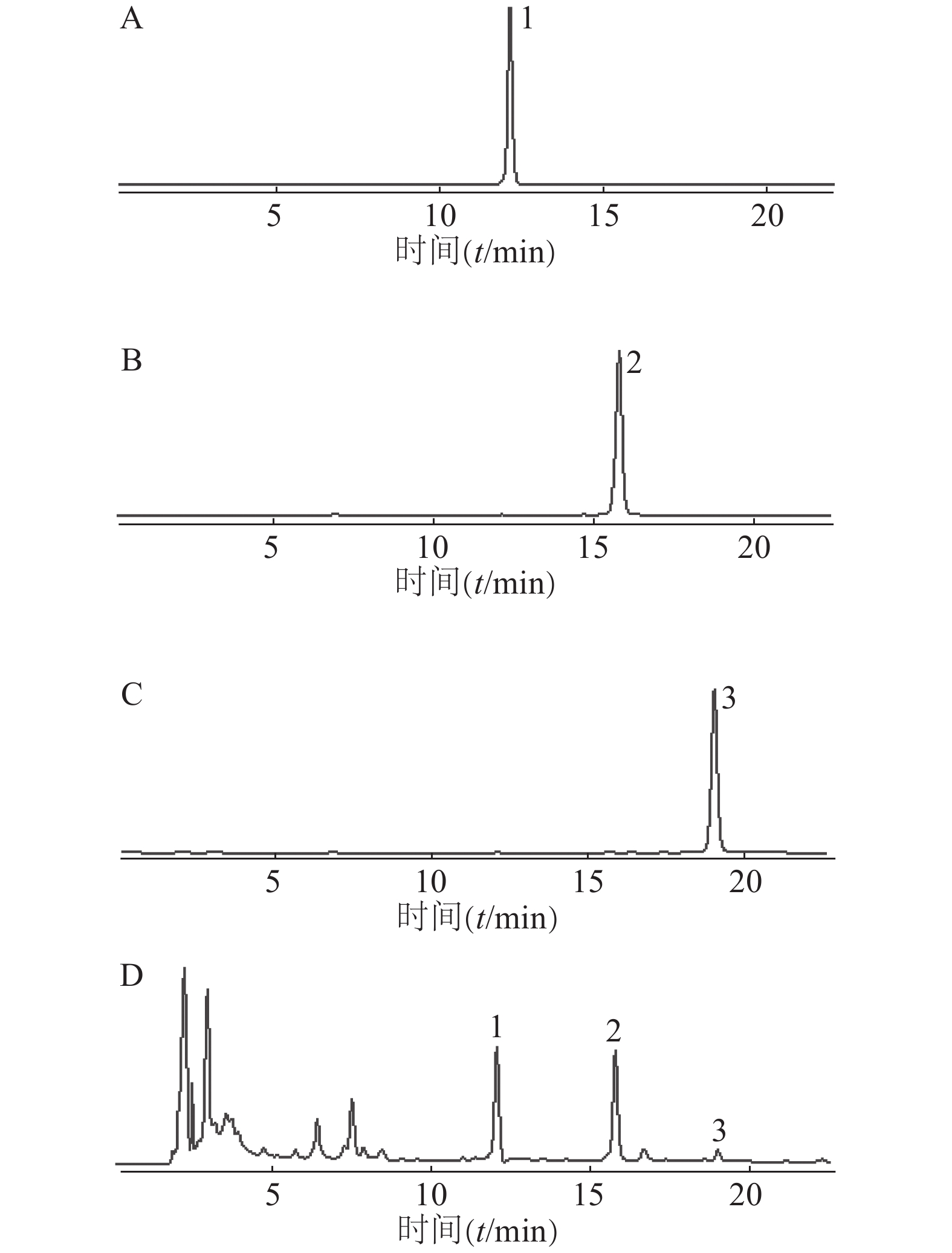
色谱柱:Agilent ZORBAX SB-C18柱(4.6 mm×250 mm,5 μm);流动相:乙腈(A)-0.5%甲酸水溶液(B);洗脱条件:梯度洗脱(0~20 min,32%→50% A,20~25 min,50%→90% A,25~30 min:90%→32% A);其他参数:流速为1 ml/min,柱温为30℃,检测波长为280 nm,进样量为10 μl。在此色谱条件下,供试品溶液(图2)中PHG、PGHG、THA与其他成分均达到基线分离,分离度大于1.5,理论塔板数以PHG计不低于20 000。
-
取“2.1.1”项方法制备的混合对照品溶液,依次稀释2、4、10、50、100倍,分别按“2.1.3”项色谱条件进样测定,以3种成分的进样浓度(X)为横坐标,峰面积(Y)为纵坐标,分别进行HPLC检测,线性拟合得回归方程。PHG、PGHG、THA的回归方程分别为:Y=18 575.798X+5.091 9(r=0.999 9),Y=21 923.382X+29.293 3(r=0.999 9),Y=21 544.589X−13.093 6(r=0.999 9),线性范围依次是6.10~610.40、6.04~604.40、4.85~485.20 μg/ml,以上表明3种化合物线性关系良好。
-
取对照品溶液,按“2.1.3”项色谱条件进行HPLC检测,连续进样分析6次,记录峰面积。结果显示PHG峰面积的RSD为1.15%,PGHG峰面积的RSD为0.18%,THA峰面积的RSD为0.12%,表明所用仪器精密度良好。
-
取赶黄草药材(S3,过3号筛)6份,按“2.1.2”项方法制备供试品溶液,再分别按“2.1.3”项色谱条件进行HPLC检测,记录峰面积,计算含量。结果显示样品中PHG的平均含量为5.83 mg/g,RSD为1.03%;PGHG平均含量为9.99 mg/g,RSD为0.91%;THA平均含量为1.31 mg/g,RSD为0.50%,表明本方法重复性良好。
-
取赶黄草药材(S3,过3号筛)1份,按“2.1.2”项方法制备供试品溶液,分别放置0、4、8、12、24 h后取样,按“2.1.3”项色谱条件进样测定,记录峰面积。结果显示样品中PHG、PGHG、THA峰面积的RSD分别为1.72%、2.44%和4.06%,表明供试品溶液在24 h内稳定。
-
取同一批赶黄草药材(S3,过3号筛)6份,每份约0.5 g,精密称定,按照药材含有量1∶1的比例,分别精密加入PHG、PGHG、THA对照品,按“2.1.2”项方法制备供试品溶液,再按“2.1.3”项条件进行HPLC分析,记录峰面积,计算回收率。结果显示PHG、PGHG、THA加样回收率分别为102.04%、100.90%、101.55%,对应的RSD值分别为0.88%、0.82%、1.43%,表明该方法可靠。
-
取各批次赶黄草药材(S1~S3,过3号筛)各3份,按“2.1.2”项方法制备供试品溶液后按“2.1.3”项条件进行HPLC分析,记录峰面积并计算含量(表2)。
表 2 赶黄草中3种化合物的含量(n=3)
样品编号 PHG/
(mg/g)PGHG/
(mg/g)THA/
(mg/g)总含量/
(mg/g)S1 3.66 5.12 1.99 10.77 S2 7.06 8.26 1.77 17.09 S3 5.69 9.73 1.25 16.67 -
取赶黄草药材(S2)切成3~5 cm小段,称取50 g,加入60%乙醇溶液500 ml,分别采用浸渍法(浸渍24 h)、渗漉法(浸泡24 h后以5 ml/min的流速收集渗漉液)、回流法(加热回流1 h)提取。结果表明,浸渍法平均总提取率为36.67%,渗漉法平均总提取率为36.82%,回流法平均总提取率为71.99%。考察结果为回流法提取效果最佳,因此选择回流法作为提取方法。
-
在确定提取方法为回流法的基础上,取赶黄草药材(S2),选择常规回流提取中对提取效果影响较大的因素:溶媒浓度(A)、提取时间(B)、溶媒用量(C)、提取次数(D)作为影响因素,每个因素各取3个水平,在平行操作条件下,设计L9(34)正交试验(表3)。
表 3 正交试验因素水平表
水平 A因素 B因素 C因素 D因素 溶媒浓度(%) 提取时间(t/h) 溶媒用量(倍) 提取次数(次) 1 40 1 10 1 2 60 2 20 2 3 80 3 30 3 以PHG、PGHG、THA的总提取率作为考察指标得正交试验结果(表4),根据极差大小可以看出各因素对赶黄草中大环多酚类成分的影响大小为A>B>D>C;进一步方差分析(表5)结果表明,溶媒浓度(A)对提取效果有显著影响(P<0.05),而其他3个因素无显著影响(P>0.05)。因此,根据正交试验得出的最佳组合为A3B1C3D2。
表 4 正交试验结果表
试验号 A因素 B因素 C因素 D因素 总提取率(%) 溶媒浓度(%) 提取时间(t/h) 溶媒用量(倍) 提取次数(次) 1 1 1 1 1 32.27 2 1 2 2 2 46.67 3 1 3 3 3 50.47 4 2 1 2 3 50.40 5 2 2 3 1 70.53 6 2 3 1 2 80.07 7 3 1 3 2 92.86 8 3 2 1 3 89.79 9 3 3 2 1 87.56 K1 129.41 175.54 202.15 190.37 K2 201.01 206.99 184.63 219.61 K3 270.21 218.11 213.86 190.66 极差R 46.93 14.19 9.74 9.75 表 5 方差分析表
因素 偏差平方和 自由度 F值 F临界值 P A 3303.955 2 22.901 F0.05 (2,2)=19
F0.10 (2,2)=9<0.05 B 324.996 2 2.253 >0.10 C 144.274 2 1.000 >0.10 D 188.129 2 1.304 >0.10 误差 144.274 2 − − − -
本实验比较并优化了供试品溶液制备方法,并考察了不同型号色谱柱、不同检测波长、不同流动相组成,在此基础上建立了赶黄草中PHG、PGHG、THA的HPLC检测方法,该法能使样品中测定成分与其他成分达到有效分离,峰型好,可简便快速分析样品,检测结果准确可靠。
在建立含量测定方法的基础上进行提取工艺优化。从毒性大小、常用性角度选择乙醇为溶媒,单因素实验结果显示回流法提取效果最佳,因此选择乙醇热回流法作为提取方法,对常规热回流法影响较大的4个因素进行3个水平设置,建立L9(34)正交试验组,以便考察不同参数设定值对赶黄草中大环多酚成分提取率的影响。通过极差及方差分析发现溶媒浓度(A)即乙醇浓度对提取率有显著性影响,而其他3个因素(B、C、D)均无显著性影响。经正交试验优选后的最佳提取工艺为A3B1C3D2,结合生产实际,从节约原料降低成本的角度,对无明显影响的3个因素进行适当调整,调整后的提取工艺为A3B2C1D2,即取赶黄草干药材,切3~5cm小段,加入10倍体积、浓度为80%的乙醇溶液,回流2次,每次2 h。按照该工艺,取3批药材各5 kg,进行3次放大验证试验,提取率均在90%以上,且RSD值为3.73%,说明该工艺稳定可行,可为赶黄草中该类成分的进一步开发研究打下基础。
Content determination and extraction process of macrocyclic polyphenols from Penthorum chinense Pursh
-
摘要:
目的 建立HPLC法同时测定赶黄草中大环多酚类成分:乔松素-7-O-[4'', 6''-(S)-六羟基二苯甲酰基]-β-D-葡萄糖苷(PHG)、乔松素-7-O-[3''-O-没食子酰基-4'', 6''-(S)-六羟基二苯甲酰基]-β-D-葡萄糖苷(PGHG)、乔松素二氢查耳酮-7-O-[3''-O-没食子酰基-4'', 6''-(S)-六羟基二苯甲酰基]-β-D-葡萄糖苷(THA)的含量,并优化其最佳提取工艺。 方法 通过HPLC法测定PHG、PGHG、THA的含量,以PHG、PGHG、THA的总提取率为指标对赶黄草提取物进行分析,采用正交设计考察溶媒浓度、提取时间、溶媒用量、提取次数对提取率的影响,从而优化赶黄草大环多酚类成分的最佳提取工艺。 结果 在采用的含量测定方法下,PHG、PGHG、THA在线性范围内线性关系良好,加样回收率在100.90%~102.04%之间,RSD值均小于1.5%。最佳提取工艺为取赶黄草干药材,切3~5 cm小段,加入10倍体积、浓度为80%的乙醇水溶液,回流2次,每次2 h。该工艺下,大环多酚提取率超过90%。 结论 新建立的含量测定方法准确稳定,重复性好;经优化的提取工艺稳定可行,可为该类成分的进一步开发利用打下基础。 Abstract:Objective To establish an HPLC method for simultaneous assay of macrocyclic polyphenols from Penthorum chinense Pursh, pinocembrin-7-O-[4'', 6''-(S)-hexahydroxydiphenoyl]-β-D-glucose (PHG), pinocembrin-7-O-[3''-O-galloyl-4'', 6''-(S)-hexahydroxydiphenoyl]-β-D-glucose (PGHG) and pinocembrin dihydrochalcone-7-O-[3''-O-galloyl-4'', 6''-(S)-hexahydroxydiphenoyl]-β-D-glucoside or thonningianin A (THA), and optimize the extraction process. Methods The total extraction rate of PHG, PGHG, THA was used as an investigated index to analyze the extracts from Penthorum chinense Pursh. Orthogonal design was applied to evaluate solvent amount, extraction time, solvent concentration and extraction times as the influencing factors for the optimal extraction process of macrocyclic polyphenols from Penthorum chinense Pursh. Results When this content assay method was adopted, there were good linear relationships for PHG, PGHG, THA in the linear range. The recoveries were between 100.90% to 102.04% with the RSDs below 1.5%. The optimal extraction process was involved in cutting Penthorum chinense Pursh into 3-5 cm, adding 10 times 80% ethanol aqueous solution by volume and refluxing 2 hours twice. The extraction rate of macrocyclic polyphenols was above 90% with this process. Conclusion This assay method is accurate, stable, and repeatable. The optimized extraction process is stable and feasible for further development and utilization. -
Key words:
- Penthorum chinense Pursh /
- HPLC /
- PHG /
- PGHG /
- THA /
- orthogonal method /
- extraction process
-
雀梅藤Sageretia thea(Osbeck)Johnst又名雀梅刺、对角刺、碎米子等,为鼠李科雀梅藤属植物,主要分布地区包括云南、安徽、江苏等[1-2]。根、茎、叶均可入药,其性甘、淡、平,具有降气化痰、祛风利湿等功效[3]。民间常用雀梅藤药材煎汤或浸酒内服治疗乳腺肿瘤、淋巴结肿大和水肿等疾病,具有较好效果[4]。现代药理研究表明,雀梅藤具有抗结直肠癌、抗炎、抗氧化、抗病毒、抗菌和肝保护等活性[5-6],但尚未见雀梅藤对乳腺癌等其他肿瘤影响的报道。该研究通过多种体外实验观察雀梅藤对乳腺癌细胞增殖及凋亡的影响,并初步探索其作用机制,以证实民间应用该药材治疗乳腺肿瘤的合理性,为进一步的药物开发奠定基础。
1. 材料和仪器
1.1 试剂和仪器
CCK8 试剂盒(大连美仑生物技术有限公司);Spark酶标仪(瑞士Tecan公司);二氧化碳培养箱(Thermo Fisher);96孔培养板(泰坦);电子分析天平(塞多利斯 BSA2245-CW);细胞计数仪(Corning 6749);倒置相差显微镜(奥林巴斯 IX73)。
1.2 药材提取
雀梅藤药材购自昆明井田药业有限公司,生产许可证号:滇20160155。经海军军医大学药学系生药学教研室辛海量教授鉴定为鼠李科雀梅藤属植物雀梅藤Sageretia thea(Osbeck)Johnst.的茎。取雀梅藤干燥药材660 g,粉碎后用8倍量75%乙醇回流提取3次,每次1.5 h。合并提取液,过滤后回收溶剂,得乙醇提取物。乙醇提取物用水溶解混悬,加入等体积的石油醚萃取3次,收集萃取液,通过旋转蒸发得到石油醚萃取部位。进一步采用真空冷冻干燥机在−80 ℃下冻干,分别称重,获得乙醇和石油醚提取物质量为57 g和0.91 g,提取得率分别为8.63%和0.13%。
1.3 提取物溶解
称取20 mg雀梅藤石油醚提取物溶于1 ml的DMSO溶剂中,然后用培养液稀释成不同药物浓度,药物最高剂量下的DMSO浓度不超过0.3%。同时,对照组培养液中添加0.3%的DMSO作为阴性对照。
1.4 细胞株
三阴性人乳腺癌细胞株MDA-MB-231、BT549购自中国科学院上海细胞库;人脐静脉血管内皮细胞株购自上海赋望实业有限公司。
2. 方法
2.1 细胞活力分析
分别取对数生长期的人三阴性乳腺癌细胞株MDA-MB-231和BT549及人脐静脉血管内皮细胞株(HUVEC)并计数,以每孔5×103个的细胞密度接种到96孔板,在37 ℃的细胞培养箱中过夜培养至细胞贴壁。实验分为对照组和给药组,对照组以正常培养基培养,给药组以不同浓度含药培养基孵育细胞24 h。随后按试剂盒说明书进行操作,每孔加入10%的CCK8试剂,在培养箱中孵育2 h后,用酶标仪在450 nm处检测各孔的吸光度(OD)值。对照组细胞活力换算为100%,其余各给药组按以下公式计算:细胞增殖抑制率(%)=[(对照组A值−实验组A值)/(对照组A值−空白组A值)]×100%。
2.2 平板克隆试验
取上述对数生长期的人三阴性乳腺癌细胞株,以每孔500个细胞的密度均匀接种在12孔板内,过夜,使细胞贴壁,随后加入雀梅藤提取物孵育24 h。吸弃培养基,用含10%的胎牛血清培养基继续培养,当培养皿中出现肉眼可见的克隆形成时,终止培养。吸弃上清液,用PBS小心浸洗,然后甲醇固定。去除固定液,加入适量的结晶紫染色液进行染色,采用PBS多次轻轻洗去周边染色液,干燥后拍照,随后用Image J软件进行统计分析。
2.3 活死细胞分析
将两种乳腺癌细胞接种于96孔板,放置培养箱中过夜,随后加入提取物孵育24 h。吸弃培养基,用PBS温和洗涤细胞一次,每孔加入100 μl的Calcein AM/PI染色工作液,放入37 ℃培养箱中避光孵育15 min后,用高内涵系统采集图像。
2.4 细胞周期分析
取对数生长期乳腺癌细胞株,以每孔40万个细胞接种于6孔板,培养箱中过夜,待细胞贴壁后,用含不同浓度提取物的培养基处理24 h,消化,离心收集细胞,以预冷的70%乙醇混悬固定过夜。离心,去除乙醇,用PBS清洗一次,加入500 μl的碘化丙啶染色工作液,避光染色30 min后用流式细胞仪分析细胞周期。
2.5 流式凋亡分析
将对数生长期的三阴性乳腺癌细胞株以每孔40万个接种于6孔板中,过夜,待细胞贴壁后,用含不同浓度提取物的培养基孵育24 h。消化,离心收集细胞,用100 μl的1×结合缓冲液混悬后加入FITC Annexin V 和PI各5 μl,轻微振荡,室温下避光孵育15 min,流式细胞仪分析凋亡率。
2.6 DAPI染色分析
将上述对数生长期的人三阴性乳腺癌细胞株以每孔20万个接种于6孔板,过夜,待细胞贴壁后,用含不同浓度提取物的培养基孵育24 h,吸弃培养基,每孔加入1 ml稀释过的DAPI染液孵育细胞10 min,PBS清洗2遍后采用Cytation 5拍照。
2.7 线粒体膜电位(MMP)分析
将对数生长期的人三阴性乳腺癌细胞株以每孔20万个接种于6孔板,过夜,待细胞贴壁后,用含不同浓度提取物的培养基孵育细胞24 h。吸弃培养液,PBS洗涤细胞之后每孔加入1 ml的JC-1染液,在37 ℃培养箱中孵育20 min。吸除上清液,用缓冲液洗涤细胞3次后加入2 ml细胞培养液,高内涵系统拍照。
2.8 活性氧(ROS)含量检测
取上述对数生长期细胞株,以每孔20万个的细胞密度接种于6孔板,过夜,待细胞贴壁后,用含不同浓度提取物的培养基孵育24 h。吸弃培养基,每孔加入1 ml含DCFH-DA的新鲜培养基孵育细胞20~30 min,DAPI复染,采用高内涵系统拍照。
2.9 统计学处理
使用Graphpad Prism 8.0.1分析软件对所获得的实验数据进行统计学分析,组间比较采用单因素方差分析,两组比较采用t检验,以P<0.05为差异有统计学意义。
3. 结果
3.1 抑制乳腺癌细胞生长
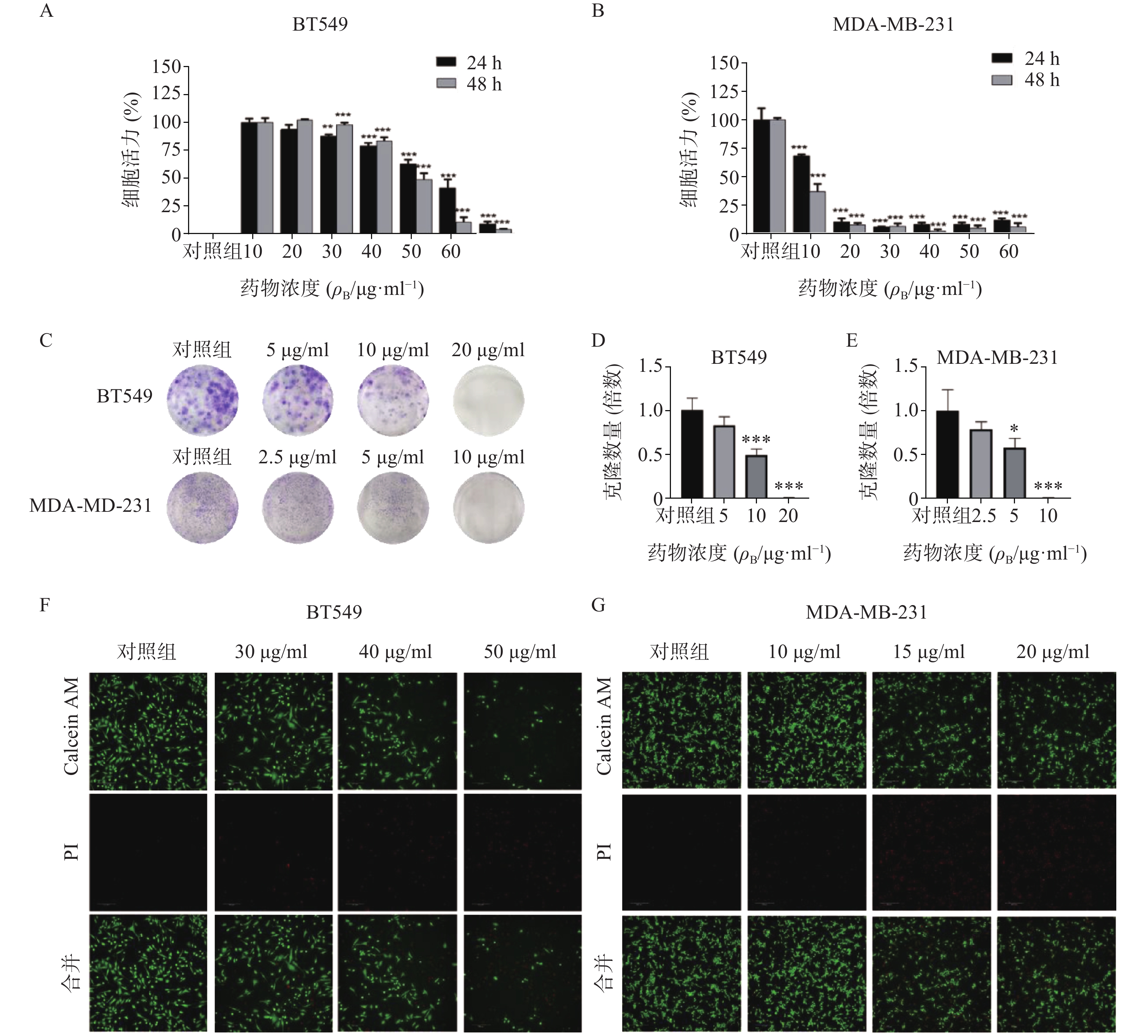
通过细胞活力分析发现,雀梅藤石油醚提取部位对多种癌细胞均有明显细胞毒性,其中对乳腺癌细胞株抑制作用最强,而且明显强于乙醇提取物。结合临床应用,实验选择两种人三阴性乳腺癌系(BT549和MDA-MB-231)进一步研究(见图1)。CCK8结果表明(图1A-B),雀梅藤石油醚提取物以剂量和时间依赖的方式抑制乳腺癌细胞活力,作用24 h和48 h的IC50值分别为45.40、12.23 μg/ml和38.87、7.60 μg/ml。平板克隆实验结果显示(图1C-E),随着雀梅藤石油醚提取物剂量的增加,两种乳腺癌细胞生长均被显著抑制。浓度分别在10 μg/ml和20 μg/ml时,MDA-MA-231和BT549细胞株的生长被完全抑制。Calcein AM/PI活死细胞染色显示(图1F-G),随着药物剂量增加,活细胞(绿色)数量较对照组显著减少,而死亡细胞(红色)数量则显著增加,与对照组比较有极显著差异。
3.2 诱导乳腺癌细胞周期阻滞
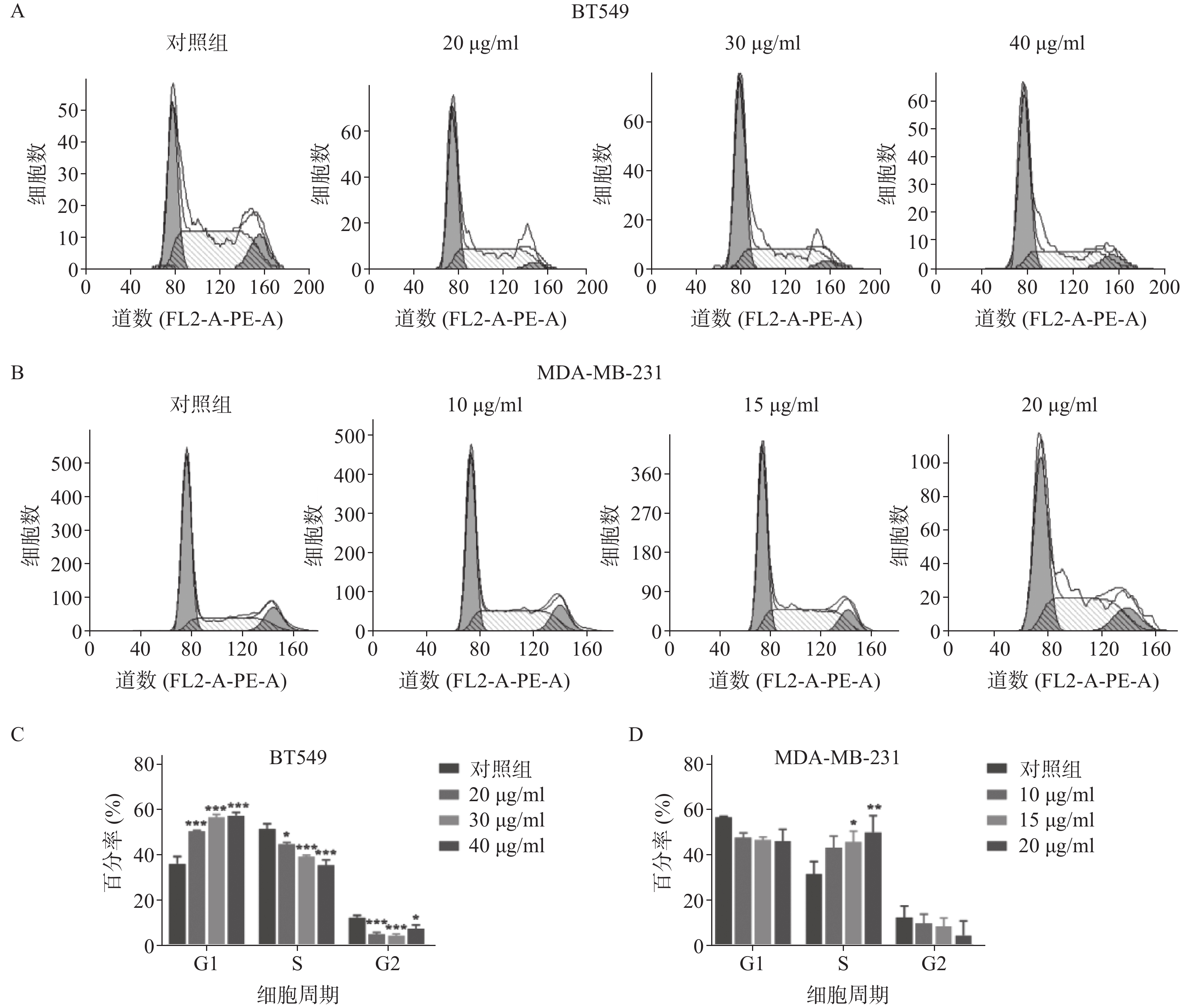
雀梅藤石油醚提取物孵育乳腺癌细胞24 h后,采用流式细胞仪测定细胞的增殖周期情况(见图2)。结果显示,药物明显阻滞两种乳腺癌细胞株的细胞周期,但对两种细胞阻滞周期不同,BT549细胞阻滞在G1期(图2A和2C,给药组G1期细胞比率较对照组显著升高),MDA-MA-231细胞阻滞在S期(图2B和2D,给药组S期细胞比率较对照组显著升高),提示石油醚提取物对两种细胞株的细胞周期阻滞可能存在不同机制。
3.3 诱导乳腺癌细胞凋亡
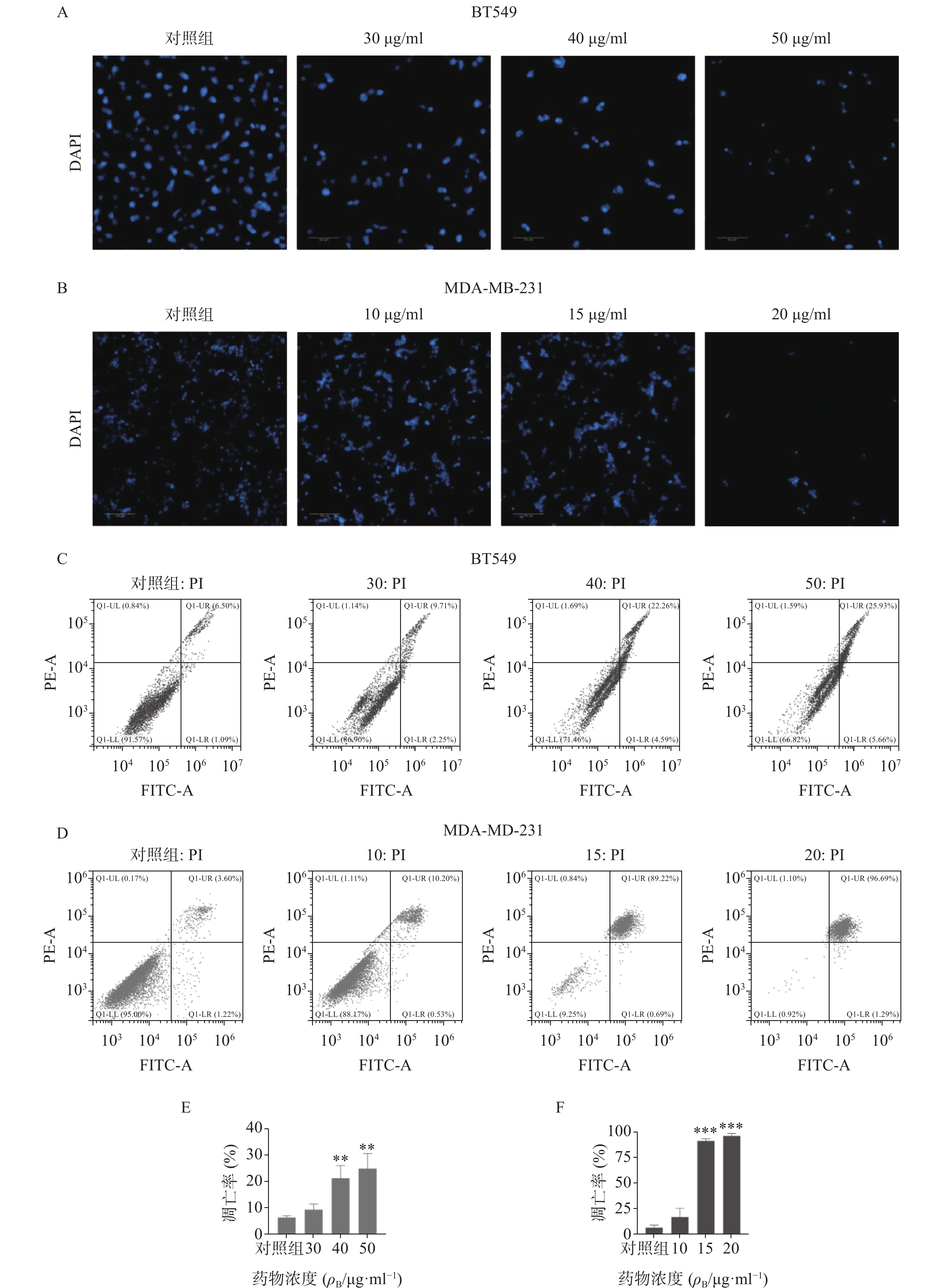
采用DAPI染色方法对细胞核形态进行分析(见图3)。如图3A-B所示,正常对照组乳腺癌细胞核呈均匀的圆形浅蓝色,药物处理后细胞核质固缩或碎裂成凋亡小体,且呈剂量依赖性。流式细胞仪凋亡定量分析显示(图3C-F),石油醚提取物显著增加两种乳腺癌细胞的凋亡率,与对照组比较有显著性差异,其中尤以MDA-MA-231细胞株明显,20 μg/ml浓度下几乎诱导细胞全部凋亡。
3.4 诱导线粒体膜电位坍塌
线粒体通路是肿瘤细胞最常见的凋亡途径,最典型的特征是线粒体膜电位(MMP)水平显著下降。因此,研究采用JC-1免疫荧光染色检测线粒体膜电位水平。结果如图4所示,给药组红色荧光随剂量增加明显减弱,绿色荧光则明显增强,说明给药组线粒体膜电位显著下降。实验结果提示,雀梅藤石油醚提取物可能通过损伤线粒体而促进了乳腺癌细胞凋亡。
3.5 促进乳腺癌细胞活性氧生成
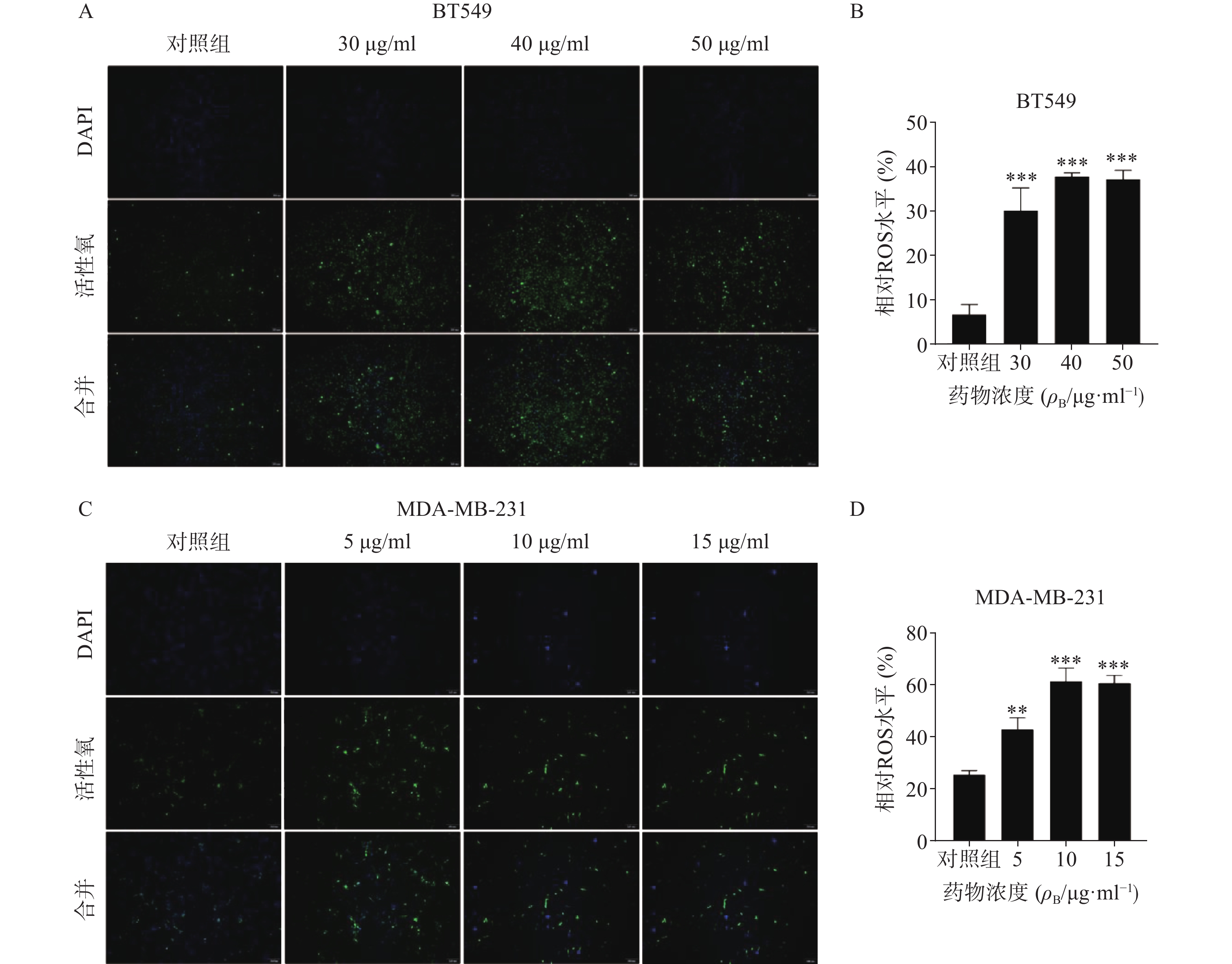
ROS升高是激活线粒体通路诱导肿瘤细胞凋亡的重要原因之一,因此进一步检测了药物处理24 h后ROS含量变化(图5)。结果代表ROS水平的绿色荧光在对照组仅有少量表达,而在给药组则显著增加,经统计学处理有显著性差异,其中尤以BT549细胞株明显,提示药物可能通过促进ROS生成而诱导了乳腺癌细胞凋亡。
3.6 对正常血管内皮细胞活力的影响
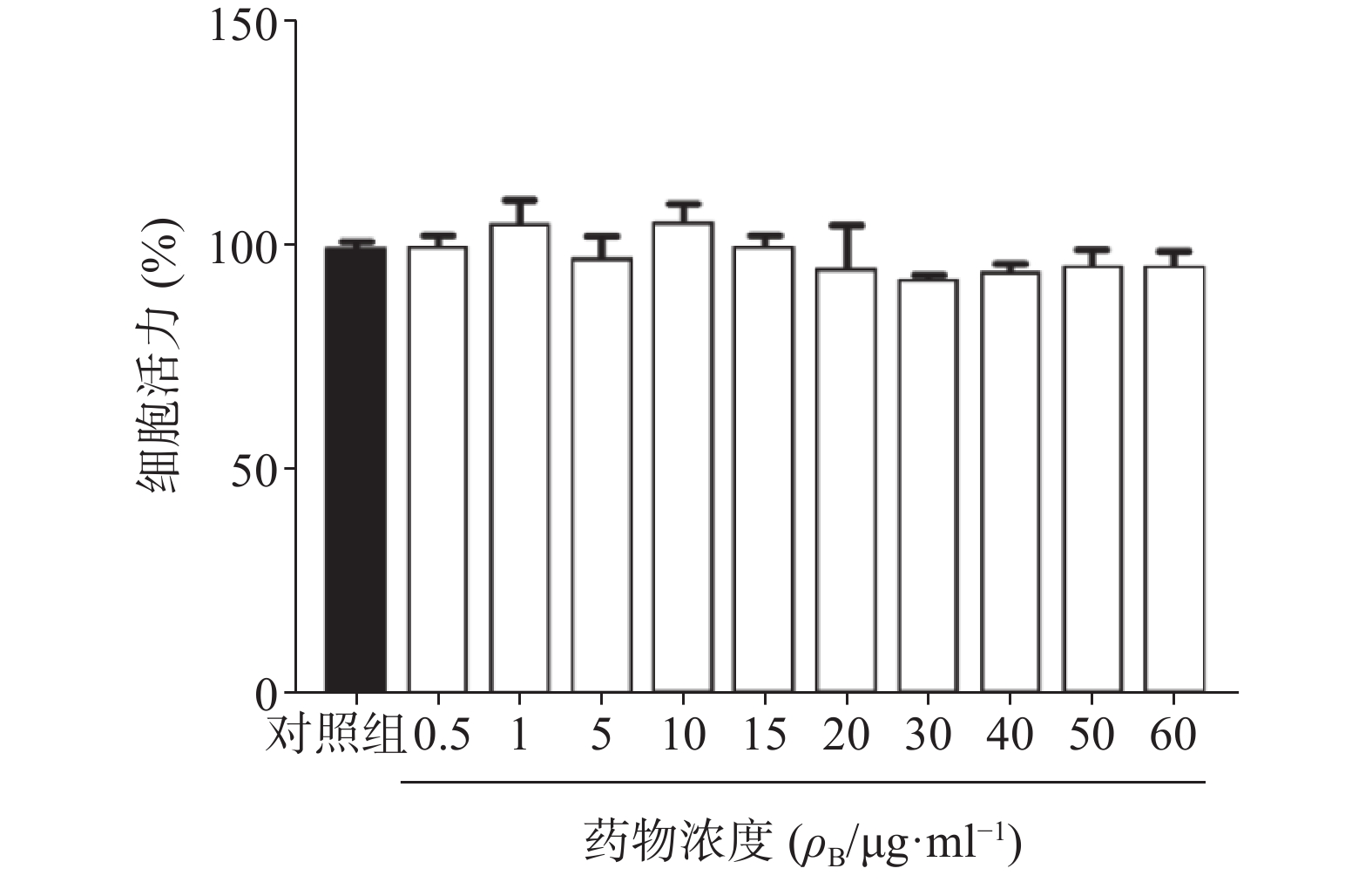
为了确定雀梅藤提取物是否对正常细胞产生毒性,进一步采用同样剂量对人正常脐静脉血管内皮细胞(HUVEC)进行CCK8细胞活力分析。结果提取物孵育24 h后,即使在60 μg/ml的最高浓度下亦未观察到内皮细胞活力受到影响,与对照组比较无明显差异(图6),提示雀梅藤石油醚提取物对正常细胞并不产生毒性,具有较好的安全性。
4. 讨论
雀梅藤为云南等地民间常用中药,临床观察发现其对乳腺瘤生长有明显抑制作用[7],且毒性较小[4, 8]。研究前期对雀梅藤的乙醇、石油醚、乙酸乙酯、二氯甲烷、正丁醇等5个部位提取物进行了多种肿瘤细胞活性筛选,结果显示,对多数癌细胞,如乳腺癌、结肠癌、肝癌等,都具有明显杀伤作用,其中以石油醚部位提取物对癌细胞作用最为显著。进一步实验发现,雀梅藤石油醚提取物时间和剂量依赖地抑制乳腺癌细胞活力,显著减少细胞克隆形成率,阻滞细胞周期在G1/S期,明显增加癌细胞凋亡率,但并不影响正常血管内皮细胞活力,提示其细胞毒性具有明显的选择性。
引起细胞凋亡的途径包括线粒体通路、死亡受体通路和内质网应激通路,其中线粒体通路是药物诱导肿瘤细胞凋亡的最常见途径[9],因此研究人员进一步观察了雀梅藤石油醚提取物是否通过损伤线粒体诱导乳腺癌细胞凋亡。结果通过JC-1染色发现,两种乳腺癌细胞的线粒体膜电位均显著降低,提示雀梅藤提取物诱导了细胞线粒体途径的凋亡。
ROS的主要来源之一是线粒体内膜的呼吸链底物端,ROS升高会引起线粒体内膜损伤,造成细胞毒性,从而促进肿瘤细胞凋亡[10]。研究人员用荧光探针方法检测雀梅藤石油醚提取物孵育BT549和MDA-MB-231细胞后的ROS水平,结果发现代表ROS的绿色荧光逐渐增强,表明石油醚提取物显著升高了线粒体内ROS水平。这些结果提示,石油醚提取物可能通过升高线粒体内ROS水平,造成ROS累积,损伤了线粒体,导致线粒体内容物如细胞色素c等流出到细胞质,进而激活caspase级联瀑布反应,从而诱导了细胞凋亡[9,11]。
虽然雀梅藤提取物在体外研究中表现出较好的抗乳腺癌细胞生长作用,但是凋亡信号转导通路和作用靶点尚不明确,线粒体中蛋白表达的变化犹未可知,因此具体作用机制尚需进一步研究。此外,已有研究人员从雀梅藤药材中鉴定出43种化学成分,可分为有机酸类、黄酮类及其他类,有机酸类包括儿茶素及其衍生物等,黄酮类包括异槲皮素等[12]。但是雀梅藤提取物中究竟何种成分发挥主要抗癌作用仍需进一步证实。
-
表 1 赶黄草药材来源信息表
样品编号 采集地区 批号 提供单位 S1 四川古蔺 18110803 四川古蔺肝苏药业有限公司 S2 四川古蔺 18110804 四川古蔺肝苏药业有限公司 S3 四川古蔺 19050701 四川新荷花中药饮片有限公司 表 2 赶黄草中3种化合物的含量(n=3)
样品编号 PHG/
(mg/g)PGHG/
(mg/g)THA/
(mg/g)总含量/
(mg/g)S1 3.66 5.12 1.99 10.77 S2 7.06 8.26 1.77 17.09 S3 5.69 9.73 1.25 16.67 表 3 正交试验因素水平表
水平 A因素 B因素 C因素 D因素 溶媒浓度(%) 提取时间(t/h) 溶媒用量(倍) 提取次数(次) 1 40 1 10 1 2 60 2 20 2 3 80 3 30 3 表 4 正交试验结果表
试验号 A因素 B因素 C因素 D因素 总提取率(%) 溶媒浓度(%) 提取时间(t/h) 溶媒用量(倍) 提取次数(次) 1 1 1 1 1 32.27 2 1 2 2 2 46.67 3 1 3 3 3 50.47 4 2 1 2 3 50.40 5 2 2 3 1 70.53 6 2 3 1 2 80.07 7 3 1 3 2 92.86 8 3 2 1 3 89.79 9 3 3 2 1 87.56 K1 129.41 175.54 202.15 190.37 K2 201.01 206.99 184.63 219.61 K3 270.21 218.11 213.86 190.66 极差R 46.93 14.19 9.74 9.75 表 5 方差分析表
因素 偏差平方和 自由度 F值 F临界值 P A 3303.955 2 22.901 F0.05 (2,2)=19
F0.10 (2,2)=9<0.05 B 324.996 2 2.253 >0.10 C 144.274 2 1.000 >0.10 D 188.129 2 1.304 >0.10 误差 144.274 2 − − − -
[1] 何述敏, 李敏, 吴众, 等. 扯根菜的研究进展[J]. 中草药, 2002(6):102-103. [2] 胡杨洋, 王胜鹏, 陈锐娥, 等. 赶黄草的药学研究和应用[J]. 中药药理与临床, 2012, 28(3):136-140. [3] 杨丽娜, 周承芳, 曾棋平, 等. 赶黄草保肝活性成分的提取纯化工艺研究进展[J]. 解放军药学学报, 2018, 34(2):169-171. [4] 肖丽萍, 宋洋洋, 周彦希, 等. 赶黄草抗非酒精性脂肪肝的实验研究[J]. 中国实验方剂学杂志, 2014, 20(10):125-129. [5] CAO Y W, JIANG Y, ZHANG D Y, et al. Protective effects of Penthorum chinense Pursh against chronic ethanol-induced liver injury in mice[J]. J Ethnopharmacol,2015,161:92-98. doi: 10.1016/j.jep.2014.12.013 [6] HU Y Y, WANG S P, WANG A Q, et al. Antioxidant and hepatoprotective effect of Penthorum chinense Pursh extract against t-BHP-induced liver damage in L02 cells[J]. Molecules,2015,20(4):6443-6453. doi: 10.3390/molecules20046443 [7] 张冲. 不同浓度乙醇赶黄草提取物对大鼠酒精性脂肪肝的治疗作用及机制研究[D]. 四川医科大学, 2015. [8] 唐勇, 张冲, 李国春, 等. 赶黄草乙醇提取物对大鼠酒精性脂肪肝的作用[J]. 中成药, 2016, 38(7):1601-1605. [9] 李国春, 黄新武, 尹加珍, 等. 赶黄草提取物对大鼠酒精性脂肪肝的影响[J]. 中国临床药理学杂志, 2016, 32(2):163-165. [10] 解静. 赶黄草提取物对胆汁淤积性肝细胞损伤的保护作用[D]. 西南医科大学, 2016. [11] WANG M, ZHANG X J, FENG R B, et al. Hepatoprotective properties of Penthorum chinense Pursh against carbon tetrachloride-induced acute liver injury in mice[J]. Chin Med,2017,12:32. doi: 10.1186/s13020-017-0153-x [12] 孙晓梅, 阎姝. 复方赶黄草对ANIT致大鼠胆汁淤积性肝损伤的影响及作用机制研究[J]. 中药材, 2018, 41(3):716-719. [13] 覃俊媛, 谢晓芳, 杨雪, 等. 2个产地赶黄草对四氯化碳致大鼠急性肝损伤的保护作用[J]. 中成药, 2018, 40(7):1592-1594. doi: 10.3969/j.issn.1001-1528.2018.07.031 [14] 张剑, 伍淑明, 杨肖, 等. 赶黄草中化学成分研究进展[J]. 中草药, 2017, 48(21):4571-4577. doi: 10.7501/j.issn.0253-2670.2017.21.033 [15] 黄豆豆. 肝苏颗粒质量控制研究[D]. 上海: 第二军医大学, 2014. [16] WANG A Q, WANG S P, JIANG Y, et al. Bio-assay guided identification of hepatoprotective polyphenols from Penthorum chinense Pursh on t-BHP induced oxidative stress injured L02 cells[J]. Food Funct,2016,7(4):2074-2083. doi: 10.1039/C6FO00110F [17] ZHOU F Y, WANG A Q, LI D, et al. Pinocembrin from Penthorum chinense Pursh suppresses hepatic stellate cells activation through a unified SIRT3-TGF-β-Smad signaling pathway[J]. Toxicol Appl Pharmacol,2018,341:38-50. doi: 10.1016/j.taap.2018.01.009 [18] HUANG D D, JIANG Y, CHEN W S, et al. Evaluation of hypoglycemic effects of polyphenols and extracts from Penthorum chinense[J]. J Ethnopharmacol,2015,163:256-263. doi: 10.1016/j.jep.2015.01.014 [19] 姚宏亮, 沈洁, 佴逸凡. 藕皮多酚提取工艺优化及其体外抗氧化性研究[J]. 食品研究与开发, 2019, 40(14):103-108. [20] 窦志华, 曹瑞, 卞理, 等. 正交试验法优选大黄中蒽醌类成分提取工艺[J]. 中草药, 2018, 49(14):3279-3286. doi: 10.7501/j.issn.0253-2670.2018.14.013 [21] 高林晓, 郭蒙, 郭茂鸿, 等. 正交试验设计优化刺三加根中总多酚的提取工艺研究[J]. 食品研究与开发, 2019, 40(13):57-62. -





 下载:
下载:
 下载:
下载: