-
飞机草 Chromolaena odorata(L.)R. M. King & H. Rob. 为菊科Asteraceae飞机草属Chromolaena多年生草本植物,别名香泽兰、民国草、解放草、破坏草等。原产于中南美洲,1930年代传入我国,被用作植物农药杀虫、沤肥原料以及止血药。随着国内外研究的深入,飞机草的性能与功用值得重新认识挖掘。本文对飞机草的临床应用、药理作用、化学成分、毒副作用等相关文献进行全面查阅分析,并结合中医药理论对飞机草的中药性能、功效、应用、用法用量进行探讨分析,以期为该植物作为中药资源应用于中医临床研究与治疗提供理论依据。
-
选取国内的中国知网、维普、万方数据、中国生物医学文献数据库和国外的 PubMed, Web of Science, Scopus, Embase, and SciFinder 文献数据库进行检索,检索时间为自建库至 2023年10月20日。
-
对国内数据库采用高级检索方式,主题词输入中文名“飞机草”进行检索,从中国知网中检索到393篇、维普中207篇、万方数据中213篇、中国生物医学文献数据库中57篇。根据文章题目、摘要,筛除不相关和重复文献,最终纳入文献共50篇。对国外数据库中也采用高级检索方式,输入检索词为飞机草拉丁名“Chromolaena odorata” 或 “Eupatorium odoratum”,从PubMed 中检索到481篇,Web of Science中 794篇,Scopus 中861篇,Embase中 466篇,SciFinder 910篇,最终纳入文献共397篇。
-
纳入研究飞机草的临床应用、药理作用、化学成分及毒副作用相关的文献。
-
剔除: ①重复的文献; ②文章内容涉及飞机草但与研究内容不相关的文献; ③文章信息不全的文献。
-
在数据库中选中所有检索的文献,导出题录数据包,随即导入NoteExpress 3.9.0。使用NoteExpress 3. 9. 0 软件对导入的题录按“年份、作者、标题、来源”等字段进行分类,按照标准进行纳入与排除。
-
飞机草为菊科泽兰属多年生丛生型草本或亚灌木,原产于中南美洲,1882年前已引种至印度,1922年前作为香料植物被引种至泰国,1934年首次在我国云南南部和海南尖峰山发现,因繁殖传播速度极快而得名,现主要分布于我国广东、广西、云南、海南、贵州、香港、澳门、台湾等地[1]。飞机草虽因其强大的入侵能力于2003年被列入《中国第一批外来入侵物种名单》,但其潜在价值已得到多方面开发:在农业领域,被用作堆肥原料和植物源农药;在医药领域,被用作止血药,如《常用中草药手册》中记载其具有“杀虫、止血”功效,可用于治疗旱蚂蟥咬伤出血等症状。《全国中草药汇编》和《中华本草》上也均收录了飞机草的药用价值。
-
飞机草中的化学成分以黄酮类与萜类为主,其中黄酮类主要有金合欢素、异樱花素、飞机草素、槲皮素、山柰酚与木犀草素等活性物质,具有较好的抗炎、抗菌、抗氧化等活性;挥发油中的主要成分是萜类化合物,有泽兰醇、羽扇豆醇、石竹烯等,具有较好的抗菌活性[2]。
-
飞机草作为近代入侵植物,在我国的应用历史较短,主要用于散瘀消肿、止血杀虫等。现代研究发现其药理作用有抗菌、止血、促愈合、抗炎、抗氧化、解热镇痛、抗疟杀虫、抗糖尿病及其他作用等。
-
飞机草的抗菌效果非常广泛,对革兰氏阳性菌和革兰氏阴性菌、人体和植物机会致病菌均有显著的抑制作用,如对金黄色葡萄球菌、大肠杆菌、铜绿假单胞菌、白念珠菌、结核分枝杆菌等具有抗菌活性[3-4]。
-
飞机草在国内外民间被广泛用作止血药,如国内将其与传统止血药裸花紫珠进行联合使用,发现比单用具有更佳的止血与促凝效果;在印度还发现其具有改善A型血友病患者的凝血能力[5]。研究表明,飞机草可能是通过改变血红素氧合酶1、血栓素合成酶和抗血小板聚集的基质金属蛋白酶-9等基因的表达来缩短体外出血时间[6] 。
-
飞机草有显著的促进伤口愈合的作用,如不同浓度的飞机草水和乙醇提取物均能加速伤口愈合[7];飞机草叶对深Ⅱ度烧伤小鼠模型创面表皮再生和胶原沉积有较好的效果[8]。通过分子对接发现,其内含的β-生育酚和角鲨烯与血管内皮生长因子展现出显著的结合亲和力[9]。
-
飞机草具有显著的抗炎活性,其二氯甲烷、丙酮、乙醇、甲醇和水提取物的抗炎活性均优于槲皮素[10],机制可能与抑制NF-κB及p38 MAPK信号通路有关[11]。
-
飞机草富含黄酮类、酚类和萜类化合物,具有强自由基清除活性,能有效用于抗蛋白质纤维化和氧化损伤相关疾病[12]。飞机草花中的化合物(drahebephin B)比奎诺二甲基丙烯酸酯(Trolox)有更高的抗氧化活性[13]。
-
飞机草对化学和热刺激致痛有明显的镇痛作用,既有中枢也有外周的镇痛作用,可能与其降低中枢和外周NO和前列腺素E2含量有关[14]。Owoyele等[15]通过动物实验验证了飞机草解热镇痛的作用。
-
飞机草的抗疟活性显著,为尼日利亚等非洲国家民间抗疟药物之一,且其抗疟活性与氯喹和复方蒿甲醚相当[16]。此外,飞机草还被用作杀虫剂,灭杀蚊蝇、植物害虫和寄生线虫等[17-18]。
-
飞机草在国外民间被广泛用于治疗糖尿病,实验研究证实其对链脲佐菌素诱导的大鼠糖尿病及白内障有逆转作用[19],机制可能与上调葡萄糖转运蛋白2、葡萄糖激酶和Nrf2 mRNA的表达,抑制keap1 mRNA的表达等有关[20]。
-
研究还发现飞机草有降血脂、抗肿瘤、促进神经发生等的作用,如对酒精引起的血脂升高有抑制作用[21];对人乳腺癌和结肠癌细胞表现出显著的抑制作用[22];通过激活Raf/ERK1/2信号通路,上调神经细胞增殖、分化及成熟过程中关键蛋白的表达,从而促进神经发生[23] 。
-
指药物的寒、热、温、凉4种药性,反映了药物对人体阴阳盛衰、寒热变化的作用倾向,即《神农本草经》中的“疗寒以热药,疗热以寒药”。《中华本草》等文献中记载,飞机草味微辛,性温,仅外用于散瘀消肿、止血,并无内服记载,不能完全反映其四气之性。而飞机草含有丰富的黄酮类化合物,具有一定的抗炎、解热镇痛、中枢神经抑制等作用,根据其作用趋向因此推断其性质偏寒凉。从飞机草收敛止血、解毒生肌、截疟杀虫的功效中可以看出其偏性不强,应属凉性。但由于证实其寒凉之性的相关文献较少,具体需结合临床反馈进一步验证。
-
即辛、甘、酸、苦、咸5种基本的滋味,此外还有涩和淡两种分属于酸和甘的滋味,主要依据药物的作用和真实的滋味来推定。飞机草又名香泽兰,内含丰富的挥发油,味道芳香浓烈,因此推断飞机草具有“辛”味。此外,飞机草内含丰富的单宁,属“涩”味,且其还有显著的止血促愈合的作用,这与中医理论中的“涩能收敛固涩”相符,因此推断飞机草也具有“涩”味。
-
飞机草在动物的急性与亚急性毒性实验中,均未表现出明显毒性,结果如表1所示。但是其内含吡咯里西啶类生物碱,有潜在毒性[24]。《中国有毒植物》中记载“叶有毒,用叶擦皮肤可引起红肿、起泡,误食嫩叶出现头晕、呕吐,还可毒鱼、杀虫”。因此推测飞机草有小毒,且有皮肤致敏性,使用时需注意用法用量。
-
指药物对人体向上、向下、向内、向外的作用趋向,中医理论认为具有收敛固涩作用的药物能下行向内,而具有杀虫等功效的药物则趋向不明显[28],如收敛止血药中的白及、仙鹤草、棕榈炭等均趋向沉降。飞机草具有收敛止血、解毒生肌、截疟杀虫之效,因此推断其趋向沉降。
-
表示药物作用的定位,以所治病症为依据而确定。飞机草功能收敛止血,适用于体内、外各种出血症状。而中医理论认为心主血脉,行血以输送营养物质,使全身各脏腑获得充足的营养;肝主疏泄而藏血,既能储血又能造血。因此推断飞机草归心、肝二经。
-
文献计量分析显示,数据库收录的23篇飞机草止血相关研究中,15篇(65.2%)以叶为药用部位,7篇(30.4%)使用全草或地上部分,仅1篇(4.3%)研究其单体化合物。且传统应用也主要为全草和叶,因此建议飞机草的入药部位为全草或叶,在4~12月枝叶茂盛或含苞待放时采收。
-
飞机草能显著减少止血时间,加快创面愈合,并具有一定的抗菌、抗炎活性,有助于外伤恢复,因此在国内外主要被用于外伤止血。中医理论认为,除外伤出血外,出血症还包含血液不循常道所致的内出血,如咯血、咳血、吐血、便血、衄血、尿血、崩漏、紫癜等。从动物实验结果来看,Okoroiwu等[29]在大鼠模型上对飞机草体内外止血作用进行了验证。因此,除治疗外伤出血外,也能推断飞机草对吐血、咯血等内出血具备一定的止血作用。疮疡是各种致病因素侵袭人体后引起的一切体表化脓感染性疾病的总称,其致病因素主要包括外感和内伤两大类。在感染部位,致病菌也通常发挥着至关重要的作用。而飞机草具有显著的抗菌作用,能有效抑制疮疡肿毒中的致病菌,且其所具有的促进伤口愈合、抗炎与抗氧化等药理活性,也能同时促进病区快速消肿并恢复。综上所述,推断飞机草具有收敛止血、解毒生肌的功效,可用于外伤出血、吐血、咯血、疮疡肿毒等。
-
疟疾是由疟原虫感染引起的寄生虫病,主要通过雌性按蚊叮咬传播,普遍易感。当前疟疾流行地区主要分布在非洲、东南亚、拉丁美洲、大洋洲等地区。而原产美洲的飞机草经过持续的入侵式传播,现今分布的地区与疟疾流行地区高度重合,也主要分布在拉丁美洲、撒哈拉以南非洲、东南亚和大洋洲。无论是药理活性研究的结果,还是民间使用的经验,都一致证实了飞机草具有抗疟活性,并且从中发现了相关活性成分。此外,20世纪我国人民在劳作过程中被山蚂蟥和水蚂蟥咬伤病例较多,通过实践发现飞机草对于旱蚂蟥咬伤出血有快速止血的作用,且用鲜叶揉碎涂下肢可防治蚂蟥叮咬,因此被收录进许多全国性的中草药手册,如“2.1”中所列的3本著作中均有提及。综上所述,推断飞机草具有截疟杀虫的功效,可用于疟疾、蚂蟥咬伤等。
-
Paul等[30]将飞机草叶水提取物制作成干粉,术前7 d口服500 mg/kg处理,可有效减少肝损伤大鼠54.30%的出血量,以及股动脉损伤家兔70.36%的出血量。参考徐叔云教授主编的《药理实验方法学》中人和动物间按体表面积折算的等效剂量比值计算,人体给药浓度应为79.4 mg/kg,每位成人每天5.56 g的给药量。Okoroiwu等[29]发现飞机草300 mg/kg乙醇提取物具有更佳的体内止血活性,相当于人体给药浓度47.6 mg/kg,成人3.33 g/d的给药量。此外,由表1可知,大鼠急性毒性最低的LD50值为2.154 g/kg,相当于人体的LD50值为0.345 g/kg,成人每天24.125 g的给药量。综上所述,建议飞机草的临床使用剂量为3~6 g。
-
根据上述资料分析,拟定飞机草的基原为菊科植物飞机草的干燥全草或叶,除去杂质,晒干后入药。性味归经为:辛、涩,凉;有小毒;趋向沉降;归心、肝经。功能主治为:收敛止血,解毒生肌,截疟杀虫。用于吐血,咯血,外伤出血,疮疡肿毒,疟疾,蚂蟥咬伤等。用法用量为:3~6 g,水煎服。外用适量,鲜叶捣敷。
飞机草是一种入侵性极强的植物,能分泌化感物质,抑制本土植物生长。自引入中国以来,他迅速在西南和南部地区扩散,数量众多。然而,飞机草也是一种具有较高药用价值的植物,在全球范围内被用于外伤止血、抗糖尿病、抗疟疾和杀虫等。因此,飞机草在医药领域拥有广阔的发展前景,赋予其中药性能,对于飞机草的中药配方和临床合理应用具有进一步的研究价值。目前,飞机草与裸花紫珠已配伍用于外伤止血和抗炎,预计将来还会出现更多类似的配伍应用,如飞机草配伍白及治疗内脏出血,配伍侧柏叶、藕节治疗吐血、咯血,配伍槐花治疗便血,配伍三七治疗疮痈初起,以及配伍白及、黄连、贝母、轻粉治疗疮痈已溃、久不收口者等。深入探究飞机草的中药性能,科学利用外来植物,对于拓展中药资源,保护生态平衡具有重要意义。
Literature study and properties discussion of Chromolaena odorata
-
摘要:
目的 通过对飞机草国内外相关文献研究,依据中医药理论探讨其中药性能,为飞机草与中药合理配伍及临床应用提供理论依据。 方法 从国内的中国知网、维普、万方数据、中国生物医学文献数据库和国外的 PubMed, Web of Science, Scopus, Embase, and SciFinder文献数据库检索并筛选与飞机草相关的医药类文献,纳入研究的英文文献397篇,中文文献50篇,按照临床应用、药理作用、化学成分、毒副作用等角度对其进行系统化归类,并根据中医药理论进行分析。 结果 飞机草味辛、涩,性凉,归心、肝经,有小毒,趋向沉降,功能收敛止血、解毒生肌、截疟杀虫,用于吐血、咯血、外伤出血、疮疡肿毒、疟疾、蚂蟥咬伤等。 结论 研究归纳飞机草的性能功效,可为将其作为中药资源应用于中医临床研究与治疗提供理论依据。 Abstract:Objective To provide theoretical basis for the clinical application of the rational compatibility of C. odorata by studying the related domestic and international literature and exploring the properties of C. odorata according to the theory of Traditional Chinese Medicine. Methods The medical literature related to C. odorata was retrieved and screened from CNKI, VIP, Wanfang Data, China Biomedical Literature Database and foreign literature databases such as PubMed, Web of Science, Scopus, Embase, and SciFinder. A total of 397 English articles and 50 Chinese articles were included in the study, which were systematically classified according to clinical application, chemical composition, pharmacological effect, toxic and side effects, and were analyzed according to the theory of Traditional Chinese Medicine. Results C. odorata features spicy, astringent tastes, a cool nature, entering heart and liver meridians, and a slightly toxic.Its functions include astringing to stop bleeding, detoxifying and promoting tissue regeneration, as well as intercepting malaria and killing parasites. It is used for conditions such as hematemesis, haemoptysis, traumatic bleeding, sores and abscesses, malaria, and leech bites. Conclusion The exploration of the properties and efficacy of C. odorata could provide reference for its clinical research and application in Traditional Chinese Medicine. -
流感是一种严重的上呼吸道病毒感染,由于其高毒力和突变率,该病毒仍然是对公众健康的主要威胁。据美国疾病控制与预防中心和世界卫生组织估计,每年有多达65 万人死于季节性流感引起的呼吸道疾病[1]。传统中医药预防和治疗流感病毒导致的感染(如呼吸道肺炎和支气管炎)已成为中国临床上常规治疗策略,发挥了独特的医疗优势[2,3]。
感冒安颗粒是由金银花、连翘、板蓝根、拳参、桑叶、紫苏和荆芥等七味中药制成的复方制剂,临床应用30 多年,具有疏散风邪,解表退热功能,其预防和治疗呼吸道感染的作用已得到很好的临床验证,特别是在病毒感染初期的治疗效果尤其显著,但药效物质基础并不清楚。目前,建立了TLC法对方中的板蓝根和连翘两味药材进行特征鉴别;同时对方中各药味的共有成分绿原酸和齐墩果酸也建立了TLC鉴别方法。在含量限度方面,则建立了制剂中连翘酯苷A的HPLC法。尽管这些获批的标准已用于制剂常规质量控制,但尚需进一步进行质量评价,以期更客观、准确地反映感冒安颗粒的临床疗效。
由于中药复方复杂的化学成分,它的药理作用是通过多靶点、多途径而实现的。流感病毒感染的病理生理过程主要是病毒的直接作用和宿主免疫反应损伤(如细胞因子风暴所致的炎性损伤和ROS导致的氧化应激损伤)的结果[2,4]。为了研究感冒安颗粒临床效果的药效物质基础,我们对组方各药味的化学成分进行了文献追踪,发现方中药味含有多种黄酮类成分,如异槲皮苷、芦丁、木樨草素及木樨草苷等[5-9]。而黄酮类成分对流感病毒的作用越来越受到关注[10,11]。异槲皮苷抑制流感病毒A和B的复制,与抗病毒药amantadine或者oseltamivir合用可抑制它们导致的耐药病毒出现[12]。槲皮素与流感病毒A H1N1(A/PR/8/34)的神经酰胺酶的结合与zanamivir相当,体内研究也证实了其抗流感病毒能力,可作为抗甲型H1N1流感的有效先导化合物[13]。Zima研究认为木犀草素及其同源物是强效流感核酸内切酶抑制剂,揭示黄酮类化合物的抗流感作用[14]。鉴于此,本研究在总黄酮含量测定的基础上[15],采用HPLC-MS/MS方法建立5 种黄酮类成分的定量方法,不仅为制剂质量评价提供方法学,也为进一步研究感冒安颗粒防治流感病毒引起的呼吸道感染机制奠定物质基础。
1. 仪器与试药
1.1 仪器
Agilent Technologies
6410 Triple Quad LC/MS仪,配以Triple Quad B.02.01(B2043.12)数据处理软件(美国安捷伦公司);XS205DU电子天平(瑞士梅特勒-托利多仪器有限公司);DL-720A超声波清洗器(上海之信仪器有限公司)。1.2 试药
感冒安颗粒(本院院内制剂,批号110418、110704、111025、111121、111130、111221、120131、120201、120207、120214);芦丁对照品(中国食品药品检定研究院,供UV法测定,含量以92.5 %计,批号:100080-200707);金丝桃苷对照品(中国食品药品检定研究院,供含量测定用,含量以93.9 %计,批号:111521-201004);木犀草素对照品(中国食品药品检定研究院,供含量测定用,批号:111520-200504);槲皮素对照品(中国食品药品检定研究院,供含量测定用,批号:100081-200406);异槲皮苷对照品(成都曼斯特生物制品有限公司,纯度>99.0 %,批号:MUST-10021901);甲醇为色谱纯;甲酸为分析纯;水为蒸馏水。
2. 方法与结果
2.1 溶液制备
2.1.1 对照品溶液制备
分别取芦丁、金丝桃苷、异槲皮苷、槲皮素和木犀草素对照品各适量,用甲醇溶解,摇匀,各配制成500 μg/ml的对照品贮备液。分别精密量取5种对照品贮备液适量,稀释成浓度如下:分别含芦丁0.25、0.50、1.00、2.00、4.00、6.00、8.00 μg/ml,金丝桃苷0.002、0.008、0.020、0.032、0.044、0.056、0.080 μg/ml,异槲皮苷0.03、0.10、0.25、0.45、0.65、0.95、2.00 μg/ml,槲皮素0.02、0.10、0.20、0.30、0.40、0.60、0.70 μg/ml,木犀草素0.012、0.026、0.040、0.054、0.082、0.096、0.200 μg/ml的混合对照品溶液。
2.1.2 供试品溶液制备
按已优化的黄酮提取方法进行[15]。取样品约0.5 g,精密称定,置量瓶中,加70 %甲醇35 ml,超声提取30 min,放冷,过滤,滤液加70 %甲醇溶液定容至50 ml,摇匀,用微孔滤膜(0.45 μm)滤过,即得。
2.2 色谱-质谱条件
色谱条件:采用Kromasil C 18(4.6 mm×150 mm,5 μm,100 Å)色谱柱;甲醇(A)- 0.1 %甲酸(B)作为流动相,按0~20 min,35 % A;20~40 min,45 % A梯度洗脱。
质谱条件:电喷雾负离子化(ESI−)源:毛细管电压 3.0 kV;气体温度 350 ℃,气体流速 10 L/min,雾化气压 35 psi。多反应模式(MRM)监测。5种黄酮检测的离子对:芦丁m/z 609.1→300.1、金丝桃苷和异槲皮苷m/z 463.0→300.1、槲皮素m/z 301.0→151.0、木犀草素m/z 285.0→132.9。
2.3 方法学考察
2.3.1 检测限和定量限
采用上述色谱条件,每个待测化合物对照品用70%甲醇溶液进行系列稀释,分别以信噪比(S/N)等于3和10确定各自的检测限和定量限。结果见表1。
表 1 5种黄酮成分的线性方程、相关系数、线性范围、检测限和定量限黄酮化合物 线性方程 相关系数
r线性范围
(ng/ml)检测限
(ng/ml)定量限
(ng/ml)芦丁 Y=24 527X–162.17 0.999 7 250~8 000 0.025 0.50 金丝桃苷 Y=34 123X– 1.7381 0.999 1 2~80 0.005 0.01 异槲皮苷 Y=29 935X+1 597.80 0.999 1 30 ~2 000 0.02 0.50 槲皮素 Y=19 667X+370.71 0.999 2 20~700 0.02 0.10 木犀草素 Y=33 076X–177.98 0.999 7 12~200 0.005 0.01 2.3.2 线性范围考察
精密量取“2.1.1”项下配制的5 种黄酮成分的对照品混合溶液,照“2.2”项下进样测定,记录各待测组分的峰面积积分值。横坐标为黄酮成分质量浓度(X,ng/ml),纵坐标为峰面积(Y),进行线性回归,计算回归方程和相关系数。结果见表1,表明5 种黄酮成分在各自浓度范围内呈良好的线性关系。
2.3.3 精密度试验
精密吸取供试品溶液(批号
120131 ),照“2.2”项下操作,进样,连续测定5 次和连续测定5 d,记录各待测组分的峰面积积分值,计算日内、日间RSD。结果显示,芦丁、金丝桃苷、异槲皮苷、槲皮素和木犀草素的日内精密度RSD分别为1.09 %、1.42 %、1.69 %、0.86 %、1.27 %(n=5),日间精密度RSD分别为1.85 %、1.76 %、1.43 %、2.01 %、1.90 %(n=5),表明仪器精密度良好。2.3.4 重复性试验
取同一批号样品(批号
120131 )5 份,各0.5 g,精密称定,照“2.1.2”项下方法制备供试品溶液,照“2.2”项下操作,进样,测定峰面积积分值,并进行含量测定。结果显示,芦丁、金丝桃苷、异槲皮苷、槲皮素和木犀草素的含量分别为260.16、1.84、19.76、13.39、3.73 μg/g(n=5),RSD分别为1.51 %、1.73 %、0.90 %、1.44 %、1.68 %(n=5),表明方法的重复性良好。2.3.5 加样回收率试验
取已知含量的样品(批号120131)9 份,每份约0.5 g,精密称定,各精密加入对照品贮备液适量,使已知样品中加入的相当对照品量分别含芦丁140.00 μg、金丝桃苷0.90 μg、异槲皮苷10.00 μg、槲皮素7.00 μg、木犀草素1.90 μg的各对照品贮备液,按“2.1.2”项下的方法制备供试品溶液,照“2.2”项下操作,进样,测定峰面积积分值,计算加样回收率。结果显示,芦丁、金丝桃苷、异槲皮苷、槲皮素和木犀草素的平均加样回收率分别为:102.06%、101.60%、100.63%、102.81%、101.80%(n=9),RSD分别为1.56%、1.93%、0.67%、2.07%、1.84%(n=9)。
2.3.6 样品含量测定
取10 个批号的感冒安颗粒,分别按“2.1.2”项下的方法制备供试品溶液,照“2.2”项下操作,进样,测定峰面积积分值,计算含量,结果见表2。
表 2 不同批号感冒安颗粒含量测定结果($\bar x $ ±s, n=3)批号 芦丁 金丝桃苷 异槲皮苷 槲皮素 木犀草素 含量(μg/g) RSD(%) 含量(μg/g) RSD(%) 含量(μg/g) RSD(%) 含量(μg/g) RSD(%) 含量(μg/g) RSD(%) 110418 479.83±1.99 0.41 0.855±0.004 0.49 20.54±0.25 1.23 14.83±0.05 0.31 3.46±0.06 1.70 110704 198.98±3.01 1.52 0.596±0.006 1.05 11.79±0.20 1.68 15.31±0.13 0.86 4.51±0.01 0.19 111025 32.23±0.26 0.83 0.993±0.012 1.26 13.31±0.00 0.02 6.53±0.04 0.55 5.15±0.08 1.58 111121 69.18±1.03 1.51 0.499±0.006 1.26 13.36±0.21 1.56 8.04±0.14 1.69 5.65±0.07 1.19 111130 67.53±0.27 0.40 0.533±0.008 1.57 13.36±0.21 1.54 7.48±0.12 1.62 5.42±0.06 1.15 111221 275.38±3.61 1.31 0.291±0.002 0.73 11.44±0.02 0.21 15.74±0.02 0.14 6.51±0.02 0.24 120131 264.55±0.51 0.19 1.825±0.012 0.68 20.29±0.04 0.17 13.66±0.02 1.52 3.78±0.01 0.26 120201 239.19±1.55 0.65 0.593±0.010 1.76 18.95±0.06 0.33 18.41±0.21 1.16 3.86±0.03 0.81 120207 109.20±2.14 1.97 0.503±0.004 0.83 18.00±0.21 1.16 6.72±0.08 1.22 4.21±0.02 0.37 120214 108.93±0.59 0.54 0.461±0.002 0.45 17.67±0.10 0.01 6.32±0.08 1.19 4.73±0.01 0.11 3. 讨论
3.1 MS/MS条件的优化
为了获得良好的MS结果,优化了检测的离子模式、碎裂电压、碰撞能量等参数,以获得高灵敏度的分子离子和碎片离子。结果显示,ESI采用负离子模式可使待测的黄酮成分有更高的灵敏度。对照品混合液经产物离子扫描显示,芦丁的主要碎片为m/z:300.1、271.0;金丝桃苷和异槲皮苷的主要碎片为m/z:300.1、270.8;槲皮素的主要碎片为m/z:178.6、151.0、120.9、106.9;木犀草素的主要碎片为m/z:150.9、132.9、106.8。依据定量碎片离子选择原则,从远离母离子、裂解方式稳定、碎片离子有足够的丰度等方面进行考察,最终选择的碎裂电压、碰撞能量和定量离子如表3所示。由于金丝桃苷和异槲皮苷是结构异构体,它们有相同分子离子峰[M-H]− m/z 463,MS/MS图谱中有相同的产物离子峰m/z 300,这两个化合物通过比较两者在HPLC中的保留时间进行定位。
表 3 5种黄酮化合物的质谱检测参数黄酮化合物 母离子 产物离子 碰撞电压
(U/ V)碰撞能量
(U/ eV)芦丁 609.1 300.1 190 38 金丝桃苷 463.0 300.1 170 25 异槲皮苷 463.0 300.1 170 25 槲皮素 301.0 151.0 130 19 木犀草素 285.0 132.9 150 37 3.2 定量方法学验证
采用已优化的测定条件,感冒安颗粒中5 种黄酮类成分通过与各自标准对照品的保留时间和MS谱图的比较得以鉴别和确认,结果见图1。由于金丝桃苷、异槲皮苷和芦丁均是以槲皮素为苷元,结合不同的糖而形成,金丝桃苷与异槲皮苷还具有相同的分子量,它们的保留时间非常相近。采用HPLC-UV或二极管阵列检测的方法专属性不强,待测成分间相互干扰,很难保证测定结果的准确性。而本研究采用MS/MS-MRM模式测定,实现了准确定量的目的。
3.3 结果分析
本研究采用经优化的超声提取法提取感冒安颗粒中黄酮成分,用所建立的LC-MS/MS方法测定了10 个批号样品,结果显示,每批样品中均为芦丁含量最高,金丝桃苷含量最低;批间样品同种黄酮成分含量存在差异。为了保证感冒安颗粒质量的稳定性,临床疗效的一致性,对其中的主要黄酮成分可以考虑设定最低限度要求。感冒安颗粒是经传统水提醇沉工艺制得的稠膏制粒而成,我们以往的研究表明,制剂中含有大量的酸性成分[16],工艺提取过程中的高温、偏低的pH值可能导致金丝桃苷、异槲皮苷、芦丁等苷类黄酮化合物发生水解反应。本研究将3种黄酮苷对照品及生产工艺获得的稠膏经2 % HCl溶液在80 ℃水浴加热处理30 min,进行HPLC-MS/MS分析,处理后的稠膏样品中金丝桃苷和芦丁含量降低,异槲皮苷和槲皮素含量增加;在3种黄酮苷对照品水解液中,均有槲皮素产生;除此之外,芦丁对照品溶液水解还出现了异槲皮苷。由此可以推测,感冒安颗粒的制备工艺可能导致黄酮类成分的水解和转化。
本研究采用HPLC-MS/MS同时测定了感冒安颗粒中5 种黄酮类成分的含量,所建立方法的专属性、灵敏度、精密度和准确性均已得到确证,达到了同时测定多种结构相似的黄酮类成分的目的,为其质量标准的建立提供了方法学依据。我们的研究已经证明感冒安颗粒中含有多种酚酸类成分[17],本研究又测定了其中的黄酮类成分。这些成分可能共同作用于流感病毒在宿主内复制的多环节,或者改善流感病毒对机体的炎性损伤,降低炎性细胞因子表达,改善氧化应激损伤,提高机体的免疫力等,充分发挥其多途径和多靶点作用优势,为其预防和治疗流感病毒所致呼吸道感染性疾病奠定物质基础。
-
[1] 曹洪麟, 葛学军, 叶万辉. 外来入侵种飞机草在广东的分布与危害[J]. 广东林业科技, 2004, 20(2):57-59. [2] 梁国兴, 赵媛, 王彩芳. 入侵物种飞机草(Eupatorium odoratum)化学成分及生物活性研究进展[J]. 北京师范大学学报(自然科学版), 2011, 47(6):611-617. [3] MATHEW M, ANIL A, CARLIN V V, et al. An updated research on the antimicrobial properties of Chromolaena odorata (L). leaf and flower extracts against wound promoting pathogens: a comparative and combinatorial in vitro/in silico approach[J]. Med Plants Int J Phytomed Relat Ind, 2022, 14(1):129-143. doi: 10.5958/0975-6892.2022.00014.4 [4] OMOKHUA-UYI A G, MADIKIZELA B, ARO A O, et al. Flavonoids of Chromolaena odorata (L.) R. M. King & H. Rob. as potential leads for treatment against tuberculosis[J]. S Afr J Bot, 2023, 158:158-165. doi: 10.1016/j.sajb.2023.05.002 [5] NANDU BABY P, RAMESH V. Assessment of Chromolena odorata potential ability of hemostasis in patients with and without Haemophilia A Inhibitors[J]. Ijrps, 2020, 11(4):7048-7052. doi: 10.26452/ijrps.v11i4.3810 [6] PANDITH H, ZHANG X B, LIGGETT J, et al. Hemostatic and wound healing properties of Chromolaena odorata leaf extract[J]. ISRN Dermatol, 2013, 2013:168269. [7] VIJAYARAGHAVAN K, RAJKUMAR J, SEYED M A. Efficacy of Chromolaena odorata leaf extracts for the healing of rat excision wounds[J]. Vet Med, 2017, 62(10):565-578. doi: 10.17221/161/2016-VETMED [8] HUYNH LUU N D, DANG L H, VO LE T V, et al. Topical cream based on nanoformulation of Chromolaena odorata extract for accelerating burn wound healing[J]. J Drug Deliv Sci Technol, 2023, 82:104360. doi: 10.1016/j.jddst.2023.104360 [9] TEUKU HUSNI T R, DARMAWI D, AZWAR A, et al. Bioactive phytoconstituents of ethanolic extract from Chromolaena odorata leaves interact with vascular endothelial growth factor and cyclooxygenase-2: a molecular docking study[J]. J Adv Pharm Technol Res, 2023, 14(1):29-33. doi: 10.4103/japtr.japtr_520_22 [10] OMOKHUA A G, VAN STADEN J, MCGAW L J. Extracts of two relatively safe South African alien weeds have synergistic activity with conventional antibiotics against some urinary tract pathogens[J]. FASEB J, 2019, 33(S1):504-505. [11] DHAR R, KIMSENG R, CHOKCHAISIRI R, et al. 2', 4-Dihydroxy-3', 4', 6'-trimethoxychalcone from Chromolaena odorata possesses anti-inflammatory effects via inhibition of NF-κB and p38 MAPK in lipopolysaccharide-activated RAW 264.7 macrophages[J]. Immunopharmacol Immunotoxicol, 2018, 40(1):43-51. doi: 10.1080/08923973.2017.1405437 [12] EZE F N, JAYEOYE T J. Chromolaena odorata(Siam weed): a natural reservoir of bioactive compounds with potent anti-fibrillogenic, antioxidative, and cytocompatible properties[J]. Biomed Pharmacother, 2021, 141:111811. doi: 10.1016/j.biopha.2021.111811 [13] YANG J N, YI J L, ZOU J H, et al. Flavonoidal alkaloids from the flowers of Chromolaena odorata(L. )R. M. King & H. Rob[J]. Nat Prod Res, 2024, 38(17):2964-2972. doi: 10.1080/14786419.2023.2202395 [14] 秦树森, 曾春晖, 陈益清, 等. 飞机草镇痛作用研究[J]. 广西中医药, 2013, 36(4):64-66. [15] OWOYELE B, OGUNTOYE S O, DARE K M, et al. Analgesic, anti-inflammatory and antipyretic activities from flavonoid fractions of Chromolaena odorata[J]. J Med Plants Res, 2008, 2:219-225. [16] ELEBIYO T C, OLUBA O M, ADEYEMI O S. Anti-malarial and haematological evaluation of the ethanolic, ethyl acetate and aqueous fractions of Chromolaena odorata[J]. BMC Complement Med Ther, 2023, 23(1):402. doi: 10.1186/s12906-023-04200-8 [17] KATO-NOGUCHI H, KATO M. Evolution of the secondary metabolites in invasive plant species Chromolaena odorata for the defense and allelopathic functions[J]. Plants(Basel), 2023, 12(3): 521. [18] GADE S, RAJAMANIKYAM M, VADLAPUDI V, et al. Acetylcholinesterase inhibitory activity of stigmasterol & hexacosanol is responsible for larvicidal and repellent properties of Chromolaena odorata[J]. Biochim Biophys Acta Gen Subj, 2017, 1861(3):541-550. doi: 10.1016/j.bbagen.2016.11.044 [19] ONKARAMURTHY M, VEERAPUR V P, THIPPESWAMY B S, et al. Anti-diabetic and anti-cataract effects of Chromolaena odorata Linn., in streptozotocin-induced diabetic rats[J]. J Ethnopharmacol, 2013, 145(1): 363-372. [20] ELEKOFEHINTI O O, ADEWUMI N A, IWALOYE O. Antidiabetic potential of Chromolaena Odorata leave extract and its effect on Nrf2/keap1 antioxidant pathway in the liver of diabetic-induced Wistar Rats[J]. Adv Tradit Med, 2023, 23(2):513-523. [21] TSOFACK NGUEGUIM F, KAMKUMO GOUNOUE R, HUBERT DONFACK J, et al. Chromolaena odorata(L. )R. M. king and H. Robinson leaves aqueous extract improves the femoral head in ethanol-induced osteonecrosis in rats[J]. Evid-Based Complement Altern Med, 2023, 2023:5436771. doi: 10.1155/2023/5436771 [22] JUN H, QINGHUA Q, YIBAO Z, et al. Unveiling the anticancer, antimicrobial, antioxidative properties, and UPLC-ESI-QTOF-MS/GC–MS metabolite profile of the lipophilic extract of siam weed(Chromolaena odorata)[J]. Arab J Chem, 2023, 16(7):104834. doi: 10.1016/j.arabjc.2023.104834 [23] PAKDEEPAK K, CHOKCHAISIRI R, GOVITRAPONG P, et al. 5, 6, 7, 4'-Tetramethoxyflavanone alleviates neurodegeneration in a dexamethasone-induced neurodegenerative mouse model through promotion of neurogenesis via the Raf/ERK1/2 pathway[J]. Phytother Res, 2021, 35(5):2536-2544. doi: 10.1002/ptr.6983 [24] NONTEMBEKO D, FANIE R, COSTAS Z, et al. First record of pyrrolizidine alkaloids in the southern African biotype of Chromolaena odorata(Asteraceae), South Afric J Botan, 2021, 139: 19-25. [25] 杨航, 程少文, 黄凌. 飞机草提取物的急性毒性与细胞毒性研究[J]. 广东化工, 2022, 49(4):41-47,78. [26] ASOMUGHA R N, EZEJIOFOR A N, OKAFOR P N, et al. Acute and cytotoxicity studies of aqueous and ethanolic leaf extracts of Chromolaena odorata[J]. Pak J Biol Sci, 2015, 18(1):46-49. [27] TEDJASULAKSANA R, RATMINI N K. Toxicity effects of kirinyuh leaf ethanol extract (Chromolaena odorata L.) on white rats (Rattus novergicus)[J]. Biomed Pharmacol J, 2023, 16(2):927-934. doi: 10.13005/bpj/2675 [28] 唐德才, 吴庆光. 中药学[M]. 4版. 北京: 人民卫生出版社, 2021: 20-25. [29] OKOROIWU H U, ATANGWHO I J, UKO E K, et al. Haemostatic property of Chromolaena odorata leaf extracts: in vitro and in vivo evaluation in wistar rats[J]. J Biol Res, 2016, 89(2):56-60. [30] PAUL T, DAS B, GURAV M. A preliminary study on perioperative hemostatic effect of spray dried powder of Chromolaena odorata leaf extract[J]. Indian J Exp Biol, 2021, 59(8):547-555. -





 下载:
下载:
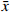
 下载:
下载: 

