-
姜黄素(Cur)是从姜科姜黄属植物中提取的多酚类化合物,由于安全无毒,被WHO和FDA批准为天然食品添加剂。姜黄素具有抗炎、抗肿瘤、抗抑郁等药理作用[1-2],但由于水中溶解度小,口服难吸收,且在肠道易转化,目前仍处于临床实验阶段。如何提高姜黄素在体内的生物利用度是近年来的研究热点,包括研制新剂型、改变其化学结构及联用生物利用度增强剂[3-4]。胡椒碱(Pip)可作用于P-gp,通过调节胃肠道分泌等机制来增强其他药物的生物利用度[5]。姜黄素与佐剂胡椒碱的联用是近几年的研究热点,胡椒碱不仅能够改善姜黄素生物利用度,还具有药理作用上的协同效果。自乳化药物传递系统(SMEDDS)由药物、油相、表面活性剂和助表面活性剂组成,在体内胃肠道温和蠕动下能够自发形成微乳[6],通过增加难溶性药物的溶解度,从而促进药物在体内的吸收。
姜黄素与胡椒碱比例在各参考文献中不同,本研究项目结合参考文献后尝试不同梯度的质量比,以稳定性和载药量为指标,最终优选姜黄素和胡椒碱的质量比为4∶1。本研究将姜黄素和胡椒碱同时包裹于自微乳制剂中,制备成复方自微乳制剂(Cur+Pip)-SMEDDS,旨在提高姜黄素的溶解度和生物利用度。笔者建立了复方姜黄素自微乳制剂中姜黄素和胡椒碱含量的HPLC测定法,考察药物的体外释放行为,为姜黄素和胡椒碱的新剂型研究提供理论依据。
-
美国Waters公司高效液相色谱仪;AG285型电子天平(Mettler Toledo公司);KQ32(X)E医用超声波清洗器;HJ-1磁力搅拌器(常州荣华仪器制造有限公司);PHSJ-4F型实验室pH计(上海仪电科学仪器有限公司);SHA-C恒温水浴振荡器(金坛市国旺实验仪器厂)。
-
胡椒碱原料药(含量98%,陕西西安兰草生物科技有限公司);胡椒碱对照品(纯度>99%,中国食品药品检定研究院,批号:110775-201706);姜黄素原料药(含量95%,陕西西安兰草生物科技有限公司);姜黄素对照品(中国食品药品检定研究院,批号:110823-201706,纯度>99%);透析袋(截留分子量14000,西安罗森伯科技有限公司);pH = 4.8、7.5 PBS缓冲液;吐温-80(天津市科密欧化学试剂开发中心);甲醇、乙腈(色谱纯,天津市科密欧化学试剂有限公司);水为超纯水;其他试剂均为市售分析纯。复方姜黄素自微乳制剂及空白自微乳均为自制。
-
按照处方称取油酸乙酯∶吐温-80∶二乙二醇单乙基醚(Transcutol P)=30%∶55%∶15%,置于50 ml烧杯中,25 ℃超声混匀后,得到空白自微乳制剂。称取适量空白自微乳制剂,按照姜黄素40 mg/g,胡椒碱10 mg/g加入原料药,于30 ℃超声混合,至药物完全溶解,得到含姜黄素和胡椒碱的复方姜黄素自微乳制剂(Cur+Pip)-SMEDDS,外观见图1。取本品约1.0 g,加水稀释至10 ml,使用pH计测定自乳化制剂pH值。空白自乳化制剂pH值为5.37;载药自乳化制剂pH值为4.97。
-
色谱柱DiamonsilTM C18柱(200 mm×4.6 mm,5 μm);流动相∶乙腈∶4%冰醋酸溶液=48∶52(V:V);流速:1.0 ml/min;柱温:25 ℃;姜黄素检测波长:430 nm;胡椒碱检测波长:343 nm;进样量:20 μl。
-
对照品溶液:取姜黄素和胡椒碱对照品各约10.0 mg,精密称定,置于10 ml量瓶中,用甲醇溶解并定容,配成1.0 mg/ml的标准母液备用。
样品溶液:吸取适量(Cur+Pip)-SMEDDS溶液于10 ml量瓶中,加入甲醇溶解并定容,用0.45 μm微孔滤膜过滤后稀释10倍作为样品溶液。
空白溶液:吸取适量空白自微乳制剂于10 ml量瓶中,按照样品溶液的配制方法处理,作为不含药物的阴性样品溶液。
-
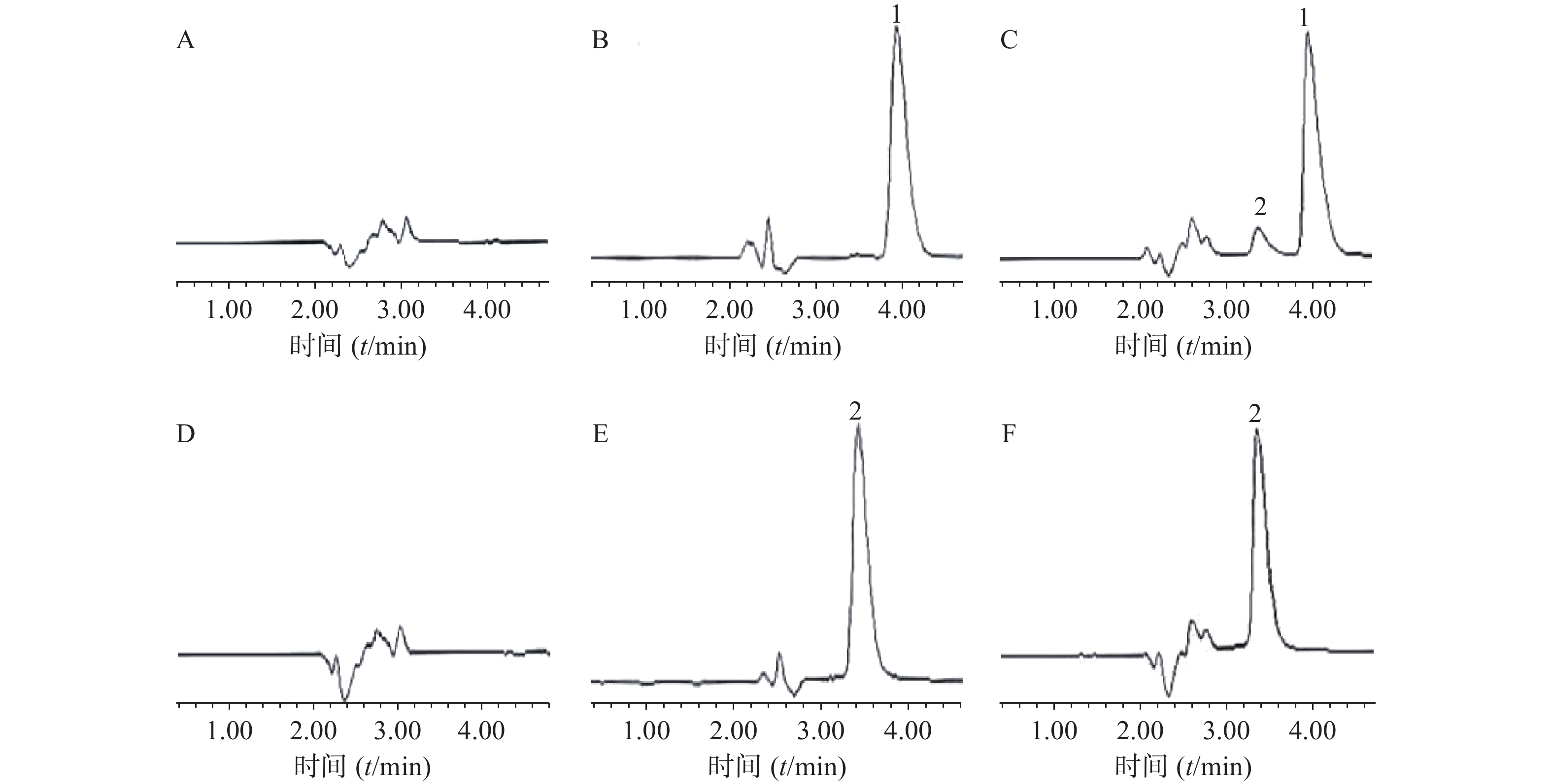
分别精密吸取空白微乳溶液、姜黄素和胡椒碱对照品溶液和(Cur+Pip)-SMEDDS样品溶液各20 μl,按照“2.2”项下依法操作,记录色谱图,考察辅料是否对药物的测定存在干扰。结果表明,在此条件下,高效液相色谱法专属性强,辅料不干扰药物的测定(图2)。
-
姜黄素的线性关系:精密吸取姜黄素母液10、100 μl,1、2、4、6、8 ml于100 ml量瓶中,加流动相定容后混匀,配制成系列浓度为0.1、1.0、10.0、20.0、40.0、60.0、80.0 µg/ml的姜黄素标准液。吸取胡椒碱母液10、20 、100 μl,0.5、1、2、4 ml于100 ml量瓶中,配制成系列浓度为0.1、0.2、1.0、5.0、10.0、20.0、40.0 µg/ml的标准液。按照“2.2.1”项下依法操作,记录姜黄素和胡椒碱峰面积。以峰面积为纵坐标,以浓度为横坐标绘制标准曲线,求得回归方程。
姜黄素:Y=36.07X−12.75,(n=7,r=0.999 8);
胡椒碱:Y=34.296X+4.442 3,(n=7,r=0.999 9)。
结果表明,姜黄素在0.1~80 µg/ml浓度范围内,胡椒碱在0.1~40 µg/ml浓度范围内,峰面积与测定浓度呈良好的线性关系。
-
分别精密吸取适量姜黄素和胡椒碱低、中、高3种浓度的药物溶液,进行HPLC分析。于1 d内重复进样6次,测定峰面积,计算日内精密度。连续进样5 d,测定峰面积,计算日间精密度。姜黄素和胡椒碱的日内、日间精密度RSD均 < 2.0%(n=6)。说明该方法精密度良好,满足测定的要求。
-
取供试品溶液(Cur+Pip)-SMEDDS,分别于0、2、4、6、8、12、24、48 h进样测定,测定峰面积,计算RSD以考察供试品稳定性。结果显示姜黄素和胡椒碱在48 h内RSD分别为1.7%和1.75%,表明供试品溶液在48 h内稳定性良好。
-
取3批样品(批号:20190604、20190608、20190612),按“2.1”项下方法平行制备6份供试品溶液,姜黄素平均含量为81.6 μg/ml,RSD为0.82%(n=6);胡椒碱平均含量为14.58 μg/ml,RSD为0.76%(n=6),结果表明该方法重复性良好。
-
精密称取已知含量的同一批复方姜黄素自微乳样品(批号:20190612)9份,约28 mg,分别准确加入对照品溶液(其中,姜黄素10 μg/ml,胡椒碱5 μg/ml)为5、25、50 ml各3份,稀释定容至100 ml,按照“2.2”项下依法测定。结果显示,低、中、高3个浓度的姜黄素和胡椒碱溶液在空白自微乳中的回收率在98.0%~102.0%之间,结果表明回收率满足分析方法的要求,表明该方法准确性良好。
-
分别取3批不同批号(20190604、20190608、20190612)的样品,按“2.2.2”项下方法制成供试品溶液,依法测定峰面积,计算样品中姜黄素和胡椒碱的含量,见表1。
表 1 3批自微乳制剂的含量测定结果
批号 姜黄素(μg/ml) 胡椒碱(μg/ml) 20190604 81.64 14.52 20190608 80.72 13.78 20190612 81.96 14.95 均值 81.34±0.056 14.42±0.068 RSD(%) 0.96 1.15 -
由于姜黄素和胡椒碱溶解度低,因此选择合适的表面活性剂置于透析液中,通过增加药物的溶解度来建立体外释放的漏槽条件。将不同浓度乙醇、吐温-80、十二烷基硫酸钠(SDS)加到磷酸盐缓冲溶液中,加入过量的药物,放入恒温水浴箱中振荡,72 h后离心取上清液进HPLC仪,计算药物饱和溶解度,见表2。
表 2 不同溶出介质中姜黄素和胡椒碱的溶解度
释放介质 溶解度(mg/ml) 姜黄素 胡椒碱 10% 乙醇 0.104 0.094 20% 乙醇 0.245 0.136 30% 乙醇 0.312 0.198 磷酸盐缓冲液 0.08×10−3 0.03×10−3 0.05%吐温-80 0.016 0.015 0.2%吐温-80 0.085 0.064 0.5%吐温-80 0.199 0.095 0.75%吐温-80 0.332 0.260 0.05%SDS 0.044 0.052 0.2%SDS 0.085 0.092 0.5%SDS 0.108 0.312 0.75%SDS 0.198 0.485 结果显示药物在0.75% 吐温-80中溶解度较大且稳定性良好,故选择加入0.75% 吐温-80的磷酸盐缓冲液作为漏槽条件。
-
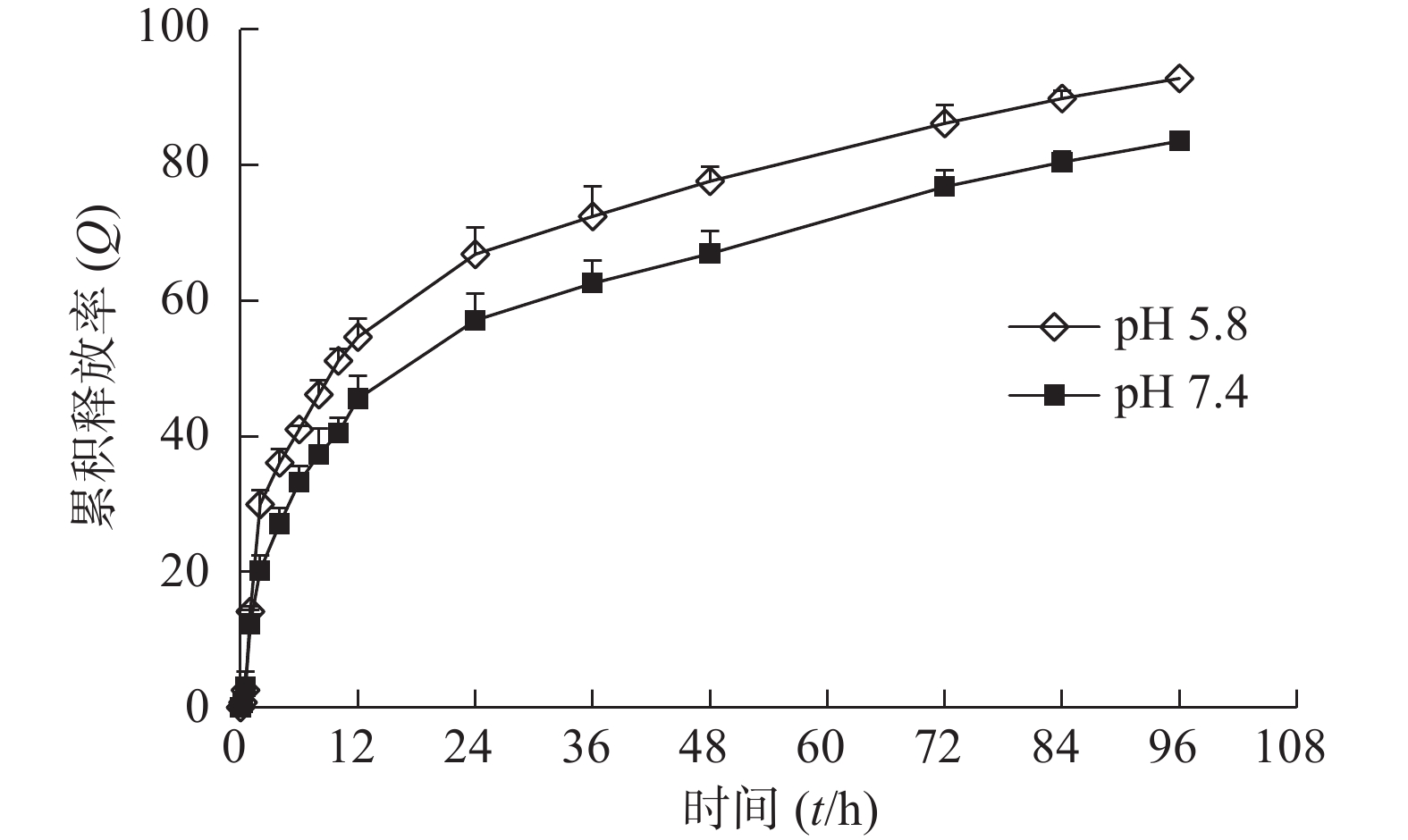
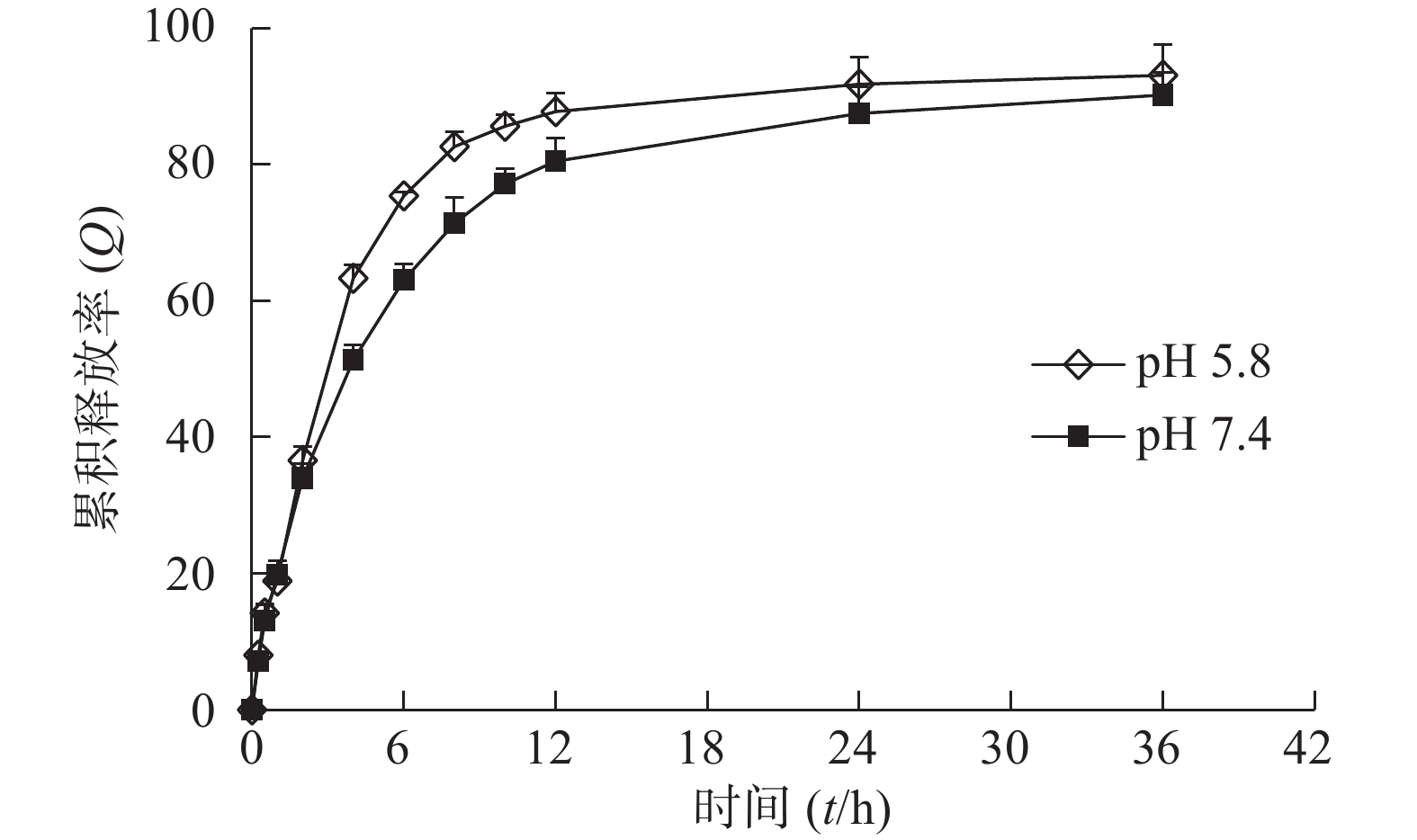
吸取3 ml复方自微乳溶液装于透析袋中,将透析袋置于200 ml释放介质中(n =3),于37.2 ℃,100次/min振荡的条件下进行药物体外释放行为的考察。分别于不同时间点取3 ml释放介质,过滤后使用HPLC测定药物浓度,同时补充相同体积的空白介质。根据HPLC法进行含量测定,计算药物浓度及累积释放率(Q)。结果见图3、图4。
由于肿瘤微环境呈酸性,pH值较低,本研究使用pH 4.8的释放介质来模拟肿瘤环境。由图可知,药物在pH 4.8酸性环境中释放更完全,表明该自微乳制剂中的药物能够在肿瘤部位释放。姜黄素在pH 4.8和pH 7.5释放介质中108 h累积释放率分别为94.85%和84.38%。胡椒碱比姜黄素释放更完全,可能由于胡椒碱在0.75% 吐温-80中的溶解度较高,因此释放量较多。胡椒碱在pH 4.8和pH 7.5释放介质中36 h累积释放率分别为92.85%和90.05%。36 h后,在释放介质中几乎测定不到胡椒碱,而姜黄素能够缓慢释放到108 h。结果表明自微乳制剂具有缓释特性,能够缓慢释放姜黄素。
-
姜黄素具有明确的抗肿瘤效果,但是其水溶性差,体外不稳定等缺点限制了临床应用。本研究将姜黄素和其代谢酶抑制剂胡椒碱制备成自微乳制剂,增加了姜黄素的溶解度以及生物利用度。本研究建立的反相高效液相色谱法能够在同一色谱条件下测定(Cur+Pip)- SMEDDS中姜黄素和胡椒碱的含量,该方法专属性良好、精密度、重复性和准确性均能够满足测定要求。本研究制备的自微乳制剂能够缓慢释放姜黄素和胡椒碱,发挥长效作用,避免突释效应,为进一步体内研究奠定理论基础。
-
本研究中姜黄素和胡椒碱的浓度相差较大及仪器的限制,排除使用紫外分光光度法,选择反相高效液相色谱法同时测定药物含量。为了能够高效检测,本研究采用在同一色谱条件下,不同波长(430和343 nm)条件下对姜黄素和胡椒碱进行测定[7]。本研究考察多种不同流动相后,结合参考文献[8],优选乙腈-4%冰醋酸溶液(48∶52)作为测定两种药物的流动相。结果显示,在该色谱条件下姜黄素衍生物去甲氧基和双去甲氧基姜黄素不干扰姜黄素的测定,同时,姜黄素和胡椒碱的色谱峰可以达到较好的分离,该方法的精密度、回收率等均符合测定要求,可以用来测定自微乳中的药物含量。
-
通过体外释放行为的考察,证实该制剂具有一定的缓释特性。释放结果显示前30 min存在一定的突释效应,可能是微乳表面的游离药物迅速释放到介质中,造成了突释[9],而胡椒碱的体外突释现象更为明显,与其具有较低的载药量相关,胡椒碱载药量低导致微乳表面具有较多的游离药物。两种药物均显示出在酸性环境中释放较完全,由此推测,在进行抗肿瘤疗效研究时,在酸性的肿瘤部位释放药物较多,具有一定靶向作用,从而能够发挥持久的抗肿瘤效果。但体内和体外研究可能具有差异性,需要进一步进行体内研究来证实其缓释以及靶向作用[10]。
-
本研究建立的HPLC方法学专属性好,精密度和回收率均满足测定方法的要求。制备的(Cur+Pip)-SMEDDS具有缓释特性,且在肿瘤的酸性环境下释放较正常组织中更多,为进一步进行体内试验奠定了理论基础。本实验只对复方自微乳制剂的体外释放做了研究,体内试验还需进一步考察。
In vitro release study on self-microemulsion of curcumin and piperine
-
摘要:
目的 考察复方自微乳中姜黄素和胡椒碱的体外释放行为。 方法 采用动态透析法,分别以pH值为4.8、7.5的磷酸盐缓冲液并加入0.75%吐温-80作为漏槽条件,考察姜黄素和胡椒碱的体外释放特性。 结果 姜黄素在pH 4.8和pH 7.5释放介质中108 h累积释放百分率分别为94.85%和84.38%。胡椒碱在上述介质中36 h累积释放率分别为92.85%和90.05%。 结论 自微乳制剂中姜黄素和胡椒碱具有缓释特性,且在肿瘤酸性环境中释放更多。 Abstract:Objective To study the release profile of curcumin and piperine from the compound self-microemulsion. Methods The release of curcumin and piperine in vitro was investigated by dynamic dialysis under the condition of phosphate buffer of pH 4.8 and 7.5 with 0.75% Tween-80. Results The cumulative release rates of curcumin in pH 4.8 and pH 7.5 were 94.85% and 84.38% in 108 h, respectively. The cumulative release rates of piperine were 92.85% and 90.05% in 36 h, separately. Conclusion Curcumin and piperine in self-microemulsion have sustained release properties and released more in the acidic environment similar to the environment in tumors. -
Key words:
- curcumin /
- piperine /
- self-microemulsifying drug delivery /
- in vitro release /
- sustained release
-
玄参别名元参、黑参、浙玄参等,为我国传统大宗药材,主产地为浙江、安徽、四川、贵州等地[1-2]。玄参,始载于《神农本草经》,被列为中品,味甘、苦、咸,性微寒[3];归肺、胃、肾经,具有清热凉血,滋阴降火,解毒散结的功效,常用于热病伤阴,舌绛烦渴,津伤便秘、目赤、咽痛等症[4-5]。环烯醚萜苷类是玄参的主要有效成分,包括哈巴苷、哈巴俄苷等,临床上主要用于脑缺血、高血压、糖尿病等疾病,具有抗炎、保护心血管、抗肿瘤、免疫调节等作用[6-9]。
关于不同产地玄参有效成分含量测定的报道较少,仅有的报道也只集中在少数产地[10-11]。玄参药材原植物生长环境差别大,不同的生境因子下药材质量参差不齐,且在栽培过程中,栽培品系繁多混杂,严重阻碍了玄参产业的可持续发展。2020版《中国药典》规定将哈巴苷、哈巴俄苷作为玄参药材的质控成分,现代药理学研究也表明哈巴苷、哈巴俄苷具有保护心血管、保护神经的药理作用[12-13]。因此,课题组以哈巴苷和哈巴俄苷成分为指标性成分,收集全国玄参15个主产区玄参种质资源,建立HPLC法对其进行含量测定,分析不同产地玄参环烯醚萜苷类成分之间的差异性,以期为玄参药材质量控制提供理论依据。
1. 材料与方法
1.1 药材
2019年11月至2019年12月,收集浙江磐安、安徽谯城区、贵州阳溪、河南朱庄、四川陇东等15个产地新鲜玄参种质资源,经浙江中医药大学药学教研室秦路平教授鉴定为玄参科植物玄参(Scrophularia ningpoensis Hemsl.)的干燥根,信息见表1。
表 1 不同产地玄参样品信息编号 产地 经度(°) 纬度(°) 海拔(l/m) 降雨量(l/mm) 年平均温度(t/℃) S1 浙江磐安 120.43 29.05 1020 1440.1 17.4 S2 浙江临安 119.72 30.23 1050 1463.3 16.2 S3 杭州植物园 120.13 30.27 25 1400.3 16.1 S4 安徽涡阳 116.22 33.52 40 809.8 15.1 S5 安徽谯城区 115.77 33.88 35 805.0 14.5 S6 安徽利辛 116.20 33.15 22 823.9 14.8 S7 河南太丘 116.13 33.93 32 740.5 14.3 S8 河南南丰 115.20 33.65 34 738.6 14.6 S9 河南朱庄 114.51 33.01 33 740.5 14.3 S10 四川陇东 102.71 30.48 1428 1000.0 12.6 S11 四川永富 102.65 30.55 1456 984.6 13.4 S12 四川五龙 102.77 30.40 1410 993.4 12.5 S13 贵州洛龙 107.71 29.06 832 1170.4 22.1 S14 贵州阳溪 107.57 29.07 1300 1100.3 16.3 S15 贵州玉溪 107.36 29.05 1324 1070.3 15.6 1.2 仪器与试剂
Waters Alliance e2695型高效液相色谱仪(美国Waters公司);ZORBAX Eclipse C18色谱柱(250 mm×4.6 mm, 5 μm);XS105型电子分析天平(梅特勒-多利多公司);超纯水仪(美国Millipore公司);DXF–60D型中药打粉机(广州市大祥电子机械设备有限公司);KQ–300DV型超声波(广州颖汉科技有限公司);DHG–9031A型电热恒温鼓风干燥箱(上海森信试验仪器有限公司)。哈巴苷(B20481)、哈巴俄苷(B20480)对照品均购于上海源叶生物科技有限公司。乙腈(色谱级,美国天地公司),磷酸(色谱级,上海阿拉丁公司),其余试剂均为分析纯。
1.3 方法
1.3.1 色谱条件
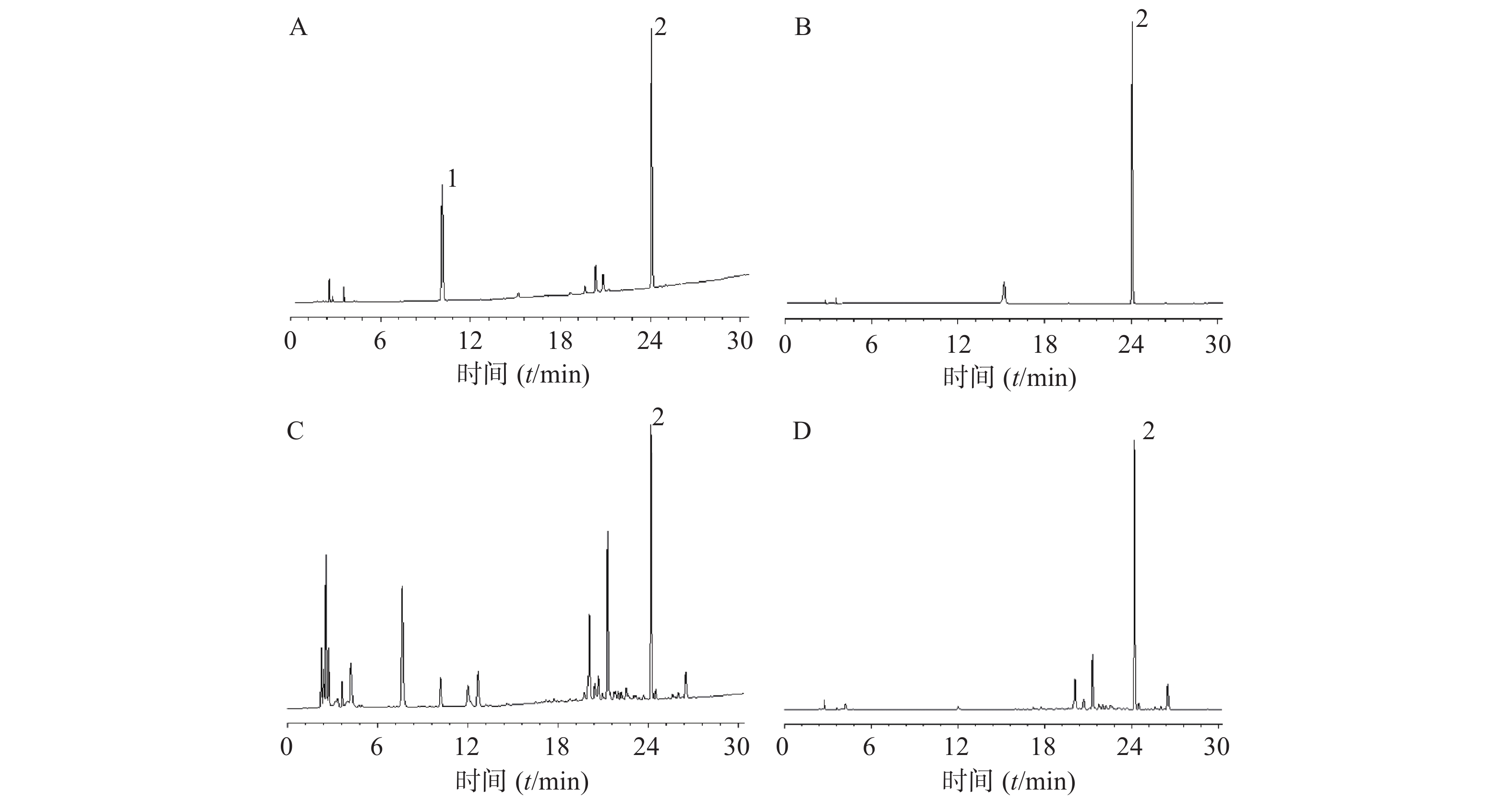
ZORBAX Eclipse Plus C18色谱柱(250 mm×4.6 mm,5 μm);流动相:乙腈(A)–0.03%磷酸水溶液(B),梯度洗脱(1~10 min,3%~10% A;10~20 min,10%~33% A;20~25 min,33%~50% A;25~30 min,50%~80% A;30~35 min,80% A;35~37 min,80%~3% A;37~42 min,3% A);体积流量1.0 ml/min,柱温30 ℃,进样量为10 μl;检测波长为210、280 nm。色谱图见图1。
1.3.2 线性关系考察
精密称取哈巴苷、哈巴俄苷对照品适量,用30%甲醇溶液制备成终质量浓度为每1 ml含哈巴苷0.6 mg、哈巴俄苷0.2 mg的混合对照品溶液,于4 ℃冰箱中保存备用。分别精密吸取哈巴苷、哈巴俄苷混合对照品溶液0.34、0.67、1.00、1.40、1.70 ml置于2 ml容量瓶中,30%甲醇溶液定容至2 ml,吸取上述溶液适量,0.45 μm微孔滤膜过滤,按“1.3.1”项下色谱条件依次进样。哈巴苷的检测波长为210 nm,哈巴俄苷的检测波长为280 nm。以对照品溶液质量浓度为横坐标(X),峰面积为纵坐标(Y)进行回归,结果见表2,可知哈巴苷与哈巴俄苷在各自范围内线性关系良好。
表 2 线性关系考察成分 回归方程 线性范围 r 哈巴苷 Y=2964.3X+5156.4 0.1020~0.5100 mg/ml 0.9999 哈巴俄苷 Y=13919X+366.1 0.0340~0.1700 mg/ml 0.9999 1.3.3 供试品溶液制备
将洗净后的玄参根切片,置于60 ℃烘箱中烘至恒定质量,粉碎后过3号筛。精密称取玄参根样品粉末0.25 g,置于25 ml具塞锥形瓶中,精密加入50%甲醇溶液25 ml,密塞,称定重量,浸泡1 h,超声处理45 min(300 W, 40 kHz),放冷,再称定重量,用50%甲醇溶液补足损失的重量,摇匀,用0.45 μm微孔滤膜过滤,取续滤液,即得。按“1.3.1”项下色谱条件平行测定3次。
1.3.4 精密度试验
精密吸取哈巴苷、哈巴俄苷对照品溶液适量,按“1.3.1”项下色谱条件依次进样6次,测得哈巴苷、哈巴俄苷峰面积RSD分别为0.11%、0.09%,表明仪器精密度良好。
1.3.5 稳定性试验
取浙江磐安样品,按“1.3.3”项下方法制备供试品溶液,分别于0、2、4、8、12、18、24 h,按“1.3.1”项下色谱条件进样,测得哈巴苷、哈巴俄苷峰面积RSD分别为0.24%、0.17%,表明供试品溶液在24 h内稳定性良好。
1.3.6 重复性试验
取浙江磐安样品6份,按“1.3.3”项下方法制备供试品溶液,按“1.3.1”项下色谱条件进样,测得哈巴苷、哈巴俄苷含量的RSD分别为0.59%、0.50%,表明该方法重复性良好。
1.3.7 加样回收率试验
取含量已知的浙江磐安样品,精密称定0.125 g, 加入哈巴苷、哈巴俄苷对照品适量,按“1.3.3”项下方法制备成供试品溶液,按“1.3.1”项下色谱条件进样,计算回收率,结果见表3。
表 3 加样回收率试验结果(n=6)成分 称样量(m/g) 原有量(m /mg) 加入量(m /mg) 测得量(m /mg) 回收率(%) 平均回收率(RSD)(%) 哈巴苷 0.1251 0.0748 0.0748 0.1478 0.9759 97.44(0.93) 0.1250 0.0748 0.0748 0.1476 0.9733 0.1251 0.0748 0.0748 0.1486 0.9866 0.1254 0.0750 0.0750 0.1482 0.9760 0.1253 0.0749 0.0749 0.1480 0.9760 0.1251 0.0748 0.0748 0.1465 0.9586 哈巴俄苷 0.1250 0.1065 0.1065 0.2093 0.9653 97.08(1.24) 0.1254 0.1068 0.1068 0.2126 0.9906 0.1252 0.1067 0.1068 0.2089 0.9569 0.1251 0.1066 0.1068 0.2109 0.9766 0.1253 0.1068 0.1068 0.2096 0.9625 0.1251 0.1066 0.1068 0.2105 0.9728 1.4 数据处理与分析
应用SPSS 19.0软件处理数据。方差分析采用单因素ANOVA分析,聚类分析采用组间连接法[14]。
2. 结果与分析
2.1 哈巴苷与哈巴俄苷含量比较
15个产地间玄参根中哈巴苷、哈巴俄苷的含量存在统计学差异(P<0.01),结果见表4。哈巴苷、哈巴俄苷含量以及两者总量分别为0.791、0.228、1.265 mg/g。四川陇东产哈巴苷含量最高、安徽谯城区含量最低;浙江磐安产哈巴俄苷含量最高,四川永富含量最低;四川陇东产哈巴苷与哈巴俄苷总量最高,杭州植物园最低,含量范围在0.752~1.529 mg/g之间,均符合《中国药典》2020版质量标准。
表 4 不同产地间玄参样品中各成分含量测定结果($\bar x \pm s$ ,n=3,mg/g)样品 哈巴苷含量 哈巴俄苷含量 哈巴苷与哈巴俄苷总量 S1 0.598±0.003 0.852±0.003 1.450±0.006 S2 0.979±0.002 0.520±0.004 1.499±0.006 S3 0.600±0.007 0.152±0.009 0.752±0.013 S4 0.625±0.003 0.542±0.003 1.167±0.004 S5 0.489±0.002 0.831±0.008 1.320±0.009 S6 0.558±0.003 0.615±0.006 1.173±0.009 S7 0.730±0.021 0.626±0.017 1.355±0.038 S8 0.921±0.007 0.563±0.006 1.484±0.002 S9 0.642±0.004 0.655±0.004 1.297±0.008 S10 1.147±0.006 0.382±0.002 1.529±0.008 S11 0.992±0.016 0.036±0.002 1.029±0.017 S12 0.560±0.002 0.422±0.001 0.983±0.002 S13 0.759±0.006 0.385±0.005 1.144±0.009 S14 1.120±0.009 0.234±0.015 1.355±0.024 S15 1.140±0.007 0.297±0.294 1.434±0.010 均值 0.791** 0.228** 1.265** **P<0.01,表示不同产地的哈巴苷或哈巴俄苷含量存在极显著差异。 2.2 相关性分析
对不同产地之间中的有效成分与生境因子进行相关性分析,结果如表5所示,哈巴苷与海拔、降雨量、年平均温度呈正相关关系,与海拔正相关系数最高为(0.440);与经度、纬度之间呈负相关关系,与经度负相关系数最高为(–0.419)。哈巴俄苷与经度、纬度呈正相关,与海拔、降雨量、年平均温度呈负相关,与海拔负相关系数最高为(–0.360)。
表 5 玄参中哈巴苷、哈巴俄苷含有量与生境因子相关性分析项目 哈巴苷 哈巴
俄苷经度 纬度 海拔 年降
雨量年平均
温度哈巴苷 1.000 哈巴俄苷 −0.553 1.000 经度 −0.419 0.572 1.000 纬度 −0.341 0.506 0.370 1.000 海拔 0.440 −0.360 −0.620* −0.768** 1.000 年降雨量 0.098 −0.243 0.184 −0.795** 0.508 1.000 年平均温度 0.079 −0.237 −0.005 −0.507 0.009 0.363 1.000 *P<0.05,表示显著相关;**P<0.01,表示极显著相关。 2.3 聚类分析
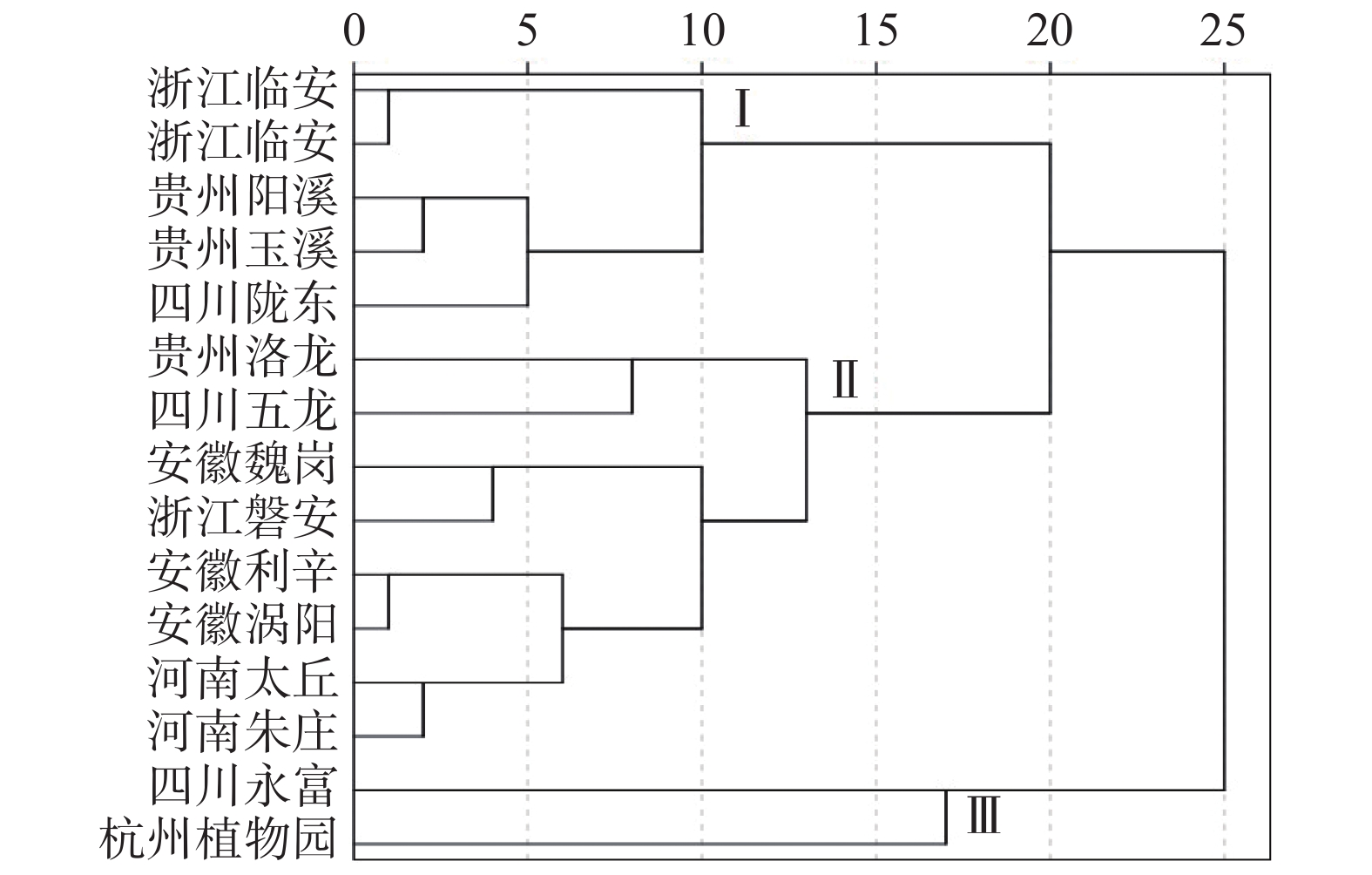
以哈巴苷、哈巴俄苷含量以及两者总量为参考指标,对15个产地玄参进行聚类分析,根据欧式距离D2=19.98将不同产地划分为3个类群,如图2所示。类群I共5个产地,分别为浙江临安,河南南丰,贵州阳溪、玉溪,四川陇东,该类玄参中哈巴苷含量、哈巴苷和哈巴俄苷总量最高;类群II有8个产地、分别为贵州洛龙,四川五龙,安徽利辛、谯城区、涡阳,浙江磐安,河南太丘、朱庄,这些产地哈巴俄苷含量次之;类群III共有2个产地,分别是四川永富和杭州植物园,这两个产地的哈巴俄苷含量、哈巴苷和哈巴俄苷总量最低。
3. 讨论与结论
本试验采用高效液相法测定玄参哈巴苷与哈巴俄苷含量,经PDA检测器对哈巴苷和哈巴俄苷标准品溶液进行波长扫描,结果显示,哈巴苷的最大检测波长是210 nm,与溶剂甲醇的吸收波长一致,此处会有溶剂峰的出现,而哈巴俄苷的最大检测波长是280 nm,此时基线平稳,未与溶剂峰相重叠,因此,确定检测波长为210 nm和280 nm;采用2020版《中国药典》中哈巴苷与哈巴俄苷的含量测定的提取方法及流动相,结果显示,提取、分离效果良好,哈巴苷与哈巴俄苷在甲醇中超声处理45 min即可提取完全,各峰之间的分离度>1.5,理论塔板数>5000,哈巴苷与哈巴俄苷的保留时间分别是10.107、24.116 min。
药用植物的生长环境对次生代谢产物的积累起着非常关键的作用,包括经纬度、海拔、降雨量等[14]。本实验结果显示,15个产地玄参根中哈巴苷、哈巴俄苷的含量存在统计学差异(P<0.01),其中四川陇东、河南南丰、浙江临安、磐安含量最高;海拔、降雨量、年平均温度与哈巴苷之间呈正相关,与哈巴俄苷呈负相关。课题组发现,浙江临安、磐安的海拔分别是1050 m、1020 m,远高于杭州植物园的25 m,因此,临安、磐安哈巴苷的含量要高于植物园,这与实验结果一致;经纬度与哈巴俄苷呈正相关,且相关系数较大,经纬度越高,哈巴俄苷的含量就越大,四川陇东、永富、五龙的经纬度低于安徽利辛、涡阳、谯城区,因此,前者的哈巴俄苷的含量低于后者。结果显示,经纬度越高越有利于哈巴俄苷的积累,降雨量越大,海拔越高,越有利于哈巴苷的积累,故可优先在拥有上述环境条件的种质中选择。本实验只对玄参中哈巴苷、哈巴俄苷的含量进行测定,下一步将继续增加其他活性成分的含量测定,为玄参的质量控制提供参考依据。
-
表 1 3批自微乳制剂的含量测定结果
批号 姜黄素(μg/ml) 胡椒碱(μg/ml) 20190604 81.64 14.52 20190608 80.72 13.78 20190612 81.96 14.95 均值 81.34±0.056 14.42±0.068 RSD(%) 0.96 1.15 表 2 不同溶出介质中姜黄素和胡椒碱的溶解度
释放介质 溶解度(mg/ml) 姜黄素 胡椒碱 10% 乙醇 0.104 0.094 20% 乙醇 0.245 0.136 30% 乙醇 0.312 0.198 磷酸盐缓冲液 0.08×10−3 0.03×10−3 0.05%吐温-80 0.016 0.015 0.2%吐温-80 0.085 0.064 0.5%吐温-80 0.199 0.095 0.75%吐温-80 0.332 0.260 0.05%SDS 0.044 0.052 0.2%SDS 0.085 0.092 0.5%SDS 0.108 0.312 0.75%SDS 0.198 0.485 -
[1] MBESE Z, KHWAZA V, ADERIBIGBE B A. Curcumin and its derivatives as potential therapeutic agents in prostate, colon and breast cancers[J]. Molecules,2019,24(23). doi: 10.3390/molecules24234386 [2] SALEHI M, MOVAHEDPOUR A, TAYARANI A, et al. Therapeutic potentials of curcumin in the treatment of non-small-cell lung carcinoma[J]. Phytother Res,2020,34(10):2557-2576. doi: 10.1002/ptr.6704 [3] 任金妹, 李曼, 谢宁, 等. 提高姜黄素口服生物利用度方法的研究进展[J]. 中国药房, 2018, 29(23):3303-3308. doi: 10.6039/j.issn.1001-0408.2018.23.29 [4] KARTHIKEYAN A, SENTHIL N, MIN T. Nanocurcumin: a promising candidate for therapeutic applications[J]. Front Pharmacol,2020,11:487. doi: 10.3389/fphar.2020.00487 [5] TANG J L, JI H Y, REN J M, et al. Solid lipid nanoparticles with TPGS and Brij 78: a co-delivery vehicle of curcumin and piperine for reversing P-glycoprotein-mediated multidrug resistance in vitro[J]. Oncol Lett,2017,13(1):389-395. doi: 10.3892/ol.2016.5421 [6] PANDEY V, KOHLI S. Lipids and surfactants: the inside story of lipid-based drug delivery systems[J]. Crit Rev Ther Drug Carrier Syst,2018,35(2):99-155. doi: 10.1615/CritRevTherDrugCarrierSyst.2018016710 [7] 李秋萍, 戴俊东, 翟文文, 等. 单纯形网格法优化设计姜黄素-胡椒碱复方自微乳制剂处方[J]. 中国中药杂志, 2014, 39(20):3936-3944. [8] 任金妹. 载姜黄素和胡椒碱固体脂质纳米粒给药系统的研究[D]. 哈尔滨: 哈尔滨医科大学, 2014. [9] KAZI M, SHAHBA A A, ALRASHOUD S, et al. Bioactive self-nanoemulsifying drug delivery systems (bio-SNEDDS) for combined oral delivery of curcumin and piperine[J]. Molecules,2020,25(7):1703. doi: 10.3390/molecules25071703 [10] SLIKA L, MOUBARAK A, BORJAC J, et al. Preparation of curcumin-poly (allyl amine) hydrochloride based nanocapsules: piperine in nanocapsules accelerates encapsulation and release of curcumin and effectiveness against colon cancer cells[J]. Mater Sci Eng C Mater Biol Appl,2020,109:110550. doi: 10.1016/j.msec.2019.110550 -





 下载:
下载:


 下载:
下载: