-
镰形棘豆(Oxytropis falcate Bunge)系豆科棘豆属多年生无茎草本植物。据《晶珠本草》记载,镰形棘豆以根及根茎或全草入药,被誉为“草药之王”,是我国青藏高原常用的民间草药之一[1]。研究表明镰形棘豆主要活性成分有黄酮类、生物碱类、多糖类等[2],其中黄酮类具有镇痛、抗炎、抗氧化、抑菌等生物活性,在抗肿瘤、抗2型糖尿病及防紫外线晒伤等领域已有较多的文献报道[3-4]。因此,寻找适宜的镰形棘豆总黄酮含量测定方法对其进一步研究具有重要意义。
目前,中药中黄酮含量测定的常用方法有高效液相色谱法[5-6]、毛细管电泳法[7]和紫外可见分光光度法[8-13]。其中前两种方法用于测定黄酮单体,而紫外分光光度法则用于测定总黄酮。近年来,金属离子络合法[8-13]已成为总黄酮含量测定应用最广泛的方法[10],其原理是在酸性或碱性条件下,金属离子与黄酮发生络合反应,生成不同颜色的金属螯合物,再在紫外或可见光区用比色法测定其含量[10],常用的显色剂有氯化铝和硝酸铝。镰形棘豆总黄酮含量测定方法研究未见报道,本文以芦丁为对照品,对氯化铝显色法和硝酸铝显色法直接测定总黄酮进行考察,以期建立适用于镰形棘豆总黄酮的含量测定方法。
-
AUX220电子分析天平、2550紫外可见分光光度计(日本岛津);LD5-2A低速离心机(北京医用离心机厂);HH2数显恒温水浴锅(江苏金坛市江南仪器厂);SY-176华美冷柜(杭州华美电冰箱厂)。
-
镰形棘豆(青海西宁,经联勤保障部队第909医院郑绍忠副主任药师鉴定为豆科棘豆属植物镰形棘豆);芦丁对照品(纯度92.6%,中国食品药品检定研究院,批号:100080-200707);95%乙醇、氢氧化钠、醋酸钠、氯化铝、亚硝酸钠、硝酸铝等试剂均为分析纯。
-
精密称取适量镰形棘豆粗粉,置圆底烧瓶中,加入20倍量66%乙醇回流提取2次,每次84 min,过滤,合并滤液,即为上样液。以D-101大孔树脂上柱,上样浓度为275 mg/g,洗脱剂为80%乙醇,洗脱液减压浓缩真空干燥,得纯度为62.86%的总黄酮粉末。
-
精确称取芦丁对照品0.0110 g,置于50 ml量瓶中,60%乙醇稀释至刻度,摇匀,即得浓度为0.22 mg/ml的芦丁对照品溶液,备用。
-
精确称取镰形棘豆总黄酮粉末0.0875 g,置于25 ml量瓶中,60%乙醇稀释至刻度,摇匀,即得浓度为3.50 mg/ml的储备液。精密吸取1 ml储备液至10 ml量瓶中,用60%乙醇稀释并定容至刻度,摇匀,即得供试品溶液,备用。
-
直接测定法:分别吸取对照品溶液和供试品溶液1.0 ml,置于25 ml量瓶中,用60%乙醇稀释并定容至刻度,摇匀。以60%乙醇为空白,于200~800 nm扫描,记录最大吸收波长。
AlCl3显色法:分别吸取对照品溶液和供试品溶液1.0 ml置于25 ml量瓶中,加入0.1mol/L三氯化铝溶液3.0 ml,再加入1.0 mol/L醋酸钠5.0 ml,用60%乙醇稀释并定容至25 ml,摇匀,放置5 min。以60%乙醇为空白,于200~800 nm处扫描,记录最大吸收波长。
Al(NO3)3显色法:分别吸取对照品和供试品溶液1.0 ml于25 ml容量瓶中,加入5%亚硝酸钠溶液1 ml,摇匀放置6 min,再加入10%硝酸铝溶液1 ml,摇匀放置6 min,继续加入4%氢氧化钠溶液10 ml,用60%乙醇定容至刻度,摇匀,放置15 min。以60%乙醇为空白,于200~800 nm处扫描,记录最大吸收波长。
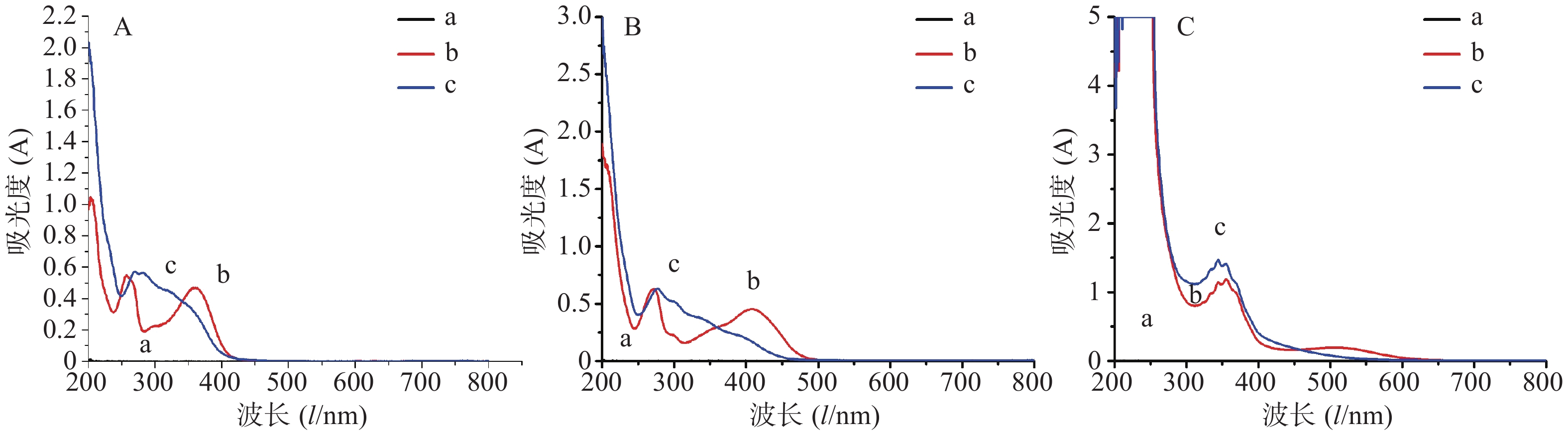
结果由图1可知,直接测定法的对照品与供试品最大吸收波长不一致,而氯化铝显色法和硝酸铝显色法对供试品溶液和对照品溶液的最大吸收波长接近,分别为277 nm和356 nm。笔者进一步研究供试品和显色剂对氯化铝显色法和硝酸铝显色法的影响,以优选出镰形棘豆总黄酮最适显色系统。
-
AlCl3显色法:分别吸取供试品溶液1.0 ml于25ml量瓶中,加入0.1 mol/L三氯化铝溶液3.0 ml,再加入1.0 mol/L醋酸钠5.0 ml,用60%乙醇稀释并定容至25 ml,摇匀,放置5 min。分别以60%乙醇、供试品和显色剂为空白,于200~800 nm处扫描,记录图谱。
Al(NO3)3显色法:分别吸取供试品溶液1.0 ml于25 ml容量瓶中,加入5%亚硝酸钠溶液1ml,摇匀放置6 min,再加入10%硝酸铝溶液1ml,摇匀放置6 min,继续加入4%氢氧化钠溶液10 ml,用60%乙醇定容至刻度,摇匀,放置15 min。分别以60%乙醇、供试品和显色剂为空白,于200~800 nm处扫描,记录图谱。
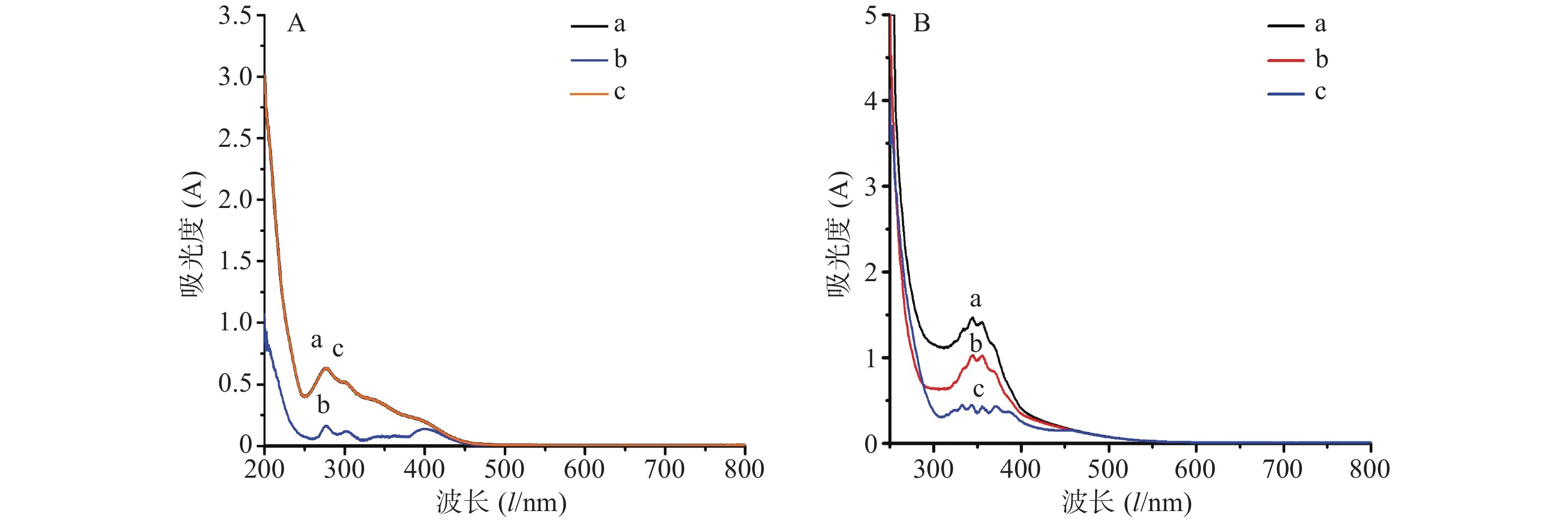
结果如图2所示。由图2A可知,在AlCl3显色体系中,以供试品作为空白时,其吸光度值相较于以60%乙醇作为空白时下降,表明供试品本身对AlCl3显色体系的信号是存在干扰的;以显色剂作为空白时,其吸光度值相较于以60%乙醇作为空白时保持不变,表明显色剂对AlCl3显色体系的信号不存在干扰。由图2B可知,在Al(NO3)3显色体系中,以供试品和显色剂作为空白时,其吸光度值相较于以60%乙醇作为空白时均有所下降,表明供试品和显色剂对Al(NO3)3显色体系的信号均存在干扰。
考虑到干扰因素的可去除性,Al(NO3)3显色体系显然不适合镰形棘豆总黄酮的测定,因为其信号干扰因素供试品和显色剂无法同时去除。而AlCl3显色体系则可通过以供试液不加显色剂作为空白来去除信号干扰,因此选择AlCl3显色体系用于镰形棘豆总黄酮含量的测定,并进行显色条件优化。
-
精密量取供试品溶液1.0 ml,置25 ml量瓶中,按照“2.4.1”项下方法,依次考察三氯化铝浓度(0.1、0.15、0.2、0.25、0.3、0.35 mol/L)、醋酸钠浓度(0.25、0.5、0.75、1.0、1.5、2.0、2.5 mol/L)、氯化铝用量(1.0、2.0、3.0、4.0、5.0、6.0 ml)、醋酸钠用量(3.0、4.0、5.0、6.0、7.0、8.0 ml)及反应时间(0、2、4、6、8、10、12、14、16、18、20 min),试验结果表明,当氯化铝浓度为0.3 mol/L,用量为3.0 ml,醋酸钠浓度为1.0 mol/L,用量为4.0 ml,反应时间为16 min时,供试品吸光度值最大且趋于稳定。
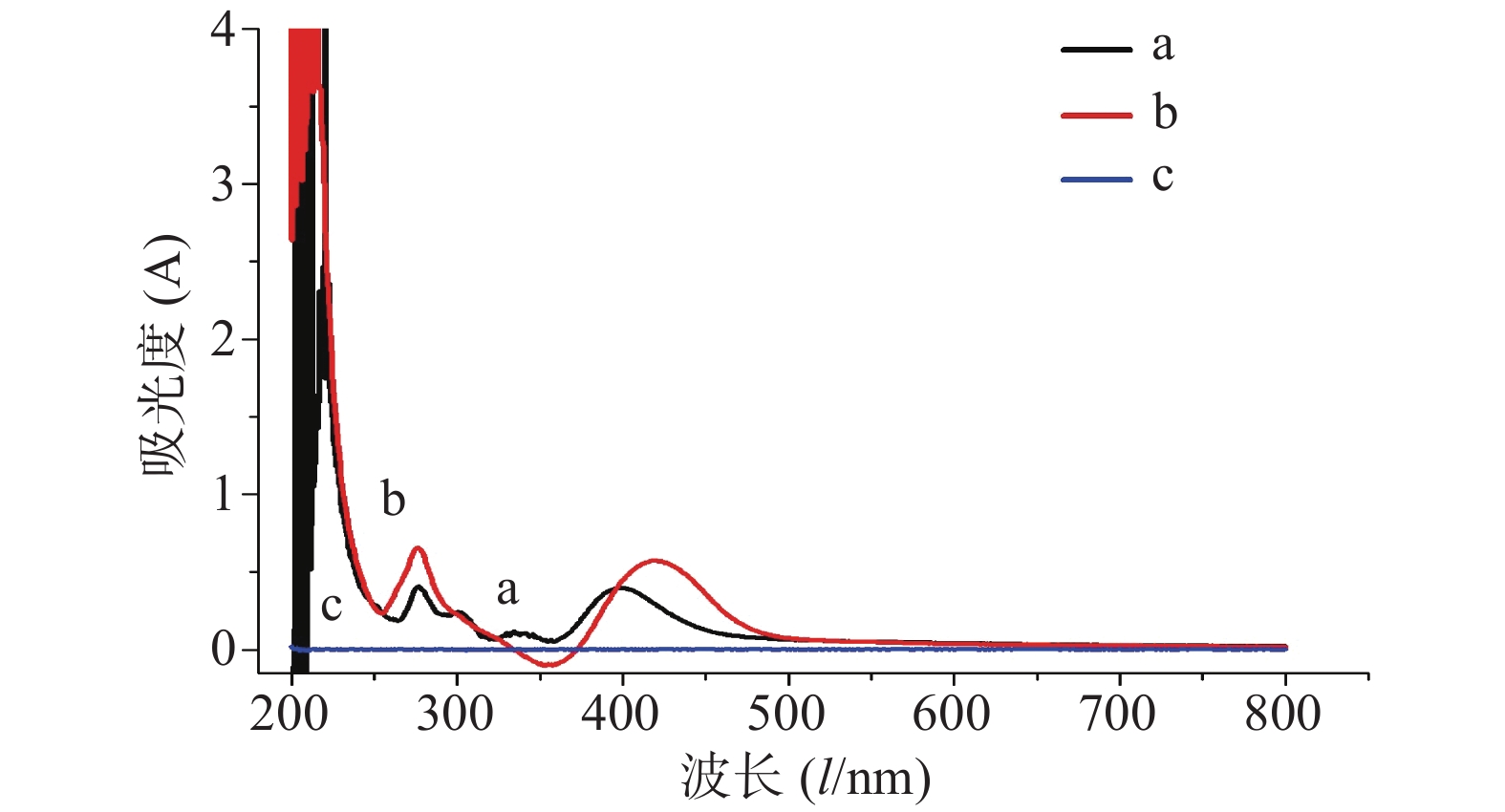
分别取供试液和对照品溶液1 ml于25 ml量瓶中,加入0.3 mol/L三氯化铝溶液3.0 ml,再加入1.0 mol/L醋酸钠4.0 ml,用60%乙醇稀释并定容至25 ml,摇匀,放置16 min,以供试液不加显色剂为参比,于200~800 nm处扫描,记录最大吸收波长,结果见图3。
-
精密量取芦丁对照溶液(0.22 mg/ml)1、1.5、2、3、4、5 ml,分别置于25 ml量瓶中,按“2.5”项下显色条件,制备系列浓度对照品溶液,以供试液不加显色剂为参比,在277 nm波长处测定吸光度,以芦丁对照品浓度X(μg/ml)为横坐标、吸光度Y(A)为纵坐标绘制标准曲线。计算得回归方程为Y=0.0353X+0.0267(r=0.9996),表明在8.8~44.0 μg/ml浓度范围内,芦丁对照品浓度与吸光度之间呈现良好的线性关系。
-
精密量取按“2.2”项下制备的芦丁对照品溶液1.0 ml,6份,置于25 ml量瓶中,按“2.5”项下显色条件,在277 nm波长处测定吸光度,以吸光度计算RSD为0.15%(n=6),结果表明精密度良好。
-
精密量取按“2.3”项下制备的镰形棘豆总黄酮供试品溶液1.0 ml,6份,置于25 ml量瓶中,按“2.5”项下显色条件,在277 nm波长处测定吸光度,以吸光度计算RSD为1.97%(n=6),表明本法重复性良好。
-
精密量取按“2.3”项下制备的镰形棘豆总黄酮供试品溶液1.0 ml,置于25 ml量瓶中,按“2.5”项下显色条件,每隔10 min测定一次,在277 nm波长处测定吸光度,以吸光度计算RSD为1.2%(n=6),表明样品在60 min内稳定。
-
精密量取按“2.3”项下制备的镰形棘豆总黄酮供试品溶液1.0 ml,置于25 ml量瓶中,再分别加入芦丁对照品溶液(0.242 mg/ml)0.65、1.00和1.10 ml,每个体积3份,共9份,按“2.5”项下显色条件,在277 nm波长处测定吸光度,标准曲线法计算总黄酮含量,并计算得回收率平均值为100.91%,RSD为2.426%(n=9),结果见表1。
表 1 镰形棘豆总黄酮加样回收率试验结果(n=9)
样品含量(μg/ml) 加入量(μg/ml) 测得量(μg/ml) 回收率(%) 平均值(%) RSD
(%)8.8 6.29 15.09 100.00 100.91 2.426 8.8 6.29 15.32 103.66 8.8 6.29 15.29 103.18 8.8 9.68 18.88 104.13 8.8 9.68 18.55 100.72 8.8 9.68 18.67 101.96 8.8 10.65 19.30 98.59 8.8 10.65 19.19 97.56 8.8 10.65 19.28 98.40 -
按“2.3”项下方法制备镰形棘豆总黄酮供试品溶液3批,按“2.5”项下显色条件,于277 nm波长处测定吸光度,以测得的吸光度结果计算RSD为3.30%(n=9),结果见表2。
表 2 镰形棘豆总黄酮含量测定结果
批号 总黄酮(g/g) 平均值(g/g) RSD (%) 202004091 0.4763 0.465 3.30 0.4654 0.4547 202004092 0.4652 0.4570 0.4562 0.4495 202004093 0.4916 0.4880 0.4851 0.4873 -
黄酮类化合物是一类广泛存在于中草药中的化合物,是植物的重要次生代谢产物。黄酮类化合物的结构中有两个交叉共轭体系,即A环苯甲酰基系统和B环桂皮酰基系统,产生两个紫外吸收谱带,分别在240~280 nm(Ⅰ)处和300~400 nm(Ⅱ)处。此类化合物的苯环上多有酚羟基取代,因此在碱性条件下,两个紫外吸收谱带可发生红移。利用这一光谱性质可采用紫外分光光度法进行黄酮类化合物含量测定。其中,Al(NO3)3显色法原理为用亚硝酸钠先把还原酮还原,再加Al3+进行络合,最后在NaOH碱性条件下使黄酮C环裂解生成查尔酮而显示橙红色。AlCl3显色法原理为Al3+可与黄酮的3-羟基-4-羰基、5-羟基-4-羰基和B环邻二酚羟基络合[16],使黄酮的紫外吸收谱带红移再用该法测定。
不同中药的总黄酮化合物组分各不相同,其显色方法需要经过研究及验证。现有文献报道[17-19],单纯以显色剂或供试品作为空白,其干扰因素的影响较为复杂。本文在显色方法选择时发现供试品和显色剂对Al(NO3)3显色体系在356 nm处的信号均存在干扰,其干扰因素无法去除,并且其专属性较差,存在多个小峰。而AlCl3显色体系中,供试品本身对AlCl3显色体系在277 nm处的信号存在干扰,但显色剂对AlCl3显色体系的信号不存在干扰,因此,可通过以供试液不加显色剂作为空白来去除信号干扰。
通过AlCl3显色法的显色条件优化,最佳显色条件为0.3 mol/L三氯化铝溶液3.0 ml,1.0 mol/L醋酸钠4.0 ml,放置16 min,最大吸收波长为277 nm。经方法学考察,该方法用于镰形棘豆总黄酮含量测定,具有简便、快速、准确和灵敏等优点。
Study on the determination of total flavonoids in Oxytropis falcata Bunge
-
摘要:
目的 建立紫外-可见分光光度法测定镰形棘豆总黄酮含量的方法。 方法 分别采用直接测定法、氯化铝-醋酸钠显色法和硝酸铝显色法,以芦丁为对照品,探究最优显色方法并进行显色条件优化和系统的方法学考察。 结果 最优显色法为氯化铝-醋酸钠显色法,以供试品不加显色剂为参比,0.3 mol/L三氯化铝溶液3.0 ml,1.0 mol/L醋酸钠4.0 ml,放置16 min,最大吸收波长为277 nm,此方法项下芦丁对照品在8.8~44 μg/ml的范围内,浓度与吸光度呈现良好的线性关系,线性回归方程为Y=0.0353X+0.0267(r=0.9996),加样回收率平均值为100.91%(n=9,RSD=2.426%)。 结论 该方法简便、快速、准确、灵敏,可作为镰形棘豆总黄酮含量的测定方法。 -
关键词:
- 镰形棘豆 /
- 总黄酮 /
- 含量测定 /
- 紫外-可见分光光度法 /
- 氯化铝-醋酸钠显色法
Abstract:Objective To establish an UV spectrophotometry method for the determination of total flavonoids in Oxytropis falcata Bunge. Methods Using rutin as comparison, three coloration methods were used to find the optimal assay method, optimize the color conditions and take a systematic methodological investigation. Results The best color development method is aluminum chloride-sodium acetate color method. Using the test product without adding color reagent as a reference, 0.3 mol/L aluminum chloride solution 3.0 ml, 1.0 mol/L sodium acetate 4.0 ml, placed for 16 min, the sample was detected at 277 nm wavelength by AlCl3-CH3COONa reaction by using rutin as reference. The rutin content had a good liner relationship in the range of 8.8 to 44 μg/ml (r=0.9996), and the average recovery rate was 100.91% with RSD of 2.426%. Conclusion This method is simple, rapid, accurate and sensitive and can be used as a method for the determination of total flavonoids from Oxytropis falcata Bunge. -
镰形棘豆(Oxytropis falcate Bunge)系豆科棘豆属多年生无茎草本植物。据《晶珠本草》记载,镰形棘豆以根及根茎或全草入药,被誉为“草药之王”,是我国青藏高原常用的民间草药之一[1]。研究表明镰形棘豆主要活性成分有黄酮类、生物碱类、多糖类等[2],其中黄酮类具有镇痛、抗炎、抗氧化、抑菌等生物活性,在抗肿瘤、抗2型糖尿病及防紫外线晒伤等领域已有较多的文献报道[3-4]。因此,寻找适宜的镰形棘豆总黄酮含量测定方法对其进一步研究具有重要意义。
目前,中药中黄酮含量测定的常用方法有高效液相色谱法[5-6]、毛细管电泳法[7]和紫外可见分光光度法[8-13]。其中前两种方法用于测定黄酮单体,而紫外分光光度法则用于测定总黄酮。近年来,金属离子络合法[8-13]已成为总黄酮含量测定应用最广泛的方法[10],其原理是在酸性或碱性条件下,金属离子与黄酮发生络合反应,生成不同颜色的金属螯合物,再在紫外或可见光区用比色法测定其含量[10],常用的显色剂有氯化铝和硝酸铝。镰形棘豆总黄酮含量测定方法研究未见报道,本文以芦丁为对照品,对氯化铝显色法和硝酸铝显色法直接测定总黄酮进行考察,以期建立适用于镰形棘豆总黄酮的含量测定方法。
1. 仪器与试药
1.1 仪器
AUX220电子分析天平、2550紫外可见分光光度计(日本岛津);LD5-2A低速离心机(北京医用离心机厂);HH2数显恒温水浴锅(江苏金坛市江南仪器厂);SY-176华美冷柜(杭州华美电冰箱厂)。
1.2 试药
镰形棘豆(青海西宁,经联勤保障部队第909医院郑绍忠副主任药师鉴定为豆科棘豆属植物镰形棘豆);芦丁对照品(纯度92.6%,中国食品药品检定研究院,批号:100080-200707);95%乙醇、氢氧化钠、醋酸钠、氯化铝、亚硝酸钠、硝酸铝等试剂均为分析纯。
2. 方法与结果
2.1 镰形棘豆总黄酮的提取及纯化[14-15]
精密称取适量镰形棘豆粗粉,置圆底烧瓶中,加入20倍量66%乙醇回流提取2次,每次84 min,过滤,合并滤液,即为上样液。以D-101大孔树脂上柱,上样浓度为275 mg/g,洗脱剂为80%乙醇,洗脱液减压浓缩真空干燥,得纯度为62.86%的总黄酮粉末。
2.2 芦丁对照品溶液配制
精确称取芦丁对照品0.0110 g,置于50 ml量瓶中,60%乙醇稀释至刻度,摇匀,即得浓度为0.22 mg/ml的芦丁对照品溶液,备用。
2.3 储备液和供试品溶液配制
精确称取镰形棘豆总黄酮粉末0.0875 g,置于25 ml量瓶中,60%乙醇稀释至刻度,摇匀,即得浓度为3.50 mg/ml的储备液。精密吸取1 ml储备液至10 ml量瓶中,用60%乙醇稀释并定容至刻度,摇匀,即得供试品溶液,备用。
2.4 显色系统的选择
2.4.1 最大吸收波长一致性的考察
直接测定法:分别吸取对照品溶液和供试品溶液1.0 ml,置于25 ml量瓶中,用60%乙醇稀释并定容至刻度,摇匀。以60%乙醇为空白,于200~800 nm扫描,记录最大吸收波长。
AlCl3显色法:分别吸取对照品溶液和供试品溶液1.0 ml置于25 ml量瓶中,加入0.1mol/L三氯化铝溶液3.0 ml,再加入1.0 mol/L醋酸钠5.0 ml,用60%乙醇稀释并定容至25 ml,摇匀,放置5 min。以60%乙醇为空白,于200~800 nm处扫描,记录最大吸收波长。
Al(NO3)3显色法:分别吸取对照品和供试品溶液1.0 ml于25 ml容量瓶中,加入5%亚硝酸钠溶液1 ml,摇匀放置6 min,再加入10%硝酸铝溶液1 ml,摇匀放置6 min,继续加入4%氢氧化钠溶液10 ml,用60%乙醇定容至刻度,摇匀,放置15 min。以60%乙醇为空白,于200~800 nm处扫描,记录最大吸收波长。
结果由图1可知,直接测定法的对照品与供试品最大吸收波长不一致,而氯化铝显色法和硝酸铝显色法对供试品溶液和对照品溶液的最大吸收波长接近,分别为277 nm和356 nm。笔者进一步研究供试品和显色剂对氯化铝显色法和硝酸铝显色法的影响,以优选出镰形棘豆总黄酮最适显色系统。
2.4.2 供试品和显色剂对反应体系干扰的考察
AlCl3显色法:分别吸取供试品溶液1.0 ml于25ml量瓶中,加入0.1 mol/L三氯化铝溶液3.0 ml,再加入1.0 mol/L醋酸钠5.0 ml,用60%乙醇稀释并定容至25 ml,摇匀,放置5 min。分别以60%乙醇、供试品和显色剂为空白,于200~800 nm处扫描,记录图谱。
Al(NO3)3显色法:分别吸取供试品溶液1.0 ml于25 ml容量瓶中,加入5%亚硝酸钠溶液1ml,摇匀放置6 min,再加入10%硝酸铝溶液1ml,摇匀放置6 min,继续加入4%氢氧化钠溶液10 ml,用60%乙醇定容至刻度,摇匀,放置15 min。分别以60%乙醇、供试品和显色剂为空白,于200~800 nm处扫描,记录图谱。
结果如图2所示。由图2A可知,在AlCl3显色体系中,以供试品作为空白时,其吸光度值相较于以60%乙醇作为空白时下降,表明供试品本身对AlCl3显色体系的信号是存在干扰的;以显色剂作为空白时,其吸光度值相较于以60%乙醇作为空白时保持不变,表明显色剂对AlCl3显色体系的信号不存在干扰。由图2B可知,在Al(NO3)3显色体系中,以供试品和显色剂作为空白时,其吸光度值相较于以60%乙醇作为空白时均有所下降,表明供试品和显色剂对Al(NO3)3显色体系的信号均存在干扰。
考虑到干扰因素的可去除性,Al(NO3)3显色体系显然不适合镰形棘豆总黄酮的测定,因为其信号干扰因素供试品和显色剂无法同时去除。而AlCl3显色体系则可通过以供试液不加显色剂作为空白来去除信号干扰,因此选择AlCl3显色体系用于镰形棘豆总黄酮含量的测定,并进行显色条件优化。
2.5 显色条件的优化及最优显色条件确定
精密量取供试品溶液1.0 ml,置25 ml量瓶中,按照“2.4.1”项下方法,依次考察三氯化铝浓度(0.1、0.15、0.2、0.25、0.3、0.35 mol/L)、醋酸钠浓度(0.25、0.5、0.75、1.0、1.5、2.0、2.5 mol/L)、氯化铝用量(1.0、2.0、3.0、4.0、5.0、6.0 ml)、醋酸钠用量(3.0、4.0、5.0、6.0、7.0、8.0 ml)及反应时间(0、2、4、6、8、10、12、14、16、18、20 min),试验结果表明,当氯化铝浓度为0.3 mol/L,用量为3.0 ml,醋酸钠浓度为1.0 mol/L,用量为4.0 ml,反应时间为16 min时,供试品吸光度值最大且趋于稳定。
分别取供试液和对照品溶液1 ml于25 ml量瓶中,加入0.3 mol/L三氯化铝溶液3.0 ml,再加入1.0 mol/L醋酸钠4.0 ml,用60%乙醇稀释并定容至25 ml,摇匀,放置16 min,以供试液不加显色剂为参比,于200~800 nm处扫描,记录最大吸收波长,结果见图3。
2.6 线性与回归方程
精密量取芦丁对照溶液(0.22 mg/ml)1、1.5、2、3、4、5 ml,分别置于25 ml量瓶中,按“2.5”项下显色条件,制备系列浓度对照品溶液,以供试液不加显色剂为参比,在277 nm波长处测定吸光度,以芦丁对照品浓度X(μg/ml)为横坐标、吸光度Y(A)为纵坐标绘制标准曲线。计算得回归方程为Y=0.0353X+0.0267(r=0.9996),表明在8.8~44.0 μg/ml浓度范围内,芦丁对照品浓度与吸光度之间呈现良好的线性关系。
2.7 精密度试验
精密量取按“2.2”项下制备的芦丁对照品溶液1.0 ml,6份,置于25 ml量瓶中,按“2.5”项下显色条件,在277 nm波长处测定吸光度,以吸光度计算RSD为0.15%(n=6),结果表明精密度良好。
2.8 重复性试验
精密量取按“2.3”项下制备的镰形棘豆总黄酮供试品溶液1.0 ml,6份,置于25 ml量瓶中,按“2.5”项下显色条件,在277 nm波长处测定吸光度,以吸光度计算RSD为1.97%(n=6),表明本法重复性良好。
2.9 稳定性试验
精密量取按“2.3”项下制备的镰形棘豆总黄酮供试品溶液1.0 ml,置于25 ml量瓶中,按“2.5”项下显色条件,每隔10 min测定一次,在277 nm波长处测定吸光度,以吸光度计算RSD为1.2%(n=6),表明样品在60 min内稳定。
2.10 加样回收率试验
精密量取按“2.3”项下制备的镰形棘豆总黄酮供试品溶液1.0 ml,置于25 ml量瓶中,再分别加入芦丁对照品溶液(0.242 mg/ml)0.65、1.00和1.10 ml,每个体积3份,共9份,按“2.5”项下显色条件,在277 nm波长处测定吸光度,标准曲线法计算总黄酮含量,并计算得回收率平均值为100.91%,RSD为2.426%(n=9),结果见表1。
表 1 镰形棘豆总黄酮加样回收率试验结果(n=9)样品含量(μg/ml) 加入量(μg/ml) 测得量(μg/ml) 回收率(%) 平均值(%) RSD
(%)8.8 6.29 15.09 100.00 100.91 2.426 8.8 6.29 15.32 103.66 8.8 6.29 15.29 103.18 8.8 9.68 18.88 104.13 8.8 9.68 18.55 100.72 8.8 9.68 18.67 101.96 8.8 10.65 19.30 98.59 8.8 10.65 19.19 97.56 8.8 10.65 19.28 98.40 2.11 镰形棘豆总黄酮含量测定
按“2.3”项下方法制备镰形棘豆总黄酮供试品溶液3批,按“2.5”项下显色条件,于277 nm波长处测定吸光度,以测得的吸光度结果计算RSD为3.30%(n=9),结果见表2。
表 2 镰形棘豆总黄酮含量测定结果批号 总黄酮(g/g) 平均值(g/g) RSD (%) 202004091 0.4763 0.465 3.30 0.4654 0.4547 202004092 0.4652 0.4570 0.4562 0.4495 202004093 0.4916 0.4880 0.4851 0.4873 3. 讨论
黄酮类化合物是一类广泛存在于中草药中的化合物,是植物的重要次生代谢产物。黄酮类化合物的结构中有两个交叉共轭体系,即A环苯甲酰基系统和B环桂皮酰基系统,产生两个紫外吸收谱带,分别在240~280 nm(Ⅰ)处和300~400 nm(Ⅱ)处。此类化合物的苯环上多有酚羟基取代,因此在碱性条件下,两个紫外吸收谱带可发生红移。利用这一光谱性质可采用紫外分光光度法进行黄酮类化合物含量测定。其中,Al(NO3)3显色法原理为用亚硝酸钠先把还原酮还原,再加Al3+进行络合,最后在NaOH碱性条件下使黄酮C环裂解生成查尔酮而显示橙红色。AlCl3显色法原理为Al3+可与黄酮的3-羟基-4-羰基、5-羟基-4-羰基和B环邻二酚羟基络合[16],使黄酮的紫外吸收谱带红移再用该法测定。
不同中药的总黄酮化合物组分各不相同,其显色方法需要经过研究及验证。现有文献报道[17-19],单纯以显色剂或供试品作为空白,其干扰因素的影响较为复杂。本文在显色方法选择时发现供试品和显色剂对Al(NO3)3显色体系在356 nm处的信号均存在干扰,其干扰因素无法去除,并且其专属性较差,存在多个小峰。而AlCl3显色体系中,供试品本身对AlCl3显色体系在277 nm处的信号存在干扰,但显色剂对AlCl3显色体系的信号不存在干扰,因此,可通过以供试液不加显色剂作为空白来去除信号干扰。
通过AlCl3显色法的显色条件优化,最佳显色条件为0.3 mol/L三氯化铝溶液3.0 ml,1.0 mol/L醋酸钠4.0 ml,放置16 min,最大吸收波长为277 nm。经方法学考察,该方法用于镰形棘豆总黄酮含量测定,具有简便、快速、准确和灵敏等优点。
-
表 1 镰形棘豆总黄酮加样回收率试验结果(n=9)
样品含量(μg/ml) 加入量(μg/ml) 测得量(μg/ml) 回收率(%) 平均值(%) RSD
(%)8.8 6.29 15.09 100.00 100.91 2.426 8.8 6.29 15.32 103.66 8.8 6.29 15.29 103.18 8.8 9.68 18.88 104.13 8.8 9.68 18.55 100.72 8.8 9.68 18.67 101.96 8.8 10.65 19.30 98.59 8.8 10.65 19.19 97.56 8.8 10.65 19.28 98.40 表 2 镰形棘豆总黄酮含量测定结果
批号 总黄酮(g/g) 平均值(g/g) RSD (%) 202004091 0.4763 0.465 3.30 0.4654 0.4547 202004092 0.4652 0.4570 0.4562 0.4495 202004093 0.4916 0.4880 0.4851 0.4873 -
[1] 陈锦珊, 杨钦磊, 刘晓玲, 等. 藏药镰形棘豆的化学成分、药理作用及毒理学研究进展[J]. 中国药房, 2016, 27(28):3945-3948. doi: 10.6039/j.issn.1001-0408.2016.28.17 [2] 霍星华, 赵宝玉, 王建军, 等. 镰形棘豆化学成分预试及生物碱成分薄层色谱分析[J]. 西北农业学报, 2008, 17(2):24-28, 32. doi: 10.3969/j.issn.1004-1389.2008.02.007 [3] 钱江, 陈锦珊, 胡永狮, 等. 镰形棘豆防晒霜对海训官兵日晒伤防护研究[J]. 东南国防医药, 2012, 14(2):105-107. doi: 10.3969/j.issn.1672-271X.2012.02.003 [4] LOU CH, YANG GM, CAI H, et al. 2′, 4′-Dihydroxychal-cone-induced apoptosis of human gastric cancer MGC-803 Cells via down-regulation of surviving mRNA[J]. Toxicol In Vitro,2010,24(5):1333-1337. doi: 10.1016/j.tiv.2010.05.003 [5] 张耕, 刘译, 唐勇, 等. 高效液相色谱法测定复方银杏通脉口服液中总黄酮醇苷含量[J]. 中国药业, 2018, 27(20):12-15. doi: 10.3969/j.issn.1006-4931.2018.20.005 [6] 代丽玲, 郑萍. HPLC内标法测定苦荞中总黄酮含量的研究[J]. 云南化工, 2017, 44(6):19-23. doi: 10.3969/j.issn.1004-275X.2017.06.005 [7] CHEN ML, HU W, ZHANG C. Capillary electrophoresis method for the determination of flavonoids[J]. Acta Pharmacol Sin,2011,46(8):883-889. [8] 袁旭江, 张平, 吴燕红, 等. 毛鸡骨草中总黄酮含量测定方法[J]. 中国实验方剂学杂志, 2015(11):80-84. [9] 常飞, 吴文能, 曹晖. 白补药总黄酮含量测定方法的建立[J]. 天然产物研究与开发, 2016, 28(01):75-79, 86. [10] 韦瑀龙, 黄小鸥, 蓝晓庆. 固本补肾口服液的总黄酮含量测定方法研究[J]. 实用药物与临床, 2016, 19(10):1287-1289. [11] 陈依春, 李捷, 姚欢, 等. 紫外分光光度法测定市售檀香中总黄酮含量[J]. 中国民族民间医药, 2020, 29(1):52-54. [12] 明明, 武爽, 杨立国, 等. 紫外分光光度法测定蒙药材多叶棘豆中总黄酮含量[J]. 亚太传统医药, 2019, 15(6):50-51. [13] 刘晓玲, 蔡小辉, 倪晓霞, 等. 复方茵陈合剂总黄酮测定方法研究[J]. 药学实践杂志, 2017, 35(6):547-550. doi: 10.3969/j.issn.1006-0111.2017.06.016 [14] 曾棋平, 王艺红, 蔡小辉, 等. 星点设计-效应面法优化镰形棘豆总黄酮的提取工艺[J]. 中国药师, 2017, 20(5):801-804. doi: 10.3969/j.issn.1008-049X.2017.05.008 [15] 蔡小辉, 曾棋平, 杨丽娜, 等. 正交法优化大孔树脂纯化镰形棘豆中总黄酮的工艺[J]. 解放军药学学报, 2018, 34(5):387-389. [16] 任珊珊, 包保全, 毛婷, 等. 中药中总黄酮的含量测定方法研究进展[J]. 北方药学, 2015, 12(3):112-115. [17] 钟优艳, 陈连国, 王琼. 中药苏叶和苏梗叶中总黄酮含量测定[J]. 安徽农业科学, 2016, 44(31):112-113. doi: 10.3969/j.issn.0517-6611.2016.31.040 [18] 倪晓霞, 王庆芬, 刘晓玲, 等. 复方黄连灌肠液的总黄酮含量测定方法研究[J]. 药学实践杂志, 2019, 37(4):352-356, 374. doi: 10.3969/j.issn.1006-0111.2019.04.013 [19] 吕亭亭, 杨志华, 谢奇, 等. 泡桐花总黄酮测定方法研究[J]. 化学与生物工程, 2020, 37(10):64-68. doi: 10.3969/j.issn.1672-5425.2020.10.014 -





 下载:
下载:
 下载:
下载:


