-
补骨脂(Psoralea corylifolia Linn)为豆科植物,以干燥成熟果实入药,性温,味辛、苦,归肾、脾经。有温肾助阳,纳气平喘,温脾止泻等功效,主治骨质疏松症、骨软化症、关节痛、哮喘、白癜风、银屑病、遗尿尿频、肾虚作喘等疾病,在中医临床治疗中被广泛应用于脾肾阳虚的治疗,但长期或者超量使用补骨脂及其制剂可导致肝损伤,临床表现主要为皮肤巩膜黄染、尿黄、乏力和食欲不振,同时伴有丙氨酸转移酶(ALT)、总胆红素(T-Bil)和直接胆红素(D-Bil)等生化指标不同程度升高,肝脏肿大或肝脏弥漫性病变。实验研究也表明,长期或大剂量服用补骨脂可引起大鼠不同程度的肝损伤。然而,补骨脂肝损伤成分和潜在机制至今尚未得到阐明。在本研究中,我们通过生物信息学工具评价补骨脂诱导肝损伤的潜在作用机制,为补骨脂肝损伤的临床和基础研究提供参考依据。
-
TCMIP (http://lsp.nwu.edu.cn/, Version 2.3);Pharm Mapper (http://59.78.96.61/pharmmapper/);Uniprot数据库中UniprotKB检索功能(http://www.uniprot.org/);String数据库(https://string-db.org/, Version 4.5.0);Disgenet(https://www.disgenet.org/);DAVIA基因富集分析网站 (http://david.ncifcrf.gov/summary.jsp);Cytoscape软件(Version 2.7.1);Chembiodraw Ultra软件 (Version14.0)
-
通过TCMIP数据库获取补骨脂所有化学成分,再结合文献挖掘与整理,筛选出补骨脂的主要成分,并对成分进行预测。
登陆Pharm Mapper服务器,上传上述补骨脂成分,获得虚拟筛选结果。利用UniProt数据库中UniProtKB搜索功能,输入蛋白名称,限定物种为人,预测补骨脂成分的作用靶点。
在Disgenet数据库中搜索药物性肝损伤相关的基因,去除重复基因和假阳性基因,与上述Pharm Mapper 服务器中返回的靶点相匹配,得到补骨脂成分诱导肝损伤的潜在作用靶点。
-
将补骨脂诱导肝损伤的作用靶点导入String数据库,利用Multiple proteins工具,选择“Homo Sapiens”为生物体,获取蛋白相互作用。将补骨脂成分和作用靶点信息以源节点和节点直接导入Cytoscape3.7.1,构建药材-成分-靶标-疾病网络。借助Network Analyzer工具对网络进行拓扑参数分析,并筛选出补骨脂诱导肝损伤的关键靶蛋白。
-
用DAVID 6.7 (http://david.ncifcrf.gov/summary.jsp) 对补骨脂药物性肝损伤PPI网络中的节点蛋白进行GO注释和KEGG通路分析,并采用R软件对结果进行图形化表示。
-
从TCMIP数据库中共筛选出的32个相关化合物,其中补骨脂素、补骨脂酚、补骨脂查尔酮、异补骨脂素和甲氧补骨脂素等22个符合Lipinski5规则,而补骨脂素、异补骨脂素和补骨脂酚为补骨脂主要成分。因此,上述22个化合物全部纳入进一步研究,化合物名称及详细信息见表1。
表 1 补骨脂成分及相关信息
化合物 相对分子
质量AlogP 氢键供
体数氢键受
体数Pub
ChemID双羟异补骨脂定 368.30 2.0 3 7 5316096 补骨脂酚 338.40 2.8 2 5 5320772 补骨脂定 336.30 4.7 2 5 5281806 异新补骨脂查尔酮 298.29 3.0 2 5 5318608 异补骨脂二氢黄酮 324.40 4.1 2 4 193679 补骨脂异黄酮醛 282.25 2.5 2 5 44257227 槐属香豆雌烷 A 334.30 4.0 1 5 14630492 补骨脂呋喃查尔酮 340.40 3.5 3 5 6476086 新补骨脂查尔酮 298.29 3.0 2 5 5320052 补骨脂二氢黄酮甲醚 338.40 4.4 1 4 10337211 补骨脂香豆雌烷B 352.30 3.1 2 6 5321820 补骨脂乙素 324.40 5.1 3 4 5281255 新补骨脂异黄酮 322.40 4.4 2 4 5320053 补骨脂查尔酮 324.40 5.1 3 4 6450879 补骨脂色烯素 322.40 4.5 2 4 5321800 异补骨脂定 336.30 4.1 1 5 12304285 甲氧补骨脂素 216.19 1.9 0 4 4114 补骨脂呋喃香豆精 186.16 2.3 0 3 3083848 异补骨脂素 186.16 2.0 0 3 10658 补骨脂素 186.16 2.3 0 3 6199 补骨脂香豆雌烷A 353.30 3.1 2 6 5321811 补骨脂定-2',3'-环氧化物 352.30 3.3 2 6 44257529 -
将补骨脂22个成分输入Pharm Mapper中,得到所有潜在蛋白质靶点,经UniProt转化为基因ID,并与Disgenet数据库中8类药物性肝损伤挖掘的疾病基因ID根据匹配度由高到低进行排序,去除重复后,匹配共得到31个补骨脂潜在的肝损伤作用靶点,见表2。
表 2 补骨脂成分潜在肝损伤作用靶点
序号 Uniprot ID 基因靶点 蛋白靶点 1 P28161 GSTM2 glutathione S-transferase Mu 2 2 O75469 NR1I2 nuclear receptor subfamily 1
group I member 23 P02768 ALB serum albumin 4 P11712 CYP2C9 cytochrome P450 2C9 5 P09211 GSTP1 glutathione S-transferase P 6 P04179 SOD2 superoxide dismutase [Mn], mitochondrial 7 Q96RI1 NR1H4 bile acid receptor 8 P05089 ARG1 arginase-1 9 P00374 DHFR dihydrofolate reductase 10 P02774 GC vitamin D-binding protein 11 P00390 GSR glutathione reductase, mitochondrial 12 P09601 HMOX1 heme oxygenase 1 13 P05019 IGF1 insulin-like growth factor I 14 P80188 LCN2 neutrophil gelatinase-associated lipocalin 15 P17931 LGALS3 galectin-3 16 P08253 MMP2 72 000 type IV collagenase 17 P00491 PNP purine nucleoside phosphorylase 18 Q08257 CRYZ quinone oxidoreductase 19 Q07869 PPARA peroxisome proliferator-activated receptor alpha 20 Q00796 SORD sorbitol dehydrogenase 21 P49888 SULT1E1 sulfotransferase 1E1 22 O00204 SULT2B1 sulfotransferase 2B1 23 P36897 TGFBR1 TGF-beta receptor type-1 24 P02766 TTR transthyretin 25 Q14994 NR1I3 nuclear receptor subfamily 1
group I member 326 Q13133 NR1H3 oxysterols receptor LXR-alpha 27 P37231 PPARG peroxisome proliferator-activated receptor gamma 28 O60760 HPGDS hematopoietic prostaglandin D synthase 29 P04035 HMGCR 3-hydroxy-3-methylglutaryl-coenzyme A reductase 30 P06702 S100A9 protein S100-A9 31 P09488 GSTM1 glutathione S-transferase Mu 1 -
采用Cytoscape软件的Merge功能构建补骨脂成分-靶点-信号通路-肝损伤网络模型,如图1所示(绿色椭圆代表靶点,黄色椭圆代表成分,粉红色菱形代表疾病,紫色椭圆表示补骨脂),节点代表活性或靶点,边代表成分、作用靶点和疾病间的相互关联,其中共有60个节点,327个边。节点的大小与度的大小呈正比关系,节点越大表示该节点的度越大。依据拓扑分析,13个成分的度值大于10,分别为补骨脂素、补骨脂定、补骨脂酚、异新补骨脂查尔酮、异补骨脂黄酮、补骨脂异黄酮醛、异补骨脂定、双羟异补骨脂定、新补骨脂查尔酮、补骨脂二氢黄酮甲醚、补骨脂乙素、补骨脂查尔酮、新补骨脂异黄酮;具有较高度值的靶点蛋白有血清白蛋白(ALB)、谷胱甘肽S-转移酶P(GSTP1)、运甲状腺素蛋白(TTR)和过氧化物酶体增殖物激活受体γ(PPARG)。
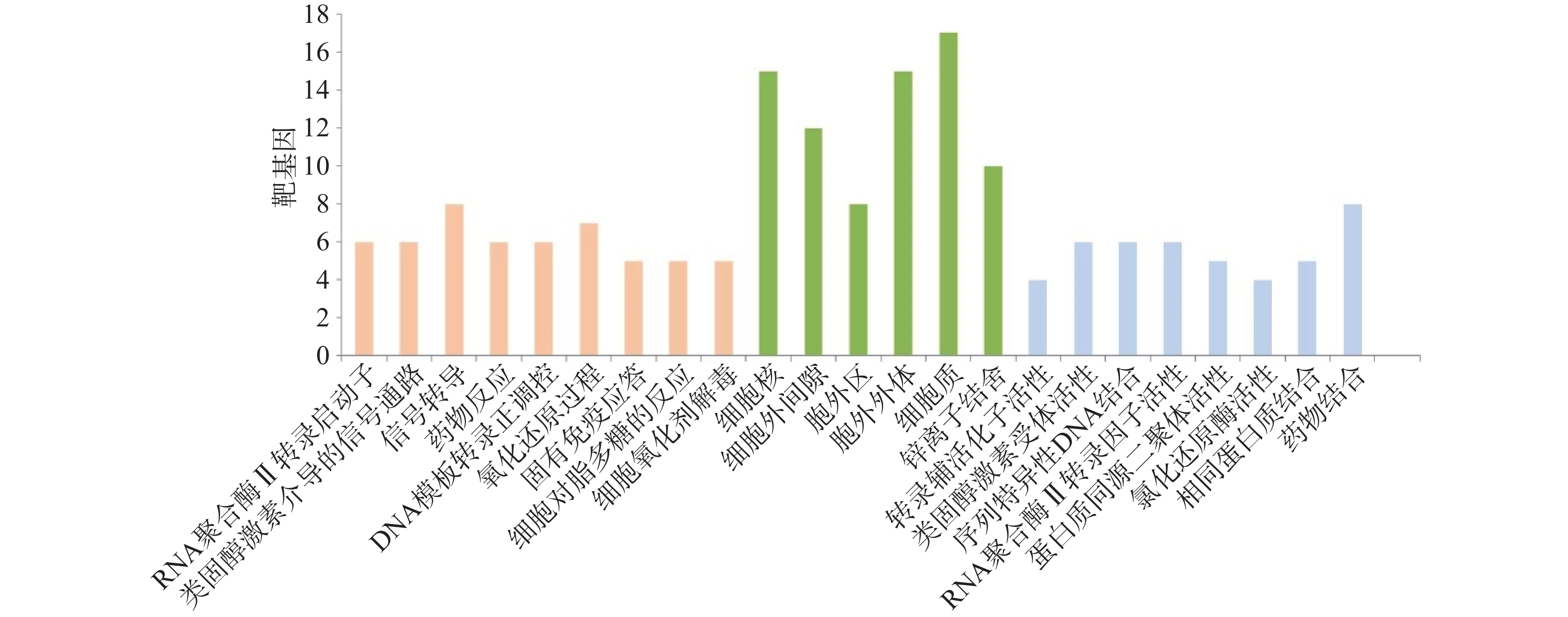
采用DAVID在线富集平台进行生物学功能分析,获得103个GO注释(黄色表示生物学过程、绿色表示细胞组成、蓝色表示分子功能)。GO分析表明,靶蛋白大多富集于RNA聚合酶Ⅱ启动子启动转录、类固醇激素介导的信号通路、信号转录、DNA模板转录正调控、RNA聚合酶Ⅱ启动子转录的正调控、氧化还原反应、固有免疫应答、细胞对脂多糖(LPS)的反应、细胞氧化解毒等生物学过程,见图2。此外,KEGG富集分析表明,5条通路(P<0.05)受补骨脂的影响,包括化学物致癌、AMPK信号通路、PPAR信号通路、肝药酶P450(CYP)有害物代谢和谷胱甘肽代谢通路等,结果见图3。
-
在临床上,补骨脂被广泛应用于治疗骨质疏松、银屑病等多种疾病,其所导致的药物性肝损伤已引起人们关注,但对于其肝损伤成分及分子机制的研究尚不深入。为了探究补骨脂所致肝损伤的作用机制,本研究从补骨脂的成分出发,借助生物信息学技术构建了补骨脂药材-成分-靶点-信号通路-肝损伤网络,分析补骨脂中成分与靶点的作用关系,为其导致肝损伤作用机制研究提供了参考。
通过数据库检索,我们发现补骨脂主要含有补骨脂素、异补骨脂素、补骨脂酚、补骨脂定、新补骨脂异黄酮和补骨脂二氢黄酮甲醚等22个成分[1-5] ,其中补骨脂素、异补骨脂素和补骨脂酚等为主要成分[5-6]。补骨脂中个别成分已被发现具有导致肝损伤的作用,如研究发现补骨脂素与补骨脂酚可通过降低BSEP蛋白的表达,升高NTCP和CYP7A1蛋白的表达,使得进入肝细胞的胆汁酸增多,进而肝细胞中胆汁酸的含量异常升高,最终导致胆汁淤积性肝损伤[7-9];此外,补骨脂素通过上调细胞周期蛋白E1和p27蛋白水平并下调细胞周期蛋白D1的水平,使肝细胞周期阻滞进而导致肝再生和代偿能力下降而诱发小鼠轻度肝损伤和L02肝细胞损伤;而异补骨脂素通过抑制MRP2和MRP3导致HepG2的细胞肝损伤[10-11]。补骨脂酚在体外的生物利用度远低于补骨脂素和异补骨脂素,但在体内补骨脂酚的CYP450代谢作用较强[12],补骨脂酚在体内复杂环境中的吸收和代谢可能是导致其在体内外肝损伤差异的主要原因。
通过GO分析整合预测,得到补骨脂导致肝损伤生物功能包括氧化还原反应、固有免疫应答、细胞对LPS的反应、细胞氧化解毒等。目前已知,氧化还原反应与免疫应答在药物性肝损伤发病机制中起关键作用。有研究发现,可溶性T细胞免疫球蛋白结构域和含黏蛋白结构域分子-3(sTIM-3)通过促进自噬和调节单核/巨噬细胞功能,减轻炎症反应和肝损伤[13]。氧化应激介导的脂质过氧化可导致胶原合成增加,氧化还原稳态失衡会干扰线粒体功能障碍进而导致药物引起的肝损伤。ROS可影响过氧化物酶体增殖物激活的受体调节脂肪酸氧化以及丝裂原活化蛋白激酶(MAPK)和相关的应激敏感激酶活力而调节肝细胞凋亡[14]。LPS参与了肝损伤中炎症或免疫破坏,可通过激活TLR-2和TLR-4途径促进炎症活动,并且LPS诱导的短暂缺血破坏了呼吸链复合物的活性,增强了ROS,从而进一步增强肠道高通透性,并能显著诱导肝损伤[15-16]。
KEGG富集分析结果表明,补骨脂所致肝损伤可能涉及AMPK、PPAR、CYP等多条信号通路。AMPK是NF-κB的上游蛋白,被认为是维持ADP/AMP/ATP水平的关键细胞代谢传感器,AMPK信号通路的激活可抑制非典型NF-κB途径,从而保护肝脏免受损伤[17-18]。PPAR信号通路在肝损伤和肝纤维化中起着关键作用,在活化的HSCs中,PPAR-γ活性降低,从而导致HSCs从维甲酸储存状态向产生ECM的肌成纤维细胞转化,可促进CCl4诱导的肝损伤和纤维化,然而,抑制PPARG可阻止Fsp27α mRNAs的表达,进而减少乙醇诱导小鼠线粒体活性氧生成所导致的肝损伤[19-20]。肝脏CYP酶在药物代谢和清除中发挥关键作用,例如CYP2E1可增加活性氧的数量,进而导致氧化应激肝损伤[21-22]。基于上述结果和理论基础,有必要开展补骨脂AMPK、PPAR等信号通路的作用研究,从而为其肝损伤机制提供理论依据。
综上所述,本研究通过生物信息学技术构建补骨脂药材-成分-靶点-信号通路-肝损伤网络对补骨脂成分所致肝损伤作用机制进行分析预测,研究结果充分表明了补骨脂多成分-多靶点-多通路的肝损伤作用特点,为进一步开展补骨脂致肝损伤作用机制的研究提供了新思路。
Mechanism of Psoralea corylifolia Linn on liver injury based on bioinformatics
-
摘要:
目的 基于生物信息学技术建立补骨脂成分-靶点-信号通路-肝损伤网络,探讨补骨脂导致肝损伤的作用机制。 方法 通过TCMIP数据库收集补骨脂成分以及肝损伤有关的靶点,依据反向药效团匹配方法预测补骨脂成分的作用靶点;采用Cytoscape 构建补骨脂成分-靶点网络,对补骨脂作用靶点构建网络模型进行GO与KEGG富集分析。 结果 补骨脂中有22个成分作用于31个肝损伤靶点蛋白,血清白蛋白(ALB)、谷胱甘肽S-转移酶P(GSTP1)、运甲状腺素蛋白(TTR)和过氧化物酶体增殖物激活受体γ(PPARG)可能是关键节点蛋白。KEGG分析遴选出化学物致癌、AMPK、PPAR信号、P450代谢和谷胱甘肽等信号通路。 结论 补骨脂可能是作用于ALB、GSTP1、TTR与PPARG等靶点并调控五类信号通路导致肝损伤。 Abstract:Objective To explore the mechanism of Psoralea corylifolia Linn (PCL) on liver injury by establishing the biological function and pathway network of PCL components, targets and protein interactions based on bioinformatics. Methods The components of PCL and potential liver-injury related targets were collected from TCMIP database. The targets of PCL were predicted by the reverse pharmacophore matching method. Cytoscape software was applied for the construction of active components-targets network map. Protein-protein interaction network was constructed by STRING database. Gene ontology functional enrichment analysis and KEGG pathway enrichment analysis were conducted to predict the liver injury mechanism of PCL. Results 22 components were identified from PCL with the corresponding 31 potential liver injury targets, mainly on serum albumin (ALB), glutathione S-transferase P (GSTP1), transthyretin (TTR) and peroxisome proliferator activated receptor gamma (PPARG) by PPI network analysis. The chemical carcinogenesis, adenosine 5 '- monophosphate activated protein kinase (AMPK) signal, PPAR signal, liver enzyme P450 and its harmful substance metabolism, glutathione metabolism and other signaling pathways were selected by KEGG analysis. Conclusion The active components of PCL may target on ALB, GSTP1, TTR and PPARG to regulate AMPK and PPAR signaling pathways, leading to liver injury. -
Key words:
- Psoralea corylifolia Linn /
- bioinformatics /
- liver injury
-
西罗莫司(sirolimus,SRL),又称雷帕霉素,是第三代免疫抑制剂,在临床上常用于抑制肝、肾等器官移植后的免疫排斥反应。SRL属于生物药剂学分类Ⅱ类药物,在水中的溶解度极低,而渗透性良好[1-4]。SRL药理活性高,但因水溶性差,且易被肠壁和肝中的CYP3A4同工酶广泛代谢,致使其口服生物利用度较低。这是临床应用SRL的重要缺陷之一。目前,已上市的SRL制剂主要是纳米结晶片,生物利用度约为17%[5-7]。
通过适当的制剂技术提高SRL在胃肠道中的溶解度,可提高其口服生物利用度。在前期研究中,课题组分别独立进行了含SRL的自微乳(self-microemulsifying drug delivery system,SMEDDS)、固体分散体(solid dispersion,SD)和纳米结构脂质载体(nanostructured lipid carriers,NLC)的构建,均显著改善了SRL的体外溶出。本实验在前期研究的基础上,新增环糊精衍生物对SRL的增溶研究,结合体外溶出度和体内生物利用度,综合分析和评价各增溶制剂的优势和缺陷,从而为解决口服难溶性药物的研究提供参考。
1. 仪器与试剂
1.1 仪器
Agilent 1200型高效液相色谱仪(美国Agilent公司);Starter 2C型pH计(上海奥豪斯仪器公司);RCZ-6BZ型药物溶出仪(上海黄海药检仪器公司);真空冷冻干燥箱(北京博医康试验仪器公司);NS1001L2K高压匀质机(意大利NiroSoavi公司);UV-2800AH型紫外可见分光光度仪(上海优尼科仪器有限公司);液相色谱-质谱联用仪(美国AB-SCIEX有限公司)。
1.2 试剂
SRL对照品(含量99.9%)、SRL原料药(含量99.6%),购自福建科瑞药业有限公司;子囊霉素对照品(上海齐奥化工科技有限公司),Rapamune®(美国惠氏制药)。聚乙二醇6000(PEG 6000)、聚乙烯吡咯烷酮(PVP K30)均购自国药集团化学试剂有限公司;聚氧乙烯-聚氧丙烯共聚物(Poloxamer 188)、聚氧乙烯35蓖麻油(Cremophor EL)、聚氧乙烯氢化蓖麻油(Cremophor RH40)均购自德国BASF公司;油酸聚乙二醇甘油酯(Labrafil M1944CS)、二乙二醇单乙基醚(Transcutol P)、辛酸癸酸聚乙二醇甘油酯(Labrasol)、棕榈酸硬脂酸甘油酯(Precirol ATO5)、月桂酸聚乙二醇甘油酯 (Gelucire 44/14)均购自法国GATTEFOSSE公司;HP-β-CD、DM-β-CD、SBE-β-CD(山东滨州智源生物科技有限公司)。
2. 方法
2.1 SRL含量测定方法
采用高效液相色谱仪(HPLC)测定样品中的SRL含量[8]。色谱柱为Eclipse XDB-C18(150 mm×4.6 mm,5 μm),流动相为乙腈-甲醇-水(45∶34∶21),流速为1 ml/min,检测波长为278 nm,柱温为50 ℃,进样量为20 μl。配制浓度为2、4、8、12、16、20 μg/ml的SRL对照品溶液,得标准曲线为Y=54.712X+1.221,r=0.999 9,表明在2~20 μg/ml浓度范围内线性关系良好。另外,精密度、回收率符合要求。
2.2 SRL增溶方法
2.2.1 SRL-SMEDDS的制备
参考前期研究[9],称取1 g SRL原料药,加入19 g的助乳化剂Transcutol HP,超声至全部溶解后,加入22 g油相Labrafil M1944CS及39 g乳化剂Cremophor EL,涡旋混匀,得到淡黄色澄清溶液,即SRL-SMEDDS。
2.2.2 SRL-NLC的制备
参考前期研究[10-11],取Gelucire44/14和Crodamol GTCC在75 ℃水浴中完全熔融后,加入SRL原料药搅拌均匀成澄明油相,再将同温度吐温−80的水溶液迅速倒入油相,以300 r/min搅拌30 min制备初乳,再经高压匀质机90 MPa乳匀5次,即得SRL-NLC分散液,其中SRL为0.21%,Gelucire44/14:Crodamol GTCC(1∶2.1),脂质总量为10%,吐温−80为7.33%。随后,将SRL-NLC(42.6%)加入微晶纤维素和聚乙烯吡咯烷酮(50%,4∶1)中,研磨混合并放置过夜以充分吸附,加入甘露醇(冻干保护剂,3%),经冷冻干燥过夜后,所得固体粉末中加入低取代羟丙基纤维素(崩解剂,4%)和二氧化硅(助流剂,0.4%)即得固化纳米脂质体。
2.2.3 SRL-SD的制备
采用溶剂-熔融法制备SRL-SD。称取载体材料,于80 ℃水浴加热熔融,滴入SRL乙醇溶液,充分混匀,待乙醇挥发完全后,迅速将其倾倒于冰浴条件下的不锈钢板上成薄膜,固化,再于−18 ℃放置4 h后,将固体分散体从不锈钢板上刮下,置真空干燥器中干燥,待脆化后研细,过80目筛,即得SRL-SD。以载体种类、药物-载体比例为考察因素,以0.4% SDS中的溶出度为指标,对SRL-SD进行单因素分析。
2.2.4 SRL-IC的制备
称取适量β-环糊精衍生物溶于去离子水中,缓慢滴加SRL乙醇溶液,在一定温度下磁力搅拌至澄清透明,减压挥发4 h,使乙醇挥发完全,再置于4 ℃冰箱冷藏12 h,降低SRL的溶解度,从而使游离的SRL发生结晶。经0.22 μm微孔滤膜过滤除去结晶,滤液冷冻干燥24 h,所得固体研磨细化,过80目筛,即得SRL-IC。
称取一定量的SRL-IC置10 ml容量瓶中,加入50%甲醇水溶液,超声至全部溶解后,定容至刻度,并采用HPLC测定SRL含量,根据公式:包封率(%)=[(SRL投入量-SRL测定量)/ SRL投入量]×100%,进行计算。以环糊精衍生物的种类、浓度、温度、乙醇体积和投药量为考察因素,以包封率为指标,对SRL-IC进行单因素分析。
2.3 体外溶出试验
参考《中国药典》2015年版四部通则0931项下溶出度与释放度测定法,考察SRL原料药、市售片(Rapamune®)、SRL-SMEDDS、SRL-NLC、SRL-IC及SRL-SD的溶出曲线。除市售片外,其余样品均装入硬胶囊中,每个胶囊含1 mg SRL。采用桨法,搅拌速度为100 r/min,溶出介质体积为250 ml,分别以0.4% SDS、水、pH 1.2盐酸溶液、pH 4.5醋酸盐缓冲液、pH 6.8磷酸盐缓冲液、pH 7.4磷酸盐缓冲液为溶出介质。将两颗胶囊或药片置于沉降篮中,投入溶出介质,在10、30、45、60、90、120 min,吸取2 ml介质,并补充等温等体积的介质,采用HPLC测定样品中的药物含量,绘制溶出曲线。
2.4 体内药代动力学试验
选用比格犬为实验动物,采用6周期6交叉实验设计,进行SRL原料药、市售片(Rapamune®)、SRL-SMEDDS、SRL-NLC、SRL-IC及SRL-SD的药代动力学试验。给药剂量为1 mg SRL,实验动物试验开始前12 h禁食不禁水,给药4 h后自由饮水,2次给药间隔2周以上的清洗期。于给药前,0.25、0.5、0.75、1、1.5、2、3、4、6、8、10、12、24、36、48及72 h分别经前肢小静脉采血2 ml,置于含肝素和EDTA的抗凝管中,−20 ℃保存备用。血样处理与测定方法参照课题组前期研究[12]。
3. 结果
3.1 SRL-SD的制备
3.1.1 载体种类
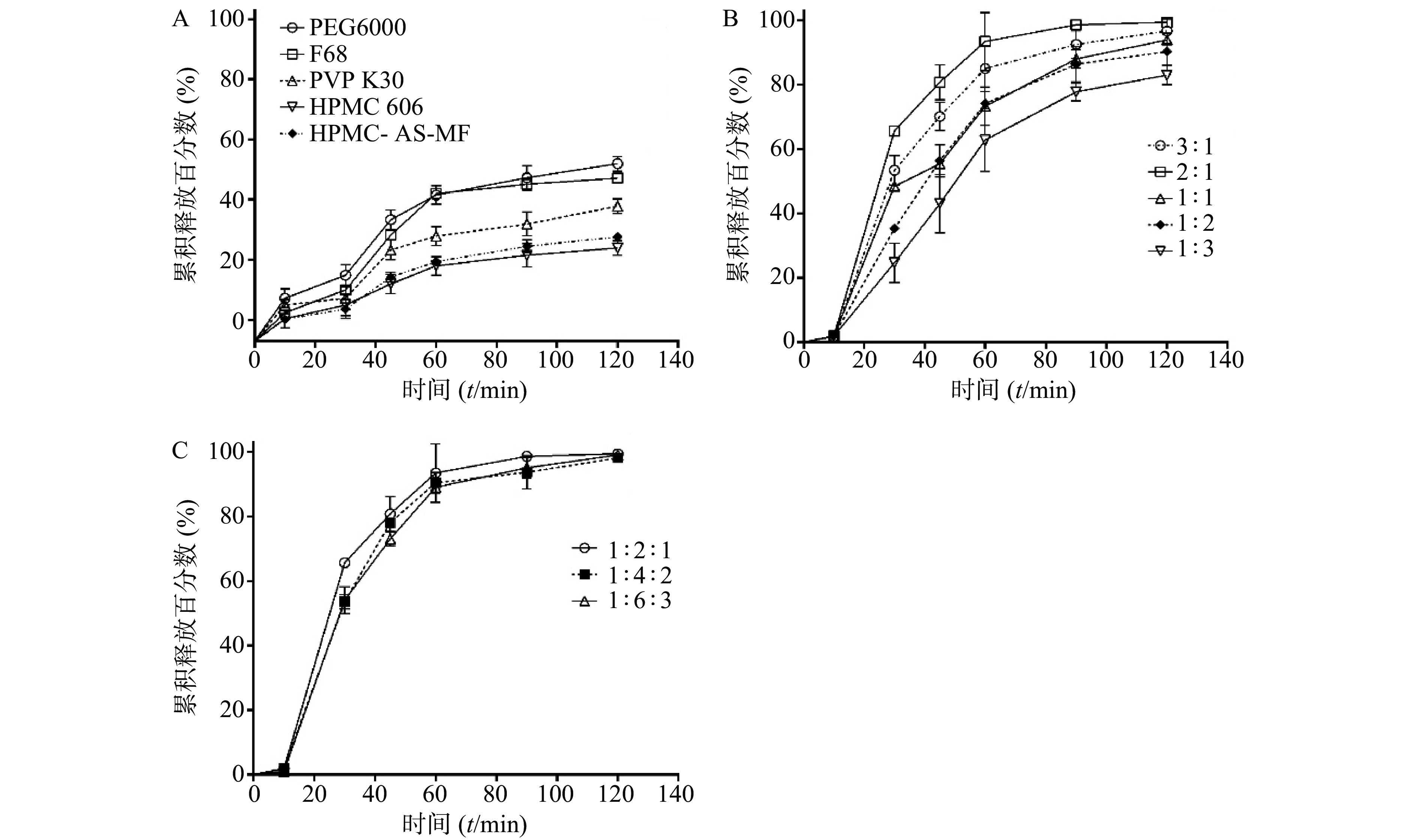
如图1A所示,不同载体材料制备的SRL-SD的溶出曲线显示了明显的差异,溶出速率为PEG6000>F68>PVP K30>HPMC606>HPMC-AS-MF。同时,各载体材料的溶出度均不理想(≤50%),因此进一步考察采用二元载体制备SRL-SD。
选择PEG6000联合F68制备二元载体固体分散体[13],两者比例为3∶1、2∶1、1∶1、1∶2、1∶3。随PEG6000/F68比例的增大,则SRL溶出度呈增大趋势,在PEG6000/F68为2∶1时的溶出度达到最大(图1B)。
3.1.2 药物-载体比例
在PEG6000/F68=2∶1的基础上,进一步考察药物-载体比例对SRL-SD溶出的影响。药物-PEG6000/F68载体比例为1∶2∶1、1∶4∶2及1∶6∶3所制的SRL-SD的溶出曲线相似,没有明显差别,2 h的溶出度都接近100%(图1C)。因此优选载药量最大,即药物- PEG6000/F68载体比例为1∶2∶1。
3.2 SRL-IC的制备
3.2.1 β-环糊精衍生物种类
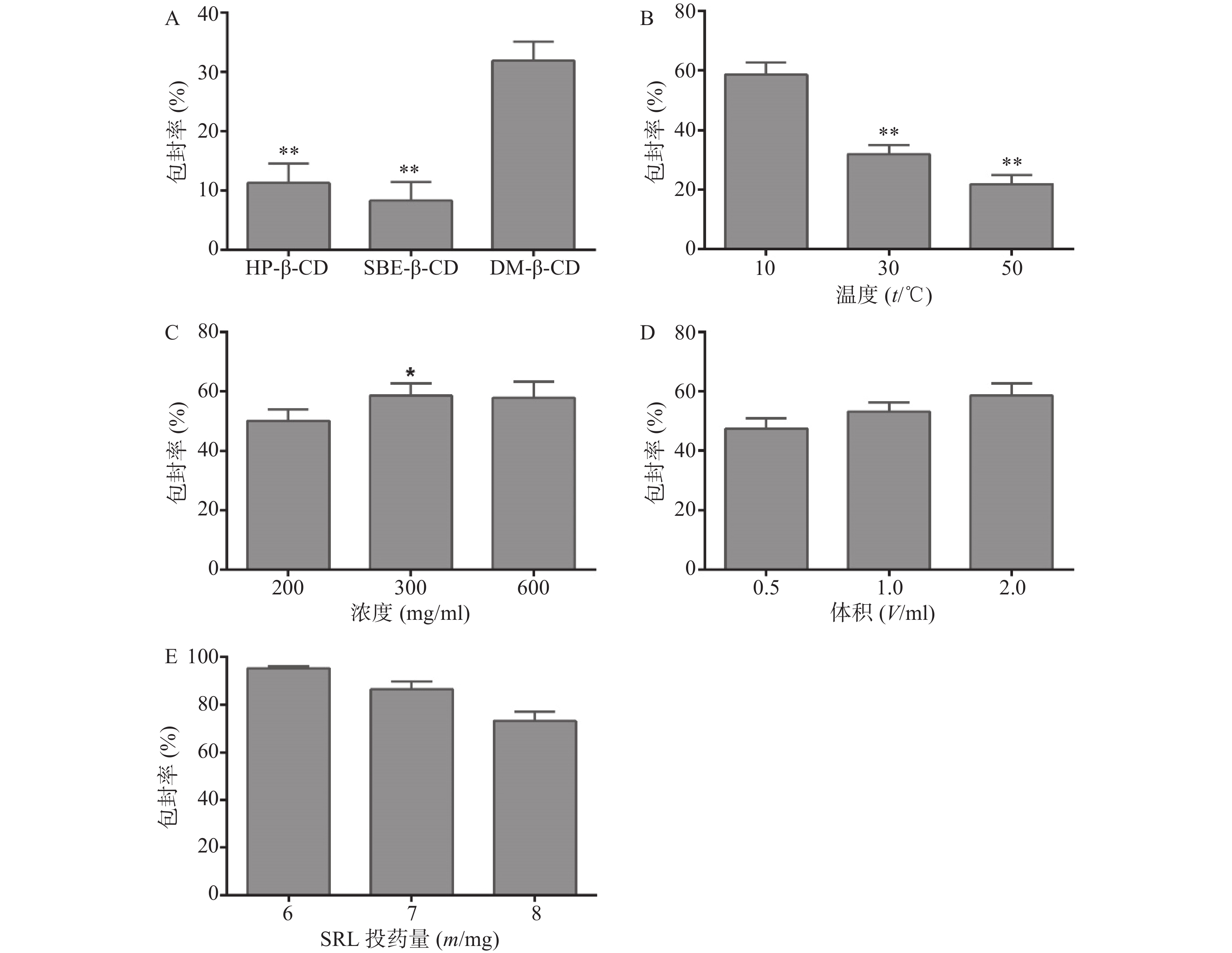
在其他条件相同的情况下,HP-β-CD、SBE-β-CD和DM-β-CD对SRL的包封率分别为(11.21±3.35)%、(8.24±3.11)%和(31.86±3.26)%,见图2A。因此,优选DM-β-CD制备SRL-IC。
3.2.2 温度
采用DM-β-CD制备SRL-IC,考察不同温度对包封率的影响。结果显示(图2B),温度越低,包封率越高,10 ℃条件下制备的SRL-IC的包封率显著高于30 ℃和50 ℃(P<0.01),为(58.61±4.16)%。因此,优选10 ℃制备SRL-IC。
3.2.3 环糊精衍生物浓度
DM-β-CD的浓度由200 mg/ml增大至300 mg/ml,SRL的包封率由(52.12±4.17)%增大至(58.61±4.11)%(P<0.05,图2C)。进一步增大DM-β-CD的浓度至600 mg/ml,包封率没有明显变化(P>0.05)。因此,优选DM-β-CD的浓度为300 mg/ml制备SRL-IC。
3.2.4 乙醇体积
乙醇体积由0.5 ml增大至2 ml,包封率呈增大趋势(图2D)。因此,优选乙醇体积为0.5 ml制备SRL-IC。
3.2.5 投药量
SRL的投药量6 mg增大至8 mg,包封率显著降低,6 mg SRL的包封率为(95.21±1.10)%,见图2E。因此,优选SRL的投药量为6 mg。
3.3 体外溶出度
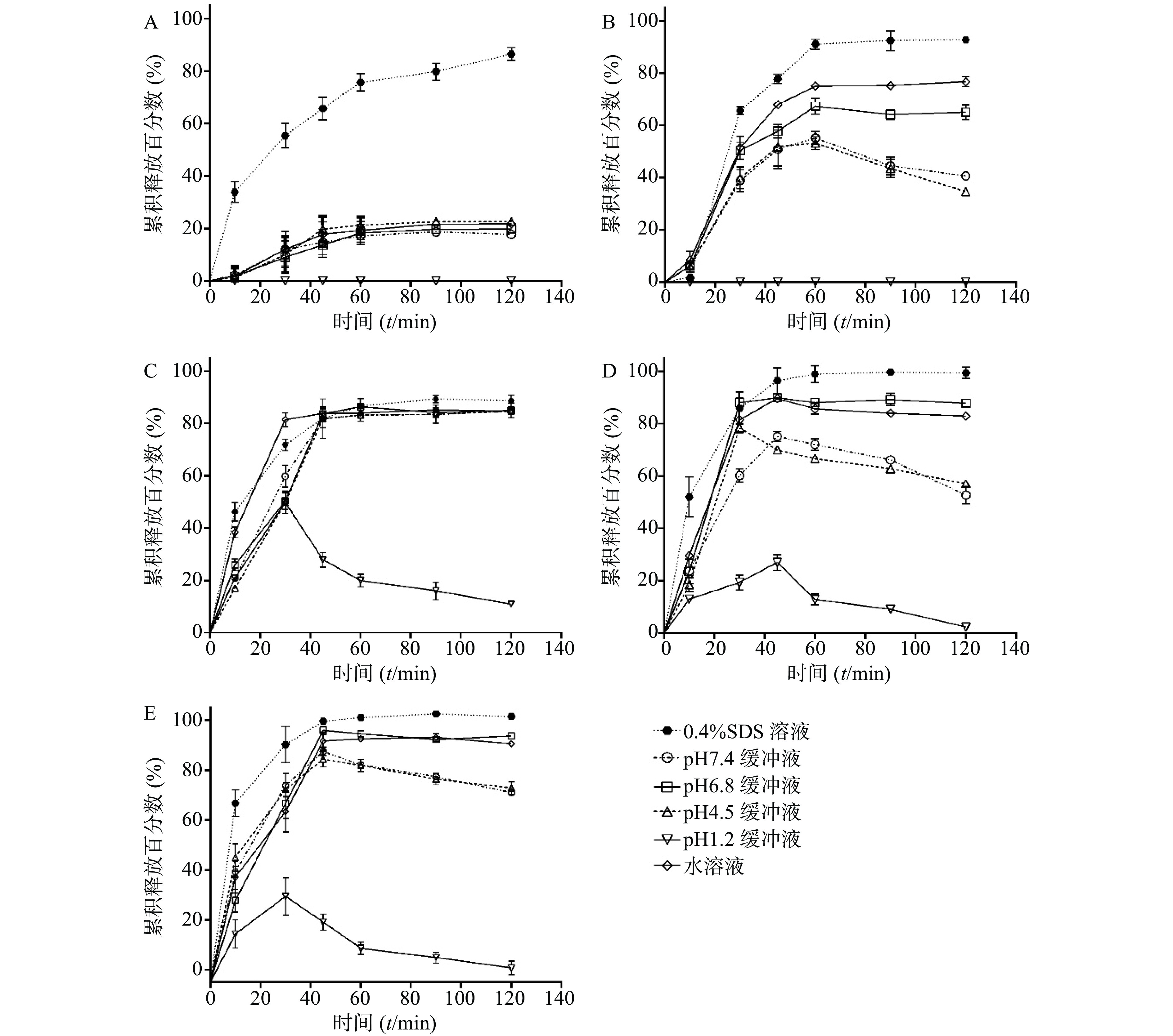
考察SRL-SD、SRL-IC、SRL-SMEDDS及SRL-NLC在不同介质中的溶出曲线。如图3所示,在0.4% SDS中,各制剂在2 h的溶出度均超过80%,尤其是SMEDDS和NLC的溶出度接近100%。
在pH 6.8和水中,SRL-SD的溶出速率减小,2 h的溶出度分别为(65.00±4.90)%和(76.70±1.95)%。在pH 4.5和pH 7.4的介质中,SRL-SD的溶出在1 h达到最大值,分别为(53.20±4.34)%和(55.20±4.34)%,随后溶出度逐渐降低。在pH 1.2的介质中,未检测到SRL。
在水、pH 4.5、pH 6.8和pH 7.4中,SRL-IC在40 min内的溶出速率有所减小,但2 h的累积溶出没有明显变化,均在80%以上。在pH 1.2的介质中,SRL-IC的溶出度在30 min达到最大值,为(49.84±7.21)%,随后溶出度逐渐降低。
SRL-SMEDDS和SRL-NLC显示了与SRL-SD相似的溶出趋势,即在水和pH 6.8中的溶出度低于0.4% SDS,但大于80%。在pH 4.5和pH 7.4的介质中,溶出达到峰值(约80%)后逐渐降低。
3.4 比格犬体内药动学试验
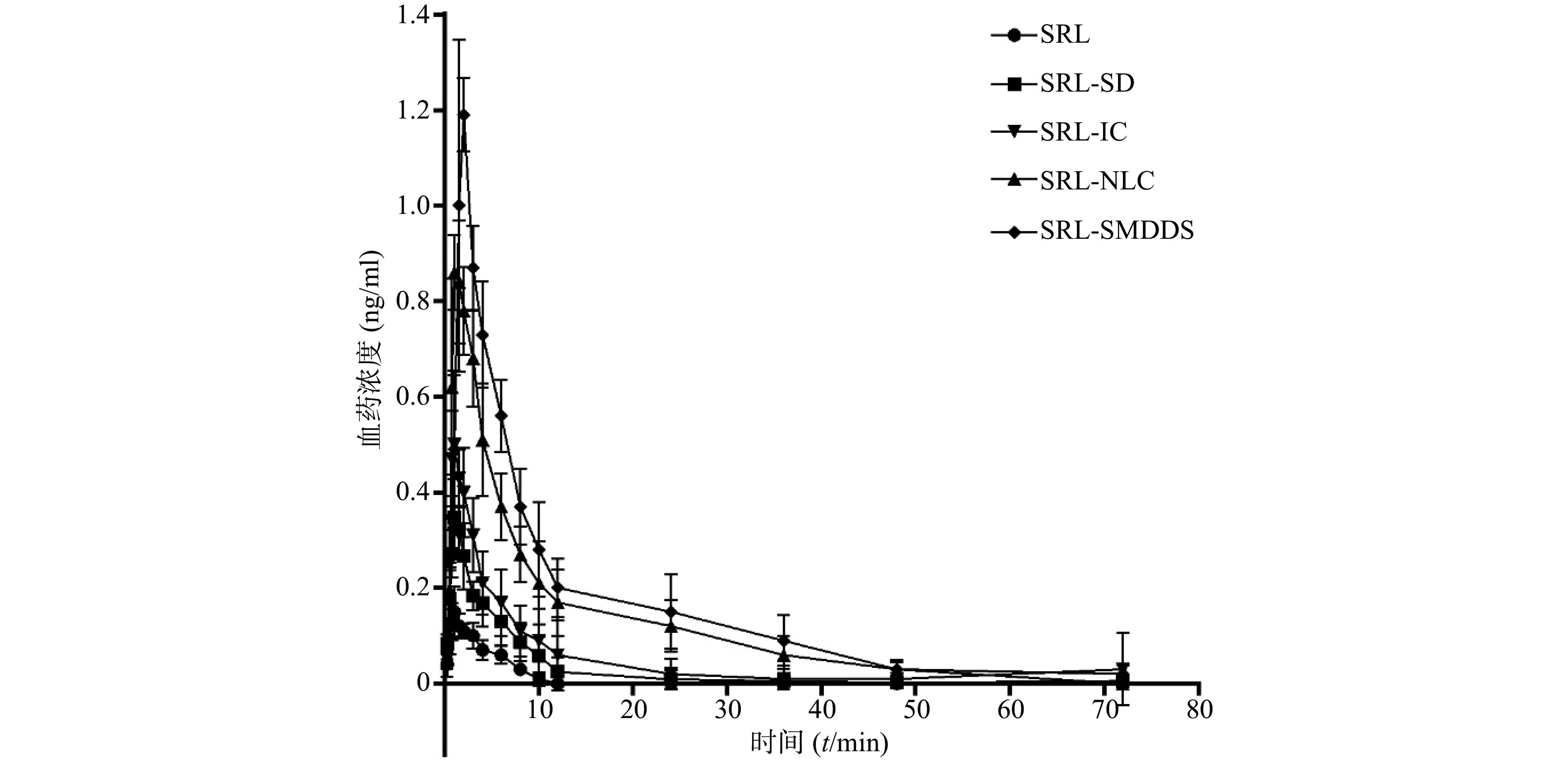
SRL血药浓度-时间曲线见图4,经DAS 3.2.6软件处理后,具体参数见表 1。
表 1 非房室模型体内药动学参数($ \bar x$ ±s)参数 SRL SRL-SD SRL-IC SRL- NLC SRL-SMEDDS Rapamune® AUC0→72(µg·h/ml) 0.70±0.13 2.06±0.79 3.66±2.64 8.60±2.03 10.76±1.57 11.02±2.73 AUC0→t(µg·h/ml) 0.73±0.15 2.07±0.81 3.78±2.84 8.67±1.95 11.15±2.11 11.75±3.13 t1/2 (t/h) 16.53±1.50 14.50±2.15 20.64±5.45 8.97±6.87 12.97±5.67 14.54±5.67 tmax(t/h) 1.04±0.25 1.25±0.28 1.04±0.25 1.13±0.31 1.50±0.38 1.83±0.26 cmax (ng/ml) 0.16±0.05 0.36±0.05 0.53±0.13 0.90±0.09 1.23±0.07 1.28±0.13 以原料药为参比制剂,SRL-SD、SRL-IC、SRL-SMEDDS、SRL-NLC、Rapamune®的相对生物利用度分别为332.8%、522.9%、1 228.6%、1 537.1%、1 574.3%,表明各增溶方法都显著提高了SRL的生物利用度。
以市售纳米晶片Rapamune®为参比制剂,SRL-SD、SRL-IC、SRL-NLC、SRL-SMEDDS的相对生物利用度分别为18.7%、33.2%、78.0%、97.6%,可见在各增溶方法中,SMEDDS对SRL体内吸收的作用最显著,与市售制剂相当。
4. 讨论
本研究同时制备和比较了SRL的4种增溶制剂,均显示了良好的体外溶出度。同时,各制剂都提高了SRL的生物利用度,但体内吸收程度有较明显的差异。
首先,SRL本身的性质是影响体内吸收的重要因素。在理化性质方面,SRL在电解质溶液中可发生开环水解,特别是在强酸和碱性条件下,降解速率显著增加[14]。在生理因素方面,SRL是肠道内CYP3A4酶和P糖蛋白的底物,对肠道吸收有较大影响[15]。
其次,制剂本身的特点对体内吸收有重要影响。SMEDDS和NLC均可形成纳米级的脂质微粒,在胃肠道消化后可形成乳糜胶束[16-17]均减轻了胃肠液的pH对SRL的降解作用,因此SMEDDS和NLC对脂质微粒中的SRL有一定的保护作用。相比之下,SD中的SRL快速释放后,载体材料失去了对药物的隔离保护作用,导致SRL在极短的时间内发生降解。另外,环糊精的空腔可以容纳药物分子[18],不仅提高了SRL的溶解度,而且降低了H+和OH-对SRL的作用概率,减缓了SRL的降解。本研究的体外溶出试验也证实了不同增溶制剂中SRL稳定性的差异。
同时,SMEDDS的辅料Labrafil M1944 CS和Cremophor EL[9, 19-21]和NLC中的脂质及其代谢产物能够抑制CYP3A4酶的代谢和P糖蛋白外排,消化后形成的乳糜胶束还可通过淋巴途径吸收[22],从而提高了生物利用度[10-11]。
另外,由于SRL分子量较大,分子结构可能仅有部分插入环糊精的空腔中。因此,尽管环糊精提高了SRL的溶出度,但包合物的稳定性较差,进入胃肠道后,药物可被胃肠液中的成分替换[23],导致SRL加速降解或发生重结晶,进而生物利用度下降。
-
表 1 补骨脂成分及相关信息
化合物 相对分子
质量AlogP 氢键供
体数氢键受
体数Pub
ChemID双羟异补骨脂定 368.30 2.0 3 7 5316096 补骨脂酚 338.40 2.8 2 5 5320772 补骨脂定 336.30 4.7 2 5 5281806 异新补骨脂查尔酮 298.29 3.0 2 5 5318608 异补骨脂二氢黄酮 324.40 4.1 2 4 193679 补骨脂异黄酮醛 282.25 2.5 2 5 44257227 槐属香豆雌烷 A 334.30 4.0 1 5 14630492 补骨脂呋喃查尔酮 340.40 3.5 3 5 6476086 新补骨脂查尔酮 298.29 3.0 2 5 5320052 补骨脂二氢黄酮甲醚 338.40 4.4 1 4 10337211 补骨脂香豆雌烷B 352.30 3.1 2 6 5321820 补骨脂乙素 324.40 5.1 3 4 5281255 新补骨脂异黄酮 322.40 4.4 2 4 5320053 补骨脂查尔酮 324.40 5.1 3 4 6450879 补骨脂色烯素 322.40 4.5 2 4 5321800 异补骨脂定 336.30 4.1 1 5 12304285 甲氧补骨脂素 216.19 1.9 0 4 4114 补骨脂呋喃香豆精 186.16 2.3 0 3 3083848 异补骨脂素 186.16 2.0 0 3 10658 补骨脂素 186.16 2.3 0 3 6199 补骨脂香豆雌烷A 353.30 3.1 2 6 5321811 补骨脂定-2',3'-环氧化物 352.30 3.3 2 6 44257529 表 2 补骨脂成分潜在肝损伤作用靶点
序号 Uniprot ID 基因靶点 蛋白靶点 1 P28161 GSTM2 glutathione S-transferase Mu 2 2 O75469 NR1I2 nuclear receptor subfamily 1
group I member 23 P02768 ALB serum albumin 4 P11712 CYP2C9 cytochrome P450 2C9 5 P09211 GSTP1 glutathione S-transferase P 6 P04179 SOD2 superoxide dismutase [Mn], mitochondrial 7 Q96RI1 NR1H4 bile acid receptor 8 P05089 ARG1 arginase-1 9 P00374 DHFR dihydrofolate reductase 10 P02774 GC vitamin D-binding protein 11 P00390 GSR glutathione reductase, mitochondrial 12 P09601 HMOX1 heme oxygenase 1 13 P05019 IGF1 insulin-like growth factor I 14 P80188 LCN2 neutrophil gelatinase-associated lipocalin 15 P17931 LGALS3 galectin-3 16 P08253 MMP2 72 000 type IV collagenase 17 P00491 PNP purine nucleoside phosphorylase 18 Q08257 CRYZ quinone oxidoreductase 19 Q07869 PPARA peroxisome proliferator-activated receptor alpha 20 Q00796 SORD sorbitol dehydrogenase 21 P49888 SULT1E1 sulfotransferase 1E1 22 O00204 SULT2B1 sulfotransferase 2B1 23 P36897 TGFBR1 TGF-beta receptor type-1 24 P02766 TTR transthyretin 25 Q14994 NR1I3 nuclear receptor subfamily 1
group I member 326 Q13133 NR1H3 oxysterols receptor LXR-alpha 27 P37231 PPARG peroxisome proliferator-activated receptor gamma 28 O60760 HPGDS hematopoietic prostaglandin D synthase 29 P04035 HMGCR 3-hydroxy-3-methylglutaryl-coenzyme A reductase 30 P06702 S100A9 protein S100-A9 31 P09488 GSTM1 glutathione S-transferase Mu 1 -
[1] 朱星宇, 赵根华, 高倩倩, 等. 对照提取物法测定补骨脂饮片中7种成分含量[J]. 中国实验方剂学杂志, 2017, 23(15):85-91. [2] 颜冬梅, 高秀梅. 补骨脂化学成分研究进展[J]. 辽宁中医药大学学报, 2012, 14(9):96-99. [3] 樊玲, 秋新松, 高阳, 等. HPLC法同时测定中药补骨脂中10种成分的含量[J]. 齐齐哈尔医学院学报, 2018, 39(16):1928-1931. doi: 10.3969/j.issn.1002-1256.2018.16.031 [4] WANG Y F, WU B, YANG J, et al. A rapid method for the analysis of ten compounds in Psoralea corylifolia L. by UPLC[J]. Chromatographia,2009,70(1-2):199-204. doi: 10.1365/s10337-009-1118-8 [5] 邱蓉丽, 李璘, 乐巍. 补骨脂的化学成分与药理作用研究进展[J]. 中药材, 2010, 33(10):1656-1659. [6] 吴疆, 魏巍, 袁永兵. 补骨脂的化学成分和药理作用研究进展[J]. 药物评价研究, 2011, 34(3):217-219. [7] 王安红, 周昆, 柴丽娟. 补骨脂素对HepG2细胞BSEP、NTCP的影响[J]. 时珍国医国药, 2015, 26(7):1563-1565. [8] PAULI-MAGNUS C, MEIER P J. Hepatobiliary transporters and drug-induced cholestasis[J]. Hepatology,2006,44(4):778-787. doi: 10.1002/hep.21359 [9] 张新颖, 毛景东, 杨晓燕, 等. AMPK/mTOR信号通路的研究进展[J]. 微生物学杂志, 2019, 39(3):109-116. doi: 10.3969/j.issn.1005-7021.2019.03.015 [10] 张玥, 毕亚男, 袁晓美, 等. 基于靶器官的补骨脂肝毒性成分探讨[J]. 时珍国医国药, 2017, 28(8):1844-1847. [11] 周昆, 毕亚男, 史红. 异补骨脂素抑制MRP2、MRP3所致的HepG2细胞内胆汁酸蓄积和毒性[J]. 中国药理学通报, 2015, 31(8):1112-1116. doi: 10.3969/j.issn.1001-1978.2015.08.017 [12] 李艾芳, 沈国林, 焦士勇, 等. 细胞色素P450介导的补骨脂酚代谢减毒[J]. 北京大学学报(医学版), 2012, 44(3):431-436. [13] YANG Y, YING G X, WU F T, et al. sTim-3 alleviates liver injury via regulation of the immunity microenvironment and autophagy[J]. Cell Death Discov,2020,6:62. [14] YEW W W, CHANG K C, CHAN D P. Oxidative stress and first-line antituberculosis drug-induced hepatotoxicity[J]. Antimicrob Agents Chemother,2018,62(8):e02637-17. [15] WILDE B, KATSOUNAS A. Immune dysfunction and albumin-related immunity in liver cirrhosis[J]. Mediators Inflamm,2019,2019:7537649. [16] ARAKAWA K, IKEYAMA Y, SATO T, et al. Functional modulation of liver mitochondria in lipopolysaccharide/drug co-treated rat liver injury model[J]. J Toxicol Sci,2019,44(12):833-843. doi: 10.2131/jts.44.833 [17] ZHU H Y, CHAI Y C, DONG D H, et al. AICAR-induced AMPK activation inhibits the noncanonical NF-κB pathway to attenuate liver injury and fibrosis in BDL rats[J]. Can J Gastroenterol Hepatol,2018,2018:6181432. [18] XING W, YANG L, PENG Y, et al. Ginsenoside Rg3 attenuates Sepsis-induced injury and mitochondrial dysfunction in liver via AMPK-mediated autophagy flux[J]. Biosci Rep,2017,37(4):BSR20170934. doi: 10.1042/BSR20170934 [19] DONG S, CHEN Q L, SONG Y N, et al. Mechanisms of CCl4-induced liver fibrosis with combined transcriptomic and proteomic analysis[J]. J Toxicol Sci,2016,41(4):561-572. doi: 10.2131/jts.41.561 [20] XU M J, CAI Y, WANG H, et al. Fat-specific protein 27/CIDEC promotes development of alcoholic steatohepatitis in mice and humans[J]. Gastroenterology,2015,149(4):1030-1041.e6. doi: 10.1053/j.gastro.2015.06.009 [21] LAITAKARI A, OLLONEN T, KIETZMANN T, et al. Systemic inactivation of hypoxia-inducible factor prolyl 4-hydroxylase 2 in mice protects from alcohol-induced fatty liver disease[J]. Redox Biol,2019,22:101145. doi: 10.1016/j.redox.2019.101145 [22] WANG Y X, DU Y, LIU X F, et al. A hepatoprotection study of Radix Bupleuri on acetaminophen-induced liver injury based on CYP450 inhibition[J]. Chin J Nat Med,2019,17(7):517-524. -





 下载:
下载:

 下载:
下载: