-
髋关节置换术及髋关节翻修术后患者有发生静脉血栓栓塞症(VTE)的可能[1]。这类患者中有一些既往行冠脉支架植入术需常规口服抗栓药的患者,持续抗血栓治疗可能会导致围术期出血风险增加,而停药又可能导致急性冠状动脉综合征(ACS)和/或动脉血栓栓塞(ATE)发生[2],因此,合适的抗栓方案成为治疗的关键。笔者分析1例冠状动脉支架植入术后髋关节翻修术患者的抗栓治疗策略,并进行文献复习,以期为临床提供参考。
-
患者,男,63岁,因“左全髋置换术后19年,疼痛伴无法行走7个多月”入住骨关节科。患者于18月前行冠状动脉支架植入术,高血压病史、糖尿病病史多年,入院前长期服用阿司匹林肠溶片及降压、降糖药。入院诊断:左全髋关节置换术后假体松动;有冠状动脉支架植入术史;高血压;糖尿病。
患者入院后予阿托伐他汀钙片20 mg qn;替米沙坦氢氯噻嗪胶囊40 mg qd;格列齐特缓释片30 mg qd;伏格列波糖片0.3 mg tid,3 d后在腰麻下行左侧人工髋关节翻修术。术后红细胞计数3.83×1012/L,血小板计数141×109/L,血红蛋白108 g/L,D-二聚体4.96μg/ml,凝血酶原时间15.8 s。术后17 h患者出现胸闷不适,诊断为急性非ST段抬高性心肌梗死(NSTEMI)。转入心内科给予阿司匹林肠溶片100 mg qd+硫酸氢氯吡格雷片75 mg qd 口服;依诺肝素钠注射液4000 U bid 皮下注射,治疗后患者心肌梗死缓解。术后6 d红细胞计数2.40×1012/L、血小板计数237×109/L、血红蛋白66 g/L,患者进行性红细胞下降,术后8、9、10 d分别输注红细胞悬液2 U。停用硫酸氢氯吡格雷片,改为单用阿司匹林肠溶片100 mg qd 口服;停用依诺肝素钠注射液,改为利伐沙班片15 mg qd 口服。术后10 d红细胞计数4.90×1012/L,血小板计数276×109/L,血红蛋白139 g/L。患者病情平稳,予以出院口服药物治疗。
-
冠状动脉支架植入术后患者需口服抗血小板药用于ATE的二级预防[3],研究表明阿司匹林会增加围术期出血的风险,但并不会导致发病率和病死率增加[4-5],而围术期停用阿司匹林可使ATE风险增高[6],对于服用阿司匹林进行ATE二级预防的高危患者建议围术期继续应用[7]。另一方面,对于已服用阿司匹林的患者应根据需要调整剂量或给予额外的低分子肝素(LMWH)[7],指南建议对于长期服用阿司匹林或氯吡格雷的患者应于骨科大手术术前5 d停用阿司匹林,术前7 d停用氯吡格雷,停药期间桥接应用LMWH[8]。该患者冠状动脉支架植入术后一直服用阿司匹林,临床药师结合以上指南及文献认为其髋关节翻修术围术期继续应用阿司匹林,或术前5 d停用阿司匹林,停药期间桥接应用LMWH,术后24 h若无活动性出血恢复阿司匹林。而该患者入院后即停用阿司匹林,3 d后行髋关节翻修术,期间亦未用LMWH进行桥接抗凝,导致抗栓治疗不足,患者术后出现了NSTEMI。
-
髋关节翻修术后患者易发生ATE风险,ACS是主要风险之一。该患者髋关节翻修术后出现NSTEMI,为ACS常见类型,应口服抗血小板药,合用抗凝药可产生更强大的抗栓效应[9-10]。该患者抗栓治疗方案为阿司匹林肠溶片100 mg qd和硫酸氢氯吡格雷片75 mg qd双联抗血小板,联合依诺肝素钠注射液4000 U bid抗凝治疗。经治疗患者心肌梗死缓解,术后6 d患者出现进行性红细胞计数下降,考虑抗栓过度。根据指南[9],对NSTEMI急性期后有低出血风险的患者可停用肠外抗凝药,口服阿司匹林、氯吡格雷或利伐沙班治疗。临床药师协助医师停用依诺肝素钠注射液,改为利伐沙班片抗凝治疗;停双联抗血小板治疗,改为单用阿司匹林肠溶片;同时输注红细胞悬液。患者应用抗血小板药物及抗凝药物,出血风险较大,应谨慎观察是否有鼻衄、牙龈出血、胃肠道出血等出血体征;并关注血红蛋白等实验室检查结果以发现隐匿性出血。临床药师密切监测患者血栓及出血风险,至出院时患者病情平稳。嘱患者出院后如出现胸闷、气急、胸痛、消化道出血等不适及时就诊。
-
VTE是髋关节翻修术后有较高发生率的并发症之一,重点在预防深静脉血栓(DVT)的形成,预防药物主要有LMWH、利伐沙班、阿哌沙班和磺达肝癸钠[7]。对于已服用阿司匹林或氯吡格雷的患者骨科大手术后应加用LMWH预防VTE[8],预防时间至少为10~14 d,髋关节置换术后患者药物预防时间建议延长至35 d[7]。该患者术后皮下注射常规剂量LMWH依诺肝素,后改为口服利伐沙班片,在院期间未发生VTE;出院带药利伐沙班片继续口服预防VTE,建议用至髋关节翻修术后35 d。嘱患者出院后注意是否有肢体肿胀、疼痛,呼吸困难等可能发生VTE的症状出现;同时留意是否有血便、黑便,血尿等药物所致出血不良反应,如有相应情况及时就医。
-
冠状动脉支架植入术后患者行髋关节翻修术的围术期管理具有特殊性和复杂性,抗栓治疗应平衡血栓形成与出血的风险,合理选择抗栓治疗方案,以降低髋关节翻修术围术期ACS、VTE发生率及出血风险。
Perioperative antithrombotic therapy in the patient undergoing revision total hip arthroplasty after coronary stent implantation: a case report and literature review
-
摘要:
目的 探讨冠状动脉支架植入术后患者行髋关节翻修术围术期抗栓治疗策略。 方法 对1例冠状动脉支架植入术后患者行髋关节翻修术的抗栓治疗进行分析,并进行相关文献复习。 结果 患者术后出现急性非ST段抬高性心肌梗死,系因术前3 d即停用阿司匹林,期间亦未用低分子肝素桥接抗凝所致,并对术后急性冠状动脉综合征抗栓及静脉血栓栓塞症预防方案进行分析。 结论 冠状动脉支架植入术后行髋关节翻修术患者围术期应平衡血栓形成与出血风险,合理选择抗栓治疗方案。 Abstract:Objective To explore the strategies of perioperative antithrombotic therapy in the patient undergoing revision total hip arthroplasty after coronary stent implantation. Methods The antithrombotic therapy in one patient undergoing revision total hip arthroplasty after coronary stent implantation was analyzed with the review of related literatures. Results The patient developed non-ST segment elevated myocardial infarction due to the stop of aspirin three days before operation and no low molecular weight heparin was used. The antithrombotic treatment and prevention of venous thromboembolism were analyzed. Conclusion Antithrombotic therapy should be selected reasonably in patients undergoing revision total hip arthroplasty after coronary stent implantation. -
子宫内膜异位症(endometriosis,EM)是临床上最为常见的慢性妇科疾病之一,以慢性盆腔疼痛、月经紊乱和不孕为主要的临床表现。EM本质是血瘀证,临床治疗时以活血化瘀为主,常用的药物有桃仁、红花、泽兰、丹参、益母草、川牛膝、王不留行等,能够有效缓解患者痛经、非经期盆腔痛等症状[1]。
目前活血化瘀类中药对EM治疗的具体机制不是很清晰,其针对的靶点也不是很明了。网络药理学将生物网络作为研究对象,探究药物、靶点、疾病之间的联系,系统完整地研究药物的机制,可展现出药物对于多个靶点、多个通路不同影响。因为和中医整体观念天然契合,网络药理学现已广泛应用于中药研究中[2-3] 。在本研究中,笔者采用网络药理学的方法探究活血化瘀类中药治疗EM的作用机制,构建“化合物-靶标-通路-疾病”网络,并初步探析何种活血化瘀药在EM治疗中更具优势,为临床用药以及进一步实验研究提供理论依据。
1. 材料与方法
1.1 活血化瘀类中药确认
根据卫生部“十一五”规划教材《中药学》分类,确认桃仁、红花、泽兰、丹参、益母草、川牛膝、王不留行七味活血化瘀药为本次主要研究对象。
1.2 中药有效成分以及相关靶点的获取
利用中药化学成分数据库TCMSP平台(http:// lsp.nwu.edu.cn/tcmsp.php),检索七味中药所含活性成分。依据数据库指南要求,将口服生物利用度(oral bioavailability,OB)≥30%以及类药性(drug-like,DL)≥0.18作为筛选条件,对活性成分进行筛选[4]。OB值是评价药物能否发挥药效的重要药动学参数,DL值是指化合物与所有已知药物之间的相似程度。上述2个参数是评价中药化学成分吸收、分布、代谢、排泄的关键参数。获得符合OB、DL参数有效活性成分后,利用TCMSP数据库查询各有效活性成分对应相关靶点。利用Venn图工具(https://bioinfogp.cnb.csic.es/tools/venny/)对药物化学成分以及相关靶点进行共同点分析,寻找活血化瘀中药共有成分和作用靶点。
1.3 EM相关靶点基因确认
利用美国国立生物技术信息中心Gene数据库(https://www.ncbi.nlm.nih.gov/gene/)将所获靶点信息转换成基因名称。查询GeneCards(https://www.genecards.org/)数据库,获得与EM相关基因靶点。最后将每种中药的作用靶点对应的Gene Symbol与EM基因进行比对,获得每种中药可能影响EM的相关基因,利用Cytoscape 3.6.0软件构建化合物-靶点网络[5]。
1.4 构建蛋白互作网络
为进一步研究靶点之间的相互关系,将活血化瘀药共同靶点上传至线上软件 STRING(http://string db.org),构建蛋白互作网络。物种选择为Homosapiens,minimum required interaction score调整为highest confidence,隐藏网络图中游离节点,获取PPI网络。
1.5 KGEE通路分析
利用KEGG数据库(https://www.keg g.jp/)查询每种中药针对EM的相关基因,获得相关KEGG通路信息。筛选各中药KEGG通路中相关基因富集情况,并利用Prism 8.0软件绘制通路靶点富集热图。
2. 结果
2.1 活血化瘀类中药有效成分及对应靶点的获取
按照要求从TCMSP数据库中筛选出各中药有效成分,删除重复项,共有94种有效成分(supplementary materials table S1)。其中丹参有效活性成分达到65个,而泽兰有效活性成分只有2个。未能发现七味活血化瘀药共同有效成分,但β-谷固醇为川牛膝、红花、桃仁、泽兰所共有,槲皮素为川牛膝、红花、王不留行、益母草所共有,是涉及活血化瘀类中药最多的2种有效成分(supplementary materials table S2)。与此同时,我们找到了七味中药所共有的19个作用靶点(表1),包括孕酮受体(progesterone receptor)、前列腺素G/H合成酶1(prostaglandin G/H synthase 1)、前列腺素G/H合成酶2(prostaglandin G/H synthase 2)、凋亡调节剂Bcl-2(apoptosis regulator Bcl-2)、核受体共激活剂(nuclear receptor coactivator 2)等。
表 1 七种活血化瘀中药共有的19个靶点序号 蛋白名称 基因名称 靶点标识码 1 钠通道蛋白5型亚基 SCN5A TAR00070 2 前列腺素G/H合成酶1 PTGS1 TAR00006 3 Beta-2型肾上腺素受体 ADRB2 TAR00261 4 毒蕈碱型乙酰胆碱受体M3 CHRM3 TAR00016 5 孕酮受体 PGR TAR00209 6 半胱天冬酶3 CASP3 TAR04087 7 热休克蛋白HSP 90 HSP90 TAR00444 8 钾电压门控通道亚家族H成员2 KCNH2 TAR00037 9 凋亡调节剂Bcl-2 BCL2 TAR00086 10 PKA催化亚基C-alpha PRKACA TAR00699 11 半胱天冬酶9 CASP9 TAR04090 12 γ-氨基丁酸受体亚基α-1 GABRA1 TAR00309 13 毒蕈碱型乙酰胆碱受体M1 CHRM1 TAR00038 14 前列腺素G/H合酶2 PTGS2 TAR00094 15 转录因子AP-1 JUN,FOS TAR00414 16 磷脂酰肌醇-4,5-双磷酸3-激酶催化亚基,γ亚型 PIK3CG TAR00491 17 毒蕈碱型乙酰胆碱受体M2 CHRM2 TAR00210 18 核受体共激活剂2 NCOA2 TAR03276 19 维甲酸受体RXR-alpha RARA TAR00158 2.2 EM相关靶点确认
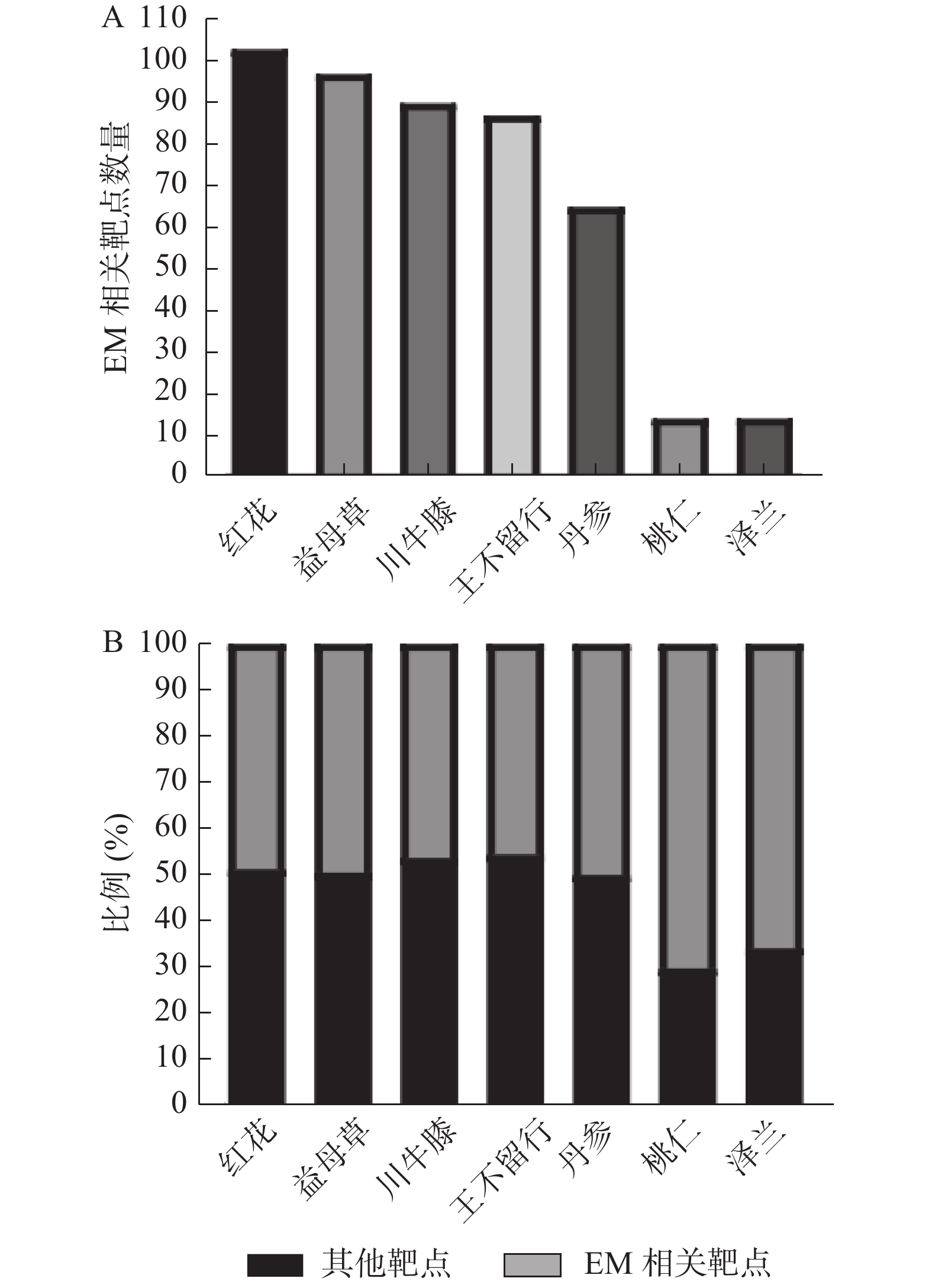
利用人类基因数据库查找EM作用靶点,与七味中药有效成分对应靶点进行比对,发现红花所含相关靶点数量最多,达到103个;而桃仁、泽兰所含相关靶点数量最少,为14个(图1A);王不留行所含相关靶点占有效成分作用靶点比例最高,为54.7%;而桃仁最低,为29.8%(图1B)。经过去重处理后,七味中药所含EM相关靶点共119个(supplementary materials table S3)。利用Cytoscape3.6.0软件进行成分-靶点网络分析,获得图2,其中共计216个节点,其中黄色节点为活血化瘀药有效活性成分,而蓝色节点代表EM相关靶点。利用软件自带分析功能,对于网络各节点度值进行分析,网络中某些节点度值较高,提示该节点为网络中的关键节点(supplementary materials table S4)。在各中药所含有效成分中,槲皮素展现出极高的连接度(度值=87),远超其他有效成分,而其余较高连接度值依次是木犀草素(度值=43)、山柰酚(度值=33)、黄芩素(度值=23)、丹参酮A(度值=20)、花生四烯酸(度值=20)、β-谷固醇(度值=18)。中药是一个多有效成分的复杂系统,一个有效成分可作用于多个靶点,协同作用于某种疾病的治疗。而在靶点的分析中,较高连接度的靶点可能在EM的治疗作用中起着重要的作用。前列腺素G/H合酶2(PTGS2,度值=82)、前列腺素G/H合酶1(PTGS1,度值=39)两者拥有最高的度值,是临床上炎性疾病治疗的主要靶点;核受体辅活化子2(NCOA2,度值=35)、核受体辅活化子1(NCOA1,度值=34)紧跟其后,同样在各炎症通路中作用显著;凝血酶(度值=31)是临床上治疗出血的重要靶点,直接作用于血液凝固过程的最后一环;Mu-type阿片受体(OPRM1,度值=30)则涉及到中枢镇痛功能。上述靶点均和EM症状及病机之间有着密切的关系。
2.3 PPI网络的构建与分析
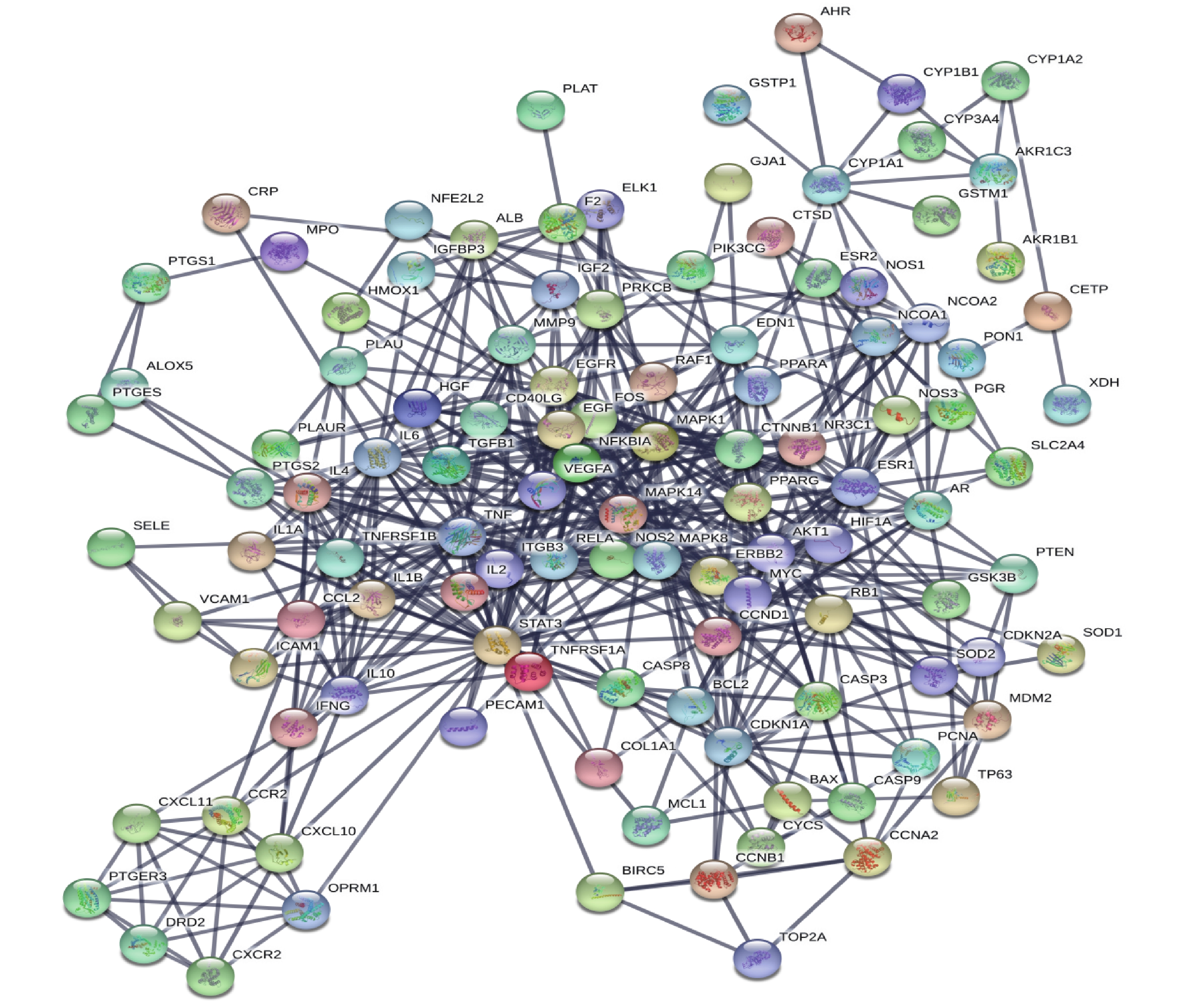
利用STRING软件构建靶点PPI网络,图中包含119个节点,505条边,所有节点平均度值为8.49,具体见图3。根据“度值>均值”筛选出PPI网络中关键节点56个(supplementary materials table S6),前9位关键节点,平均度值为88,见表2,与PPI网络74%节点存在相互作用关系,提示它们在网络调控中起着关键作用,可能是活血化瘀药物治疗EM的关键所在。
表 2 PPI网络中关键节点节点名称 度值 节点名称 度值 节点名称 度值 ALB 97 IL6 92 PTGS2 83 AKT1 95 TNF 86 CASP3 80 VEGFA 94 MAPK8 83 MAPK1 80 2.4 KEGG通路分析
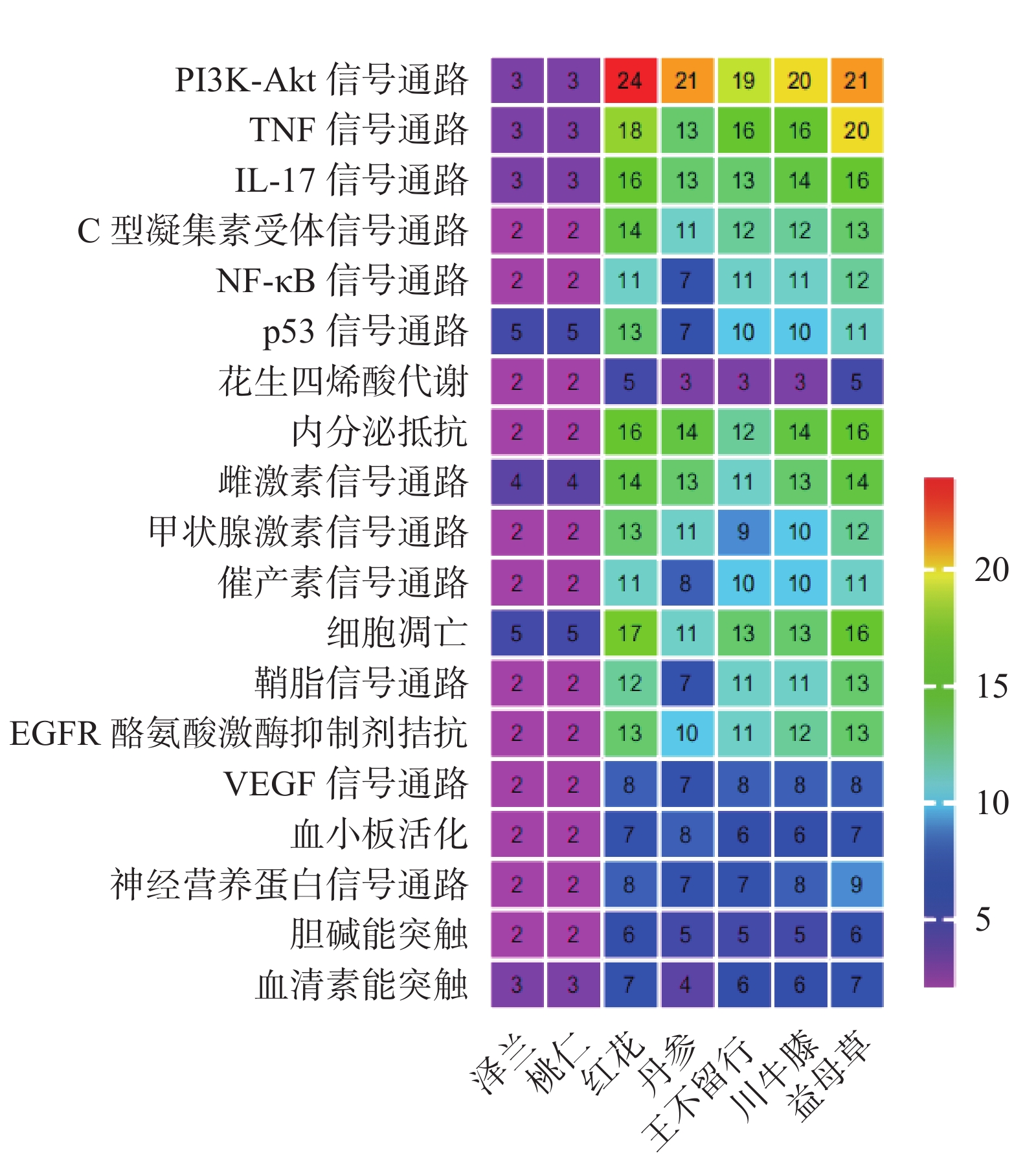
利用KEGG数据库查询每种中药针对EM的相关基因,获得相关KEGG通路信息。整理各中药KEGG通路相关基因富集情况,发现七味中药共有信号通路44条(supplementary materials table S5),筛选出与EM密切相关的19条通路(表3)。从表3中,不难发现,19条通路涉及性激素、炎症、细胞调亡以及血管生成等各个方面,其中炎症相关通路达到7条,为所有通路中最多。利用Prism 8.0软件绘制通路靶点富集热图,根据图4可知,在系列通路中,泽兰与桃仁作用均弱于其他五味中药。而在PI3K-Akt、IL-17、TNF三条信号通路中,多味中药靶点存在高度富集,红花在PI3K-Akt信号通路中显著富集,远超该药其他通路,值得注意。
表 3 七味活血化瘀中药的19条KEGG通路序号 标识码 信号通路名称 类别 1 hsa04151 PI3K-Akt信号通路 炎症相关 2 hsa04668 TNF信号通路 炎症相关 3 hsa04657 IL-17信号通路 炎症相关 4 hsa04625 C型凝集素受体信号通路 炎症相关 5 hsa04064 NF-κB信号通路 炎症相关 6 hsa04115 p53信号通路 炎症相关 7 hsa00590 花生四烯酸代谢 炎症相关 8 hsa01522 内分泌抵抗 激素相关 9 hsa04915 雌激素信号通路 激素相关 10 hsa04919 甲状腺激素信号通路 激素相关 11 hsa04921 催产素信号通路 激素相关 12 hsa04210 细胞凋亡 细胞凋亡 13 hsa04071 鞘脂信号通路 细胞凋亡 14 hsa01521 EGFR酪氨酸激酶抑制剂拮抗 血管相关 15 hsa04370 VEGF信号通路 血管相关 16 hsa01521 血小板活化 血管相关 17 hsa04722 神经营养蛋白信号通路 疼痛相关 18 hsa04725 胆碱能突触 疼痛相关 19 hsa04726 血清素能突触 疼痛相关 3. 讨论
本研究采用网络药理学的研究方法,从TCMSP数据库中提取出了94个符合标准的成分,通过VENE图去重以及分析网络图的拓扑特性后,发现槲皮素为四味活血化瘀药所共有,与83种EM相关靶点存在关联。现代研究表明,槲皮素具有抑制炎症、血小板聚集和血管平滑肌细胞增殖的作用,通过抗氧化作用诱导细胞凋亡,还可通过雌激素受体,调控受体下游多种底物及信号通路而调节雌激素[6-7]。木犀草素与41种EM靶点相关联,具有抗炎、抗纤维化、抑制血管生成等作用[8]。EM发生发展过程中慢性炎症反应一直贯穿始终,且存在纤维化病变,木犀草素或在EM治疗中有一定作用[9-10]。
通过VENE图,发现七味中药共有作用靶点19个,部分共有靶点与Cytoscape网络图以及PPI网络中关键节点高度对应,进一步强调了该部分共有靶点在EM中的作用。如PTGS2,该靶点所调控环氧合酶(COX-2)的高表达会导致细胞的高增殖性、高侵袭性,诱导血管生成从而加重EM的疼痛和不孕症状[11]。NCOA2、NCOA1的水平异常与EM的进展关联密切。趋化因子参与子宫内膜异位种植过程中趋化、黏附、侵袭、血管形成及细胞生长分化等多个重要环节[12]。Xiu等发现,在分泌期,NCOA1和趋化因子CXCL12在异位子宫内膜中的表达明显高于正常子宫内膜;活化血小板对异位内膜具有促炎、促血管生成的作用,促使异位内膜细胞的侵袭和增殖[13-14],子宫内膜基质细胞可分泌F2,以密集依赖的方式诱导血小板活化和聚集,从而影响EM的进展[15-16] 。VEGFA可促进新生血管形成并使血管通透性增加,陈晓莉等[17]研究表明,内异症组血清和腹腔液VEGF水平明显高于对照组,且重度患者腹腔液中VEGF水平高于轻度患者,VEGF在EMT患者血管生成中起促进性作用,在血清与腹腔液中的高表达与疾病发生发展相关。尉伟东等[18]发现CASP3蛋白在异位内膜和在位内膜中的评分明显低于正常对照组,caspase-3的水平下降提示内膜细胞活性下降,促使子宫内膜细胞自发性凋亡增加以及凋亡信号敏感性增强,诱导或加重EM。
利用KEGG数据库,找到了七味活血化瘀药共有EM相关通路19条,涉及性激素、炎症、细胞凋亡以及血管生成等方面。所有通路中,炎症通路达到36%。其中PI3K-Akt、IL-17、TNF三条信号通路是靶点富集最多的通路,提示活血化瘀药主要通过抗炎作用来对EM起治疗作用。与正常女性相比,EM患者的子宫内膜在位和异位内膜细胞的PI3K表达增加,AKT磷酸化水平升高,证实PI3K/AKT信号通路可影响EM进展[19]。EM是一种雌激素依赖性疾病,呈现出慢性炎症反应,多种炎性因子参与其病理过程,包括NF-κB、TNF-α、IL-1、IL-17等[20]。许丽华等[21]通过实验发现,EM患者血清及腹腔液中TNF-α水平显著高于对照组。EM患者Ⅲ和Ⅳ期血清和腹腔液中TNF-α水平均高于Ⅰ和Ⅱ期,证实了TNF-α与子宫内膜异位症的发生发展密切相关,有助于子宫内膜异位症的诊断。IL-1家族在EM发生发展中作用显著,与正常女性相比,EM患者静脉血中IL-1β浓度显著增高。不仅仅是IL-1β,研究显示,IL-1β前体蛋白(proIL-1β)也可以加重炎症反应,EM患者腹腔液中IL-1β、proIL-1β水平均高于健康女性。IL-1家族细胞因子的损伤,导致EM患者腹腔免疫机制的紊乱,局部以及全身IL-1β、IL-18调控机制的缺陷,使得内膜组织的侵袭性以及生长性大幅增加,从而导致EM[22-24]。炎症相关通路的高富集也与之前网络图中TNF、IL-6等炎性相关靶点的高度值相对应,进一步强调了活血化瘀药物通过抗炎作用治疗EM的作用机制。细胞凋亡是一种独特的程序性细胞死亡,细胞的有效清除而不会引起炎症反应,EM特征为异位内膜细胞凋亡率下降。与健康女性子宫内膜相比,EM异位内膜抗凋亡因子表达增加,促凋亡因子表达减少,证实了细胞凋亡在EM的发病中确有作用,并和炎症反应存在一定关联[25]。EM发生发展过程中亦伴随着血管生成增多以及局部病灶周期性出血,EM患者异位内膜血管内皮生长因子(VEGF)表达量增高,抗血管生成因子(sFlt-1)表达量下降,证实VEGF信号通路、血小板激活通路均参与此过程,与前面靶点分析也形成呼应[26-27] 。脑源性神经营养因子是各种慢性疾病中慢性疼痛形成和维持的调节因子,EM伴有疼痛的患者血清和腹膜液中神经营养因子浓度明显高于无疼痛EM患者[28]。利用KEGG通路分析,可以发现活血化瘀药对于炎症、凋亡、疼痛、血管生成等相关通路均具备调控作用,进一步强调了临床上活血化瘀药对于EM的治疗价值。
综上所述,活血化瘀中药可通过多靶点、多通路协同作用方式对EM进行治疗,体现了中医药治疗疾病特色。上述七味中药中,桃仁、泽兰对于EM的作用低于其余活血化瘀药,而红花、益母草在EM治疗体系中,EM相关靶点高于其余中药,可能会起到更好的疗效,在临床上可尝试推广使用。本研究从网络药理学角度出发,根据活血化瘀中药有效成分和作用靶点,在一定程度上对活血化瘀中药治疗EM进行了机制的解析,为指导临床用药提供了一定的依据。但本研究仅仅基于TCMSP数据库,利用计算机软件从理论上对活血化瘀中药治疗EM作用机制做了探析,还需要通过实验和临床实践来进一步证实,而且还需要扩大活血化瘀药物探究范围,结合临床实际,深入剖析活血化瘀药共同点与差异之处。
-
[1] 周宗科, 翁习生, 曲铁兵, 等. 中国髋、膝关节置换术加速康复: 围术期管理策略专家共识[J]. 中华骨与关节外科杂志, 2016, 9(1):1-9. doi: 10.3969/j.issn.2095-9985.2016.01.001 [2] KUMAR A, TSAI W C, TAN T S, et al. Risk of post-TKA acute myocardial infarction in patients with a history of myocardial infarction or coronary stent[J]. Clin Orthop Relat Res,2016,474(2):479-486. doi: 10.1007/s11999-015-4616-z [3] 中华医学会心血管病学分会介入心脏病学组, 中国医师协会心血管内科医师分会血栓防治专业委员会, 中华心血管病杂志编辑委员会. 中国经皮冠状动脉介入治疗指南(2016)[J]. 中华心血管病杂志, 2016, 44(5):382-400. doi: 10.3760/cma.j.issn.0253-3758.2016.05.006 [4] YANG Z, NI J, LONG Z, et al. Is hip fracture surgery safe for patients on antiplatelet drugs and is it necessary to delay surgery? A systematic review and meta-analysis[J]. J Orthop Surg Res,2020,15(1):105. doi: 10.1186/s13018-020-01624-7 [5] LIPPI G, CERVELLIN G. Aspirin for thromboprophylaxis in major orthopedic surgery: old drug, new tricks? Acta Biomed,2018,89(1):31-33. [6] WANG X, CHEN X, SUN W, et al. Very late stent thrombosis in drug-eluting stents new observations and clinical implications[J]. Cardiol Rev,2019,27(6):279-285. doi: 10.1097/CRD.0000000000000283 [7] LEE H L, CHIU K Y, YIU K H, et al. Perioperative antithrombotic management in joint replacement surgeries[J]. Hong Kong Med J,2013,19(6):531-538. [8] 中华医学会骨科学分会. 中国骨科大手术静脉血栓栓塞症预防指南[J]. 中华骨科杂志, 2016, 36(2):65-71. doi: 10.3760/cma.j.issn.0253-2352.2016.02.001 [9] 中华医学会心血管病学分会, 中华心血管病杂志编辑委员会. 非ST段抬高型急性冠状动脉综合征诊断和治疗指南(2016)[J]. 中华心血管病杂志, 2017, 45(5):359-376. doi: 10.3760/cma.j.issn.0253-3758.2017.05.003 [10] 国家卫生计生委合理用药专家委员会, 中国药师协会. 冠心病合理用药指南(第2版)[J]. 中国医学前沿杂志(电子版), 2018, 10(6):1-130. -

 点击查看大图
点击查看大图
计量
- 文章访问数: 3300
- HTML全文浏览量: 1174
- PDF下载量: 22
- 被引次数: 0




 下载:
下载:


 下载:
下载:
