-
脑卒中是危害人类健康的主要疾病之一。根据国家卫健委最新颁布的《中国脑卒中防治指导规范(2021年版)》显示:脑卒中已成为我国居民第一大死因。缺血性脑卒中是最常见的脑卒中类型,占我国脑卒中的69.6%~70.8%。我国住院急性缺血性脑卒中患者发病后1个月内病死率为2.3%~3.2%,发病后1年内病死率为14.4%~15.4%,死亡/残疾率为33.4%~33.8%[1],缺血性脑卒中的致死率和致残率相当高。对于缺血性脑卒中的治疗,我们熟知的静脉溶栓、抗血小板、抗凝、降纤、扩容等方法,都是旨在改善脑血液循环,并非针对脑神经细胞的保护[2]。目前针对神经保护的药物较少,且疗效与安全性尚未被临床广泛接受。美国心脏病协会/美国卒中协会发布的《2019年急性缺血性卒中患者早期管理指南》中表示:目前没有任何假定具有神经保护作用的药物或非药物治疗能够证明改善缺血性脑卒中的预后[3]。国内最新脑卒中诊治指南也认为神经保护剂的疗效与安全性尚需要更多高质量临床试验来进一步证实[1]。目前的神经保护药物尚不能解决脑卒中患者遗留神经功能障碍的问题。
菸花苷是课题组从传统活血化瘀中药红花中研发的治疗急性脑缺血性脑卒中的中药1类新药,化学结构式如图1。课题组前期的研究表明,菸花苷对于动物缺血性脑卒中急性期具有预防和治疗作用[4],但是,菸花苷对脑缺血的长期治疗效果尚未见报道,其抗脑缺血作用机制的研究也有待进一步深入。本实验通过观察菸花苷对于大鼠长期生存率、神经系统功能、体重及脑神经元的影响,进一步探讨菸花苷对缺血性脑卒中的长期治疗效果及可能的作用机制。
-
SPF级健康雄性Wistar大鼠,购自上海斯莱克实验动物有限公司,体重(250±20)g,手术开始前于清洁级动物房适应性饲养1周,自由进食、饮水,温度(25±2) ℃,相对湿度40%~60%,人工照明模拟昼夜变化。实验过程中,严格遵循动物伦理原则,遵守动物福利、动物保护的相关规定。
-
菸花苷注射液(菸花苷含量为10 mg/ml)及菸花苷注射液空白制剂,均由苏中药业集团股份有限公司提供。
-
通用型组织固定液(上海博光生物科技有限公司);氯化钠注射液(辰欣药液股份有限公司);尼氏染色液、苏木素伊红(HE)染色试剂盒(上海博谷生物科技有限公司);水合氯醛、氯化钠、无水乙醇、二甲苯(AR级)(国药集团化学试剂有限公司)。
-
手术器械(上海医疗器械有限公司);线栓(平顶山豫顺生物科技有限公司);蠕动泵(上海之信仪器有限公司);Direct-Pure RO(上海迪发仪器仪表有限公司);荧光显微镜(日本Olympus公司);EG1160一体式石蜡包埋机、ASP200S全自动脱水机、RM2235切片机、HI1210水浴摊片机、HI1220烘片机(德国Leica公司)。
-
取健康雄性Wistar大鼠,体重(250±20)g,分为假手术组、模型组、菸花苷组。其中假手术组大鼠10只,模型组和菸花苷组各20只。菸花苷组在手术当天缺血后1 h,以10 mg/kg的剂量尾静脉注射给药,手术后第2~7天,每天给药1次,此后每隔日给药1次。模型组以相同的给药方法给予相同体积的菸花苷注射液空白制剂。
-
选用MCAO法进行缺血性脑卒中模型的造模,参考相关文献中的MCAO的方法[5-7],并结合本实验室改进措施,最终选用如下方式进行操作:术前将大鼠禁食8 h,按大鼠体重以350 mg/kg的剂量,用10%的戊巴比妥钠腹腔注射麻醉,仰卧位固定于手术台上。沿颈部正中线切开皮肤,钝性分离腺体、筋膜及其他皮下组织,分离并暴露左侧颈总动脉(CCA),继而分离颈外动脉(ECA)和颈内动脉(ICA)。用细线结扎CCA近心端及ECA基部。动脉夹暂时夹闭ICA,用显微剪沿CCA近心端斜向上45°剪一小口,将直径约0.26 mm的线栓小心插入CCA血管腔中,用提前布于CCA下方的细线微微固定(结扎过紧会造成进线困难,太松则易造成出血),在血管放松的前提下,向前轻推最终沿着ICA插入颅内,插入深度距ECA与ICA分叉处大约18 mm。缺血2 h后将线栓轻轻拉出,造成再灌注损伤,此时注意拔栓速度不宜过快以免造成血管痉挛,随后扎紧CCA远心端,缝合伤口。术后置大鼠于俯卧位,且稍稍抬高大鼠颈部。整个手术过程中室温维持在25 ℃左右,并用保暖灯及电热毯保持大鼠体温恒定在37 ℃左右。假手术组大鼠分离暴露血管,并不插入线栓,也不结扎任何血管。术后待大鼠清醒后,放置单笼饲养观察。
-
从手术后第1天开始,由不参与整个实验的研究者观察手术后各组大鼠在第1、2、3、5、7、10、15、20、25、30天的行为学表现,评分并记录。每只大鼠的行为学检查在3~5 min内完成。行为学评分参照文献中的经典评分方法[8-10],具体如下:
(1)轻轻将大鼠的尾部提起,至地面的垂直距离约0.5 m高,观察前肢情况,是否有内收或者内旋现象。正常实验鼠的两前肢平衡对称,向下向前伸出。根据严重程度评分,最严重者为4分,正常为0分。
(2)将大鼠放于平稳的地板上,推左肩向对侧移动,再推右肩向对侧移动,观察大鼠抗推动的能力。正常大鼠左右两侧的抗推动能力相当,若大鼠左侧抗推动能力下降,最严重为3分,正常为0分。
(3)将大鼠的左右前肢轻轻放于较大的金属网上,观察左右前肢抓金属网的肌肉张力。正常大鼠的左右前肢抓金属网的力量明显且对称。若大鼠左前肢张力下降,最严重为3分,正常为0分。
每只受试的大鼠,根据以上标准打分并累加,满分为10分。
-
手术前记录各组大鼠体重作为起始体重。手术后,在每天的相同时段(相差不超过1h),将各组大鼠放于体重计上,待示数稳定5 s后,立刻记下体重数。由不参与整个实验的研究者记录手术后菸花苷组与模型组在第1、2、3、5、7、10、15、20、25、30天的体重。每只大鼠的体重记录在1~3 min内完成。
-
手术30 d后,按大鼠体重以350 mg/kg的剂量,用10%的戊巴比妥钠腹腔注射麻醉。迅速打开胸腔,暴露心脏,用针头从心尖部位插入左心室,剪开右心耳,针头另一端连接生理盐水,打开灌流泵,使生理盐水通过血液循环将血液排出。待灌入150 ml左右生理盐水,且流出的液体几乎为无色时,立刻将灌注液改为通用型组织固定液(4%多聚甲醛),此时注意速度为先快后慢。灌流时若大鼠全身不停抽动则代表4%多聚甲醛已进入全身循环,待灌入150 ml左右固定液即可停止。将脑完整取出,在4%多聚甲醛中固定48 h。
-
用ASP200S全自动脱水机进行脱水处理,再用EG1160一体式石蜡包埋机进行包埋。临用前,切取3~5 mm厚的石蜡切片附于载玻片上,用新鲜的二甲苯脱蜡2次,每次10 min。随后依次放入无水乙醇5 min;放入90%乙醇、70%乙醇、蒸馏水各2 min。
-
将上述脱蜡后的石蜡切片参照试剂盒说明书进行如下操作:在37 ℃的烘箱中,用尼氏染色液染色7 min。随后,用蒸馏水洗涤 2 次,每次5 s,再用95%乙醇洗涤5 s,至此完成尼氏染色。
-
将脱蜡后的石蜡切片参照试剂盒说明书进行如下操作:用苏木素染色液染色6 min。浸于足够的蒸馏水中冲去多余的染色液,这个过程大约持续10 min,再放于新鲜的蒸馏水内数秒钟润洗一遍。然后,用1%盐酸酒精溶液分化数秒(一般不超过5 s)。蒸馏水洗涤5 min后,Scott液返蓝处理50 s,蒸馏水再次洗涤3 min,进入伊红染色液中染色8 min,至此完成HE染色。
-
将上述过程中的尼氏染色、HE染色的切片分别用70%乙醇洗涤后,用95%乙醇脱水3次,每次3 min。入二甲苯透明5 min,共计2次。中性树胶封片。
-
利用软件SPSS 18.0进行统计学分析,所得计量数据以(
$ \bar{x} $ ±s)表示,两组间数据比较采用Student t检验;生存资料以生存曲线表示,采用Log-rank (Mantel-Cox)检验。P<0.05具有统计学意义。 -
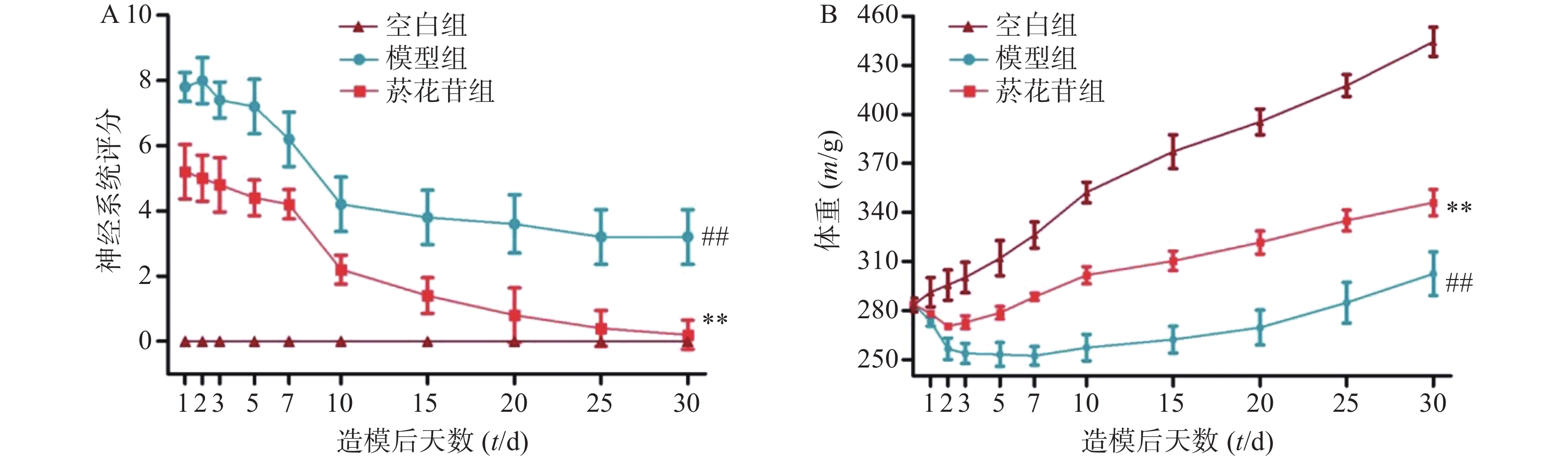
观察30 d内脑缺血损伤后大鼠的生存情况,发现手术后,模型组和菸花苷组大鼠均出现不同程度的死亡情况。菸花苷组大鼠于第8天开始,存活的数目趋于稳定,模型组于第16天开始,无新增的死亡大鼠。截止到第30天观察结束时,假手术组生存率为100%,模型组生存率为30.4%,菸花苷组生存率为70%,较之模型组,菸花苷组的生存率显著升高(P<0.05),结果见图2。
-
由图3A可知,在手术后的各个观察时间点,假手术组的行为学评分均为0,一直未出现神经功能损伤的体征。与模型组相比,菸花苷组在测评的各个时间点神经功能损伤较轻,具有显著的统计学意义(P<0.01),且整个观察过程中,菸花苷组大鼠的行为学得分不断降低,神经功能趋向好转。
由图3B可知,在体重变化方面,手术后,假手术组大鼠体重一直保持持续增长状态。术后第1天,模型组与菸花苷组大鼠的体重有不同程度的下降,菸花苷组大鼠在术后第3天开始恢复体重增长状态,模型组从术后第10天开始恢复体重增长状态。在初始体重差别不大的情况下,较之模型组,菸花苷组在术后各个时间点观察得到的体重数值均明显高于模型组大鼠的体重数值(P<0.01)。
-
由图4A可知,假手术组皮层和海马区的细胞大小均一,结构清晰,胞浆丰富,核质比例适中,CA1区的锥体细胞和DG区的颗粒细胞排列整齐紧密,CA3区锥体细胞体积较之CA1区的略大,排列稍松散但整齐。模型组的神经元大小不一,胞质不规则淡染,胞核皱缩变形,部分细胞脱失明显,CA1区锥体细胞和DG区的颗粒细胞排列松散,CA3区锥体细胞排列散乱,表明造模后神经细胞受损严重。与模型组相比,菸花苷组的神经元虽也出现了细胞淡染,大小不均,部分胞体肿胀,CA1区及DG区排列稍显混乱,但整体的形态接近正常,病理损伤明显减轻。
由图4B可知,假手术组皮层和海马区的尼氏体大且多,“虎斑”也不在少数,呈深蓝色,表明神经元功能良好。模型组整体淡染,皮层的尼氏体大大减少,海马区尼氏体极少,表明造模后神经元功能受到损伤。与模型组相比,菸花苷组皮层尼氏体数目更多,个体更大,染色较均匀,海马区尼氏体虽多为颗粒状,个体稍小,但数目明显增多,说明神经元蛋白合成有所增加,较为活跃。
-
正如“卒中治疗学术产业圆桌会议”中对神经保护药物的研究所提出的那样[11]:较为理想的神经保护类药物的实验室阶段研究,应该在至少两个不同实验室中展开,运用在至少两种动物身上,兼顾在永久缺血模型和短暂局灶性缺血模型,既要考察短期内的组织和功能上的结果,也需要考察长期作用的影响。在本研究中,我们在前期证明菸花苷对急性永久性缺血模型和短暂局灶性缺血模型均具有良好的保护作用的基础上[12-13],通过建立大鼠脑缺血再灌注模型,从功能和组织层面证明了菸花苷对缺血性脑卒中的长期保护作用。
长期生存率是药效结果最直观的体现,体重可以反映出大鼠在发生缺血性脑卒中后整体的预后情况,而行为学的变化可以间接反应出大鼠神经系统的功能。我们通过连续30 d观察实验大鼠的生存率、行为学以及体重变化,发现造模后给予菸花苷显著地提高了大鼠生存率,并能逐渐降低行为学得分,改善神经功能,体重也在术后第3天开始恢复增长状态。这些结果表明菸花苷可以改善缺血性脑卒中的预后,促进神经系统的远期功能恢复。
海马区是大脑中负责记忆与学习的重要区域,与认知功能密切相关,也是研究卒中后认知障碍等脑卒中并发症的重点关注区域,其中CA1区的神经元对脑缺血缺氧较为敏感,容易受到损伤,而CA3区及DG区的神经元则相对耐受[14]。尼氏体是神经元胞体和树突内的嗜碱性颗粒或小斑块,由游离的核糖体和粗面内质网构成,对缺血变化非常敏锐[15]。病理组织学研究表明,菸花苷给药后大鼠海马区的尼氏体数目有所增加,蛋白合成更为活跃,脑组织恢复更好,整体趋向正常。提示菸花苷对神经细胞结构和功能具有长期保护作用。
综上所述,菸花苷对缺血性脑卒中大鼠具有长期保护作用,可维持神经细胞结构功能处于相对良好的状态,并能促进神经系统远期功能的恢复,可以作为一种潜在的神经保护剂,其作用机制有待进一步研究。
Long-term protective effects of the nicotiflorin on ischemic stroke rats
-
摘要:
目的 探讨菸花苷对缺血性脑卒中大鼠的长期保护作用。 方法 建立大鼠脑缺血模型,观察菸花苷对于大鼠长期生存率、神经系统功能、体重及脑神经元的影响。 结果 菸花苷可以显著提高脑缺血大鼠的长期生存率,促进大鼠体重增加,减轻脑组织病理损伤,维持脑神经元形态及神经系统功能。 结论 菸花苷具有明显的对缺血性脑卒中大鼠的长期保护作用,其作用机制可能与保护脑神经元结构和功能有关。 Abstract:Objective To investigate the long-term protective effects of the nicotiflorin on ischemic stroke rats. Methods Ischemic stroke model in rats was established for this study. The effects of nicotiflorin on long-term survival rate, nervous system function, body weight and brain neurons in rats were observed. Results The nicotiflorin had significantly improved the long-term survival rate of cerebral ischemia rats, which also promoted weight gain, alleviated pathological damage of brain tissue, maintained morphology of brain neurons and function of nervous system. Conclusion The nicotiflorin has obvious long-term protective effect on ischemic stroke rats and the mechanism may be related to the protection of the structure and function of brain neurons. -
Key words:
- nicotiflorin /
- ischemic stroke /
- neuroprotection /
- pathology
-
根据世界卫生组织最新统计显示,心脑血管疾病如心肌梗死、缺血性卒中等是目前全球最主要的致死原因[1]。血小板作为动脉血栓形成的一项重要介质,其高反应性是导致动脉血栓事件发病率和病死率增加的重要危险因素[2, 3]。尽管现有的抗血栓药物可有效减少心血管疾病患者的动脉血栓形成,但出血的不良反应也极大限制了它们的使用。因此为了开发出能在抗血栓形成效果和出血之间取得更好平衡的新一代安全有效的抗血栓药物,迫切需要了解导致血管血栓闭塞的致病机制,开展新靶标的基础研究[4, 5]。
分泌蛋白可由机体各种组织器官分泌,在生理、病理过程中起关键作用,具备良好的研究前景,有望开发成为心脑血管疾病防治的药物、靶标、生物标志物[6, 7]。近期有多项研究表明部分分泌蛋白大量存在于血液之中,可直接作用于血栓调控[8-10]。Metrnl是本实验室前期通过构建限食模型筛选获得的一种与神经营养因子Metrn同源的新型分泌蛋白[11]。迄今为止,多项研究结果表明Metrnl在免疫炎症及代谢性心脑血管疾病中发挥重要作用,例如调节胰岛素敏感性、维持肠道稳态、对抗动脉粥样硬化、促进血管新生等[12-17]。此外,临床研究显示,血液Metrnl水平与冠心病、心肌梗死、缺血性脑卒中等多种血栓性疾病存在相关性[18-20]。以上结果均提示Metrnl在心脑血管疾病病理过程中扮演重要角色,但是Metrnl在血栓形成特别是其对血小板的直接作用尚未可知。
前期,本实验室通过使用Metrnl全身性敲除小鼠,已在多种血栓模型下证明Metrnl缺乏会导致血栓形成能力增强,并且在进一步的血小板功能检测中,证实Metrnl缺乏会导致血小板活性增强[21]。然而,我们尚未证明究竟是循环Metrnl还是血小板Metrnl的缺乏在促进血栓形成中扮演主要角色,且血小板Metrnl是否可以直接调控血小板活性改变,从而在血小板高活性与动脉血栓形成事件发生率增加之间建立联系,目前尚不清楚。
因此,本研究使用Metrnlloxp/loxp小鼠和Pf4-Cre小鼠进行交配繁殖,旨在构建血小板特异性Metrnl敲除小鼠模型,作为深入研究血小板内源性Metrnl在动脉血栓中的作用及调控机制的工具,并对该敲除小鼠的构建成功与否展开验证工作。
1. 材料与方法
1.1 实验试剂和仪器
鼠尾DNA提取试剂盒(CW2094S)购自北京康为世纪生物科技有限公司,5×Evo M-MLV RT Master Mix(AG11706)、通用型RNA提取试剂盒(AG21022)购自湖南艾科瑞生物工程有限公司,小鼠Actin抗体(
66009 -1-IG)购自武汉三鹰技术有限公司,Anti-METRNL抗体(ab235775)购自Abcam公司,辣根过氧化物酶标记山羊抗小鼠IgG(H+L)(A0216)、辣根过氧化物酶标记山羊抗兔IgG(H+L)(A0208)购自上海碧云天生物技术有限公司,红细胞裂解液(BL503B)购自北京兰杰柯科技有限公司。实时荧光定量PCR仪(LightCycler96)来自Roche公司,PCR仪(TP600)来自Takara公司,化学发光分析系统(5200S)来自Tanon公司,动物全血计数仪(pocH-100iV)来自希森美康公司。
1.2 实验动物
Metrnlloxp/loxp小鼠为实验室前期构建所得。SPF级8周龄Pf4-Cre小鼠购自上海南方模式生物技术有限公司。
所有实验小鼠均饲养在独立通气笼盒(IVC)系统中,温度(24±2) ℃,相对湿度为40%~60%,饲养期间笼盒内保持清洁,小鼠在笼内自由活动、进食及饮水,动物房内照明系统为自动控制(12 h照明、12 h黑暗)。动物实验标准均依照国家《实验动物护理使用卫生指南》,并经过海军军医大学大学医学研究伦理委员会批准指导。
1.3 实验方法
1.3.1 动物基因型鉴定
将剪刀消毒后剪取小鼠尾尖约3 mm,剪碎,按照DNA提取试剂盒的说明书方法提取DNA。之后,对目的基因进行PCR扩增,各引物序列如表1。
表 1 PCR扩增实验中的引物序列基因名称 上游引物(5’→3’) 下游引物(5’→3’) Metrnl loxp TGAGGGTTGGAGGCTCCTAGC GGATGAGCGTTTGAGCACAGC Pf4-Cre CCAAGTCCTACTGTTTCTCACTC TGCACAGTCAGCAGGTT 内参基因 CAAATGTTGCTTGTCTGGTG GTCAGTCGAGTGCACAGTTT 将PCR产物进行1.2% 琼脂糖凝胶电泳,上样量为每孔6 μl,电泳条件为100 V×30 min,结束后进行拍照、分析。
1.3.2 小鼠取材
将小鼠称重后,腹腔注射1%戊巴比妥钠溶液(100 mg/kg),待小鼠处于深度麻醉后,打开其腹腔,用1 ml注射器吸取约100 μl 2%枸橼酸钠溶液(枸橼酸钠0.2 g,蒸馏水定容至10 ml),自腹主动脉处缓慢抽取抗凝血液,并转移至15 ml离心管中。组织灌流后迅速剪取小鼠心、肝、脾、肺、肾、脑、结肠组织,放入组织冻存管扔进液氮速冻,待取材结束后及时转入−80 ℃超低温冰箱储存。骨髓提取分离小鼠股骨并剪去多余肌肉和纤维组织,剪掉股骨两端,在干净PBS中反复冲洗骨髓腔,收集冲洗液室温离心
1000 r/min×5 min获得骨髓细胞,用1 ml Triozl溶液重悬混匀,储存至−80 ℃超低温冰箱。1.3.3 小鼠洗涤血小板制备
向小鼠抗凝全血中加入等体积0.9%生理盐水,并加入Apyrase(终浓度2 U/ml),快速颠倒混匀后室温离心800 r/min×10 min;离心后收集最上层富血小板血浆(PRP),转移至新的15 ml离心管,室温离心
1700 r/min×5 min,弃去上清液,取适量台式液重悬。1.3.4 小鼠外周血细胞制备
小鼠心脏采抗凝血后,室温离心
1000 r/min×5 min,弃去上清液后加入5 ml的红细胞裂解液,室温作用10 min,室温离心1000 r/min×5 min,重复1次,在血细胞沉淀中加入5 ml PBS洗涤,室温离心1000 r/min×5 min,弃去上清后根据白细胞沉淀的量加入100~500 μl PBS重悬。红细胞提取在全血中加入等体积红细胞保存液(枸橼酸钠0.8 g,葡萄糖2.05 g,枸橼酸0.0325 g,氯化钠0.42 g,蒸馏水定容至100 ml), 室温离心2 000 r/min×10 min,连续离心洗涤3次后,取压积红细胞加入100~500 μl红细胞保存液重悬。1.3.5 实时荧光定量PCR实验
使用RNA提取试剂盒提取组织RNA,Triozl法提取骨髓RNA,将得到的RNA进行浓度测定与吸光度测定后进行逆转录,得到cDNA用于实时荧光定量PCR实验,各引物序列如表2。
表 2 实时荧光定量PCR实验中的引物序列基因名称 上游引物(5′→3′) 下游引物(5′→3′) Mouse Metrnl CTGGAGCAGGGAGGCTTATTT GGACAACAAAGTCACTGGTACAG Mouse Gapdh GTATGACTCCACTCACGGCAAA GGTCTCGCTCCTGGAAGATG 1.3.6 蛋白免疫印迹实验
取适量组织至2 ml高速离心管,加入蛋白裂解液后,使用高通量匀浆仪匀浆240 s。取出高速离心管,离心:
12000 g×15 min。将上清液转移至另一干净1.5 ml EP管中,进行蛋白浓度测定,剩余样品加入5×蛋白上样缓冲液,97 ℃变性10 min得到蛋白样品。使用10% SDS-PAGE凝胶进行电泳,电泳条件为:150 V×60 min。使用PVDF膜进行转膜,转膜条件为100 V×60 min。
转膜结束后,使用快速封闭液封闭20 min,之后使用1 × TBST缓冲液洗膜,5 min×3次。加入一抗孵育液(1∶
1000 稀释)4 ℃孵育过夜。次日去除一抗孵育液,使用1×TBST缓冲液洗膜,10 min×3次。加入二抗孵育液(1∶1000 稀释)常温孵育1 h,用1×TBST缓冲液洗去二抗,10 min×2次,结束后即可进行扫膜。1.3.7 统计学分析
实验数据使用GraphPad Prism 9.5进行统计分析。两组间的比较使用two-tailed Student’s t test检验,P<0.05视为结果存在统计学意义。
2. 结果
2.1 血小板特异性Metrnl敲除小鼠的构建和基因型鉴定
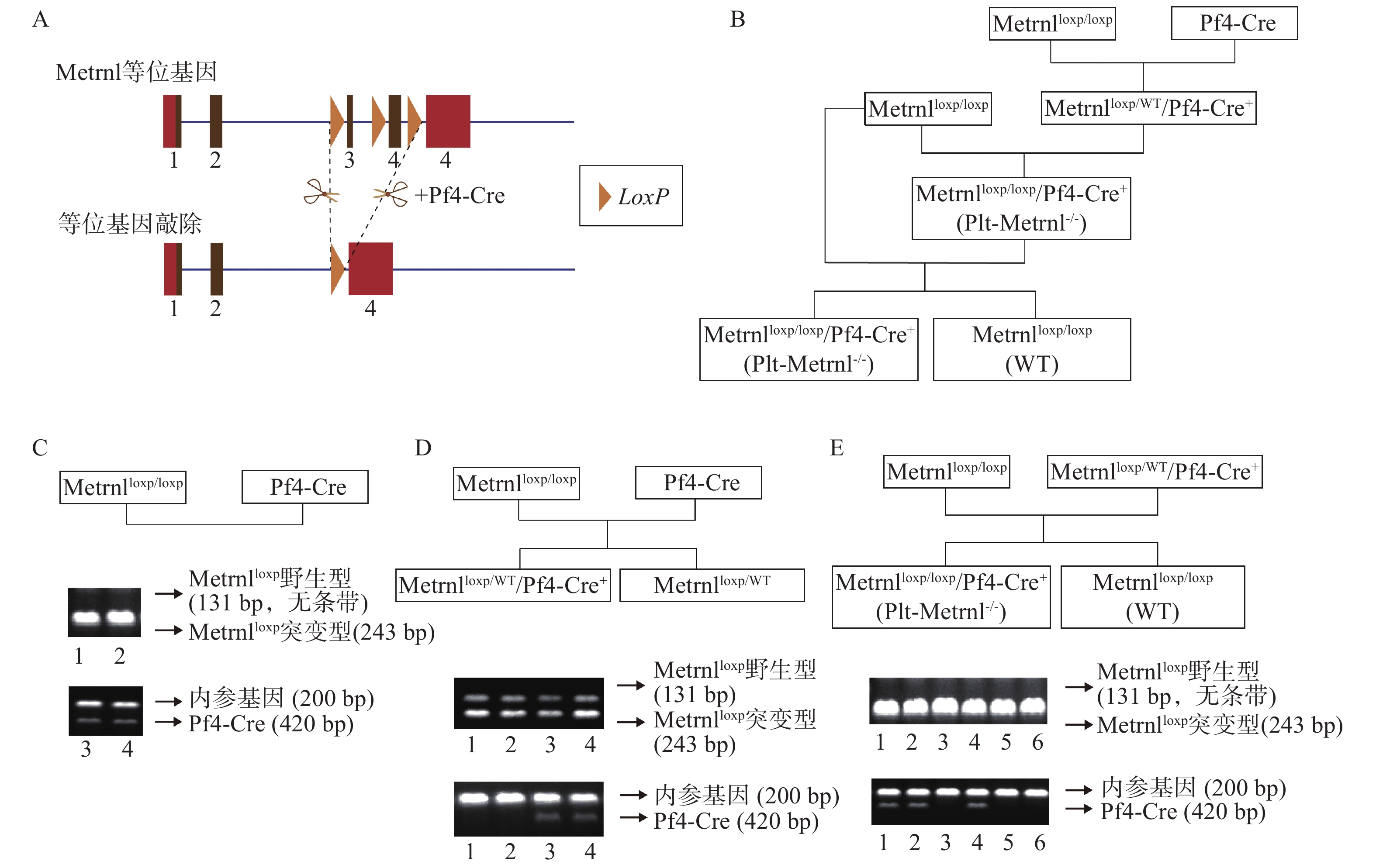
本研究构建策略基于前期构建的Metrnlloxp/loxp小鼠和Cre-LoxP重组酶系统,所构建血小板特异性Metrnl敲除小鼠(Metrnlloxp/loxp/Pf4-Cre+)简称Plt-Metrnl-/-小鼠,具体构建策略如图1A所示。
Metrnlloxp/loxp小鼠是前期构建而成,该小鼠Metrnl基因的3号外显子两侧和4号外显子编码区的都插有同向LoxP位点(即图1A中所示“等位基因”),可基于Cre-LoxP系统在Cre酶的作用下,将LoxP位点之间的序列切除(图1A)[12]。
Pf4-Cre小鼠是由Pf4基因启动子Cre重组酶在巨核细胞及血小板谱系表达的工具鼠,最初开发用于研究APC-Wnt调节途径在巨核细胞生成和血小板产生中的作用,其Cre重组酶的表达受巨核细胞特异性受体Pf4基因的启动子介导,在巨核细胞的成熟Ⅰ期(最早可识别形态期)中即开始发生转录激活,之后广泛表达于成熟的血小板[22, 23]。
将Metrnlloxp/loxp小鼠和Pf4-Cre小鼠进行交配繁殖,巨核细胞特异性表达的Cre酶可将Metrnl同向LoxP位点之间的序列切除,以达到在巨核细胞及血小板谱系特异性敲除Metrnl基因的目的,具体构建繁殖流程如图1B所示,最终可以获得Plt-Metrnl-/-小鼠及其对照小鼠(WT)。
繁殖过程中进行基因型鉴定时,需确认Metrnlloxp基因和Pf4-Cre基因的表达情况。采用相应基因上下游引物分别进行鼠尾基因型鉴定,Metrnlloxp突变型基因阳性条带为243bp,对应野生型序列条带为131bp,Pf4-Cre基因阳性条带为420bp,内参基因阳性条带为200bp。对培育繁殖过程中的母代及子代小鼠均进行了基因型鉴定,如图1C、D、E中DNA电泳条带图所示:图1C中泳道1、2为母代Metrnlloxp/loxp小鼠,泳道3、4为母代Pf4-Cre小鼠;图1D中泳道1、2为Metrnlloxp/WT小鼠,泳道3、4为Metrnlloxp/WT/Pf4-Cre+小鼠;图1E泳道1、2、4为Plt-Metrnl-/-小鼠,泳道3、5、6为WT小鼠。
2.2 血小板特异性Metrnl敲除小鼠血小板蛋白表达情况
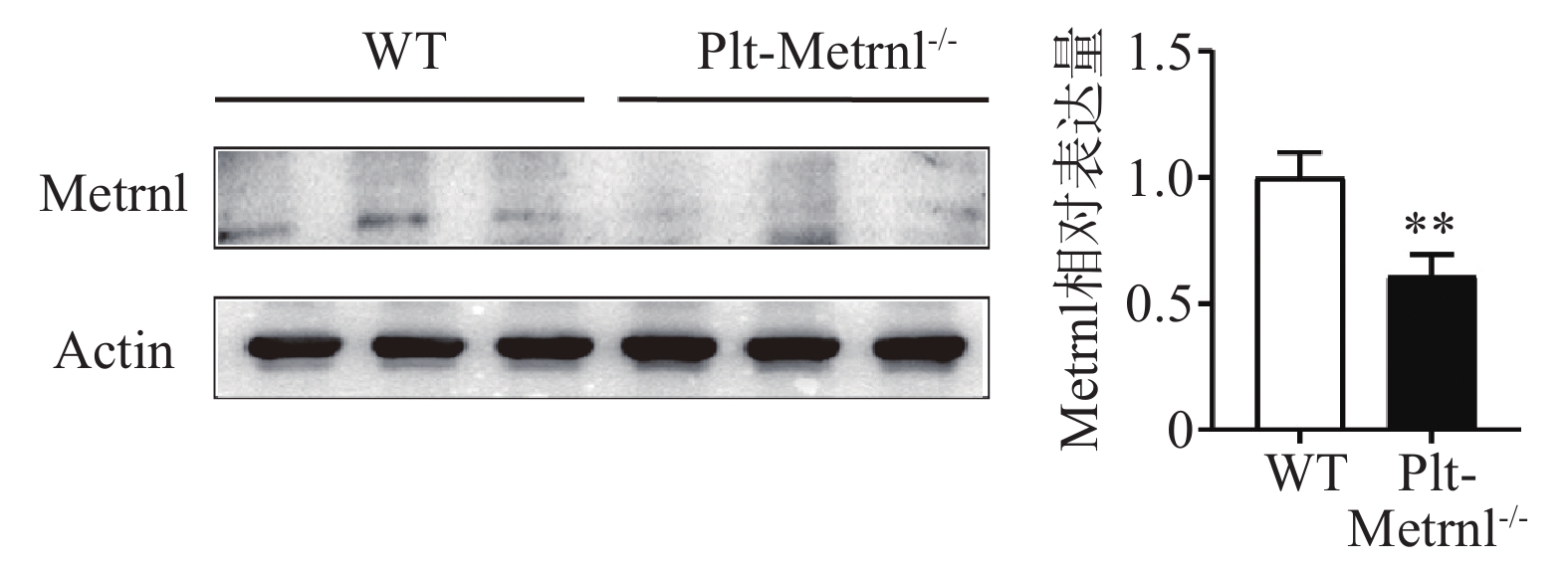
为验证血小板特异性Metrnl敲除小鼠是否实现血小板特异性Metrnl基因敲除,分别提取Plt-Metrnl-/-小鼠及对照WT小鼠血小板蛋白,使用蛋白免疫印迹实验方法验证敲除情况,结果如图2所示,Plt-Metrnl-/-小鼠血小板蛋白Metrnl表达较对照WT小鼠明显降低,提示Plt-Metrnl-/-小鼠血小板Metrnl成功敲除。
2.3 血小板特异性Metrnl敲除小鼠各组织Metrnl mRNA及蛋白表达情况
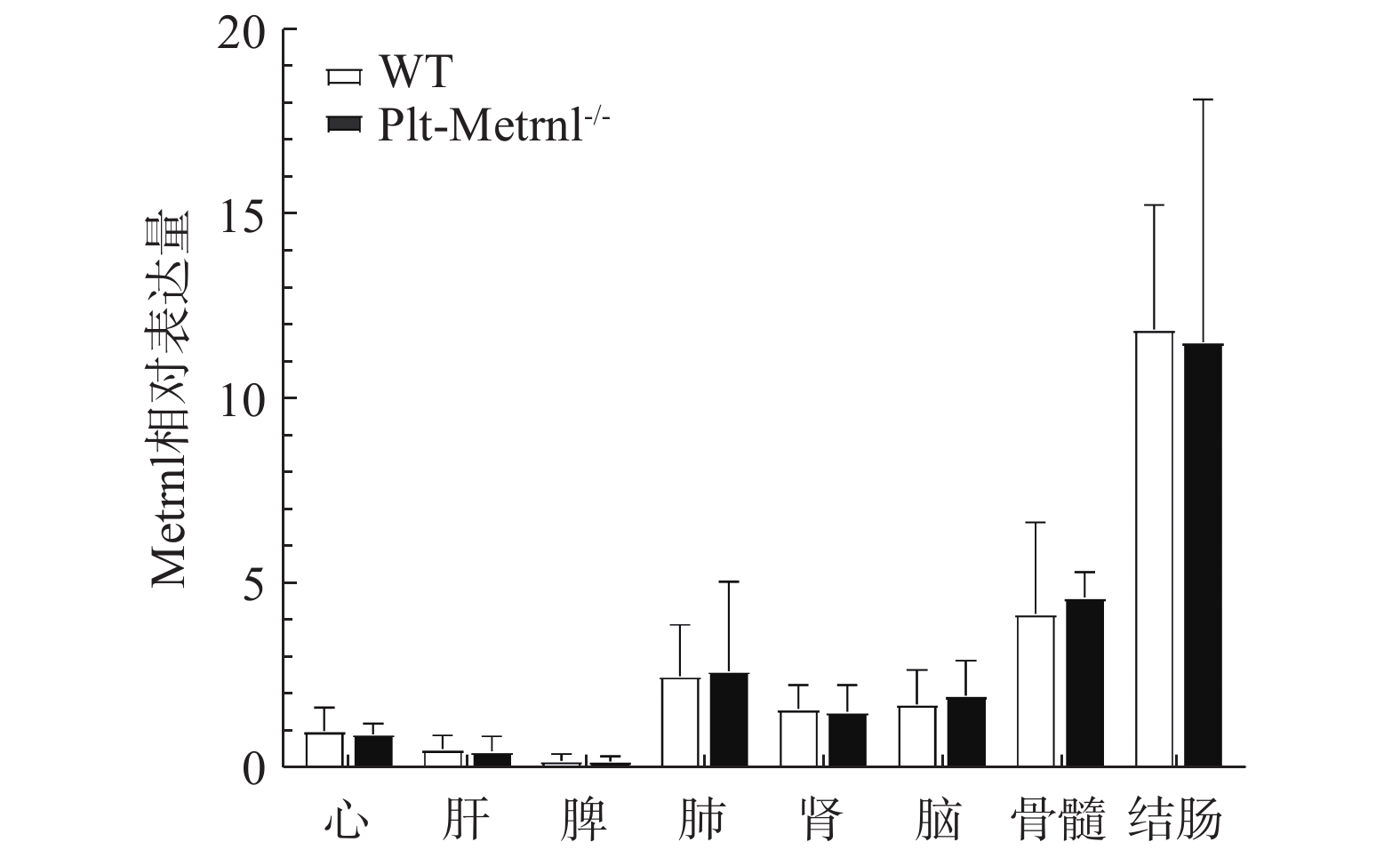
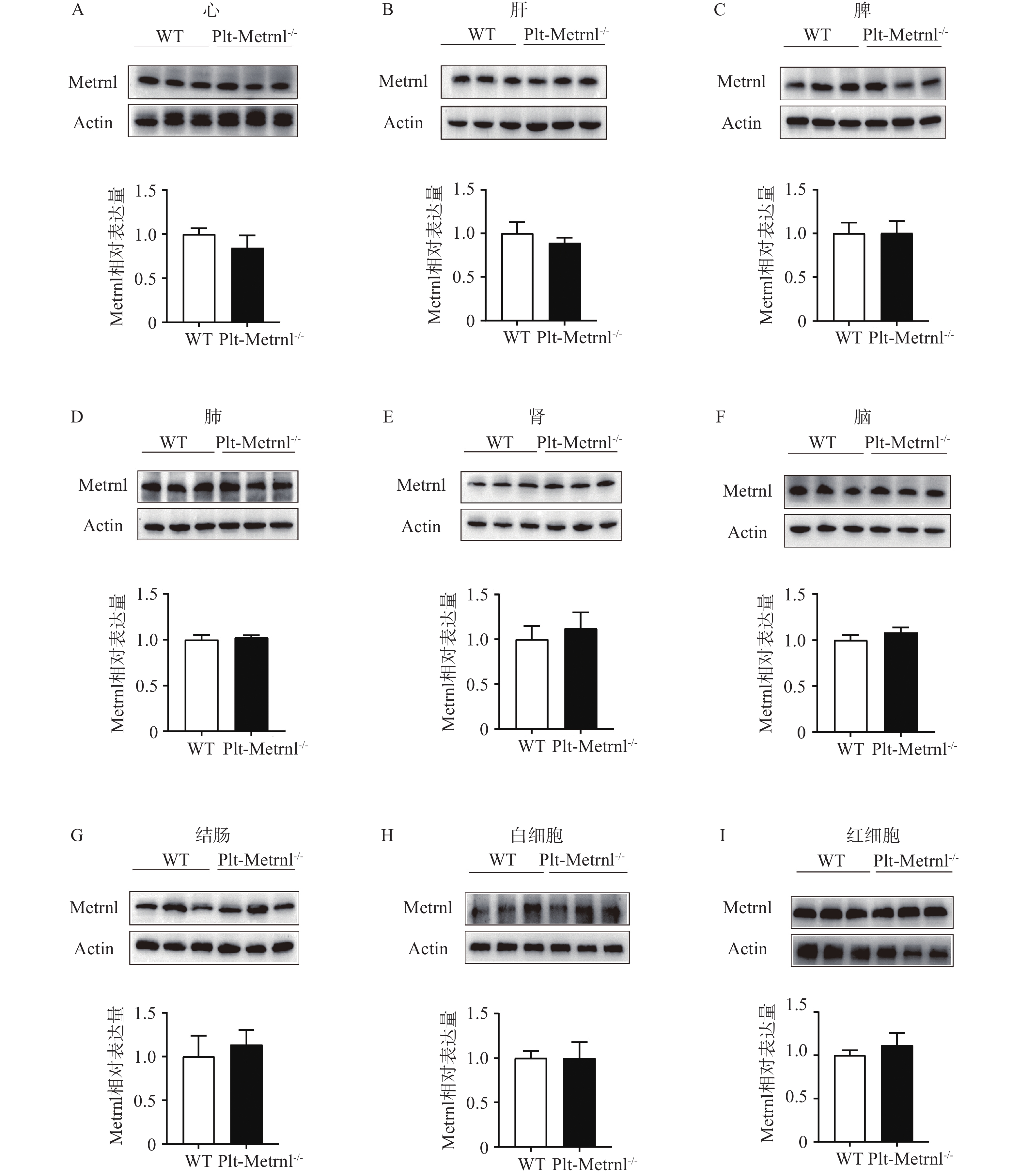
为验证血小板特异性Metrnl敲除小鼠是否存在其他组织非特异性敲除,本研究首先利用实时荧光定量PCR技术检测了该小鼠各组织中Metrnl mRNA的表达情况。如图3所示,以WT对照小鼠的心脏Metrnl mRNA表达量为1,Plt-Metrnl-/-小鼠在心、肝、脾、肺、肾、脑、结肠、骨髓组织mRNA水平上并未存在显著差异。该结果说明,血小板特异性Metrnl基因敲除小鼠在组织mRNA水平上并未发生其他组织非特异性敲除。
然后,本研究提取血细胞及各组织的蛋白,使用蛋白免疫印迹实验方法验证Plt-Metrnl-/-小鼠各血细胞及组织中Metrnl蛋白表达情况。如图4所示,并未发现Metrnl蛋白在Plt-Metrnl-/-小鼠和对照WT小鼠各组织中存在显著差异,该结果提示,Plt-Metrnl-/-小鼠在其他血细胞蛋白水平及各组织蛋白水平上并未发生非特异性敲除。
2.4 血小板特异性Metrnl敲除小鼠外周血常规指标情况
分别对Plt-Metrnl-/-小鼠及对照WT小鼠外周血进行血常规指标检测,结果如表3所示,外周血血常规计数红细胞、白细胞、血小板数量未见明显改变,血小板大小及分布未见显著差异,提示血小板特异性敲除Metrnl后不影响外周血细胞数量,且对血小板形态没有明显影响。
表 3 Plt-Metrnl-/-小鼠及对照WT小鼠血常规指标对比(n=6)血常规检验项目 WT Plt-Metrnl-/- 白细胞计数(109/L) 2.10±0.50 2.25±0.30 淋巴细胞计数(109/L) 1.28±0.20 1.52±0.20 淋巴细胞比率(%) 63±3 68±3 嗜酸性粒细胞计数(109/L) 0.10±0.05 0.05±0.02 嗜酸性粒细胞比率(%) 3.0±1.8 1.0±0.3 其他细胞计数(109/L) 0.72±0.20 0.68±0.10 其他细胞比率(%) 34.0±3.3 31±3 红细胞计数(1012/L) 8.49±0.40 7.83±0.40 血红蛋白(g/L) 122.0±5.5 113.0±4.6 红细胞压积(%) 42±2 37±2 平均红细胞体积(fL) 49.1±0.8 47.7±0.9 平均血红蛋白含量(pg) 14.30±0.08 14.5±0.1 平均血红蛋白浓度(g/L) 292±5 304.0±7.7 红细胞分布宽度-SD(fL) 27.6±0.4 26.2±0.6 红细胞分布宽度-CV(%) 13.2±0.4 12.4±0.3 血小板计数(109/L) 1121 ±581049 ±132血小板平均宽度(fL) 6.7±0.4 6.1±0.1 平均血小板体积(fL) 6.20±0.26 5.80±0.08 大型血小板比率(%) 1.9±1.0 3.5±0.3 2.5 血小板特异性Metrnl敲除小鼠一般繁殖情况
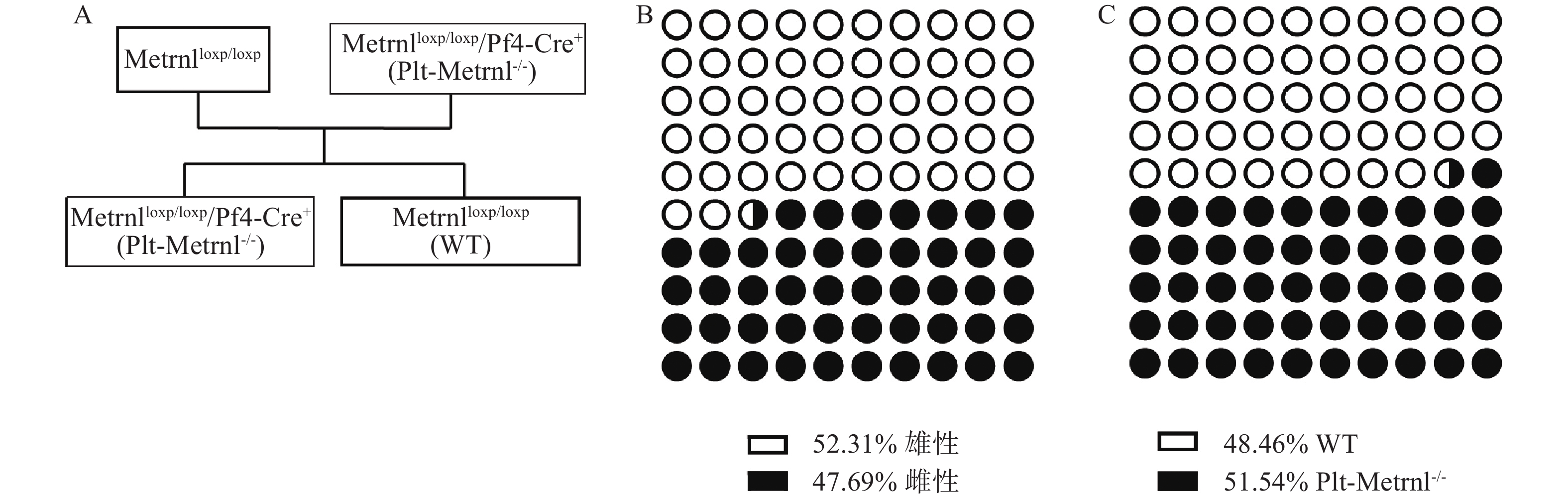
Metrnlloxp/loxp/Pf4-Cre+(Plt-Metrnl-/-)小鼠和对照WT小鼠为首次繁殖培育的转基因动物,在生理状态下,血小板Metrnl缺失是否影响动物繁殖情况尚未见报道,因此,本研究统计记录了小鼠基因型分布情况。Plt-Metrnl-/-小鼠扩大繁殖流程如图5A所示,按照遗传学规律,Metrnlloxp/loxp/Pf4-Cre+(Plt-Metrnl-/-)小鼠和Metrnlloxp/loxp小鼠杂交繁殖获得子代鼠中Plt-Metrnl-/-小鼠和WT小鼠的比例应为1∶1。如图5B、5C所示,对繁殖过程中所获得的16窝次共计130只目的鼠进行统计,Plt-Metrnl-/-小鼠共有67只,其中雄鼠31只,雌鼠36只;WT小鼠共有63只,其中雄鼠37只,雌鼠26只。结果表明繁殖鼠遗传规律基本符合预期,无明显差异,提示血小板特异性敲除Metrnl对小鼠胚胎发育和性别比例无明显影响。
3. 讨论与总结
Cre-LoxP重组酶系统主要用于构建条件性基因敲除小鼠模型,是当前阐释基因功能的最直接的方式之一。Pf4-Cre工具鼠长期以来应用于巨核谱系基因敲除动物的构建,虽然有研究表明Pf4-Cre表达不仅限于巨核细胞/血小板谱系,也表达于其他骨髓造血干细胞以及远端肠道的上皮细胞中,但是该小鼠目前仍是巨核细胞谱系遗传修饰的最佳工具,且不影响血小板和血栓形成功能的考察[22-24]。因此本研究利用Pf4-Cre工具鼠和实验室前期构建的Metrnlloxp/loxp小鼠进行杂交繁殖,最终获得血小板特异性Metrnl敲除小鼠,即Plt-Metrnl-/-小鼠。
本研究从mRNA水平、组织蛋白水平、外周血常规水平考察了Plt-Metrnl-/-小鼠血小板Metrnl敲除的情况。本研究结果显示,Plt-Metrnl-/-小鼠血小板Metrnl蛋白表达较对照WT小鼠减低约50%,可能是由于本实验室前期构建的Metrnlloxp/loxp小鼠插入的loxp序列位点在3、4号外显子,因此Pf4-Cre仅介导3、4号外显子间的同向基因序列切除,并未实现Metrnl基因全长敲除。另外,血小板是骨髓巨核细胞分化形成的“细胞碎片”,由于无法获得原代骨髓巨核细胞,本研究并未对骨髓巨核细胞的Metrnl敲除情况进行验证,未证实Metrnl敲除是否会对骨髓巨核细胞的生成和形态产生影响,仅从血常规计数中初步得知血小板的生成未受到明显影响。Metrnl与骨髓巨核细胞之间的关系也可作为下一步的研究方向。
在小鼠培育的过程中,尚未发现Plt-Metrnl-/-小鼠和同窝对照WT小鼠在体重、形态等方面的差异。基于孟德尔遗传定律,Plt-Metrnl-/-小鼠和Metrnlloxp/loxp小鼠杂交进行扩大繁殖和保种的得率也接近50%,说明血小板Metrnl缺失不影响小鼠繁殖情况。
前期本课题组已证实Metrnl全身敲除小鼠血栓形成能力增强,血小板活性明显增强,构建Plt-Metrnl-/-小鼠可考虑用于血小板内源性Metrnl与血小板功能相关性的研究,并且该小鼠可与Metrnl全身敲除小鼠进行血栓形成能力比较,比较全身Metrnl和局部血小板Metrnl的作用,深入研究其作用方式及机制,为血栓性疾病的防治提供新靶点。
-
-
[1] 国家卫生健康委脑卒中防治工程委员会, 中华医学会神经病学分会脑血管病学组. 中国脑卒中防治指导规范(2021年版) . (2021-08-27). http://www.nhc.gov.cn/wjw/index.shtml. [2] 中华医学会神经病学分会, 中华医学会神经病学分会脑血管病学组. 中国急性缺血性脑卒中诊治指南2018[J]. 中华神经科杂志, 2018, 51(9):666-682. doi: 10.3760/cma.j.issn.1006-7876.2018.09.004 [3] POWERS W J, RABINSTEIN A A, ACKERSON T, et al. Guidelines for the early management of patients with acute ischemic stroke: 2019 update to the 2018 guidelines for the early management of acute ischemic stroke: a guideline for healthcare professionals from the American heart association/American stroke association[J]. Stroke,2019,50(12):e344-e418. [4] 王业晴, 夏玉叶, 唐颖, 等. 菸花苷对全脑缺血再灌注模型大鼠的脑保护作用[J]. 药学服务与研究, 2017, 17(2):109-113. [5] BELAYEV L, KHOUTOROVA L, ATKINS K D, et al. Robust docosahexaenoic acid-mediated neuroprotection in a rat model of transient, focal cerebral ischemia[J]. Stroke,2009,40(9):3121-3126. doi: 10.1161/STROKEAHA.109.555979 [6] CHEN J L, YE X C, YAN T, et al. Adverse effects of bone marrow stromal cell treatment of stroke in diabetic rats[J]. Stroke,2011,42(12):3551-3558. doi: 10.1161/STROKEAHA.111.627174 [7] HASEGAWA Y, SUZUKI H, SOZEN T, et al. Activation of sphingosine 1-phosphate receptor-1 by FTY720 is neuroprotective after ischemic stroke in rats[J]. Stroke,2010,41(2):368-374. doi: 10.1161/STROKEAHA.109.568899 [8] SUZUKI Y, CHEN F, NI Y C, et al. Microplasmin reduces ischemic brain damage and improves neurological function in a rat stroke model monitored with MRI[J]. Stroke,2004,35(10):2402-2406. doi: 10.1161/01.STR.0000140628.00927.1a [9] DESLAND F A, AFZAL A, WARRAICH Z, et al. Manual versus automated rodent behavioral assessment: comparing efficacy and ease of bederson and garcia neurological deficit scores to an open field video-tracking system[J]. J Cent Nerv Syst Dis, 2014, 6: 7-14. DESLAND F A, AFZAL A, WARRAICH Z, et al. Manual versus automated rodent behavioral assessment: comparing efficacy and ease of bederson and garcia neurological deficit scores to an open field video-tracking system[J]. J Cent Nerv Syst Dis, 2014, 6:7-14. [10] PANG X M, LI T X, FENG L X, et al. Ellagic acid-induced thrombotic focal cerebral ischemic model in rats[J]. J Pharmacol Toxicol Methods,2014,69(3):217-222. doi: 10.1016/j.vascn.2014.01.001 [11] Stroke Therapy Academic Industry R. Recommendations for standards regarding preclinical neuroprotective and restorative drug development[J]. Stroke,1999,30:2752-2758. doi: 10.1161/01.STR.30.12.2752 [12] LI R P, GUO M L, ZHANG G, et al. Nicotiflorin reduces cerebral ischemic damage and upregulates endothelial nitric oxide synthase in primarily cultured rat cerebral blood vessel endothelial cells[J]. Journal of Ethnopharmacology,2006,107(1):143-150. doi: 10.1016/j.jep.2006.04.024 [13] LI R P, GUO M L, ZHANG G, et al. Neuroprotection of nicotiflorin in permanent focal cerebral ischemia and in neuronal cultures[J]. Biol Pharm Bull,2006,29(9):1868-1872. doi: 10.1248/bpb.29.1868 [14] SCHMIDT-KASTNER R, FREUND T F. Selective vulnerability of the Hippocampus in brain ischemia[J]. Neuroscience,1991,40(3):599-636. doi: 10.1016/0306-4522(91)90001-5 [15] HU H H, LI S J, WANG P, et al. An L-type calcium channel agonist, bay K8644, extends the window of intervention against ischemic neuronal injury[J]. Mol Neurobiol,2013,47(1):280-289. doi: 10.1007/s12035-012-8362-x -





 下载:
下载:
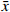
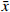

 下载:
下载: