-
作者通过网络药理学和体外实验,对青蒿治疗肾阴虚型糖皮质激素性骨质疏松(GIOP)的潜在作用靶点及相关信号通路进行预测和初步验证。研究结果表明, 青蒿治疗肾阴虚型GIOP具有多靶点-多通路的特点,可以通过多条途径促进成骨细胞的增殖、分化,其中PI3K/AKT信号通路是一条重要的通路,青蒿治疗肾阴虚型骨质疏松可能与其能够促进PI3K/AKT信号通路,促进AKT的磷酸化有关。
-
骨质疏松症(osteoporosis, OP)是一种以骨密度(bone mineral density, BMD) 降低、骨量丢失、骨微结构破坏为主要特点的全身代谢性骨病,以骨脆性增加、易发生骨折为主要特征[1]。随着老龄化的加剧,OP的发生率越来越高,在我国50岁以上的人群中,OP的发生率为19.2%,其中女性为32.1%,男性为6.0%[2]。OP可分为原发性OP和继发性OP,在继发性OP中,糖皮质激素性OP(glucocorticoid-induced osteoporosis, GIOP)的发生率排在第一位[3],目前骨质疏松症(OP)是一种以骨密度(BMD) 降低、骨量丢失、骨微结构破坏为主要特点的全身代谢性骨病,以骨脆性增加、易发生骨折为主要特征[1]。随着老龄化的加剧,OP的发生率越来越高,在我国50岁以上的人群中,OP的发生率为19.2%,其中女性为32.1%,男性为6.0%[2]。OP可分为原发性OP和继发性OP,在继发性OP中,GIOP的发生率排在第一位[3],GIOP治疗上西医使用的药物有钙制剂、活性维生素 D、双磷酸盐类以及雌激素等,这些药物不仅忽略了糖皮质激素这个罪魁祸首,还有可能产生一系列的副作用[4],寻找安全有效且有针对性的药物显得尤为重要。
中医认为糖皮质激素是“纯阳”之品[5],使用过量易伤阴津;肾主骨,肾虚是导致骨质疏松的关键病机,因此,肾阴虚证是GIOP的一个主要证型,临床研究也证明,肾阴虚证是GIOP患者的一个易患证型[6]。青蒿为菊科蒿属植物黄花蒿植物Artemisia annua L.的干燥地上部分,分布遍及全国,味苦、辛,性寒,归肝、胆经,具有清虚热、除骨蒸的作用[7],对于过量使用糖皮质激素造成的阴虚火旺、烦躁不安,有一定的疗效,临床上也常用青蒿加减处方治疗糖皮质激素使用过度,造成阴虚火旺、虚火上炎的病症[8-9],同时,体内实验发现,青蒿在多种骨丢失模型动物上,可以促进骨组织的再生,提高骨密度[10],青蒿在治疗骨质疏松方面具有广阔的应用前景。然而,目前关于青蒿治疗OP,特别是在GIOP方面的研究尚有限,为此,本研究应用网络药理学和体外实验,结合中医基础理论知识,研究青蒿治疗肾阴虚型GIOP的关键靶点和信号通路,以期明确中药青蒿抗肾阴虚型GIOP的作用及机制,为骨质疏松的临床治疗提供新思路和方法。
-
在GeneCards数据库(https://www.Genecards.org)、OMIM数据库(https://omim.org)和Drugbank数据库(https://go.drugbank.com)中,以“glucocorticoid induced osteoporosis”作为关键词进行检索,获得GIOP的靶点基因,去除两个数据库的重复结果,获得GIOP疾病靶点基因。
-
根据全国中西医结合虚证与老年病研究专业委员会[11]1986年对虚证辩证标准的修订,阴虚证诊断标准:主证:①五心烦热(palms and soles);②咽燥口干(dry throat and thirst );③舌红或少苔、无苔(red tongue or less fur or without fur);④脉细数(thin and rapid pulse)。次证:①午后升火(tidal fever);②便结而尿短赤(constipation and scanty dark urine);③盗汗(night sweating)。诊断条件:具备主证3项,次证1项。在GeneCards数据库中,对各症状关键词进行检索,筛选出4个主证检索结果中至少出现3次的靶点,与次证检索结果交叉分析后得到阴虚靶点。肾虚证诊断标准为:①腰脊酸痛(soreness and weakness of waist);②胫酸膝软或足跟痛(soreness and weakness of knees or heel pain);③耳鸣或耳聋(tinnitus or deaf);④发脱或齿摇(alopecia or toothmobilit)y;⑤尿后有余沥或失禁(urinary incontinence or poor urination);⑥性功能减退、不育、不孕(sexual dysfunction and infertility or sterility)。诊断条件:具备3项。在GeneCards数据库中,对各症状关键词进行检索,筛选出至少出现3次的靶点为肾虚靶点。将阴虚靶点与肾虚靶点交叉分析后获得肾阴虚靶点。将GIOP疾病靶点与肾阴虚靶点交叉分析后获得肾阴虚型GIOP靶点。
-
在中药系统药理学数据库与分析平台(TCMSP:http://tcmspw.com/tcmsp.php)上,以Herb:青蒿、OB≥30%、DL≥0.18为条件进行检索,确定青蒿的活性成分。
-
利用TCMSP的靶点预测模型,进一步预测青蒿活性成分的相关靶点,通过UniProt数据库(http://www.Uniprot.org/)对预测靶点添加基因名。最后利用微生信在线软件(http://www.bioinformatics.com.cn/)将肾阴虚型GIOP靶点基因与青蒿靶点基因进行交集分析,并绘制出韦恩图。
-
将“青蒿-肾阴虚型GIOP”共同靶点基因数据导入String在线软件(https://string-db.org /),选择种属为“Homo sapiens”,设置最小互作得分为0.4,构建出PPI网络,将数据导入Cytoscape软件中进行可视化分析,并利用CytoNCA插件进行拓扑分析,以度中心度(DC)和介度中心度(BC)均大于上四分位数的靶点作为核心靶点,进一步分析。
-
为进一步阐述青蒿对肾阴虚型GIOP的作用机制,将“青蒿-肾阴虚型GIOP”共同靶点基因数据导入metascape数据库(https://metascape.org/gp/index.html)进行GO功能富集分析和KEGG功能富集分析,并通过微生信在线软件绘制相关柱状图和气泡图。
-
青蒿购于河北安国市场,经海军军医大学药学系生药学教研室辛海量副教授鉴定,密封存放于干燥阴凉处。称取青蒿粉末1g,加入60%乙醇50 ml,室温冷浸7 d,过滤得滤液,55 ℃旋蒸浓缩后,55 ℃烘干备用[12-13]。
其他试剂及生产厂家:地塞米松(大连美仑);胎牛血清(Gibco,美国);DMEM培养基等细胞培养试剂(天津灏洋);碱性磷酸酶(ALP)试剂盒(南京建成);BCA蛋白检测试剂盒、MTT(上海碧云天生物技术有限公司);PI3K、AKT、p-AKT、GADPH抗体(CST公司)。
-
以二次消化法从新生大鼠颅骨盖中分离获得原代成骨细胞[14]。
-
以含10%胎牛血清和1%青/链霉素的DMEM培养基培养成骨细胞,置于37 ℃、5%CO2培养箱中培养,待细胞铺满80%~90%时,用0.25%胰蛋白酶消化传代培养。
-
取3-8代的成骨细胞计算其数目,配制成细胞浓度为1×104 个/ml细胞悬液接种于96孔板。24 h后分别更换为含药培养液(DEX: 10 μmol/L;AE: 100、50、 25 μg/ml)。给药48 h后采用MTT法检测成骨细胞的增殖情况。
取3-8代的成骨细胞计算其数目,配制成细胞浓度为5×104 个/ml细胞悬液接种于24孔板。24 h后分别更换为含药培养液(给药浓度同上)。培养过程中每3 d更换1次含药培养液。第8d裂解细胞,收集细胞裂解液,于4 ℃、13800×g 离心5 min。用对硝基苯磷酸二钠法测定细胞ALP活性。
-
将3-8代的成骨细胞裂解,提取细胞总蛋白,根据BCA试剂盒进行蛋白定量。采用Western-blot技术对PI3K、AKT和p-AKT水平进行检测。
-
实验结果以“均值±标准差”(
$ \bar x$ ±s)表示。采用SPSS 22.0软件进行数据分析,选用单因素方差分析(One-Way ANOVA)进行组间变量的比较分析。 -
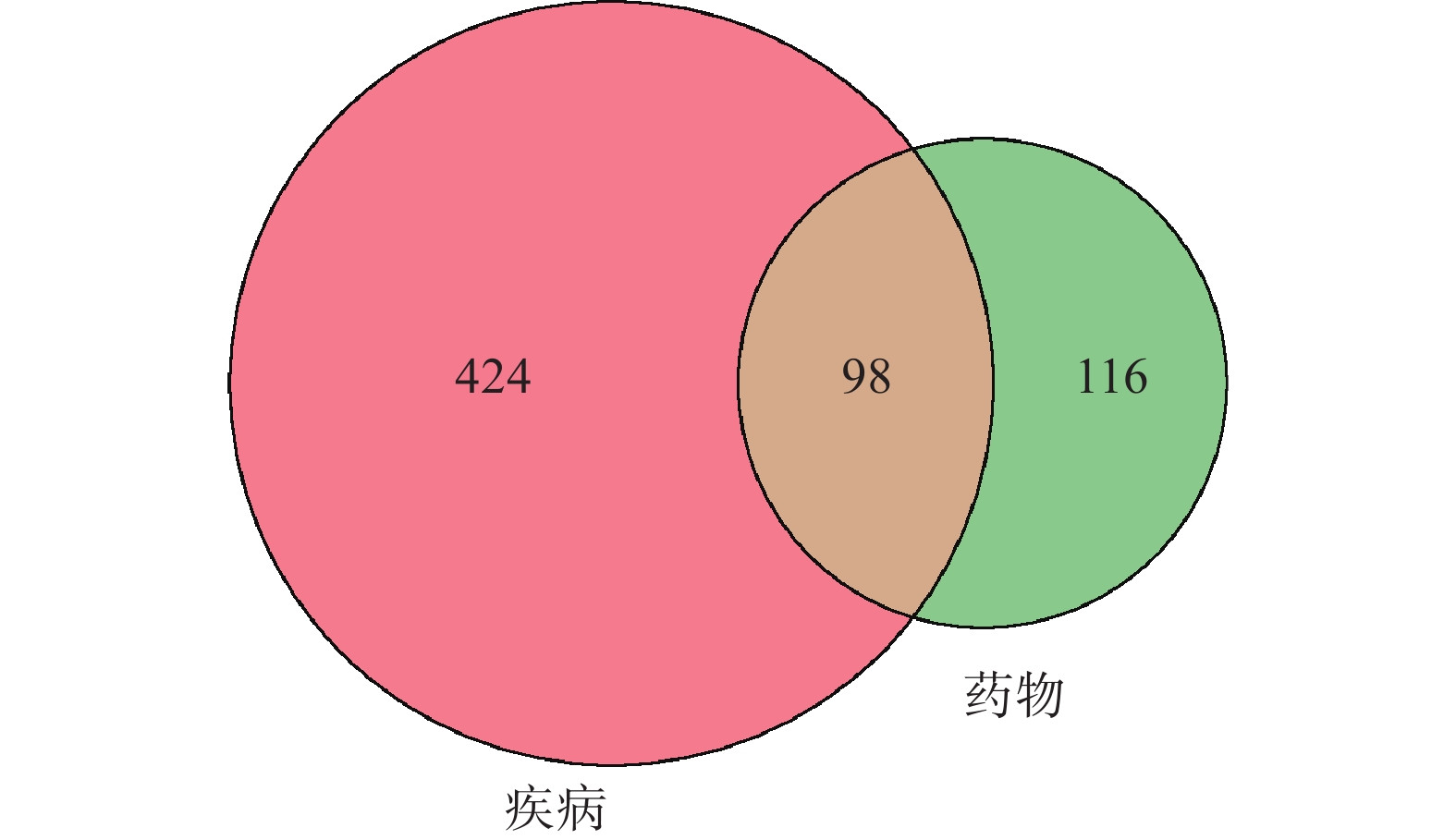
通过Genecards数据库共检索到GIOP相关靶点基因1741个,通过OMIM数据库共检索到GIOP相关靶点基因311个,通过Drugbank数据库共检索到GIOP相关靶点基因30个,将3个数据库检索结果合并后去除重复基因后,最终获得2039个。通过Genecards数据库检索获得阴虚靶点基因876个,肾虚靶点基因4603个,交叉分析后获得肾阴虚靶点基因836个。将肾阴虚靶点基因和GIOP靶点基因交叉分析后获得522个肾阴虚型GIOP靶点基因(图1)。
-
通过TCMSP平台共检索到青蒿中OB≥30%,DL≥0.18的活性成分22个,见表1。
表 1 青蒿主要活性成分
分子名称 生物利用度(%) 药物相似度(DL) 新西兰牡荆苷_qt 59.85 0.21 醋酸酯 58.02 0.52 脱氧青蒿素 54.47 0.26 青蒿烯 54.36 0.31 万寿菊素 53.11 0.34 牡荆黄素_qt 52.18 0.21 泽兰黄醇素 50.8 0.41 双氢青蒿素 50.75 0.3 青蒿素 49.88 0.31 异鼠李素 49.6 0.31 青蒿亭 49.55 0.48 茵陈黄酮 48.96 0.41 槲皮素 46. 43 0.28 维采宁-2_qt 45.84 0.21 豆甾醇 43.83 0.76 线蓟素 43. 46 0.34 六氟磷酸钠 42.6 0.37 山奈酚 41.88 0.24 谷甾醇 36.91 0.75 木犀草素 36.16 0.25 怪柳黄素 32.86 0.31 玄参黄酮 30.35 0.3 -
通过TCMSP和UniProt数据库获得214个青蒿活性成分靶点基因。将其与肾阴虚型GIOP疾病靶点基因交叉分析(图1),“青蒿-肾阴虚型GIOP”交集靶点基因共有98个。
-
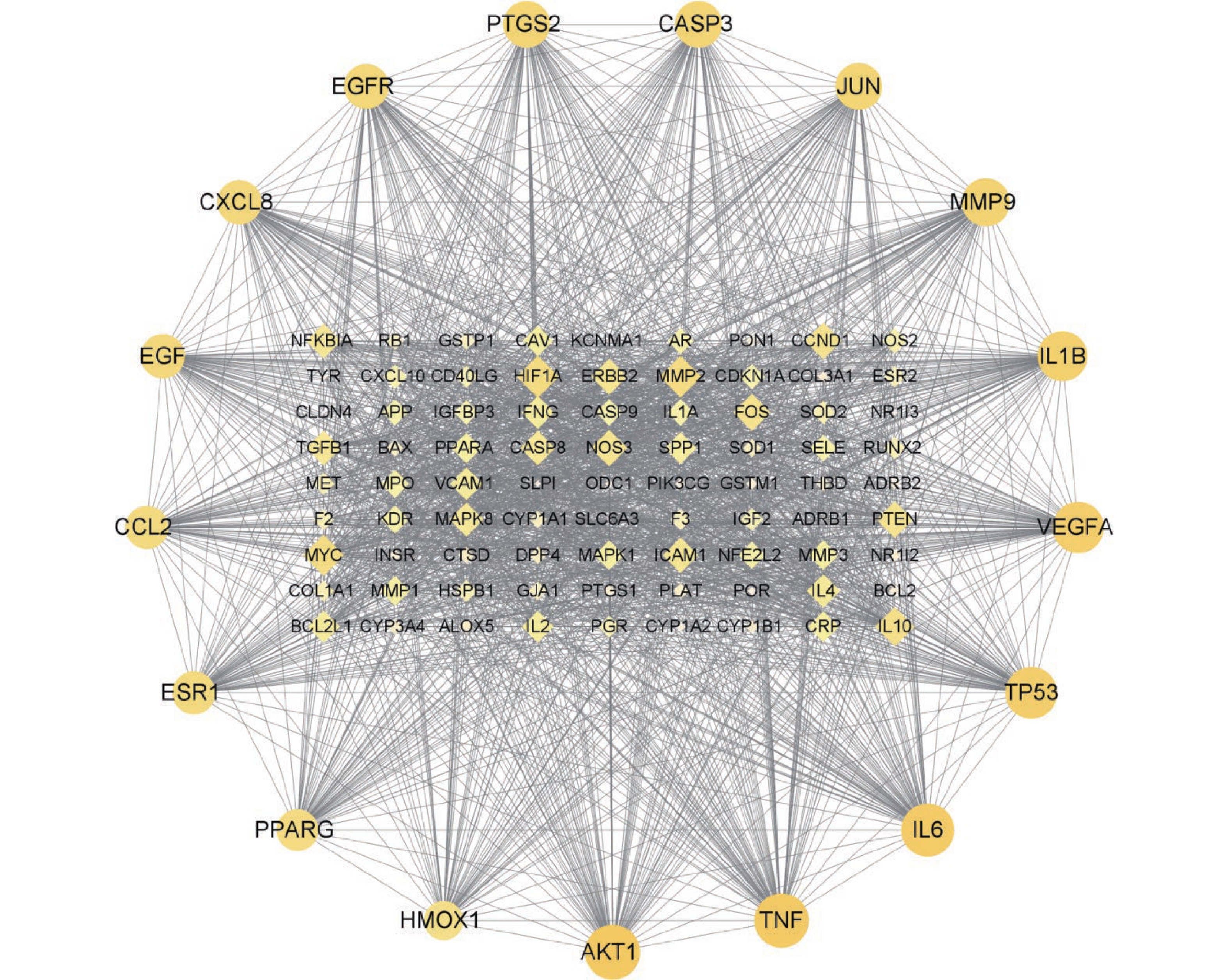
运用String在线软件构建出“青蒿-肾阴虚型GIOP”共同靶点PPI网络(图2),共有98个节点,1935条相互关系,见图2。利用CytoNCA插件计算网络节点的DC,BC上四分位数为59、101.49248,故以DC≥59、BC≥101.49248为筛选条件,筛选青蒿治疗肾阴虚型GIOP的核心靶点,共得到17个核心靶点,如表2。
表 2 “青蒿-肾阴虚型GIOP”核心靶点信息
靶点信息 简称 度中心度
(DC)介度中心度
(BC)RAC-α丝氨酸/苏氨酸
蛋白激酶AKT1 84 495.8247 肿瘤坏死因子 TNF 83 336.63745 白细胞介素-6 IL6 81 281.4354 细胞肿瘤抗原p53 TP53 79 273.47903 血管内皮生长因子A VEGFA 78 200.2001 白细胞介素-1β IL1B 76 199.86818 基质金属蛋白酶-9 MMP9 73 146.52397 转录因子AP-1 JUN 71 167.16982 前列腺素G/H合成酶-2 PTGS2 71 140.30101 半胱氨酸蛋白酶-3 CASP3 71 120.33017 表皮生长因子受体 EGFR 68 294.5016 表皮生长因子 EGF 67 107.6285 白细胞介素-8 CXCL8 67 127.67476 雌激素受体 ESR1 65 251.7144 C-C基序趋化因子配体 CCL2 65 101.49248 过氧化物酶体增殖物
激活受体γPPARG 63 118.61439 血红素氧合酶-1 HMOX1 59 156.89531 -
GO富集分析获得5612个细胞生物学过程,其中BP分析获得4649个条目,MF分析获得585个条目,CC分析获得378个条目,根据富集的基因数进行降序排列,分别选取前10个条目建立BP、MF、CC三合一柱状图(图3)。生物学过程(BP)主要涉及激素应答、性腺发育、细胞死亡的正向调节等,细胞成分(CC)包括细胞外基质、转录调节复合物、膜筏等,分子功能(MF)包括信号受体调节活性、蛋白结构域特异性结合、激酶结合等。
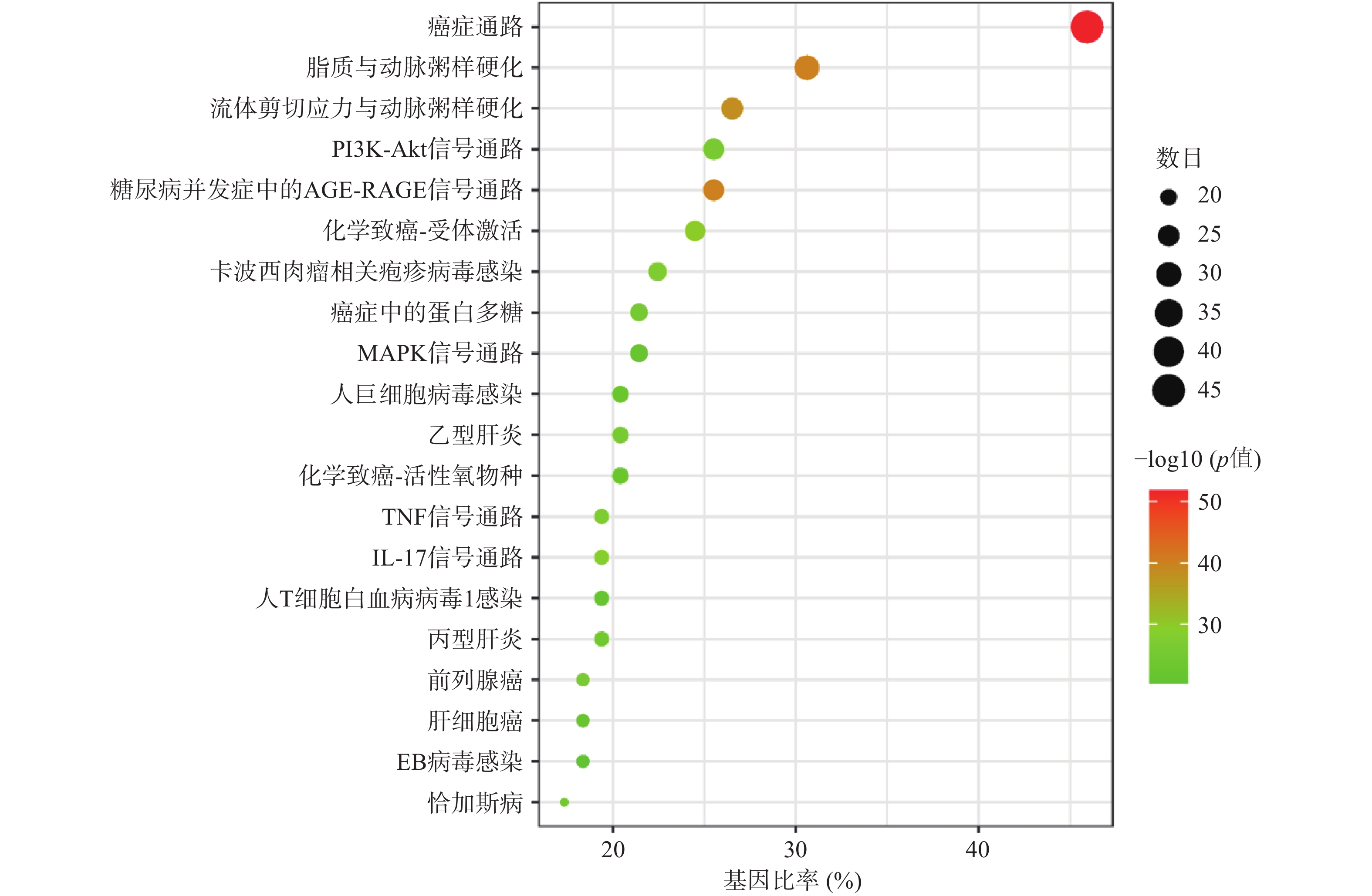
KEGG富集分析获得225个信号过程,根据富集的基因数进行降序排列,选取前20个条目建立气泡图(图4),KEGG富集分析主要涉及的信号通路有PI3K/AKT信号通路,IL-17信号通路,AGE/RAGE信号通路,MAPK信号通路等,说明青蒿治疗肾阴虚型GIOP可能是从多条信号通路联合发挥作用的,其中PI3K/AKT信号通路上富集的共同靶点最多。
-
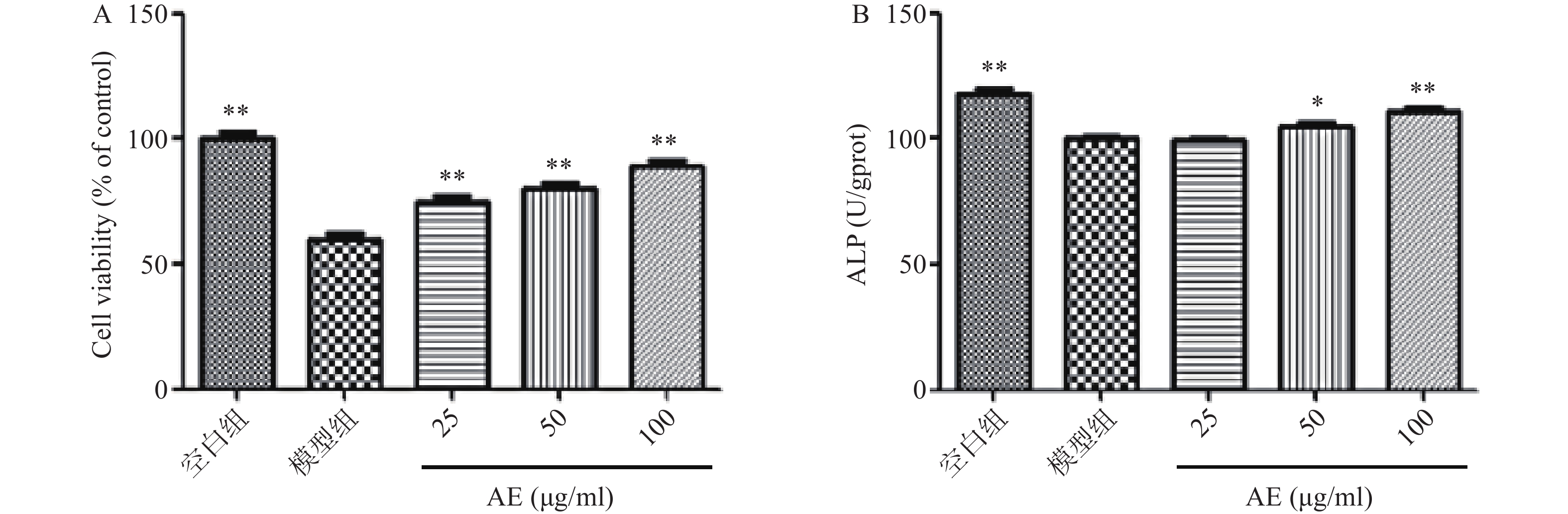
DEX损伤成骨细胞后,其增殖能力及ALP活性显著降低。药物治疗后,青蒿提取物可显著促进DEX损伤的成骨细胞的增殖,提高ALP活性,促进DEX损伤的成骨细胞的增殖(图5)。
-
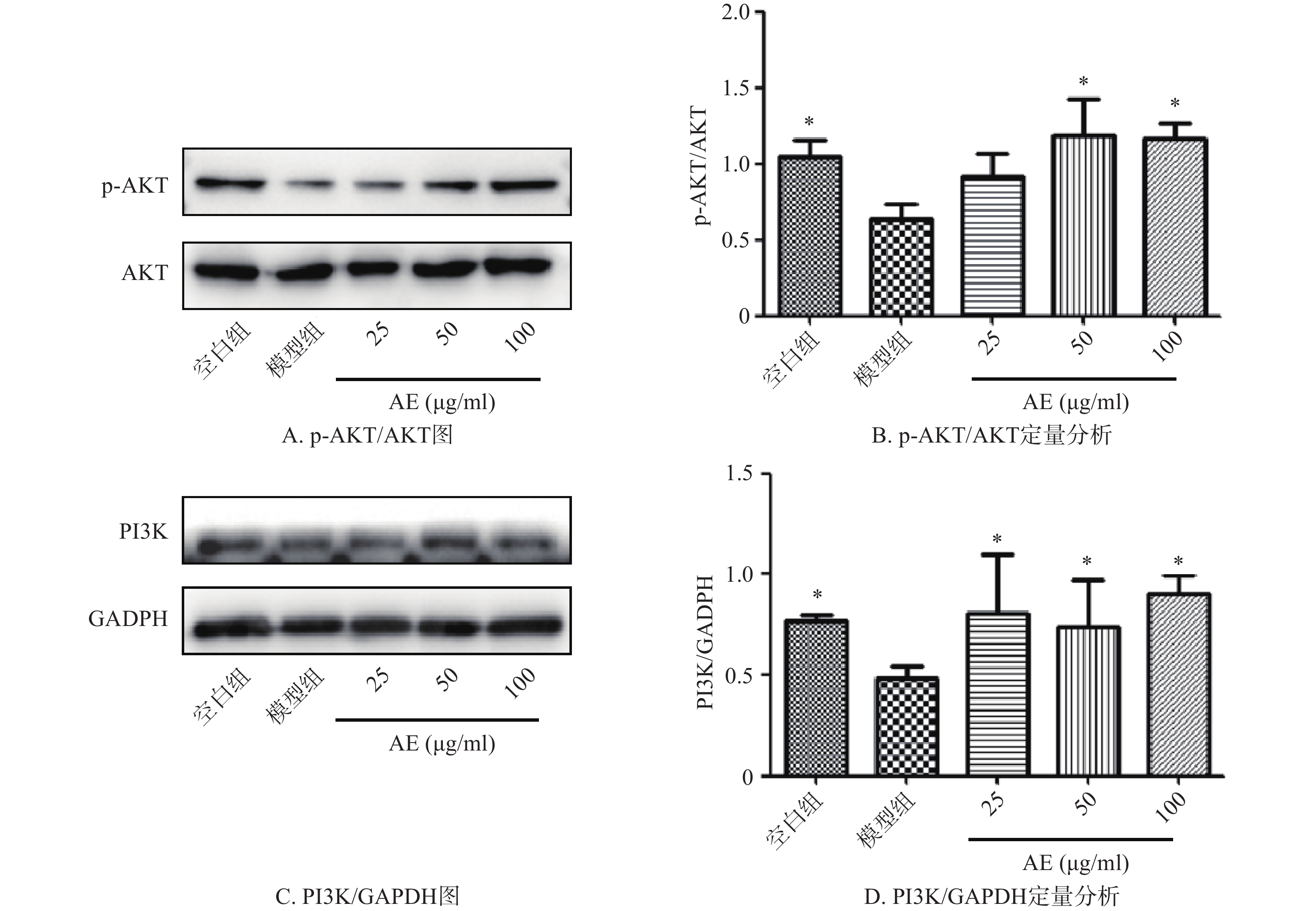
药物处理DEX损伤的成骨细胞48 h后,Western blot结果显示,与空白组比较,模型组p-AKT/AKT比值、PI3K蛋白表达水平明显下降,给予青蒿提取物治疗后,p-AKT/AKT比值、PI3K蛋白表达水平明显提高(图6)。
-
研究发现,PI3K/AKT通路与氧化应激有密切的联系,一方面,过量的活性氧(ROS)可抑制AKT的磷酸化[15],另一方面,磷酸化的AKT也可以通过Nrf2/HO-1通路抑制氧化应激[16]。在OP的治疗药物探索过程中,抗氧化是一条重要的线索,如啤酒花中的黄腐酚,杜仲中的绿原酸,黄连中的小檗碱,其抗骨质疏松的机制均与抗氧化有关[17-19],现代药理研究已经证明青蒿具有抗氧化,抗炎,调节免疫等作用[20-21],但青蒿中化学成分众多,虽然目前多以倍半萜类成分青蒿素含量作为其质量评价标准[22]。然而,除了倍半萜类成分外,青蒿中还存在黄酮类成分、有机酸类成分等等[23],青蒿的抗肾阴虚型GIOP的机制可能与抗氧化有关。研究发现,倍半萜类成分、黄酮类成分、有机酸类成分均存在一定的抗氧化效果[24-27],青蒿的抗肾阴虚型GIOP的机制可能与抗氧化有关。因此,研究青蒿是否在抗OP方面存在作用,青蒿中哪种单体成分在其抗OP的过程中起主要作用值得进一步探究。
本研究以网络药理学为基础,初步筛选出了青蒿抗肾阴虚型GIOP的98个共同靶点,通过拓扑分析,筛选出了17个核心靶点。GO分析和KEGG富集分析发现这些共同靶点参与了多个生物学过程,且参与PI3K/AKT,IL-17,AGE/AGE,MAPK等多个信号通路,其中PI3K/AKT信号通路上富集的共同靶点最多。研究表明,PI3K/AKT信号通路可通过影响成骨细胞的增殖和分化,抑制OP的发生[28]。本研究体外实验亦证实青蒿可以促进DEX损伤的成骨细胞的增殖和分化,激活PI3K/AKT信号通路,促进AKT的磷酸化,验证了网络药理学的预测结果,为后续青蒿抗GIOP研究提供了科学依据。
Mechanism of Artemisia annua L. in GIOP with kidney-yin deficiency based on network pharmacology
-
摘要:
目的 通过网络药理学和体外实验,对青蒿治疗肾阴虚型糖皮质激素性骨质疏松(GIOP)的潜在作用靶点及相关信号通路进行预测和初步验证。 方法 通过TCMSP数据库和Uniprot数据库获取青蒿药物靶点并确定目标靶点基因名;通过GeneCards数据库、OMIM数据库和Drugbank数据库获取肾阴虚型GIOP的靶点基因,与药物靶点基因交叉分析获得共同作用靶点基因;利用String数据库构建蛋白质-蛋白质相互作用(PPI)网络,并利用Cytoscape软件进行可视化分析和核心靶点筛选;通过Metascape数据库对所有共同靶点进行基因本体(GO)和京都基因与基因组百科全书(KEGG)富集分析,最后通过体外实验对预测结果进行验证。 结果 筛选出98个青蒿治疗肾阴虚型GIOP的作用靶点,其中核心基因17个。GO和KEGG功能富集分析结果表明,青蒿治疗肾阴虚型GIOP与激素应答、细胞死亡的正向调节和细胞外刺激应答等生物过程,以及PI3K/AKT、AGE/RAGE、MAPK和IL-17等信号通路有关,其中PI3K/AKT信号通路上富集的基因数最多。体外实验结果显示,青蒿可以促进地塞米松(DEX)损伤的成骨细胞的增殖,提高碱性磷酸酶(ALP)活性,激活PI3K/AKT通路,促进AKT的磷酸化。 结论 青蒿治疗肾阴虚型GIOP具有多靶点‐多通路的特点,可以通过多条途径促进成骨细胞的增殖、分化,其中PI3K/AKT信号通路是一条重要的通路,青蒿治疗肾阴虚型GIOP可能与其能够促进PI3K/AKT信号通路,促进AKT的磷酸化有关。 -
关键词:
- 青蒿 /
- 肾阴虚 /
- 糖皮质激素性骨质疏松 /
- 地塞米松 /
- 成骨细胞
Abstract:Objective To predict and preliminarily verify the potential targets and related signaling pathways of Artemisia annua L. in treating glucocorticoid-induced osteoporosis (GIOP) with kidney-yin deficiency by network pharmacology and in vitro experiments. Methods The pharmacological targets of Artemisia annua L. were obtained from TCMSP database and were converted to gene names through Uniprot database. The target genes of GIOP with kidney-yin deficiency were obtained from GeneCards database, OMIM database and Drugbank database, and the common target genes were obtained by cross analysis with drug target gene. Protein-protein interaction (PPI) network was constructed by String database, and visualization analysis and core targets screening were performed by Cytoscape 3.9.0. All common targets were analyzed by Gene Ontology (GO) and Kyoto Encyclopedia of Genes and Genomes (KEGG) functional enrichment analysis through Metascape database. Finally, the prediction results were verified by in vitro experiments. Results Ninety-eight targets of Artemisia annua L. to GIOP with kidney-yin deficiency were screened, including 17 core genes. The results of GO and KEGG functional enrichment analysis indicated that Artemisia annua L. treating GIOP with kidney-yin deficiency was related to biological processes such as hormonal response, positive regulation of cell death and extracellular stimulation response, et al, as well as signaling pathways such as PI3K/AKT, AGE/RAGE, MAPK and IL-17 et al. The number of genes enriched in PI3K/AKT signaling pathway was the largest. In vitro experiment results showed that Artemisia annua L. promoted the proliferation of osteoblasts damaged by dexamethasone (DEX), increased alkaline phosphatase activity, activated PI3K/AKT pathway, and promoted the phosphorylation of AKT. Conclusion Artemisia annua L. treating GIOP with kidney-yin deficiency has the characteristics of multi-targets and multi-pathway, which could promote the proliferation and differentiation of osteoblasts through multiple pathways. The PI3K/AKT signaling pathway is an important pathway. Artemisia annua L. treating GIOP with kidney-yin deficiency might be related to its ability to promote the PI3K/AKT signaling pathway and promote the phosphorylation of AKT. -
药物利用研究(DUR)是促进用药安全、有效和经济的重要手段[1]。随机对照临床试验(RCT)作为评价药物安全性、有效性的金标准,在外推至日常诊疗环境时往往面临挑战。作为RCT的重要补充,真实世界研究(RWS)考察日常诊疗环境中产生的真实世界数据(RWD),注重评价药物使用的“安全性”和“有效性”,已经成为药物利用研究的热点[2]。RWS着眼于应用到医疗实践环境中,大大缩短了试验周期、降低了成本,真实世界实效性临床研究更加易于获取全面的病例数据,使其结果更具有可靠性及可行性[3]。应当正确认识两者关系,将两者作为互补且相辅相成的研究方法和手段来为药物利用评价和监管评价等方面提供循证支持[4-7]。
随着医院管理信息系统(HIS)的高速发展以及高新传感器技术在生物医疗领域探索运用,使得逐步精准化、数字化患者的各项检查及健康诊疗数据成为现实,并进一步完善患者诊疗、实验室检查以及用药信息等全生命周期的医疗记录,且便于追溯及交互关联[2]。尽管数据库技术及大数据挖掘服务于药物安全性、有效性等方面研究成为现实,但应用于DUR尚缺乏具体的技术指导方案、自然流程等。本研究借鉴国内外RWS在药品器械上市后适应证开发及安全性评价方面的做法,梳理DUR中RWS有效技术手段和方法路径,为RWS更好的服务于DUR提供借鉴和参考。
1. 相关概念
DUR是按照预定的标准,评价、分析和解释一个给定的医疗卫生制度下药物利用的模式、质量、影响因素和结果,着重于药物的市场销售、分配、处方和使用情况,强调由此产生的医疗、社会和经济方面的结果。广泛应用于药物流行病学、抗菌药物管理、药物监测、药物警戒等方面的研究。2020年4月,国家药监局发布《真实世界证据支持药物研发与审评的指导原则(试行)》[8],对RWD、真实世界证据(RWE)以及RWS等概念做了相关阐述[8-9]。RWS作为实现从RWD到RWE的有效手段,是连接两者的桥梁[10]。然而,大规模的数据并不一定就能产生有价值的证据,只有通过适用性评估的RWD、分析得出医疗产品的使用和潜在收益或风险的临床证据时才有可能使数据转变为证据[11-12]。数据适用性即从数据使用者角度出发,评价数据满足使用者需求的程度[13],强调数据质量在开展相应RWS方面的可应用程度[14]。
2. 真实世界药物利用研究现状
2.1 真实世界研究与药物利用研究结合现状
国家药品监督管理局自2014年起就陆续出台多项措施,支持RWS用于医疗器械评价、药物审评、研发及监管决策,完善医疗器械不良事件监测和再评价制度,并联合高校、医联体推进多项试点工作的开展,出台了《真实世界研究支持儿童药物研发与审评的技术指导原则(试行)》[15]等法规文件以推进RWS。目前RWS主要集中在以下3个方面:①药物治疗效果[16-17],RWS在药物疗效、不良事件、安全可靠方面的结果研究,以满足药物对人类临床应答的解释以及推广方面应用;②指南或临床实践[18-20],国内外权威的指南是临床实践的重要参考依据,RWS也可用于协助制定和修订患者治疗方案,而RWE有利于指南更加科学性和具有实践性。此外,RWS还可以用于协助政府部门管理的指导性文件的制定;③经济效益[21-23],RWS应用于卫生经济学中筛选研究和治疗选择等方面,帮助医师制定最优的药物治疗方案,并提供合理的经济成本。此外,RWS在帮助制定个性化医疗政策方面也具有很大的潜力。
2.2 真实世界研究体系现状
国际上,随着药品审评和监管标准的不断提高,越来越多的研究者重视RWS,目前已经形成了良好的研究体系,比如美国的以患者为中心的结局研究所(PCORI)和欧盟临床试验公共注册和结果数据库(EUPAS)。RWS主要集中于:①在研究用药的随机对照试验、观察性研究及实践指南中的应用;②在疾病的发病风险评估、医疗健康保险的应用。目前国内的RWS主要涉及:①在中医方面的应用研究[24-26],包括中药的药物疗效及不良反应的研究;②基于医院信息数据库疾病及其合并疾病的用药特征的分析;③在医疗大数据及循证医学方面的应用[27-29]。
RWS的研究设计和方法学也不断完善,近年来不少国家或国际组织都陆续出台关于RWS的指南以及指导原则,提高了RWS的质量和可靠性,比如美国 FDA[30-31]、欧洲EMA[32],英国NICE[33]。
3. 真实世界研究在药物利用研究中的应用
3.1 真实世界药物利用研究的方法
3.1.1 数据来源及研究问题
RWS收集真实诊疗数据或者基于已经存在的研究型数据库或数据研究平台,建立登记数据库,针对具体研究问题,运用循证医学方法,开展数据分析,从而回答验证假设[34-36]。RWD通常来自于以上一个或多个数据库,包含需要主动收集的数据以及常规诊疗行为产生的临床数据。随着医学大数据的快速发展,一些研究型数据库或数据研究平台也逐步拓展,目前,国内外利用公共数据库如SEER、MIMIC等进行相关研究已成为RWS的重要发展方向。
RWS通常基于研究目的建立研究数据库或数据集,研究要素一般包含目标患者人口学特征、用药信息、门诊、住院信息、实验室检查、治疗转归与结局,以及其他研究目的所涉及到的临床治疗、护理、手术处置等信息。如果数据来自多个不同数据库,还必须通过如患者身份证号码、住院号/检查号、姓名等患者唯一标识码进行辨识和数据关联。如果研究的资料内容涉及到患者的个人信息等情况,还要注意取得伦理学审核以及保护患者隐私[37-41]。真实世界DUR的药品数据通常通过ATC编码来规范,采用用药依从性,限定日剂量(DDD)、平均治疗天数(ATD)、总DDD数、处方年费用等DUR指标[42]。基于药物效果和安全性研究、经济学和药物政策、多个疾病和多个治疗方案的复杂病情分析是当前真实世界药物利用研究的一个热点。
RWS作为一项非随机、开放性、不使用安慰剂的研究。为了挖掘真实的临床医疗环境产生的诊疗数据,应把质量控制作为全局指标来进行把握,并从研究伊始就建立起全面的数据质量控制方案并严格遵守。同时,在研究中详细记录异常情况[43],还要注意数据清洗以及混杂因素的控制,如此才能保证研究证据的质量及等级[44]。
3.1.2 研究人群及纳排标准
RWS人群纳入条件较为宽松,但仍在研究中需要明确与研究目的相关或可能影响研究的因素,以及纳入及排除标准的研究时间段和制定日期。研究通常通过WHO国际疾病分类(ICD-9/10)筛选研究人群。研究人群通常为患有特定疾病的患者、药物使用者(罕见病、孕妇、儿童等)以及患有多种疾病的复杂病例或有多种伴随症状的人群。有时候为解决研究对象以往接受过某种治疗措施可能导致的选择偏倚,还需要考虑遵照首次用药人群的设计[45]。最后,研究者需谨慎纳入和排除标准,以免直接影响研究结果的外推。
研究者应当严格参照PICOTS原则明确的6个关键点(总体、干预、比较对象、结果、时间和场所),同利益相关者一同提出针对研究问题可利用的科学方法[46]。
3.1.3 真实世界药物利用研究设计
观察性研究设计是RWS中广泛使用的设计类型之一[44],常见的有前瞻性观察研究[47]、回顾性队列研究[18,48]、Meta分析[49]等。根据不同的研究目的和研究对象,可以选择适合的研究方法和样本来源,通常需要开展大规模、跨学科的合作,以确保研究结果的可靠性和科学性。RWS设计时要结合研究目的来具体确定研究要素,综合考虑年龄、混杂偏倚和特殊人群、药品ATC编码,以及病历等非结构化数据。设计通常包括以下几个阶段:①定义问题:在研究开始之前明确研究的目的和问题,确定研究的对象、变量和数据采集方式。需要考虑研究的可行性、科学性和意义。②研究设计:根据定义的问题,制定设计方案。明确设计类型、样本容量、数据采集方式、结局指标以及数据分析方法等。③招募研究对象:确定研究对象的选择标准,并依照这些标准进行样本招募。④数据收集和管理:采集所需的研究数据,将收集到的数据进行规范化、清洗、质量控制和审查等处理。⑤数据分析:使用统计学方法进行数据分析,包括描述性统计、回归分析、生存分析和成本效益分析等。⑥结果解释和推广:将研究结果进行整合、解释和推广,发表研究报告和文章,向目标受众,如医师、政策制定者、患者和公众等,传达研究结论和建议。
3.1.4 特征变量及评价指标
RWS设计阶段应该充分了解现有数据的优缺点,并恰当合理的定义并描述暴露因素,尽可能的收集与暴露相关的特征指标。RWS结局指标是评估一种治疗或干预措施在真实医疗实践中的效果和安全性以及相关临床和经济结果的指标。
通常有以下几种结局指标:①主要疗效结局:主要的成果、结果或效果指标。例如,治疗效果、复发率、临床终点事件;②次要疗效结局:主要疗效结局之外的其他疗效结果或事件。如总体存活率(OS)、无进展生存期(PFS)、无病生存期(DFS)、疾病进展时间(TTP)、治疗失败时间(TTF)、死亡率,住院时间等[50];③安全性结局[12,51]:一般采用药物不良反应(ADR)、不良反应发生率(IRs,通常以1000人/年表示)[12]、危险性信号、药物相互作用等;④经济学结局[52-53]:包括成本效益和成本效用评估、日均费用、医疗保险、社会资源利用及患者的自付费用等。
选取结局指标时需要根据研究目的和研究对象,进行目标导向和可行性评估。常规首选应该是临床意义明确和易于全面评估的主要疗效结局,同时可以考虑次要疗效结局和安全性结局作为辅助评估。为综合评估治疗效果和成本并获得系统的经济评估结果,相关经济学方面的评价指标也应该考虑进来。
3.2 统计及敏感性分析
通常对目标患者群体和治疗模式进行描述性统计分析,分析各分类变量的频率、百分比,以及在连续区间尺度上测量的变量平均值、标准差、中位数及范围,有学者应用Kaplan-Meier(KM)生存函数进行相关生存分析[54]。针对研究目标确定分析要素,选用合适的统计分析方法,如卡方检验、logistic回归和多元线性回归等,对治疗结局、暴露因素、协变量数据类型及分布情况进行校正分析。由于所有研究结果基于假设提出,而这些假设往往是推论真实性的依据。研究者需对数据的局限性和问题本质有清晰认识,研究过程中对假设进行调整,评价观察结果对特定假设的敏感度或方向大小上的一致性。
3.3 混杂因素及偏倚控制
3.3.1 混杂因素
RWD来源包含电子病历、医保数据库、生命体征记录、医学图像等,存在许多复杂的混杂因素。混杂因素可能的类型包括个体基线特征、随时间变化的特征、医疗诊断和治疗、环境因素。常见的混杂控制策略包括随机对照、匹配分析、协变量校正、倾向值和剂量反应模型等。除此之外,在实施RWS时,还要注意有代表性的样本选择,对数据质量和分析偏倚进行评估和控制,以获得准确和可靠的研究结论。
3.3.2 偏倚控制
RWS是在真实临床环境下进行的研究,目标人群的治疗措施因非随机分配影响内部真实性,虚弱个体治疗措施与结局之间的关联性等,使得其研究结果可能存在一定的偏倚,这些偏倚可能影响研究的可靠性和有效性。常见的偏倚类型包括选择性偏倚、信息偏倚[55]、报告偏倚、记忆偏倚等,常见的偏倚控制方法有模拟试验、设计分层、倾向值匹配、重复量表、级联分析等。
4. 展望
真实世界DUR作为一种新兴的药物评价方法,可将从真实世界环境下收集和分析的大量数据利用起来,通过实效性、回顾性研究使得过往产生的既有诊疗数据进一步提炼成RWE而二次利用。通过研究分析获得的循证医学证据,可以为DUR提供有价值的依据,帮助优化药物使用、个体化医疗、提高患者结局、降低医疗费用、促进医学的健康发展;也可采用前瞻性研究大样本或特殊人群,为其更好、更安全有效用药提供证据。
同时,RWS也是评价药物滥用的有效手段。随着大数据和医疗技术的不断发展,RWS将会成为药物治疗效果、患者治疗策略和临床实践方面重要的研究领域,并将不断地推动医药的创新、优化和进步。
值得注意的是,RWS是一项复杂的研究工作,需要具备较强的统计、数据挖掘和医学知识背景,同时也面临着数据质量、缺失值、样本匹配和结果影响因素多等问题。因此,在实施RWS时,需要有效的科学设计、广泛报告,同时进行敏感度分析和可能存在的偏差分析,为制定更加科学和有效的药物治疗方案提供科学支持。
-
表 1 青蒿主要活性成分
分子名称 生物利用度(%) 药物相似度(DL) 新西兰牡荆苷_qt 59.85 0.21 醋酸酯 58.02 0.52 脱氧青蒿素 54.47 0.26 青蒿烯 54.36 0.31 万寿菊素 53.11 0.34 牡荆黄素_qt 52.18 0.21 泽兰黄醇素 50.8 0.41 双氢青蒿素 50.75 0.3 青蒿素 49.88 0.31 异鼠李素 49.6 0.31 青蒿亭 49.55 0.48 茵陈黄酮 48.96 0.41 槲皮素 46. 43 0.28 维采宁-2_qt 45.84 0.21 豆甾醇 43.83 0.76 线蓟素 43. 46 0.34 六氟磷酸钠 42.6 0.37 山奈酚 41.88 0.24 谷甾醇 36.91 0.75 木犀草素 36.16 0.25 怪柳黄素 32.86 0.31 玄参黄酮 30.35 0.3 表 2 “青蒿-肾阴虚型GIOP”核心靶点信息
靶点信息 简称 度中心度
(DC)介度中心度
(BC)RAC-α丝氨酸/苏氨酸
蛋白激酶AKT1 84 495.8247 肿瘤坏死因子 TNF 83 336.63745 白细胞介素-6 IL6 81 281.4354 细胞肿瘤抗原p53 TP53 79 273.47903 血管内皮生长因子A VEGFA 78 200.2001 白细胞介素-1β IL1B 76 199.86818 基质金属蛋白酶-9 MMP9 73 146.52397 转录因子AP-1 JUN 71 167.16982 前列腺素G/H合成酶-2 PTGS2 71 140.30101 半胱氨酸蛋白酶-3 CASP3 71 120.33017 表皮生长因子受体 EGFR 68 294.5016 表皮生长因子 EGF 67 107.6285 白细胞介素-8 CXCL8 67 127.67476 雌激素受体 ESR1 65 251.7144 C-C基序趋化因子配体 CCL2 65 101.49248 过氧化物酶体增殖物
激活受体γPPARG 63 118.61439 血红素氧合酶-1 HMOX1 59 156.89531 -
[1] KANIS J A, COOPER C, RIZZOLI R, et al. European guidance for the diagnosis and management of osteoporosis in postmenopausal women[J]. Osteoporos Int, 2019, 30(1): 3-44. doi: 10.1007/s00198-018-4704-5 [2] 中国健康促进基金会骨质疏松防治中国白皮书编委会. 骨质疏松症中国白皮书[J]. 中华健康管理学杂志, 2009, 3(3): 148-154. [3] 邓微. 骨质疏松为何偏爱女性[J]. 江苏卫生保健, 2021, 23(11): 10. [4] 叶丹. 骨质疏松药物治疗的研究进展[J]. 牡丹江医学院学报, 2021, 42(1): 148-151. [5] 姚曼, 林玩福, 程彬彬. 糖皮质激素性骨质疏松症的中西医研究进展[J]. 中华中医药学刊, 2015, 33(7): 1606-1609. [6] 赖丽钧. 糖皮质激素性骨质疏松症的中医证型分布特点[J]. 中医临床研究, 2020, 12(12): 123-124, 126. [7] 张兴. 认识身边的中药: 青蒿[J]. 中医健康养生, 2021, 7(4): 26-27. [8] 马玉超. 青蒿汤加减联合糖皮质激素治疗轻中型系统性红斑狼疮的疗效观察[J]. 实用中西医结合临床, 2022, 22(2): 43-45. [9] 张蕾, 易春艳, 唐明秀, 等. 浅谈青蒿在激素依赖性皮炎中的运用[J]. 世界最新医学信息文摘, 2017, 17(34): 161, 163. [10] ZHANG J. The osteoprotective effects of artemisinin compounds and the possible mechanisms associated with intracellular iron: a review of in vivo and in vitro studies[J]. Environ Toxicol Pharmacol, 2020, 76: 103358. doi: 10.1016/j.etap.2020.103358 [11] 沈自尹, 王文健. 中医虚证辨证参考标准[J]. 中西医结合杂志, 1986, 6(10): 598. [12] 谭余庆, 赵一, 林启云,等. 青蒿提取物抗内毒素实验研究[J]. 中国中药杂志, 1999, 24((3):): 166-171. [13] 张静修, 戴克逊, 赵一. 青蒿浸膏抗疟实验研究[J]. 广西中医药, 1978, 1(4): 57-60. [14] GU G, HENTUNEN T A, NARS M, et al. Estrogen protects primary osteocytes against glucocorticoid-induced apoptosis[J]. Apoptosis, 2005, 10(3): 583-595. doi: 10.1007/s10495-005-1893-0 [15] DENG S, DAI G, CHEN S, et al. Dexamethasone induces osteoblast apoptosis through ROS-PI3K/AKT/GSK3β signaling pathway[J]. Biomed Pharmacother, 2019, 110: 602-608. doi: 10.1016/j.biopha.2018.11.103 [16] HAN D D, CHEN W, GU X L, et al. Cytoprotective effect of chlorogenic acid against hydrogen peroxide-induced oxidative stress in MC3T3-E1 cells through PI3K/Akt-mediated Nrf2/HO-1 signaling pathway[J]. Oncotarget, 2017, 8(9): 14680-14692. doi: 10.18632/oncotarget.14747 [17] SUN X L, XIA T S, ZHANG S Y, et al. Hops extract and xanthohumol ameliorate bone loss induced by iron overload via activating Akt/GSK3β/Nrf2 pathway[J]. J Bone Miner Metab, 2022, 40(3): 375-388. doi: 10.1007/s00774-021-01295-2 [18] HAN D D, GU X L, GAO J, et al. Chlorogenic acid promotes the Nrf2/HO-1 anti-oxidative pathway by activating p21Waf1/Cip1 to resist dexamethasone-induced apoptosis in osteoblastic cells[J]. Free Radic Biol Med, 2019, 137: 1-12. doi: 10.1016/j.freeradbiomed.2019.04.014 [19] SHAO J J, LIU S B, ZHENG X, et al. Berberine promotes peri-implant osteogenesis in diabetic rats by ROS-mediated IRS-1 pathway[J]. Biofactors, 2021, 47(1): 80-92. doi: 10.1002/biof.1692 [20] 徐明霞. 青蒿素及其衍生物在动物生产中的应用研究[J]. 饲料研究, 2021, 44(4): 147-149. [21] SKOWYRA M, GALLEGO M G, SEGOVIA F, et al. Antioxidant properties of Artemisia annua extracts in model food emulsions[J]. Antioxidants (Basel), 2014, 3(1): 116-128. doi: 10.3390/antiox3010116 [22] 张秋红, 朱子微, 李晋, 等. 中药青蒿化学成分与种植研究现状[J]. 中国医药导报, 2011, 8(19): 10-12. [23] 赵祎武, 倪付勇, 宋亚玲, 等. 青蒿化学成分研究[J]. 中国中药杂志, 2014, 39(24): 4816-4821. [24] FAROMBI E O, ADEDARA I A, ABOLAJI A O, et al. Sperm characteristics, antioxidant status and hormonal profile in rats treated with artemisinin[J]. Andrologia, 2014, 46(8): 893-901. doi: 10.1111/and.12170 [25] 王伟, 何平, 江小明. 木犀草素及其黄酮苷的抗炎、抗氧化作用[J]. 食品科学, 2020, 41(17): 208-215. [26] 周蕙祯, 汤良杰, 龚宇, 等. 瑞香狼毒花化学成分及其抗氧化活性研究[J]. 中草药, 2020, 51(9): 2395-2401. [27] CAO Z Y, DING Y, CAO L, et al. Isochlorogenic acid C prevents Enterovirus 71 infection via modulating redox homeostasis of glutathione[J]. Sci Rep, 2017, 7(1): 16278. doi: 10.1038/s41598-017-16446-7 [28] 史东梅, 董明, 陆颖, 等. PI3K/Akt信号通路与骨破坏: 问题与机制[J]. 中国组织工程研究, 2020, 24(23): 3716-3722. -





 下载:
下载: