-
在正常条件下,大部分肝细胞处于静止状态(G0期),通常很少进入有丝分裂期。一旦肝细胞受到手术切除和药物等应激的刺激,它们会迅速对促分裂原产生反应,过渡到有丝分裂期,并开始增殖[1-4]。肝细胞增殖不仅是肝脏自我修复和再生的基础,也是应对慢性肝炎、肝硬化以及药物性肝损伤(DILI)等多种损害的重要机制。研究表明,肝脏出现病理性损伤后产生多种肝细胞因子,例如纤维蛋白原样蛋白(FGL1)、Hepassocin、肝细胞生长因子(HGF)等,在促进肝细胞增殖方面发挥重要作用[5-8]。例如,FGL1通过激活细胞增殖相关的信号通路促进肝细胞的再生,从而加速肝脏的修复[9]。此外,Hepassocin通过自分泌机制促进肝细胞生长[6]。这些研究提供了肝脏疾病治疗的新思路,尤其是调控这些肝细胞因子来加速肝功能的恢复。
Orosomucoid-1(ORM1),也称为α-1-酸性糖蛋白1(AGP1),作为一个已知的肝细胞因子[10],是一种主要由肝脏合成分泌的急性期蛋白,在应激条件下(如组织损伤和炎症)显著升高,具有调控细胞外基质(ECM)、调节糖代谢、维持血管通透性等重要的生物学功能[10-12]。此外,ORM1在结肠腺癌细胞、肝细胞、免疫细胞等多种细胞上,表现出促进增殖的作用[13-15]。但ORM1调控肝细胞增殖的具体作用机制尚不完全明确,有待进一步研究。
为进一步探究ORM1在肝细胞增殖中的具体作用及机制,本研究首先在两种肝细胞系上验证了ORM1促进肝细胞增殖,并通过对ORM1敲除小鼠的肝脏组织测序,挖掘ORM1调控肝细胞增殖的可能机制。本研究旨在揭示ORM1促进肝细胞增殖的潜在功能和机制,为肝脏损伤修复及相关疾病的治疗提供新的分子靶点和理论依据。
-
α1-酸性糖蛋白(美国 Sigma-Aldrich 公司)、CCK8试剂盒(Adamas life)、Lipofectamine 3000试剂(Thermo Fisher Scientific)。
-
小鼠肝癌细胞系Hepa1-6,购自中国科学院细胞库。培养液配方:DMEM、10%FBS、1%双抗生素。培养条件:5%CO2、37 ℃恒温孵育箱。人肝癌细胞系HepG2,购自武汉普诺赛生命科技有限公司。培养液配方:MEM(含NEAA)、10%FBS、1%双抗生素。培养条件:5%CO2、37 ℃恒温孵育箱。
-
细胞接种于96孔板,密度约104/孔,每组复孔为9;ORM1过表达、干扰或人源ORM给药(10、50、100 μg/ml)处理相应时间后,弃去培养基,在细胞贴壁后,使用无血清培养基处理细胞,培养相应时间后,加入CCK8试剂,吸光度测定(Epoch BioTeK酶标检测仪)450 nm处的A值,根据不同组之间的A值计算组间差异。
-
通过LipofectamineTM
3000 将ORM1过表达质粒(序列见NM_008768.2)或siRNA转染进细胞内,以实现过表达或干扰目标基因的目的。当细胞密度达到50%~70%时,进行过表达质粒的瞬时转染实验;当细胞密度达到30%~50%时,进行siRNA的瞬时转染实验。吸取舍弃原培养基后用1×PBS轻柔洗涤细胞1~2次,根据转染条件配制好转染试剂,随后将配置好含有过表达质粒(或siRNA)的DMEM培养基加入至细胞培养基中用于细胞继续培养,最后置于细胞培养箱中孵育24 h(若为转染siRNA,则孵育48 h)即可完成细胞瞬时转染试验。siRNA序列及转染试剂配制方法见表1、表2。表 1 ORM1 siRNA序列
siRNA名称 siRNA序列(5'→3') si-ORM1 CCACCAACUUGAUAAACGATT 表 2 96孔培养板转染条件
培养皿 Opti-MEM (μl) Lipo3000 (μl) DNA转染 RNA转染 DNA (ng) P3000 (μl) RNA (pmol) 96孔板 2×10 0.3 100 0.2 20 -
使用ORM1基因敲除(KO)小鼠和对应的野生型(WT)小鼠(均为C57BL/6背景,n=6)。在小鼠24周龄时采集肝脏组织,液氮速冻并存储于−80°C。RNA-seq委托上海欧易生物公司进行,差异基因分析通过DESeq完成,筛选标准为FoldChange>1.5或<0.66,且P<0.05。
差异基因富集分析通过DAVID进行,进行Kyoto Encyclopedia of Genes and Genomes (KEGG)富集分析。KEGG分析用于揭示差异基因在代谢通路中的富集情况。富集分析筛选标准为P<0.05。
-
实验数据采用GraphPad Prism 9.0软件进行统计与分析。单因素两组之间相互比较,采用双尾非配对t检验(Student’t)检验分析;单因素多组之间相互比较,采用单向方差分析(One-way ANOVA)检验,组间均值两两比较采用Dunnett's multiple comparisons test。实验结果均采用“均数±标准误(Mean±SE)”表示。以P<0.05认为差异具有统计学意义。
-
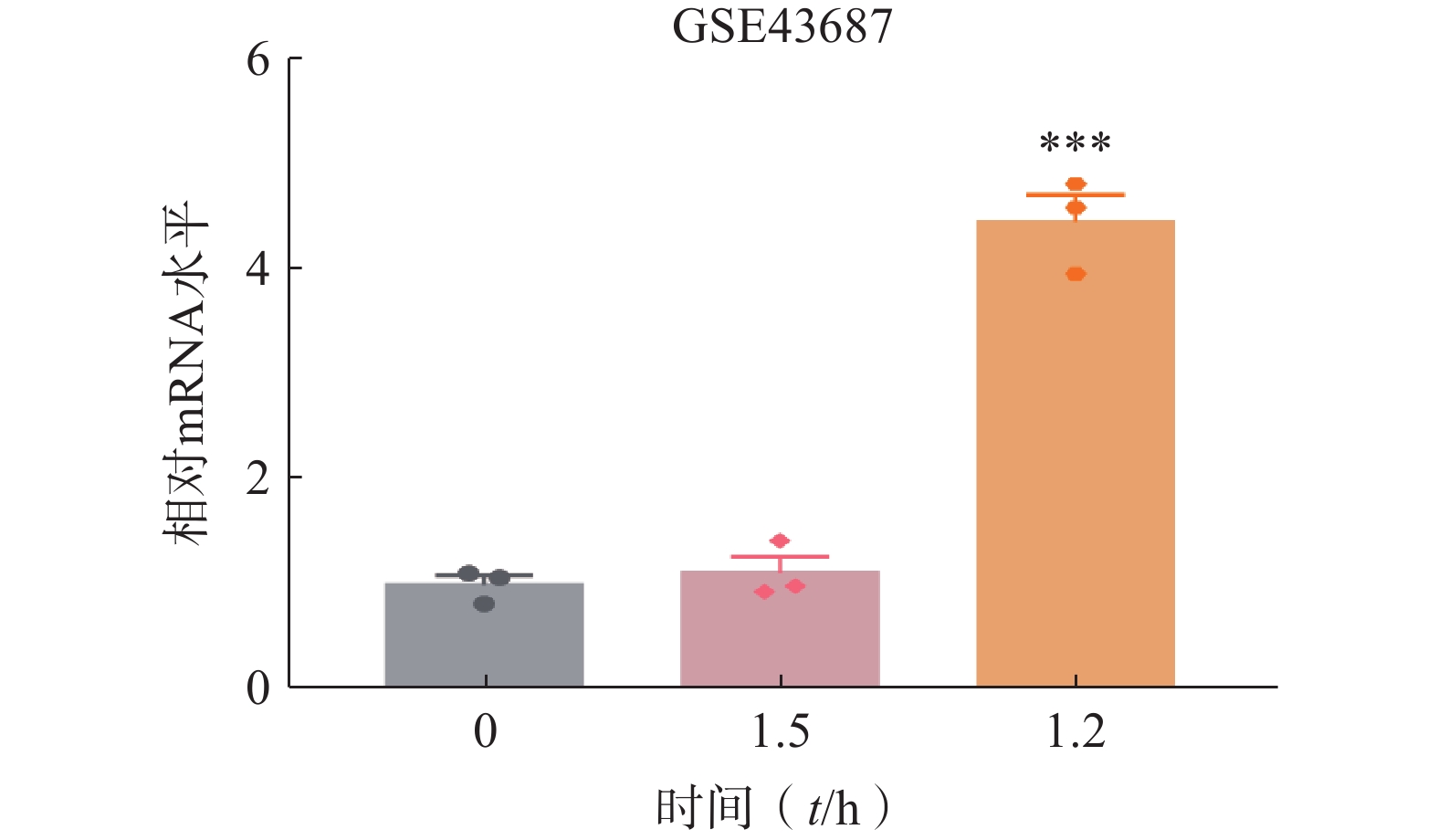
肝脏组织在肝切除术后会进入肝细胞快速增殖状态[16]。通过检索GEO数据库,选取C57BL/6小鼠在2/3肝脏部分切除术(PH)后数据(GSE43687)进行分析。结果显示,肝脏组织中ORM1的表达在PH后1.5 h时无显著变化,在PH后12 h显著上升(图1)。这一结果提示ORM1可能参与肝脏再生过程。
-
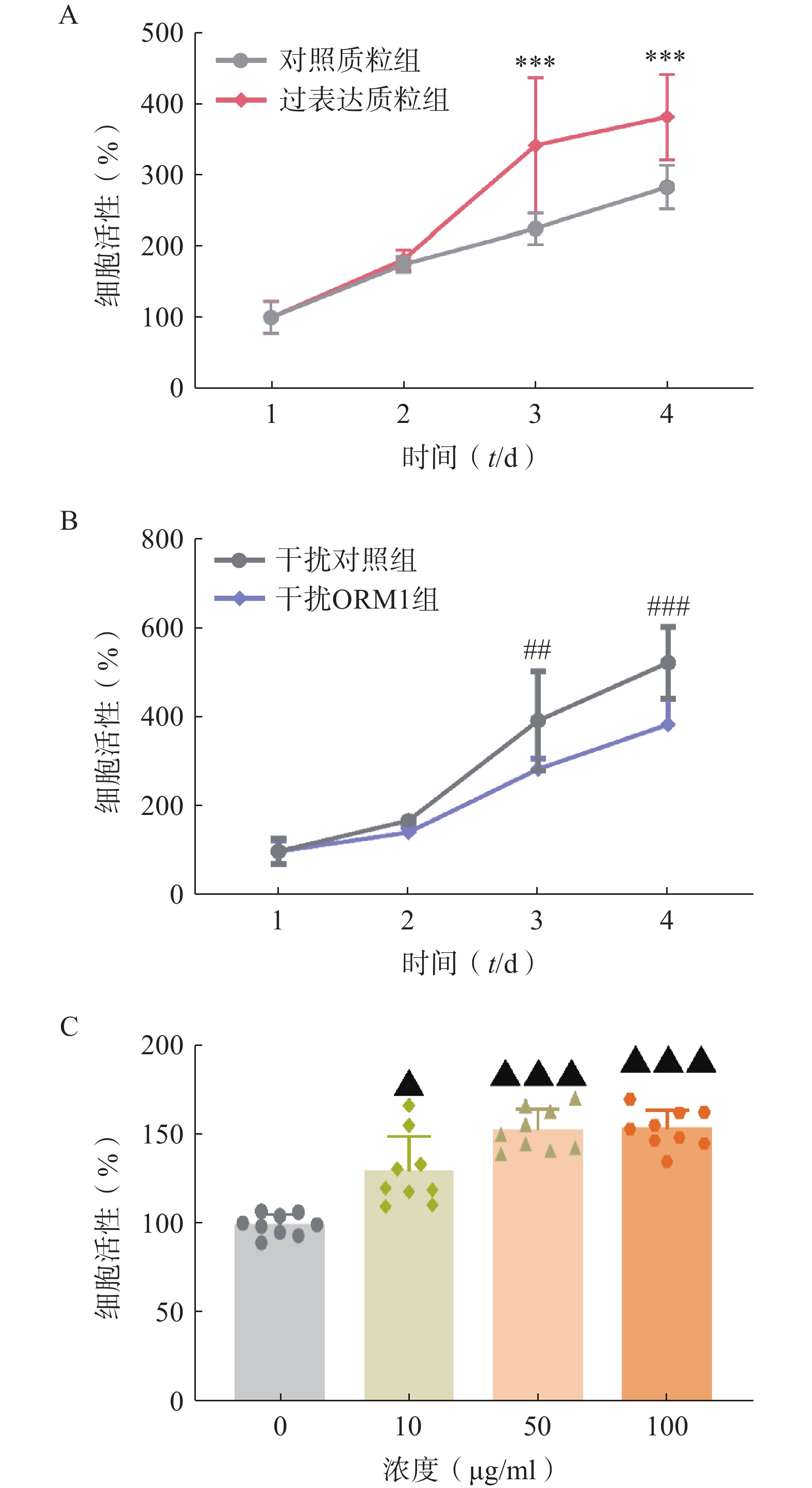
为验证ORM1对肝细胞增殖的影响,我们在小鼠和人的肝细胞系上进行了ORM1过表达、干扰或ORM外源性给药实验。在小鼠Hepa1-6肝癌细胞系过表达ORM1(pCMV-ORM1),与对照质粒组(pCMV)组相比,转染后第3、4天ORM1过表达质粒组的细胞增殖显著增加(图2A)。而干扰ORM1后细胞增殖能力呈现相反的结果(图2B)。人HepG2肝细胞上给予不同浓度外源性ORM,48 h后检测细胞增殖情况,可见随着ORM1浓度的增加,细胞增殖呈现显著上升(图2C)。上述结果表明ORM1对肝细胞增殖具有显著的促进作用。
-
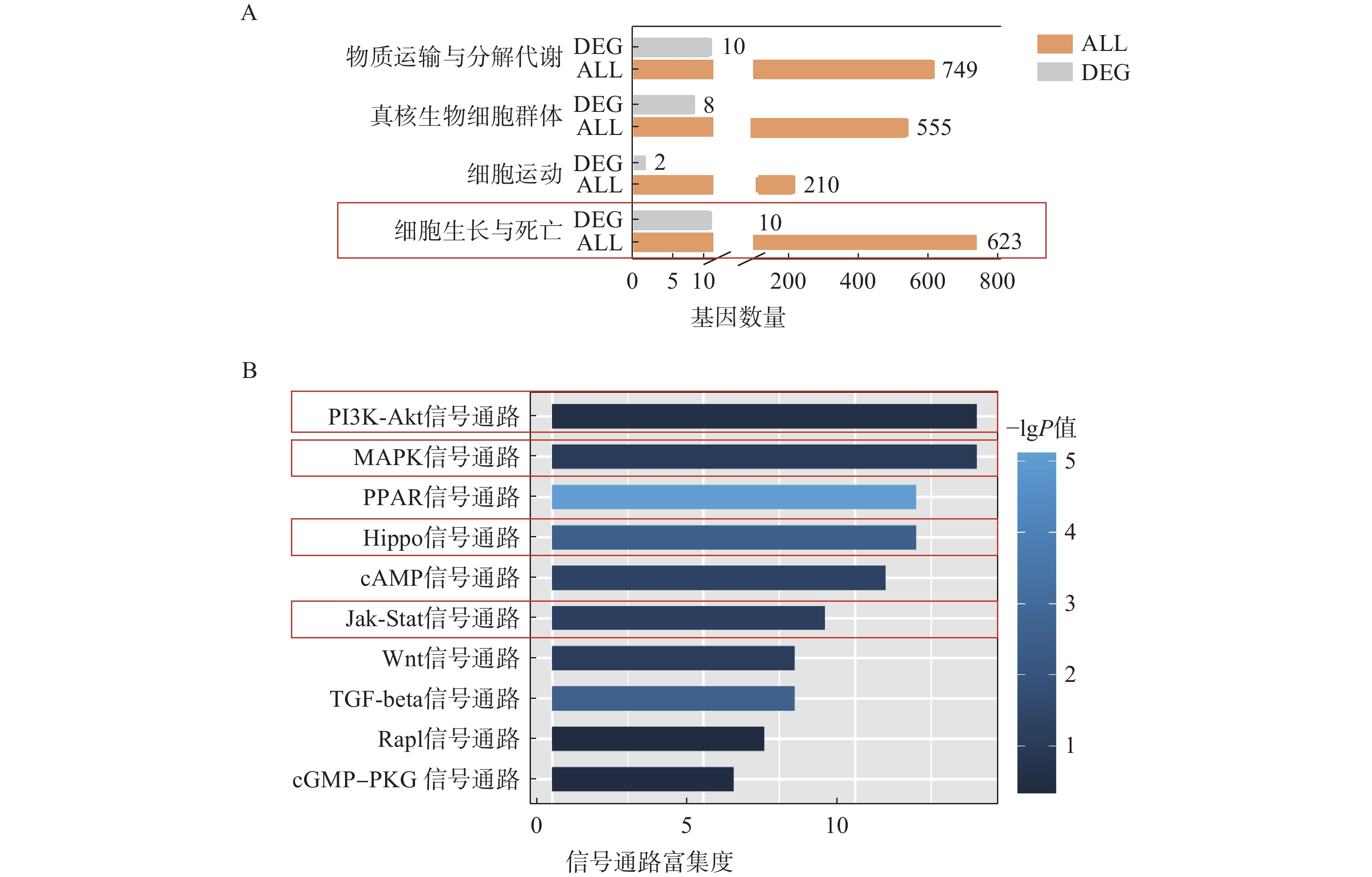
为了进一步探究ORM1基因敲除后对肝脏组织的影响,我们对ORM1基因敲除(KO)小鼠和野生型(WT)小鼠的肝脏组织进行了测序。KEGG富集分析表明,在ORM1基因敲除小鼠与野生型小鼠的比较中,差异表达基因被富集在“细胞生长与死亡”和“细胞运输与自噬”等通路中(图3A),提示ORM1缺失会引起细胞生长和死亡相关的通路相关改变。
进一步信号通路的富集分析显示,PI3K-Akt、MAPK、PPAR、Hippo、Jak-Stat等通路在差异基因表达分析中有显著富集(图3B),其中,PI3K-Akt、MAPK、Hippo、Jak-Stat通路据报道与细胞增殖高度相关[17-19]。这些结果提示,ORM1基因敲除可能影响细胞增殖关键通路,通过调控细胞生长、死亡相关的基因影响肝细胞增殖。
-
为进一步明确ORM1在这些经典通路中的调控机制,我们重点分析了其中与细胞增殖相关的差异基因表达变化。在PI3K-Akt信号通路中,具有促增殖作用的Itgb8和Ntf3显著下调(图4A)。在MAPK信号通路中,同样具有促增殖作用的Map3k6在KO组中显著下调,而抑制细胞增殖作用的Gadd45a则显著上调,Hspa1b和Hspa2下调(图4B)。与之类似,Jak-Stat信号通路中的Il6ra和Lepr具有促增殖作用,其表达在KO组中也显著下调,而有抑制细胞增殖作用的Cish在KO组中的表达显著上调(图4C)。在Hippo信号通路中,具有促增殖作用的Tef7、Tead1、Ctgf在KO组中的表达显著下调(图4D)。这些结果表明,ORM1可能调控PI3K-Akt、MAPK、Jak-Stat和Hippo信号通路中的影响细胞增殖的多种关键信号分子影响肝细胞的增殖。
-
本研究中,我们揭示了ORM1在肝细胞增殖中的潜在调控机制。首先,利用GEO数据库(GSE43687)分析,发现ORM1在小鼠2/3肝切除术后12h表达升高,提示ORM1可能参与肝脏再生。而在体外肝细胞系中,过表达ORM1或外源性给药ORM,可以促进肝细胞增殖;相反,干扰ORM1抑制的肝细胞的增殖,进一步验证了ORM1对肝细胞增殖的促进作用。此外,我们对ORM1基因敲除小鼠组学分析,发现PI3K-Akt、MAPK、Hippo、Jak-Stat等细胞增殖相关通路的多个信号分子在ORM1缺失时表现出显著变化,提示这些关键通路可能参与了ORM1对肝细胞增殖的调控。
在PI3K-AKT信号通路中,Ntf3(neurotrophin-3)主要通过与受体TrkC结合,促进细胞的存活、增殖和分化[20]。ORM1缺失后Ntf3的下调可能导致细胞存活和再生能力减弱。而Itgb8(整合素β8)和Lamc2(laminin subunit gamma-2)作用类似,均是通过与细胞外基质(ECM)蛋白(如纤连蛋白、胶原蛋白等)结合,介导细胞与其周围环境的相互作用,从而影响细胞的增殖和分化[21-22]。ORM1缺失后,Itgb8和Lamc2下调提示ECM重塑减弱,从而无法为新生肝细胞的重新附着与生长提供必要的微环境支持。
在MAPK信号通路中,Gadd45a(growth arrest and DNA damage-inducible alpha)是一种生长停滞和DNA损伤诱导因子,通过抑制细胞周期相关激酶(如CDK1和CDK2),阻止细胞从G1期或G2/M期进入下个阶段[23]。ORM1缺失后Gadd45a上调提示可能出现细胞周期停滞,从而抑制了肝细胞的增殖。Map3k6(mitogen-activated protein kinase 6)作为一种激酶,通过磷酸化MAPK激酶调控下游的信号分子和后续的细胞生物学反应,如细胞增殖、分化、存活、迁移和应激反应[24]。ORM1缺失后Map3k6下调可能导致MAPK通路激活减少。Hspa1b和Hspa2是热休克蛋白,在抑制凋亡通路主要通过抑制线粒体凋亡途径,caspase的活化以及调控JNK信号通路发挥作用;同时,Hspa1b和Hspa2通过清除活性氧(ROS)和稳定线粒体功能,发挥抗氧化应激损伤的作用,进而增加细胞存活。Hspa1b和Hspa2的下调提示ORM1缺失可能削弱细胞的抗氧化应激能力,从而影响肝细胞存活[26]。
此外,Jak-Stat3信号通路激活通过诱导与细胞增殖和抗凋亡相关的基因表达,如Cyclin D1和Bcl-2,从而促进细胞增殖、存活和组织修复[27]。而Cish(cytokine-inducible SH2-containing protein)是该通路一个重要的负反馈调节因子,通过抑制Jak-Stat信号的活化,调控细胞因子信号传导的强度和持续时间,发挥抑制细胞增殖和促进细胞凋亡的作用[28]。与之相反,Il6ra是IL-6受体的亚基,IL-6结合IL-6受体后激活Jak-Stat3信号通路,诱导与细胞存活、增殖和组织修复相关基因的表达[29]。此外,Lepr(leptin receptor)是瘦素(leptin)的主要受体,该受体激活后亦可激活下游Jak-Stat3信号通路[27]。特别是在肝脏中,Lepr信号能够促进肝细胞的再生和修复能力[30]。而ORM1敲除时,Cish上调,Il6ra、Lepr下调均表明JAK-STAT通路激活减少,从而导致细胞增殖减弱。
最后,在Hippo信号通路中,Tcf7在Hippo信号通路中扮演着重要的角色,其与细胞增殖的关系主要通过YAP/TAZ的激活来实现,并参与促进细胞增殖[31],Ctgf是一种与细胞外基质(ECM)相关的结合肝素的蛋白,能够直接与整合素结合。它由成纤维细胞合成,并能促进细胞的增殖和趋化[32],ORM1敲除导致Hippo通路中Tcf7和Ctgf表达下调,可能通过解除其对肝细胞增殖的抑制作用而促进细胞增殖。ORM1缺失还导致了该通路Tead1基因的下调,而Tead1作为YAP(yes-associated protein)和TAZ的下游效应器,与YAP/TAZ结合后在细胞核中调控靶基因Birc5、Cyr61、CTGF和Myc等的表达,进而促进细胞增殖、抑制细胞凋亡,并推动组织生长和再生[33]。
本研究阐释了ORM1可能通过调控PI3K-Akt、MAPK、Hippo、Jak-Stat等信号通路发挥促进肝细胞增殖的作用。提示ORM1可能通过影响肝细胞存活、ECM重塑等一系列复杂机制调节肝细胞增殖过程。未来研究应进一步探讨ORM1在这些信号通路中的具体调控机制,特别是在不同病理条件下如何影响肝细胞的增殖、凋亡以及组织修复,为肝脏疾病的治疗提供新的潜在靶点。
Exploration of the role and mechanism of ORM1 in promoting hepatocyte proliferation
-
摘要:
目的 研究Orosomucoid-1(ORM1)对肝细胞增殖的作用及机制。 方法 通过GEO数据库挖掘ORM1在肝脏切除后的表达情况;通过CCK8实验检测细胞增殖,分析过表达、干扰ORM1或外源性补充ORM对肝细胞增殖的影响;通过RNA-seq检测ORM1敲除小鼠肝组织基因表达情况,利用KEGG富集分析等方法挖掘ORM1调控肝细胞增殖的分子机制。 结果 在小鼠部分肝切除术后,ORM1随着肝再生过程表达升高,并且ORM在体外可促进小鼠Hepa1-6肝癌细胞系和人HepG2肝癌细胞系增殖。对ORM1敲除小鼠肝组织进行RNA-seq,结果提示ORM1影响PI3K-Akt、MAPK、Hippo、Jak-Stat等细胞增殖相关通路。在ORM1敲除后,促增殖基因Ctgf、Tcf7、Tead1、Il6ra、Lepr等表达下降,抑制增殖基因Cish、Gadd45a等表达上升。 结论 ORM1可能通过调控PI3K-Akt、MAPK、Hippo、Jak-Stat等细胞增殖相关通路中的关键基因表达促进肝细胞增殖。 Abstract:Objective To investigate the role and signaling pathway mechanism of Orosomucoid-1(ORM1)in hepatocyte proliferation. Methods The expression data of ORM1 after liver resection from the GEO database was analyzed. The effects of ORM1 on hepatocyte proliferation were assessed after overexpressing ORM1 or supplementing exogenous ORM1 in liver cells. Cell proliferation was evaluated by the CCK8 assay. RNA sequencing (RNA-seq) was performed on liver tissues from ORM1 knockout mice and wildtype littermates to analyze gene expression, and KEGG enrichment analysis was employed to explore the molecular mechanisms by which ORM1 regulates hepatocyte proliferation. Results After partial liver resection in mice, ORM1 expression increased during the liver regeneration process. In vitro, ORM1 promoted the proliferation of murine Hepa1-6 hepatocytes and human HepG2 hepatocellular carcinoma cells. RNA-seq analysis of liver tissues from ORM1 knockout mice indicated that ORM1 influenced several proliferation-related pathways, including the PI3K-Akt, MAPK, Hippo, and Jak-Stat pathways. Upon ORM1 knockout, the expression of pro-proliferative genes such as Ctgf, Tcf7, Tead1, Il6ra, and Lepr decreased, while the expression of anti-proliferative genes such as Cish and Gadd45a increased. Conclusion ORM1 may promote hepatocyte proliferation by regulating key genes in cell proliferation-related pathways, including the PI3K-Akt, MAPK, Hippo and Jak-Stat pathways. -
Key words:
- ORM1 /
- hepatocyte proliferation /
- mechanism of action /
- signaling pathway
-
在正常条件下,大部分肝细胞处于静止状态(G0期),通常很少进入有丝分裂期。一旦肝细胞受到手术切除和药物等应激的刺激,它们会迅速对促分裂原产生反应,过渡到有丝分裂期,并开始增殖[1-4]。肝细胞增殖不仅是肝脏自我修复和再生的基础,也是应对慢性肝炎、肝硬化以及药物性肝损伤(DILI)等多种损害的重要机制。研究表明,肝脏出现病理性损伤后产生多种肝细胞因子,例如纤维蛋白原样蛋白(FGL1)、Hepassocin、肝细胞生长因子(HGF)等,在促进肝细胞增殖方面发挥重要作用[5-8]。例如,FGL1通过激活细胞增殖相关的信号通路促进肝细胞的再生,从而加速肝脏的修复[9]。此外,Hepassocin通过自分泌机制促进肝细胞生长[6]。这些研究提供了肝脏疾病治疗的新思路,尤其是调控这些肝细胞因子来加速肝功能的恢复。
Orosomucoid-1(ORM1),也称为α-1-酸性糖蛋白1(AGP1),作为一个已知的肝细胞因子[10],是一种主要由肝脏合成分泌的急性期蛋白,在应激条件下(如组织损伤和炎症)显著升高,具有调控细胞外基质(ECM)、调节糖代谢、维持血管通透性等重要的生物学功能[10-12]。此外,ORM1在结肠腺癌细胞、肝细胞、免疫细胞等多种细胞上,表现出促进增殖的作用[13-15]。但ORM1调控肝细胞增殖的具体作用机制尚不完全明确,有待进一步研究。
为进一步探究ORM1在肝细胞增殖中的具体作用及机制,本研究首先在两种肝细胞系上验证了ORM1促进肝细胞增殖,并通过对ORM1敲除小鼠的肝脏组织测序,挖掘ORM1调控肝细胞增殖的可能机制。本研究旨在揭示ORM1促进肝细胞增殖的潜在功能和机制,为肝脏损伤修复及相关疾病的治疗提供新的分子靶点和理论依据。
1. 材料与方法
1.1 试剂
α1-酸性糖蛋白(美国 Sigma-Aldrich 公司)、CCK8试剂盒(Adamas life)、Lipofectamine 3000试剂(Thermo Fisher Scientific)。
1.2 实验细胞
小鼠肝癌细胞系Hepa1-6,购自中国科学院细胞库。培养液配方:DMEM、10%FBS、1%双抗生素。培养条件:5%CO2、37 ℃恒温孵育箱。人肝癌细胞系HepG2,购自武汉普诺赛生命科技有限公司。培养液配方:MEM(含NEAA)、10%FBS、1%双抗生素。培养条件:5%CO2、37 ℃恒温孵育箱。
1.3 CCK8
细胞接种于96孔板,密度约104/孔,每组复孔为9;ORM1过表达、干扰或人源ORM给药(10、50、100 μg/ml)处理相应时间后,弃去培养基,在细胞贴壁后,使用无血清培养基处理细胞,培养相应时间后,加入CCK8试剂,吸光度测定(Epoch BioTeK酶标检测仪)450 nm处的A值,根据不同组之间的A值计算组间差异。
1.4 细胞瞬时转染
通过LipofectamineTM
3000 将ORM1过表达质粒(序列见NM_008768.2)或siRNA转染进细胞内,以实现过表达或干扰目标基因的目的。当细胞密度达到50%~70%时,进行过表达质粒的瞬时转染实验;当细胞密度达到30%~50%时,进行siRNA的瞬时转染实验。吸取舍弃原培养基后用1×PBS轻柔洗涤细胞1~2次,根据转染条件配制好转染试剂,随后将配置好含有过表达质粒(或siRNA)的DMEM培养基加入至细胞培养基中用于细胞继续培养,最后置于细胞培养箱中孵育24 h(若为转染siRNA,则孵育48 h)即可完成细胞瞬时转染试验。siRNA序列及转染试剂配制方法见表1、表2。表 1 ORM1 siRNA序列siRNA名称 siRNA序列(5'→3') si-ORM1 CCACCAACUUGAUAAACGATT 表 2 96孔培养板转染条件培养皿 Opti-MEM (μl) Lipo3000 (μl) DNA转染 RNA转染 DNA (ng) P3000 (μl) RNA (pmol) 96孔板 2×10 0.3 100 0.2 20 1.5 RNA-seq及差异基因富集分析
使用ORM1基因敲除(KO)小鼠和对应的野生型(WT)小鼠(均为C57BL/6背景,n=6)。在小鼠24周龄时采集肝脏组织,液氮速冻并存储于−80°C。RNA-seq委托上海欧易生物公司进行,差异基因分析通过DESeq完成,筛选标准为FoldChange>1.5或<0.66,且P<0.05。
差异基因富集分析通过DAVID进行,进行Kyoto Encyclopedia of Genes and Genomes (KEGG)富集分析。KEGG分析用于揭示差异基因在代谢通路中的富集情况。富集分析筛选标准为P<0.05。
1.6 数据统计与分析
实验数据采用GraphPad Prism 9.0软件进行统计与分析。单因素两组之间相互比较,采用双尾非配对t检验(Student’t)检验分析;单因素多组之间相互比较,采用单向方差分析(One-way ANOVA)检验,组间均值两两比较采用Dunnett's multiple comparisons test。实验结果均采用“均数±标准误(Mean±SE)”表示。以P<0.05认为差异具有统计学意义。
2. 结果
2.1 ORM1在小鼠肝切除术后表达增加
肝脏组织在肝切除术后会进入肝细胞快速增殖状态[16]。通过检索GEO数据库,选取C57BL/6小鼠在2/3肝脏部分切除术(PH)后数据(GSE43687)进行分析。结果显示,肝脏组织中ORM1的表达在PH后1.5 h时无显著变化,在PH后12 h显著上升(图1)。这一结果提示ORM1可能参与肝脏再生过程。
2.2 ORM1促进小鼠和人肝细胞增殖
为验证ORM1对肝细胞增殖的影响,我们在小鼠和人的肝细胞系上进行了ORM1过表达、干扰或ORM外源性给药实验。在小鼠Hepa1-6肝癌细胞系过表达ORM1(pCMV-ORM1),与对照质粒组(pCMV)组相比,转染后第3、4天ORM1过表达质粒组的细胞增殖显著增加(图2A)。而干扰ORM1后细胞增殖能力呈现相反的结果(图2B)。人HepG2肝细胞上给予不同浓度外源性ORM,48 h后检测细胞增殖情况,可见随着ORM1浓度的增加,细胞增殖呈现显著上升(图2C)。上述结果表明ORM1对肝细胞增殖具有显著的促进作用。
2.3 ORM1基因敲除对肝脏细胞生物学功能及信号通路的影响
为了进一步探究ORM1基因敲除后对肝脏组织的影响,我们对ORM1基因敲除(KO)小鼠和野生型(WT)小鼠的肝脏组织进行了测序。KEGG富集分析表明,在ORM1基因敲除小鼠与野生型小鼠的比较中,差异表达基因被富集在“细胞生长与死亡”和“细胞运输与自噬”等通路中(图3A),提示ORM1缺失会引起细胞生长和死亡相关的通路相关改变。
进一步信号通路的富集分析显示,PI3K-Akt、MAPK、PPAR、Hippo、Jak-Stat等通路在差异基因表达分析中有显著富集(图3B),其中,PI3K-Akt、MAPK、Hippo、Jak-Stat通路据报道与细胞增殖高度相关[17-19]。这些结果提示,ORM1基因敲除可能影响细胞增殖关键通路,通过调控细胞生长、死亡相关的基因影响肝细胞增殖。
2.4 ORM1可能通过调控多条信号通路促进肝细胞增殖
为进一步明确ORM1在这些经典通路中的调控机制,我们重点分析了其中与细胞增殖相关的差异基因表达变化。在PI3K-Akt信号通路中,具有促增殖作用的Itgb8和Ntf3显著下调(图4A)。在MAPK信号通路中,同样具有促增殖作用的Map3k6在KO组中显著下调,而抑制细胞增殖作用的Gadd45a则显著上调,Hspa1b和Hspa2下调(图4B)。与之类似,Jak-Stat信号通路中的Il6ra和Lepr具有促增殖作用,其表达在KO组中也显著下调,而有抑制细胞增殖作用的Cish在KO组中的表达显著上调(图4C)。在Hippo信号通路中,具有促增殖作用的Tef7、Tead1、Ctgf在KO组中的表达显著下调(图4D)。这些结果表明,ORM1可能调控PI3K-Akt、MAPK、Jak-Stat和Hippo信号通路中的影响细胞增殖的多种关键信号分子影响肝细胞的增殖。
3. 讨论
本研究中,我们揭示了ORM1在肝细胞增殖中的潜在调控机制。首先,利用GEO数据库(GSE43687)分析,发现ORM1在小鼠2/3肝切除术后12h表达升高,提示ORM1可能参与肝脏再生。而在体外肝细胞系中,过表达ORM1或外源性给药ORM,可以促进肝细胞增殖;相反,干扰ORM1抑制的肝细胞的增殖,进一步验证了ORM1对肝细胞增殖的促进作用。此外,我们对ORM1基因敲除小鼠组学分析,发现PI3K-Akt、MAPK、Hippo、Jak-Stat等细胞增殖相关通路的多个信号分子在ORM1缺失时表现出显著变化,提示这些关键通路可能参与了ORM1对肝细胞增殖的调控。
在PI3K-AKT信号通路中,Ntf3(neurotrophin-3)主要通过与受体TrkC结合,促进细胞的存活、增殖和分化[20]。ORM1缺失后Ntf3的下调可能导致细胞存活和再生能力减弱。而Itgb8(整合素β8)和Lamc2(laminin subunit gamma-2)作用类似,均是通过与细胞外基质(ECM)蛋白(如纤连蛋白、胶原蛋白等)结合,介导细胞与其周围环境的相互作用,从而影响细胞的增殖和分化[21-22]。ORM1缺失后,Itgb8和Lamc2下调提示ECM重塑减弱,从而无法为新生肝细胞的重新附着与生长提供必要的微环境支持。
在MAPK信号通路中,Gadd45a(growth arrest and DNA damage-inducible alpha)是一种生长停滞和DNA损伤诱导因子,通过抑制细胞周期相关激酶(如CDK1和CDK2),阻止细胞从G1期或G2/M期进入下个阶段[23]。ORM1缺失后Gadd45a上调提示可能出现细胞周期停滞,从而抑制了肝细胞的增殖。Map3k6(mitogen-activated protein kinase 6)作为一种激酶,通过磷酸化MAPK激酶调控下游的信号分子和后续的细胞生物学反应,如细胞增殖、分化、存活、迁移和应激反应[24]。ORM1缺失后Map3k6下调可能导致MAPK通路激活减少。Hspa1b和Hspa2是热休克蛋白,在抑制凋亡通路主要通过抑制线粒体凋亡途径,caspase的活化以及调控JNK信号通路发挥作用;同时,Hspa1b和Hspa2通过清除活性氧(ROS)和稳定线粒体功能,发挥抗氧化应激损伤的作用,进而增加细胞存活。Hspa1b和Hspa2的下调提示ORM1缺失可能削弱细胞的抗氧化应激能力,从而影响肝细胞存活[26]。
此外,Jak-Stat3信号通路激活通过诱导与细胞增殖和抗凋亡相关的基因表达,如Cyclin D1和Bcl-2,从而促进细胞增殖、存活和组织修复[27]。而Cish(cytokine-inducible SH2-containing protein)是该通路一个重要的负反馈调节因子,通过抑制Jak-Stat信号的活化,调控细胞因子信号传导的强度和持续时间,发挥抑制细胞增殖和促进细胞凋亡的作用[28]。与之相反,Il6ra是IL-6受体的亚基,IL-6结合IL-6受体后激活Jak-Stat3信号通路,诱导与细胞存活、增殖和组织修复相关基因的表达[29]。此外,Lepr(leptin receptor)是瘦素(leptin)的主要受体,该受体激活后亦可激活下游Jak-Stat3信号通路[27]。特别是在肝脏中,Lepr信号能够促进肝细胞的再生和修复能力[30]。而ORM1敲除时,Cish上调,Il6ra、Lepr下调均表明JAK-STAT通路激活减少,从而导致细胞增殖减弱。
最后,在Hippo信号通路中,Tcf7在Hippo信号通路中扮演着重要的角色,其与细胞增殖的关系主要通过YAP/TAZ的激活来实现,并参与促进细胞增殖[31],Ctgf是一种与细胞外基质(ECM)相关的结合肝素的蛋白,能够直接与整合素结合。它由成纤维细胞合成,并能促进细胞的增殖和趋化[32],ORM1敲除导致Hippo通路中Tcf7和Ctgf表达下调,可能通过解除其对肝细胞增殖的抑制作用而促进细胞增殖。ORM1缺失还导致了该通路Tead1基因的下调,而Tead1作为YAP(yes-associated protein)和TAZ的下游效应器,与YAP/TAZ结合后在细胞核中调控靶基因Birc5、Cyr61、CTGF和Myc等的表达,进而促进细胞增殖、抑制细胞凋亡,并推动组织生长和再生[33]。
本研究阐释了ORM1可能通过调控PI3K-Akt、MAPK、Hippo、Jak-Stat等信号通路发挥促进肝细胞增殖的作用。提示ORM1可能通过影响肝细胞存活、ECM重塑等一系列复杂机制调节肝细胞增殖过程。未来研究应进一步探讨ORM1在这些信号通路中的具体调控机制,特别是在不同病理条件下如何影响肝细胞的增殖、凋亡以及组织修复,为肝脏疾病的治疗提供新的潜在靶点。
-
表 1 ORM1 siRNA序列
siRNA名称 siRNA序列(5'→3') si-ORM1 CCACCAACUUGAUAAACGATT 表 2 96孔培养板转染条件
培养皿 Opti-MEM (μl) Lipo3000 (μl) DNA转染 RNA转染 DNA (ng) P3000 (μl) RNA (pmol) 96孔板 2×10 0.3 100 0.2 20 -
[1] TERUI K, OZAKI M. The role of STAT3 in liver regeneration[J]. Drugs Today, 2005, 41(7):461-469. doi: 10.1358/dot.2005.41.7.893622 [2] FUJIYOSHI M, OZAKI M. Molecular mechanisms of liver regeneration and protection for treatment of liver dysfunction and diseases[J]. J Hepatobiliary Pancreat Sci, 2011, 18(1):13-22. doi: 10.1007/s00534-010-0304-2 [3] HAGA S, OGAWA W, INOUE H, et al. Compensatory recovery of liver mass by Akt-mediated hepatocellular hypertrophy in liver-specific STAT3-deficient mice[J]. J Hepatol, 2005, 43(5):799-807. doi: 10.1016/j.jhep.2005.03.027 [4] WEBBER E M, BRUIX J, PIERCE R H, et al. Tumor necrosis factor primes hepatocytes for DNA replication in the rat[J]. Hepatology, 1998, 28(5):1226-1234. doi: 10.1002/hep.510280509 [5] SEGAWA Y, ITOKAZU Y, INOUE N, et al. Possible changes in expression of chemotaxin LECT2 mRNA in mouse liver after concanavalin A-induced hepatic injury[J]. Biol Pharm Bull, 2001, 24(4):425-428. doi: 10.1248/bpb.24.425 [6] HARA H, UCHIDA S, YOSHIMURA H, et al. Isolation and characterization of a novel liver-specific gene, hepassocin, upregulated during liver regeneration[J]. Biochim Biophys Acta, 2000, 1492(1):31-44. doi: 10.1016/S0167-4781(00)00056-7 [7] OHTOMI M, NAGAI H, OHTAKE H, et al. Dynamic change in expression of LECT2 during liver regeneration after partial hepatectomy in mice[J]. Biomed Res, 2007, 28(5):247-253. doi: 10.2220/biomedres.28.247 [8] RIZVI F, EVERTON E, SMITH A R, et al. Murine liver repair via transient activation of regenerative pathways in hepatocytes using lipid nanoparticle-complexed nucleoside-modified mRNA[J]. Nat Commun, 2021, 12(1):613. doi: 10.1038/s41467-021-20903-3 [9] LIU X H, QI L W, ALOLGA R N, et al. Implication of the hepatokine, fibrinogen-like protein 1 in liver diseases, metabolic disorders and cancer: the need to harness its full potential[J]. Int J Biol Sci, 2022, 18(1):292-300. doi: 10.7150/ijbs.66834 [10] LUO Z M, LEI H, SUN Y, et al. Orosomucoid, an acute response protein with multiple modulating activities[J]. J Physiol Biochem, 2015, 71(2):329-340. doi: 10.1007/s13105-015-0389-9 [11] WANG P Y, FENG J Y, ZHANG Z, et al. The adipokine orosomucoid alleviates adipose tissue fibrosis via the AMPK pathway[J]. Acta Pharmacol Sin, 2022, 43(2):367-375. doi: 10.1038/s41401-021-00666-9 [12] YUAN W, LI G L, ZENG M, et al. Modulation of the blood-brain barrier permeability by plasma glycoprotein orosomucoid[J]. Microvasc Res, 2010, 80(1):148-157. doi: 10.1016/j.mvr.2010.03.011 [13] YUE L, XU X Z, DAI S P, et al. Orosomucoid 1 promotes colorectal cancer progression and liver metastasis by affecting PI3K/AKT pathway and inducing macrophage M2 polarization[J]. Sci Rep, 2023, 13(1):14092. doi: 10.1038/s41598-023-40404-1 [14] QIN X Y, HARA M, ARNER E, et al. Transcriptome analysis uncovers a growth-promoting activity of orosomucoid-1 on hepatocytes[J]. EBioMedicine, 2017, 24:257-266. doi: 10.1016/j.ebiom.2017.09.008 [15] NAKAMURA K, ITO I, KOBAYASHI M, et al. Orosomucoid 1 drives opportunistic infections through the polarization of monocytes to the M2b phenotype[J]. Cytokine, 2015, 73(1):8-15. doi: 10.1016/j.cyto.2015.01.017 [16] MICHALOPOULOS G K, BHUSHAN B. Liver regeneration: biological and pathological mechanisms and implications[J]. Nat Rev Gastroenterol Hepatol, 2021, 18(1):40-55. doi: 10.1038/s41575-020-0342-4 [17] YU J S L, CUI W. Proliferation, survival and metabolism: the role of PI3K/AKT/mTOR signalling in pluripotency and cell fate determination[J]. Development, 2016, 143(17):3050-3060. doi: 10.1242/dev.137075 [18] SUN Y, LIU W Z, LIU T, et al. Signaling pathway of MAPK/ERK in cell proliferation, differentiation, migration, senescence and apoptosis[J]. J Recept Signal Transduct Res, 2015, 35(6):600-604. doi: 10.3109/10799893.2015.1030412 [19] FU M Y, HU Y, LAN T X, et al. The Hippo signalling pathway and its implications in human health and diseases[J]. Signal Transduct Target Ther, 2022, 7(1): 376. ell proliferation during regeneration in rats[J]. J Cell Mol Med, 2020, 24(23): 13679-13689. [20] GREENHALGH S N, MATCHETT K P, TAYLOR R S, et al. Loss of integrin αvβ8 in murine hepatocytes accelerates liver regeneration[J]. Am J Pathol, 2019, 189(2):258-271. doi: 10.1016/j.ajpath.2018.10.007 [21] CHENG L L, LI X F, DONG W H, et al. LAMC2 regulates the proliferation, invasion, and metastasis of gastric cancer via PI3K/Akt signaling pathway[J]. J Cancer Res Clin Oncol, 2024, 150(5):230. doi: 10.1007/s00432-024-05720-7 [22] HUMAYUN A, JR FORNACE A J. GADD45 in stress signaling, cell cycle control, and apoptosis[J]. Adv Exp Med Biol, 2022, 1360:1-22. [23] WANG X P, ZHANG Z D, CAO X L. Salidroside inhibited the proliferation of gastric cancer cells through up-regulating tumor suppressor miR-1343-3p and down-regulating MAP3K6/MMP24 signal molecules[J]. Cancer Biol Ther, 2024, 25(1):2322206. doi: 10.1080/15384047.2024.2322206 [24] SOJKA D R, ABRAMOWICZ A, ADAMIEC-ORGANIŚCIOK M, et al. Heat shock protein A2 is a novel extracellular vesicle-associated protein[J]. Sci Rep, 2023, 13(1):4734. doi: 10.1038/s41598-023-31962-5 [25] WU Y, ZHAO J, TIAN Y, et al. Cellular functions of heat shock protein 20(HSPB6)in cancer: A review[J]. Cell Signal, 2023, 112:110928. doi: 10.1016/j.cellsig.2023.110928 [26] LAM Q L, WANG S J, KO O K, et al. Leptin signaling maintains B-cell homeostasis via induction of Bcl-2 and Cyclin D1[J]. Proc Natl Acad Sci U S A, 2010, 107(31):13812-13817. doi: 10.1073/pnas.1004185107 [27] CUI Y Z, HOSUI A, SUN R, et al. Loss of signal transducer and activator of transcription 5 leads to hepatosteatosis and impaired liver regeneration[J]. Hepatology, 2007, 46(2):504-513. doi: 10.1002/hep.21713 [28] SCHMIDT-ARRAS D, ROSE-JOHN S. IL-6 pathway in the liver: from physiopathology to therapy[J]. J Hepatol, 2016, 64(6):1403-1415. doi: 10.1016/j.jhep.2016.02.004 [29] INABA Y, FURUTANI T, KIMURA K, et al. Growth arrest and DNA damage-inducible 34 regulates liver regeneration in hepatic steatosis in mice[J]. Hepatology, 2015, 61(4):1343-1356. doi: 10.1002/hep.27619 [30] MUELLER K A, GLAJCH K E, HUIZENGA M N, et al. Hippo Signaling Pathway Dysregulation in Human Huntington's Disease Brain and Neuronal Stem Cells[J]. Sci Rep, 2018, 8(1):11355. doi: 10.1038/s41598-018-29319-4 [31] FU M, PENG D, LAN T, et al. Multifunctional regulatory protein connective tissue growth factor(CTGF): A potential therapeutic target for diverse diseases[J]. Acta Pharm Sin B, 2022, 12(4):1740-60. doi: 10.1016/j.apsb.2022.01.007 [32] CAI W Y, LIN L Y, HAO H, et al. Yes-associated protein/TEA domain family member and hepatocyte nuclear factor 4-alpha(HNF4α)repress reciprocally to regulate hepatocarcinogenesis in rats and mice[J]. Hepatology, 2017, 65(4):1206-1221. doi: 10.1002/hep.28911 -





 下载:
下载:

 下载:
下载:


