-
在我国,红火蚁是一种对农业生产、生态环境、人畜健康和公共安全造成严重危害的入侵性害虫之一。红火蚁通过毒针刺伤人类皮肤,每次将大约0.66 nl毒液注入人的皮肤[1-2]。患者被蛰伤时会立即产生持续剧烈的灼烧感,随后出现瘙痒、疼痛、水泡、丘疹等局部症状,严重者会出现头痛头晕、心悸胸闷、心律失常等全身症状;对毒液过敏的患者则会出现更严重的哮喘、喉头和支气管水肿等全身性过敏反应,甚至出现过敏性休克,危及患者生命[3-5]。红火蚁毒液的主要成分包括水、生物碱和少量的蛋白质[6],本文详细综述了目前对红火蚁毒液中各毒素物质的研究进展以及各组分的作用和功能。
-
生物碱是红火蚁毒液重要的组成成分,其主要成分是2-甲基-6-烷基哌啶生物碱混合物,约占毒液总量的95%[7-8]。这些哌啶生物碱存在立体异构现象,顺式生物碱构型为(2R,6S)(图1A),反式构型为(2R,6R)(图1B),反式生物碱与相应的顺式异构体的比值为87~378:1[8-9]。另外,红火蚁体内还存在一些哌啶环上含双键的△1,6和△1,2-2甲基-6-烷基哌啶类混合物,这些生物碱可能是红火蚁毒素中顺式生物碱和反式生物碱的合成前体[9] (图1C)。Chen L[10]等已人工合成一系列外消旋2-甲基-6-烷基-△1,6-哌啶类化合物,用于红火蚁毒液中天然产物的化学确证和生物活性评价。除了哌啶类生物碱外,红火蚁毒液中还存在少量的吡啶类生物碱。Chen J[11]等采用硅胶柱层析分离法,利用SPME和SPME-GC-MC技术在红火蚁工蚁毒液的生物碱中首次分离和鉴定出6种2-甲基-6烷基(或烯基)吡啶类生物碱,其中4种生物碱也存在于雌性红火蚁体内。最近,Vander Meer [12]等在工蚁毒液中又意外地发现了6-十一烷基吡啶、2-甲基-6-十一烷基吡啶和2-甲基-6-(1)-十一烯基吡啶等3种新的生物碱,在红火蚁毒液研究方面取得了新的进展。
红火蚁毒液中生物碱的含量与红火蚁的种类、大小、年龄、分布地域等因素有关。在同一巢穴中,雌性生殖蚁的生物碱含量相对较高,约83 μg/头,而工蚁体内的生物碱含量则与其个体的大小呈正相关,中龄工蚁体内生物碱含量远高于老龄工蚁和幼龄工蚁[13]。由于被入侵地的环境、生态等影响,不同地区的红火蚁毒液生物碱组分的相对含量也会存在明显差异[14]。
-
红火蚁体内的碱类分泌物能够有效抑制各种病原微生物,使红火蚁免于各种疾病的困扰[15]。但是这些生物碱作用于人体时能够抑制细胞Na+和K+-ATP酶作用,限制线粒体呼吸,在低浓度下即可解除氧化磷酸化,阻断神经肌肉连接,促使肥大细胞释放组胺和血管活性物质,因此患者被蛰伤时局部组织会发生坏死、溶血[5]。红火蚁毒液中的生物碱具有一定的抗菌活性,其中trans-C11、trans-C13、trans-C15对革兰阳性菌抑制作用较强[16]。患者在被红火蚁蜇伤初期一般不会发生细菌感染,但是若处理不及时或者处理不当,则会造成二次感染,形成脓疱[17]。
红火蚁毒液中的生物碱成分在介导寄生性天敌对红火蚁工蚁的吸引力方面起着重要作用,例如寄生性蚤蝇能够利用红火蚁分泌的示警信息素定位工蚁位置[18]。 Chen L等[19] 通过实验证实蚤蝇对毒液生物碱中的cis-C11、cis-C13:1、cis-C13、cis-C15:1、cis-C15、trans-C11、trans-C13:1、△1,6-C15:1 和△1,6-C15存在触角电位(EAG)反应,为红火蚁毒液生物碱作为苍蝇引诱剂的可能作用机制提供了新的见解。
红火蚁蚁后和雌性生殖蚁体内的生物碱还具有特殊的信息交流作用。这些毒液能够用于蚂蚁种群的建立,并且反映蚁后的发育程度以及鉴别蚁后的基因型[20]。
-
红火蚁毒液中的蛋白质含量只占毒液总量的5%,但是其抗原性强,毫微克即可引起致敏并诱发过敏反应。Hoffman等[21] 从红火蚁毒液中分离提纯出4种均一性蛋白:Soli Ⅰ(Solenopsis invicta Ⅰ)、Soli Ⅱ、Soli Ⅲ和Soli Ⅳ,都属于过敏性蛋白质,具有致敏活性。典型Soli Ⅰ的分子量为37 kDa,由309个氨基酸组成,在SDS-PAGE电泳上产生18、16.5和14 KDa共3个蛋白条带[22]。非变性Soli Ⅱ的分子量为28 kDa,是一种由119个氨基酸组成的磷脂酶。Soli Ⅱ的天然形式是一种通过2个二硫键链接的二聚体,每个亚基由5个螺旋包围1个疏水孔,并由3个分子内二硫键稳定,该蛋白在结构上与气味/信息素结合蛋白相似,能够捕获或转运某些小型疏水配体(如信息素、脂肪酸、气味等)[23]。虽然红火蚁工蚁和蚁后的Soli Ⅱ的蛋白质序列具有74.8%的同源性,但过敏患者对工蚁Soli Ⅱ的免疫反应比蚁后的表现更为强烈。Soli Ⅲ的分子量均为26 KDa,由212个氨基酸组成,其中含有8个半胱氨酸[24]。非变性的Soli Ⅳ的分子量为20 kDa,由117个氨基酸残基构成,具有6个半胱氨酸,在SDS-PAGE电泳上产生1条15 kDa的单链[25]。
目前临床上已将红火蚁毒素蛋白广泛用于红火蚁引起的过敏反应的诊断以及红火蚁过敏患者的免疫治疗。由于红火蚁体内毒素蛋白含量很低,通过人工饲养得到的全蚁提取液或毒液的量极少,但通过体外扩增的方法可以安全、大量地表达用于免疫治疗的毒素蛋白,具有十分重大的意义。韩雪清等[26] 利用RT-PCR和nPCR技术扩增出红火蚁体内毒素蛋白Soli Ⅰ和Soli Ⅳ全基因及其活性片段,与GenBank中的红火蚁序列同源性为99%,具有较高的致敏活性和很好的抗原特异性,达到了良好的免疫治疗效果。1993年Schmidt 等[27] 首次对Soli Ⅱ毒素蛋白进行序列测定并克隆分析其编码 cDNA序列,重组蛋白Soli Ⅱ 具有与毒蛋白Soli Ⅱ 相同的构象。2003年Schmidt等[28] 又利用杆状病毒载体体外表达了Soli Ⅲ重组蛋白,其与毒素蛋白具有相似的IgE活性。王建峰等[29] 利用大肠杆菌表达系统成功的在体外表达了红火蚁重组毒素蛋白Soli Ⅳ,与Genebank 上的KAFI03805核苷酸同源性高达99%,氨基酸序列同源性为99%。重组蛋白Soli Ⅳ在一定浓度范围内能够激活T淋巴细胞、B淋巴细胞活化并释放特异性IgE,诱发Ⅰ型变态反应,可以用于过敏的诊断和免疫治疗。
Dos Santos Pinto等[30] 对红火蚁全蚁提取液进行蛋白质组学分析,分离鉴别出46种蛋白质或多肽,根据它们在毒液中的功能和作用,将其分为4组:毒素蛋白、管家蛋白、肌肉蛋白和化学通讯蛋白(表1)。在这些蛋白中,除了被大家所熟知的Soli Ⅰ、Soli Ⅱ、Soli Ⅲ这3种致敏性抗原外,还包括2种首次在红火蚁毒液中分离鉴定出的蛋白质——解聚素/金属蛋白酶(disintegrin/metalloproteiase)和心房利钠肽。管家蛋白和肌肉蛋白可能是在解剖红火蚁或提取毒液的过程中,周围肌肉或细胞被破坏,部分细胞内容物泄漏到毒液中所致,这些蛋白在毒液中并不发挥任何作用。Ye 和 Li[31]在火蚁体内992个蛋白中检测出2387个赖氨酸乙酰化(Kac)位点,这些乙酰化蛋白质参与了各种细胞过程和生物功能,确定Kac靶蛋白的功能可能有助于设计特效药来预防这种危险物种的入侵。
表 1 红火蚁毒液蛋白质组学
类别 分类 组分 毒素蛋白 组织损伤类蛋白质 PLA2、解聚素/金属蛋白酶、肌肉毒素、PsTX-60 神经毒素类蛋白质 U5-ctenotoxins PK1a、alpha-toxins Tc48a、Scolopendra toxin 抗生类蛋白质 Ponericin L1-like peptides、Ponericin G4-like peptides 血管舒张类蛋白质 心房利钠肽(ANP) 致敏类蛋白质 Soli Ⅰ、Soli Ⅱ、Soli Ⅲ、Pac c 3 allergen-like protein “自我保护”类蛋白质 转铁蛋白、谷胱甘肽-S-转移酶、细胞色素C氧化酶、硫氧还蛋白过氧化物酶、PLA2抑制剂、血管内皮细胞生长因子 管家蛋白 — 卵黄蛋白1-3、核糖体蛋白1-4、核蛋白、ATP依赖解旋酶、络氨酰-DNA磷酸二酯酶、脂蛋白结合蛋白、电压门控钾通道、胰岛素底物受体1-B、短神经肽F受体、神经纤维瘤蛋白、PLD1 、Pescadillo protein、Integrator complex subunit 10 肌肉蛋白 — 肌钙蛋白C、prominin-like protein 化学通讯蛋白 — 气味结合蛋白、化学感受蛋白、信息素结合蛋白 -
红火蚁毒液中的磷脂酶能够水解生物膜上的磷脂,导致细胞裂解、炎症和组织损伤。肌肉毒素与磷脂酶的作用类似,它能够使螫针蛰刺部位周围的骨骼肌坏死,增加局部微血管的通透性,并且促进细胞溶解和坏死。在红火蚁毒液中发现的另一种溶细胞蛋白是一种类似海葵PSTx-60的毒素,该毒素会引起明显的溶血反应[32]。解聚素/金属蛋白酶可降解细胞外基质和毛细血管基底膜,破坏局部毛细血管网,因此被红火蚁蜇伤的患者会出现出血和水肿,局部坏死和组织损伤、休克等临床表现。硫氧还蛋白过氧化物酶(thioredoxin peroxidase)、谷胱甘肽-S-转移酶(glutathione-S-transferase)、细胞色素C氧化酶(cytochrome c oxidase)可能参与红火蚁遭受氧化应激损伤时的自我保护机制,使相关毒素蛋白能够保持完整结构,同时防止毒腺遭到氧化和破坏。Ponericin-like peptide、转铁蛋白能够防治储存的食物变质,预防成虫和幼虫感染细菌。化学通讯蛋白主要与红火蚁的警报、追踪、攻击等社会行为的化学信息交流机制有关[33]。
-
国内外已多次报道被红火蚁蜇伤的案例,但对于红火蚁毒素,目前尚未研制出有效的解毒剂。红火蚁毒液中的生物碱是造成灼烧感和水泡的主要原因,过敏反应则是由毒液中的蛋白质或多肽类物质造成的。目前对红火蚁蜇伤的治疗以对症治疗为主,一般是选用抗组胺、类固醇等药品或冰敷来缓解症状;若处理不及时或不当而发生二次感染,可以使用抗生素;如果严重至过敏性休克,则可选用肾上腺素等药物。在对红火蚁蛰伤患者的治疗中,采用中西医结合的治疗策略能够有效缓解患者的临床症状,缩短住院时间,达到满意的治疗效果[34] 。
Basic research on toxin of Solenopsis invicta
-
摘要: 红火蚁是一种对农业、生态、环境和人类健康造成严重危害的入侵性害虫。红火蚁主要利用螯针中的毒液攻击人类,对红火蚁毒液过敏的患者会出现全身性过敏反应,甚至出现过敏性休克,危及患者生命。国内外的科研人员对红火蚁毒液中的物质成分进行了大量细致的研究,红火蚁毒液主要组成成分包括水、生物碱和少量的蛋白,生物碱是造成灼烧感和水泡的主要原因,过敏反应则是由毒液中的蛋白质或多肽类物质造成的。本文综述了目前对红火蚁毒液中毒素物质的研究进展以及各组分的作用和功能。Abstract: Solenopsis invicta is a kind of invasive pest that causes serious damage to local agriculture, environment, and human health. They attack mainly with venom within stingers. Those who are allergic to the venom would suffer a systemic anaphylaxis, even fatal shock, after being stinged by these ants. Many studies reveal that their venom is mainly composed by water, insoluble alkaloids and trace proteins, within which alkaloids are the main cause of burning sensation and blisters, while allergic reactions are caused by proteins or peptides. The research progress of toxic substances in the venom of Solenopsis invicta as well as the roles and functions of each component were reviewed in this paper.
-
Key words:
- the venom of Solenopsis invicta /
- alkaloid /
- protein /
- allergen
-
针对非小细胞肺癌(NSCLC)的靶向药EGFR-TKIs,自第一代问世以来发展迅速,目前第四代已在临床研发阶段。但由于新的耐药突变的不断产生,导致其应用受限。因此如何克服EGFR-TKIs耐药问题和寻找可改善肺癌靶向治疗耐药的药物已成当务之急。植物来源的单体成分种类繁多,应用前景巨大。毒胡萝卜(Thapsia garganica L.,伞形科毒胡萝卜属)是于地中海西部沿海地区发现的一种开花植物,一直被作为止痛剂应用于传统医学。毒胡萝卜素是从该植物中分离的单体化合物,作为内质网应激(ERS)的诱导剂,近年也被用于抗肿瘤和抗病毒研究。吉非替尼作为第一代EGFR-TKIs,副作用小,有效率高。本研究旨在探讨毒胡萝卜素和吉非替尼联合用药对人肺腺癌耐药细胞株PC9/GR耐药性的影响,并探讨其可能的机制。
1. 材料与方法
1.1 实验材料
吉非替尼(纯度99.94%,HY-50895)、毒胡萝卜素(纯度99.95%,HY-13433)、CCK8试剂(HY-K0301-500T)均购自美国MCE公司;胎牛血清(F8318-500ML)和DMEM培养基(D6429-500ML)购自美国Sigam Aldrich公司;胰酶(25200-072)购自美国Gibco公司;凋亡试剂盒(559763)购自美国BD公司; ATF-6抗体(#65880)、IRE1α抗体(#3294)均购自美国CST公司;羊抗兔二抗(AS003)购自abclonal;PVDF膜购自Millipore;其余试剂均为国产分析纯试剂。人肺腺癌细胞(PC9)由同济医院惠赠,PC9/GR细胞购自湖南丰晖生物科技有限公司。
1.2 方法
1.2.1 细胞株及细胞培养
PC9细胞使用DMEM培养基培养,其中含10%的胎牛血清、100 U/ml的青霉素和100 μg/ml的链霉素,于37 ℃、5% CO2的恒温培养箱中孵育。PC9/GR细胞使用上述培养基维持培养并额外含800 ng/ml的吉非替尼。
1.2.2 CCK8法检测细胞增殖
检测细胞对吉非替尼的耐药性:分别取对数生长期的PC9和PC9/GR细胞制成单细胞悬液,调整细胞浓度为40 000/ml,接种于96孔板,每孔100 μl细胞悬液,在培养箱中孵育过夜。吸弃96孔板上清液,加入含药培养基(PC9细胞中吉非替尼浓度分别为0、1、5、10、20、40、80、250、500、1 000 nmol/L;PC9/GR细胞中吉非替尼的浓度分别为0、1、10、100、1 000、2 500、5 000、10 000、20 000、40 000 nmol/L),同时设对照组,每组设4个复孔。72 h时吸弃上清液,再加入含CCK8的DMEM,0.5 h后用酶标仪检测A450。
检测毒胡萝卜素对细胞增殖的影响:分别取对数生长期的PC9和PC9/GR细胞同上述处理铺96孔板,贴壁后加入浓度为0.1、1、10、100、1 000、10 000 nmol/L的毒胡萝卜素,同时设对照组,每组设4个复孔。72 h时使用CCK8法检测A450。
检测毒胡萝卜素对PC9/GR细胞耐药的逆转:取PC9/GR对数生长期的细胞同上述处理铺96孔板,设12组,加入吉非替尼的浓度分别为0、4.5、4.5、4.5、4.5、4.5、0、9、9、9、9、9 μmol/L,毒胡萝卜素的浓度分别为0、0、0.1、1、10、100、 0、0、0.1、1、10、100 nmol/L。72 h时用CCK8法检测A450。
检测毒胡萝卜素对PC9/GR细胞耐药的逆转:取PC9/GR对数生长期的细胞同上述处理铺96孔板,设两组,为吉非替尼单药组和联合用药组:其中单药组设7个小组,加入吉非替尼的浓度分别为0、1、10、102、103、104、105 μmol/L;联合用药组设7个小组,每小组加入10 nmol/L的毒胡萝卜素,同时加入浓度分别为0、1、10、102、103、104、105 nmol/L的吉非替尼。72 h时用CCK8法检测A450。逆转倍数(RF)=逆转前的IC50值/逆转后的IC50值。
1.2.3 流式细胞术检测细胞凋亡
取对数生长期的PC9/GR铺6孔板,每孔3×105个细胞,孵育过夜,吸弃上清液,加入含药培养基(对照组为9 μmol/L的吉非替尼组,实验组为9 μmol/L的吉非替尼组+10 nmol/L的毒胡萝卜素联合用药组),孵育72 h后,收集上清液及贴壁细胞,按说明书加入膜联蛋白(Annexin V-PE),室温孵育20 min后,再加入7-AAD,5 min后,收集细胞,流式细胞仪上机检测。
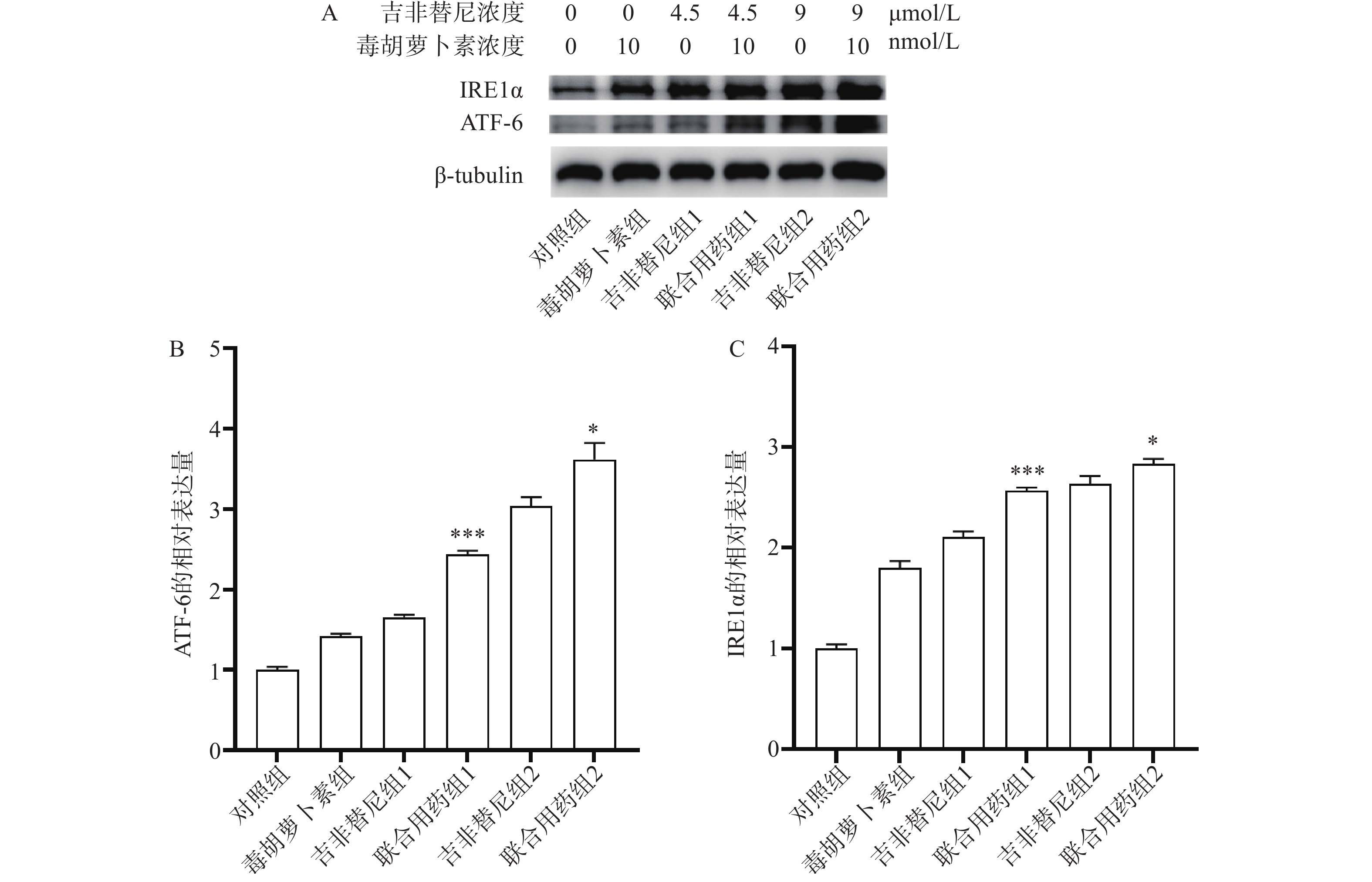
1.2.4 蛋白印迹法检测PC9/GR细胞ERS相关蛋白IRE1α、ATF-6的表达
取对数生长期的PC9/GR铺6孔板,每孔3×105个细胞,孵育过夜,吸弃上清液,加入含药培养基(每孔吉非替尼浓度依次为0、0、4.5、4.5、9、9 μmol/L,毒胡萝卜素浓度依次为0、10、0、10、0、10 nmol/L),培养72 h,去上清液,收集细胞蛋白,BCA法测量样品中总蛋白浓度。蛋白变性后取蛋白样品,使用蛋白印迹法检测IRE1α、ATF-6蛋白表达。
1.3 统计学处理
数据采用GraphPad Prism 9软件进行统计分析,计量资料用(
$ \bar x $ ±s)表示,符合正态分布和方差齐性者采用单因素方差分析的单向分类方差分析(ANOVA),对取得的数据两两比较使用 LSD 检验。以P<0.05 为有统计学意义。2. 结果
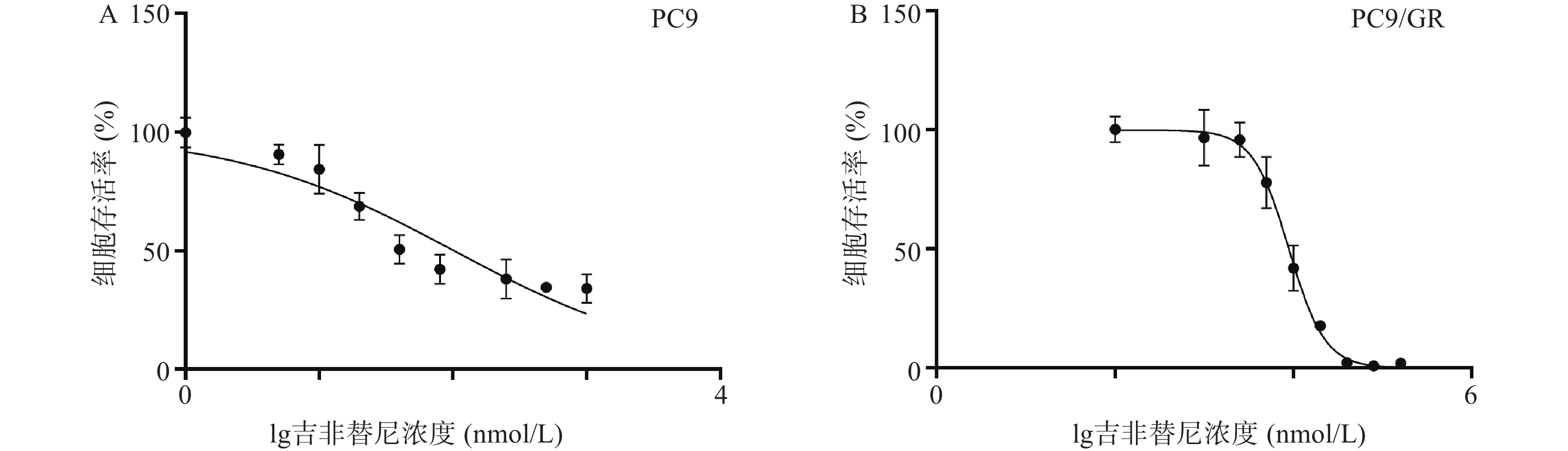
2.1 吉非替尼对PC9和PC9/GR细胞株的IC50值
吉非替尼对人肺腺癌细胞株PC9和PC9/GR的IC50值经计算分别为0.1019 μmol/L(图1A)和8.912 μmol/L(图1B),按公式计算耐药倍数为87.5(本课题中PC9和PC9/GR细胞株的IC50值分别以0.1 μmol/L和9 μmol/L进行实验)。
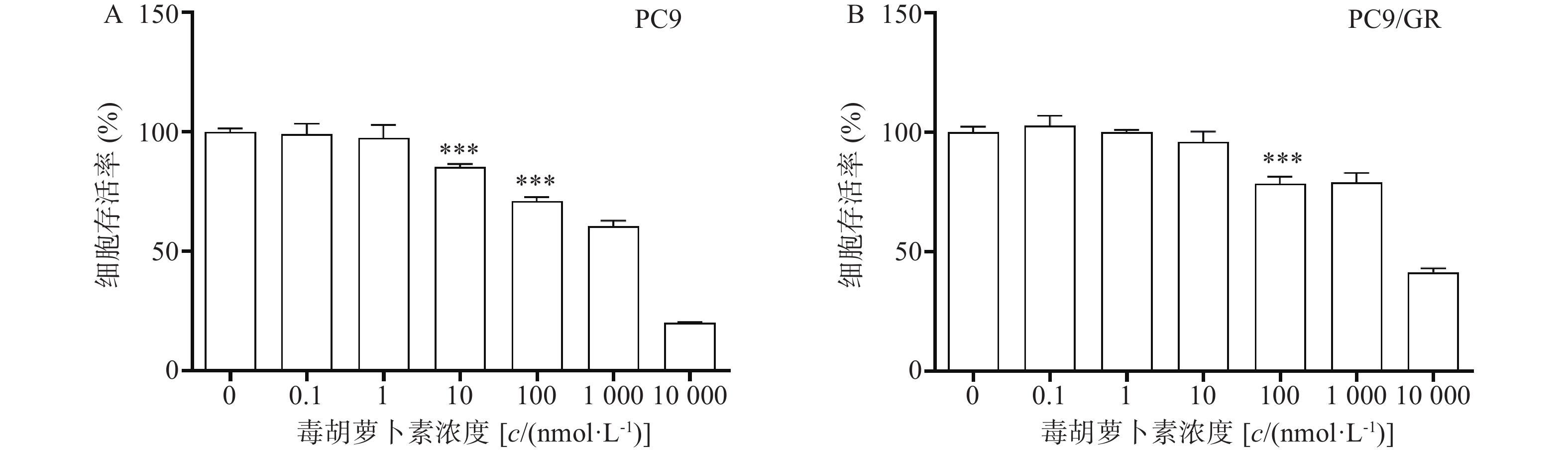
2.2 CCK8法检测毒胡萝卜素对细胞增殖的影响
毒胡萝卜素对人肺腺癌细胞株PC9和PC9/GR的增殖均有抑制作用,呈剂量依赖性。当毒胡萝卜素浓度为10 nmol/L时,对PC9和PC9/GR的抑制率分别为14.7%(图2A)和4.11%(图2B)。毒胡萝卜素浓度为10 nmol/L时对PC9细胞的增殖显示较弱的抑制作用,而对PCR/GR细胞增殖的作用与对照组相比无统计学差异。抑制率(IR)=(1−药物组A值/对照组A值)×100%。本课题中,毒胡萝卜素的工作浓度选择10 nmol/L或者围绕10 nmol/L进行设计。
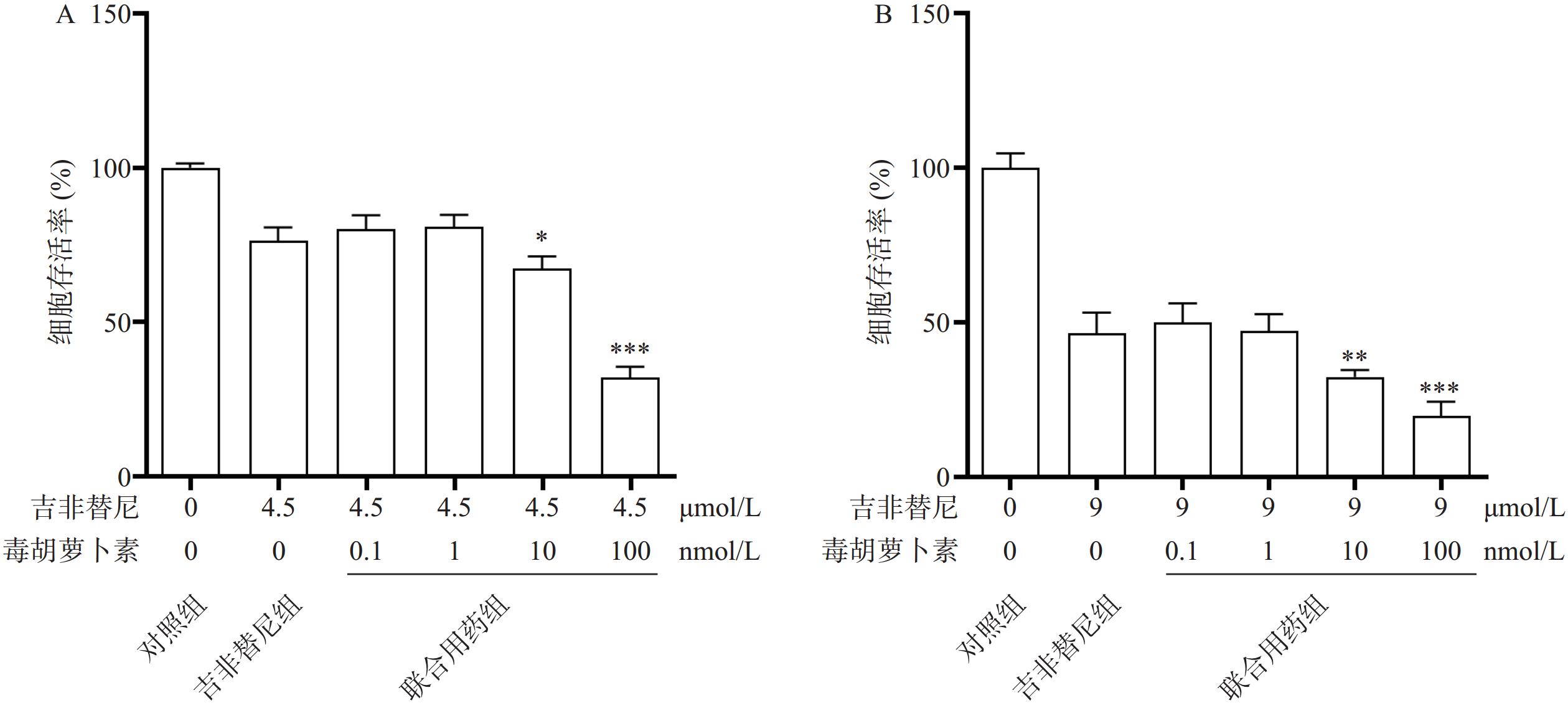
2.3 毒胡萝卜素对PC9/GR耐药的逆转作用
相比于吉非替尼单独用药,毒胡萝卜素(浓度依次为0、0.1、1、10、100 nmol/L)和吉非替尼(4.5 μmol/L或9 μmol/L)联合用药72 h时,PC9/GR的细胞增殖率在10 nmol/L和100 nmol/L时显著下降,并且具有统计学差异性(图3A、B)。
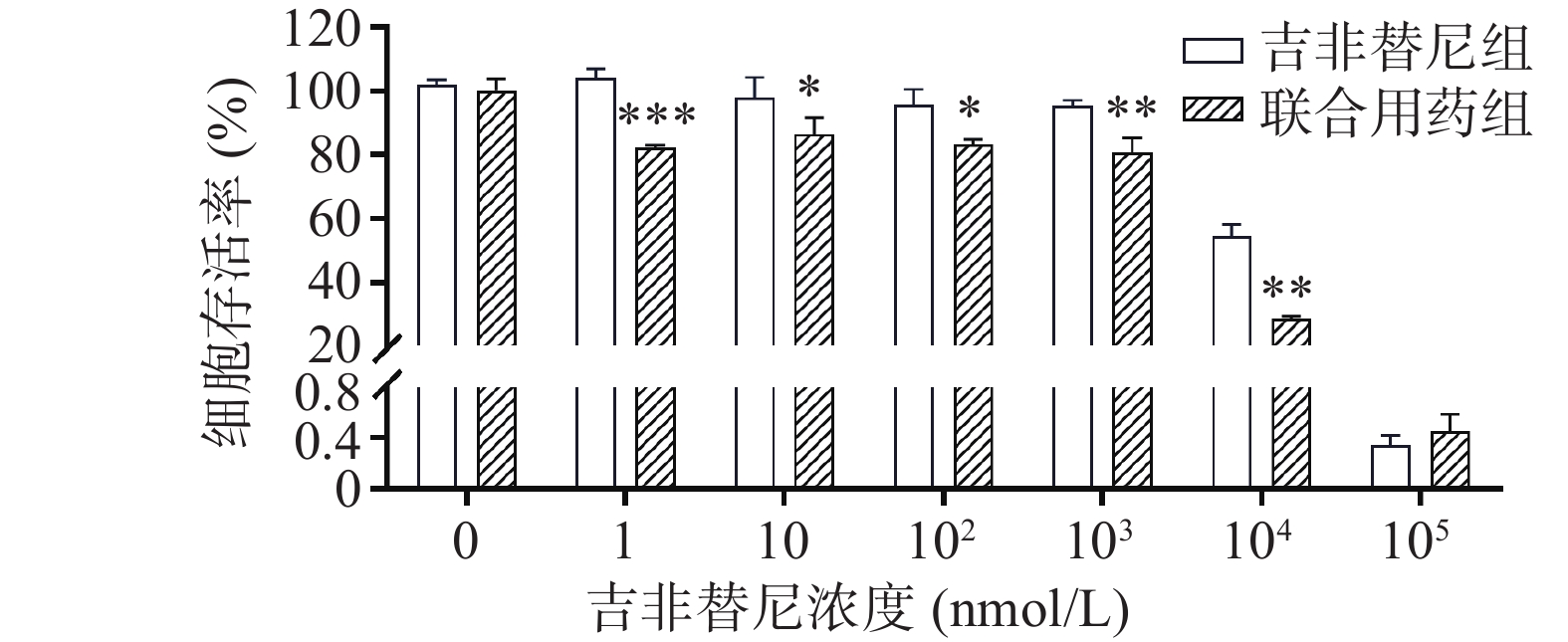
在不同浓度(0、1、10、102、103、104、105 nmol/L)的吉非替尼联合10 nmol/L的毒胡萝卜素作用后,PC9/GR的细胞增殖率相比吉非替尼单独用药(吉非替尼组浓度依次为0、1、10、102、103、104、105 nmol/L)也出现了下降,具有统计学差异(图4)。计算得出吉非替尼单独用药的IC50值为11.039 μmol/L,联合用药后其IC50值为3.584 μmol/L,其RF为3.15。
2.4 药物作用对PC9/GR细胞凋亡的影响
与对照组(图5A)、吉非替尼单独作用(图5B)、毒胡萝卜素单独作用(图5)相比,联合用药(图5)后PC9/GR细胞早期凋亡和晚期凋亡的比例均相应增加,并且具有统计学差异(图5)。说明毒胡萝卜素在一定程度上可以改善PC9/GR细胞的耐药性。
2.5 Western blotting法检测药物作用对细胞PCR/GR中ATF-6和IRE1α蛋白表达的影响
结果显示,与吉非替尼组1或2相比,药物作用后联合用药组1或联合用药组2中PC9/GR细胞的ATF-6及IRE1α蛋白表达均上调(图6A),并且有统计学差异(图6B、C)。ATF-6和IRE1α均是ERS的指标蛋白,说明PC9/GR细胞在药物联合作用后发生了ERS。
3. 讨论
肺癌是当今世界最常见、致死率最高的恶性肿瘤之一,严重危害人类健康[1]。NSCLC是最常见的病理类型,约占所有比例的85%[2]。约70%的NSCLC患者在确诊时已处于晚期,失去了手术的机会。近年来,NSCLC的分子靶向治疗发展迅速,靶向药EGFR-TKIs不断更新,成为放化疗和免疫治疗之外的重要治疗手段之一。
截止目前,EGFR-TKIs已从第1代发展至第3代[3],且有多款第4代靶向药已进入临床实验阶段。然而由于抗肿瘤耐药性,患者使用靶向药一定时间后不可避免的会出现耐药[4]。于是寻找能够克服肿瘤耐药的药物及方法已经成为肿瘤治疗领域中亟待解决的问题。由于中草药植物的毒副作用小且疗效明确,故从中寻找能够克服肿瘤耐药的成分已经成为一种趋势。毒胡萝卜素是从地中海菊属植物中提取的单体成分[5],作为常用的ERS的诱导剂,毒胡萝卜素在科研中有着广泛的应用[6]。也有文献报道其有抗肿瘤活性[7],同时对冠状病毒、合胞病毒、甲型流感病毒等有较强的抑制作用[8]。本研究中使用的吉非替尼耐药细胞株PC9/GR经CCK8实验证明其对吉非替尼具有耐药性。实验结果显示,吉非替尼对PC9的IC50值为0.1019 μmol/L(图1A),对PC9/GR的IC50值为8.912 μmol/L(图1B),耐药倍数为87.6。当毒胡萝卜素浓度为 10 nmol/L时,对PCR/GR细胞增殖的作用与对照组相比无统计学差异,故该浓度的毒胡萝卜素未显示出对PCR/GR的细胞增殖的抑制作用(图2B),故本课题中毒胡萝卜素选择10 nmol/L作为实验浓度。而提高毒胡萝卜素的浓度,其对PC9/GR细胞抑制率也增加,表明毒胡萝卜素本身对于肺腺癌细胞PC9/GR具有抑制作用。实验发现联合用药中当毒胡萝卜素浓度为大于或等于10 nmol/L时,PCR/GR细胞的增殖相比吉非替尼单独用药受到了更强的抑制,并具有显著性差异(图3A、B)。本课题同时使用不同浓度的吉非替尼联合10 nmol/L的毒胡萝卜素共同作用于PC9/GR细胞,结果发现所有联合用药组相比于吉非替尼单独用药组,均对PC9/GR细胞的生长产生抑制作用。分别计算吉非替尼单药和联合用药对PC9/GR细胞的IC50值,发现联合用药的IC50值降低(图4),逆转倍数为3.15。说明10 nmol/L的毒胡萝卜素可以有效改善PC9/GR对吉非替尼的耐药。
肿瘤细胞的耐药性严重影响着患者的预后。耐药突变、自噬、肿瘤免疫微环境都是肿瘤细胞产生耐药的因素[9]。由于耐药突变,EGFR-TKIs治疗已经陷入了研究人员开发新药物与肿瘤细胞产生新耐药突变的循环之中。近年来,因自噬异常与肿瘤发生和进展、细胞死亡及抗肿瘤治疗疗效相联系而受到广泛关注[10]。但是抑制自噬只能延缓EGFR-TKI耐药的产生,并不能有效解决耐药的问题[11]。因此,耐药问题亟待找到新的解决方法。体内低氧、低糖等恶劣环境会导致肿瘤细胞发生ERS,并启动未折叠蛋白反应从而让细胞重新恢复稳态。ERS过度可启动细胞凋亡。因此,ERS也与肺癌治疗息息相关[12]。毒胡萝卜素作为研究ERS常用的激动剂,是一种特异性的肌浆/内质网Ca2+-ATP酶抑制剂,能够使内质网中Ca2+量减少、未折叠蛋白增多,引起ERS[13]。本研究中通过细胞凋亡实验发现,和单独用药相比,毒胡萝卜素联合吉非替尼联合用药可以进一步促进PC9/GR细胞的凋亡(图5B、D和E)。通过蛋白印迹实验证实,联合用药相比吉非替尼单独用药,PC9/GR细胞中ATF-6(图6A、B)和IRE1α蛋白(图6A、C)的表达均上调,表明联合用药后PC9/GR细胞处于ERS状态。这是毒胡萝卜素有效改善PC9/GR对吉非替尼耐药的可能原因之一。
综上所述,体外实验证实毒胡萝卜素低浓度下可以有效促进PC9/GR的ERS,高浓度下对肺癌细胞具有直接杀伤作用,说明毒胡萝卜素本身具有抗肿瘤活性,本课题同时证实,毒胡萝卜素能增强吉非替尼对PC9/GR的杀伤作用。其可能的机制是,在抗肿瘤药物和ERS状态的双重压力下,肺腺癌耐药细胞株PC9/GR对靶向药吉非替尼的敏感性增加。因此,毒胡萝卜素有望成为解决非小细胞肺癌靶向治疗耐药的潜在药物之一,但其中的机制仍需进一步的探索。
-
表 1 红火蚁毒液蛋白质组学
类别 分类 组分 毒素蛋白 组织损伤类蛋白质 PLA2、解聚素/金属蛋白酶、肌肉毒素、PsTX-60 神经毒素类蛋白质 U5-ctenotoxins PK1a、alpha-toxins Tc48a、Scolopendra toxin 抗生类蛋白质 Ponericin L1-like peptides、Ponericin G4-like peptides 血管舒张类蛋白质 心房利钠肽(ANP) 致敏类蛋白质 Soli Ⅰ、Soli Ⅱ、Soli Ⅲ、Pac c 3 allergen-like protein “自我保护”类蛋白质 转铁蛋白、谷胱甘肽-S-转移酶、细胞色素C氧化酶、硫氧还蛋白过氧化物酶、PLA2抑制剂、血管内皮细胞生长因子 管家蛋白 — 卵黄蛋白1-3、核糖体蛋白1-4、核蛋白、ATP依赖解旋酶、络氨酰-DNA磷酸二酯酶、脂蛋白结合蛋白、电压门控钾通道、胰岛素底物受体1-B、短神经肽F受体、神经纤维瘤蛋白、PLD1 、Pescadillo protein、Integrator complex subunit 10 肌肉蛋白 — 肌钙蛋白C、prominin-like protein 化学通讯蛋白 — 气味结合蛋白、化学感受蛋白、信息素结合蛋白 -
[1] MACCONNELL JG, BLUM MS, FALES HM. Alkaloid from fire ant venom: identification and synthesis[J]. Science, 1970, 168(3933): 840-841. doi: 10.1126/science.168.3933.840 [2] HAIGHT KL, TSCHINKEL WR. Patterns of venom synthesis and use in the fire ant, Solenopsis invicta[J]. Toxicon, 2003, 42(6): 673-682. doi: 10.1016/j.toxicon.2003.09.005 [3] 郭小平. 临床上对入侵红火蚁蜇伤的临床特征分析及预防[J]. 中国医药指南, 2015, 13(7): 135-136. [4] 刘栋, 江世宏, 李广京. 入侵红火蚁叮蛰皮肤后的症状表现和变化[J]. 昆虫知识, 2005, 42(4): 453-454, 480. [5] 李天星, 蔡婷婷. 入侵红火蚁蜇伤治疗方法的探讨[J]. 临床皮肤科杂志, 2019, 48(4): 210-212. [6] HOFFMAN DR. Allergens in Hymenoptera venom: XVII. Allergenic components of Solenopsis invicta (imported fire ant) venom[J]. J Allergy Clin Immunol, 1987, 80(3): 300-306. [7] YU YT, WEI HY, FADAMIRO HY, et al. Quantitative analysis of alkaloidal constituents in imported fire ants by gas chromatography[J]. J Agric Food Chem, 2014, 62(25): 5907-5915. doi: 10.1021/jf501423y [8] 张文倩, 胡林, 陈立, 等. 基于主成分分析和聚类分析的红火蚁毒腺生物碱的比较研究[J]. 华南农业大学学报, 2015, 36(6): 76-81. [9] CHEN J, SHANG H, JIN X. Interspecific variation of Delta1, 6-piperideines in imported fire ants[J]. Toxicon, 2010, 55(6): 1181-1187. doi: 10.1016/j.toxicon.2010.01.009 [10] WU XQ, WANG GY, XU GX, et al. Synthesis and insecticidal activity of fire ant venom alkaloid-based 2-methyl-6-alkyl-Δ1, 6-piperideines[J]. Molecules, 2022, 27(3): 1107. doi: 10.3390/molecules27031107 [11] CHEN J, ZHAO Y, LI XC, et al. Pyridine alkaloids in the venom of imported fire ants[J]. J Agric Food Chem, 2019, 67(41): 11388-11395. doi: 10.1021/acs.jafc.9b03631 [12] VANDER MEER RK, CHINTA SP, JONES TH. Novel alkaloids from the fire ant, Solenopsis geminata[J]. Naturwissenschaften, 2022, 109(1): 15. doi: 10.1007/s00114-022-01786-w [13] 张惠菊, 陈立, 王文凯. 不同品级红火蚁体内生物碱含量的比较[J]. 环境昆虫学报, 2018, 40(2): 468-473. [14] 官迪, 廖晓兰, 陈立. 中国和美国红火蚁毒腺生物碱组分的比较分析[J]. 昆虫学报, 2013, 56(4): 365-371. [15] CHEN J, Du YZ. Fire ants feed their nestmates with their own venom[J]. J Insect Physiol, 2022, 142: 104437. doi: 10.1016/j.jinsphys.2022.104437 [16] 李晓玲. 红火蚁毒液对蚁巢细菌群落的影响[D]. 荆州: 长江大学, 2020. [17] JOUVENAZ DP, BLUM MS, MACCONNELL JG. Antibacterial activity of venom alkaloids from the imported fire ant, Solenopsis invicta Buren[J]. Antimicrob Agents Chemother, 1972, 2(4): 291-293. doi: 10.1128/AAC.2.4.291 [18] 王丽坤, 黄俊, 章金明, 等. 基于Wolff-Kishner-黄鸣龙法合成红火蚁告警信息素及其触角电位反应[J]. 浙江农业学报, 2021, 33(10): 1897-1903. [19] CHEN L, SHARMA KR, FADAMIRO HY. Fire ant venom alkaloids act as key attractants for the parasitic phorid fly, Pseudacteon tricuspis (Diptera: Phoridae)[J]. Naturwissenschaften, 2009, 96(12): 1421-1429. doi: 10.1007/s00114-009-0598-6 [20] ELIYAHU D, ROSS KG, HAIGHT KL, et al. Venom alkaloid and cuticular hydrocarbon profiles are associated with social organization, queen fertility status, and queen genotype in the fire ant Solenopsis invicta[J]. J Chem Ecol, 2011, 37(11): 1242-1254. doi: 10.1007/s10886-011-0037-y [21] HOFFMAN DR. Allergens in Hymenoptera venom: XXI. Cross-reactivity and multiple reactivity between fire ant venom and bee and wasp venoms[J]. J Allergy Clin Immunol, 1988, 82(5): 828-834. doi: 10.1016/0091-6749(88)90085-1 [22] HOFFMAN DR. Sol i 1, the phospholipase allergen of imported fire ant venom[J]. J Allergy Clin Immunol, 2005, 115(3): 611-616. doi: 10.1016/j.jaci.2004.11.020 [23] BORER AS. Crystal structure of Sol i 2: a major allergen from fire ant venom[J]. J Mol Biol, 2012, 415(4): 635-648. doi: 10.1016/j.jmb.2011.10.009 [24] PADAVATTAN S. Crystal structure of the major allergen from fire ant venom, Sol i 3[J]. J Mol Biol, 2008, 383(1): 178-185. doi: 10.1016/j.jmb.2008.08.023 [25] HOFFMAN DR. Allergens in Hymenoptera venom XXIV: the amino acid sequences of imported fire ant venom allergens Sol i II, Sol i III, and Sol i IV[J]. J Allergy Clin Immunol, 1993, 91(1): 71-78. doi: 10.1016/0091-6749(93)90298-T [26] 韩雪清, 林祥梅, 张永国, 等. 重组红火蚁毒素致敏原Sol i1的表达及活性分析[J]. 昆虫学报, 2007, 50(7): 655-661. [27] SCHMIDT M, et al. Nucleotide sequence of cDNA encoding the fire ant venom protein Sol i II[J]. FEBS Lett, 1993, 319(1-2): 138-140. doi: 10.1016/0014-5793(93)80053-W [28] SCHMIDT M, MCCONNELL TJ, HOFFMAN DR. Immunologic characterization of the recombinant fire ant venom allergen Sol i 3[J]. Allergy, 2003, 58(4): 342-349. doi: 10.1034/j.1398-9995.2003.00085.x [29] 王建峰, 林祥梅, 张书霞, 等. 重组红火蚁毒素蛋白Soli Ⅳ致病机理的初步研究[J]. 中国畜牧兽医, 2008, 35(1): 83-86. [30] DOS SANTOS PINTO JR, FOX EG, SAIDEMBERG DM, et al. Proteomic view of the venom from the fire ant Solenopsis invicta Buren[J]. J Proteome Res, 2012, 11(9): 4643-4653. doi: 10.1021/pr300451g [31] YE JW, LI J. First proteomic analysis of the role of lysine acetylation in extensive functions in Solenopsis invicta[J]. PLoS One, 2020, 15(12): e0243787. doi: 10.1371/journal.pone.0243787 [32] KOYA S, CRENSHAW D, AGARWAL A. Rhabdomyolysis and acute renal failure after fire ant bites[J]. J Gen Intern Med, 2007, 22(1): 145-147. doi: 10.1007/s11606-006-0025-z [33] KRIEGER MJ, ROSS KG. Identification of a major gene regulating complex social behavior[J]. Science, 2002, 295(5553): 328-332. doi: 10.1126/science.1065247 [34] 汤晓丽, 吴雪, 罗毅, 等. 中西医结合综合护理干预在红火蚁叮蛰伤患者中的应用研究[J]. 蛇志, 2022, 34(2): 259-261. -






 下载:
下载:


 下载:
下载:


