-
我国的绿茶资源十分丰富,茶多酚系指绿茶中富含的多种酚类化合物,在绿茶中含量约为15%~30%[1],具有降低血压、调血脂、抗菌消炎、治疗放射损伤、预防骨质疏松、减肥、抗癌、抗氧衰老等广泛的药理作用[2-7]。
随着大众对天然健康产品需求日益增长,茶多酚市场展现出强劲的发展动力,茶多酚的提取工艺仍是影响茶多酚制品深加工和跨界开发利用的重要环节[8]。溶剂萃取法、超声提取法、微波提取法、生物酶提取法和超临界萃取法(SFE)等是业内常用的茶多酚提取方式[9]。传统有机溶剂萃取操作简便但存在提取得率及纯度低、溶剂残留、耗时长等缺点;超临界萃取法效率高但设备投资高因而推广性不强;酶辅助提取条件温和、环境友好,但成本较高,酶制剂易残留;超声提取法具有高效、快速的优点,常与溶剂萃取法结合,以提高茶多酚得率并提升企业经济效益,但提取时间过长会影响提取效果[9-12];微波提取法以穿透力强、可供选择溶剂较多且用量少、产物活性优良等为优势,适用于耐热成分的提取[13-16]。常见的提取工艺优化方法有均匀试验、正交试验(OED)、响应面优化(RSM)等[17],均匀试验适用于多因素、多水平情况但追求最大化均匀性、忽略部分正交性导致了结果的不稳定性[18-20],正交试验具有试验量少的优点但最佳参数仅局限于已设水平的组合[21],在更加广泛的范围内考察各因素间的交互作用并希望得到高精确度的回归方程则多采用响应面优化法[22]。
-
高级绿茶,实验前置于50 ℃烘箱干燥,研磨至细粉;茶多酚标准品(含量≥98%,乐美天医药科技有限公司)。
试剂: 无水乙醇、KH2PO4、FeSO4·7H2O、Na2HPO4·12H2O (分析纯,中国医药集团上海化学试剂公司);没食子酸(纯度≥ 98%)、四水合酒石酸钠钾(分析纯,德国Ehrenstorfer公司)。
-
仪器: IS09001电子分析天平(德国Sartorius公司);G70D20CN1P-D2(S0)微波炉(广东格兰仕有限公司);ANPEL 2300TH超声波清洗器(上海安谱有限公司);UV2310 紫外-可见分光光度计[天美(中国)科学仪器有限公司];DHG-9240A电热恒温鼓风干燥箱(上海一恒科学仪器有限公司)。
-
⑴精密称取0.252 5 g FeSO4·7H2O、1.251 3 g 四水合酒石酸钠钾,置于250 ml容量瓶中,加入适量的蒸馏水充分溶解后稀释定容,摇匀即得酒石酸亚铁溶液。
⑵精密称取2.268 2 g KH2PO4置于250 ml容量瓶中,加入适量的蒸馏水并用超声波辅助溶解,蒸馏水稀释定容,摇匀即得0.066 67 mol/L Na2HPO4水溶液;精密称取23.876 0 g Na2HPO4·12H2O置于1000 ml容量瓶中,加入适量的蒸馏水并用超声波辅助溶解,蒸馏水稀释定容,摇匀即得0.066 67 mol/L KH2PO4水溶液。将上述磷酸二氢钾水溶液和磷酸氢二钠水溶液以3∶17的配比混合,搅匀,即得pH=7.5的磷酸盐缓冲液[16]。
⑶精密称取没食子酸0.050 0 g于50 ml容量瓶,加入适量的蒸馏水充分溶解后,蒸馏水稀释定容,摇匀即得1.0 mg/ml的没食子酸标准溶液。
⑷精密称取茶多酚标准品0.015 0 g于10 ml容量瓶,加入适量的蒸馏水充分溶解后,蒸馏水稀释定容,摇匀即得1.5 mg/ml茶多酚标准品母液。
-
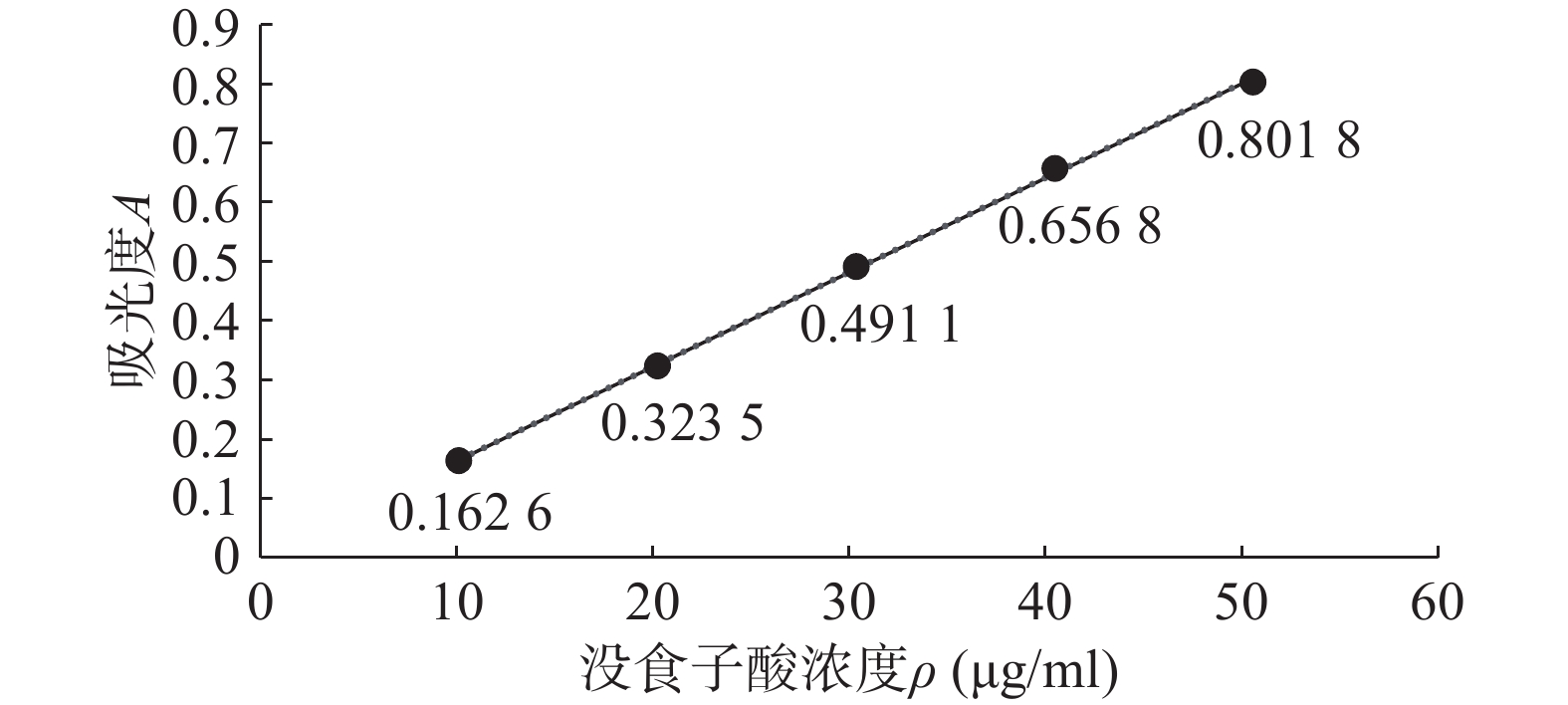
没食子酸标准曲线绘制: 取25 ml棕色容量瓶,分别加入0.00、0.25、0.50、0.75、1.0、1.25ml的没食子酸标准溶液,再加入4.00 ml蒸馏水和5.00 ml酒石酸亚铁溶液,最后加入磷酸盐缓冲液稀释定容,摇匀即得0.00、10.00、20.00、30.00、40.00、50.00 μg/ml没食子酸系列标准溶液。以0.00 μg/ml没食子酸溶液作为参比溶液,测定波长为540 nm对应的吸光度,绘制没食子酸标准曲线并计算线性回归方程[23, 24]。
茶多酚标准品校正因子f测定: 精密量取茶多酚标准品母液0.50 ml于25 ml容量瓶,照上述没食子酸标准曲线绘制中的溶液配制方法,即得30.00 μg/ml茶多酚标准品溶液。测定540 nm波长对应吸光度,将此数据代入没食子酸标准曲线回归方程求算ρ没食子酸,按下列公式即可求得f。
$${f}\text=\frac{{\rho}_{\text{茶多酚标准品}}}{{\rho}_{\text{没食子酸}}}\text=\frac{\text{30.00}}{{\rho}_{\text{没食子酸}}} $$ -
准确称取1.0 g高级绿茶粉末于250 ml锥形瓶,以不同提取条件微波辅助提取,提取液减压抽滤并弃去茶饼,准确量取澄清提取液的体积后保存适量提取液,精密量取0.30 ml于25 ml棕色容量瓶,再加入4.00 ml蒸馏水和5.00 ml酒石酸亚铁溶液,最后加入磷酸盐缓冲液稀释定容,摇匀即得提取液样品溶液。在波长540 nm处测定吸光度,茶多酚提取得率按下列公式计算:
$$\text{茶多酚提取得率}=\frac{{nf\rho V}}{{m}{×}{\text{10}}^{{-6}}}\times {100\%} $$ 式中:n为稀释倍数;f为校正因子;ρ为没食子酸质量浓度( μg/ml);m为茶叶质量(g);V为提取液体积( ml) [24]。
-
以提取时间、微波输出功率、乙醇体积分数、料液比为4项考察因素,设计相应的5个适宜水平进行茶多酚提取(见表1),按“1.3.3”项下方法进行吸光度测定,计算茶多酚提取得率。
表 1 单因素实验条件
因素 水平 提取条件 提取时间(t/s) 10 30 50 70 90 350 w,60% 乙醇,料液比1:60 微波输出功率(w) 70 210 350 490 630 50 s,60% 乙醇,料液比1:60 料液比(g/ml) 1∶20 1∶40 1∶60 1∶80 1∶100 50 s,350 w,60% 乙醇 乙醇体积分数(%) 0 20 40 60 80 50 s,350 w,料液比1:60 -
依据单因素实验数据,选定各单因素的适宜水平,使用Design Expert 12.0.3.0统计软件下Box-Behnken方法[25],把茶多酚提取得率作为响应值,设计四个因素三种水平优化提取工艺进行响应面实验,得到各因素与响应值的二次多项回归方程及方差分析模型,预测最佳提取工艺并进行验证。
-
如图1,在没食子酸0.00 ~50.00 μg/ml浓度范围内,没食子酸标准曲线方程: A=0.015 9ρ+0.003 7(r=0.999 7),吸光度A和没食子酸浓度ρ线性关系良好。
-
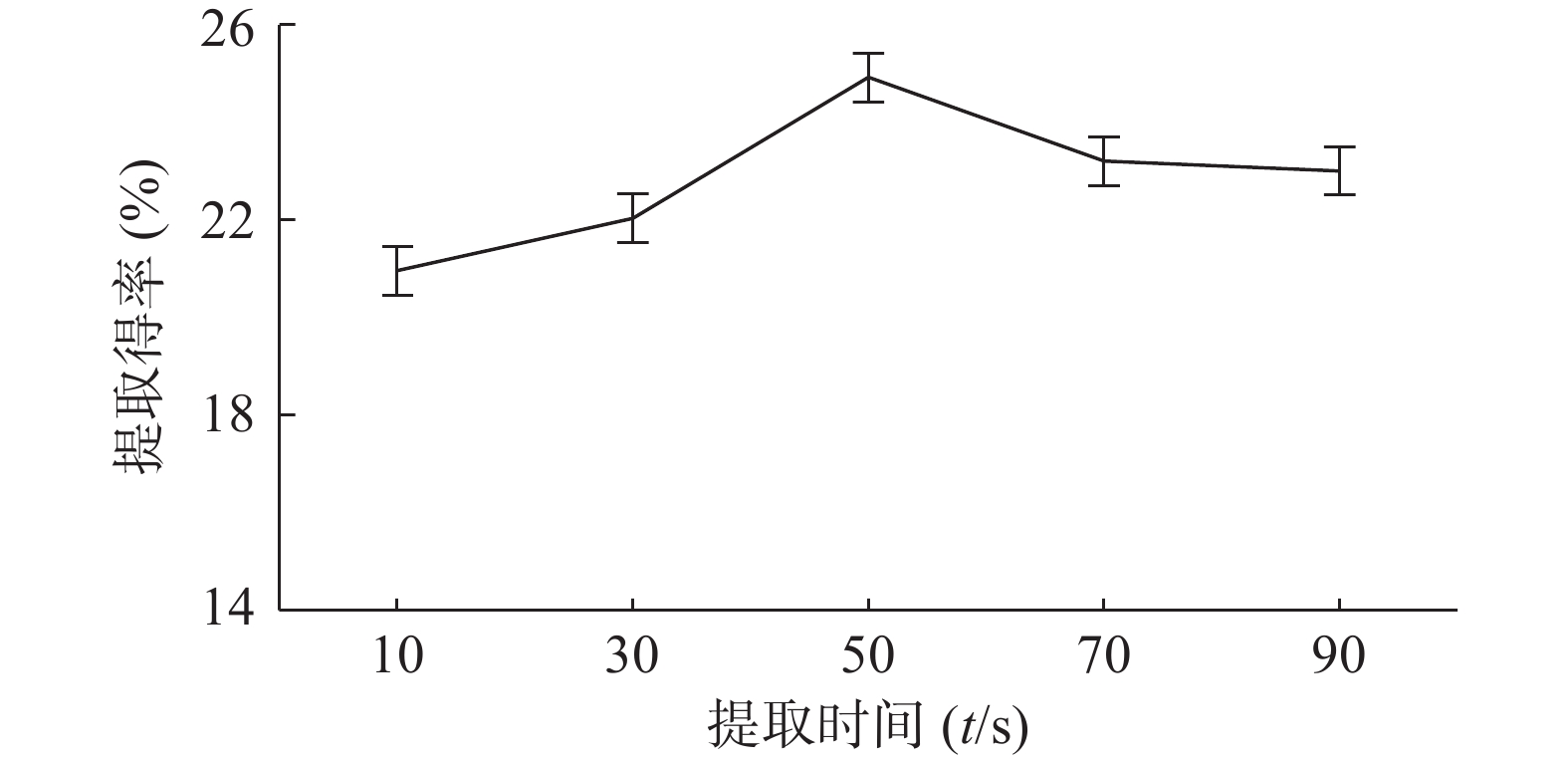
如图2所示,固定微波输出功率、料液比、乙醇体积分数,提取时间在10~90 s范围内,随着提取时间延长,茶多酚提取得率先增大后减小,提取时间为50 s时,茶多酚提取得率最大值为24.93%。原因推测由于时间过长,茶叶中除了茶多酚的其他易溶于乙醇的成分被提取出来,导致茶多酚的醇提液饱和[26]。因此最佳提取时间为50 s。
-
如图3所示,固定提取时间、料液比、乙醇体积分数,微波输出功率在70~630 w范围内,茶多酚提取得率随微波功率的增加先上升后小幅降低,在提取时间为350 w时,茶多酚提取得率达到24.27%,为70~630 w范围内的最大值。原因推测为微波输出功率过低无法有效破碎细胞使其释放茶多酚,过高导致茶多酚被氧化破坏[27]。因此最佳微波输出功率为350 w。同时,当微波输出功率为210 w和490 w时,茶多酚提取得率相对于其他功率下较高,提示我们考察微波输出功率影响时,其范围可适当拓宽。
-
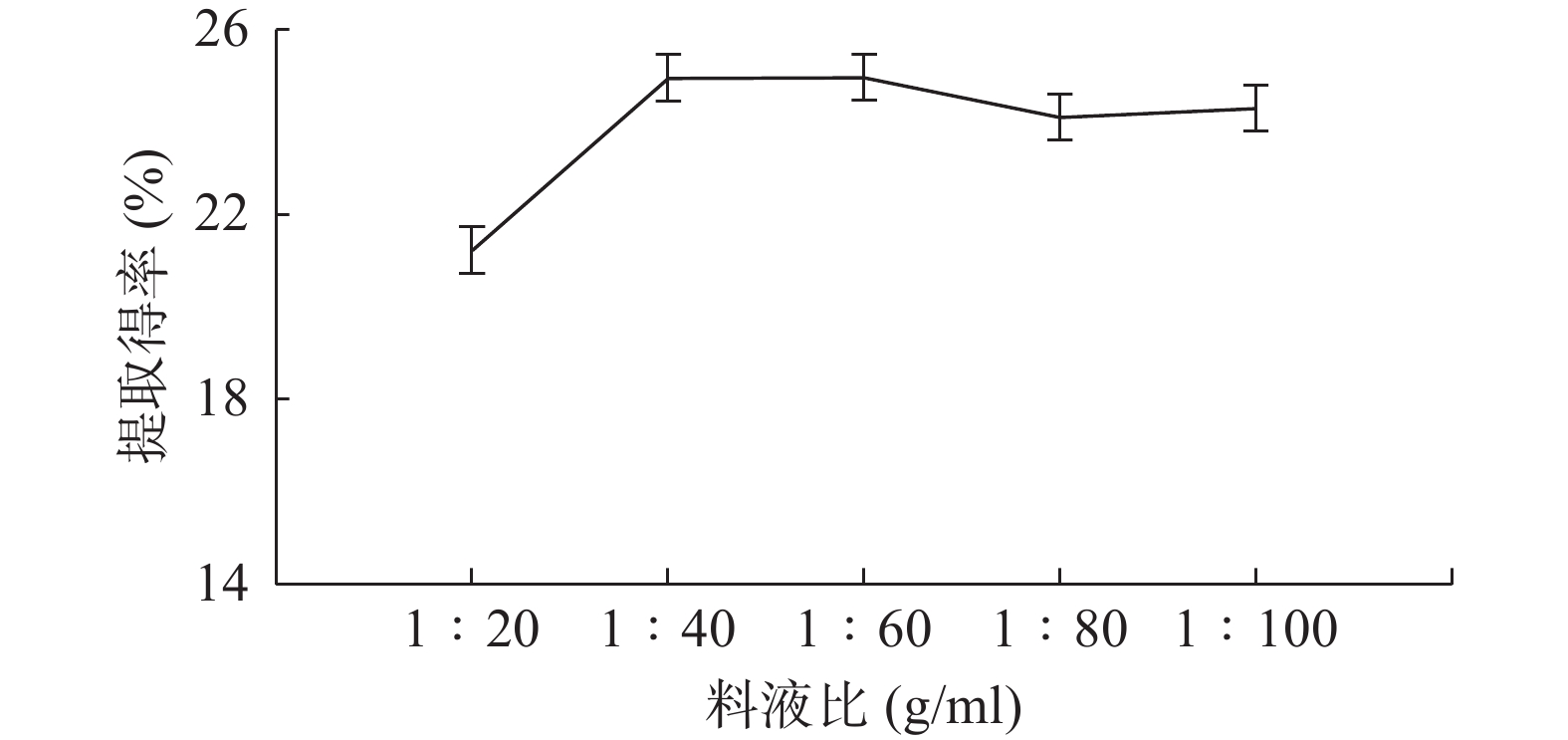
如图4所示,固定提取时间、微波输出功率、乙醇体积分数的条件下,料液比在1∶20 (g/ml) ~1∶100 (g/ml)范围内,茶多酚提取得率随料液比增加先增加,后逐渐稳定,在料液比为 1∶40 (g/ml)和1∶60 (g/ml)时,茶多酚提取得率分别达到24.95%和24.96%(最大值)。原因推测为料液比过低时溶剂量不足,导致提取不完全,由于料液比过高,茶多酚已经达到了较大溶出度、其他杂质溶出部分竞争茶多酚溶出空间[28]。因此最佳料液比为1∶60 (g/ml)。
-
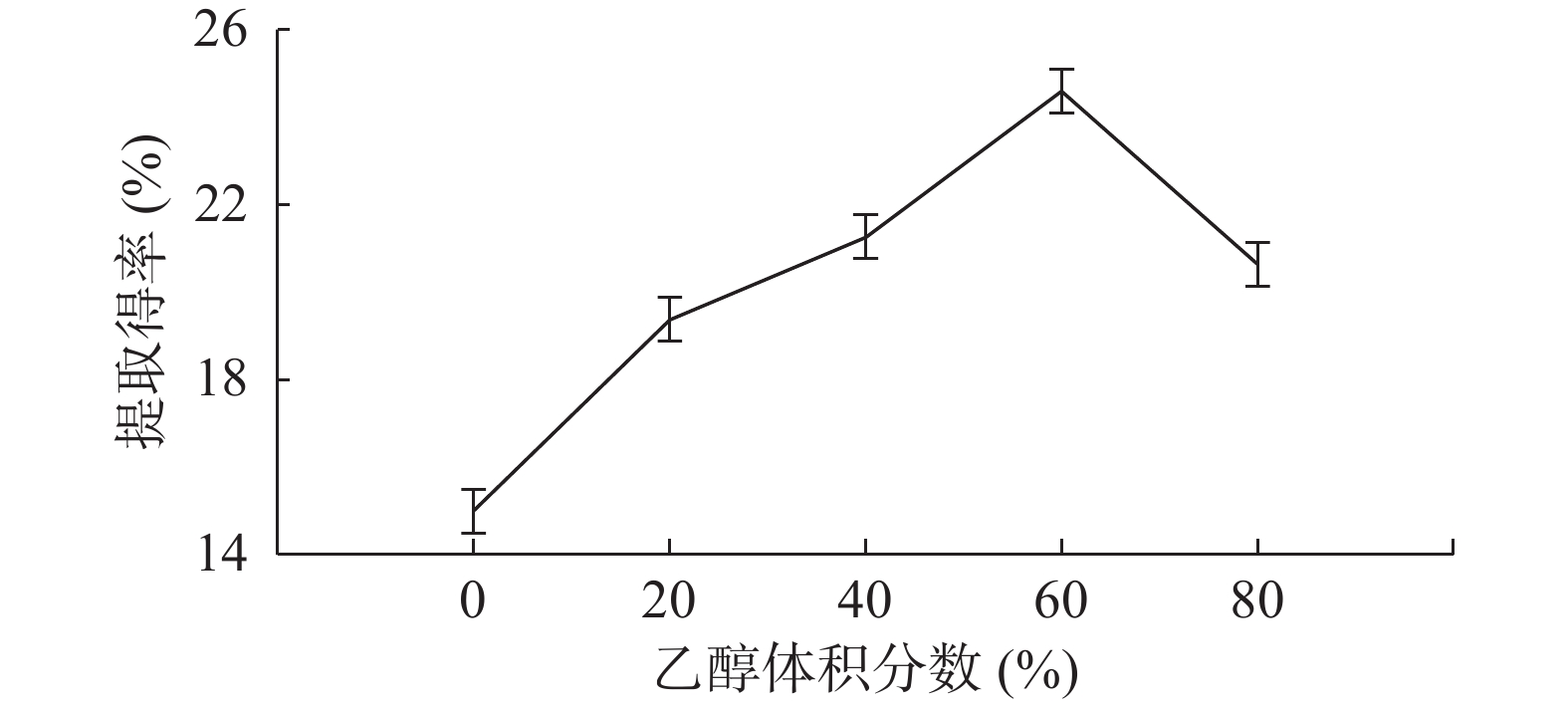
如图5所示,固定提取时间、微波输出功率、料液比,乙醇体积分数在0%~80%范围内,随着乙醇体积分数增加,茶多酚提取得率先增大后减小,乙醇体积分数为60%时,茶多酚提取得率最大值24.59%。因此,最佳乙醇体积分数为60%。同时,把乙醇体积分数为0%与其他水平时对应的提取得率做对比,我们可以发现乙醇提取茶多酚效率远高于纯水提取。
-
根据单因素实验中各因素水平对茶多酚提取得率的影响结果,按照表2的响应面设计方案并进行实验,结果如表3所示。
表 2 响应面设计各因素及水平
因素 编号 水平 −1 0 1 提取时间(t/s) A 30 60 90 微波输出功率(w) B 70 350 630 料液比(g/ml) C 1∶20 1∶40 1∶60 乙醇体积分数(%) D 40 60 80 表 3 响应面实验条件及结果
序号 A B C D 提取得率(%) 1 0 1 1 0 21.24 2 0 1 −1 0 15.86 3 0 0 −1 1 12.67 4 0 1 0 −1 19.55 5 0 0 1 −1 21.63 6 1 0 0 1 20.58 7 1 0 −1 0 16.50 8 1 0 0 −1 20.61 9 0 −1 −1 0 19.76 10 −1 0 0 −1 24.61 11 −1 0 1 0 23.69 12 0 −1 0 −1 23.53 13 0 0 0 0 25.61 14 0 0 0 0 25.52 15 0 0 0 0 24.22 16 1 0 1 0 23.04 17 0 −1 1 0 20.01 18 1 −1 0 0 22.29 19 0 0 0 0 25.67 20 −1 1 0 0 23.71 21 −1 0 0 1 20.85 22 0 −1 0 1 18.21 23 −1 0 −1 0 19.57 24 0 0 0 0 26.86 25 0 1 0 1 19.55 26 0 0 1 1 21.40 27 0 0 −1 −1 16.37 28 1 1 0 0 15.62 29 −1 −1 0 0 22.49 -
把提取时间(A)、微波输出功率(B)、料液比(C)、乙醇体积分数(D)作为自变量,茶多酚提取得率(%)Y作为因变量,进行回归方程拟合和方差分析,得回归方程如下:
Y=+25.58−1.36A−0.896 2B+2.52C−1.09D−1.97AB+0.604 3AC+0.929 6AD+1.28BC+1.33BD+0.868 1CD−1.23A2−2.70B2−3.96C2−2.99D2
回归模型极显著(P<0.0001),失拟项不显著(P>0.05),r=0.967 0,结果表明优化条件下茶多酚提取得率的实际值与二次回归方程的预测值吻合良好(表4),说明该数学模型适用于高级绿茶中茶多酚提取工艺的预测。其中,A、C、D、AB、B2、C2、D2对响应值茶多酚提取得率的影响极显著(P<0.01),B、A2对响应值茶多酚提取得率的影响显著(P<0.05)。
表 4 回归方程模型显著性分析表
分析项 平方和 自由度 均方 F值 P值 回归模型 321.40 14 22.31 14.41 <0.0001 A 22.10 1 22.10 14.28 0.0020 B 9.64 1 9.64 6.23 0.0257 C 76.35 1 76.35 49.32 <0.0001 D 14.14 1 14.14 9.14 0.0091 AB 15.57 1 15.57 10.06 0.0068 AC 1.46 1 1.46 0.9436 0.3478 AD 3.46 1 3.46 2.23 0.1573 BC 6.60 1 6.60 4.26 0.0580 BD 7.09 1 7.09 4.58 0.0504 CD 3.01 1 3.01 1.95 0.1846 A2 9.83 1 9.83 6.35 0.0245 B2 47.31 1 47.31 30.56 <0.0001 C2 101.70 1 101.70 65.70 <0.0001 D2 57.82 1 57.82 37.35 <0.0001 残差 21.67 14 1.55 失拟项 18.18 10 2.08 0.2497 净误差 3.49 4 总差 334.08 28 -
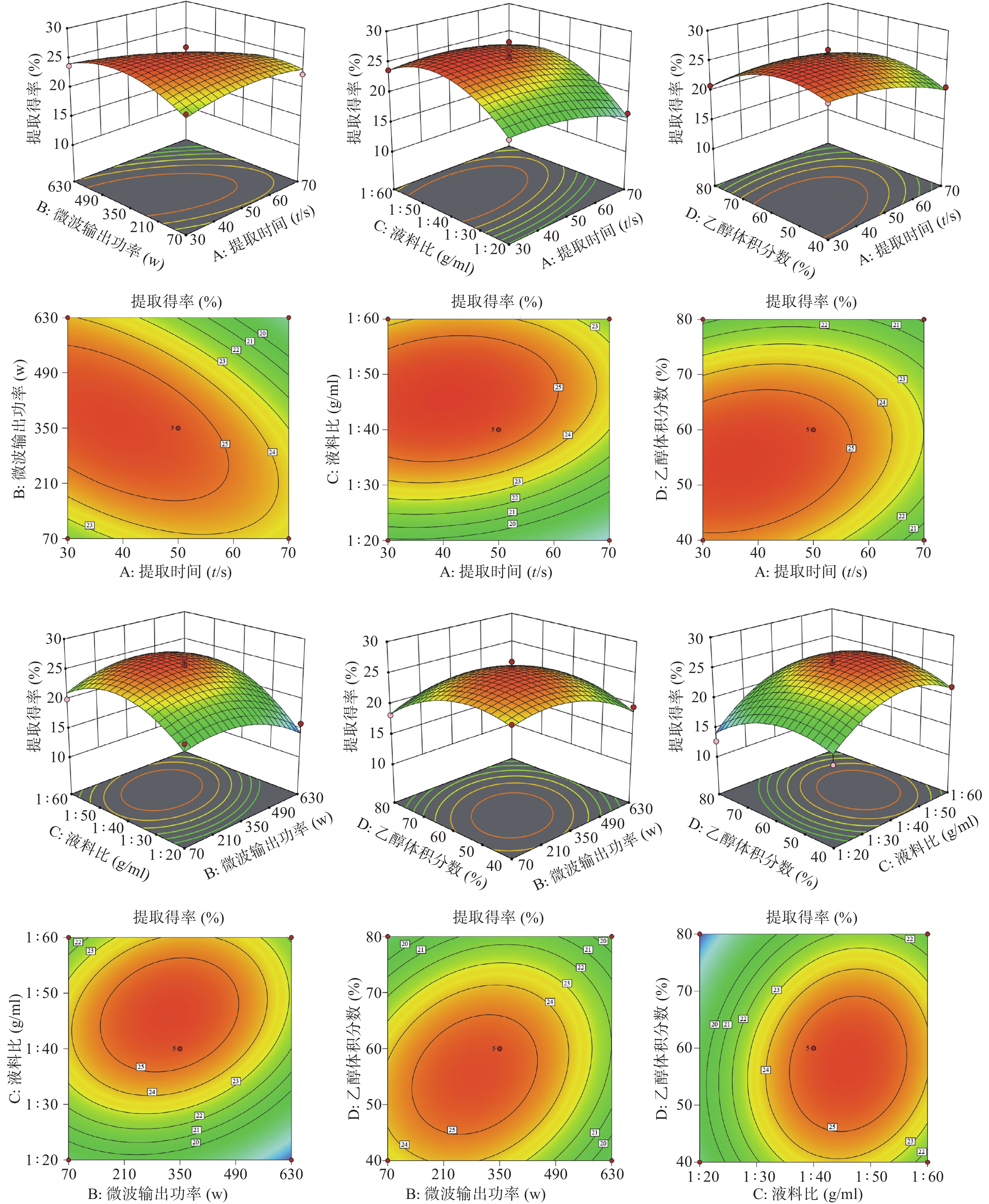
将提取时间A、微波输出功率B、料液比C、乙醇体积分数D中任意两个因素作为X1、X2,将茶多酚提取得率设为响应值Z,创建两个因素相互作用的响应平面图。3D曲线单因素方向坡度越陡即斜率越大,反映出该单因素对茶多酚提取得率的影响越具显著性; 3D曲线越陡、等高线轮廓呈椭圆形,反映两个因素交互作用对茶多酚的提取得率有更显著的影响[29-32]。结合方差分析表,各因素对茶多酚提取得率的影响如下: 料液比(C)>提取时间(A)>乙醇体积分数(D)>微波输出功率(B)。同时,图6直观显示提取时间A和微波输出功率B交互作用对茶多酚提取得率的影响极为显著,其余因素间交互作用不显著,各交互作用对茶多酚提取得率的影响如下: AB>BD>BC>AD>CD>AC。
-
利用所得二次回归方程模型预测绿茶中茶多酚的最佳提取工艺为: 提取时间37.41 s、微波输出功率369.28 w、料液比1∶45.13 (g/ml)、乙醇体积分数55.44%,该优化条件下茶多酚预测提取得率为26.42%。从实际实验条件出发,将最佳提取条件修改为: 微波提取时间37s、微波输出功率350 w、料液比1∶45 (g/ml)、乙醇体积分数55%,并进行三次平行重复实验验证,茶多酚平均提取得率为25.56%。
-
茶多酚是绿茶中的一类多酚活性物质,本实验通过建立没食子酸标准曲线、引入校正因子测算茶多酚提取得率。从支持绿色工艺和溶剂常用性角度,本实验采用常见的食品级溶剂乙醇萃取技术取代传统的有害有机溶剂萃取技术[12]。基于响应面优化法试验次数少、周期短优势[14],为解决前期文献中有关微波提取茶多酚的报道大多局限于单因素实验研究而缺乏优化的系统实验方案[33]、各因素水平选取范围参差不齐[13, 34]以及其他工艺优化方法低精度、预测差等问题,本实验考察了微波提取时间、微波输出功率、料液比、乙醇体积分数4个单因素对茶多酚提取得率的影响,并确定各单因素适宜范围,在此基础上采用响应面优化方法预测了最佳提取条件,考虑到实际生产所需调整茶多酚最佳提取条件,并进行三次平行重复实验验证。
实验结果表明响应面设计茶多酚提取得率实际值与理论值相差不大,证明响应面实验设计在优化茶多酚提取工艺方面具有可靠性。综上,响应面优化微波辅助茶多酚的提取工艺具有操作性强、生产周期短、生产成本较低、准确度高、稳定性强的优势,能同步考察较多因素对工艺的综合影响,为茶多酚的实际生产领域提供技术支撑,在茶多酚大规模工业化生产方面具有较大的应用潜力[35, 36]。
Optimization of microwave-assisted extraction of green tea polyphenols by response surface methodology
-
摘要:
目的 优化微波辅助绿茶茶多酚的提取工艺。 方法 建立没食子酸标准曲线,通过引入校正因子测定绿茶提取液中茶多酚浓度以计算茶多酚提取得率;重点研究微波提取时间、微波输出功率、料液比、乙醇体积分数4项单因素水平对茶多酚提取得率的影响,初步确定4项单因素水平的适宜范围,并采用响应面法进一步提高绿茶茶多酚提取工艺。 结果 最佳提取工艺为:提取时间37 s、微波输出功率350 w、料液比1∶45 (g/ml)、乙醇体积分数55%,茶多酚实际提取得率为25.65%,与理论值相差不大。 结论 响应面优化的微波辅助绿茶茶多酚提取工艺省时可行、提取得率较高。 Abstract:Objective To optimize the microwave-assisted extraction process of green tea polyphenols. Methods The extraction yield of tea polyphenols was figured up by building the standard curve of gallic acid and examining the concentration of tea polyphenols in green tea extract with the introduction of a correction factor. The effects of four single factor levels of microwave extraction time, microwave output power, liquid-to-material yield, and ethanol volume fraction on the extraction yield of tea polyphenols were primarily studied in this experiment. The response surface was applied to further optimize the extraction process of green tea polyphenols after exploring the appropriate range of four single factor levels. Results The optimal extraction process was as follows: extraction time 37 s, microwave output power 350 w, material - liquid yield 1∶45 (g/ml), ethanol volume fraction 55%, and the actual extraction yield of tea polyphenols was 25.65%, which was not much different from the theoretical value. Conclusion The microwave-assisted green tea polyphenol extraction process optimized by response surface methodology is time-saving and practicable, and the extraction yield is high. -
Key words:
- green tea /
- tea polyphenols /
- content determination /
- response surface optimization /
- extraction process
-
临床药物研究需要严格、标准、规范的数据管理[1],众多文献阐述了统计分析前临床试验数据核查的相关问题及改进措施[1-4],然而,对于统计分析所得数据的核查却鲜有报道。本文以生物等效性(BE)研究为例,介绍统计分析数据核查的要点,包括:试验分组的随机数字表、药代动力学(PK)主要参数以及BE的分析计算数据和结果在相应的软件中是否能够重现、与原统计分析报告是否一致。同时,统计专业人员对核查提出的问题进行敏感性分析,并出具相关报告。
1. 资料与方法
1.1 资料来源
本文所使用的数据来自我部于2019-2021年间所接受的18项BE研究统计分析数据核查的结果,所测试的药物分别为抗病毒、抗菌药物以及治疗心脑血管疾病、糖尿病等疾病的药物。
1.2 统计学方法
1.2.1 采用SAS软件运行得出随机数字表
随机指利用SAS软件中的随机化功能,事先给出种子数,进行随机化分组。该方法简便易行、可重复、符合随机化要求[5]。通过SAS系统的“PROC PLAN SEED=种子数”过程实现两组等比例随机化。例如,将001~010这10个数随机分配为A、B两组,种子数设定为20200506,则生成的结果A组为002、003、006、008和009,B组为001、004、005、007和010。核查时,只要采用试验时设定的种子数,则通过SAS运行得到的A组和B组的数据不变。用同样的随机种子,通过SAS程序运行,能够得出相同的随机表。由此证明研究对象进入试验组和对照组机会均等。
1.2.2 采用WinNonlin软件计算主要PK参数、SAS软件进行BE评价
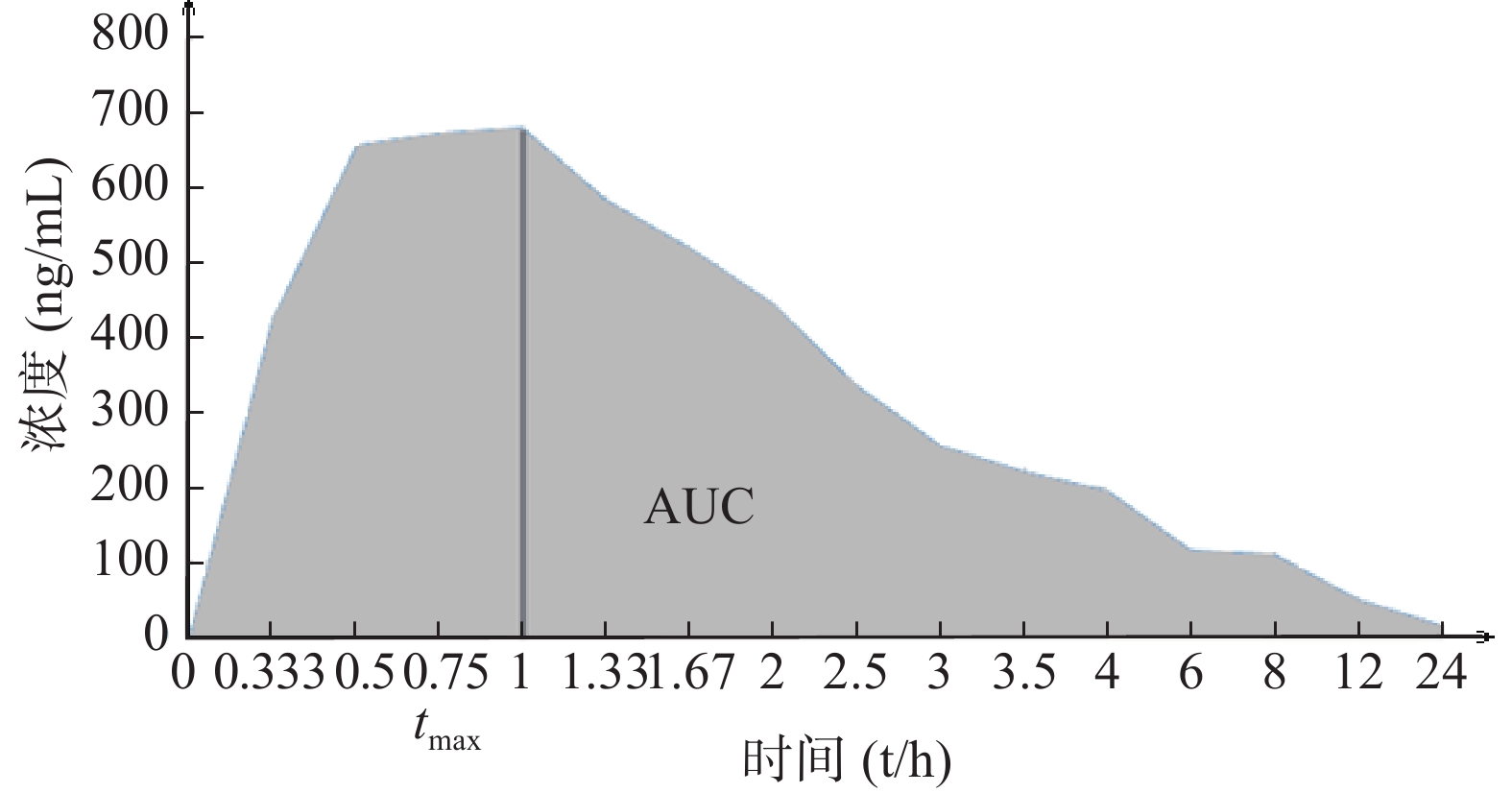
BE指药学等效制剂或可替换药物在相同的试验条件下,给予相同的剂量,其活性成分吸收速度和程度的差异无统计学意义[6]。BE研究给药后,通过测量不同时间点的生物样本(全血、血浆、血清等)药物浓度,得出药物浓度-时间曲线,经过计算得出血药浓度-时间曲线下面积(AUC)、药物达峰浓度(cmax)、达峰时间(tmax)(图1)等PK参数后,再通过统计学分析比较,判断两种制剂是否生物等效。
目前,BE评价方法是置信区间法。当主要PK参数AUC和cmax的几何均值比值的90%置信区间在80%~125%内时,受试制剂吸收的速度和程度与参比制剂相当,视为生物等效[7]。
核查时,首先需要核对申办方提供的统计分析前的原始数据。统计专业人员向核查人员展示数据传输协议(由申办方提供);然后,根据原始样本浓度数据,现场使用WinNonlin 8.1软件处理各组血药浓度测定数据,采用非房室模型计算出主要PK参数,包括AUC0-t、AUC0-∞、cmax,其他数据则使用SAS 9.4软件分析。如果受试制剂与参比制剂的AUC0-t、AUC0-∞和cmax几何均数比值的90%置信区间均落在80%~125%范围内,则两种制剂生物等效;否则,两种制剂不存在生物等效。将核查所得结果和结论与原统计分析报告核对,检查一致性。
2. 结果
2.1 一般情况
18项BE研究的分组随机数字表均可重现;18项研究均符合生物等效的判定标准,且BE评价结果与原统计分析报告一致;其中有13项研究的PK参数与原统计分析报告相同,其余5项研究的PK参数则有差异,见“2.2”项。
2.2 问题及处理结果
有12项研究存在个别样本采样时间偏差,其中,2项研究被要求补充敏感性分析,3项研究的分析数据集被要求进行受试者数据的重新纳入或剔除后,也进行了敏感性分析。
上述5项研究敏感性分析的结果显示:PK参数AUC0-t、AUC0-∞和cmax的几何均值比值的90%置信区间虽在数值上有所变化,但仍然在80%~125%范围内,维持原统计分析报告的BE评价。
3. 讨论
3.1 BE研究中随机化和等效性评价的意义
BE试验通常采用随机交叉等试验设计,随机和盲法因其有效控制偏倚而成为BE试验注册和核查的关键内容[8]。由于随机化即随机分配的优点,随机对照试验被广泛认为是评价新的药物、新的医疗器械或新的治疗方法疗效的最佳设计[9],是评价医学新疗法的金标准[10]。
在过去的二十年里,许多第一代专利药品的专利和上市许可的到期,导致了仿制药的兴起。进行BE研究被认为是确定仿制药与专利药具有相同的有效性和安全性的关键[7]。BE研究在化学药物仿制药的申请、新药评价以及已上市药物的变更申请中,具有不可替代的作用[6, 8, 11]。
3.2 核查发现的问题
3.2.1 采样时间偏差
在药物临床试验方案中,试验期间各个样本采集的时间点有严格规定。由于操作技术、环境及其它因素的影响,可能导致样本采集的时间与计划采样时间有所偏差、且超过了方案允许的偏差范围,这种情况视为超窗[12]。超窗会否影响统计分析的结果,需要通过敏感性分析予以证明。
敏感性分析指通过改变方法、模型、未测量的变量值等考查结果的改变程度,以确定评估方法的稳健性。敏感性分析结果与主要分析结果一致,表明主要分析的结果稳健,反之亦然[13]。对BE研究而言,考查的关键便是生物等效这一评估结果对PK参数的变化是否敏感。
核查发现,有2项BE研究分别存在个别受试者采血时间超窗问题。例如,在某研究中,某受试者计划采血时间为给药后5 min,方案规定的允许偏差范围为30s之内,但实际采血时间为5min32s,即超窗2s。在原统计分析报告中,PK参数按照计划采血时间加2s,即5min2s计算。核查人员要求按照实际采血时间重新计算主要PK参数,即按照5min32s计算,并做敏感性分析,与原统计分析结果进行比较,考查所得结论的一致性。
由此可见,对样本采集的环节进行严格、科学的管理非常重要。另外,无论采样时间是否存在偏差甚至超窗,应尽可能获取所有数据,真实记录采样时间,并做出敏感性分析报告。
3.2.2 受试者数据重新剔除或纳入
临床试验有效性分析应涵盖随机化分组后的所有受试者,而不仅限于实际完成的受试者数据。按照这种意向性治疗原则所做的分析是最好的分析。
BE研究的统计分析集除全分析集(FAS)和安全数据集(SS)外,最主要的数据集为PK参数集(PKPS)和BE集(BES)[14],BES是推断受试制剂和参比制剂是否生物等效的数据集。
在撰写统计报告时,如果剔除了某受试者数据,或者有受试者出现种种事故但没有被剔除,核查时可能被要求重新纳入或剔除受试者的数据,并进行敏感性分析,以考查是否对最终结果造成影响。例如,某BE试验对照组某受试者第二周期无给药后3.50 h、3.75 h、4.00 h、4.25 h、4.50 h及以后共13个时间段的血药浓度数据,原报告将该受试者纳入PKPS与BES,在核查时,将该受试者第二周期剔除PKPS与BES;或者,原报告将类似受试者剔除PKPS与BES,核查时又将该受试者重新纳入PKPS与BES。
需要注意的是,BE研究通常样本量相对较小,受各种原因数据剔除造成数据缺失的影响相对较大,可能对BE统计分析结果的稳健性带来挑战。因此,BE研究须严格质量管理,事先没有规定的不做剔除处理[11]。
4. 结论
统计分析数据是临床研究结果的呈现,是撰写统计分析报告和临床研究报告的依据。为确保临床研究最终结果和结论没有争议,国家药品监督管理局核查中心对药物临床研究的统计分析数据进行核查非常必要。
本文从统计学角度介绍了BE研究统计分析数据现场核查的主要内容,并对相关统计方法、核查发现的问题、原因和对策进行逐一分析和讨论。考虑到BE研究通常样本量较小,采样时间出现偏差、剔除或纳入数据可能影响统计结果的稳健性,因此,敏感性分析在BE研究中尤为重要,用于评估主要分析结果和结论的稳健性。敏感性分析和主要分析结果一致,则补充、巩固和加强研究结论,进一步证实试验药物的有效性和安全性[15-17]。本文建议,BE研究在统计分析计划的制定与统计分析报告的撰写中,对核查的内容、可能涉及敏感性分析的相关问题,特别是敏感性数据集PKPS和BES的调整,应予以充分考虑,以便在数据分析阶段采用多种敏感性分析方法,综合考虑结果的稳健性,为评估不同制剂临床治疗的可替换性提供扎实的研究数据。
-
表 1 单因素实验条件
因素 水平 提取条件 提取时间(t/s) 10 30 50 70 90 350 w,60% 乙醇,料液比1:60 微波输出功率(w) 70 210 350 490 630 50 s,60% 乙醇,料液比1:60 料液比(g/ml) 1∶20 1∶40 1∶60 1∶80 1∶100 50 s,350 w,60% 乙醇 乙醇体积分数(%) 0 20 40 60 80 50 s,350 w,料液比1:60 表 2 响应面设计各因素及水平
因素 编号 水平 −1 0 1 提取时间(t/s) A 30 60 90 微波输出功率(w) B 70 350 630 料液比(g/ml) C 1∶20 1∶40 1∶60 乙醇体积分数(%) D 40 60 80 表 3 响应面实验条件及结果
序号 A B C D 提取得率(%) 1 0 1 1 0 21.24 2 0 1 −1 0 15.86 3 0 0 −1 1 12.67 4 0 1 0 −1 19.55 5 0 0 1 −1 21.63 6 1 0 0 1 20.58 7 1 0 −1 0 16.50 8 1 0 0 −1 20.61 9 0 −1 −1 0 19.76 10 −1 0 0 −1 24.61 11 −1 0 1 0 23.69 12 0 −1 0 −1 23.53 13 0 0 0 0 25.61 14 0 0 0 0 25.52 15 0 0 0 0 24.22 16 1 0 1 0 23.04 17 0 −1 1 0 20.01 18 1 −1 0 0 22.29 19 0 0 0 0 25.67 20 −1 1 0 0 23.71 21 −1 0 0 1 20.85 22 0 −1 0 1 18.21 23 −1 0 −1 0 19.57 24 0 0 0 0 26.86 25 0 1 0 1 19.55 26 0 0 1 1 21.40 27 0 0 −1 −1 16.37 28 1 1 0 0 15.62 29 −1 −1 0 0 22.49 表 4 回归方程模型显著性分析表
分析项 平方和 自由度 均方 F值 P值 回归模型 321.40 14 22.31 14.41 <0.0001 A 22.10 1 22.10 14.28 0.0020 B 9.64 1 9.64 6.23 0.0257 C 76.35 1 76.35 49.32 <0.0001 D 14.14 1 14.14 9.14 0.0091 AB 15.57 1 15.57 10.06 0.0068 AC 1.46 1 1.46 0.9436 0.3478 AD 3.46 1 3.46 2.23 0.1573 BC 6.60 1 6.60 4.26 0.0580 BD 7.09 1 7.09 4.58 0.0504 CD 3.01 1 3.01 1.95 0.1846 A2 9.83 1 9.83 6.35 0.0245 B2 47.31 1 47.31 30.56 <0.0001 C2 101.70 1 101.70 65.70 <0.0001 D2 57.82 1 57.82 37.35 <0.0001 残差 21.67 14 1.55 失拟项 18.18 10 2.08 0.2497 净误差 3.49 4 总差 334.08 28 -
[1] 陈峰, 尹鹏, 郭桂义, 等. 响应面法优化提取绿茶茶多酚工艺研究[J]. 茶叶通讯, 2020, 47(4):659-664. [2] DENG G Y, WU Y, SONG Z Y, et al. Tea polyphenol liposomes overcome gastric mucus to treat Helicobacter pylori infection and enhance the intestinal microenvironment[J]. ACS Appl Mater Interfaces,2022,14(11):13001-13012. doi: 10.1021/acsami.1c23342 [3] WANG D X, WANG T T, LI Z M, et al. Green tea polyphenols upregulate the Nrf2 signaling pathway and suppress oxidative stress and inflammation markers in D-galactose-induced liver aging in mice[J]. Front Nutr,2022,9:836112. doi: 10.3389/fnut.2022.836112 [4] YE Y S, WARUSAWITHARANA H, ZHAO H Y, et al. Tea polyphenols attenuates inflammation via reducing lipopolysaccharides level and inhibiting TLR4/NF-κB pathway in obese mice[J]. Plant Foods Hum Nutr,2022,77(1):105-111. doi: 10.1007/s11130-021-00937-0 [5] 李露, 吕佳倩, 江承佳, 等. 茶多酚对心血管保护作用的研究进展[J]. 食品科学, 2016, 37(19):283-288. [6] 叶晴, 刘毅, 陈金鹏, 等. 绿茶化学成分及药理作用研究进展[J]. 药物评价研究, 2021, 44(12):2711-2719. [7] RAJAN L, RADHAKRISHNAN A, ALAGARSAMY K N, et al. Green tea polyphenols in cardiometabolic health: a critical appraisal on phytogenomics towards personalized green tea[J]. PharmaNutrition,2022,20:100296. doi: 10.1016/j.phanu.2022.100296 [8] 左小博, 孔俊豪, 杨秀芳, 等. “十三五”期间我国茶叶深加工科技发展报告[J]. 中国茶叶加工, 2021(3):5-11. [9] 杨新, 陈莉, 卢红梅, 等. 茶多酚提取与纯化方法及其功能活性研究进展[J]. 食品工业科技, 2019, 40(5):322-328,332. [10] 郝治华, 李颖, 张唐伟, 等. 响应曲面法优化复合酶提取林芝绿茶中茶多酚工艺[J]. 河北师范大学学报(自然科学版), 2021, 45(1):53-60. [11] 李文婷, 车振明, 罗梦莹. 超临界CO2萃取绿茶中茶多酚工艺的研究[J]. 食品工业, 2011, 32(7):22-24. [12] 左小博, 孔俊豪, 杨秀芳, 等. 茶多酚产业现状与发展展望[J]. 中国茶叶加工, 2019(4):14-20. [13] 李刚凤, 汪辉喜, 陈仕学, 等. 微波法提取低档绿茶多酚工艺研究[J]. 粮食与油脂, 2015, 28(1):60-62. [14] 李石敬敏, 许军, 高颖洁, 等. 超声-离子沉淀法提取茶多酚及茶多酚还原修饰石墨烯研究[J]. 化工技术与开发, 2018, 47(6):14-18. [15] 王凯博, 逄涛, 陶丽红, 等. 废弃茶叶中茶多酚的超声波辅助提取及纯化工艺研究[J]. 云南农业大学学报(自然科学), 2016, 31(5):959-966. [16] 张龙笛. 南丰蜜桔果皮精油和果胶的分离提取研究[D]. 南昌: 江西科技师范大学, 2021. [17] 赵少甫, 韩伟. 试验设计与优化方法在中药提取中的应用[J]. 机电信息, 2016(20):38-45. [18] 孙丽娜, 杨源涛, 王雪怡, 等. 响应面优化法在药学领域的应用[J]. 科技创新与应用, 2017(23):36-37. [19] 魏佳宁, 郝昊, 常衢通, 等. 基于演化算法的约束区域均匀仿真实验设计方法[J]. 系统仿真学报, 2021, 33(7):1591-1599. [20] 杨晓丽, 徐云惠, 陈静. 应用MATLAB实现茶多酚提取均匀试验设计数据的高效拟合[J]. 昭通学院学报, 2014, 36(5):32-35. [21] 王跃生, 欧阳旭, 王丹辉, 等. 数学模式试验设计方法的优缺点比较及其在中药研究应用中的适宜性分析[J]. 中药新药与临床药理, 2010, 21(2):207-210. [22] BETTIN F, COUSSEAU F, MARTINS K, et al. Effects of pH, temperature and agitation on the decolourisation of dyes by laccase-containing enzyme preparation from Pleurotus sajor-caju[J]. Braz Arch Biol Technol,2019,62(03):e19180338-e19180359. [23] 曾光远, 王飞. 影响酒石酸铁比色法测定结果的因素[J]. 监督与选择, 2008(S1):67-69. [24] 邓祥, 韩伟. 酒石酸亚铁-标准曲线法检测绿茶提取物中茶多酚含量[J]. 南京工业大学学报(自然科学版), 2020, 42(5):677-682. [25] 张小荣, 耿广琴, 赵沙沙, 等. Box-Behnken响应面法优化红芪多糖水提醇沉工艺研究[J]. 中兽医医药杂志, 2022, 41(2):7-14. [26] SANG S M, LAMBERT J D, HO C T, et al. The chemistry and biotransformation of tea constituents[J]. Pharmacol Res,2011,64(2):87-99. doi: 10.1016/j.phrs.2011.02.007 [27] 蒋丽, 王雪梅, 全学军, 等. 不同提取方法对茶多酚理化性质的影响[J]. 食品科学, 2010, 31(14):136-139. [28] DRUZYNSKA B, STEPNIEWSKA A, WOLOSIAK R. The influence of time and type of solvent on efficiency of the extraction of polyphenols from green tea and antioxidant properties obtained extracts[J]. Acta Sci Pol Technol Aliment,2007,6(1):87-99. [29] 兰林, 汪晟羽, 张晋森, 等. 响应面法优化竹叶青茶末中茶氨酸的提取工艺[J]. 茶叶通讯, 2021, 48(4):701-706,711. doi: 10.3969/j.issn.1009-525X.2021.04.017 [30] 叶文斌, 马应丽, 李娜, 等. 响应面法优化陇南黄樱桃低糖保健酱配方研究[J]. 保鲜与加工, 2021, 21(12):51-58. [31] 赵滢, 刘利娥, 韩萍, 等. 响应面法优化超声辅助提取蔓菁多糖工艺及其体外抗氧化性研究[J]. 食品工业科技, 2020, 41(7):139-145. [32] 朱莹, 陈红名, 白雅芝, 等. 响应面法优化超声辅助提取芒果多糖工艺[J]. 吉林医药学院学报, 2021, 42(2):90-93. [33] 谢小花, 戴缘缘, 陈静, 等. 微波法从绿茶中提取茶多酚的工艺研究[J]. 佳木斯大学学报(自然科学版), 2019, 37(3):443-446. [34] 徐方祥, 郑博文, 苏袁宁, 等. 微波辅助双水相提取绿茶中茶多酚的研究[J]. 食品工业科技, 2017, 38(17):188-192,201. [35] 成荣敏, 詹从红, 夏婷婷, 等. 响应面分析法及其在大学化学实验中的应用研究[J]. 化学教育(中英文), 2021, 42(2):30-33. [36] 张扬, 钱磊, 訾惠君, 等. 响应面分析法在食用菌领域的应用[J]. 中国食用菌, 2021, 40(5):1-4. -





 下载:
下载:
 下载:
下载: