-
山莨菪碱是托品酸和有机碱形成的酯类,结构与阿托品和东莨菪碱相类似,在托品基的6位碳原子上有不对称的羟基,是一种天然的莨菪烷类生物碱[1-3]。山莨菪碱属于非选择性的毒蕈碱受体阻断剂,能够阻断M1和M5受体亚型。因此,山莨菪碱有一系列相似于阿托品的药理作用[4],如抑制唾液分泌、抑制胃酸和汗液分泌、抑制胃肠蠕动及膀胱收缩,其他还包括散瞳、扩张支气管等[5],适用于胃或肠道的绞痛、急性微循环障碍及有机磷酸中毒等临床病症[4,6]。但单独使用山莨菪碱用药剂量大,故常出现口干、面红、视近物模糊、心跳加快、排尿困难等阿托品样副作用,因此极大限制了其在临床上的广泛应用。近年来,随着对山莨菪碱注射液及其衍生物药理作用的深入研究,发现其胆碱能抗炎通路对慢性炎症如风湿性关节炎、溃疡性结肠炎等慢性疾病具有较好的药效作用[4]。但这些疾病的疗程较长,如何降低或消除山莨菪碱在治疗过程中的阿托品样副作用是临床现实问题。
新斯的明是胆碱酯酶抑制剂,进入机体后,通过可逆性抑制胆碱酯酶活性,使乙酰胆碱不能水解,从而提高体内受体部位的乙酰胆碱浓度,加强和延长乙酰胆碱的作用,呈现出全部胆碱能神经兴奋的效应[4]。将毒蕈碱受体阻断剂和胆碱酯酶抑制剂这两类药物以适当的比例联合使用(即复方山莨菪碱)来协同激活胆碱能抗炎通路,增强其抗炎效果并降低其副作用的治疗方案,有望为临床治疗类风湿性关节炎提供新的治疗方案[4]。
前期的研究结果显示:通过将盐酸消旋山莨菪碱与甲硫酸新斯的明组合制备而成的复方山莨菪碱注射液不仅对类风湿关节炎具有良好的抗炎效果,还可明显降低山莨菪碱的阿托品样不良反应。但目前国内外未见有关复方山莨菪碱注射液遗传毒性安全性评价方面的研究报道。为提高临床用药的安全性,本实验采用鼠伤寒沙门氏菌回复突变试验(Ames试验)、体外培养CHO细胞染色体畸变试验和ICR小鼠骨髓微核试验方法评价其是否具有遗传毒性,为进一步的临床研究提供科学依据。
-
受试物为复方山莨菪碱注射液,两种成分的化学分子结构式详见图1和图2(无色澄明溶液,批号20101222;规格:5 ml中含盐酸消旋山莨菪碱1 g与甲硫酸新斯的明2 mg;由海军军医大学药学系提供)。溶媒对照为氯化钠注射液(无色透明液体,批号110714K2,安徽丰原药业股份有限公司)。
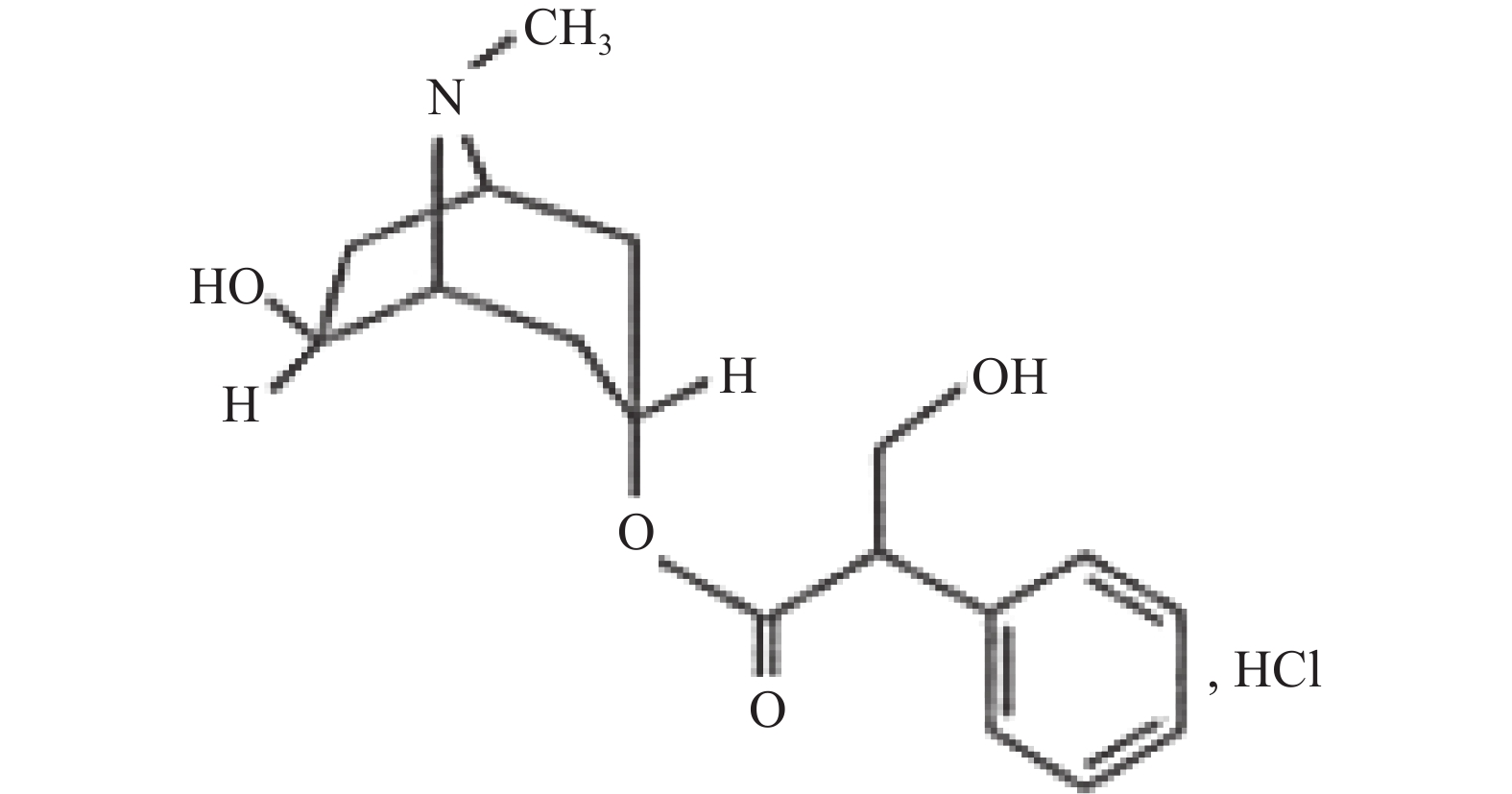
图 1 消旋山莨菪碱结构式 [7]
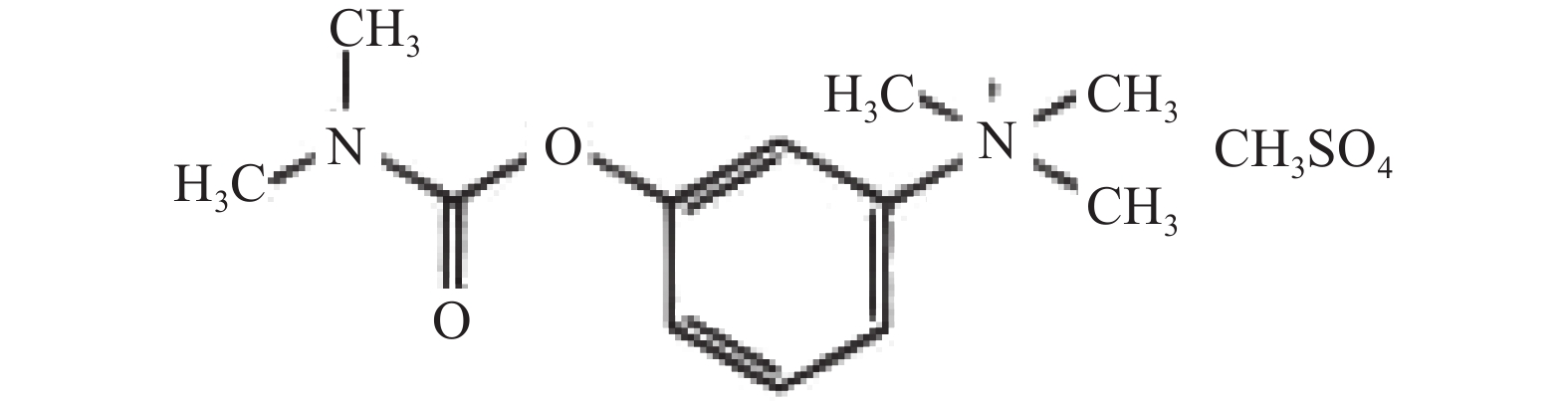
图 2 甲硫酸新斯的明结构式 [7]
-
组氨酸缺陷型鼠伤寒沙门氏菌(S.typhimurium)TA1535、TA102、 TA100、TA98和TA97 5个菌株,由复旦大学公共卫生学院环境卫生教研室赠予,储存于液氮中。实验前进行菌株鉴定,均符合规定标准。CHO细胞由国家上海新药安全评价研究中心赠予。
-
购自美国MOLTOX公司(批号分别为2765和2715,有效期至:2013-05-17和2012-02-12),保存于−80 ℃冰箱。
-
选用60只SPF级的ICR小鼠,雌雄各半(上海市西普尔-必凯动物有限公司,合格证号2008001616722)。检疫期为3 d,每日观察动物的外观、粪便和摄食等情况并记录。自购入日起的当日和检疫结束当日共两次称量所有动物的体重(检疫结束时的体重:雌鼠21.24~23.74 g; 雄鼠21.32~23.72 g),且根据该体重将雌、雄小鼠分别按随机区组法分组,共分为6组,每组10只。
-
按《药物遗传毒性研究技术指导原则》等[8-9]的设计要求,选用标准试验组合中的细菌回复突变试验 [10],体外染色体畸变试验[11]和体内微核试验[12]来全面评价复方山莨菪碱注射液的遗传毒性。
-
应用组氨酸缺陷型的鼠伤寒沙门氏菌TA1535、TA102、TA100、TA98和TA97共5种菌株进行测试。对不受溶解度或细胞毒性限制的受试物最高浓度应达到5 mg/皿 [10],故设复方山莨菪碱注射液(以5 ml中含盐酸消旋山莨菪碱1 g与甲硫酸新斯的明2 mg为计)总剂量为0.5、5、50、500、5 000 μg/皿共5组,此外还有对照组,包括空白对照、溶媒对照和阳性对照。按标准的平板掺入法操作,细菌在有或没有S9代谢活化系统(-S9组在每个平皿的试验体系中加入0.5 ml的磷酸缓冲液,+S9组在每个平皿的试验体系中加入0.5 ml的S9混合液)的平行条件下,将相应浓度的受试物溶液、溶媒对照品(氯化钠注射液)或阳性对照品溶液分别加入到无菌的试管中(表1和表2)0.1 ml,每个组别均设3个平行。以上所有物质与顶层琼脂混匀后,迅速铺浇到底层琼脂平板上,待其凝固后倒置培养48~72 h,通过肉眼或显微镜仔细观察各剂量组的菌苔是否正常,区分受试物沉淀与白色菌落,判断是否有由受试物导致的明显抑菌现象,接着采用手工计数的方法记录每皿中全部回复突变的菌落数量,统计3个平行皿的均值和标准差,与溶媒对照组进行比较。按上述操作再验证一次。
表 1 复方山莨菪碱注射液的第1次Ames试验结果(个/皿,
$\bar x $ ±s,n=3)剂量组
(μg/皿)TA97 TA98 TA100 TA102 TA1535 +S9 -S9 +S9 -S9 +S9 -S9 +S9 -S9 +S9 -S9 5 000 76.7±4.2 76.3±3.2 46.3±2.3 38.3±6.8 96.3±10.5 112.7±17.0 123.0±2.6 170.7±38.3 15.3±5.0 33.3±9.5 500 69.3±8.3 112.0±12.2 46.0±1.7 45.7±9.7 97.3±11.4 115.3±17.9 187.0±53.8 166.7±41.6 28.3±4.5 30.7±2.1 50.0 74.7±1.2 83.7±14.8 36.7±7.0 39.3±12.8 85.3±3.0 132.7±20.0 183.3±5.7 159.0±36.8 31.3±8.1 30.0±10.5 5.0 76.7±12.3 64.7±11.0 40.7±12.2 36.3±13.6 138.7±47.4 137.7±15.9 158.3±17.4 155.0±32.6 25.3±3.2 27.3±8.3 0.5 63.0±5.2 74.0±20.3 42.7±12.8 36.3±11.9 138.0±45.4 119.3±10.3 176.0±44.2 170.7±40.0 23.3±1.2 29.3±5.7 空白对照 90.7±29.5 78.7±2.3 35.0±4.4 41.3±8.1 119.3±14.0 125.3±9.2 201.3±21.4 192.0±20.8 27.3±6.8 28.0±3.6 溶媒对照 72.0±12.0 72.0±11.1 35.3±2.3 37.0±2.0 121.3±9.0 123.3±9.4 167.3±18.6 210.0±25.0 32.3±6.6 30.0±2.0 阳性对照 653.3±83.3 583.3±28.9 714.0±53.0 625.3±162.0 802.7±140.9 651.0±64.5 1093.3±122.2 1026.7±83.2 622.7±189.9 752.0±44.5 阳性对照品:-S9组TA97、TA98敌克松(50 μg/皿),TA100、TA102 甲基磺酸甲酯(1 μg皿);TA1535 4-硝基喹啉-N-氧化物(0.5 μg/皿)+S9组TA97、TA98、TA100 2-AF(10 μg/皿);TA102 1,8-二羟基蒽醌(50 μg/皿);TA1535环磷酰胺(50 μg/皿) 表 2 复方山莨菪碱注射液的第2次Ames试验结果(个/皿,
$\bar x $ ±s,n=3)剂量组
(μg/皿)TA97 TA98 TA100 TA102 TA1535 +S9 -S9 +S9 -S9 +S9 -S9 +S9 -S9 +S9 -S9 5 000 65.0±23.4 64.7±15.7 17.0±3.5 25.7±1.5 74.3±1.0 89.0±4.4 108.3±6.6 102.7±19.2 18.3±2.1 16.0±3.5 500 73.0±6.1 69.0±12.1 22.0±6.9 20.3±2.9 82.3±24.4 97.7±7.8 162.0±45.4 169.3±31.0 20.0±4.6 19.0±5.6 50.0 74.0±26.4 78.3±7.1 20.0±6.2 24.3±7.5 82.3±29.4 88.0±8.2 188.3±4.5 157.0±37.6 22.0±5.3 20.0±3.6 5.0 60.7±16.8 58.0±8.0 24.0±3.0 21.3±3.9 92.0±45.2 89.7±10.0 162.7±51.0 161.0±35.0 22.7±9.8 21.0±3.6 0.5 56.7±8.1 68.7±11.8 21.0±6.0 19.0±1.7 104.0±31.2 97.7±7.6 143.0±56.2 157.3±41.0 20.0±2.6 24.0±2.0 空白对照 80.7±7.0 76.7±2.1 25.3±2.5 22.3±6.8 110.0±10.0 102.7±30.6 221.3±34.0 151.0±36.8 17.3±3.0 15.0±5.2 溶媒对照 85.7±7.6 84.0±7.0 24.0±5.2 21.3±3.0 111.3±21.9 92.3±7.4 169.3±18.0 155.0±32.4 30.3±9.3 23.3±5.0 阳性对照 660.0±66.8 581.0±157.0 564.0±65.8 618.7±112.1 565.3±65.2 657.3±115.7 1064.0±24.0 1044±26.2 552.0±78.0 597.0±89.3 阳性对照品:-S9组TA97、TA98敌克松(50 μg/皿),TA100、TA102 甲基磺酸甲酯(1 μg皿);TA1535 4-硝基喹啉-N-氧化物(0.5 μg/皿)+S9组TA97、TA98、TA100 2-AF(10 μg/皿);TA102 1,8-二羟基蒽醌(50 μg/皿);TA1535环磷酰胺(50 μg/皿) -
采用体外培养的CHO细胞在有或没有S9代谢活化系统的平行条件下进行测试。预试验最高浓度设定为5 mg/ml,再按等比级数设计若干个浓度。正式试验的最高浓度产生的细胞毒性应约为50% [11]。故根据预试验测定IC50(50 %细胞生长抑制浓度)为235.0 μg/ml,因此一共设3个剂量组,依次为58.75、117.5和235.0 μg/ml,另设阳性对照组(-S9组为0.5 μg/ ml丝裂霉素C溶液,+S9组为60 μg/ ml环磷酰胺溶液)和溶媒对照组(氯化钠注射液),每个组别均设2个平行。-S9/4 h组和+S9/4 h组:受试物作用细胞4 h后弃全部培养基,用PBS洗涤后重新添加新的10 ml 1640完全培养基,放入培养箱中继续培养至24 h后收集细胞;-S9/24 h组:受试物作用细胞24 h后收集细胞。终止培养前4 h加入20 μg/ml秋水仙碱,目的是使大部分细胞的有丝分裂停止在中期相,所有细胞依次经过0.75% KCl低渗、固定(甲醇∶冰乙酸=3∶1)、涂片和Gimsa染色处理,在显微镜下选择染色体数目完整且分散良好的中期分裂相染色体作为观察对象,观察染色体数量和结构的改变。分别记录各组含有结构畸变染色体的细胞数和畸变类型(表3),计算每组的染色体畸变率。
表 3 复方山莨菪碱注射液对体外培养CHO细胞的染色体畸变试验结果
剂量组(μg/ml) 观察细胞数
(个)各类染色体畸变数 畸变细
胞数/个畸变率
(%)断裂 断片 双着丝粒 三辐体 四辐体 碎片或微小体 环状 -S9/24 h 溶媒对照组 200 0 0 2 0 0 0 0 2 1.0 58.75 200 0 0 0 0 0 0 0 0 0 117.5 200 0 0 0 0 0 0 0 0 0 235.0 200 2 0 0 0 0 0 0 2 1.0 阳性对照组 100 25 2 0 3 0 4 0 21 21.0* -S9/4 h 58.75 200 1 0 0 0 0 0 0 1 0.5 117.5 200 1 0 0 0 0 0 0 1 0.5 235.0 200 2 0 0 0 0 0 0 2 1.0 +S9/4 h 溶媒对照组 200 0 0 0 0 0 1 0 1 0.5 58.75 200 2 0 0 0 0 0 0 2 1.0 117.5 200 1 0 0 0 0 0 0 1 0.5 235.0 200 1 0 1 0 0 0 0 2 1.0 阳性对照组 100 15 1 0 1 1 8 0 20 20.0* *P<0.05,与溶媒对照组比较。 -
采取与临床拟用途径一致的给药方式[12],对ICR小鼠采用单次经尾静脉注射的给药方式。根据受试物急性毒性的试验结果:半数致死量LD50为60.4 mg/kg。本次试验的最高剂量为1/2 的LD50,最高剂量之下的其他剂量保持剂量间距为2~3倍[12]。故共设3个剂量组(分别为7.5、15.0和30.0 mg/kg),及溶媒对照组(氯化钠注射液,给药方式与受试物组相同)和阳性对照组(剂量为40 mg/kg的环磷酰胺溶液,临用时用氯化钠注射液配制成4.0 mg/ml的环磷酰胺溶液,给药方式为单次腹腔注射),给药容积均为10 ml/kg。因此,总共有六组,其中的高剂量组有两组,分别在药物作用24 h和48 h后处死,除高剂量48 h组外,其他组均在药物作用24 h后处死。取小鼠两侧大腿股骨制备骨髓涂片,每只小鼠制2张骨髓片,自然干燥后染色。所有动物均镜检约1 000个嗜多染红细胞(PCE),计数含微核的PCE数(MNPCE),统计微核发生率,在记录200个PCE的同时计数观察到的所有正染红细胞(NCE)的数量(表4),通过PCE/NCE值来评价受试物是否具有骨髓毒性。
表 4 复方山莨菪碱注射液对ICR小鼠骨髓微核试验结果
剂量组
(mg/kg)动物数
(只)雄鼠 雌鼠 观察PCE数(个) PCE/ (PCE +NCE) 微核率($\bar x $±s, ‰) 观察PCE数(个) PCE/(PCE +NCE) 微核率($\bar x $±s, ‰) 溶媒对照组 5 10 125 1.00±0.15 0.40±0.22 10 364 1.03±0.16 0.30±0.27 7.5 5 10 079 1.33±0.16 0.60±0.22 10 085 0.98±0.19 0.40±0.41 15.0 5 10 019 1.33±0.38 2.00±0.35 10 086 1.56±0.11 2.38±1.07 30.0(24 h采样) 5 9 879 1.37±0.30 2.12±1.07 10 131 1.34±0.12 2.07±1.08 30.0(48 h采样) 5 9 340 1.44±0.30 1.38±1.31 9 642 1.45±0.22 1.45±0.94 阳性对照组 5 10 192 0.78±0.10 17.62±10.40* 10 673 0.85±0.09 26.31±4.34* *P<0.05,与溶媒对照组比较。 -
细菌回复突变试验的结果判定是将各剂量组的受试物与溶媒对照组的回复突变菌落数进行比较,如果某个组别的回复突变菌落数是溶媒对照组突变菌落数的2倍及以上,且可重复性,并在剂量范围内存在着剂量-反应关系,则判断为阳性;体外染色体畸变试验和体内微核试验的结果,也是与溶媒对照组进行比较,均采用卡方检验,检验标准以P<0.05为有统计学差异。
-
所有平皿经均未见杂菌污染,可观察到目标菌苔的正常生长。所有菌株的自发回复突变菌落数和阳性物诱发的回复突变菌落数都在历史对照数据库的范围内,且阳性对照组与空白对照组相比回复突变菌落数是显著增加的,该结果提示整个试验系统符合要求[13-17]。最高浓度已达到5 mg/皿时,未观察到复方山莨菪碱注射液的抑菌现象。两种平行条件下,即有或没有S9代谢活化系统中,各剂量组的受试物所诱发的回复突变菌落数均与自发的回复突变菌落数接近,未见明显的剂量-反应关系。两次结果见表1和表2。
-
经显微镜观察,阳性对照组能显著诱发细胞染色体的畸变,与溶媒对照组相比差异均有统计学意义(P<0.05),验证了该系统的有效性[13-17];复方山莨菪碱注射液各剂量组的CHO细胞染色体畸变率与溶媒对照组相比差异均无统计学意义(P>0.05),结果见表3。
-
各剂量组小鼠在给药后未见异常,且未出现动物死亡。雌、雄小鼠在给予阳性对照品后,其骨髓嗜多染红细胞的微核发生率与溶媒对照组相比均有统计学意义(P<0.05),提示试验系统符合要求[13-17]。复方山莨菪碱注射液各剂量组的雌、雄小鼠骨髓PCE/(PCE+NCE) > 50%,即受试物对骨髓无抑制作用,各剂量组微核率与溶媒对照组相比均无统计学意义(P>0.05)。结果见表4。
-
作为单药,山莨菪碱与甲硫酸新斯的明均已进行过完整的遗传毒性评价,且皆为阴性。但既往研究表明,药物联合作用可改变单药的致突变性。用TA98、TA100和TA102菌株对顺铂和卡铂与新斯的明、博莱霉素、5-氟尿嘧啶和长春新碱联合用药的遗传毒性进行评价,发现药物之间的相互作用会产生抗致突变性作用,联合用药时的致突变性比单药要低[18]。复方山莨菪碱是由盐酸消旋山莨菪碱与甲硫酸新斯的明按照500:1的比例组成的复方注射剂,为考察其是否会产生与单药不同的遗传毒性,本研究按照《药物遗传毒性研究技术指导原则》[8]推荐的组合方法,分别从体外到体内,从微生物、离体细胞和整体动物水平上对复方山莨菪碱注射液的遗传毒性进行了评价,该试验组合能检测染色体畸变、基因突变等多个遗传学终点[8-9]。Ames试验表明复方山莨菪碱注射液在0.5、5、50、500、5 000 μg/皿受试剂量下,两种平行条件下,即有或没有S9代谢活化系统时,与溶媒对照组的突变菌落数进行比较,各剂量组所诱发的回复突变菌落数均和其相近。CA试验结果表明58.75、117.5和235.0 μg/ml 3个剂量的受试物,所有剂量在两种平行的系统条件下(即有或没有S9代谢活化系统时)对CHO细胞的染色体无明显的畸变影响。MNT试验设的7.5、15.0和30.0 mg/kg 3个剂量,对ICR小鼠骨髓的微核诱发率均无统计学意义(P>0.05)。以上结果显示,在本实验条件下,复方山莨菪碱注射液对鼠伤寒沙门氏菌无致突变性,对哺乳动物培养细胞染色体无致畸变作用,对ICR小鼠骨髓嗜多染红细胞无诱发微核的效应;此也提示复方山莨菪碱注射液在受试条件下对人体不具有潜在致癌性和遗传毒性。
综上可知,在本实验条件下结果提示复方山莨菪碱注射液不具有遗传毒性和潜在致癌性,与单方相关的文献报道结论基本相符,本研究结果为该药的临床安全性评价提供了前期科学依据。
Evaluation on genotoxicities of raceanisodamine hydrochloride injection
-
摘要:
目的 复方山莨菪碱注射液的遗传毒性研究。 方法 采用细菌回复突变试验(bacterial reverse mutation test,简称Ames test),体外染色体畸变试验(chromosome aberration test, 简称CA)和体内微核试验(micronucleus test,简称MNT)3个标准试验组合,以评价复方山莨菪碱注射液的遗传毒性。 结果 Ames试验表明在所有受试剂量为0.5、5、50、500、5 000 μg/皿,两种平行条件下,即有或没有S9代谢活化系统时,受试物对TA1535、TA102、TA100、TA98及TA97这5种细菌菌株,与溶媒对照组的突变菌落数进行比较,各剂量组的所诱发的回复突变菌落数均与其相近。CA试验中,受试物设3个剂量组,依次为58.75、117.5及235.0 μg/ml,所有剂量在两种平行的系统条件下(即有或没有S9代谢活化系统时),对中国仓鼠卵巢细胞(CHO细胞)的染色体畸变率均没有显著影响。MNT试验也设了3个剂量组,分别为7.5、15.0及30.0 mg/kg。所有剂量组与溶媒对照组的微核诱发率进行比较,对ICR小鼠骨髓的微核诱发率均无统计学意义(P>0.05)。 结论 在本研究条件下,复方山莨菪碱注射液对细菌无致突变性,对哺乳动物细胞的染色体无致畸变作用,对啮齿类动物骨髓中的嗜多染红细胞无诱发微核的效应。所有试验结果都显示,复方山莨菪碱注射液在本受试条件下对人体不具有潜在致癌性及遗传毒性。 Abstract:Objective To study the genotoxicities of raceanisodamine hydrochloride injection. Methods Bacterial reverse mutation test, in vitro Chromosomal aberration test and in vivo Micronucleus test were performed to investigate the genotoxicities of raceanisodamine hydrochloride injection. Results The Ames test showed that raceanisodamine hydrochloride injection did not increase mutagenicity for TA1535, TA102, TA100, TA98 and TA97 strains at the dosage of 0.5, 5, 50, 500, 5000 μg per plate under two parallel system conditions (±S9). Results of CA test indicated that there was no statistical difference between raceanisodamine hydrochloride injection groups (doses of 58.75,117.5 and 235.0 μg/ml) and the solvent control group under two parallel system conditions (±S9). In MNT test, with doses of 7.5, 15.0 and 30.0 mg/kg respectively, the micronucleus induction rate of bone marrow of ICR mice was not statistically significant (P>0.05) when compared with that of vehicle control group in all dose groups. Conclusion Under the conditions of these study, the results indicated that raceanisodamine hydrochloride injection had no mutagenicity to Salmonella typhimurium, had no aberration effect on the chromosome of mammalian cultured cells, and had no effect on inducing micronucleus of bone marrow polychromatic erythrocytes in ICR mouse. All test results showed that raceanisodamine hydrochloride injection had no potential carcinogenicities and genetic toxicities under the test conditions. -
内生真菌经过长期进化与宿主植物形成互利共生的关系,植物可以为内生真菌提供生长所需的营养物质,内生真菌可以促进植物生长、协助对抗干旱与虫害等胁迫、产生结构新颖丰富的次生代谢物以及诱导植物次生代谢物积累[1]。植物内生真菌作为来源于药用植物的一种新兴微生物资源,在医药、农业和食品工业领域都展现出越来越广泛的应用前景[2]。
金线莲Anectochilus roxburhii为兰科金线兰属(Anectochilus)多年生草本植物,又名金线兰、金耳环、鸟人参等,在民间有“药王”、“金草”等美称,具有清热凉血、除湿解毒等功效,主产于我国南部如福建、台湾、浙江等地,富含多糖、内酯苷和黄酮及苷类等成分,具有抗炎、提高免疫力、保肝、抗肿降糖等生物活性[3, 4]。目前,有关金线莲内生菌的研究多聚焦于植株体内内生菌生物多样性[5]、促进宿主生长[6],以及提高宿主抗病性[7]等研究。对于金线莲内生菌次生代谢产物的研究相对有限[8, 9],从金线莲内生真菌次生代谢产物中发现结构新颖、具有显著药效活性的先导化合物具有较大潜能,有待进一步挖掘。
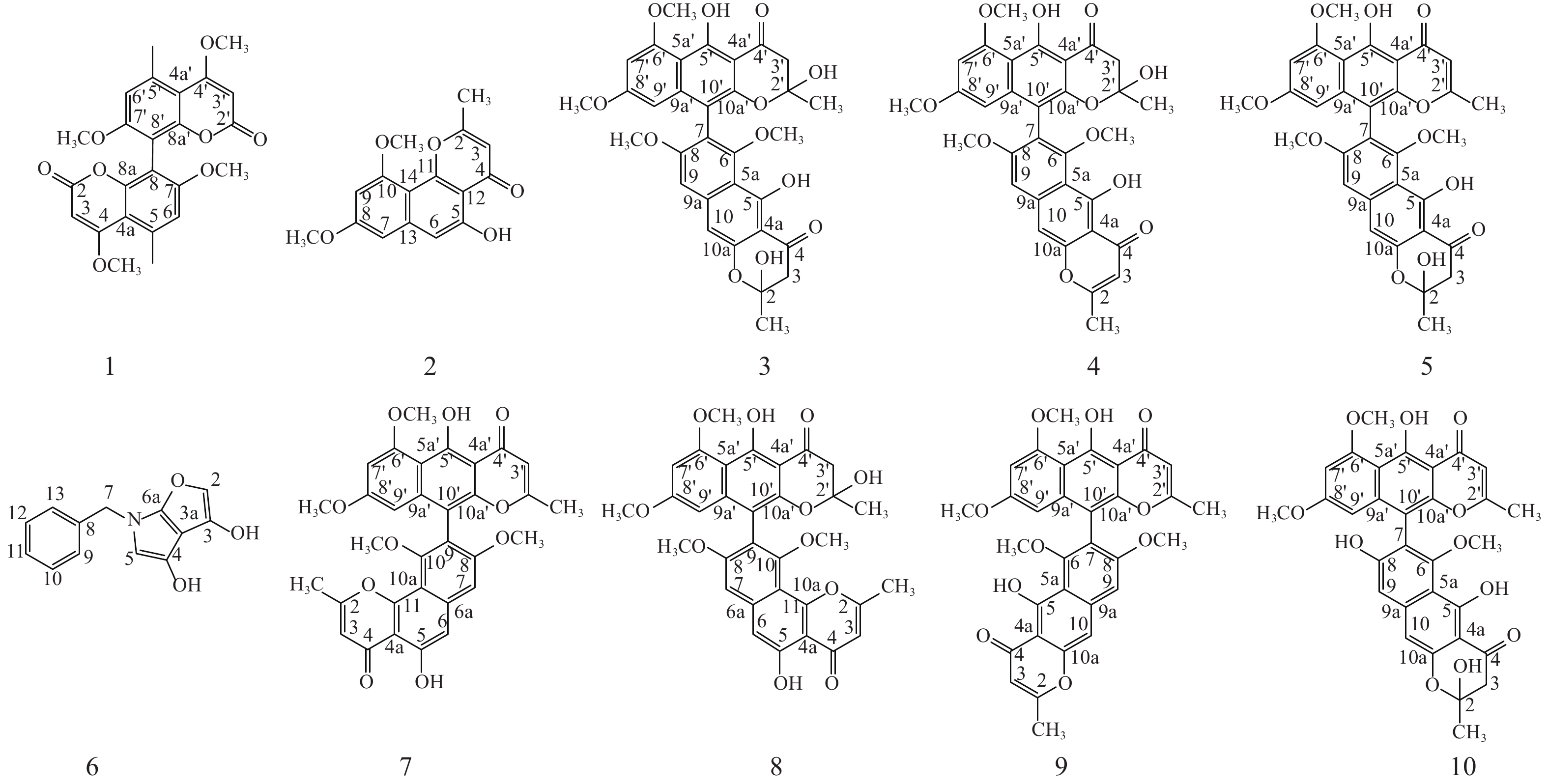
本研究选取从金线莲中分离得到的一株内生真菌株Aspergillus sp. J218,采用大米固体发酵法进行发酵,并从发酵产物的乙酸乙酯萃取物中分离纯化、鉴定得到10个化合物(图1)。所鉴定成分多为二聚萘并吡喃酮类化合物,提示该株内生真菌含有丰富的二聚化合成酶,对其生物合成潜能有进一步挖掘的价值。
1. 材料与方法
1.1 仪器与试剂
Agilent 1200 Series 半制备型液相色谱仪(美国Agilent公司);Eclipse XDB-C18 半制备色谱柱(250 mm×9.4 mm,5 μm;美国Agilent公司);Bruker Avance 600 MHz(德国Bruker公司);APEX7.0 FT-MS型质谱仪(德国Bruker公司);RE-52C旋转蒸发仪(上海沪西分析仪器厂有限公司);HWS-24型恒温水浴锅(上海一恒科学仪器有限公司);SHZ-DⅢ型循环水式真空泵(巩义予华仪器有限责任公司);Sephadex LH-20(美国Pharmacia公司);反相柱色谱硅胶12 nm S-50 μm (日本株式会社YMC);柱色谱硅胶(200~300 目)和 GF254 ( 100 mm × 100 mm) 硅胶板(青岛海洋化工厂);分析级乙醇、乙酸乙酯、甲醇、二氯甲烷(上海泰坦科技股份有限公司);色谱级甲醇、乙腈(上海泰坦科技股份有限公司);屈臣氏蒸馏水(广州屈臣氏食品饮料有限公司);发酵用水为去离子水;显色剂为香草醛-硫酸显色剂(12 g 香草醛,250 ml 乙醇,200 ml 浓硫酸,500 ml 蒸馏水)。
1.2 药材
本实验所用菌株为2020年从产自福建南靖的一株金线莲(Anectochilus roxburhii)中分离得到。采样植株经福建中医药大学吴岩斌副研究员鉴定为金线莲,内生真菌经形态学鉴定为曲霉菌属Aspergillus sp.,编号为J218,现保存于海军军医大学中药鉴定学教研室。
1.3 菌株发酵
将保存的金线莲内生真菌菌株Aspergillus sp. J218接种至经高压灭菌的PDA平板培养基上,于培养箱活化培养7 d,用灭菌的打孔器打孔取菌饼置于装有250 g大米培养基的1000 ml锥形瓶中,共40瓶,常温发酵30 d。
1.4 代谢产物提取与分离
发酵产物每瓶用500 ml 95%乙醇超声提取二次,每次45min, 过滤,减压浓缩至无醇味,将发酵提取物用石油醚(1∶1.5)脱脂2次,然后用乙酸乙酯(1∶2)萃取3次,合并乙酸乙酯部分萃取液,减压浓缩得到褐色浸膏24.7 g。将24.7 g浸膏由适量甲醇溶解,上样于Sephadex LH-20柱色谱,以80%甲醇进行洗脱,得到5个组分(Fr. 1~5)。
Fr.2析出淡黄色结晶,经300~400目硅胶色谱以二氯甲烷:甲醇(30∶1)洗脱得到化合物1(49.2 mg)。Fr.3部分经200目硅胶柱色谱,以二氯甲烷:甲醇(200∶1→7∶1)进行梯度洗脱,同时用TLC进行点板检测,合并得到5个组分Fr.3-1~3-5。Fr.3-4经300~400目硅胶色谱以二氯甲烷:甲醇(75∶1)洗脱得到化合物2(5 mg);Fr.3-5经Sephadex LH-20凝胶柱(80%甲醇洗脱)和300~400目硅胶色谱以石油醚:乙酸乙酯:甲醇(5∶10∶0.5)洗脱得到化合物3(22.6 mg);Fr.3-2 经200目硅胶柱色谱(二氯甲烷,二氯甲烷:甲醇=1000∶1→100∶1)得到5个亚组分Fr.3-2-1~3-2-5。Fr.3-2-5经300-400目硅胶色谱以二氯甲烷:甲醇(105∶1)洗脱得到化合物4(27.7 mg);Fr.3-2-4以65%甲醇-0.05%甲酸水为流动相,经Agilent 1200 Series 半制备型液相色谱,色谱柱为Eclipse XDB-C18,流速为2 ml/min,收集22 min馏分减压浓缩得到化合物5(49.3 mg);Fr.3-2-2经300-400目硅胶色谱以二氯甲烷:甲醇(135∶1)洗脱得到化合物6(10.7 mg)和化合物7(6.8 mg);Fr.3-2-2经300~400目硅胶色谱以二氯甲烷:甲醇(120∶1)洗脱得到化合物8(15.7 mg)和化合物9(11.5 mg)。Fr.4部分经200目硅胶柱色谱,以二氯甲烷:甲醇(800∶1→80∶1)进行梯度洗脱,得到化合物10(2.3 mg)。
2. 结果
化合物1:黄色粉末。分子式:C24H22O8, ESI-MS m/z: 439 [M+H]+。1H NMR (600 MHz, Chloroform-d) δH: 6.73 (s, 1H, H-6, 6′), 5.51 (s, 1H, H-3, 3′), 3.93 (s, 3H, 4,4′-OCH3), 3.80 (s, 3H, 5, 5′- OCH3), 2.70 (s, 3H, 7, 7′-CH3). 13C NMR (150 MHz, Chloroform-d) δC:169.88 (C-4, 4′), 163.12 (C-2, 2′), 159.57 (C-7, 7′), 153.49 (C-8a, 8a′), 138.52 (C-5, 5′), 111.43 (C-6, 6′), 108.45 (C-8, 8′), 107.47 (C-4a, 4a′), 87.72 (3, 3′-CH3), 56.11 (7, 7′- OCH3), 55.89 (4, 4′- OCH3), 24.06 (5, 5′-CH3) [10], 以上波谱数据与文献对照一致,确定化合物1为kotanin。
化合物2:黄色粉末。分子式:C16H14O5, ESI-MS m/z: 285 [M-H]−。1H NMR (600 MHz, Chloroform-d) δH: 12.81 (s, 1H, 5-OH), 6.88 (s, 1H, H-6), 6.60 (d, J = 2.2 Hz, 1H, H-7), 6.41 (d, J = 2.2 Hz, 1H, H-9), 6.29 (s, 1H, H-3), 3.99 (s, 3H, 10-OCH3), 3.94 (s, 3H, 8-OCH3), 2.51 (s, 3H, 2-CH3); 13C NMR (150 MHz, Chloroform-d) δC: 182.83 (C-4), 166.54 (C-2), 161.43 (C-8), 159.05 (C-10), 156.61 (C-5), 155.79 (C-11), 141.18 (C-13), 110.21 (C-3), 108.84 (C-14), 105.77 (C-6), 104.88 (C-12), 97.93 (C-7), 96.98 (C-9), 55.85 (10- OCH3), 55.44 (8- OCH3), 20.46 (2-CH3) [11], 以上波谱数据与文献对照一致,确定化合物2为flavasperone。
化合物3:黄色粉末。分子式:C32H30O12, ESI-MS m/z: 607 [M+H]+。1H NMR (600 MHz, Chloroform-d) δH: 14.53 (s, 1H, 5′-OH), 14.17 (s, 1H, 5-OH), 6.88~6.78 (m, 1H, H-9), 6.69 (d, J = 17.8 Hz, 1H, , H-10), 6.37 (d, J = 2.2 Hz, 1H, H-7′), 6.13 (dd, J = 8.5, 2.3 Hz, 1H, H-9′), 4.00 (s, 3H, 6′-OCH3), 3.79 (d, J = 9.8 Hz, 3H, 8-OCH3), 3.68~3.61 (m, 3H, 8′-OCH3), 3.38 (d, J = 3.1 Hz, 3H, 6-OCH3), 3.07~2.99 (m, 2H, 3-H2), 2.98~2.87 (m, 2H, 3′-H2), 1.79 (d, J = 6.0 Hz, 3H, 2-CH3), 1.48 (d, J = 3.8 Hz, 3H, 2′-CH3); 13C NMR (150 MHz, Chloroform-d) δC: 197.60 (C-4′), 196.89 (C-4), 164.85 (C-8′), 163.81 (C-8), 162.15 (C-6′), 161.81 (C-6), 161.01 (C-5′), 158.18 (C-5), 153.19 (C-10a), 151.34 (C-10a′), 142.66 (C-9a), 142.39 (C-9a′), 117.81 (C-7), 110.55 (C-5a), 107.73 (C-5a′), 106.44 (C-10′), 103.79 (C-4a), 103.58 (C-4a′), 102.77 (C-9), 102.24 (C-10), 100.21 (C-2), 100.11 (C-2′), 97.37 (C-7′), 96.21 (C-9′), 61.58 (C-6), 56.17 (C-6′), 55.89 (C-8), 55.16 (C-8′), 47.33 (C-3), 46.92 (C-3′), 29.24 (2′-CH3), 28.69 (2-CH3) [12, 13], 以上波谱数据与文献对照一致,确定化合物3为aurasperone B。
化合物4:微黄色粉末。分子式:C32H28O11, ESI-MS m/z: 587 [M-H]−。1H NMR (600 MHz, Chloroform-d) δH: 14.77 (s, 1H, 5-OH), 14.52 (s, 1H, 5′-OH), 7.12 (s, 1H, H-10), 6.97 (s, 1H, H-9), 6.36 (d, J = 2.2 Hz, 1H, H-7′), 6.13 (d, J = 2.3 Hz, 1H, H-9′), 6.04 (s, 1H, H-3), 4.00 (s, 3H, 6′-OCH3), 3.82 (s, 3H, 8-OCH3), 3.64 (s, 3H, 8′-OCH3), 3.42 (s, 3H, 6-OCH3), 2.92 (d, J = 8.7 Hz, 2H, 3′-H2), 2.40 (s, 3H, 2-CH3), 1.48 (s, 3H, 2′-CH3); 13C NMR (150 MHz, Chloroform-d) δC: 197.49 (C-4′), 184.46 (C-4), 167.68 (C-2), 164.96 (C-8′), 162.18 (C-8), 161.89 (C-6′), 161.86 (C-6), 160.22 (C-5), 157.40 (C-5′), 153.18 (C-10a), 151.30 (C-10a′), 142.62 (C-9a), 140.21 (C-9a′), 118.64 (C-7), 111.39 (C-5a), 107.83 (C-5a′), 107.36 (C-3), 106.62 (C-10′), 104.72 (C-4a), 103.84 (C-4a′), 101.75 (C-9), 101.18 (C-10), 100.23 (C-2′), 97.44 (C-7′), 96.23 (C-9′), 61.78 (6-OCH3), 56.19 (6′-OCH3), 55.90 (8-OCH3), 55.15 (8′-OCH3), 46.88 (C-3′), 28.86 (2′-CH3), 20.74 (2-CH3) [14, 15], 以上波谱数据与文献对照一致,确定化合物4为fonsecinone B。
化合物5:淡黄色粉末。分子式:C32H28O11, ESI-MS m/z: 589 [M+H]+。 1H NMR (600 MHz, Chloroform-d) δH: 14.94 (brs, 1H), 14.17 (d, J = 4.3 Hz, 1H), 7.00 (s, 1H, H-10), 6.86 (d, J = 3.7 Hz, 1H, H-9), 6.73 (d, J = 3.3 Hz, 1H, H-7′), 6.43 (d, J = 2.2 Hz, 1H, H-9′), 6.24 (d, J = 2.3 Hz, 1H, H-3′), 6.00 (t, J = 15.3 Hz, 1H, 2-OH), 4.04 (s, 3H, 6′-OCH3), 3.78 (s, 3H, 8-OCH3), 3.65 (d, J = 1.4 Hz, 3H, 8′-OCH3), 3.44 (s, 3H, 6-OCH3), 3.13~2.94 (m, 2H, 3-H2), 2.21~2.10 (m, 3H, 2′-CH3), 1.82 (s, 3H, 2-CH3); 13C NMR (150 MHz, Chloroform-d) δC: 196.59 (C-4), 184.58 (C-4′), 167.56 (C-2′), 164.06 (C-8), 162.63 (C-8′), 161.43 (C-6′), 161.04 (C-6), 160.96 (C-5), 159.43 (C-5′), 153.32 (C-10a′), 150.80 (C-10a), 142.74 (C-9a), 140.71 (C-9a′), 116.80 (C-7), 110.70 (C-5a′), 108.57 (C-5a), 107.20 (C-3′), 105.17 (C-10), 104.25 (C-4a′), 103.51 (C-4a), 102.67 (C-9), 101.85 (C-10′), 100.12 (C-2), 96.96 (C-7′), 96.49 (C-9′), 61.87 (6′-OCH3), 56.19 (6-OCH3), 55.91 (8′-OCH3), 55.18 (8-OCH3), 47.35 (C-3), 28.68 (2-CH3), 20.68 (2′-CH3) [12, 14], 以上波谱数据与文献对照一致,确定化合物5为fonsecinone D。
化合物6:黄色粉末。分子式:C13H11NO3, ESI-MS m/z: 230 [M+H]+。1H NMR (600 MHz, Chloroform-d) δH: 9.11 (s, 1H, 4-OH), 8.75 (s, 1H, H-2), 7.42~7.37 (m, 2H, H-9, 13), 7.37~7.31 (m, 1H, H-11), 7.26 (dt, J = 6.2, 1.4 Hz, 2H, H-10, 12), 6.27 (s, 1H, H-5), 6.03 (s, 1H, 3-OH), 3.91 (s, 2H, 7-H2); 13C NMR (150 MHz, Chloroform-d) δC: 178.08 (C-3), 168.85 (C-6a), 164.15 (C-4), 162.07 (C-2), 133.79 (C-8), 129.12 (C-9,13), 127.83 (C-10,12), 119.26 (C-3a), 116.06 (C-5), 39.60 (C-7) [16], 以上波谱数据与文献对照一致,确定化合物6为tensidol A。
化合物7:黄色粉末。分子式:C32H26O10, ESI-MS m/z: 571 [M+H]+。1H NMR (600 MHz, Chloroform-d) δH: 15.22 (brs, 1H,5′-OH), 12.81 (brs, 1H, 5-OH), 7.08 (s, 1H, H-6), 7.00 (s, 1H, H-7), 6.46 (d, J = 2.1 Hz, 1H, H-7′), 6.37 (s, 1H, H-3), 6.22 (d, J = 2.1 Hz, 1H, H-9′), 6.04 (s, 1H, H-3′), 4.06 (s, 3H, 6′-OCH3), 3.81 (s, 3H, 8-OCH3), 3.65 (s, 3H, 8′-OCH3), 3.46 (s, 3H, 10-OCH3), 2.52 (s, 3H, 2-CH3), 2.15 (s, 3H, 2′-CH3); 13C NMR (151 MHz, Chloroform-d) δC: 184.59 (C-4′), 183.01 (C-4), 167.48 (C-2), 166.87 (C-2′), 162.83 (C-5′), 161.61 (C-8′), 161.16 (C-6′), 160.07 (C-8), 156.96 (C-10), 156.69 (C-5), 155.15 (C-11), 150.86 (C-10a′), 140.82 (C-6a), 140.67 (C-9a′), 117.16 (C-9), 110.68 (C-3), 108.65(C-5a′), 108.01 (C-10a), 107.37 (C-3′), 106.07 (C-6), 105.05 (C-10′), 104.28 (C-4a′), 101.57 (C-7), 97.03(C-7′), 96.36 (C-9′), 61.21 (10-OCH3), 56.23 (6′-OCH3), 55.98 (8-OCH3), 55.18 (8′-OCH3), 20.67 (2′-CH3), 20.55 (2-CH3) [15, 17], 以上波谱数据与文献对照一致,确定化合物7为fonsecinone A。
化合物8:黄色粉末。分子式:C32H28O11, ESI-MS m/z: 588 [M+H]+。1H NMR (600 MHz, Chloroform-d) δH: 14.55 (s, 1H, 5′-OH), 12.79 (s, 1H, 5-OH), 7.07 (s, 1H, H-7), 7.02 (s, 1H, H-6), 6.41 (d, J = 2.2 Hz, 1H, H-7′), 6.37~6.35 (m, 1H, H-3), 6.17 (d, J = 2.2 Hz, 1H, H-9′), 4.04 (s, 3H, 6′-OCH3), 3.86 (s, 3H, 8-OCH3), 3.67 (s, 3H, 8′-OCH3), 3.42 (s, 3H, 6-OCH3), 2.97 (d, J = 18.4 Hz, 2H, 3′-H2), 2.51 (s, 3H, 2-CH3), 1.49 (s, 3H, 2′-CH3); 13C NMR (150 MHz, Chloroform-d) δC: 197.18 (C-4′),182.70 (C-4), 166.66 (C-2), 165.11 (C-8′), 162.45 (C-8), 161.91 (C-6′), 160.06 (C-10), 156.55 (C-5), 155.61 (C-5′), 154.98 (C-11), 151.13 (C-10a′), 142.53 (C-6a), 140.45 (C-9a′), 118.17 (C-9), 110.74 (C-10′), 109.4 (C-10a), 107.93 (C-5a′), 107.90 (C-3), 106.58 (C-10), 106.05 (C-4a), 103.71 (C-4a′), 102.01 (C-6), 100.22 (C-2′), 97.31 (C-7′), 96.49 (C-9′), 61.13 (10-OCH3), 56.20 (6′-OCH3), 55.98 (8-OCH3), 55.21 (8′-OCH3), 46.65 (C-3′), 29.16 (2′-CH3), 20.51 (2-CH3) [15], 以上波谱数据与文献对照一致,确定化合物8为fonsecinone C。
化合物9:黄色粉末。分子式:C32H26O10, ESI-MS m/z: 571 [M+H]+。1H NMR (600 MHz, Chloroform-d) δH: 15.20 (s, 1H, 5′-OH), 14.79 (s, 1H, 5-OH), 7.11 (s, 1H, H-10), 6.93 (s, 1H, H-9), 6.37 (d, J = 2.2 Hz, 1H, H-7′), 6.17 (d, J = 2.2 Hz, 1H, H-9′), 6.01 (d, J = 0.8 Hz, 1H, H-3), 5.94 (d, J = 0.8 Hz, 1H, H-3′), 3.98 (s, 3H, 6′-OCH3), 3.74 (s, 3H, 8-OCH3), 3.58 (s, 3H, 8′-OCH3), 3.42 (s, 3H, 6-OCH3), 2.37 (d, J = 0.7 Hz, 3H, 2-CH3), 2.07 (d, J = 0.7 Hz, 3H, 2′-CH3); 13C NMR (150 MHz, Chloroform-d) δC: 184.60 (C-4′), 184.43 (C-4), 167.62 (C-2), 167.54 (C-2′), 162.72 (C-5′), 162.01 (C-5), 161.41 (C-8′), 161.07(C-6′), 160.20 (C-8), 158.61 (C-6), 153.37 (C-10a), 150.84 (C-10a′), 140.70 (C-9a), 140.55 (C-9a′), 117.63 (C-7), 111.45 (C-5a), 108.59 (C-5a′), 107.44 (C-3), 107.26 (C-3′), 105.17 (C-10′), 104.73 (C-4a), 104.27 (C-4a′), 101.35 (C-9), 101.21 (C-10), 96.88 (C-7′), 96.53 (C-9′), 62.01 (6-OCH3), 56.21 (6′-OCH3), 55.91 (8-OCH3), 55.13 (8′-OCH3), 20.75 (2-CH3), 20.68 (2′-CH3) [11, 17], 以上波谱数据与文献对照一致,确定化合物9为aurasperone A。
化合物10:黄色粉末。分子式:C31H26O11, ESI-MS m/z: 575 [M+H]+。1H NMR (600 MHz, Chloroform-d) δH: 15.11 (s, 1H, 5′-OH), 14.28 (s, 1H, 5-OH), 7.05 (s, 1H, H-9), 6.68 (d, J = 2.4, 1H, H-7′), 6.28 (d, J = 2.4, 1H, H-9′), 5.95 (s, 1H, H-10), 5.91 (s, 1H, H-3′), 3.86 (s, 3H, 6′-OCH3), 3.69 (s, 3H, 8′-OCH3), 3.42 (s, 3H, 6-OCH3), 3.00 (dd, J = 16.9, 3.8 Hz, 2H, 3-H2), 2.14 (s, 3H, 2′-CH3), 1.28 (s, 3H, 2-CH3); 13C NMR (150 MHz, Chloroform-d) δC: 196.48 (C-4), 184.14 (C-4′), 168.21 (C-2′), 164.48 (C-5), 163.38 (C-5′), 162.22 (C-8′), 160.92 (C-6′), 159.81 (C-8), 157.63 (C-6), 152.99 (C-10a), 151.98 (C-10a′), 142.79 (C-9a), 140.72 (C-9a′), 115.05 (C-7), 110.59 (C-5a), 108.45 (C-5a′), 107.32 (C-3′), 106.50 (C-9), 106.48 (C-10′), 104.14 (C-4a′), 103.30 (C-4a), 102.31 (C-10), 100.02 (C-2), 97.21 (C-9′), 95.94 (C-7′), 62.03 (6-OCH3), 55.86 (6′-OCH3), 55.31 (8′-OCH3), 47.19 (C-3), 28.80 (2-CH3), 20.72 (2′-CH3) [18], 以上波谱数据与文献对照一致,确定化合物10为aurasperone F。
3. 讨论
本研究选取从金线莲植株中分离得到的一株内生真菌Aspergillus sp. J218为研究对象,从其大米固体发酵产物中共分离鉴定出10个化合物。其中化合物3、4、5、7、8、9、10均为二聚萘并吡喃酮类化合物,化合物1为香豆素类化合物二聚体。据报道,萘并吡喃酮类化合物的单体及二聚体类广泛分布于曲霉属和镰刀属真菌的次级代谢产物中,二聚萘并吡喃酮类化合物对多种致病菌,如绿脓杆菌、克鲁斯假丝酵母、幽门螺杆菌等,有中等抑菌活性[19],对多种癌细胞如MDA-MB-231、PANC-1、A549等表现出一定抑制活性[20-21]。研究表明,化合物7和9对幽门螺杆菌具有中等抑制活性[22];化合物8对 A549、HL-60 和 MGC-803细胞具有不用程度抑制作用[23];化合物6能够增强咪康唑对白色念珠菌的抑制活性[24];化合物1对枯草芽孢杆菌和尖孢镰刀菌具有一定的抑制作用[25]。由此可见,从Aspergillus sp. J218中分离鉴定的多数化合物对病原微生物具有一定的抑制作用,提示该菌株在提升宿主植物抗病性方面具有潜在的应用价值;所鉴定化学结构类型提示该菌株含有丰富的二聚化合成酶,但相关研究较少。Frandsen等推测二聚萘并吡喃酮类化合物是由乙酰辅酶A和丙二酰辅酶A分子经过一系列缩合、甲基化和氧化还原反应形成萘并吡喃酮单体,再由一种假定的漆酶Gip1将单体羟基上一个电子移除,然后通过电子重排形成碳活化单体,自身或相互偶联形成二聚体[26];徐丹等[27]发现二聚萘并吡喃酮化合物ustilaginoidins中C-2和C-3双键的还原是由一种磷脂甲基转移酶(UsgR)催化形成,这种还原酶对线性萘并-γ-吡喃酮单体的还原具有特异性,但对二聚体则无特异性,而漆酶(UsgL)对各种单体的阻转异构选择性偶联导致了ustilaginoidins系列衍生物的结构多样性。上述研究为该菌株后续探索该类芳香族聚酮化合物二聚化的生物合成途径提供了一条线索。
-
图 1 消旋山莨菪碱结构式 [7]
图 2 甲硫酸新斯的明结构式 [7]
表 1 复方山莨菪碱注射液的第1次Ames试验结果(个/皿,
$\bar x $ ±s,n=3)剂量组
(μg/皿)TA97 TA98 TA100 TA102 TA1535 +S9 -S9 +S9 -S9 +S9 -S9 +S9 -S9 +S9 -S9 5 000 76.7±4.2 76.3±3.2 46.3±2.3 38.3±6.8 96.3±10.5 112.7±17.0 123.0±2.6 170.7±38.3 15.3±5.0 33.3±9.5 500 69.3±8.3 112.0±12.2 46.0±1.7 45.7±9.7 97.3±11.4 115.3±17.9 187.0±53.8 166.7±41.6 28.3±4.5 30.7±2.1 50.0 74.7±1.2 83.7±14.8 36.7±7.0 39.3±12.8 85.3±3.0 132.7±20.0 183.3±5.7 159.0±36.8 31.3±8.1 30.0±10.5 5.0 76.7±12.3 64.7±11.0 40.7±12.2 36.3±13.6 138.7±47.4 137.7±15.9 158.3±17.4 155.0±32.6 25.3±3.2 27.3±8.3 0.5 63.0±5.2 74.0±20.3 42.7±12.8 36.3±11.9 138.0±45.4 119.3±10.3 176.0±44.2 170.7±40.0 23.3±1.2 29.3±5.7 空白对照 90.7±29.5 78.7±2.3 35.0±4.4 41.3±8.1 119.3±14.0 125.3±9.2 201.3±21.4 192.0±20.8 27.3±6.8 28.0±3.6 溶媒对照 72.0±12.0 72.0±11.1 35.3±2.3 37.0±2.0 121.3±9.0 123.3±9.4 167.3±18.6 210.0±25.0 32.3±6.6 30.0±2.0 阳性对照 653.3±83.3 583.3±28.9 714.0±53.0 625.3±162.0 802.7±140.9 651.0±64.5 1093.3±122.2 1026.7±83.2 622.7±189.9 752.0±44.5 阳性对照品:-S9组TA97、TA98敌克松(50 μg/皿),TA100、TA102 甲基磺酸甲酯(1 μg皿);TA1535 4-硝基喹啉-N-氧化物(0.5 μg/皿)+S9组TA97、TA98、TA100 2-AF(10 μg/皿);TA102 1,8-二羟基蒽醌(50 μg/皿);TA1535环磷酰胺(50 μg/皿) 表 2 复方山莨菪碱注射液的第2次Ames试验结果(个/皿,
$\bar x $ ±s,n=3)剂量组
(μg/皿)TA97 TA98 TA100 TA102 TA1535 +S9 -S9 +S9 -S9 +S9 -S9 +S9 -S9 +S9 -S9 5 000 65.0±23.4 64.7±15.7 17.0±3.5 25.7±1.5 74.3±1.0 89.0±4.4 108.3±6.6 102.7±19.2 18.3±2.1 16.0±3.5 500 73.0±6.1 69.0±12.1 22.0±6.9 20.3±2.9 82.3±24.4 97.7±7.8 162.0±45.4 169.3±31.0 20.0±4.6 19.0±5.6 50.0 74.0±26.4 78.3±7.1 20.0±6.2 24.3±7.5 82.3±29.4 88.0±8.2 188.3±4.5 157.0±37.6 22.0±5.3 20.0±3.6 5.0 60.7±16.8 58.0±8.0 24.0±3.0 21.3±3.9 92.0±45.2 89.7±10.0 162.7±51.0 161.0±35.0 22.7±9.8 21.0±3.6 0.5 56.7±8.1 68.7±11.8 21.0±6.0 19.0±1.7 104.0±31.2 97.7±7.6 143.0±56.2 157.3±41.0 20.0±2.6 24.0±2.0 空白对照 80.7±7.0 76.7±2.1 25.3±2.5 22.3±6.8 110.0±10.0 102.7±30.6 221.3±34.0 151.0±36.8 17.3±3.0 15.0±5.2 溶媒对照 85.7±7.6 84.0±7.0 24.0±5.2 21.3±3.0 111.3±21.9 92.3±7.4 169.3±18.0 155.0±32.4 30.3±9.3 23.3±5.0 阳性对照 660.0±66.8 581.0±157.0 564.0±65.8 618.7±112.1 565.3±65.2 657.3±115.7 1064.0±24.0 1044±26.2 552.0±78.0 597.0±89.3 阳性对照品:-S9组TA97、TA98敌克松(50 μg/皿),TA100、TA102 甲基磺酸甲酯(1 μg皿);TA1535 4-硝基喹啉-N-氧化物(0.5 μg/皿)+S9组TA97、TA98、TA100 2-AF(10 μg/皿);TA102 1,8-二羟基蒽醌(50 μg/皿);TA1535环磷酰胺(50 μg/皿) 表 3 复方山莨菪碱注射液对体外培养CHO细胞的染色体畸变试验结果
剂量组(μg/ml) 观察细胞数
(个)各类染色体畸变数 畸变细
胞数/个畸变率
(%)断裂 断片 双着丝粒 三辐体 四辐体 碎片或微小体 环状 -S9/24 h 溶媒对照组 200 0 0 2 0 0 0 0 2 1.0 58.75 200 0 0 0 0 0 0 0 0 0 117.5 200 0 0 0 0 0 0 0 0 0 235.0 200 2 0 0 0 0 0 0 2 1.0 阳性对照组 100 25 2 0 3 0 4 0 21 21.0* -S9/4 h 58.75 200 1 0 0 0 0 0 0 1 0.5 117.5 200 1 0 0 0 0 0 0 1 0.5 235.0 200 2 0 0 0 0 0 0 2 1.0 +S9/4 h 溶媒对照组 200 0 0 0 0 0 1 0 1 0.5 58.75 200 2 0 0 0 0 0 0 2 1.0 117.5 200 1 0 0 0 0 0 0 1 0.5 235.0 200 1 0 1 0 0 0 0 2 1.0 阳性对照组 100 15 1 0 1 1 8 0 20 20.0* *P<0.05,与溶媒对照组比较。 表 4 复方山莨菪碱注射液对ICR小鼠骨髓微核试验结果
剂量组
(mg/kg)动物数
(只)雄鼠 雌鼠 观察PCE数(个) PCE/ (PCE +NCE) 微核率( $\bar x $ ±s, ‰)观察PCE数(个) PCE/(PCE +NCE) 微核率( $\bar x $ ±s, ‰)溶媒对照组 5 10 125 1.00±0.15 0.40±0.22 10 364 1.03±0.16 0.30±0.27 7.5 5 10 079 1.33±0.16 0.60±0.22 10 085 0.98±0.19 0.40±0.41 15.0 5 10 019 1.33±0.38 2.00±0.35 10 086 1.56±0.11 2.38±1.07 30.0(24 h采样) 5 9 879 1.37±0.30 2.12±1.07 10 131 1.34±0.12 2.07±1.08 30.0(48 h采样) 5 9 340 1.44±0.30 1.38±1.31 9 642 1.45±0.22 1.45±0.94 阳性对照组 5 10 192 0.78±0.10 17.62±10.40* 10 673 0.85±0.09 26.31±4.34* *P<0.05,与溶媒对照组比较。 -
[1] LEE D M, WEINBLATT M E. Rheumatoid arthritis[J]. Lancet,2001,358(9285):903-911. doi: 10.1016/S0140-6736(01)06075-5 [2] METZ C N, TRACEY K J. It takes nerve to dampen inflammation[J]. Nat Immunol,2005,6(8):756-757. doi: 10.1038/ni0805-756 [3] 孙利. 莨菪碱类药物抗休克的β-arrestins抗炎机制[D]. 上海: 第二军医大学, 2010. [4] 崔美健. 山莨菪碱和新斯的明联合治疗小鼠类风湿性关节炎的作用研究[D]. 上海: 第二军医大学, 2013. [5] 闫金雨. 山莨菪碱结合腔内成形术对膝下动脉阻塞病治疗作用的研究[D]. 福州: 福建中医药大学, 2010. [6] 刘风琴. 山莨菪碱注射液外用改善末梢循环的临床疗效观察[J]. 山西医药杂志, 2018, 47(22):2705-2707. doi: 10.3969/j.issn.0253-9926.2018.22.027 [7] 国家药典委员会. 中华人民共和国药典[S]. 二部. 化学工业出版社, 2020. [8] 国家食品药品监督管理总局. 药物遗传毒性研究技术指导原则[ZH]GPT2-1.2007. [9] ICH指导委员会. 药品注册的国际技术要求-安全性部分: 中英对照[M]. 北京: 人民卫生出版社, 2001: 37-61. [10] OECD. Test Guidance 471: Bacterial Reverse Mutation Test[S]//OECD Guidance For Testing of Chemicals. Paris: Organization for Economic Cooperation & Development, 1997: 1-8. [11] OECD. Test Guidance 473: In Vitro Mammalian Chromosome Aberration Test[S]// OECD Guidance for Testing of Chemicals. Paris: Organization for Economic Cooperation & Development, 1997: 1-7. [12] OECD. Test Guidance 474: Mammalian Erythrocyte Micronucleus Test[S]//OECD Guidance for Testing of Chemicals. Paris: Organization for Economic Cooperation & Development, 1997: 1-7. [13] 田逸君, 朱玉平, 马玺里, 等. 益母草碱对胚胎-胎仔发育毒性和遗传毒性的评价[J]. 药学实践杂志, 2020, 38(5):451-457. [14] 田逸君, 郑怡文, 朱玉平, 等. 雷公藤内酯醇的遗传毒性评价[J]. 药学实践杂志, 2016, 34(3):215-218. [15] 侍雯婧, 田逸君, 黄才国, 等. Wentilactone A的遗传毒性评价[J]. 药学实践杂志, 2020, 38(6):533-538. [16] 侍雯婧, 张吉芊竹, 朱江波, 等. 盐酸苯海拉明咖啡因复方的遗传毒性评价[J]. 癌变·畸变·突变. 2022, 34(2): 149-157. [17] 朱玉平, 张天宝, 万旭英, 等. 红景天苷注射液遗传毒性的研究[J]. 药学服务与研究. 2009, 9(4): 279-281. [18] HANNAN M A, AL-DAKAN A A, HUSSAIN S S, et al. Mutagenicity of cisplatin and carboplatin used alone and in combination with four other anticancer drugs[J]. Toxicology,1989,55(1-2):183-191. doi: 10.1016/0300-483X(89)90185-6 -





 下载:
下载:
 下载:
下载:






