-
白首乌为萝藦科(Asclepiadaceae)鹅绒藤属(Cynanchum)植物泰山白首乌(戟叶牛皮消)C. bungei Decne.、隔山消(隔山牛皮消)C. wilfordii(Maxim.)Hemsl.及滨海白首乌(耳叶牛皮消)C. auriculatum Royle ex Wight.的块根[1-2],其主要生物活性成分为苯乙酮和C21-甾体皂苷类,具有抗肿瘤、抗炎、舒张心血管,保肝、降糖和神经保护等作用[3-13]。泰山白首乌块根作为正品传统中药白首乌曾收录于1977年版《中国药典》,为泰山四大名药之首,是山东道地药材[14]。2002年版《中国中药志》记载,白首乌还包含滨海白首乌C. auriculatum和隔山消C. wilfordii。滨海白首乌在2015年被国家卫计委批准为普通食品,隔山消于2008年被《韩国药典》收载[1-2]。
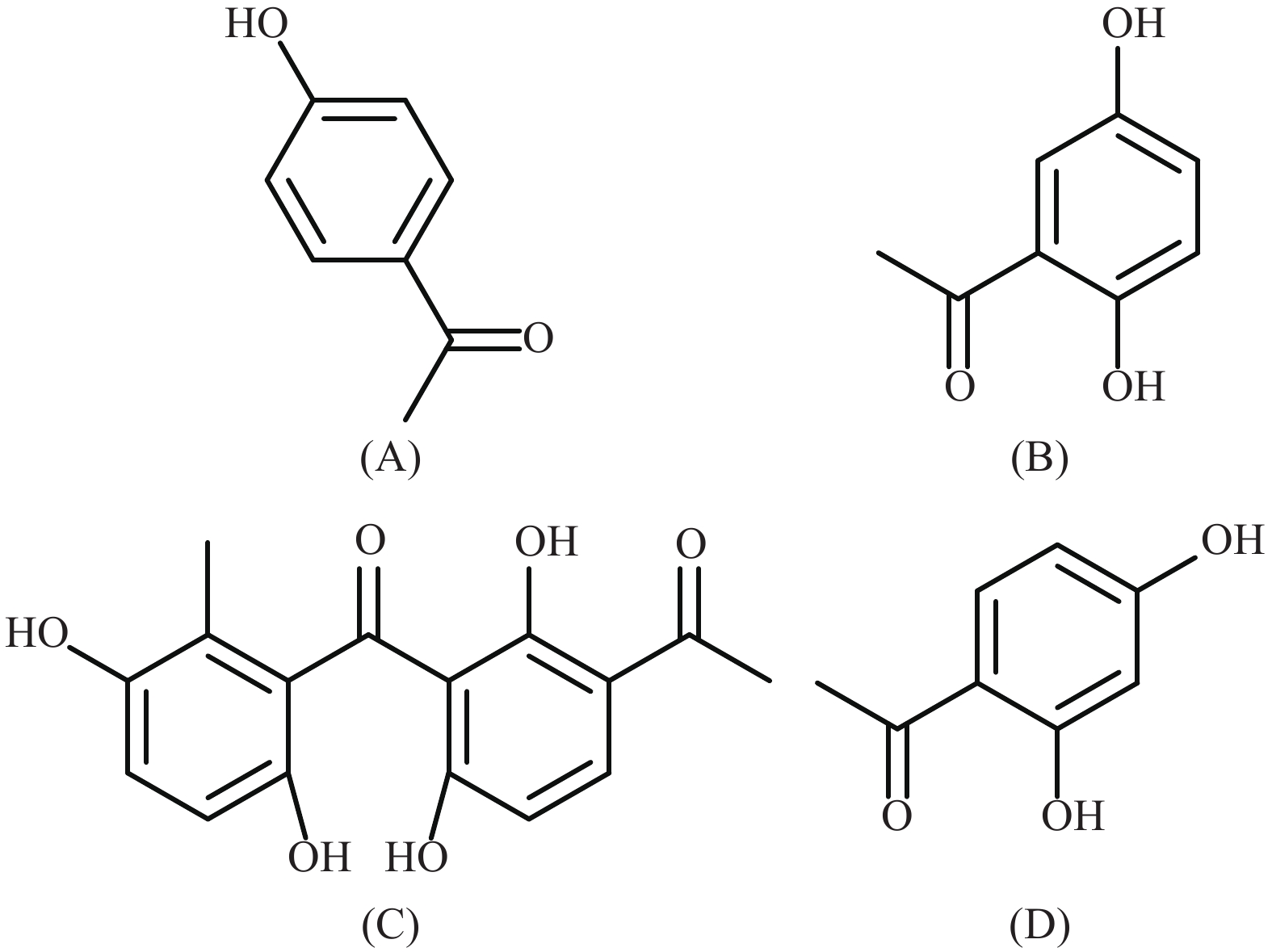
随着对白首乌生物活性研究的不断深入,其药用价值不断体现,市场需求也逐年攀升,但是白首乌药材市场存在以下问题:白首乌正品(泰山白首乌)为野生型、两年生,产量低,人工栽培极其困难,市场供应不足,因此有人将滨海白首乌和隔山消都作为白首乌正品销售,存在白首乌品种混淆的现象[15]。泰山白首乌与其近缘种滨海白首乌和隔山消的品质是否有差异,两种近缘种当作白首乌药材应用是否合理,针对这些问题,本研究收集25批白首乌类药材,建立不同产地白首乌的HPLC指纹图谱,运用HPLC指纹图谱进行质量评价。同时对不同批次的白首乌中4种苯乙酮类成分进行含量测定,结构式见图1,从而为不同品种白首乌药材的品质评价提供理论依据。
-
LC-20AD高效液相色谱仪(岛津,四元梯度系统);色谱柱Diamonsil C18柱(4.6 mm× 250 mm, 5 μm);AG285型电子分析天平(瑞士Mettler-Toledo公司)。
4-羟基苯乙酮(CAS:99-93-4,纯度≥98%)、2',4'-二羟基苯乙酮(CAS:89-84-9,纯度≥98%)、2',5'-二羟基苯乙酮(CAS490-78-8,纯度≥98%)均为国药集团提供,白首乌二苯酮为实验室自制(纯度≥98%)。
白首乌药材样品均于2018年采集或购买自国内不同地区(表1),并经山东中医药大学药学院中药鉴定教研室徐凌川教授分别鉴定为泰山白首乌C. bungei Decne.、耳叶牛皮消C. auriculatum Royle ex Wight.和隔山消C. wilfordii (Maxim.) Hemsl.,密封存放于4 ℃冰箱。
表 1 25批白首乌样品来源
样品 产地 物种 类型 S1 山东济南 泰山白首乌 栽培(两年) S2 山东临沂 泰山白首乌 栽培(两年) S3 山东泰安 泰山白首乌 栽培(一年) S4 山东临沂 隔山消 栽培(两年) S5 四川巴蜀 滨海白首乌 饮片 S6 湖南湘西 滨海白首乌 野生 S7 四川成都 滨海白首乌 饮片 S8 湖南张家界 滨海白首乌 饮片 S9 广东广州 滨海白首乌 饮片 S10 山东济南 隔山消 栽培(两年) S11 安徽阜阳 滨海白首乌 饮片 S12 四川遂宁 滨海白首乌 饮片 S13 安徽亳州 滨海白首乌 饮片 S14 江苏南京 滨海白首乌 饮片 S15 广西玉林 滨海白首乌 饮片 S16 江苏徐州 滨海白首乌 饮片 S17 贵州毕节 滨海白首乌 饮片 S18 江西南昌 滨海白首乌 饮片 S19 江苏滨海 滨海白首乌 饮片 S20 云南昆明 滨海白首乌 饮片 S21 云南大理 滨海白首乌 饮片 S22 安徽大别山 隔山消 野生 S23 四川广安 隔山消 野生 S24 陕西汉中 隔山消 野生 S25 河北安国 滨海白首乌 饮片 -
岛津LC-20AD高效液相色谱仪,Diamonsil C18 (4.6 mm×250 mm, 5 μm);流动相为甲醇-0.1%磷酸水溶液梯度洗脱(0~7 min,15%甲醇; 7~18 min,15%~24%甲醇;18~27 min,24%甲醇;27~32 min,24%~30%甲醇;32~40 min,30%甲醇;40~45 min,30%~15%甲醇),流速为1 ml/min,柱温为30 ℃,检测波长为260 nm(4-羟基苯乙酮、白首乌二苯酮、2',4'-二羟基苯乙酮)和280 nm(2',5'-二羟基苯乙酮),进样量为10 μl。
-
精确称取标准品4-羟基苯乙酮156.12 mg、2',5'-二羟基苯乙酮162.08 mg、白首乌二苯酮98.02 mg和2',4'-二羟基苯乙酮133.45 mg,置于1 000 ml容量瓶中,用甲醇溶解并稀释至刻度线,摇匀,制得混合对照品储备液。精密量取混合对照品储备液适量,用甲醇稀释10倍,得到4-羟基苯乙酮、2',5-'二羟基苯乙酮、白首乌二苯酮和2',4'-二羟基苯乙酮质量浓度分别为0.015 61、0.016 21、0.009 802、0.013 34 mg/ml的混合对照品溶液,过0.45 μm微孔滤膜作对照品溶液,置于4 ℃冰箱中备用。
-
称取白首乌样品粉末(过五号筛)约2.0 g,精密称定,置于50 ml具塞锥形瓶中,精密加入甲醇20.0 ml,密塞,称定重量,超声处理30 min,放冷,再称定重量,用甲醇补足超声过程中损失的重量,摇匀,滤过,再取续滤液,过0.45 μm微孔滤膜,即得。
-
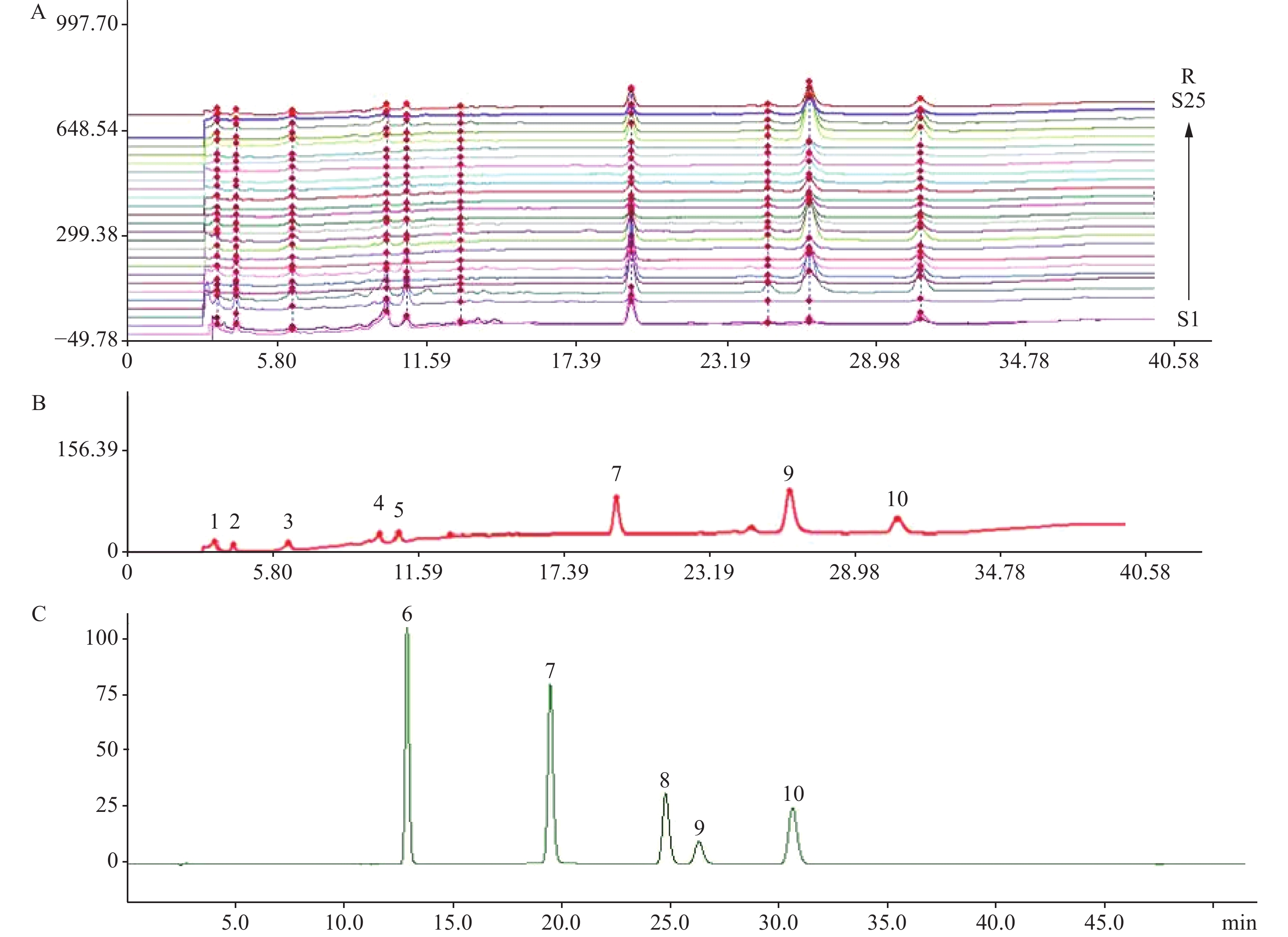
取25批白首乌样品,分别按实验方法制备供试品溶液,按“1.2”项色谱条件进行测定,得到25个样品的HPLC指纹叠加图谱及10个共有峰,并对指纹图谱中的4种苯乙酮类成分进行归属确认。其中,对4-羟基苯乙酮(保留时间19.531 min)、2',5'-二羟基苯乙酮(保留时间24.773 min)、白首乌二苯酮(保留时间26.455 min)和2',4'-二羟基苯乙酮(保留时间30.768 min)进行了指认,白首乌指纹图谱、对照图谱及混合对照品图谱如图2所示。
本研究采用国家药典委员会“中药色谱指纹图谱相似度评价系统”(2012 A版)对25批白首乌样品的HPLC指纹图谱进行数据分析处理,运用多点校正法对其指纹图谱进行相似度评价,选取S16作为参照图谱,设置“时间窗宽度”为0.6 min,以平均数的方法生成白首乌共有模式的指纹对照图谱。在相似度评价中,25批白首乌样品除了S1(产地山东济南)、S2(产地山东临沂)、S3(产地山东泰安)之外,其余相似度均在0.823~0.980之间。故可以通过相似度分析初步将S1、S2、S3这3个批次的白首乌样品归为一类,从色谱图上可以看出其某些成分含量较低,与其他产地的白首乌差距明显,结果显示均为泰山白首乌。研究结果表明,可以明显将以上3个批次的泰山白首乌与其他2个种白首乌(滨海白首乌和隔山消)区分为2大类,说明泰山白首乌与其它白首乌品种(滨海白首乌和隔山消)的化学成分差距显著。
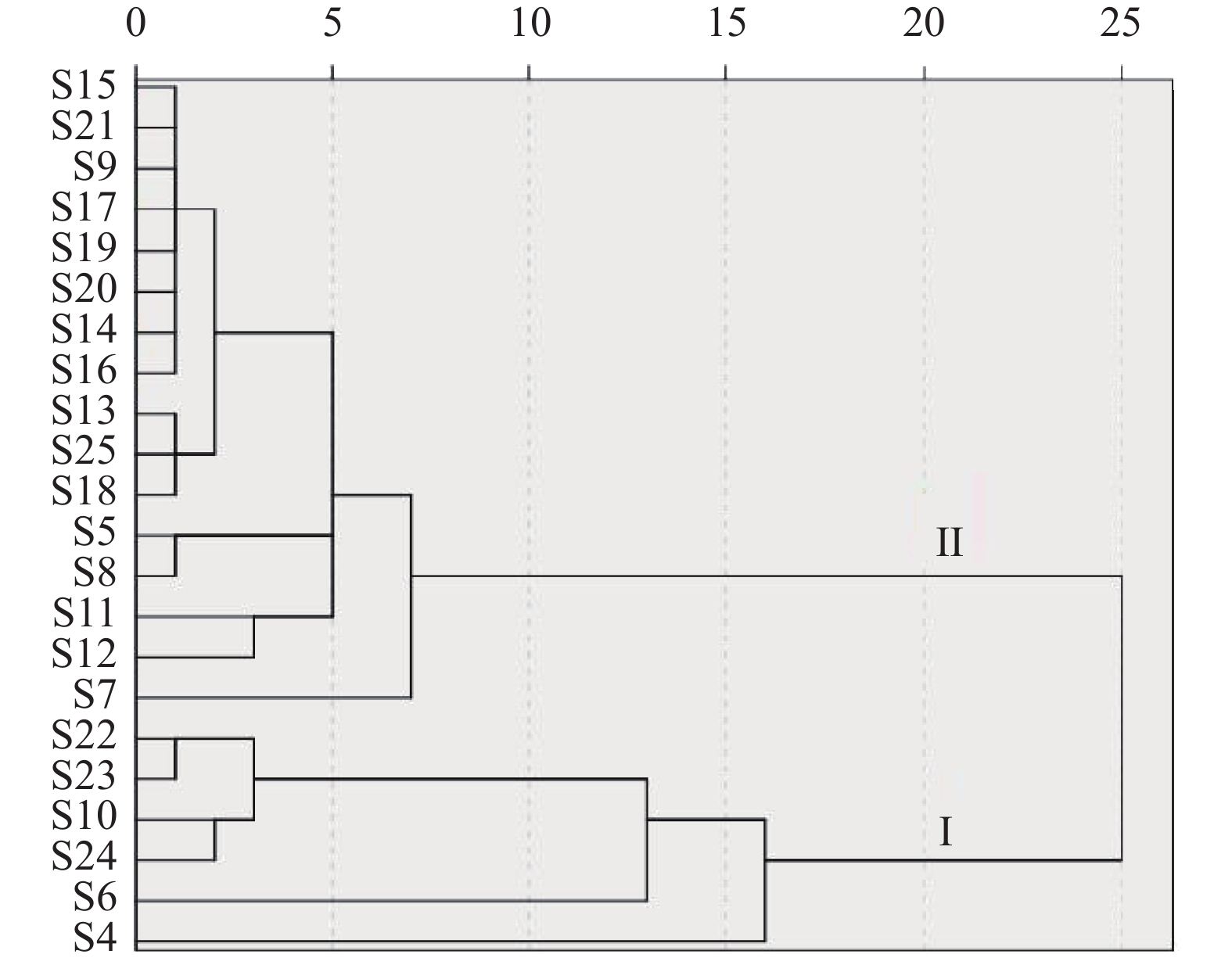
相似度分析可以根据化学特征峰差异明显地区分泰山白首乌,但是滨海白首乌和隔山消不易区分。因此,将其他22批次白首乌样品的10个特征峰面积组成数据矩阵,导入SPSS 20.0统计软件,采用组间联接法以及欧氏距离对指纹图谱进行聚类分析,结果如图3。结果表明,化学距离为2.5,可以将22个样品分为2类,第Ⅰ类的6组均为隔山消,第Ⅱ类的16组均为滨海白首乌。聚类分析结果表明,隔山消和滨海白首乌化学成分含量差异明显。
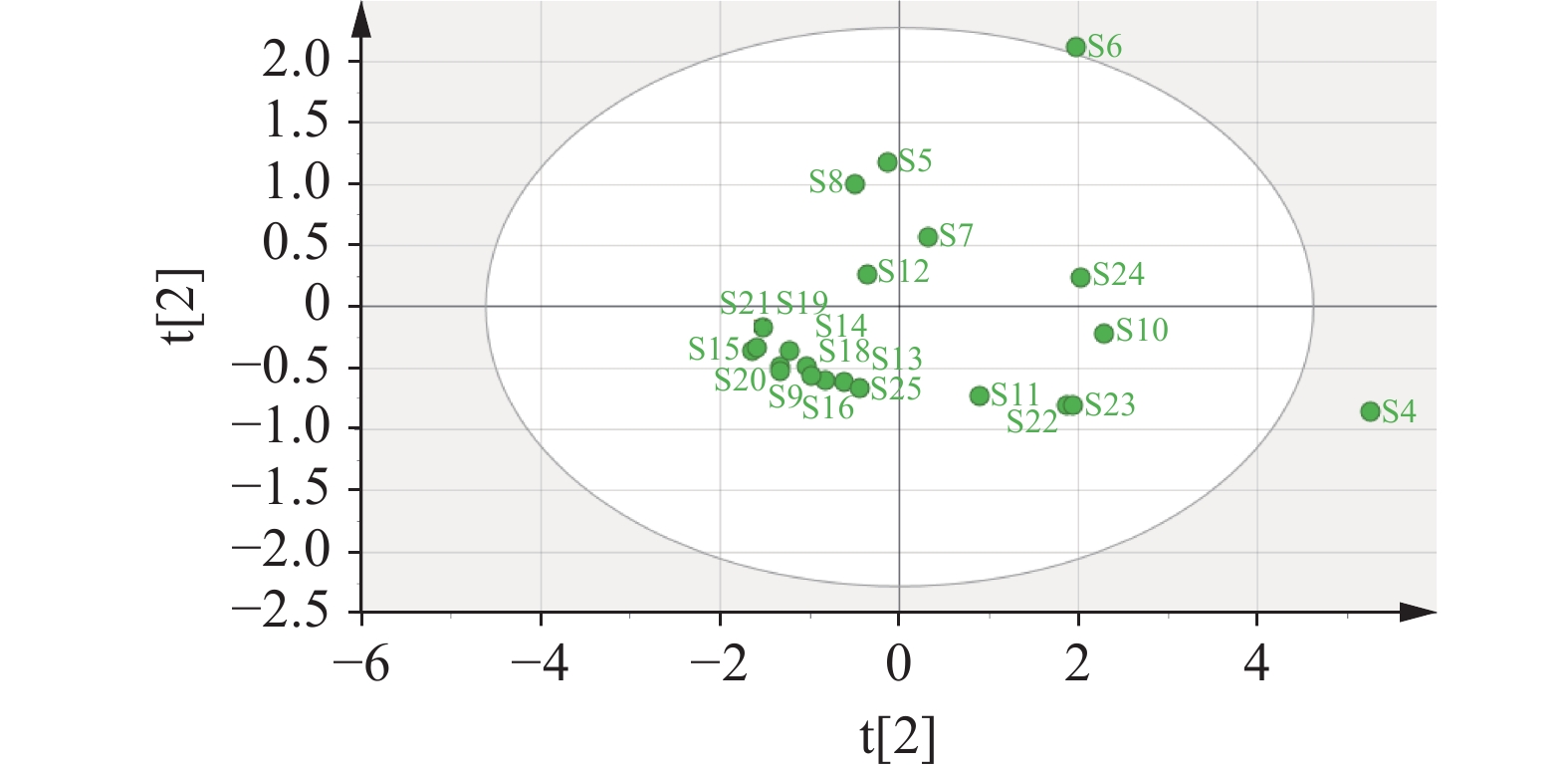
为了评价22批次样品所有成分的样品分辨能力,运用SIMCA 14.1 分析软件对其进行主成分分析,结果见图4。由PCA图可以看出,S9、S13~S21、S25聚为一类,S5、S7、S8、S12聚为一类,S10、S22、S23、S24聚为一类,与聚类分析的结果基本一致,样品之间的离散程度较大,表明样品差异性较大。
-
精密吸取混合对照品溶液1、2、4、8、16、32 μl,分别注入高效液相色谱仪,在“1.2”项实验色谱条件下,重复进样3次,测定4-羟基苯乙酮、2',5'-二羟基苯乙酮、白首乌二苯酮和2',4'-二羟基苯乙酮的峰面积,对结果进行线性回归分析,以各对照品浓度(X, μg)对峰面积(Y)绘制各标准曲线。线性关系考察结果见表2。
表 2 线性关系考察结果
成分 回归方程 R2 线性范围(μg) 4-羟基苯乙酮 Y=47 109X-22 868 0.999 9 0.015 61-0.499 6 2',5'二羟基苯乙酮 Y =23 028X-12 341 0.999 8 0.016 21-0.518 7 白首乌二苯酮 Y=15 075X-7 940.1 0.999 8 0.009 802-0.313 7 2',4'二羟基苯乙酮 Y=28 725X-12 816 0.999 9 0.013 34-0.427 0 -
按“1.2”项色谱条件对混合对照品溶液,重复进样6次,测定并计算4-羟基苯乙酮、2',5'-二羟基苯乙酮、白首乌二苯酮和2',4'-二羟基苯乙酮峰面积的RSD分别为1.35%、1.15%、1.27%和1.37%。
-
取混合对照品溶液,室温放置,按“1.2”项色谱条件,分别在0 h、2 h、4 h、6 h、12 h和24 h进样,测定并计算得到RSD分别为0.99%、0.82%、0.92%和0.88%,RSD值均小于3%,结果表明供试品溶液在24 h稳定性良好。
-
取同一批白首乌(S16)样品粉末6份,精密称定,按“1.3.2”项方法制备供试品溶液,按“1.2”项色谱条件测定,4-羟基苯乙酮、2',5'-二羟基苯乙酮、白首乌二苯酮和2',4'-二羟基苯乙酮峰面积的RSD分别为1.48%、1.84%、1.13%和2.01%,RSD值均小于3%,表明方法重复性良好。
-
精密称取同一批次白首乌(S16)样品粉末6份,每份1.0 g,按1:1质量比分别加入适量的4-羟基苯乙酮、2',5'-二羟基苯乙酮、白首乌二苯酮和2',4'-二羟基苯乙酮对照品,按照样品溶液的配制方法制备供试品溶液,在“1.2”项色谱条件下,测定并计算得到平均加样回收率(n=6)分别为97.77%、99.15%、98.81%和96.77%,RSD分别为2.07%、1.57%、1.20%和1.19%,加样回收率结果见表3。
表 3 加样回收率实验结果
成分 加样量(m/g) 样品含量(m/mg) 加对照品量(m/mg) 测得量(m/mg) 回收率(%) 平均回收率(%) RSD(%) 4-羟基苯乙酮 1.000 0 0.102 1 0.100 0 0.198 2 98.07 97.77 2.07 1.000 3 0.102 1 0.100 0 0.193 4 95.70 1.000 6 0.102 2 0.100 0 0.204 8 101.29 1.000 2 0.102 1 0.100 0 0.193 6 95.79 1.000 8 0.102 2 0.100 0 0.196 7 97.27 1.000 9 0.102 2 0.100 0 0.199 3 98.57 2',5'-二羟基苯乙酮 1.000 0 0.087 3 0.090 0 0.179 3 101.11 99.15 1.57 1.000 3 0.087 3 0.090 0 0.178 9 100.90 1.000 6 0.087 4 0.090 0 0.172 5 97.24 1.000 2 0.087 3 0.090 0 0.174 9 98.64 1.000 8 0.087 4 0.090 0 0.175 8 99.10 1.000 9 0.087 4 0.090 0 0.173 7 97.91 白首乌二苯酮 1.000 0 0.742 1 0.750 0 1.487 2 99.67 98.81 1.20 1.000 3 0.742 3 0.750 0 1.459 1 97.77 1.000 6 0.742 5 0.750 0 1.498 5 100.40 1.000 2 0.742 2 0.750 0 1.483 4 99.41 1.000 8 0.742 7 0.750 0 1.452 9 97.33 1.000 9 0.742 8 0.750 0 1.467 0 98.27 2',4'-二羟基苯乙酮 1.000 0 0.119 8 0.120 0 0.229 7 95.79 96.77 1.19 1.000 3 0.119 8 0.120 0 0.232 2 96.83 1.000 6 0.119 9 0.120 0 0.236 2 98.46 1.000 2 0.119 8 0.120 0 0.228 3 95.20 1.000 8 0.119 9 0.120 0 0.231 9 96.67 1.000 9 0.119 9 0.120 0 0.234 3 97.67 -
取25个批次的白首乌各2.0 g,按照样品溶液的配制方法制备白首乌供试品溶液,进样后记录各色谱峰的峰面积,将所得数据代入各标准曲线回归方程计算其含量,结果如表4。不同批次白首乌中各化合物成分存在显著差异,总苯乙酮类成分的含量也不同。
表 4 25批白首乌中苯乙酮类化学成分含量测定结果(n=3,mg/g)
编号 4-羟基
苯乙酮2',5'-二羟
基苯乙酮白首乌
二苯酮2',4'-二羟
基苯乙酮总苯乙酮
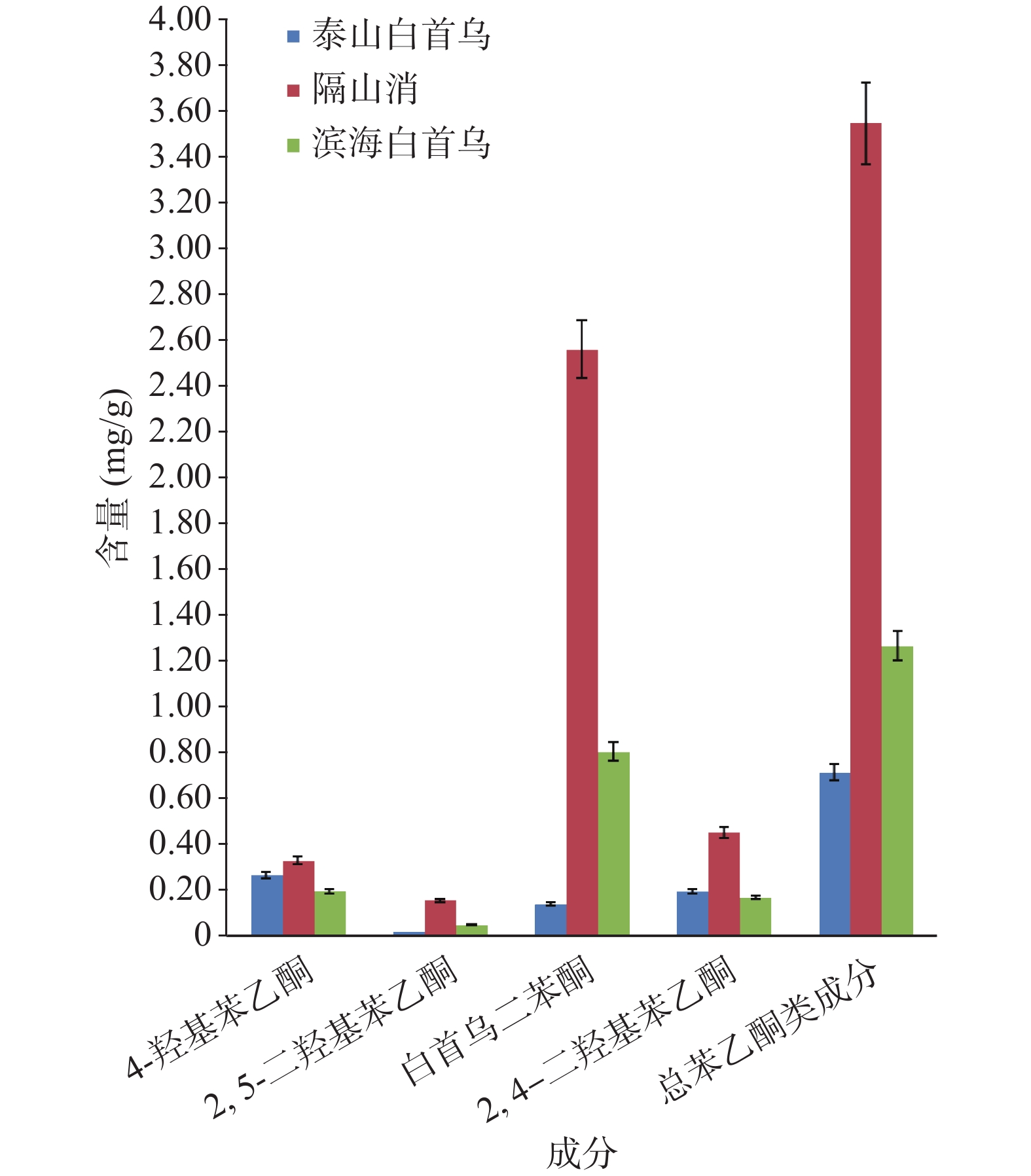
类成分S1 0.274 8 − 0.071 8 0.137 6 0.529 8 S2 0.470 9 0.045 4 0.344 7 0.384 0 1.432 3 S3 0.069 5 − 0.015 4 0.077 6 0.196 7 S4 0.497 5 0.311 1 2.808 6 0.683 7 4.373 9 S5 0.380 5 0.044 2 0.696 7 0.218 3 1.397 9 S6 0.679 3 0.065 3 1.781 4 0.360 8 2.955 1 S7 0.277 1 0.064 5 0.890 9 0.338 9 1.598 0 S8 0.290 4 0.020 4 0.650 6 0.240 4 1.247 7 S9 0.070 8 0.059 6 0.595 7 0.086 9 0.858 2 S10 0.364 5 0.155 5 2.171 7 0.402 2 3.115 2 S11 0.202 0 0.132 1 1.697 6 0.264 5 2.328 4 S12 0.210 4 0.034 2 1.192 0 0.211 9 1.676 6 S13 0.114 5 0.084 2 1.011 4 0.127 6 1.372 0 S14 0.095 0 0.070 6 0.703 3 0.110 3 1.028 3 S15 0.061 5 0.041 7 0.482 9 0.067 4 0.701 4 S16 0.102 1 0.087 3 0.742 1 0.119 8 1.066 0 S17 0.067 6 0.026 8 0.522 4 0.121 5 0.804 0 S18 0.088 8 0.067 5 0.867 2 0.105 9 1.160 1 S19 0.084 3 0.048 8 0.705 2 0.112 0 0.966 7 S20 0.064 2 0.052 6 0.742 4 0.083 5 0.955 2 S21 0.072 6 0.048 3 0.424 0 0.068 0 0.648 6 S22 0.209 0 0.113 2 2.710 9 0.401 7 3.469 3 S23 0.212 9 0.118 3 2.683 9 0.410 0 3.456 4 S24 0.392 7 0.099 8 2.466 8 0.383 3 3.359 6 S25 0.110 5 0.092 3 1.023 1 0.161 4 1.400 3 注:“−”表示含量很低,超出线性范围。 泰山白首乌历来被认为是白首乌的正品,而隔山消和滨海白首乌尽管也用作白首乌,但仍被认为是泰山白首乌的近缘品种。本研究发现,隔山消中总苯乙酮类成分的含量最高,滨海白首乌次之,泰山白首乌最低,总苯乙酮含量仅为隔山消的20%(图5)。栽培的隔山消中总苯乙酮含量与野生的相差不大,说明隔山消野生变家养驯化成功。
滨海白首乌是目前流通的主流品种,江苏滨海、湖南、安徽、四川等地均有栽培,含量差异不大,然而野生的滨海白首乌总苯乙酮含量显著高于栽培品,说明该品种的种植存在着改良的空间,可以从种植环境、栽培技术等方面予以改进。
-
本研究通过建立白首乌指纹图谱来评价白首乌药材的品质,对25批次不同白首乌的4种苯乙酮类指标性成分进行含量测定分析,并对其方法学进行考察。HPLC指纹图谱中相似度和聚类分析研究表明,泰山白首乌、滨海白首乌及隔山消的化学成分差异显著。HPLC含量测定分析发现,隔山消中总苯乙酮类的含量明显高于滨海白首乌和泰山白首乌。后续可以对3种白首乌的植物基源、化学成分、药理及毒理作用进行综合对比研究,为滨海白首乌和隔山消是否可以替代泰山白首乌作为白首乌正品药材应用,提供理论依据。
Species differences of Baishouwu based on characteristic chromatogram and content determination of acetophenones
-
摘要:
目的 建立不同产地白首乌药材的指纹图谱,并测定苯乙酮类成分含量,为不同品种白首乌药材的质量控制提供科学依据。 方法 采用HPLC-DAD法建立白首乌药材HPLC指纹图谱,同时对4种苯乙酮类成分进行含量测定。其中,色谱柱为Diamonsil C18(4.6 mm× 250 mm, 5 μm),流动相为甲醇-0.1%磷酸梯度洗脱,流速为1 ml/min,柱温为30 ℃,检测波长为260 nm(4-羟基苯乙酮、白首乌二苯酮、2',4'-二羟基苯乙酮)和280 nm(2',5'-二羟基苯乙酮)。 结果 泰山白首乌、滨海白首乌及隔山消中化学成分差异显著,隔山消中总苯乙酮类成分含量明显高于滨海白首乌和泰山白首乌。 结论 以苯乙酮类成分为评价指标,隔山消的总苯乙酮含量较高,可作为白首乌药材的优质资源。 Abstract:Objectives To provide scientific basis for the quality control of different species of Baishouwu by establishing the HPLC fingerprint of domestic of Baishouwu and determining the main active components of acetophenones. Methods HPLC-DAD method was used to determine the HPLC fingerprints of domestic of Baishouwu. Then, the content of 4 kinds of acetophenones in Baishouwu was determined. The column was Diamonsil C18(250mm×4.6mm, 5μm)with the mobile phase of methanol and 0.1% phosphoric acid at a flow rate of 1.0 ml/min. The detection wavelength of p-Hydroxyl acetophenone, baishouwu benzophenone, 2',4'-Dihydroxy acetophenone was set at 260 nm and 2',5'-Dihydroxy acetophenone at 280 nm respectively. Results The similarity and cluster analysis in HPLC fingerprint showed that the constituents were significantly different among C. bungei, C. auriculatum and C. wilfordii. The content of total acetophenones in C. wilfordii was significantly higher than that in other localities of C. auriculatum and C. bungei. Conclusions Acetophenone could be used as the evaluation index to evaluate the quality of Baishouwu in different origins. The content of total acetophenone in C. wilfordii is the highest, which could be used as the best quality resource of Baishouwu. -
Key words:
- Baishouwu /
- acetophenone /
- HPLC /
- characteristic chromatogram /
- contents determination
-
西红花为名贵药材,来源于鸢尾科植物番红花Crocus sativus L.的干燥柱头。原产于地中海地区、希腊、小亚细亚和伊朗,后经西藏传入国内,故又名藏红花[1]。《本草纲目》中记载番红花“主治心忧郁积、气闷不散,活血,亦治惊悸”[2]。2020版《中国药典》描述西红花具有活血化瘀、凉血解毒、解郁安神的功效[3]。越来越多的现代药理研究表明,西红花具有抗肿瘤、抗血小板聚集与凋亡、抗心血管细胞凋亡、降血脂和降血糖等活性[4–6],在健康和医疗领域具有重要作用。
世界卫生组织国际癌症研究机构(IARC)发布的最新数据,2020年全球癌症新发患者病例数超过1 930万例,癌症死亡患者接近1 000万例[7]。天然活性成分是抗肿瘤药物研发的重要来源[8]。有研究表明,西红花中特有的西红花酸、西红花苷等具有抗肿瘤活性[9],已有学者在西红花治疗结直肠癌、乳腺癌等的抗肿瘤作用方面进行了相关研究[10-11],但其主要活性成分及抗肿瘤作用机制仍需进一步探索。
网络药理学[12]将系统生物学、生物信息学、计算生物学、网络科学和靶向药理学相结合,从系统层次和生物网络的整体角度探讨成分—靶标—通路的相互作用关系,为中药多靶点、多成分、系统性、整体性的作用机制研究提供了有力的技术支撑,从而指导新药研发和临床诊疗。因此,本研究应用网络药理学结合反向分子对接的方法,对西红花的抗肿瘤作用成分及靶点机制进行研究,为深入探索西红花抗肿瘤药效物质基础及作用机制提供参考。
1. 方法
1.1 西红花化学成分获取
利用TCMSP平台获取西红花化学成分,口服生物利用度(oral bioavailability,OB)和类药性(drug-likeness,DL) 是药物筛选的关键参数,一般设置OB≥30%和DL≥0.18的化学成分作为候选药效成分,并结合文献报道[13–15]补充4个西红花化学成分。
1.2 西红花活性成分和肿瘤疾病相关靶点整理
应用TCMSP平台和PharmMapper[16]工具获取西红花活性成分的作用靶点,并借助UniProt数据库将靶点转换为对应基因。以“tumor”、“cancer”为关键词,在GeneCards(https://www.genecards.org/)、OMIM数据库(https://www.omim.org/)和TTD数据库(http://db.idrblab.net/ttd/)进行检索。将得到的疾病靶点和药物靶点取交集,作为药物作用于疾病的预测靶点。
1.3 “成分-靶点”网络的构建
根据预测的西红花药效成分、交集靶点,使用Cytoscape 3.9.1软件建立“成分-靶点”的网络图。
1.4 蛋白质相互作用网络(protein-protein interaction,PPI)的构建与分析
将药物疾病交集靶点输入String数据库构建PPI网络进行初步筛选,再将PPI网络导入Cytoscape 3.9.1中,以半数degree为参考标准,选取关键靶点。
1.5 基因功能注释和富集通路分析
将筛选获得的37个核心靶点录入Metascape平台(http://metascape.org/gp/index.html),物种设置为人,选择Custom Analysis,设置P<0.01,进行基因本体(gene ontology,GO)功能富集分析及京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析。
1.6 分子对接
将筛选出的西红花主要活性成分通过PubChem下载SDF格式;利用RCSB PDB数据库下载关键蛋白靶点,优先选择有配体、结构相对完整的晶体结构,并采用AutoDock Tools对获取的PDB蛋白分子进行除水、加氢、计算电荷预处理;使用AutoDock Vina进行分子对接,计算结合能;选取最优构象,使用PyMOL软件做出3D结合模式图。
2. 结果
2.1 西红花化学成分获取
通过TCMSP获得70个西红花化学成分,设置OB≥30%且DL≥0.18进行筛选,再添加文献检索相关成分,共获得9个西红花活性成分,见表1。
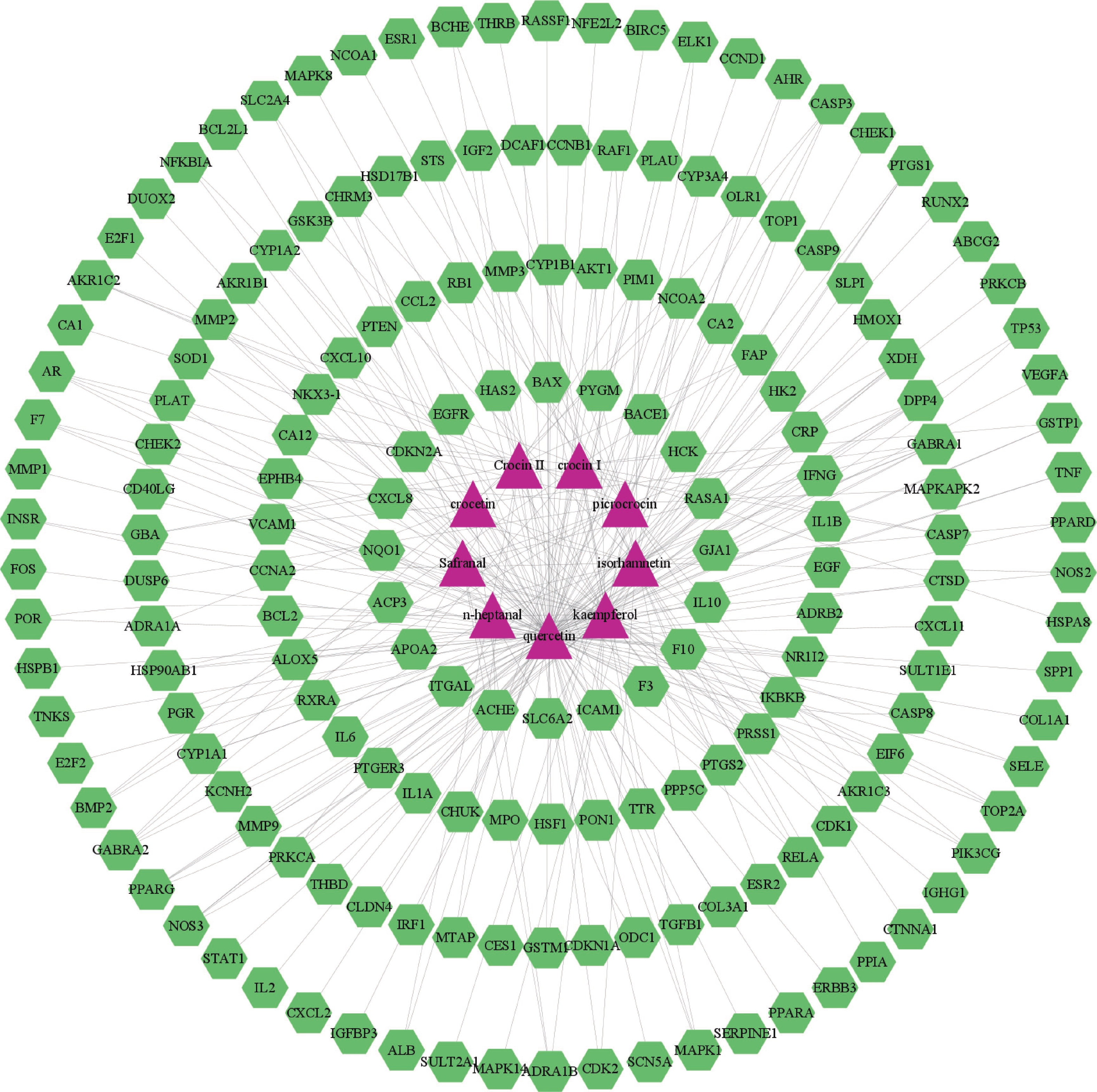
表 1 西红花活性成分序号 化合物编号 化合物英文名 中文名 OB (%) DL 1 MOL001389 n-heptanal 庚醛 79.74 0.59 2 MOL001406 crocetin 西红花酸 35.3 0.26 3 MOL000354 isorhamnetin 异鼠李素 49.6 0.31 4 MOL000422 kaempferol 山柰酚 41.88 0.24 5 MOL000098 quercetin 槲皮素 46.43 0.28 6 MOL001405 crocin Ⅰ 西红花苷Ⅰ 2.54 0.12 7 MOL001407 crocin Ⅱ 西红花苷Ⅱ 1.65 0.21 8 MOL000720 safranal 藏红花醛 39.56 0.04 9 MOL001409 picrocrocin 苦番红花素 33.71 0.04 2.2 西红花活性成分和肿瘤疾病靶点
将TCMSP平台和PharmMapper获取结果进行整理,并借助UniProt数据库进行靶基因匹配,获得201个潜在靶点。以“tumor”和“cancer”为关键词,在GeneCards、OMIM和TTD数据库进行预测整理,剔除重复,筛选得到5896个潜在疾病靶点。将得到的疾病靶点和药物靶点取交集,共得到可作为药物作用于疾病的179个预测靶点。
2.3 “成分-靶点”网络的构建与分析
将西红花的9个活性成分与预测到的179个潜在靶点导入Cytoscape 3.9.1软件,构建“药物-活性成分-靶点”网络(图1),网络中绿色代表药物作用于疾病的靶点,蓝色代表西红花活性成分,全图包括189个节点、299条边,其中degree值排名靠前的活性成分为槲皮素、山柰酚、异鼠李素、苦番红花素和西红花苷Ⅰ,这些可能是西红花发挥抗肿瘤作用的潜在活性成分。
2.4 蛋白相互作用PPI的构建与分析
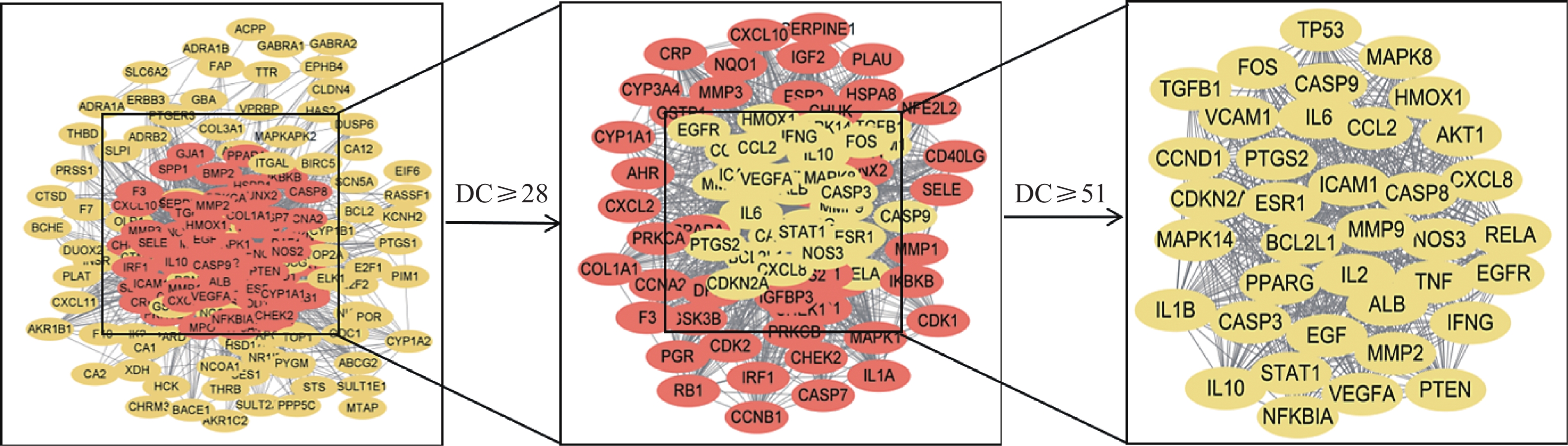
将疾病与活性成分的潜在靶点导入String数据库,采用Cytoscape 3.9.1软件绘制PPI网络图,依据degree值进行排序,以大于半数degree值为标准进行两次筛选,获取核心靶点37个(图2)。度值排名前5的靶点分别为EGF、MMP9、NFKBIA、IL-1B和IL-10,提示这些靶点可能是西红花发挥抗肿瘤作用的关键潜在靶点。
2.5 基因功能注释和富集通路分析
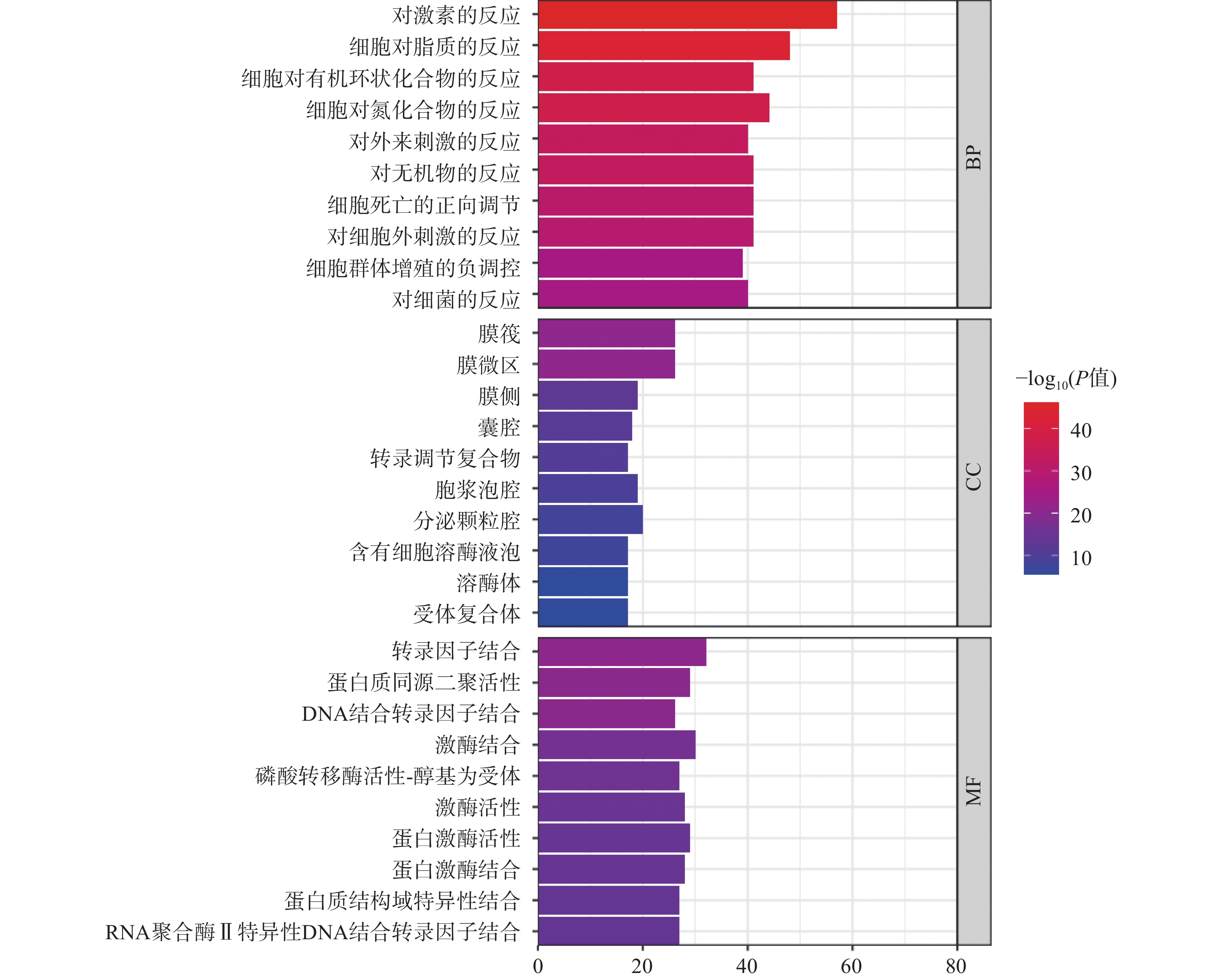
GO分析常用于注释基因和基因产物生物功能,分析包括生物过程(biological process,BP)、分子功能(molecular function,MF)和细胞组成(cellular component,CC)三部分。此次GO富集分析共得到BP富集结果193个、CC富集结果83个和MF富集结果123个,选取排名前10的条目绘制GO功能分析图(图3)。如图3所示,BP主要涉及对激素的反应、对脂质的反应、对异源刺激的反应等;CC主要涉及膜筏、膜微区、囊腔、细胞质囊泡腔等;MF主要涉及转录因子结合、DNA结合转录因子结合、RNA聚合酶Ⅱ特异性DNA结合转录因子结合等。通过比较发现,细胞生物过程富集的基因数较多,说明西红花可能主要通过调节生物过程发挥抗肿瘤作用。
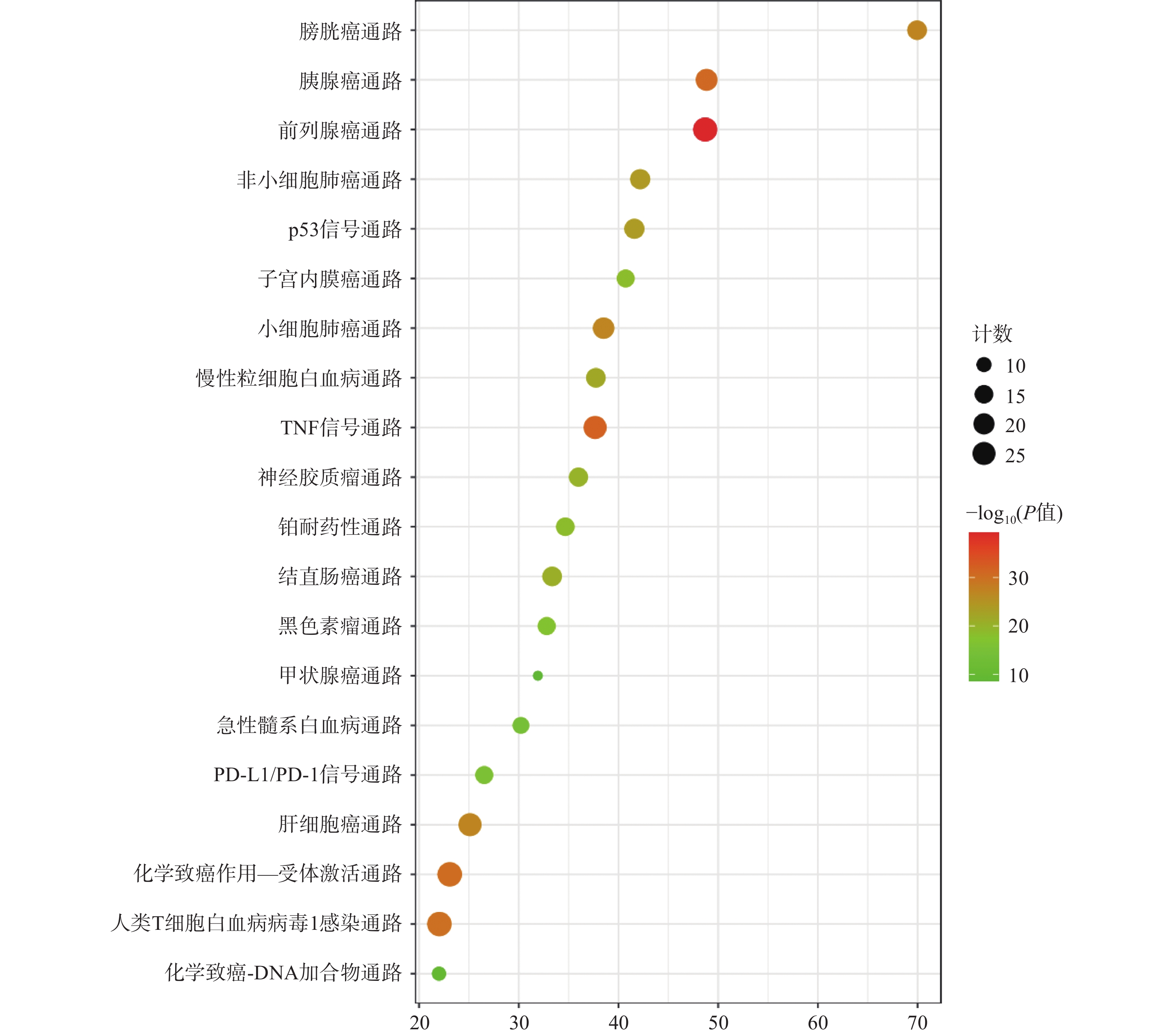
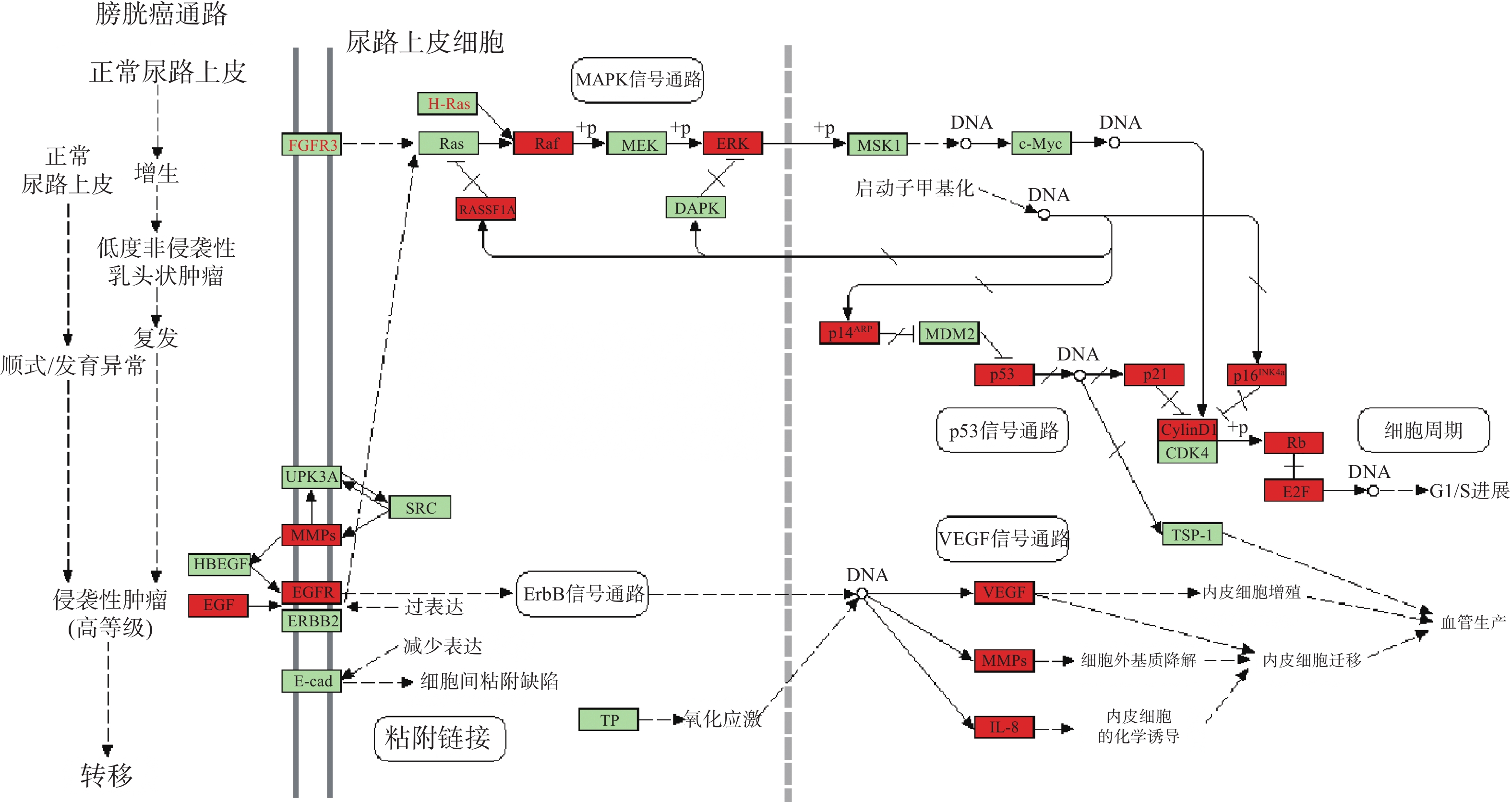
KEGG分析共富集到194条信号通路,其中34条癌症相关通路,并对前20条通路绘制气泡图(图4)。依据KEGG分析,西红花可能通过p53信号通路、TNF通路发挥抗肿瘤作用,可能对膀胱癌、胰腺癌、前列腺癌、非小细胞肺癌等肿瘤具有治疗作用,西红花靶点-通路相互作用网络见图5,红色三角形代表与肿瘤相关的信号通路,蓝色矩形代表关键靶点。其中,西红花通过膀胱癌信号通路调控EGF、MMPs、Raf、VEGF、ERK等基因发挥抗肿瘤作用(图6),红色矩形代表西红花可能干预的关键靶点。
2.6 分子对接
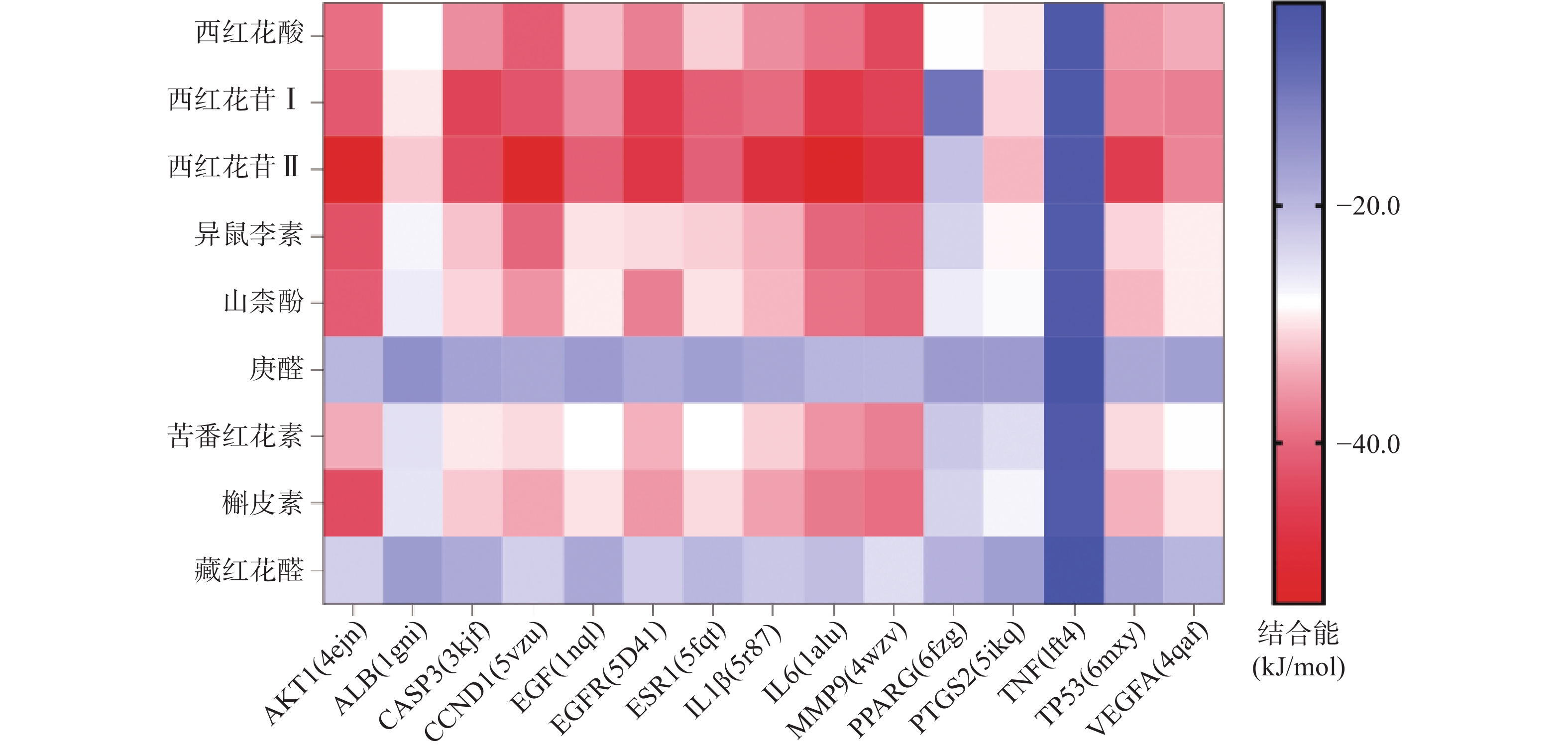
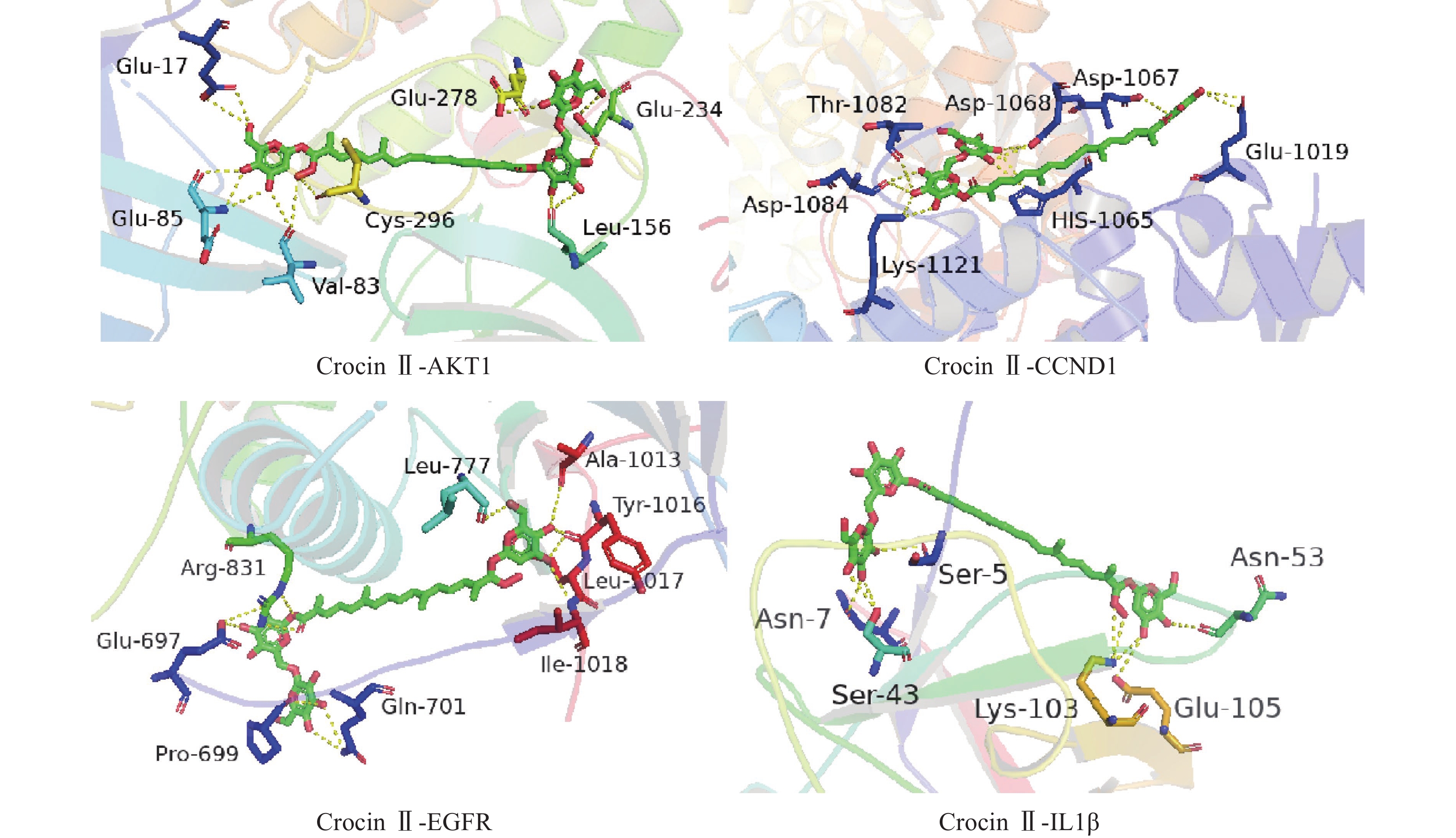
将前15个潜在核心靶点与西红花活性成分进行分子对接。结合能(affinity)<0表明配体分子能够与受体蛋白自发结合,结合能≤−17.78 kJ/mol表明配体与受体有一定的结合活性,结合能≤−20.92 kJ/mol 表明配体与受体有较好的结合活性,结合能≤−29.29 kJ/mol 表明配体与受体有强的结合活性[17],且结合能越低,表明对接的效果越好,结合的构象越稳定[18]。经AutoDock Vina对接,将得到的结合能数据使用热图展示(图7)。本研究结合自由能小于−20.92kJ/mol 的活性成分有102个,占75.6%;小于−29.29kJ/mol 的活性成分有73个,占54.1%,可见这些核心化合物与受体结合活性较高,结构相对稳定。选取结合能力最好的4个组合用Pymol软件进行可视化处理(图8)。
3. 讨论
肿瘤的发生和发展是多基因、多步骤的结果。中药多成分、多靶点的特点使其在肿瘤治疗方面有独特的优势。大量的临床实践表明,中药在治疗肿瘤中能够改善症状、提高患者生存质量、延长生存期等,有着其他治疗药物及手段不可替代的作用[19-20]。以中药黄芪为例,不仅可以通过Wnt5/β-catenin信号通路抑制肿瘤生长[21],同时具有通过PD-L1下调诱导耐药黑色素瘤的干性抑制和化疗敏感性增强的作用,可以减少化疗药物用量[22],还能充当免疫佐剂,提高患者免疫力,改善生存质量[23]。网络药理学最大的优势在于可以运用系统生物学的分析,为中药多成分、多靶点、多通路的机制研究提供有力的技术支撑[12],其分析理念和技术路径又与中医药治疗疾病的整体观相契合,已用于多种中药和中药复方作用机制的研究,如灯盏细辛、半枝莲等中药和茵陈蒿汤、桃红四物汤等中药复方,利用网络药理学的方法得到治疗机制的详细阐述和证明[24–27],为中药药理作用机制的探索提供了很好的参考。
本研究发现西红花中多种成分,如西红花酸、西红花苷等可与IL-6、AKT1、CCND1、IL-1β、MMP9、EGFR、TP53靶点产生适度结合,提示这些靶点可能是西红花中活性成分发挥抗肿瘤作用的关键靶点。研究发现,AKT1是PI3K-AKT-mTOR信号通路中的重要靶点,被磷酸化激活后可以促进细胞的增殖与存活,与肿瘤细胞的生长密切相关[28]。多项研究表明,通过抑制AKT1可以治疗肺癌、结肠癌、卵巢癌等多种实体癌[29]。EGFR与一些全球发病率和致死率高的癌症发病机制直接或间接相关,包括肺癌、乳腺癌和结直肠癌等[30]。当EGFR过度表达时,细胞表面会出现过量的受体,诱导正常的细胞转化为癌细胞,并为癌细胞持续生存提供条件[31]。CCND1是细胞周期家族的一员[32],公认的原癌基因,在甲状旁腺瘤、乳腺癌、肝癌及食管、肺、头颈部鳞状细胞癌的发生、发展过程中均起着重要作用[33-34]。西红花苷是由西红花酸和龙胆二糖或葡萄糖结合形成的二萜苷类化合物,西红花苷Ⅰ和西红花苷Ⅱ的差别在于分子中糖苷基数目的多少 [35]。西红花酸已具有抗肿瘤作用,以其为苷元形成的西红花苷同样也表现出较好的抗肿瘤活性,其中西红花苷Ⅱ的表现最好。西红花苷可以通过P53途径下调细胞周期蛋白d1和p21的表达,诱导细胞凋亡和细胞周期停滞,从而抑制肿瘤生长[36]。分子对接的结果与GO富集分析、KEGG通路富集分析结果一致,验证了网络药理学分析结果的正确性。
Buyun等学者在肝癌Hep3B和HepG2细胞中使用西红花苷抑制了IL-6对STAT3以及细胞周期蛋白D1的激活,验证了西红花对肝癌细胞的抗增殖,凋亡和阻断入侵作用[37]。在转移性乳腺癌的研究中,Ali等研究人员在体内和体外实验中均证明了西红花苷可以通过VEGF和MMP9下调发挥抗肿瘤作用,而且对乳腺癌的转移扩散有较好的抑制作用[38]。这些研究成果在一定程度上验证了利用网络药理学探究发现的西红花抗肿瘤作用机制的可行性。
综上所述,本研究利用网络药理学结合分子对接技术,探究西红花抗肿瘤作用的活性成分、作用靶点及信号通路。发现西红花抗肿瘤的作用具有多成分、多靶点、多通路、多机制的特点,其中以西红花苷为代表的西红花特有化学成分显示出了良好的抗肿瘤活性,可以在多条肿瘤发生通路中发挥作用,为西红花治疗肿瘤的深入研究提供了理论基础。但这些结果受限于各个数据库信息的片面性,而且只关注了成分,没有考量到成分的含量及其之间是否存在相互作用,预测的结果存在一定的片面性和局限性,需要进一步进行体内、外实验验证。
-
表 1 25批白首乌样品来源
样品 产地 物种 类型 S1 山东济南 泰山白首乌 栽培(两年) S2 山东临沂 泰山白首乌 栽培(两年) S3 山东泰安 泰山白首乌 栽培(一年) S4 山东临沂 隔山消 栽培(两年) S5 四川巴蜀 滨海白首乌 饮片 S6 湖南湘西 滨海白首乌 野生 S7 四川成都 滨海白首乌 饮片 S8 湖南张家界 滨海白首乌 饮片 S9 广东广州 滨海白首乌 饮片 S10 山东济南 隔山消 栽培(两年) S11 安徽阜阳 滨海白首乌 饮片 S12 四川遂宁 滨海白首乌 饮片 S13 安徽亳州 滨海白首乌 饮片 S14 江苏南京 滨海白首乌 饮片 S15 广西玉林 滨海白首乌 饮片 S16 江苏徐州 滨海白首乌 饮片 S17 贵州毕节 滨海白首乌 饮片 S18 江西南昌 滨海白首乌 饮片 S19 江苏滨海 滨海白首乌 饮片 S20 云南昆明 滨海白首乌 饮片 S21 云南大理 滨海白首乌 饮片 S22 安徽大别山 隔山消 野生 S23 四川广安 隔山消 野生 S24 陕西汉中 隔山消 野生 S25 河北安国 滨海白首乌 饮片 表 2 线性关系考察结果
成分 回归方程 R2 线性范围(μg) 4-羟基苯乙酮 Y=47 109X-22 868 0.999 9 0.015 61-0.499 6 2',5'二羟基苯乙酮 Y =23 028X-12 341 0.999 8 0.016 21-0.518 7 白首乌二苯酮 Y=15 075X-7 940.1 0.999 8 0.009 802-0.313 7 2',4'二羟基苯乙酮 Y=28 725X-12 816 0.999 9 0.013 34-0.427 0 表 3 加样回收率实验结果
成分 加样量(m/g) 样品含量(m/mg) 加对照品量(m/mg) 测得量(m/mg) 回收率(%) 平均回收率(%) RSD(%) 4-羟基苯乙酮 1.000 0 0.102 1 0.100 0 0.198 2 98.07 97.77 2.07 1.000 3 0.102 1 0.100 0 0.193 4 95.70 1.000 6 0.102 2 0.100 0 0.204 8 101.29 1.000 2 0.102 1 0.100 0 0.193 6 95.79 1.000 8 0.102 2 0.100 0 0.196 7 97.27 1.000 9 0.102 2 0.100 0 0.199 3 98.57 2',5'-二羟基苯乙酮 1.000 0 0.087 3 0.090 0 0.179 3 101.11 99.15 1.57 1.000 3 0.087 3 0.090 0 0.178 9 100.90 1.000 6 0.087 4 0.090 0 0.172 5 97.24 1.000 2 0.087 3 0.090 0 0.174 9 98.64 1.000 8 0.087 4 0.090 0 0.175 8 99.10 1.000 9 0.087 4 0.090 0 0.173 7 97.91 白首乌二苯酮 1.000 0 0.742 1 0.750 0 1.487 2 99.67 98.81 1.20 1.000 3 0.742 3 0.750 0 1.459 1 97.77 1.000 6 0.742 5 0.750 0 1.498 5 100.40 1.000 2 0.742 2 0.750 0 1.483 4 99.41 1.000 8 0.742 7 0.750 0 1.452 9 97.33 1.000 9 0.742 8 0.750 0 1.467 0 98.27 2',4'-二羟基苯乙酮 1.000 0 0.119 8 0.120 0 0.229 7 95.79 96.77 1.19 1.000 3 0.119 8 0.120 0 0.232 2 96.83 1.000 6 0.119 9 0.120 0 0.236 2 98.46 1.000 2 0.119 8 0.120 0 0.228 3 95.20 1.000 8 0.119 9 0.120 0 0.231 9 96.67 1.000 9 0.119 9 0.120 0 0.234 3 97.67 表 4 25批白首乌中苯乙酮类化学成分含量测定结果(n=3,mg/g)
编号 4-羟基
苯乙酮2',5'-二羟
基苯乙酮白首乌
二苯酮2',4'-二羟
基苯乙酮总苯乙酮
类成分S1 0.274 8 − 0.071 8 0.137 6 0.529 8 S2 0.470 9 0.045 4 0.344 7 0.384 0 1.432 3 S3 0.069 5 − 0.015 4 0.077 6 0.196 7 S4 0.497 5 0.311 1 2.808 6 0.683 7 4.373 9 S5 0.380 5 0.044 2 0.696 7 0.218 3 1.397 9 S6 0.679 3 0.065 3 1.781 4 0.360 8 2.955 1 S7 0.277 1 0.064 5 0.890 9 0.338 9 1.598 0 S8 0.290 4 0.020 4 0.650 6 0.240 4 1.247 7 S9 0.070 8 0.059 6 0.595 7 0.086 9 0.858 2 S10 0.364 5 0.155 5 2.171 7 0.402 2 3.115 2 S11 0.202 0 0.132 1 1.697 6 0.264 5 2.328 4 S12 0.210 4 0.034 2 1.192 0 0.211 9 1.676 6 S13 0.114 5 0.084 2 1.011 4 0.127 6 1.372 0 S14 0.095 0 0.070 6 0.703 3 0.110 3 1.028 3 S15 0.061 5 0.041 7 0.482 9 0.067 4 0.701 4 S16 0.102 1 0.087 3 0.742 1 0.119 8 1.066 0 S17 0.067 6 0.026 8 0.522 4 0.121 5 0.804 0 S18 0.088 8 0.067 5 0.867 2 0.105 9 1.160 1 S19 0.084 3 0.048 8 0.705 2 0.112 0 0.966 7 S20 0.064 2 0.052 6 0.742 4 0.083 5 0.955 2 S21 0.072 6 0.048 3 0.424 0 0.068 0 0.648 6 S22 0.209 0 0.113 2 2.710 9 0.401 7 3.469 3 S23 0.212 9 0.118 3 2.683 9 0.410 0 3.456 4 S24 0.392 7 0.099 8 2.466 8 0.383 3 3.359 6 S25 0.110 5 0.092 3 1.023 1 0.161 4 1.400 3 注:“−”表示含量很低,超出线性范围。 -
[1] 彭蕴茹, 丁永芳, 李友宾, 等. 白首乌研究现状[J]. 中草药, 2013, 44(3):370-378. doi: 10.7501/j.issn.0253-2670.2013.03.026 [2] 孙彦敏, 王辉, 徐凌川. 近10年白首乌研究进展[J]. 中国中医药信息杂志, 2015, 27(7):131-136. doi: 10.3969/j.issn.1005-5304.2015.07.041 [3] CHEN W H, ZHANG Z Z, BAN Y F, et al. Cynanchum bungei Decne and its two related species for “Baishouwu”: a review on traditional uses, phytochemistry, and pharmacological activities[J]. J Ethnopharmacol,2019,243:112110. doi: 10.1016/j.jep.2019.112110 [4] JIANG H W, LIN J, WANG G M, et al. Acetophenone derivatives from the root bark of Cynanchum wilfordii as potential neuroprotective agents[J]. Phytochem Lett,2018,24:179-183. doi: 10.1016/j.phytol.2018.02.002 [5] SUN Y S, LIU Z B, WANG J H, et al. Aqueous ionic liquid based ultrasonic assisted extraction of four acetophenones from the Chinese medicinal plant Cynanchum bungei Decne[J]. Ultrason Sonochem,2013,20(1):180-186. doi: 10.1016/j.ultsonch.2012.07.002 [6] HAN L, ZHOU X P, YANG M M, et al. Ethnobotany, phytochemistry and pharmacological effects of plants in genus Cynanchum Linn. (Asclepiadaceae)[J]. Molecules,2018,23(5):1194. doi: 10.3390/molecules23051194 [7] 谢凯强. 隔山消化学成分及生物活性研究[D]. 贵阳: 贵州大学, 2017. [8] LEE M K, YEO H, KIM J, et al. Protection of rat hepatocytes exposed to CCl4 in-vitro by cynandione A, a biacetophenone from Cynanchum wilfordii[J]. J Pharm Pharmacol,2000,52(3):341-345. [9] YANG S B, LEE S M, PARK J H, et al. Cynandione A from Cynanchum wilfordii attenuates the production of inflammatory mediators in LPS-induced BV-2 microglial cells via NF-κB inactivation[J]. Biol Pharm Bull,2014,37(8):1390-1396. doi: 10.1248/bpb.b13-00939 [10] KIM S H, LEE T H, LEE S M, et al. Cynandione A attenuates lipopolysaccharide-induced production of inflammatory mediators via MAPK inhibition and NF-κB inactivation in RAW264.7 macrophages and protects mice against endotoxin shock[J]. Exp Biol Med (Maywood),2015,240(7):946-954. doi: 10.1177/1535370214558022 [11] KOO H J, SOHN E H, PYO S, et al. An ethanol root extract of Cynanchum wilfordii containing acetophenones suppresses the expression of VCAM-1 and ICAM-1 in TNF-α-stimulated human aortic smooth muscle cells through the NF-κB pathway[J]. Int J Mol Med,2015,35(4):915-924. doi: 10.3892/ijmm.2015.2112 [12] JIANG H W, GU S S, CAO L, et al. Potential hypoglycemic effect of acetophenones from the root bark of Cynanchum wilfordii[J]. Nat Prod Res,2019,33(16):2314-2321. doi: 10.1080/14786419.2018.1443100 [13] HA D T, TRUNG T N, HIEN T T, et al. Selected compounds derived from Moutan Cortex stimulated glucose uptake and glycogen synthesis via AMPK activation in human HepG2 cells[J]. J Ethnopharmacol,2010,131(2):417-424. doi: 10.1016/j.jep.2010.07.010 [14] 王光辉, 王琦, 时元林. 泰山四大名药[J]. 山东中医杂志, 2006, 25(3):203-204. doi: 10.3969/j.issn.0257-358X.2006.03.028 [15] 刘琪, 谷巍, 杨兵, 等. 基于ITS2序列的滨海白首乌及其近缘种DNA分子鉴定[J]. 中草药, 2018, 49(24):5901-5909. doi: 10.7501/j.issn.0253-2670.2018.24.025 -





 下载:
下载:

 下载:
下载: