-
失眠是现代社会常见的临床症状之一,对人们的身心健康和生活质量造成严重影响,同时还会伴发多种躯体和精神疾病。随着社会的高速发展,工作压力大,生活不规律,导致失眠的发病率逐年上升且呈现低龄化趋势,引起社会各界的高度重视[1]。有研究表明,我国大约有45.5%的人群有不同程度的睡眠障碍[2]。夜宁胶囊为联勤保障部队第904医院(本院)自制制剂,该制剂是《中华人民共和国药典》(一部)2020版收载的夜宁糖浆[3]的改剂型,主要由合欢皮、灵芝、首乌藤等7味药材组成,具有镇静、养心、安神的功效,用于改善心血不足所致的失眠、多梦、头晕、乏力。该文通过研究夜宁胶囊对小鼠自主活动、协同阈上/阈下戊巴比妥钠催眠作用以及小鼠脑组织中γ-氨基丁酸(GABA)、去甲肾上腺素(NE)、多巴胺(DA)、5-羟色胺(5-HT)含量变化的影响,验证夜宁胶囊的镇静催眠作用,并初步对其作用机制进行探讨。
-
雄性ICR小鼠[体质量为(20±2) g,SPF级 ,常州卡文斯实验动物有限公司,动物合格证号:SCXK(苏)2016-0010]。动物在温度为25 ℃±2 ℃,湿度为55%±10%的环境中适应性饲养7 d,自由摄取饮用水和标准饲料,保持昼夜节律和环境干净整洁。
-
夜宁胶囊(批号:2020081,本院院内自制制剂);艾司唑仑片(批号:20200111,常州四药);戊巴比妥钠(批号:191201,Sigma分装);生理盐水(批号:020100201,四川科伦药业股份有限公司);GABA ELISA试剂盒(货号:xy-E12157,信裕生物);NE ELISA试剂盒(货号:MBS2600834,Mybiosource);DA ELISA试剂盒(货号:MBS269234,Mybiosource);5-HT ELISA试剂盒(货号:MBS266457,Mybiosource)。
-
电子分析天平(XS105型,梅特勒托利多仪器有限公司);超声波清洗机(FQ-1006HTD型,杭州法兰特超声波科技有限公司);旋转蒸发器(RE-5C式,上海青浦沪西仪器厂);电热恒温水浴锅(上海医疗器械五厂); CT-C-O型烘箱(常州市范氏干燥设备有限公司);自制开野实验敞箱(50 cm×50 cm×30 cm),箱内为黑色,箱底画出25个同等面积的方格;酶标仪(ELX 800型,Bio-Tex);离心机(80-2型,上海手术器械厂);可调高速匀浆机(FSH-2A型,常州翔天实验仪器厂)。
-
夜宁胶囊的制法为:浮小麦加水浸泡2 h,煮沸,于80 ℃~90 ℃温浸2次,每次2 h,滤过合并温浸液;灵芝粉碎成粗粉,用95%乙醇浸泡7 d,压榨滤过,滤液减压浓缩干燥,粉碎成细粉,过80目筛,备用;上述灵芝粗粉药渣与合欢皮、首乌藤、大枣、女贞子、甘草加水煎煮滤过,滤液和上述温浸液合并,减压浓缩干燥,碎成细粉,过80目筛,加入灵芝细粉,混匀装胶囊,即得夜宁胶囊,规格为400 mg/粒,推荐服用量约10粒/日。按照一个成年人体质量60 kg,服用剂量约为60 mg/kg,换算得到小鼠的中剂量约为600 mg/kg。将ICR小鼠随机分成5组(每组10只):① 空白对照组(相应体积的溶剂灌胃);② 艾司唑仑组(0.8 mg/kg);③ 夜宁胶囊低剂量组(400 mg/kg,YNL组);④ 夜宁胶囊中剂量组(600 mg/kg,YNM组);⑤ 夜宁胶囊高剂量组(800 mg/kg,YNH组)。每天下午5点灌胃给药,连续灌胃8 d。
-
在第6天给药30 min后,将小鼠放置在开野实验敞箱中先适应1 min,待适应时间结束后观察小鼠5 min内自主活动,记录其活动次数,实验过程中保持环境安静。自主活动包括:① 舔爪、清洗整理身体、擦脸均可记为清洗身体1次;② 四肢全部进入一格记为水平走格1次;③ 前肢攀附箱壁或离箱底站立记为站立1次。每只小鼠录像结束后需清理敞箱,以免对下一只小鼠造成干扰。
-
基于前期研究戊巴比妥钠剂量的预实验,选定腹腔注射戊巴比妥钠溶液的阈下剂量为35 mg/kg。在第7天给药30 min后腹腔注射戊巴比妥钠溶液(35 mg/kg),观察15 min内小鼠睡眠情况,若小鼠翻正反射消失且持续1 min以上认为进入睡眠状态,根据睡眠小鼠只数,计算入睡率。入睡率(%)=(进入睡眠动物只数/总动物只数)×100%。
-
基于前期研究戊巴比妥钠剂量的预实验,选定腹腔注射戊巴比妥钠溶液的阈上剂量为41 mg/kg。在第8天给药30 min后腹腔注射戊巴比妥钠溶液(41 mg/kg),注射后立刻计时并观察,记录小鼠入睡潜伏期和睡眠时长。评判标准:① 入睡潜伏期指的是小鼠从注射阈上剂量戊巴比妥钠至翻正反射消失的时间;② 睡眠时长指小鼠从翻正反射消失至翻正反射恢复的时间。
-
行为学实验结束后,在末次给药24 h后脱臼处死小鼠,取出小鼠大脑,用冰冷生理盐水进行冲洗,滤纸吸干后称重。随后匀浆机匀浆(4℃),以4 000 r/min,离心10 min,收集上清液。按照试剂盒说明书操作,采用ELISA法测定小鼠脑组织中GABA、5-HT、DA、NE的水平。
-
采用SPSS 19.0 软件对实验数据进行分析处理。实验数据组间比较采用单因素方差分析法,组间两两比较采用LSD-t检验;阈下剂量戊巴比妥钠实验数据采用Fisher精确检验分析。实验结果均用(
$ \bar{x} $ ± SEM)表示,当P<0.05时即认为其有统计学意义。 -
实验结果如表1所示,与空白对照组相比,艾司唑仑组(P<0.05)、YNM组(P<0.05)、YNH组(P<0.01)均显著降低了小鼠自主活动的次数。由此表明,YNM组和YNH组具有明显的镇静作用。
表 1 夜宁胶囊对小鼠自主活动的影响(
$ \bar{x} $ ±SEM,n=10)组别 剂量(mg/kg) 小鼠自主活动次数 空白对照组 − 188.90±7.78 艾司唑仑组 0.8 160.50±7.10* YNL组 400 169.60±13.15 YNM组 600 156.80±8.34* YNH组 800 151.70±7.28** 注:*P<0.05,** P<0.01,与空白对照组比较。 -
实验结果如表2所示,与空白对照组相比,艾司唑仑组(P<0.001)、YNM组(P<0.05)、YNH组(P<0.01)的小鼠入睡率显著增加,结果表明YNM组和YNH组具有明显的镇静催眠作用。
表 2 夜宁胶囊对阈下剂量戊巴比妥钠镇静催眠作用的影响(n=10)
组别 剂量(mg/kg) 入睡数量(只) 入睡比率(%) 空白对照组 − 0 0 艾司唑仑组 0.8 9 90*** YNL组 400 1 10 YNM组 600 5 50* YNH组 800 7 70** 注:*P<0.05,**P<0.01,***P<0.001,与空白对照组比较。 -
实验结果如表3所示,与空白对照组相比,艾司唑仑组(P<0.01)、YNM组(P<0.05)、YNH组(P<0.01)均显著增加了小鼠的睡眠时长;艾司唑仑组(P<0.05)、YNM组(P<0.05)、YNH组(P<0.05)显著缩短了小鼠的入睡潜伏期。结果表明YNM组和YNH组具有明显的镇静催眠作用。
表 3 夜宁胶囊协同阈上剂量戊巴比妥钠对小鼠睡眠时长和入睡潜伏期的影响(
$ \bar{x} $ ±SEM,n=10)组别 剂量(mg/kg) 睡眠潜伏期(t/min) 睡眠时长(t/min) 空白对照组 − 5.69±0.69 8.20±3.23 艾司唑仑组 0.8 3.86±0.45* 34.20±5.89** YNL组 400 4.73±0.18 17.86±3.63 YNM组 600 4.05±0.17* 22.15±4.66* YNH组 800 3.83±0.21* 28.26±4.38** 注:*P<0.05,**P<0.01,与空白对照组比较。 -
各组小鼠脑组织中各神经递质的检测结果如表4所示,与空白对照组相比:艾司唑仑组(P<0.01)和YNH组(P<0.05)小鼠脑组织中GABA含量显著增加;艾司唑仑组(P<0.05)和YNH组(P<0.05)小鼠脑组织中5-HT含量显著增加;艾司唑仑组(P<0.001)和YNH组(P<0.05)小鼠脑组织中DA含量显著增加;艾司唑仑组(P<0.01)和YNH组(P<0.01)小鼠脑组织中NE含量显著增加。结果表明,YNH组能显著性升高小鼠脑组织中的GABA、5-HT、DA和NE水平。
表 4 夜宁胶囊对小鼠脑组织中GABA、5-HT、DA和NE水平的影响(
$ \bar{x} $ ±SEM,n=10)组别 剂量(mg/kg) GABA含量(μmol/g) 5-HT含量(μg/g) DA含量(ng/g) NE含量(ng/g) 空白对照组 − 1.08±0.11 0.52±0.11 153.61±16.88 66.74±6.14 艾司唑仑组 0.8 2.33±0.28** 1.16±0.18* 327.14±22.77*** 155.14±19.12** YNL组 400 1.02±0.12 0.52±0.09 152.72±26.68 80.50±7.25 YNM组 600 1.17±0.20 0.75±0.13 168.17±14.90 91.76±12.66 YNH组 800 1.80±0.21* 1.02±0.14* 235.99±27.31* 116.31±13.02** 注:*P<0.05,**P<0.01,***P<0.001,与空白对照组比较。 -
目前临床上治疗失眠的镇静催眠药物主要是以苯二氮䓬类为主的西药,长期服用此类药物不但带来严重的不良反应,还会产生明显的耐受性、依赖性[5]。而中医药在治疗失眠方面具有疗效好、安全性高和无成瘾性等特点,相较于西药有着独特优势,是目前研究镇静催眠药物的新方向[6]。夜宁胶囊的主要成分为合欢皮、首乌藤、灵芝、大枣、浮小麦、女贞子、甘草,有安神、养心之功效,用于治疗头昏失眠、神经衰弱、血虚多梦[7]。其中合欢皮舒肝解郁、悦心安神,用于治疗烦躁不宁、失眠多梦之症;首乌藤养心安神、祛风通络,可治疗阴虚血少而致的虚烦不眠、多梦易惊等症;灵芝利益气血,安神健脾,用于治疗心悸、失眠、虚劳、头晕等症;甘草、大枣补中益气,养血安神,缓和药性;女贞子补肝肾阴;浮小麦敛汗、益气、除热。七味药相互促进、相互依赖,协同发挥了养血安神的作用[8]。
该研究通过建立小鼠开野实验、阈上、阈下戊巴比妥钠协同作用实验等用于考察镇静催眠药物的经典的药理实验模型,对夜宁胶囊的镇静催眠作用进行了研究,并进一步考察了夜宁胶囊对小鼠脑内GABA、5-HT、DA和NE等神经递质含量的影响。在研究镇静催眠药物时,开野实验、阈上、阈下戊巴比妥钠协同作用实验均为经典的、可靠的、简单易行的动物模型,而氨基酸类神经递质GABA以及单胺类神经递质5-HT、NE和DA均为公认的参与睡眠-觉醒机制的经典神经递质,当其水平提高时,睡眠质量随之提升[9-11]。研究结果显示,在开野实验中,YNM组、YNH组能显著降低小鼠自主活动的次数;在阈上戊巴比妥钠协同作用实验中,YNM组、YNH组能明显缩短小鼠的入睡潜伏期、延长小鼠的睡眠时间;在阈下戊巴比妥钠协同作用实验中,YNM组、YNH组能显著增加小鼠的入睡率,这表明夜宁胶囊具有显著的镇静催眠作用。进一步研究发现,YNH组可显著性增加小鼠脑组织中的GABA、5-HT、DA和NE含量。综上所述,夜宁胶囊具有良好的镇静催眠作用,并初步推测其镇静催眠作用机制与GABA、5-HT、DA和NE等神经递质水平改变有关。该研究为夜宁胶囊的开发利用提供了更多的科学依据,在此基础上,其具体的作用机制有待进一步探索研究。
Sedative and hypnotic effects and mechanism of Yening Capsules on mice
-
摘要:
目的 研究夜宁胶囊对小鼠的镇静催眠作用,并初步探究其作用机制。 方法 将小鼠随机分成空白对照组,艾司唑仑组(0.8 mg/kg),夜宁胶囊低、中和高剂量组(400、600和800 mg/kg),通过开野实验,协同阈上和阈下剂量戊巴比妥钠对小鼠睡眠影响的实验,观察并记录夜宁胶囊对小鼠自主活动、入睡潜伏期、睡眠时长和入睡率的影响。用酶联免疫法检测小鼠脑组织中γ-氨基丁酸(GABA)、5-羟色胺(5-HT)、多巴胺(DA)、去甲肾上腺素(NE)的水平。 结果 与空白对照组相比,夜宁胶囊中、高剂量组(P<0.05、P<0.01)能显著降低小鼠自主活动次数;夜宁胶囊中、高剂量组能显著缩短小鼠入睡潜伏期(P<0.05、P<0.05),并延长睡眠时间(P<0.05、P<0.01);夜宁胶囊中、高剂量组(P<0.05、P<0.01)能显著增加小鼠的入睡率。与空白对照组相比,高剂量的夜宁胶囊可明显增加小鼠脑组织中GABA(P<0.05)、5-HT(P<0.05)、DA(P<0.05)、NE(P<0.01)含量。 结论 夜宁胶囊具有良好的镇静催眠作用,其作用机制与提高脑内GABA、5-HT、DA和NE水平有关。 Abstract:Objective To study the sedative and hypnotic effects of Yening Capsules and investigate its bioactive mechanism in mice. Methods The mice were randomly divided into control group, estazolam group (0.8 mg/kg), low, medium and high-dose Yening Capsules groups (400, 600 and 800 mg/kg). The locomotor activity, latency to persistent sleep, sleep duration and sleep rate were determined respectively in mice via the open field test and injection of pentobarbital sodium in subthreshold and suprathreshold doses. The content of GABA, 5-HT, DA and NE in brain tissue of mice were detected by enzyme-linked immunosorbent assay(ELISA). Results Compared with the control group, Yening Capsules medium and high dose group (P<0.05, P<0.01)significantly decreased the locomotor activity of mice.The sleep latency in Yening Capsules medium and high dose group were significantly shorten (P<0.05, P<0.05)and the sleep duration (P<0.05, P<0.01)were extended. The sleep rate of Yening Capsules medium and high dose groups (P<0.05, P<0.01) was significantly increased. Compared with the control group, high dose of Yening Capsules can significantly increase GABA (P<0.05), 5-HT (P<0.05), DA (P<0.05), NE (P<0.01) in mouse brain tissue. Conclusion Yening Capsules had obvious sedative and hypnotic effects, and its mechanism may be related to the increasement of GABA, 5-HT, DA and NE level in brain tissue of mice. -
Key words:
- Yening Capsules /
- sedative hypnosis /
- insomnia /
- pentobarbital sodium /
- neurotransmitter
-
嘧啶类化疗药物在肿瘤治疗中的地位越来越重要,其代表药物5-氟尿嘧啶及其口服前药卡培他滨更受到了广泛关注,体内二氢尿嘧啶脱氢酶(DPD)是此类药物代谢的限速酶之一[1],前瞻性评价DPD的总体活性有利于提高药物疗效及减少患者的毒副反应,对临床具有重要意义。内源性物质尿嘧啶(U)是体内DPD的天然底物,在此酶的催化下生成二氢尿嘧啶(UH2),并最终通过尿液排出体外。测定血浆中U和UH2的含量,并通过(UH2)/(U)比值计算,可从代谢物的角度评价DPD的活性[2]。临床上常用评价DPD酶活性的方法是测定患者的基因表型,DPD的编码基因DPYD序列中包含了多达7 600个多态位点,使得DPD酶的活性在人群中是高度可变的[3]。不同的突变位点及不同位点的组合给临床检测带来了极大的困难。到目前为止,也只有DPYD*2A的多态性被用于临床实践,用来筛选出5-氟尿嘧啶代谢严重不良的患者,避免严重的毒副反应[4]。单一应用基因的多态性来评价DPD酶的活性在临床上存在一定的困难,基因的多态性并不能直接同下游的酶的活性联系起来,两者并没有完全对等的关系。基因需通过转录、翻译和蛋白的修饰之后才能发挥作用。基因多态联合下游代谢物的含量测定更能准确的评价DPD酶的活性[5]。目前常应用液相色谱-串联质谱联用法对人血浆或干燥唾液中U和UH2浓度进行检测[6-11],但所报道的方法均有一些复杂或难以重现。本研究成功的建立了一种灵敏、高效、准确、重现性好,且能同时测定人血浆中U和UH2浓度的UHPLC-MS/MS方法,为体内DPD总体活性提供更客观有效的评价途径。
1. 材料与方法
1.1 仪器与耗材
1290-6460A超高效液相色谱-串联质谱仪,包含G4220A二元泵、G4226A自动进样器、G1316C柱温箱、MassHunter数据处理工作站(美国Agilent);调速涡旋混合器(美国Labnet);SK7200H超声仪(上海科导超声仪器有限公司);BSA124S-CW分析天平(德国赛多利斯);5810R型低温高速离心机、移液器(德国Eppendorf公司)。
1.2 药品与试剂
尿嘧啶、二氢尿嘧啶和氯尿嘧啶(内标)对照品(纯度>99%,大连美仑生物有限公司);乙酸铵(美国赛默飞世尔科技);甲醇、乙腈、乙酸乙酯、异丙醇(色谱纯,德国默克公司);屈臣氏蒸馏水(广州屈臣氏食品饮料有限公司);牛血清白蛋白(BSA)(上海博光生物科技有限公司);生理盐水(长征医院药学部自制)。
1.3 色谱分离条件
色谱柱为Agilent poroshell 120 SB-Aq-柱(2.1 mm×100 mm,2.7 μm),流动相为5 mmol/L乙酸铵水溶液(A)和乙腈(B),流速为0.3 ml/min,梯度洗脱:0~0.3 min,100% A;0.3~1.0 min,100%~10% A;1.0~2.5 min,10% A;柱温为30 ℃,洗脱时间2.5 min,进样量5 μl。
1.4 质谱分离条件
采用ESI离子源,多重反应监测(MRM)进行一/二级质谱分析,用于定量分析的检测离子为:U[M+H]+ m/z 113.0→40.1,检测模式为正离子模式;UH2[M+H]+ m/z 115.0→55.1,检测模式为正离子模式;氯尿嘧啶(IS)[M-H]- m/z 145.0→42.1,检测模式为负离子模式。雾化温度为300 ℃,雾化气压力为40 psi,干燥气流速为10 L/min,鞘气温度300 ℃,鞘气流速12 L/min,解离电压为4 000 V。
1.5 样本采集
选取8名血浆样品指标正常的成年人,于当日清晨8时空腹状态下静脉采血3 ml, EDTA-3K管抗凝,离心后分离上层血浆, 于−80 ℃冰箱冻存。
1.6 样本预处理
取100 μl样本,加10 μg/ml氯尿嘧啶(IS)10 μl,加乙酸乙酯3 ml,涡旋5 min,1710×g离心10 min,取上层有机相2.7 ml,45 ℃氮气挥干仪挥干,用10%甲醇溶液100 μl复溶,涡旋1 min,取上清液进样分析。
1.7 标准溶液配制
用含有3 %牛血清白蛋白作为空白基质代替血浆配置标准曲线样品。取100 μg/ml的尿嘧啶和二氢尿嘧啶各100 μl,加800 μl水,制成10 μg/ml标准混合液,置于−20 ℃备用。取10 μg/ml标准混合液适量,用3 %牛血清白蛋白稀释制成10、20、50、100、200、500、1000、1500 ng/ml系列浓度样品, 然后按照上述“1.6”项下样品的处理方法配制。
2. 结果
2.1 专属性考察
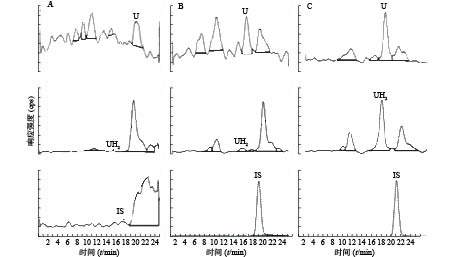
U和UH2的出峰时间以及峰型良好,代替血浆经过前处理后,对待测组分的测定没有干扰,内标对分析物的测定也没有干扰,且能很好分离,结果见图1。
2.2 标准曲线和线性范围
U和UH2的线性范围是10.0~1 500.0 ng/ml,以空白BAS中U和UH2的浓度为横坐标(X),U和UH2与内标化合物氯尿嘧啶的峰面积比为纵坐标(Y),进行最小二乘法加权(权重系数为1/χ2),U和UH2的线性回归方程分别是Y=0.27X+0.0022、Y=0.58X+0.0380,r均>0.990,表明线性关系良好。
2.3 精密度和准确度
取定量下限、低、中、高标准添加血浆样本按照前处理方法进行处理,每个浓度样品平行制备5份进行分析,连续3 d重复操作,根据当天的标准曲线计算当天实测样本浓度,计算样本在低、中和高浓度下的日内、日间精密度和准确度,结果显示,精密度和准确度的偏差均在15%左右。准确度相对偏差在20%范围内时,最低定量下限精密度偏差不大于20%,结果见表1。
表 1 尿嘧啶和二氢尿嘧啶的精密度 (n=5)分析物 标示浓度 (ng/ml) 日内 日间 测定浓度 (ng/ml) 精密度(CV%) 准确性(RE%) 测定浓度 (ng/ml) 精密度(CV%) 准确性(RE%) 尿嘧啶 10 10.2±0.38 3.74 2.58 10.12±0.78 7.70 1.18 20 20.63±1.21 5.87 3.15 19.97±1.35 6.74 −0.16 500 529.73±4.64 0.88 5.95 484.32±35.72 7.37 −3.12 1000 1093.33±25.10 2.30 9.33 1098.25±25.16 2.29 9.82 二氢尿嘧啶 10 10.32±0.71 6.86 3.18 10.28±0.65 6.37 2.77 20 19.98±2.19 10.95 −0.12 19.86±1.85 9.31 −0.72 500 517.51±10.69 2.07 3.50 515.66±10.36 2.01 3.13 1000 1079.83±17.91 1.66 7.98 1080.11±24.50 2.27 8.01 2.4 基质效应和提取回收率
取低、高2个浓度的样本进行基质效应和提取回收率考察,结果显示,U、UH2及内标氯尿嘧啶的基质效应和提取回收率良好,结果均较稳定,结果见表2。
表 2 尿嘧啶和二氢尿嘧啶的基质效应和提取回收率分析物 标识浓度(ng/ml) 基质效应 提取回收率 平均基质效应 CV(%) 平均回收率 CV(%) 尿嘧啶 1000 101.00 6.15 94.98 9.01 20 99.99 3.63 100.01 7.64 二氢尿嘧啶 1000 85.72 2.07 106.47 1.58 20 93.58 4.53 99.54 9.77 2.5 样品稳定性
考察低、高2个浓度的血浆样品经历3次冷冻与解冻循环的稳定性、血浆样品在室温(25 ºC)放置6 h后经样品处理后稳定性和血浆样品经样品处理后室温放置24 h的稳定性,结果显示,3次冻融、6 h室温(25 ºC)条件下和24 h放置自动进样器中的稳定性均符合要求,结果见表3。
表 3 样品的稳定性(RE%)分析物 冻融3次 室温放置6 h 置自动进样器24 h 低 高 低 高 低 高 尿嘧啶 100.71 98.34 93.49 106.60 108.20 107.99 二氢尿嘧啶 92.67 92.64 93.61 107.26 106.97 107.15 2.6 样本检测
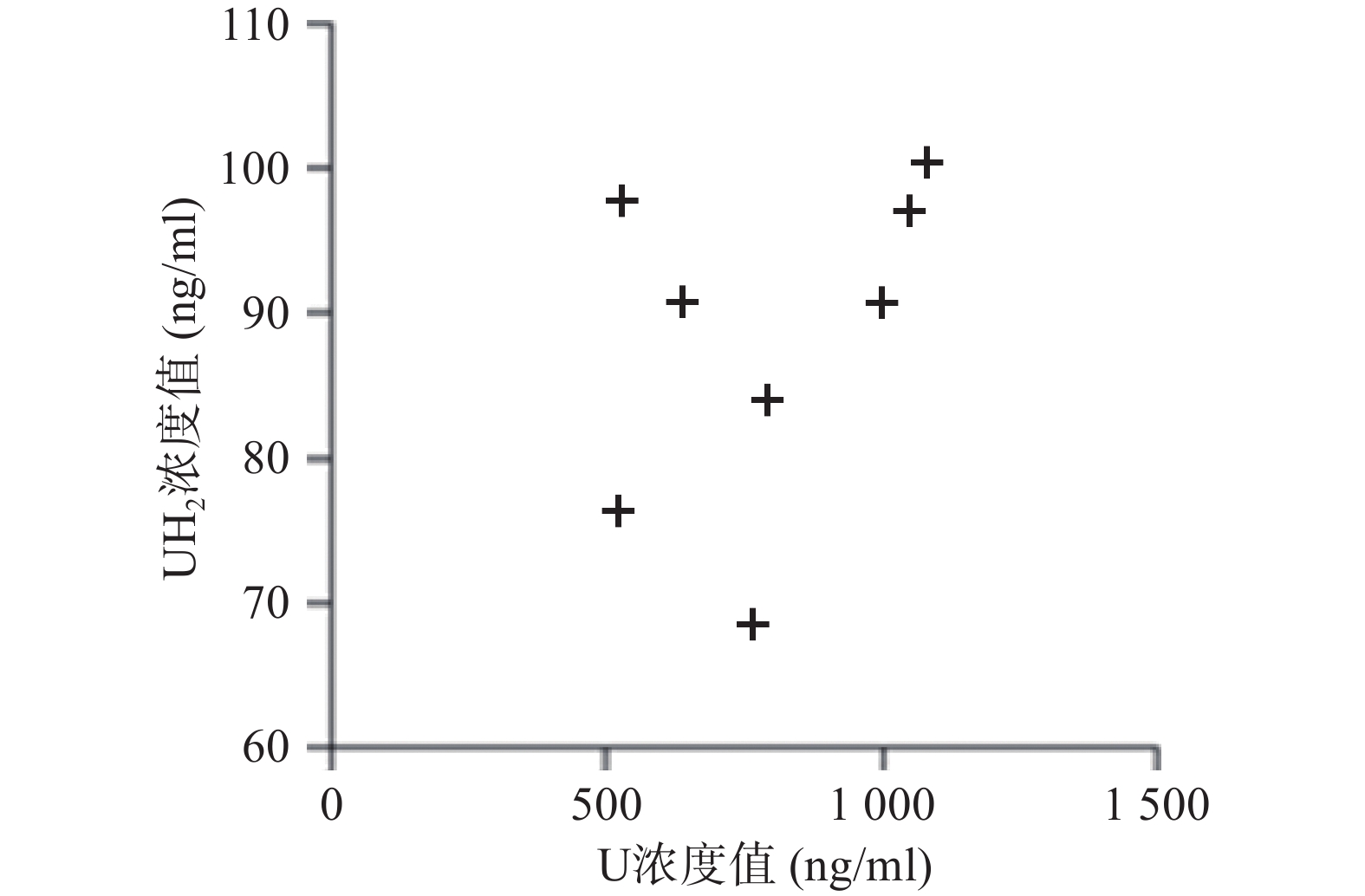
应用本研究所建立的方法,对8名健康成人的血浆样本测定分析,在样本实测过程中, 同时插入已知浓度的随行质控样本(QC样本), 随时监控样本测定的准确度。U和 UH2 浓度测定结果见图2。
3. 讨论
3.1 空白基质的选择
U和UH2是人体内常见的两种物质,且同核酸的代谢密切相关,由于U和UH2均为人体内源性物质,故不能采用人源的基质进行方法学的开发及验证,通过查阅资料,选择了不含U和UH2的3%牛血清蛋白作为基质进行方法学的开发[12]。也有文献报道采用去除U和UH2的人源血浆基质进行方法学实验[9],但基质的来源较珍贵,不适合方法的普及,所以选用3%牛血清蛋白作为替代基质。
3.2 色谱柱的选择
U因其特殊的化学性质,在大部分的色谱柱上均没有保留。U和UH2的LogP值分别为−0.707和−0.840,有较强的亲水性,决定了其不保留的性质。在定量方法的开发过程中,先后采用了Agilent Zorbax SB-C18色谱柱,Agilent Zorbax Eclipse-C18色谱柱,Waters Atlantis T3色谱柱,Waters Xselect色谱柱,Waters Xbridge等色谱柱来进行条件摸索,但上述色谱柱对U和UH2均没有保留。最后,采用Agilent Zorbax SB-Aq对U和UH2进行定量分析,该色谱柱对强极性的化合物有较好的保留效果,同时,兼容100%的起始流动相也对保留产生了良好的结果。
3.3 样本预处理的优化
本研究还分别考察了几种常见的处理方法,包括甲醇和乙腈的蛋白沉淀、Waters Oasis HLB萃取板的固相萃取以及乙酸乙酯,甲基叔丁基醚,二氯甲烷/三氯甲烷,环己烷进行的液液萃取,结果发现乙酸乙酯对U和UH2的萃取效果较好,同时,还分别考察了5%、10%、20%、30%、40%、50%的异丙醇、乙酸乙酯溶液对U和UH2的萃取效果,结果发现,单纯的乙酸乙酯对待测化合物具有较好的提取效率。提取回收率均高于90%,且RSD<10%。另外对3%牛血清蛋白的基质效应进行了考察,结果发现平均基质效应在85%~101%之间,RSD<7%,说明该前处理方法对于基质的清除较为彻底,测定结果稳定,没有明显的基质干扰。
本研究虽重在方法开发,收集的样本数量较少,但从测定的U和UH2浓度分布来看DPD对内源性U的代谢存在个体差异,建议临床应用5-氟尿嘧啶及其卡培他滨筛查DPD总体活性[12-13],后续可进一步扩大样本数量进行深入研究。
4. 结论
本实验建立了一种快速,稳定,高灵敏度的UHPLC-MS/MS方法,可用于测定人体内源性物质U和UH2的含量,从代谢物的角度评价DPD酶的活性,从而协助临床医生制定化疗药物5-氟尿嘧啶及其口服前药卡培他滨合理的用量,以较低的毒副反应获得最大的临床疗效。
-
表 1 夜宁胶囊对小鼠自主活动的影响(
$ \bar{x} $ ±SEM,n=10)组别 剂量(mg/kg) 小鼠自主活动次数 空白对照组 − 188.90±7.78 艾司唑仑组 0.8 160.50±7.10* YNL组 400 169.60±13.15 YNM组 600 156.80±8.34* YNH组 800 151.70±7.28** 注:*P<0.05,** P<0.01,与空白对照组比较。 表 2 夜宁胶囊对阈下剂量戊巴比妥钠镇静催眠作用的影响(n=10)
组别 剂量(mg/kg) 入睡数量(只) 入睡比率(%) 空白对照组 − 0 0 艾司唑仑组 0.8 9 90*** YNL组 400 1 10 YNM组 600 5 50* YNH组 800 7 70** 注:*P<0.05,**P<0.01,***P<0.001,与空白对照组比较。 表 3 夜宁胶囊协同阈上剂量戊巴比妥钠对小鼠睡眠时长和入睡潜伏期的影响(
$ \bar{x} $ ±SEM,n=10)组别 剂量(mg/kg) 睡眠潜伏期(t/min) 睡眠时长(t/min) 空白对照组 − 5.69±0.69 8.20±3.23 艾司唑仑组 0.8 3.86±0.45* 34.20±5.89** YNL组 400 4.73±0.18 17.86±3.63 YNM组 600 4.05±0.17* 22.15±4.66* YNH组 800 3.83±0.21* 28.26±4.38** 注:*P<0.05,**P<0.01,与空白对照组比较。 表 4 夜宁胶囊对小鼠脑组织中GABA、5-HT、DA和NE水平的影响(
$ \bar{x} $ ±SEM,n=10)组别 剂量(mg/kg) GABA含量(μmol/g) 5-HT含量(μg/g) DA含量(ng/g) NE含量(ng/g) 空白对照组 − 1.08±0.11 0.52±0.11 153.61±16.88 66.74±6.14 艾司唑仑组 0.8 2.33±0.28** 1.16±0.18* 327.14±22.77*** 155.14±19.12** YNL组 400 1.02±0.12 0.52±0.09 152.72±26.68 80.50±7.25 YNM组 600 1.17±0.20 0.75±0.13 168.17±14.90 91.76±12.66 YNH组 800 1.80±0.21* 1.02±0.14* 235.99±27.31* 116.31±13.02** 注:*P<0.05,**P<0.01,***P<0.001,与空白对照组比较。 -
[1] 陈贵海. 失眠的研究进展[J]. 中国临床医生杂志, 2017, 45(8):1-6,125. doi: 10.3969/j.issn.2095-8552.2017.08.001 [2] 叶增杰, 梁木子, 胡蕖, 等. 失眠障碍的国内外研究进展[J]. 医学与哲学(B), 2017, 38(5):60-63. [3] 国家药典委员会. 中华人民共和国药典(一部)2020年版[S]. 北京: 中国医药科技出版社, 2020: 1193. [4] 魏伟, 吴希美, 李元建. 药理实验方法学[M]. 4版. 北京: 人民卫生出版社, 2010: 639-640. [5] 朱尧, 夏伟, 刘溦溦, 等. 中医论治失眠研究进展[J]. 吉林中医药, 2016, 36(3):320-324. [6] 李丽娜. 近10年中医药治疗失眠症的研究进展[J]. 中医药信息, 2018, 35(3):119-123. [7] 陈云, 时维武, 齐建新. 夜宁胶囊治疗失眠的临床观察[J]. 中草药, 2017, 48(22):4731-4733. doi: 10.7501/j.issn.0253-2670.2017.22.022 [8] 王争平, 丁青龙, 李莹. 夜宁胶囊治疗神经衰弱及神经衰弱症候群的临床研究[J]. 中国现代药物应用, 2010, 4(6):106-107. doi: 10.3969/j.issn.1673-9523.2010.06.094 [9] 胡文卓, 贾力莉, 马澜, 等. 佛手柑内酯对PCPA失眠大鼠神经递质及学习记忆的影响[J]. 时珍国医国药, 2020, 31(4):821-823. doi: 10.3969/j.issn.1008-0805.2020.04.014 [10] 胡晓炜, 罗广彬, 范琼尹, 等. 柴牡安神颗粒抗焦虑作用及其活性机制[J]. 中国实验方剂学杂志, 2019, 25(13):41-48. [11] 向熙, 周龙甫, 马超英, 等. 水芹不同提取物的镇静催眠作用[J]. 中医学报, 2019, 34(6):1244-1247. -





 下载:
下载:

 下载:
下载: 




