-
氟马西尼(flumazenil)是苯二氮䓬类受体拮抗剂,临床上常用来逆转由苯二氮䓬类药物麻醉或过量使用后所致的中枢镇静作用[1-4],在军事应用方面,可用来拮抗镇静药物带来的“宿醉”等副作用,提高作业效能。目前,氟马西尼市售剂型为注射剂,为解决注射给药不便、疼痛不适的问题,提高使用者顺应性,开发一种便捷安全的制剂显得尤为重要。回顾既往研究,氟马西尼已被证明经鼻腔[5, 6]、舌下[7, 8]、口服[9]及直肠[10]等给药途径均有治疗效果。本研究开发氟马西尼舌下片,实现军事条件下作业人员高效、安全促醒。
氟马西尼因难溶于水,直接制备成舌下片会影响其被舌下黏膜吸收及药效发挥。本研究以羟丙基-β-环糊精为包合材料,将氟马西尼制备成包合物后再制备舌下片,以此改善氟马西尼的溶解度及溶出度。此外,还研究了氟马西尼舌下片在比格犬体内的药动学过程,并进行生物利用度评价,以期为进一步临床研发及应用提供依据。
-
药物透皮扩散试验仪(TPY-2,上海黄海药检仪器有限公司);质谱仪(QTRAP® 5500,日本岛津公司);TDP 单冲压片机(ZPS016,上海天祥·健台制药机械有限公司);双向磁力搅拌器(上海司乐仪器有限公司);旋转蒸发仪(R206D,上海申生科技有限公司);真空干燥箱(VD53,德国Binder公司);高效液相色谱仪(UltiMate 3000,美国Thermo公司);色谱柱(SB-C18,美国Agilent公司);色谱柱(XSelect®HSS T3,美国Waters公司)。
-
氟马西尼注射液(5 ml:0.5 mg,宜昌人福药业);氟马西尼原料药(99%,江苏恩华药业股份有限公司);内标物甲苯磺丁脲(纯度99%,美国Sigma公司);羟丙基-β-环糊精(法国Roquette公司);PVP K30(重庆斯泰克瑞登梅尔公司);乳糖(荷兰DFE公司);甘露醇(法国Roquette公司);硬脂富马酸钠(德国JRS公司);乙腈、乙酸铵均为质谱纯;实验用水为去离子水。
-
比格犬12只,雄性,体重7~9 kg,由北京玛斯生物技术有限公司提供,动物许可证号:SCXK(京)2016-0001。
-
以摩尔比2∶1称取适量羟丙基-β-环糊精与氟马西尼,加入90%乙醇溶液,超声使其溶解。将混合溶液置于45 ℃连续搅拌2 h。取混合溶液进行旋蒸,在40 ℃进行干燥,得到白色固体状包合物。
-
(1)色谱条件。色谱柱:Agilent ZORBAX SB-C18(4.6 mm×150 mm,5 μm);流动相:水(用磷酸调节pH值至2.0)-甲醇-四氢呋喃(80∶13∶7);流速:1.0 ml/min;柱温:40 ℃;检测波长:230 nm;进样量:20 μl。
(2)溶液配制。空白溶液:精密称取羟丙基-β-环糊精适量于容量瓶中,加入适量流动相,振摇使其溶解,用流动相稀释至刻度,摇匀,即得空白溶液。
对照品溶液:精密称取氟马西尼10 mg,置于100 ml容量瓶中,加入适量甲醇超声溶解后定容,制得质量浓度为0.1 mg/ml的氟马西尼溶液。
供试品溶液:精密称取F-羟丙基-β-环糊精适量于容量瓶中,加入适量流动相,振摇使其溶解,用流动相稀释至刻度,摇匀,即得供试品溶液。
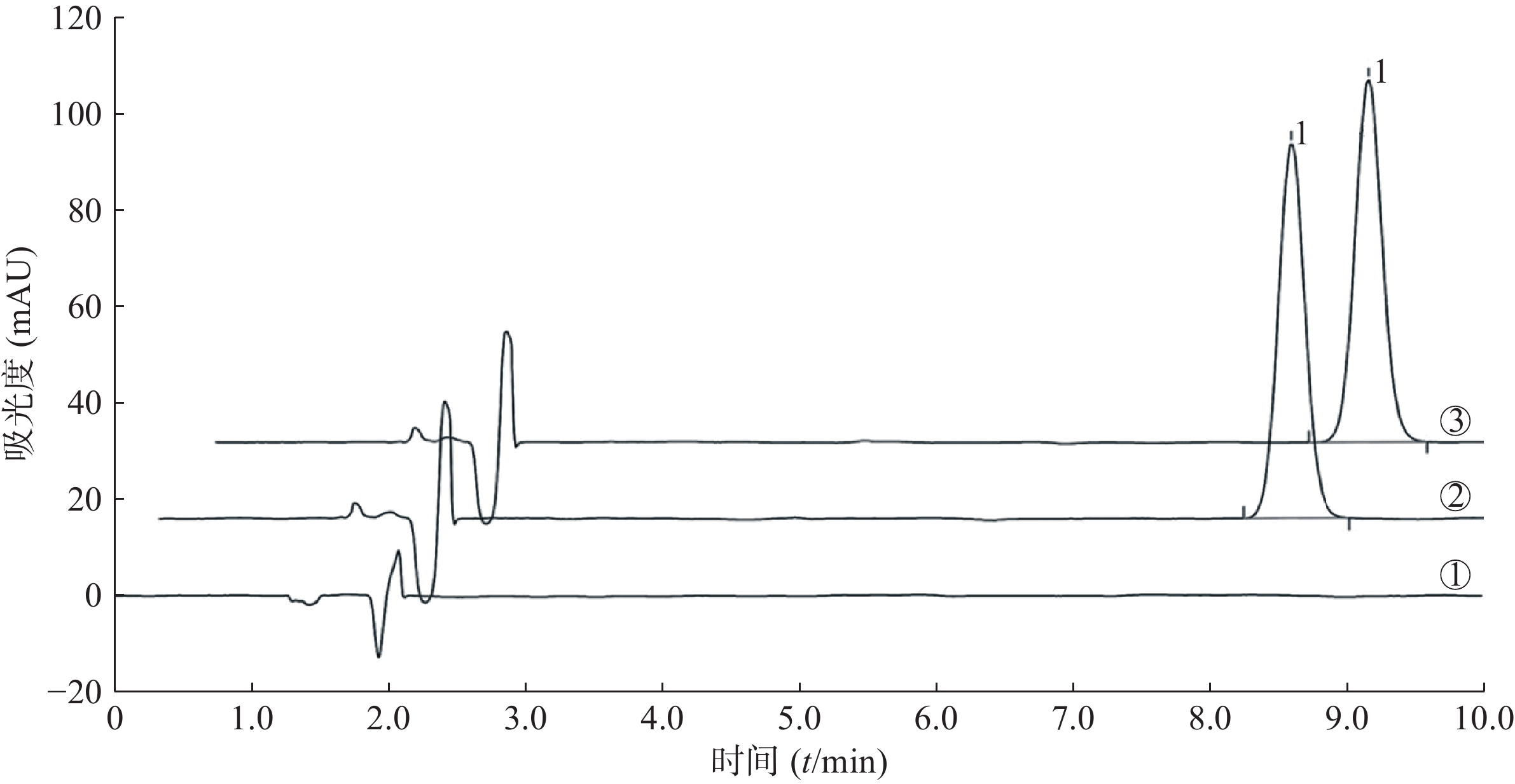
(3)专属性。分别取制备的空白溶液、对照品溶液、供试品溶液各20 μl,参照“色谱条件”项下进样,进行样品专属性考察(图1)。A为羟丙基-β-环糊精的HPLC图谱,无特征吸收峰;B为氟马西尼的HPLC图谱,有吸收峰,出峰时间为8.240 min,C为F-羟丙基-β-环糊精的HPLC图谱,有吸收峰,出峰时间为8.247 min。表明该方法测定F-羟丙基-β-环糊精的专属性良好。
(4)线性。分别精密吸取“溶液配制”项下对照品溶液适量,放置于容量瓶中,加流动相稀释定容,配制6.25、12.5、25、50、75、100 μg/ml的氟马西尼系列标准品溶液,进样分析。以峰面积(A)为纵坐标,氟马西尼浓度(C/μg·ml−1)为横坐标,进行线性回归,得回归方程为A=0.738 0C−0.171 9,r=0.999 9。结果表明,氟马西尼浓度在 6.25~100 µg/ml浓度范围内与峰面积线性关系良好,定量下限为6.25 µg/ml。
(5)精密度及准确度考察。分别取“线性”项下低(6.25 μg/ml)、中(25 μg/ml)、高(100 μg/ml)3个浓度的氟马西尼溶液各6份,进样分析,连续测定3 d,考察日内、日间精密度(以RSD表示)。根据随行回归方程计算各样品中氟马西尼的实测质量浓度,以实测质量浓度与理论质量浓度相比较,考察准确度(表1)。结果表明,该方法精密度、准确度良好,符合生物样本分析要求。
表 1 氟马西尼日内、日间精密度与准确度(
$ \bar{x} $ ±s,n=6)样品浓度 (ρB/µg·ml−1) 日内 日间 实测浓度 (ρB/µg·ml−1) 准确度(%) 精密度RSD(%) 实测浓度 (ρB/µg·ml−1) 准确度(%) 精密度RSD(%) 6.25 6.27±0.12 100.32 1.91 6.32±0.05 101.12 0.84 25 25.19±0.46 100.76 1.85 25.26±0.34 101.04 1.36 100 99.85±0.39 99.85 0.39 99.74±1.28 99.74 1.28 -
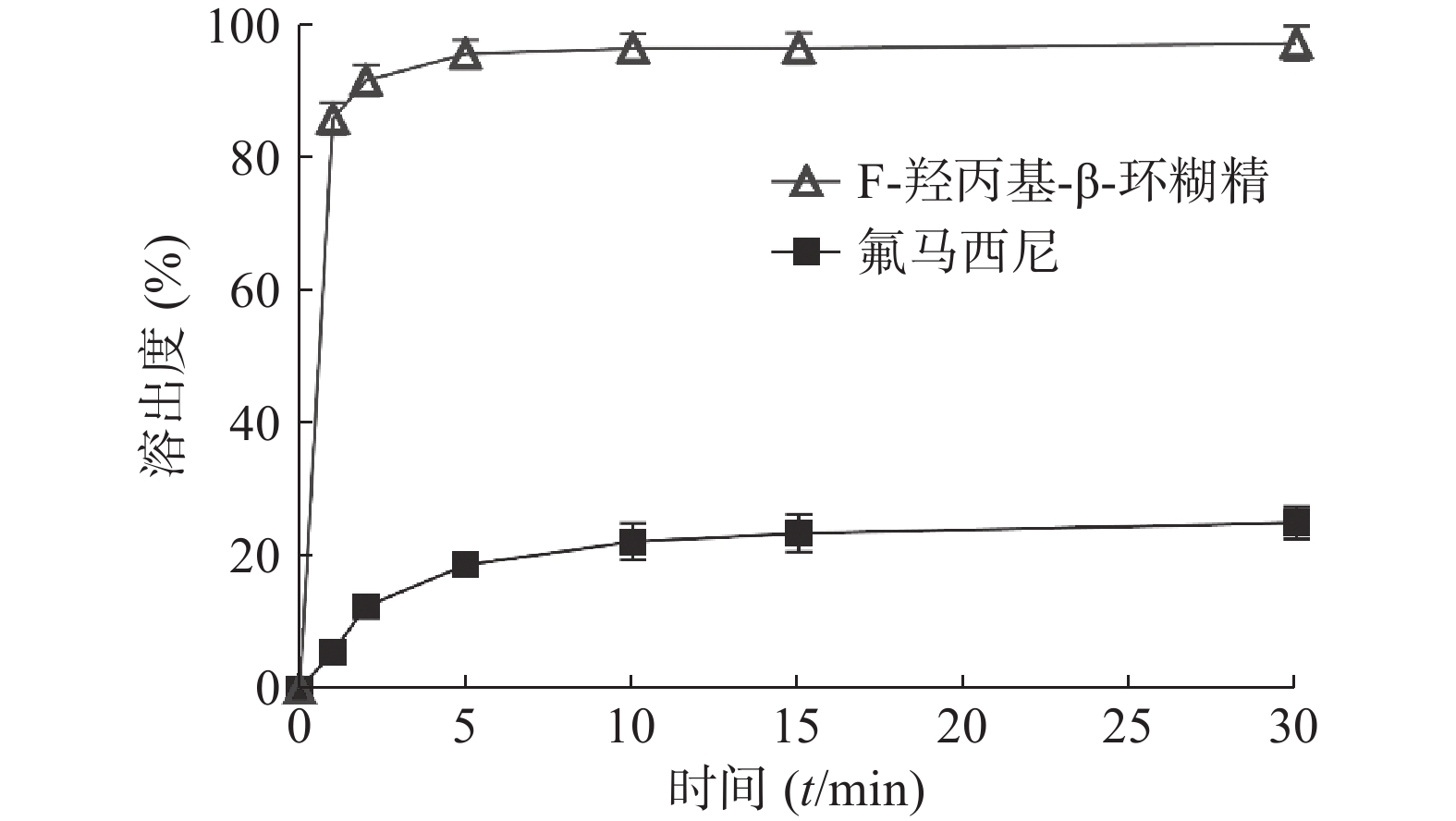
取氟马西尼和F-HP-β-CD(相当于氟马西尼10 mg),按照溶出度测定法(2020年版《中国药典》四部通则0931溶出度测定法第二法浆法),选用100 ml去离子水为溶出介质,温度设定为(37±0.5)℃,转速为100 r/min,于1、2、5、10、15、30 min时取样过滤,并补充相同体积、相同温度的空白溶出介质。取续滤液稀释后, 参照“ 色谱条件”项下,利用HPLC法进行浓度测定,计算各时间点溶出度,并与原料药进行比较。
如图2所示,5 min时 F-羟丙基-β-环糊精的溶出度大于95%,而氟马西尼30 min溶出度约30%。表明氟马西尼与羟丙基-β-环糊精包合能提高药物的溶出度,进而提高生物利用率,为后续氟马西尼舌下片制备提供了基础。
-
称取处方量F-HP-β-CD、乳糖、甘露醇、硬脂富马酸钠,过100目筛备用。将辅料(除硬脂富马酸钠外)与F-HP-β-CD等量递增混匀。加入适量10% PVP K30 的 90% 乙醇溶液制成软材,过16目筛制粒,40℃烘干2 h。加硬脂富马酸钠,混匀,单冲压片机制成片剂。每片含氟马西尼0.2 mg。
-
取氟马西尼舌下片3批次(批号:20220615-1、20220615-2、20220615-3),按照溶出度测定法,选用50 ml去离子水为溶出介质,温度设定在(37±0.5) ℃,转速为100 r/min,于5、15、30、60 min取样过滤。其余同“2.1.3” 项操作。如表2所示,氟马西尼舌下片15 min内可完全溶出。
表 2 氟马西尼舌下片的溶出度检查结果(
$ \bar{x} $ ±s,n=6)批号 溶出度(%) 5 min 15 min 30 min 60 min 20220615-1 60.14±0.98 95.89±0.62 98.29±1.36 98.86±0.43 20220615-2 63.23±1.91 96.18±2.50 98.76±1.32 98.31±1.52 20220615-3 66.74±1.92 97.56±1.07 97.45±1.26 97.89±1.39 -
(1)色谱柱。XSelect HS T3(2.1 mm×50 mm,2.5 μm);柱温:15 ℃;流动相: A相为水(含1 mmol/L乙酸铵),B 相为乙腈;梯度洗脱:0.01~1.30 min, 30%B;1.30~1.80 min, 30%~95%B;1.80~1.81 min,95%B;1.81~2.20 min,30%B;流速:0.6 ml/min;进样量:8 μl。
(2)质谱条件。正离子电喷雾离子化(ESI)方式,多反应监测(MRM);喷雾电压:5.5 kV;源温度:500℃;雾化气为60 psi;辅助加热气为60 psi;气帘气为40 psi;离子对、去簇电压、碰撞室出口电压及碰撞能量等参数见表3。
表 3 质谱条件
检测物 母离子 子离子 去簇电压
(U/V)碰撞室出口
电压(U/V)碰撞能量
(U/V)氟马西尼 304.2 257.9 140 15 25 甲苯磺丁脲 271.0 74.2 70 15 22 -
取100 μl血浆样品到EP管中,加入600 μl内标液(200 ng/ml甲苯磺丁脲的乙腈溶液)。涡旋混匀1 min,13 000 r/min、4 ℃条件下离心10 min。取上清液适当稀释后放置于进样瓶中, 8 μl进样检测。
-
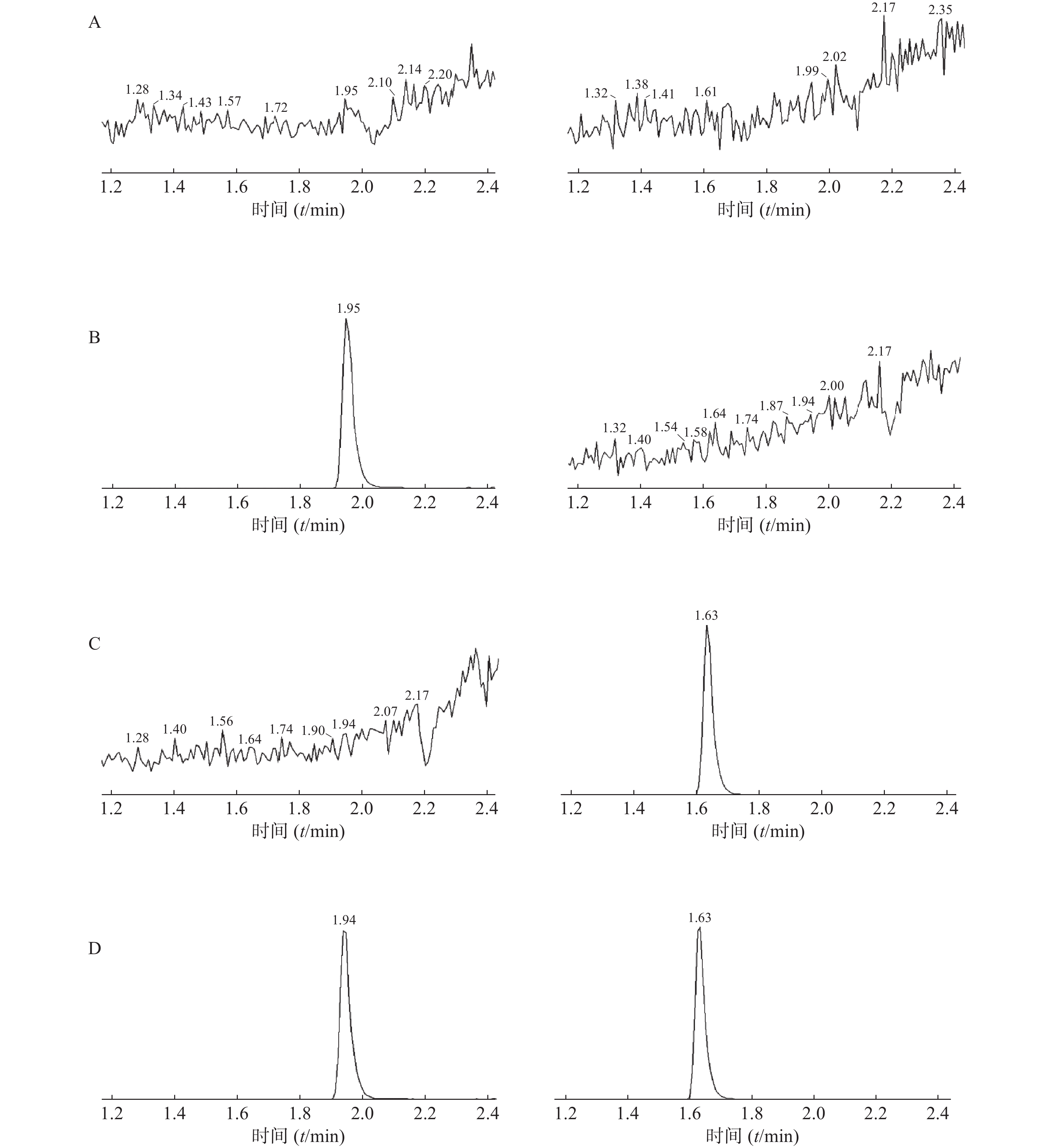
在上述提取条件及色谱、质谱条件下,测定空白血浆、含内标溶液的血浆样品、含氟马西尼的血浆样品以及给药后比格犬血浆样品,记录色谱图见图3。结果表明,氟马西尼和内标甲苯磺丁脲保留时间分别为1.63 min和1.94 min,血浆中的内源性物质不干扰测定。
-
比格犬空白血浆中精密加入不同浓度的氟马西尼对照品溶液5 μl,配制浓度分别为0.2、0.5、1、2、10、50、100、200 ng/ml的系列对照品血浆样品,按照“ 2.2.2” 项下方法操作,记录峰面积。以氟马西尼浓度C为横坐标,氟马西尼与内标物的峰面积比值(AF/ATOL)为纵坐标进行线性回归,得回归方程为AF/ATOL=0.008 3C+0.000 9,r=0.998 1。氟马西尼在 0.2~200 ng/ml浓度范围线性关系良好。本法测定血浆中氟马西尼的最低定量限为0.2 ng/ml。
-
用空白比格犬血浆配制低(0.6 ng/ml)、中(6 ng/ml)、高(160 ng/ml)3个浓度的对照品血浆样品各6份,按照“2.2.2”项下方法操作,连续测定3 d,随行标曲计算其浓度,算得血浆样品测定方法的精密度和准确度,结果如表4所示。数据表明该方法精密度、准确度良好,符合生物样本分析要求。
表 4 氟马西尼日内、日间精密度与准确度(
$ \bar{x} $ ±s,n=6)样品浓度
(ρB/ng·ml−1)日内 日间 实测浓度
(ρB/ng·ml−1)准确度
(%)精密度
RSD(%)实测浓度
(ρB/ng·ml−1)准确度
(%)精密度
RSD(%)0.6 0.60±0.02 95.35 3.09 0.59±0.03 96.70 9.99 6 6.10±0.23 101.72 3.85 6.25±0.28 104.20 4.42 160 167.76±4.31 104.85 2.57 167.76±5.66 104.85 3.38 -
取空白血浆平行配制氟马西尼、内标物甲苯磺丁脲低(0.6 ng/ml)、中(6 ng/ml)、高(160 ng/ml)浓度样品各6份,按照“ 2.2.2”项下方法预处理并进样分析,记录峰面积A1;取空白血浆按“2.2.2”项下方法预处理后,加入低、中、高浓度氟马西尼及内标物甲苯磺丁脲后进样分析,记录峰面积A2;用甲醇配制含氟马西尼及内标物甲苯磺丁脲低、中、高浓度溶液,进样分析,记录峰面积A3。A1与A2比值为提取回收率; A2与A3比值为基质效应(表5)。实验结果表明,低、中、高浓度氟马西尼提取回收率为86.12 %~87.43 %,基质效应为105.87 %~106.28 %。提取回收率和基质效应均在80 %~120 %,RSD均<15%,符合生物样本分析要求。
表 5 提取回收率及基质效应(
$ \bar{x} $ ±s,n=6)氟马西尼样品浓度
(ρB/ng·ml−1)提取回收率
(%)RSD
(%)基质效应
(%)RSD
(%)0.6 87.43±2.49 2.55 105.87±5.61 5.30 6 86.35±2.67 2.77 105.99±6.61 6.03 160 86.12±3.70 3.85 106.28±3.97 3.73 -
取空白血浆加入氟马西尼标准品溶液,配制成低(0.6 ng/ml)、中(6 ng/ml)、高(160 ng/ml)浓度的血浆样品,每个浓度平行6份,按“2.2.2”项下操作,分别考察其室温放置4 h、反复冻融3次以及−20 ℃放置30 d的稳定性,结果见表6。表明在上述条件下样品均稳定。
表 6 氟马西尼室温放置4 h、冻融及长期冻存稳定性(
$ \bar{x} $ ±s,n=6)放置条件 样品浓度(ρB/ng·ml−1) 回收率(%) RSD(%) 室温4 h 0.6 98.33±1.02 3.51 6 99.67±1.63 3.71 160 106.25±5.26 3.09 反复冻融3次 0.6 95.52±1.03 1.08 6 99.36±2.25 3.52 160 102.71±3.82 2.32 −20 ℃放置30 d 0.6 97.72±1.32 2.73 6 101.37±1.25 3.44 160 105.48±3.69 3.87 -
采用双周期双交叉实验设计方案。将12只比格犬随机分为2组,分别给予氟马西尼舌下片(0.2 mg)和注射剂(0.1 mg),清洗期为1周。给药前禁食12 h,自由饮水。于给药后10 min、20 min、30 min、45 min、1.0 h、1.25 h、1.5 h、1.75 h、2.0 h 、2.5 h、3.0 h、4.0 h、6.0 h、8.0 h由腿静脉取血2 ml,置于肝素钠采血管中,12 000 r/min离心10 min ,取上层血浆按“2.2.2”项下方法处理后测定。
-
比格犬给予氟马西尼舌下片与氟马西尼注射液后,血药浓度-时间曲线如图4。用WinNonlin 7.0药动学软件对所测数据进行非房室模型分析,得到主要药动学参数见表7。
表 7 氟马西尼舌下和静注给药的药动学参数(
$ \bar{x} $ ±s,n=12)观测参数 氟马西尼舌下片
(0.2 mg)氟马西尼注射剂
(0.1 mg)t1/2(t/h) 0.78±0.25 0.58±0.08 tmax (t/h) 0.58±0.24 0.18±0.05 Cmax ρB/(ng·ml−1) 6.36±2.14 10.96±2.62 AUClast (h·ng·ml−1) 8.86±2.83 8.41±2.15 MRTlast (t/h) 1.23±0.25 0.66±0.08 Vz (L/kg) 3.21±1.68 0.89±0.21 CL [L/(h·kg)] 2.83±1.02 1.09±0.25 F(%) 52.68 − 舌下片和注射剂的峰浓度分别为(10.96±2.62)和(6.36±2.14) ng/ml,两者达峰时间分别为(0.18±0.05)和(0.58±0.24) h ,AUClast分别为(8.41±2.15)和(8.86±2.83) h·ng·ml−1;根据数据拟合计算得到主要药动学参数,并计算出氟马西尼舌下片的绝对生物利用度,结果如表7。计算得出氟马西尼舌下片绝对生物利用度约为52.68 %。
-
本课题首先制备了氟马西尼-羟丙基-β-环糊精包合物,实验表明,包合物能显著改善氟马西尼的溶解性能和溶出度,促进药物透膜吸收,在此基础上将包合物进一步制成氟马西尼舌下片。溶出度测定结果表明,舌下片在5 min时的累积溶出度已超过60%,15 min内可完全溶出。
实验建立了LC-MS法测定比格犬血浆中氟马西尼浓度,经过方法学验证,该方法适用于氟马西尼在比格犬体内的药动学研究。药动学实验结果表明,氟马西尼舌下片在比格犬体内的舌下黏膜吸收迅速, 30 min左右达峰值(Cmax=6.36 ng/ml)。氟马西尼舌下片绝对生物利用度为52.68 %,而根据既往研究报道,氟马西尼口服给药生物利用度仅为16%[11],说明将氟马西尼与HP-β-CD包合后制备成舌下片给药能够显著提高其透舌下黏膜吸收以及生物利用度。另据文献报道[12],静脉注射0.1~0.2 mg氟马西尼注射液可有效拮抗苯二氮䓬类药物镇静催眠作用,比较氟马西尼注射剂(0.1 mg)及氟马西尼舌下片(0.2 mg)药动学参数,二者AUClast值无显著性差异,且舌下片在达峰后血药浓度始终高于注射剂,表明氟马西尼舌下片可持续有效拮抗镇静催眠药物。
Preparation and pharmacokinetics of flumazenil sublingual tablet
-
摘要:
目的 制备氟马西尼舌下片,对其在比格犬体内的药动学进行研究,评价其生物利用度。 方法 以羟丙基-β-环糊精为包合材料制备氟马西尼包合物,后压片制备氟马西尼舌下片。采用双周期交叉实验设计,将12只比格犬随机分成2组,分别给予氟马西尼舌下片和注射剂。建立LC-MS法测定血浆中氟马西尼含量,并进行方法学验证。利用WinNonlin 药动学软件计算药动学参数及生物利用度。 结果 采用羟丙基-β-环糊精包合后能有效提高氟马西尼溶出度,促进其舌下黏膜吸收。氟马西尼舌下片15 min内可完全溶出。药动学研究中,氟马西尼注射剂和舌下片AUClast分别为(8.41±2.15)和(8.86±2.83) h·ng·ml−1;Cmax分别为(10.96±2.62)和(6.36±2.14) ng/ml;tmax分别为(0.18±0.05)和(0.58±0.24) h。氟马西尼舌下片生物利用度为52.68 %。 结论 该研究利用包合物制备氟马西尼舌下片,达到安全、高效递送的目的。建立LC-MS法测定氟马西尼血药浓度,其优点在于操作简单、准确灵敏。 Abstract:Objective To prepare flumazenil sublingual tablets and study its bioavailability. Methods Flumazenil sublingual tablets were prepared by compressing flumazenil inclusion compound with hydroxypropyl-β-cyclodextrin as the inclusion material. In a double-cycle crossover trial, twelve beagle dogs were randomly divided into two groups, one group receiving flumazenil sublingual tablets and the other receiving flumazenil injections. LC-MS method was developed and validated to determine flumazenil plasma concentration. The pharmacokinetic parameters and bioavailability were calculated using WinNonlin pharmacokinetic software. Results In the pharmacokinetic study, AUClast of flumazenil injection and sublingual tablet was (8.41±2.15) and (8.86±2.83) h·ng·ml−1, respectively; Cmax was (10.96±2.62) and (6.36±2.14) ng/ml, respectively; tmax was (0.18±0.05) and (0.58±0.24) h, respectively. The bioavailability of flumazenil sublingual tablet was 52.68%. Conclusion Clathrates were used to prepare flumazenil sublingual tablets to achieve safe and efficient delivery. LC-MS method was established for the determination of flumazenil plasma concentration, and the advantages were simple, accurate and sensitive. -
Key words:
- flumazenil /
- sublingual tablet /
- beagles /
- pharmacokinetics
-
表 1 氟马西尼日内、日间精密度与准确度(
$ \bar{x} $ ±s,n=6)样品浓度 (ρB/µg·ml−1) 日内 日间 实测浓度 (ρB/µg·ml−1) 准确度(%) 精密度RSD(%) 实测浓度 (ρB/µg·ml−1) 准确度(%) 精密度RSD(%) 6.25 6.27±0.12 100.32 1.91 6.32±0.05 101.12 0.84 25 25.19±0.46 100.76 1.85 25.26±0.34 101.04 1.36 100 99.85±0.39 99.85 0.39 99.74±1.28 99.74 1.28 表 2 氟马西尼舌下片的溶出度检查结果(
$ \bar{x} $ ±s,n=6)批号 溶出度(%) 5 min 15 min 30 min 60 min 20220615-1 60.14±0.98 95.89±0.62 98.29±1.36 98.86±0.43 20220615-2 63.23±1.91 96.18±2.50 98.76±1.32 98.31±1.52 20220615-3 66.74±1.92 97.56±1.07 97.45±1.26 97.89±1.39 表 3 质谱条件
检测物 母离子 子离子 去簇电压
(U/V)碰撞室出口
电压(U/V)碰撞能量
(U/V)氟马西尼 304.2 257.9 140 15 25 甲苯磺丁脲 271.0 74.2 70 15 22 表 4 氟马西尼日内、日间精密度与准确度(
$ \bar{x} $ ±s,n=6)样品浓度
(ρB/ng·ml−1)日内 日间 实测浓度
(ρB/ng·ml−1)准确度
(%)精密度
RSD(%)实测浓度
(ρB/ng·ml−1)准确度
(%)精密度
RSD(%)0.6 0.60±0.02 95.35 3.09 0.59±0.03 96.70 9.99 6 6.10±0.23 101.72 3.85 6.25±0.28 104.20 4.42 160 167.76±4.31 104.85 2.57 167.76±5.66 104.85 3.38 表 5 提取回收率及基质效应(
$ \bar{x} $ ±s,n=6)氟马西尼样品浓度
(ρB/ng·ml−1)提取回收率
(%)RSD
(%)基质效应
(%)RSD
(%)0.6 87.43±2.49 2.55 105.87±5.61 5.30 6 86.35±2.67 2.77 105.99±6.61 6.03 160 86.12±3.70 3.85 106.28±3.97 3.73 表 6 氟马西尼室温放置4 h、冻融及长期冻存稳定性(
$ \bar{x} $ ±s,n=6)放置条件 样品浓度(ρB/ng·ml−1) 回收率(%) RSD(%) 室温4 h 0.6 98.33±1.02 3.51 6 99.67±1.63 3.71 160 106.25±5.26 3.09 反复冻融3次 0.6 95.52±1.03 1.08 6 99.36±2.25 3.52 160 102.71±3.82 2.32 −20 ℃放置30 d 0.6 97.72±1.32 2.73 6 101.37±1.25 3.44 160 105.48±3.69 3.87 表 7 氟马西尼舌下和静注给药的药动学参数(
$ \bar{x} $ ±s,n=12)观测参数 氟马西尼舌下片
(0.2 mg)氟马西尼注射剂
(0.1 mg)t1/2(t/h) 0.78±0.25 0.58±0.08 tmax (t/h) 0.58±0.24 0.18±0.05 Cmax ρB/(ng·ml−1) 6.36±2.14 10.96±2.62 AUClast (h·ng·ml−1) 8.86±2.83 8.41±2.15 MRTlast (t/h) 1.23±0.25 0.66±0.08 Vz (L/kg) 3.21±1.68 0.89±0.21 CL [L/(h·kg)] 2.83±1.02 1.09±0.25 F(%) 52.68 − -
[1] CHEN X, SANG N E, SONG K C, et al. Psychomotor recovery following remimazolam-induced sedation and the effectiveness of flumazenil as an antidote[J]. Clin Ther, 2020, 42(4):614-624. doi: 10.1016/j.clinthera.2020.02.006 [2] KIM J J, GHARPURE A, TENG J F, et al. Shared structural mechanisms of general anaesthetics and benzodiazepines[J]. Nature, 2020, 585(7824):303-308. doi: 10.1038/s41586-020-2654-5 [3] CIMOLAI N. Zopiclone overdose and flumazenil rescue[J]. Can Med Assoc J, 2017, 189(16):E613. doi: 10.1503/cmaj.732933 [4] BENINI A, GOTTARDO R, CHIAMULERA C, et al. Continuous infusion of flumazenil in the management of benzodiazepines detoxification[J]. Front Psychiatry, 2021, 12:646038. doi: 10.3389/fpsyt.2021.646038 [5] BAILEY A M, BAUM R A, HORN K, et al. Review of intranasally administered medications for use in the emergency department[J]. J Emerg Med, 2017, 53(1):38-48. doi: 10.1016/j.jemermed.2017.01.020 [6] CORRIGAN M, WILSON S S, HAMPTON J. Safety and efficacy of intranasally administered medications in the emergency department and prehospital settings[J]. Am J Health Syst Pharm, 2015, 72(18):1544-1554. doi: 10.2146/ajhp140630 [7] TROTTI L M, SAINI P, KOOLA C, et al. Flumazenil for the treatment of refractory hypersomnolence: clinical experience with 153 patients[J]. J Clin Sleep Med, 2016, 12(10):1389-1394. doi: 10.5664/jcsm.6196 [8] KATZ N, PILLAR G, PELED E, et al. Sublingual flumazenil for the residual effects of hypnotics: zolpidem and brotizolam[J]. Clin Pharmacol Drug Dev, 2012, 1(2):45-51. doi: 10.1177/2160763X12437201 [9] KASTELEIJN-NOLST TRENITÉ D G A, GROENWOLD R H H, SCHMIDT B, et al. Single dose efficacy evaluation of two partial benzodiazepine receptor agonists in photosensitive epilepsy patients: a placebo-controlled pilot study[J]. Epilepsy Res, 2016, 122:30-36. doi: 10.1016/j.eplepsyres.2016.02.003 [10] HARET D. Rectal Flumazenil can save the day[J]. Pediatr Anesth, 2008, 18(4):352. [11] ROUSSEAU-BLASS F, CRIBB A E, BEAUDRY F, et al. A pharmacokinetic-pharmacodynamic study of intravenous midazo-lam and flumazenil in adult New Zealand white-californian rabbits ( Oryctolagus cuniculus)[J]. J Am Assoc Lab Anim Sci, 2021, 60(3):319-328. doi: 10.30802/AALAS-JAALAS-20-000084 [12] SCHULT R F, OMAR D, WIEGAND T J, et al. Experience with lower dose flumazenil at an academic medical center[J]. Am J Emerg Med, 2021, 49:399-401. doi: 10.1016/j.ajem.2021.02.002 -





 下载:
下载: