-
损伤部位的机械刺激和局部感染可导致皮肤伤口的异常愈合,甚至导致瘢痕疙瘩的形成[1]。细胞的迁移、生长和增殖在伤口修复过程中起着至关重要的作用, 增生性瘢痕的形成与各类因子表达异常、成纤维细胞的增殖过度、以及胶原的过度沉积等因素密切相关[2-3]。电生理学实验研究表明,生物组织的行为与电荷的流动高度相关[4-6]。
驻极体是一类不需外加电源即能够提供稳定静电场和微电流的功能电介质材料[7], 其产生的静电场能够加快受创部位微循环,促进成纤维细胞在不同时期生长或凋亡以及促进药物的经皮渗透等作用[8-10]。 5-氟尿嘧啶(5-FU)是最早研发上市的抗癌药,作用于细胞后抑制其 DNA的合成,从而对成纤维细胞生长增殖产生影响,临床上是治疗难治性瘢痕的常用药之一[11]。
该研究将驻极体和 5-FU 联用,通过探索驻极体静电场联合5-FU对分离培养瘢痕成纤维细胞的生长、细胞周期和凋亡的影响,以期在细胞水平研究驻极体静电场以及驻极体联用 5-FU 对瘢痕形成的影响机制,为预防和治疗病理瘢痕提供新的思路。
-
Sprague-Dawley(SD)大鼠,雌雄不限,体质量为(180±20) g,购自海军军医大学实验动物中心,动物合格证号:SCXK(沪)2018-0006。
-
水合氯醛(中国医药集团化学试剂有限公司);5-FU(上海生物工程有限公司);cck-8 试剂盒[东仁化学科技(上海)有限公司];Hoechst33342(上海如吉生物科技发展有限公司);引物(武汉擎科创新生物科技有限公司);细胞培养箱(Thermo公司);栅控恒压电晕充电系统( 复旦中学校办厂);ESR102A 型振动电容静电计(北京华晶汇科技有限公司);荧光定量 PCR 仪(ABI公司); 全自动定量酶标仪(Bio-Rad公司)。
-
通过栅控恒压电晕充电系统对双裸面聚丙烯(Polypropylene,PP) 膜进行注极,栅压设为+5000 V,充电时间为 5 min,制备得+5000 V 驻极体。驻极体等效表面电位通过表面电位计(ESR102A 型振动电容静电计)测量。
-
用 10%的水合氯醛腹腔注射麻醉(4 ml/kg),用实验动物剃毛刀去除大鼠背部毛发, 在大鼠背部用打孔器制造左右对称共 4 个直径为 2 cm 的创面,创面之间间隔一定距离,去除肉膜层,分笼饲养。在创面形成后 4 周产生增生性瘢痕。
-
取瘢痕模型大鼠,10%的水合氯醛腹腔注射麻醉, 用实验动物剃毛刀将大鼠背部毛发去除干净, 酒精棉球擦拭后, 手术剪取下瘢痕皮肤组织,组织用含有青霉素浓度 100 U/ml,链霉素浓度 100 μg/ml 的 PBS 缓冲液反复冲洗 3 次。冲洗后, 用眼科剪将瘢痕皮肤组织剪成组织小块, 组织小块大小在 1~2 mm3 之间。将组织小块置于培养皿中,加入含有 20%胎牛血清的 1640培养基,待细胞长满培养皿,进行细胞传代,待细胞传至 3~8 代,进行后续实验。
-
实验分为瘢痕细胞对照组,+5000 V驻极体组,+5000 V驻极体+10 μg/ml 5-FU组,+5000 V驻极体+40 μg/ml 5-FU组,+5000 V驻极体+160 μg/ml 5-FU组。
-
取对数生长期的瘢痕皮肤组织成纤维细胞(细胞密度为 1×104/ 孔),接种于96孔培养板中(100 μl/孔) 。待细胞绝大部分贴壁后,更换培养液,按照上述实验分组分别对细胞干预24 h、48 h、72 h,再以 10 μl/孔向各孔中加入 cck-8 试剂溶液, 继续在细胞培养箱中保温 1~4 h,终止培养,震荡摇匀,在全自动定量酶标仪上以 450 nm 波长处测定各孔吸光度, 按照增殖率=(实验孔实测值−空白组平均值)/(对照组平均值−空白组平均值)×100%计算细胞增殖率。
-
取瘢痕细胞消化离心后重悬,制成单细胞悬液,按1×104个/孔种植到96孔板中,待细胞绝大部分贴壁后,更换培养基,选取+5000 V驻极体+40 μg/ml 5-FU组对其进行处理,恒温箱培养48 h后,去除培养液,各组均加入含Hoechst 33342(原浓度为10 mg/ml,稀释10000倍)的1640培养液,避光孵育30 min,然后去除培养液,用PBS清洗两次,加入适量PBS,置于荧光显微镜下观察并拍照,每组重复3个样本。荧光定量PCR引物序列表见表1。
表 1 荧光定量 PCR 引物序列表
引物名称 引物序列(5'→3') 片段长度(bp) 退火温度(℃) R-TP53-S GAAGCCCTCCAAGTGTCAGC 220 60 R-TP53-A GGCAGAACAGCTTATTGAGGGA 60 R-fas-S AGCGTTCGTGAAACCGACAAC 172 60 R-fas-A AGTGTTTCCTGTCCGTGTACTCC 60 R-fasl-S GCAAATAGCCAACCCCAGCAC 186 60 R-fasl-A ACGAAGTACAACCCAGCCTCA 60 R-BAX-S GGGCCTTTTTGCTACAGGGTTT 284 60 R-BAX-A AGCAAAGTAGAAAAGGGCAACCAC 60 R-GAPDH-S CTGGAGAAACCTGCCAAGTATG 138 60 R-GAPDH-A GGTGGAAGAATGGGAGTTGCT 60 -
瘢痕细胞在不同浓度5-FU及正极性驻极体和不同浓度5-FU联用干预 24 h、48 h、72 h后增殖率变化情况:在5-FU干预 24 h、48 h、72 h后,在不同浓度5-FU的作用下, 随着 5-FU浓度的增加,瘢痕细胞的增殖率呈下降趋势,且随着时间的增加瘢痕增值下降趋势越明显;正极性驻极体和不同浓度5-FU联用作用于细胞72 h后,细胞增殖率都有所降低。随着 5-FU 浓度的增加, 对照组和各正极性驻极体组瘢痕细胞增殖率呈下降趋势;该变化趋势较5-FU单一作用 72 h组更加明显,具体见表2。
表 2 不同浓度5-FU 及正极性驻极体和不同浓度5-FU联用对瘢痕细胞生长的影响(单位:μg/ml,n=12)
组别 0 10 40 160 24 h组 1.00±0.028 0.99±0.028 0.77±0.027 0.49±0.033 48 h组 1.00±0.024 0.98±0.025 0.65±0.028 0.41±0.028 72 h组 1.00±0.020 0.96±0.033 0.53±0.017 0.21±0.046 +5000 V与5-FU联用72 h组 0.90±0.034 0.47±0.051 0.15±0.051 -
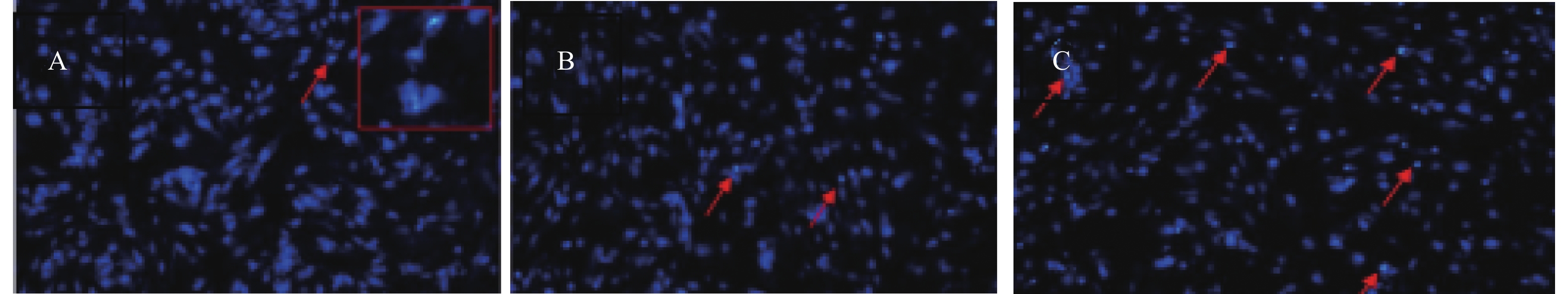
瘢痕细胞各组染色的结果见图1,图中箭头所示亮点为凋亡细胞,较暗的蓝色荧光为正常细胞,图1A右上角方框内为亮点部位放大结果。结果显示:瘢痕细胞对照组基本无细胞凋亡或者极少细胞凋亡; +5000 V驻极体组出现少数细胞凋亡; +5000 V 驻极体与5-FU联用组细胞凋亡数高于 5-FU 组。
-
瘢痕成纤维细胞各组凋亡基因 mRNA 的相对表达量见表3。以对照组为 1,比较各实验组mRNA 的表达。结果显示:与对照组相比,5-FU组表达量明显增加, +5000 V 驻极体组4种凋亡基因 mRNA 的相对表达量都有所增加;与5-FU组相比,虽然+5000 V驻极体组相对表达量稍小,但是+5000 V驻极体+5-FU组表达量则显著增大,以上相比较的各组之间差异均有统计学意义(P<0.05)。
表 3 不同实验组作用于瘢痕成纤维细胞后p53、fas、Bax和fasl mRNA的表达水平(平均值±SD,n=3)
组别 p53 fas Bas fasl 对照组 1.00±0.00 1.00±0.01 1.00±0.02 1.00±0.03 5-FU组 1.60±0.06 2.23±0.11 1.81±0.13 2.01±0.19 +5000 V 驻极体组 1.30±0.10 1.61±0.21 1.41±0.10 1.50±0.12 +5000 V+5-FU组 1.92±0.14 2.81±0.29 2.20±0.17 2.49±0.21 -
细胞的增殖和凋亡状况能够从细胞层面反应组织的生长状况[12]。实验结果表明:不同浓度的5-FU对瘢痕细胞的生长有不同的抑制作用,随着化学药物浓度的增加,瘢痕细胞的增值率降低更迅速。+5000 V驻极体与5-FU联用,对细胞的增殖有协同抑制作用,正极性驻极体和不同浓度5-FU联用作用于细胞72 h后,细胞增殖率均较5-FU单一作用于瘢痕细胞72 h的细胞增值率有所降低。且随着联合作用组5-FU浓度的增加,其抑制细胞增殖率作用更加明显,经+5000 V驻极体与160 μg/ml 5-FU联用72 h,对瘢痕细胞的抑制率可达0.15±0.051。
细胞凋亡检测实验也表明,由于驻极体静电场的作用,使瘢痕细胞凋亡数量增加,+5000 V驻极体组凋亡细胞增多,+5000 V驻极体与5-FU联用组细胞凋亡数高于5-FU组。p53、Fas、Fasl、Bax 4种基因的表达结果也证明+5000 V 驻极体能够通过一定程度的影响该4种基因的表达来促进细胞凋亡,抑制细胞生长,这与前期凋亡实验结果一致。
正极性驻极体及与5-FU的协同抑制瘢痕细胞生长作用,这可能与细胞膜所带内负外正电荷有关。有研究表明, 细胞表面电荷的分布能够影响细胞生长,驻极体产生的静电场影响了细胞膜表面的电荷分布,进而改变了膜蛋白的生物学功能和细胞膜的泵功能,同时,电场产生的微电流会影响细胞的代谢和基因表达, 从而影响细胞的分裂、增殖[13-15]。正极性驻极体产生的静电场可能通过影响细胞膜表面的电荷量, 使得细胞生长受到抑制,增殖率降低,正极性驻极体与 5-FU 联用,能够增强 5-FU 对两种细胞增殖的抑制作用,起到协同作用。
该研究通过提取大鼠正常皮肤及瘢痕皮肤成纤维细胞,通过细胞学实验,考察了正极性驻极体与 5-FU 及其联用对大鼠瘢痕皮肤成纤维细胞在细胞生长、增殖、以及凋亡等方面的影响, 并结合凋亡基因的检测,探究了正极性驻极体与 5-FU 及其联用抑制增生性瘢痕生长的机制,证实了驻极体与 5-FU 及其联用可能是通过影响细胞的生长状态进而影响增生性瘢痕的生长。展示了正极性驻极体与 5-FU 联用取得的更好的治疗增生性瘢痕的效果,为增生性瘢痕的治疗提供了一个发展的方向。
Synergistic effect of positive electret combined with 5-fluorouracil on growth inhibition of scar fibroblasts
-
摘要:
目的 探讨驻极体及5-氟尿嘧啶(5-FU)对瘢痕成纤维细胞生长的影响及其可能的作用机制。 方法 利用全自动酶标仪检测+5000 V驻极体联合不同浓度5-FU对瘢痕成纤维细胞增殖的影响,利用荧光显微镜及RT- PCR技术研究在静电场作用下的瘢痕成纤维细胞的凋亡及p53等凋亡基因mRNA的表达变化。 结果 ①正极性驻极体和不同浓度5-FU联用作用于细胞72 h后,细胞增殖率都有所降低,+5000 V驻极体+160 μg/ml 5-FU组对瘢痕细胞的抑制率达到(0.15±0.051)%。② +5000 V 驻极体组可促进瘢痕成纤维细胞凋亡; +5000 V 驻极体与 5-FU联用组细胞凋亡数高于 5-FU 单一使用组。③ +5000 V 驻极体作用组,4种凋亡基因 mRNA 的相对表达量都有所增加, +5000 V 驻极体与 5-FU 联合作用组4种标志性基因表达量均较 5-FU 组增大。 结论 正极性驻极体与5-FU联合作用对抑制细胞生长有协同作用。正极性驻极体抑制瘢痕细胞生长的机制可能是通过促进细胞凋亡基因的表达,进而影响细胞的生长状态来抑制细胞生长。 Abstract:Objective To investigate the effects and possible mechanism of electret and 5-fluorouracil(5-FU)on the growth of scar fibroblasts. Methods The effect of +5000 V electret combined with different concentrations of 5-FU on the proliferation of scar fibroblasts was detected by automatic enzyme labeling instrument. The apoptosis of scar fibroblasts and the mRNA expression of p53 and other apoptotic genes were studied by fluorescence microscopy and RT-PCR technology under the action of electrostatic field. Results ① After the treatment of positive electret and different concentrations of 5-FU for 72 h, the cell proliferation rate decreased, and the inhibition rate of scar cells in the +5000 V electret+160 μg/ml 5-FU group was (0.15±0.051)%. ②+5000 V electret group could promote the apoptosis of scar fibroblasts; The number of apoptotic cells in +5000 V electret and 5-FU group was higher than that in 5-FU group. ③The mRNA expression levels of four apoptotic genes in the +5000 V electret group were increased, and the expression levels of four signature genes in the +5000 V electret and 5-FU group were increased compared with those in the 5-FU group. Conclusion The combination of positive electret and 5-FU had a synergistic effect on inhibiting cell growth. The mechanism of positive electret inhibiting scar cell growth may be through promoting the expression of apoptosis gene, and then affecting the growth state of cells to inhibit cell growth. -
Key words:
- electrostatic field /
- electret /
- 5-fluorouracil /
- scar fibroblasts
-
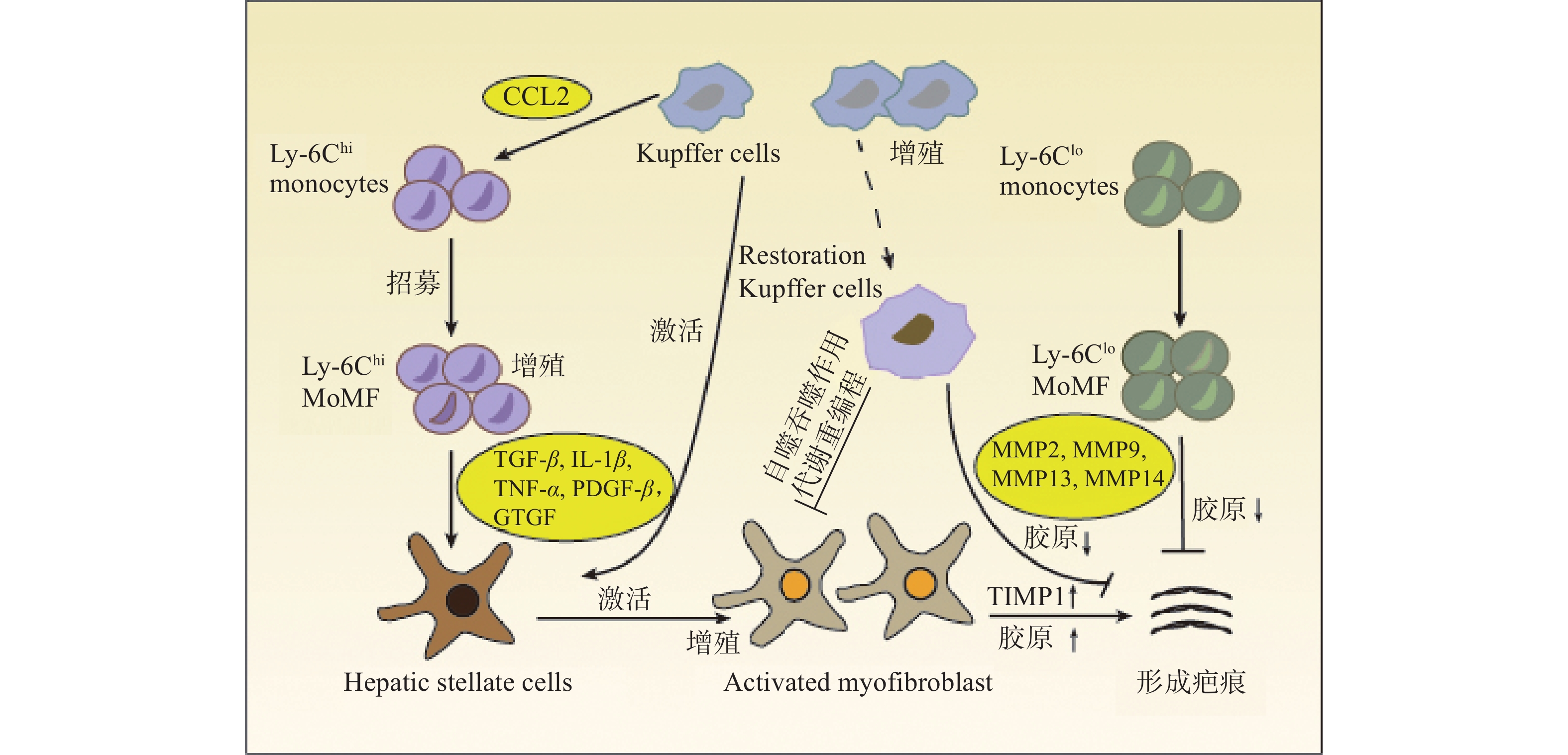
肝纤维化是肝脏对慢性肝损伤的过度修复反应,是一个动态可逆的过程。阻断肝纤维化持续进展是防治肝病向肝硬化甚至肝细胞癌发展的重要策略。目前研究认为,肝星状细胞(HSCs)转化为活化的肌成纤维细胞(MFBs)是细胞外基质 (ECM)的主要来源,也是肝纤维化的主要驱动力[1]。除此之外,大量研究发现,肝巨噬细胞在肝纤维化过程中同样发挥重要作用。
1. 肝巨噬细胞
肝巨噬细胞是肝脏中一个高度异质的非实质细胞群,占肝脏细胞的10%~15%,主要由枯否细胞 (KCs) 和单核细胞衍生的各种浸润巨噬细胞 (MoMFs) 组成,具有显著异质性。巨噬细胞的异质性以多种来源、多种细胞类型特异性标志物和极化表型为特征。此外,肝巨噬细胞具有显著的可塑性,能够快速响应组织环境的变化,呈现不同的细胞表型。肝巨噬细胞被认为是肝脏抵御病原体的第一道防线,参与包括炎症反应、纤维化形成以及纤维化消退在内的肝纤维化所有阶段[2]。因此,肝内巨噬细胞是肝纤维化的核心调控者,肝纤维化治疗的重要靶细胞。
1.1 KCs
KCs是体内最大的常驻巨噬细胞群,包括卵黄囊来源的KCs和骨髓来源的KCs。KCs可以识别内源性细胞碎片和外源性病原体,感知肝脏损伤进而发生活化。因此,KCs对于肝脏稳态的维持、免疫反应的启动和肝损伤的恢复至关重要。
1.2 MoMFs
MoMFs充当免疫反应协调者并补充巨噬细胞群以维持肝脏中的稳态。在小鼠体内,MoMFs分为两个亚群:Ly6Chi和Ly6Clo单核细胞。Ly6Chi单核细胞参与炎症反应并产生促炎作用,而Ly6Clo单核细胞则具有组织修复功能。
2. 肝巨噬细胞在肝纤维化中的作用
在肝损伤早期,损伤或死亡的肝细胞能够释放损伤相关分子模式 (DAMP),并与肝巨噬细胞相互作用,从而促进肝巨噬细胞的活化、极化和募集。活化的肝巨噬细胞能够分泌大量促炎因子和促纤维化细胞因子,参与炎症反应并促进HSCs的活化和纤维化应答[3](图1)。
2.1 肝巨噬细胞与HSCs的相互作用
HSCs位于肝细胞和肝窦内皮细胞之间的窦周间隙,在正常和受损的肝组织中具有不同的生理功能。正常的生理条件下,HSCs被称为静息的HSCs (qHSCs),负责储存肝脏中的维生素A。当肝损伤后,qHSCs被炎症介质激活,进而分化为 MFBs,分泌大量的ECM并产生纤维瘢痕,导致肝纤维化[4]。肝巨噬细胞能够与HSCs相互作用,重塑免疫微环境和ECM,该相互作用对于肝脏炎症应答和纤维化应答至关重要。
肝巨噬细胞能够分泌与HSCs活化有关的各种细胞因子和趋化因子,如转化生长因子β (TGF-β),肿瘤坏死因子α (TNF-α),白细胞介素1β (IL-1β) 和趋化因子配体2 (CCL2) 等。肝巨噬细胞产生的IL-1β和TNF-α能够激活NF-κB信号通路,增强MFBs的增殖[5]。激活素A (ACTA) 是TGF-β超家族成员之一,能够促进KCs中TNF-α和TGF-β1的表达,诱导HSCs转化为促纤维化表型,提高α-平滑肌肌动蛋白 (α-SMA) 表达水平和迁移能力[6]。此外,肝脏在受到丙型肝炎病毒 (HCV) 感染后,肝巨噬细胞能够分泌趋化因子配体5 (CCL5) ,引起HSCs中炎症小体和纤维化标志物α-SMA与TGF-β的激活[7]。
除细胞因子和趋化因子外,肝巨噬细胞还能够产生其他与HSCs串扰的分子。例如,MoMFs能够通过分泌颗粒蛋白激活qHSCs,促进其转化为MFBs,引起ECM的积累和肝纤维化的形成[8]。HMGB1是一种响应组织损伤而产生的DAMP,主要由肝细胞和KCs分泌,研究表明,HMGB1能够与HSCs中的晚期糖基化终末产物受体(RAGE)结合,激活pMEK1/2、pERK1/2和p-c-Jun通路,增加Ⅰ型胶原蛋白的沉积[9]。
此外,HSCs也可作用于肝巨噬细胞,影响其功能。紫藤凝集素阳性Mac-2结合蛋白 (WFA+-M2BP) 是一种肝纤维化的血清指示剂,可由HSCs分泌。据报道,WFA+-M2BP能够促进KCs表达M2BP,而KCs分泌的M2BP反过来又会进一步加强HSCs的激活。由此说明,在肝纤维化的发展过程中,巨噬细胞和HSCs之间存在正反馈调节[10]。
2.2 巨噬细胞极化
巨噬细胞具有显著的异质性,可以在不同的组织微环境中极化成不同的表型,从而发挥不同作用。通常,巨噬细胞极化的表型可以分为经典活化 (M1) 型和选择活化 (M2) 型。M2型可以进一步分为M2a、M2b、M2c和M2d亚型。
在被脂多糖 (LPS) 和干扰素-γ(IFN-γ) 刺激后,M1型巨噬细胞发生活化,分泌大量促炎细胞因子,如IL-1β、TNF-α、诱导型一氧化氮合酶 (iNOS) 等,从而发挥促炎作用。因此,M1型巨噬细胞在肝损伤起始阶段起重要作用,能够释放促炎因子,加剧炎症反应并促进肌成纤维细胞增殖,最终导致肝纤维化[11]。
M2型巨噬细胞的极化主要由白细胞介素4 (IL-4) 和白细胞介素13 (IL-13)等细胞因子诱导发生,能够分泌抗炎因子,如白细胞介素10 (IL-10) 、TGF-β、精氨酸酶1 (Arg-1) 等,具有抑制炎症、促进组织重塑、预防寄生虫感染以及调节免疫等生物学功能。在肝纤维化的发展过程中,M2型巨噬细胞产生抗炎作用,能够促进伤口的愈合和再生。然而,当肝损伤持续存在时,M2型巨噬细胞释放的TGF-β、血小板衍生生长因子 (PDGF) 、血管内皮生长因子 (VEGF) 等生长因子,会促进MFBs的增殖和活化,加重肝纤维化[12]。
调节巨噬细胞极化可以发挥抗肝纤维化作用。脯氨酸-丝氨酸-苏氨酸-磷酸酶相互作用蛋白2 (PSTPIP2) 能够调节STAT1和NF-κB信号通路,抑制M1型巨噬细胞极化,改善肝脏炎症和肝纤维化[13]。白细胞介素22 (IL-22) 能够调节STAT3、Erk、Akt信号通路的传导,促进巨噬细胞从M1型转变为M2型,从而减缓肝纤维化的进展[14]。
此外,肝巨噬细胞和其他细胞群之间的相互作用对肝巨噬细胞的表型转换也至关重要。自然杀伤 (NK) 细胞在调节巨噬细胞极化方面发挥关键作用,研究发现,DX5+NKp46+ NK细胞能够产生IFN-γ促进M1巨噬细胞极化,在预防非酒精性脂肪性肝炎 (NASH) 进展为肝纤维化方面发挥重要作用[15]。中性粒细胞 (PMN) 能够促进巨噬细胞转变为具有肝脏修复功能的巨噬细胞,有助于肝脏炎症和肝纤维化的自发消退[16]。
2.3 肝巨噬细胞的募集和浸润
肝巨噬细胞浸润与慢性炎症和肝纤维化密切相关。在趋化因子和相应受体的介导下,巨噬细胞能够募集到损伤部位,参与炎症和肝纤维化的发展。例如,Ly6Chi MoMFs能够依赖趋化因子受体2 (CCR2) 募集到肝损伤区域,发挥促炎和促纤维化作用。微蛋白 (PSMP) 是一种新型趋化因子,能够促进炎性巨噬细胞的浸润,分泌更多的促炎细胞因子,加剧肝纤维化应答[17]。骨髓细胞上表达的触发受体1 (TREM-1) 可促进KCs的募集和浸润以及促炎细胞因子的产生[18]。
阻碍肝巨噬细胞的浸润与募集有助于肝纤维化的消退。配对免疫球蛋白样2型受体α (PILRα) 是一种抑制性受体,主要在骨髓细胞中表达,在炎症过程中能够抑制肝巨噬细胞与PMN的浸润。研究证实,PILRα能够调节整合素信号传导,阻碍巨噬细胞迁移到受损的肝组织,从而减轻肝脏炎症并缓解肝纤维化[19]。
此外,研究还发现一种新的TREM2+ CD9+瘢痕相关巨噬细胞 (SAMacs) 亚群,其来源于MOMFs,在肝纤维化过程中表现出促纤维化表型[20],可能成为未来肝纤维化治疗的重要靶细胞。
2.4 肝巨噬细胞与肝细胞的相互作用
在肝纤维化进展中,肝细胞能够分泌一系列DAMP和细胞外囊泡 (EVs) ,可与肝巨噬细胞相互作用,诱导巨噬细胞转变为促炎表型。线粒体DNA (mtDNA) 是一种内源性DAMP,能够激活先天免疫反应[21]。肝细胞衍生的mtDNA能够激活NF-κB信号通路,诱导KCs分泌TNF-α和白细胞介素6 (IL-6) ,引起肝脏炎症和纤维化应答[22]。M1型巨噬细胞分泌的EVs能够激活肝细胞中NLRP3炎性体信号通路,而应激的肝细胞可分泌含有微小RNA-192-50 (miR-192-5p) 和血清CD40L配体 (CD40L) 的EVs,促进M1型巨噬细胞极化[23]。因此,肝细胞和巨噬细胞之间通过释放DAMP和EVs相互作用,促进了肝内炎症反应与肝纤维化进展。
2.5 肝巨噬细胞与代谢重编程
细胞代谢重编程是细胞为满足能量需求,通过改变代谢模式促进细胞增殖和生长的机制,包括糖代谢、脂代谢、氨基酸代谢等。
肝巨噬细胞的代谢重编程与巨噬细胞极化紧密联系,影响肝纤维化的进展和消退[24]。c-Rel是NF-κB转录因子家族成员之一,参与巨噬细胞代谢重编程。研究发现,c-Rel能够与6-磷酸果糖激酶-2的启动子结合,诱导巨噬细胞极化和HSCs活化,从而加重炎症反应与肝纤维化[25]。此外,肝脏中铁的代谢失调也与晚期肝纤维化有关。肝内铁的积累能够激活MiT/TFE转录因子,促进M1型巨噬细胞的活化,加重肝纤维化[26]。
膜联蛋白A5是膜联蛋白家族的成员之一,能够与M2型丙酮酸激酶(PKM2)相互作用,将肝巨噬细胞中的糖酵解转换为氧化磷酸化,促进巨噬细胞从M1型转换到M2型,从而改善炎症和肝纤维化[27]。因此,调节肝巨噬细胞的免疫代谢是肝纤维化的潜在治疗策略。
2.6 肝巨噬细胞自噬和吞噬作用
自噬是将机体中异常表达的蛋白质和受损的细胞器转移到溶酶体中进行降解,对细胞稳态的维持、细胞存活、分化和生长至关重要。大量研究证实,巨噬细胞自噬对肝脏具有保护作用。例如,KCs的自噬能够抑制细胞活性氧 (ROS) 介导的白细胞介素1α (IL-1α) 和IL-1β的分泌,从而缓解肝脏炎症和纤维化[28]。日本血吸虫卵抗原 (SEA) 诱导的巨噬细胞自噬能够抑制肝脏病理的发展[29]。白细胞介素7 (IL-7) 能够通过激活AMP活化蛋白激酶 (AMPK) 抑制SEA诱导的巨噬细胞自噬,促进炎症细胞对肝脏的浸润,增强MFBs活性,从而加重SEA感染引起的肝纤维化[30]。此外,LC3相关的吞噬作用 (LAP) 是一种非典型的自噬形式,能够将Ly6Chi MoMFs变为Ly6Clo MoMFs。研究表明,LAP可抑制全身炎症,发挥抗肝纤维化作用[31]。
吞噬作用是细胞摄取较大固体颗粒或大分子复合体的过程。肝巨噬细胞能够通过吞噬和清除肝脏中死亡的细胞调节肝脏炎症和纤维化。在肝损伤中,巨噬细胞能够吞噬坏死的肝细胞,诱导Wnt3a的表达并激活Wnt通路,从而促进肝再生。肝脏巨噬细胞的吞噬作用,减弱了受损肝细胞中线粒体衍生的DAMP的释放,从而抑制肝脏瘢痕的形成[32]。因此,调节肝巨噬细胞的自噬和吞噬功能可成为一种新的抗肝纤维化策略,值得进一步研究。
2.7 其他肝巨噬细胞在肝纤维化中的作用
除了KCs和MoMFs,其他浸润性巨噬细胞群也与肝纤维化有关。SOCS蛋白是巨噬细胞炎症活性的调节因子,在肝纤维化期间,脾巨噬细胞能够通过上调肝巨噬细胞中的SOCS3信号传导来促进CCL2的分泌,从而促进循环单核细胞的浸润,加剧肝纤维化的发展[33]。
2.8 其他机制
肝纤维化的发展与多种细胞和分子机制相关。除肝巨噬细胞外,HSCs、肝细胞、肝窦内皮细胞、胆管细胞和脾细胞也参与了肝纤维化的发展,这些细胞之间的相互作用,能够调控细胞内信号传导,从而影响肝纤维化进展和消退。此外,肝内肝窦的形成和重塑是肝纤维化的关键特征,抑制血管生成也能够减缓肝纤维化的进展。
3. 靶向肝巨噬细胞治疗肝纤维化
肝巨噬细胞在肝损伤、肝纤维化进展和消退中发挥双重作用。目前研究证实,多种药物能够通过调控肝巨噬细胞的功能发挥抗肝纤维化的作用。因此,基于巨噬细胞在肝纤维化中的作用,人们开发了相关的趋化因子抑制剂、细胞通路拮抗剂,期望为肝纤维化提供新的治疗策略。
3.1 临床前研究
3.1.1 巨噬细胞极化的调节
调节巨噬细胞极化可以治疗肝纤维化。例如,槲皮素能够调控Notch1通路,抑制M1型巨噬细胞极化,缓解炎症反应,从而抑制肝纤维化进展[34];壳寡糖能够通过调控JAK2/STAT1和JAK1/STAT6信号通路,抑制巨噬细胞极化为M1型,增加M2型巨噬细胞数量,从而发挥抗肝纤维化作用[35]。此外,研究还发现,在肝纤维化期间,脾切除能够激活ERK1/2信号通路,促进MOMFs转换为抗炎的Ly6CloMOMFs,从而减轻肝脏炎症和肝纤维化应答[36]。
3.1.2 抑制巨噬细胞的募集和浸润
抑制巨噬细胞募集和浸润有助于肝纤维化的消退。姜黄素能够通过抑制KCs的激活减少趋化因子分泌,降低Ly6ChiMOMFs的浸润,从而缓解肝纤维化[37]。鉴于CCL2/CCR2和CCL5/CCR5信号通路在巨噬细胞募集中的关键作用,人们研发出了相关的趋化因子受体拮抗剂,如CCR2拮抗剂RS102895、CCR2/CCR5双拮抗剂 (CVC) 。研究发现,在酒精性肝纤维化模型中,CVC能够明显抑制体内巨噬细胞的募集,展现出较好的的抗纤维化活性[38]。
3.1.3 诱导巨噬细胞自噬
巨噬细胞自噬是一种针对慢性肝损伤和纤维化的保护机制,通过诱导巨噬细胞自噬能够治疗肝纤维化。MJN110是一种单酰基甘油脂肪酶 (MAGL) 抑制剂,在CCl4和BDL诱导的肝纤维化模型中,MJN110的干预能够促使巨噬细胞自噬通量和自噬体生物合成增加、减少肝巨噬细胞数量,从而减缓肝纤维化进展,促进肝纤维化消退[39]。
3.2 临床研究
大多数基于肝巨噬细胞的疗法仅在肝纤维化的动物模型中进行了评估,而相关的临床研究数据较少。CVC是CCR2和CCR5双重拮抗剂,两项临床实验数据显示,CVC在伴有纤维化的NASH中具有显著的抗纤维化作用,并且耐受性良好[40]。此外,有研究人员在人体上进行了自体巨噬细胞治疗的安全性评估实验,结果表明,该疗法在肝硬化患者中是安全可行的,这为未来研究其在肝硬化和其他纤维化疾病中的疗效提供了依据[41]。
4. 结论与展望
肝纤维化是由各种病因所致慢性肝损伤的修复反应,其特征是ECM在肝内的过度沉积。鉴于肝巨噬细胞在调节肝纤维化反应中的关键作用,人们开发出了针对肝巨噬细胞治疗肝纤维化的新策略。基于抑制KCs活化的靶向疗法已被研究,这些疗法主要通过抑制细胞内炎症信号通路,如NF-κB、ASK1、JNK和p38等信号通路,从而治疗肝纤维化[42]。Loomba等人开发了Selonsertib,一种ASK1信号通路的抑制剂,研究证实,Selonsertib对肝细胞代谢和巨噬细胞活化有影响。在一项随机2期试验中,Selonsertib能够降低NASH和肝纤维化患者的肝脏中胶原蛋白含量和小叶炎症程度,并且能够改善肝细胞凋亡和坏死[43]。此外,肝纤维化治疗的重点是减少MoMFs向肝脏的募集。MoMFs向受损肝脏的募集依赖于活化的肝细胞分泌的几种趋化因子,如趋化因子配体1 (CCL1) ,CCL2,CCL5[44]。因此,调节趋化因子的信号传导也是一种治疗策略,这些疗法主要包括针对趋化因子或受体的单克隆抗体、阻止趋化因子结合的受体拮抗剂、适体分子和阻断趋化因子诱导的细胞内信号传导的小分子抑制剂等[5]。研究发现,使用CCR2敲除能够减弱小鼠MoMFs募集,抑制MFBs活化并减轻肝纤维化[45]。此外,MoMFs可分为导致肝脏损伤的Ly6Chi MOMFs和具有肝脏修复功能的Ly6Clo MOMFs。因此,另一种潜在的策略是通过将Ly6Chi MOMFs转换为Ly6Clo MOMFs来恢复正常的肝功能。研究证实,在CCl4诱导的肝纤维化模型和MCD饮食诱导的NASH模型中,CCL2抑制剂mNOX-E36能够抑制Ly6Chi MOMFs的早期流入,同时能够将Ly6Chi MOMFs转换为Ly6Clo MOMFs,促进肝纤维化的消退[46]。
尽管肝巨噬细胞在肝纤维化发病机制中的作用机制和相关治疗策略已经取得了突破性进展,然而,通过巨噬细胞靶向肝纤维化疗法仍然存在局限性。需要解决的问题如下:肝巨噬细胞的这些表型其临床意义是什么,是否有可能对肝巨噬细胞进行基因改造以解决肝纤维化,如何达到只靶向致病表型而不破坏正常的生理表型?此外,大多数关于肝巨噬细胞的作用和潜在机制的研究都是在啮齿动物模型中进行的,由于啮齿动物和人类之间的肝巨噬细胞存有差异,这些发现与人类的相关性仍需要进一步研究。
-
表 1 荧光定量 PCR 引物序列表
引物名称 引物序列(5'→3') 片段长度(bp) 退火温度(℃) R-TP53-S GAAGCCCTCCAAGTGTCAGC 220 60 R-TP53-A GGCAGAACAGCTTATTGAGGGA 60 R-fas-S AGCGTTCGTGAAACCGACAAC 172 60 R-fas-A AGTGTTTCCTGTCCGTGTACTCC 60 R-fasl-S GCAAATAGCCAACCCCAGCAC 186 60 R-fasl-A ACGAAGTACAACCCAGCCTCA 60 R-BAX-S GGGCCTTTTTGCTACAGGGTTT 284 60 R-BAX-A AGCAAAGTAGAAAAGGGCAACCAC 60 R-GAPDH-S CTGGAGAAACCTGCCAAGTATG 138 60 R-GAPDH-A GGTGGAAGAATGGGAGTTGCT 60 表 2 不同浓度5-FU 及正极性驻极体和不同浓度5-FU联用对瘢痕细胞生长的影响(单位:μg/ml,n=12)
组别 0 10 40 160 24 h组 1.00±0.028 0.99±0.028 0.77±0.027 0.49±0.033 48 h组 1.00±0.024 0.98±0.025 0.65±0.028 0.41±0.028 72 h组 1.00±0.020 0.96±0.033 0.53±0.017 0.21±0.046 +5000 V与5-FU联用72 h组 0.90±0.034 0.47±0.051 0.15±0.051 表 3 不同实验组作用于瘢痕成纤维细胞后p53、fas、Bax和fasl mRNA的表达水平(平均值±SD,n=3)
组别 p53 fas Bas fasl 对照组 1.00±0.00 1.00±0.01 1.00±0.02 1.00±0.03 5-FU组 1.60±0.06 2.23±0.11 1.81±0.13 2.01±0.19 +5000 V 驻极体组 1.30±0.10 1.61±0.21 1.41±0.10 1.50±0.12 +5000 V+5-FU组 1.92±0.14 2.81±0.29 2.20±0.17 2.49±0.21 -
[1] 柳承业, 徐凯, 林瀚. 曲安奈德与A型肉毒毒素联合注射治疗瘢痕疙瘩的疗效观察[J]. 中国美容整形外科杂志, 2020, 31(7):430-432,453. doi: 10.3969/j.issn.1673-7040.2020.07.015 [2] 安晓强, 苑旺, 梁媛媛, 等. 正极性驻极体5-氟尿嘧啶贴剂对兔耳瘢痕组织中Ⅰ、Ⅲ型胶原和TCF-β表达的影响[J]. 药学实践杂志, 2019, 37(2):115-120,145. [3] YAO G, MO X Y, YIN C H, et al. A programmable and skin temperature-activated electromechanical synergistic dressing for effective wound healing[J]. Sci Adv, 2022, 8(4):eabl8379. doi: 10.1126/sciadv.abl8379 [4] LIANG Y Y, XU J J, SUN Z P, et al. Research progress on the correlation between bacterial biofilm microenvironment and charge regulation[J]. IEEE Trans Dielectr Electr Insul, 2022, 29(4):1540-1545. doi: 10.1109/TDEI.2022.3183663 [5] LUO R Z, SHI B J, LUO D, et al. Self-powered electrical stimulation assisted skin wound therapy[J]. Sci Bull, 2023, 68(16):1740-1743. doi: 10.1016/j.scib.2023.07.017 [6] VERDES M, MACE K, MARGETTS L, et al. Status and challenges of electrical stimulation use in chronic wound healing[J]. Curr Opin Biotechnol, 2022, 75:102710. doi: 10.1016/j.copbio.2022.102710 [7] LI X, WANG Y R, XU M X, et al. Polymer electrets and their applications[J]. Appl Polym Sci, 2021, 20: 50406. [8] SUN Z P, WANG H B, GUO X, et al. Electret prevents the formation of bacterial biofilm[J]. IET Nanodielectr, 2023, 6(2):57-63. doi: 10.1049/nde2.12051 [9] 梁媛媛, 涂晔, 崔黎丽, 等. 驻极体静电场对巨噬细胞迁移能力的影响[J]. 第二军医大学学报, 2021, 42(6):688-692. [10] STRATFORD J P, EDWARDS C L A, GHANSHYAM M J, et al. Electrically induced bacterial membrane-potential dynamics correspond to cellular proliferation capacity[J]. Proc Natl Acad Sci U S A, 2019, 116(19):9552-9557. doi: 10.1073/pnas.1901788116 [11] 王碧瑶, 肖含先之, 牛依琳, 等. 当归多糖促进5-氟尿嘧啶作用后小鼠应激性红细胞发生[J]. 中国药理学通报, 2023, 39(10):1949-1956. doi: 10.12360/CPB202211087 [12] 田阳, 王飞, 徐骁然, 等. 沉默单核细胞趋化蛋白3对人增生性瘢痕成纤维细胞增殖、迁移及凋亡的影响[J]. 临床皮肤科杂志, 2022, 51(9):518-523. [13] ZHAO M. Electrical fields in wound healing-An overriding signal that directs cell migration[J]. Semin Cell Dev Biol, 2009, 20(6):674-682. doi: 10.1016/j.semcdb.2008.12.009 [14] LUO R Z, DAI J Y, ZHANG J P, et al. Accelerated skin wound healing by electrical stimulation[J]. Adv Healthc Mater, 2021, 10(16):e2100557. doi: 10.1002/adhm.202100557 [15] NUCCITELLI R. A role for endogenous electric fields in wound healing[J]. Curr Top Dev Biol, 2003, 58:1-26. -





 下载:
下载:
 下载:
下载:


