-
雀梅藤Sageretia thea(Osbeck)Johnst又名雀梅刺、对角刺、碎米子等,为鼠李科雀梅藤属植物,主要分布地区包括云南、安徽、江苏等[1-2]。根、茎、叶均可入药,其性甘、淡、平,具有降气化痰、祛风利湿等功效[3]。民间常用雀梅藤药材煎汤或浸酒内服治疗乳腺肿瘤、淋巴结肿大和水肿等疾病,具有较好效果[4]。现代药理研究表明,雀梅藤具有抗结直肠癌、抗炎、抗氧化、抗病毒、抗菌和肝保护等活性[5-6],但尚未见雀梅藤对乳腺癌等其他肿瘤影响的报道。该研究通过多种体外实验观察雀梅藤对乳腺癌细胞增殖及凋亡的影响,并初步探索其作用机制,以证实民间应用该药材治疗乳腺肿瘤的合理性,为进一步的药物开发奠定基础。
-
CCK8 试剂盒(大连美仑生物技术有限公司);Spark酶标仪(瑞士Tecan公司);二氧化碳培养箱(Thermo Fisher);96孔培养板(泰坦);电子分析天平(塞多利斯 BSA2245-CW);细胞计数仪(Corning 6749);倒置相差显微镜(奥林巴斯 IX73)。
-
雀梅藤药材购自昆明井田药业有限公司,生产许可证号:滇20160155。经海军军医大学药学系生药学教研室辛海量教授鉴定为鼠李科雀梅藤属植物雀梅藤Sageretia thea(Osbeck)Johnst.的茎。取雀梅藤干燥药材660 g,粉碎后用8倍量75%乙醇回流提取3次,每次1.5 h。合并提取液,过滤后回收溶剂,得乙醇提取物。乙醇提取物用水溶解混悬,加入等体积的石油醚萃取3次,收集萃取液,通过旋转蒸发得到石油醚萃取部位。进一步采用真空冷冻干燥机在−80 ℃下冻干,分别称重,获得乙醇和石油醚提取物质量为57 g和0.91 g,提取得率分别为8.63%和0.13%。
-
称取20 mg雀梅藤石油醚提取物溶于1 ml的DMSO溶剂中,然后用培养液稀释成不同药物浓度,药物最高剂量下的DMSO浓度不超过0.3%。同时,对照组培养液中添加0.3%的DMSO作为阴性对照。
-
三阴性人乳腺癌细胞株MDA-MB-231、BT549购自中国科学院上海细胞库;人脐静脉血管内皮细胞株购自上海赋望实业有限公司。
-
分别取对数生长期的人三阴性乳腺癌细胞株MDA-MB-231和BT549及人脐静脉血管内皮细胞株(HUVEC)并计数,以每孔5×103个的细胞密度接种到96孔板,在37 ℃的细胞培养箱中过夜培养至细胞贴壁。实验分为对照组和给药组,对照组以正常培养基培养,给药组以不同浓度含药培养基孵育细胞24 h。随后按试剂盒说明书进行操作,每孔加入10%的CCK8试剂,在培养箱中孵育2 h后,用酶标仪在450 nm处检测各孔的吸光度(OD)值。对照组细胞活力换算为100%,其余各给药组按以下公式计算:细胞增殖抑制率(%)=[(对照组A值−实验组A值)/(对照组A值−空白组A值)]×100%。
-
取上述对数生长期的人三阴性乳腺癌细胞株,以每孔500个细胞的密度均匀接种在12孔板内,过夜,使细胞贴壁,随后加入雀梅藤提取物孵育24 h。吸弃培养基,用含10%的胎牛血清培养基继续培养,当培养皿中出现肉眼可见的克隆形成时,终止培养。吸弃上清液,用PBS小心浸洗,然后甲醇固定。去除固定液,加入适量的结晶紫染色液进行染色,采用PBS多次轻轻洗去周边染色液,干燥后拍照,随后用Image J软件进行统计分析。
-
将两种乳腺癌细胞接种于96孔板,放置培养箱中过夜,随后加入提取物孵育24 h。吸弃培养基,用PBS温和洗涤细胞一次,每孔加入100 μl的Calcein AM/PI染色工作液,放入37 ℃培养箱中避光孵育15 min后,用高内涵系统采集图像。
-
取对数生长期乳腺癌细胞株,以每孔40万个细胞接种于6孔板,培养箱中过夜,待细胞贴壁后,用含不同浓度提取物的培养基处理24 h,消化,离心收集细胞,以预冷的70%乙醇混悬固定过夜。离心,去除乙醇,用PBS清洗一次,加入500 μl的碘化丙啶染色工作液,避光染色30 min后用流式细胞仪分析细胞周期。
-
将对数生长期的三阴性乳腺癌细胞株以每孔40万个接种于6孔板中,过夜,待细胞贴壁后,用含不同浓度提取物的培养基孵育24 h。消化,离心收集细胞,用100 μl的1×结合缓冲液混悬后加入FITC Annexin V 和PI各5 μl,轻微振荡,室温下避光孵育15 min,流式细胞仪分析凋亡率。
-
将上述对数生长期的人三阴性乳腺癌细胞株以每孔20万个接种于6孔板,过夜,待细胞贴壁后,用含不同浓度提取物的培养基孵育24 h,吸弃培养基,每孔加入1 ml稀释过的DAPI染液孵育细胞10 min,PBS清洗2遍后采用Cytation 5拍照。
-
将对数生长期的人三阴性乳腺癌细胞株以每孔20万个接种于6孔板,过夜,待细胞贴壁后,用含不同浓度提取物的培养基孵育细胞24 h。吸弃培养液,PBS洗涤细胞之后每孔加入1 ml的JC-1染液,在37 ℃培养箱中孵育20 min。吸除上清液,用缓冲液洗涤细胞3次后加入2 ml细胞培养液,高内涵系统拍照。
-
取上述对数生长期细胞株,以每孔20万个的细胞密度接种于6孔板,过夜,待细胞贴壁后,用含不同浓度提取物的培养基孵育24 h。吸弃培养基,每孔加入1 ml含DCFH-DA的新鲜培养基孵育细胞20~30 min,DAPI复染,采用高内涵系统拍照。
-
使用Graphpad Prism 8.0.1分析软件对所获得的实验数据进行统计学分析,组间比较采用单因素方差分析,两组比较采用t检验,以P<0.05为差异有统计学意义。
-
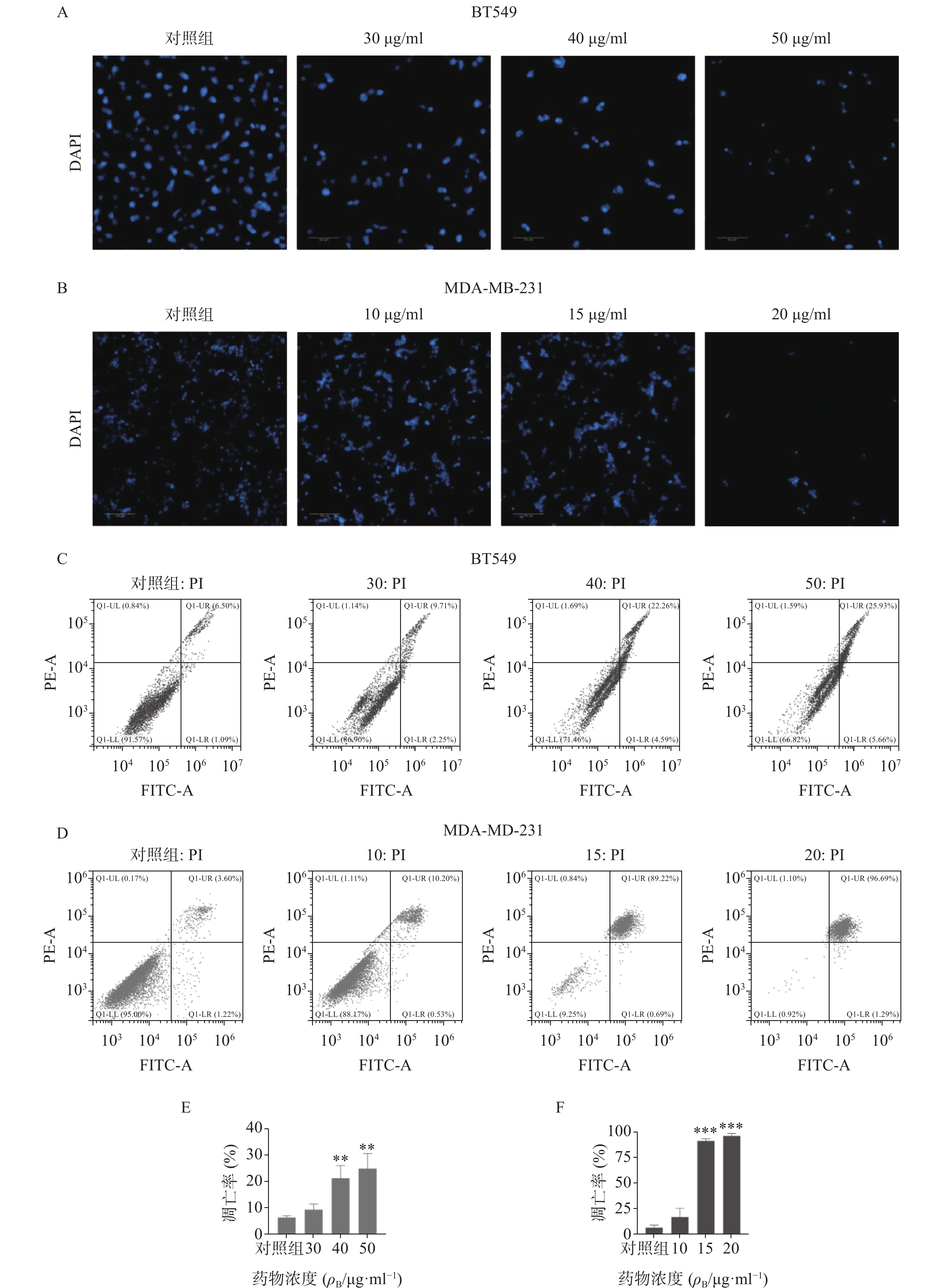
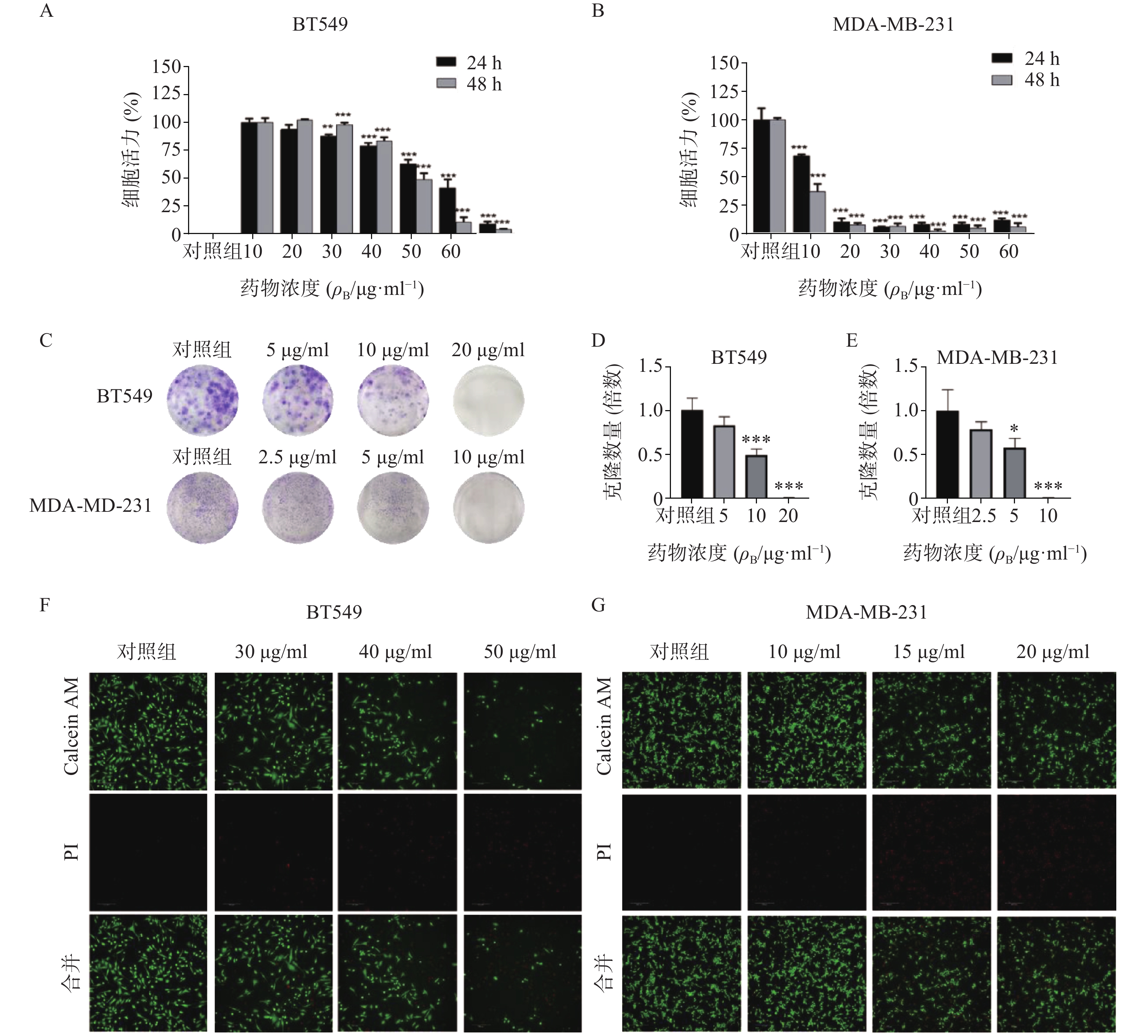
通过细胞活力分析发现,雀梅藤石油醚提取部位对多种癌细胞均有明显细胞毒性,其中对乳腺癌细胞株抑制作用最强,而且明显强于乙醇提取物。结合临床应用,实验选择两种人三阴性乳腺癌系(BT549和MDA-MB-231)进一步研究(见图1)。CCK8结果表明(图1A-B),雀梅藤石油醚提取物以剂量和时间依赖的方式抑制乳腺癌细胞活力,作用24 h和48 h的IC50值分别为45.40、12.23 μg/ml和38.87、7.60 μg/ml。平板克隆实验结果显示(图1C-E),随着雀梅藤石油醚提取物剂量的增加,两种乳腺癌细胞生长均被显著抑制。浓度分别在10 μg/ml和20 μg/ml时,MDA-MA-231和BT549细胞株的生长被完全抑制。Calcein AM/PI活死细胞染色显示(图1F-G),随着药物剂量增加,活细胞(绿色)数量较对照组显著减少,而死亡细胞(红色)数量则显著增加,与对照组比较有极显著差异。
-
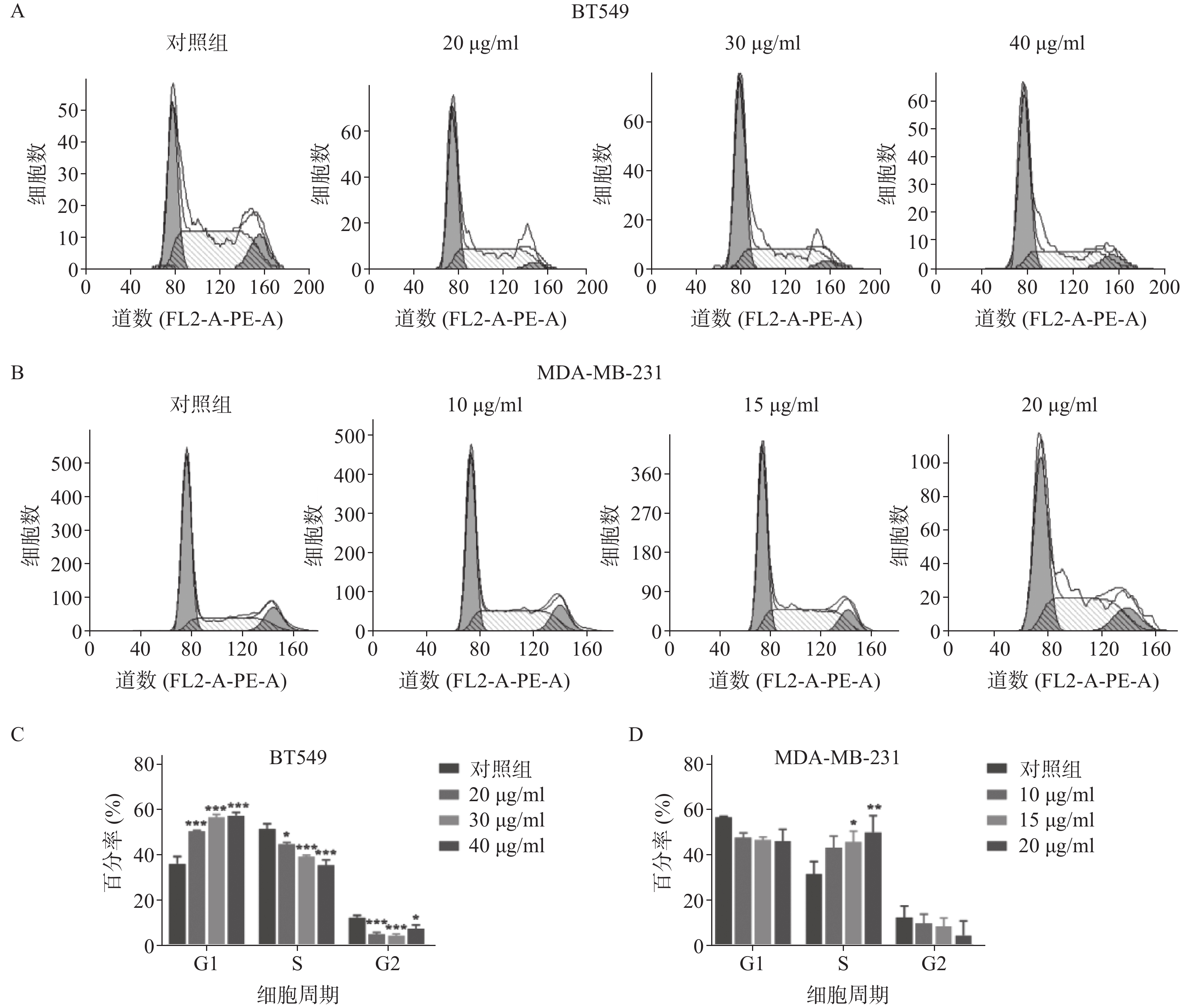
雀梅藤石油醚提取物孵育乳腺癌细胞24 h后,采用流式细胞仪测定细胞的增殖周期情况(见图2)。结果显示,药物明显阻滞两种乳腺癌细胞株的细胞周期,但对两种细胞阻滞周期不同,BT549细胞阻滞在G1期(图2A和2C,给药组G1期细胞比率较对照组显著升高),MDA-MA-231细胞阻滞在S期(图2B和2D,给药组S期细胞比率较对照组显著升高),提示石油醚提取物对两种细胞株的细胞周期阻滞可能存在不同机制。
-
采用DAPI染色方法对细胞核形态进行分析(见图3)。如图3A-B所示,正常对照组乳腺癌细胞核呈均匀的圆形浅蓝色,药物处理后细胞核质固缩或碎裂成凋亡小体,且呈剂量依赖性。流式细胞仪凋亡定量分析显示(图3C-F),石油醚提取物显著增加两种乳腺癌细胞的凋亡率,与对照组比较有显著性差异,其中尤以MDA-MA-231细胞株明显,20 μg/ml浓度下几乎诱导细胞全部凋亡。
-
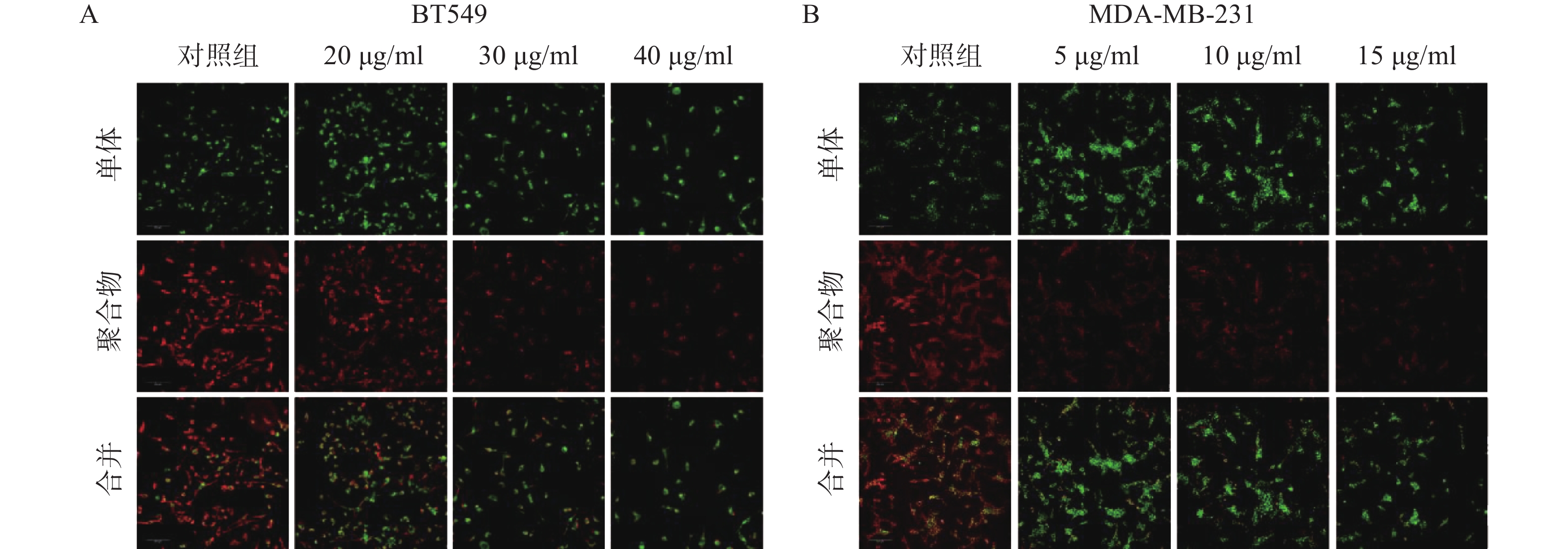
线粒体通路是肿瘤细胞最常见的凋亡途径,最典型的特征是线粒体膜电位(MMP)水平显著下降。因此,研究采用JC-1免疫荧光染色检测线粒体膜电位水平。结果如图4所示,给药组红色荧光随剂量增加明显减弱,绿色荧光则明显增强,说明给药组线粒体膜电位显著下降。实验结果提示,雀梅藤石油醚提取物可能通过损伤线粒体而促进了乳腺癌细胞凋亡。
-
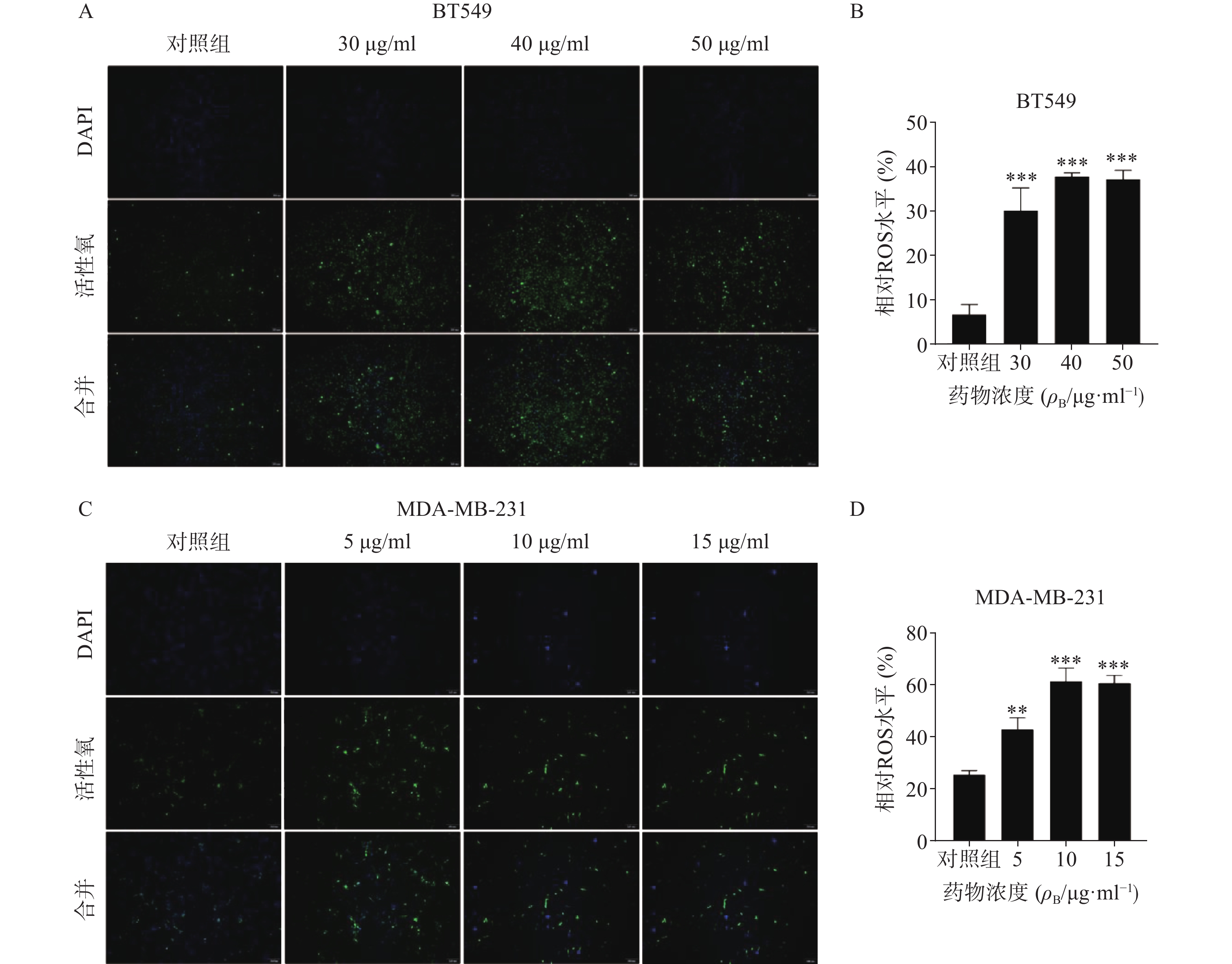
ROS升高是激活线粒体通路诱导肿瘤细胞凋亡的重要原因之一,因此进一步检测了药物处理24 h后ROS含量变化(图5)。结果代表ROS水平的绿色荧光在对照组仅有少量表达,而在给药组则显著增加,经统计学处理有显著性差异,其中尤以BT549细胞株明显,提示药物可能通过促进ROS生成而诱导了乳腺癌细胞凋亡。
-
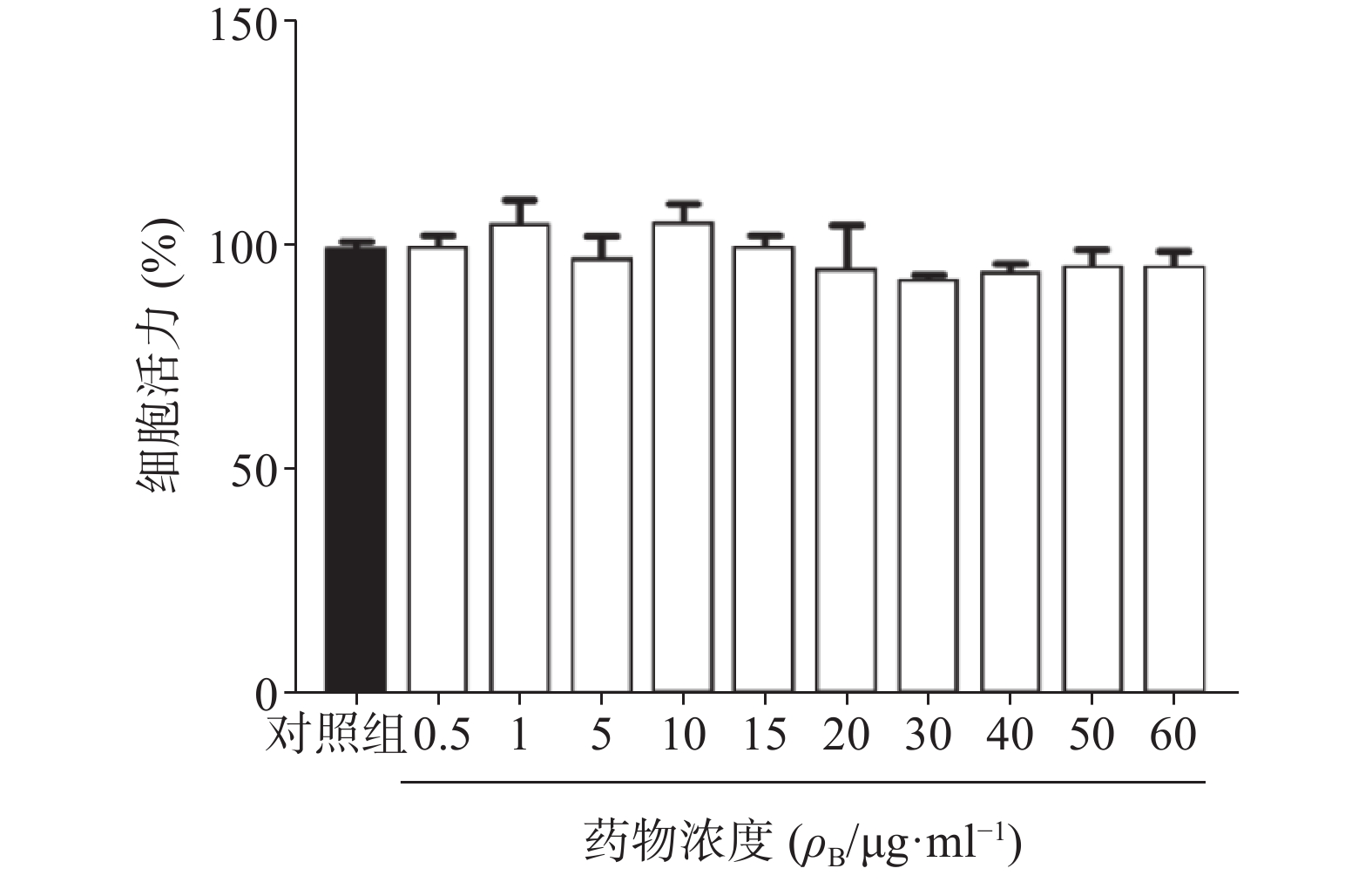
为了确定雀梅藤提取物是否对正常细胞产生毒性,进一步采用同样剂量对人正常脐静脉血管内皮细胞(HUVEC)进行CCK8细胞活力分析。结果提取物孵育24 h后,即使在60 μg/ml的最高浓度下亦未观察到内皮细胞活力受到影响,与对照组比较无明显差异(图6),提示雀梅藤石油醚提取物对正常细胞并不产生毒性,具有较好的安全性。
-
雀梅藤为云南等地民间常用中药,临床观察发现其对乳腺瘤生长有明显抑制作用[7],且毒性较小[4, 8]。研究前期对雀梅藤的乙醇、石油醚、乙酸乙酯、二氯甲烷、正丁醇等5个部位提取物进行了多种肿瘤细胞活性筛选,结果显示,对多数癌细胞,如乳腺癌、结肠癌、肝癌等,都具有明显杀伤作用,其中以石油醚部位提取物对癌细胞作用最为显著。进一步实验发现,雀梅藤石油醚提取物时间和剂量依赖地抑制乳腺癌细胞活力,显著减少细胞克隆形成率,阻滞细胞周期在G1/S期,明显增加癌细胞凋亡率,但并不影响正常血管内皮细胞活力,提示其细胞毒性具有明显的选择性。
引起细胞凋亡的途径包括线粒体通路、死亡受体通路和内质网应激通路,其中线粒体通路是药物诱导肿瘤细胞凋亡的最常见途径[9],因此研究人员进一步观察了雀梅藤石油醚提取物是否通过损伤线粒体诱导乳腺癌细胞凋亡。结果通过JC-1染色发现,两种乳腺癌细胞的线粒体膜电位均显著降低,提示雀梅藤提取物诱导了细胞线粒体途径的凋亡。
ROS的主要来源之一是线粒体内膜的呼吸链底物端,ROS升高会引起线粒体内膜损伤,造成细胞毒性,从而促进肿瘤细胞凋亡[10]。研究人员用荧光探针方法检测雀梅藤石油醚提取物孵育BT549和MDA-MB-231细胞后的ROS水平,结果发现代表ROS的绿色荧光逐渐增强,表明石油醚提取物显著升高了线粒体内ROS水平。这些结果提示,石油醚提取物可能通过升高线粒体内ROS水平,造成ROS累积,损伤了线粒体,导致线粒体内容物如细胞色素c等流出到细胞质,进而激活caspase级联瀑布反应,从而诱导了细胞凋亡[9,11]。
虽然雀梅藤提取物在体外研究中表现出较好的抗乳腺癌细胞生长作用,但是凋亡信号转导通路和作用靶点尚不明确,线粒体中蛋白表达的变化犹未可知,因此具体作用机制尚需进一步研究。此外,已有研究人员从雀梅藤药材中鉴定出43种化学成分,可分为有机酸类、黄酮类及其他类,有机酸类包括儿茶素及其衍生物等,黄酮类包括异槲皮素等[12]。但是雀梅藤提取物中究竟何种成分发挥主要抗癌作用仍需进一步证实。
Induction of apoptosis in triple-negative breast cancer cells by petroleum ether extract of Sageretia thea
-
摘要:
目的 探讨雀梅藤石油醚提取物对乳腺癌细胞增殖和凋亡的影响。 方法 石油醚提取物孵育乳腺癌细胞不同时间后,CCK8法检测细胞活力,平板克隆形成法检测细胞增殖,DAPI染色法观察细胞核形态变化,免疫荧光检测线粒体膜电位和活性氧变化,流式细胞术检测细胞周期和凋亡,CCK8法观察对人正常血管内皮细胞毒性。 结果 雀梅藤石油醚提取物孵育BT549和MDA-MB-231人三阴性乳腺癌细胞株24 h后的IC50分别为45.40 μg/ml和12.23 μg/ml,时间和剂量依赖地抑制乳腺癌细胞活力和克隆形成,诱导细胞凋亡,阻滞细胞周期于G1/S期,降低线粒体膜电位,升高活性氧;对人正常血管内皮细胞无明显毒性作用。 结论 雀梅藤石油醚提取物可能通过升高活性氧,引起线粒体膜电位坍塌,激活线粒体通路诱导细胞凋亡,从而抑制乳腺癌细胞生长,支持其民间抗乳腺肿瘤的应用。 Abstract:Objective To investigate the effect of the petroleum ether extract of Sageretia thea on the proliferation and apoptosis of breast cancer cells. Methods After breast cancer cells were incubated with the petroleum ether extract for different times, cell viability was analyzed by CCK8 assay, cell proliferation was detected by plate cloning test, nuclear morphology was observed by DAPI staining, mitochondrial membrane potential(MMP)and reactive oxygen species(ROS)were determined by immunofluorescence, and the cell cycle and apoptosis were detected by flow cytometry. After incubating with the extract for 24 h, the CCK8 assay was used to observe the toxicity to normal human vascular endothelial cells. Results The IC50 of BT549 and MDA-MB-231 breast cancer cell lines treated with the petroleum ether extract for 24 h were 45.40 μg/ml and 12.23 μg/ml, respectively. The extract time and dose dependently inhibited breast cancer cell viability and clonal formation, induced cell apoptosis and cycle arrest in G1/S phase, decreased MMP and increased ROS levels. There was no toxic effect on normal endothelial cells. Conclusion The petroleum ether extract of Sageretia thea may induce apoptosis by increasing ROS to cause MMP collapse, followed by activating mitochondrial pathway, thereby hindering the growth of breast cancer cells. These results could support the application of Sageretia thea to anti-breast tumor in the folk. -
Key words:
- Sageretia thea /
- Breast cancer /
- Proliferation /
- Apoptosis /
- Mitochondrion /
- ROS
-
清肠栓是由上海市名中医马贵同教授创制的医院制剂。该方基于溃疡性结肠炎“湿热瘀互结肠道”的关键病机,以清热化湿、活血止血立法,在锡类散、青黛散治疗黏膜溃疡的基础上优化筛选而来[1-2]。主要由三七和青黛全粉入药,五倍子和马齿苋经提取后浸膏粉入药,再加入冰片、羊毛脂,以半合成脂肪酸酯为基质制备而成的中药栓剂。
冰片为一种传统中药,清香宣散,具有开窍醒神,清热败毒的功效。现代药理学研究表明,冰片具有镇静安神、醒脑、促透、抗菌、抗炎等作用[3]。冰片常被用于肛肠外科,可避免药物的首过效应,提高药物有效性。冰片能开放并透过血脑屏障,有助于其他药物通过血脑屏障,促进疗效[4]。
冰片具有挥发性,龙脑常被作为其主要的质量控制指标,含量测定方法主要包括气相色谱法、衍生化高效液相色谱法、薄层色谱法等[5]。2020年版《中国药典》中,采用气相色谱法测定,冰片含龙脑成分不得少于55.0%,樟脑不得超过0.50%[6]。 目前,已有文献对清肠栓中三七皂苷、人参皂苷、没食子酸、靛蓝和靛玉红进行含量测定[7-8],故本实验采用气相色谱法对清肠栓中冰片含量进行测定,并计算龙脑、异龙脑的相对含量,为进一步提高清肠栓的质量控制提供有效依据。
1. 材料
1.1 仪器
7820A型气相色谱仪、氢火焰离子化检测(FID)(美Agilent 公司);225D-1CN型电子分析天平、BSA124S型电子分析天平(赛多利斯科学仪器有限公司,精度:十万分之一);S450H型超声波清洗器(德国Elma)。
1.2 试药
清肠栓为院内制剂室提供(批号:210420-210425、211018、211020、211022、211025、190107、190114、190121、190304、190311、190318、190408、190415、190422、190506、190513和200302);樟脑对照品(上海诗丹德标准技术服务有限公司,批号:2814,纯度:95.0%);龙脑对照品(中国食品药品检定研究院,批号:110881-201709,纯度:99.6%);异龙脑对照品(中国食品药品检定研究院,批号:111512-201904,纯度:98.4%);水为超纯水(实验室自制);乙酸乙酯(上海凌峰化学试剂有限公司,分析纯)。
2. 方法与结果
2.1 色谱条件
采用Agilent7890A型气相色谱仪FID检测器;DIKMA DM-Wax聚乙二醇20000(PEG-20M)毛细管色谱柱(30 m×0.25 mm×0.25 µm);进样口温度为250 ℃;检测器(FID)温度为250 ℃;柱温140 ℃;空气流速为450 ml/min,氢气燃气流速为50 ml/min;尾吹气为25 ml/min;分流比为20:1,进样量为1 µl。理论板数按龙脑峰计算应不低于2 000。
2.2 对照品溶液的制备
称取樟脑对照品适量,精密称定,加乙酸乙酯溶解,制成每1 ml含樟脑0.1 mg的对照品溶液。另取龙脑、异龙脑对照品适量,精密称定,加乙酸乙酯溶解,制成每1 ml含龙脑0.3 mg、异龙脑0.2 mg的混合对照品溶液。
2.3 供试品溶液的制备
取清肠栓(批号:200302)样品10粒,研细,取约60 mg,精密称定,置10 ml量瓶中,加乙酸乙酯8 ml,超声(频率37 kHz,功率800 w)处理30 min,放冷,加乙酸乙酯至刻度,摇匀,滤过,取续滤液,即得。
2.4 阴性对照溶液的制备
按清肠栓制剂处方比例,配制缺冰片的阴性样品,再按供试品溶液制备方法制备,即得。
2.5 方法学验证
2.5.1 专属性试验
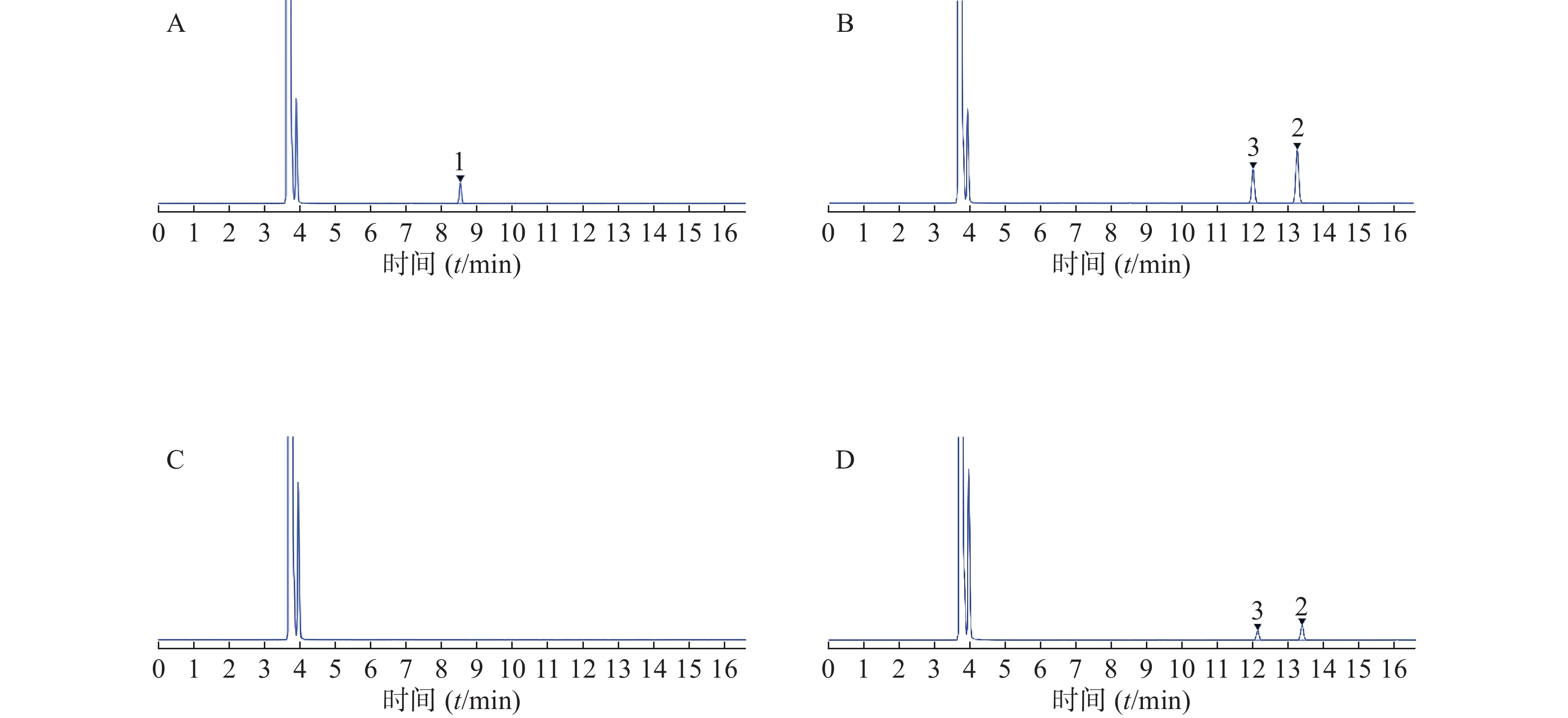
精密吸取樟脑对照品溶液、龙脑和异龙脑对照品溶液、供试品溶液、阴性对照溶液各1 µl,按“2.1”项色谱条件下方法分别进样测定,结果樟脑、异龙脑和龙脑对照品的理论板数分别为88 684、107 331、108 387,远大于规定的2 000。供试品溶液色谱图中,未检出与樟脑对照品溶液保留时间相同的色谱峰,阴性对照溶液色谱图中在与龙脑、异龙脑相同保留时间处无干扰峰,表明该方法专属性良好。色谱图见图1。
2.5.2 线性关系
分别精密称取龙脑对照品14.92 mg、异龙脑对照品10.25 mg、樟脑对照品4.83 mg,置同一10 ml量瓶中,加乙酸乙酯溶解并稀释至刻度,摇匀,制成每1 ml含龙脑1.492 mg、异龙脑1.025 mg、樟脑0.483 mg的混合对照品溶液,作为贮备液。
精密吸取5份贮备液各1 ml,加乙酸乙酯分别稀释50倍、20倍、5倍、2倍、1倍;分别精密吸取5个不同浓度的龙脑、异龙脑、樟脑混合对照品溶液,分别进样1 µl,按按“2.1 色谱条件”项下的方法测定,以进样浓度(X)为横坐标,峰面积(Y)为纵坐标,绘制标准曲线,求得回归方程分别为:Y1=283.4X1+1.320(r=1.000,n=5);Y2=283.5X2+0.8597(r=1.000,n=5);Y3=276.9X3+0.5444(r=1.000,n=5)。线性范围分别为 0.0299~1.497µg、 0.0205~1.025µg、 0.0097~0.4830µg。
2.5.3 精密度试验
精密吸取“2.2”项下对照品溶液,按“2.1 ”项的方法测定,重复进样6次,测定峰面积。结果龙脑、异龙脑、樟脑峰面积RSD分别为0.3%、0.4%、0.6%(n=6),表明仪器精密度良好。
2.5.4 稳定性试验
精密吸取同一供试品溶液(批号:200302),室温下分别放置0、4、8、12、16、20、24 h,按“2.1 色谱条件”项下的方法测定,记录峰面积。结果樟脑未检出,龙脑与异龙脑峰面积的RSD分别为1.6%和1.5%,表明供试品溶液在室温下放置24h稳定。
2.5.5 重复性试验
精密称取清肠栓样品粉末60 mg(批号:200302),精密称定,平行称取6份,按“2.3供试品溶液的制备”项下制备供试品溶液,按“2.1”项方法测定,结果均未检出樟脑,龙脑和异龙脑平均含量的RSD分别为0.8%和1.1%(n=6),表明该方法的重复性良好。
2.5.6 加样回收率试验
称取清肠栓样品粉末30 mg(批号:200302),精密称定,平行称取6份,分别精密加入龙脑、异龙脑、樟脑对照品溶液,按“2.3” 项方法制备供试品溶液,按“2.1”项方法测定,记录峰面积,并计算加样回收率。结果见表1。
表 1 龙脑回收率试验(n=6)成分 原有量(mg) 加入量
(mg)测得量
(mg)回收率
(%)平均回收率
(%)RSD
(%)龙脑 0.47 0.50 0.97 100.8 101.0 0.51 0.48 0.50 0.98 101.6 0.47 0.50 0.97 101.2 0.47 0.50 0.97 100.8 0.47 0.50 0.97 100.2 0.47 0.50 0.97 101.4 异龙脑 0.28 0.29 0.58 102.8 102.5 1.66 0.28 0.29 0.59 104.5 0.28 0.29 0.58 104.2 0.28 0.29 0.57 100.4 0.28 0.29 0.58 102.1 0.28 0.29 0.57 100.8 樟脑 0.00 0.13 0.12 97.06 99.69 3.77 0.00 0.13 0.12 93.91 0.00 0.13 0.13 102.6 0.00 0.13 0.13 99.43 0.00 0.13 0.13 104.2 0.00 0.13 0.13 101.0 2.6 样品含量测定
取清肠栓制剂2019、2021年共20个批次的样品,按“2.3”项方法制备供试品溶液,再按“2.1”项方法测定,20个批次均未检出樟脑。样品中龙脑和异龙脑含量见表2(表中1~10为2019年样品,11~20为2021年样品)。
表 2 清肠栓样品含量实验样品序号 龙脑(mg/g) 异龙脑(mg/g) 冰片(mg/g) 1 14.23 8.509 22.74 2 14.19 8.564 22.76 3 14.38 8.665 23.05 4 14.26 8.569 22.83 5 14.28 8.511 22.79 6 14.21 8.571 22.78 7 14.24 8.446 22.68 8 14.41 8.632 23.04 9 14.13 8.329 22.46 10 13.89 8.401 22.29 11 18.76 11.35 30.11 12 18.60 11.20 29.80 13 18.93 11.39 30.32 14 19.03 11.37 30.40 15 18.65 11.26 29.91 16 18.82 11.38 30.19 17 18.89 11.35 30.24 18 18.74 11.28 30.02 19 18.94 11.35 30.29 20 18.88 11.39 30.27 3. 讨论
3.1 提取方式的考察
乙酸乙酯对冰片具有较好的溶解性,并且样品中其他干扰成分的溶出较少,故选择其作为提取溶剂。本实验考察了不同提取时间(15 min、30 min、45 min)对样品提取效果的影响,观察比较不同条件处理后供试品溶液色谱情况,根据含量结果选择提取时间为30 min。最终以乙酸乙酯为提取溶剂,超声处理30 min作为供试品制备时的提取方式。
3.2 色谱条件的选择
柱温的选择:由于2020年版《中国药典》中冰片含量测定选择的注温为140 ℃,而查阅文献,部分实验者选择的柱温为160 ℃[9],因此,我们分别选择140 ℃和160 ℃进行试验,根据出峰时间及峰形比较,最终选择140 ℃作为实验条件。色谱柱的选择:实验研究使用的两种色谱柱分别为DIKMA DM-Wax(PEG-20M)毛细管色谱柱(30 m×0.25 mm,0.25 µm);Agilent HP-INNOWAX(PEG-20M)毛细管色谱柱(30 m×0.25 mm,0.25 µm),比较两种色谱柱的塔板数,实验显示色谱峰分离度良好,说明色谱柱对样品的测定结果影响较小,此方法具有普遍性,故最终选择本实验室常用的DIKMA DM-Wax色谱柱。樟脑检出限和定量限确定:检测限及定量限采用信噪比法确认,当信噪比(S/N)为3∶1时,樟脑检出限为1.4 μg/g;当信噪比(S/N)为10∶1时,其定量限为4.6 μg/g。
3.3 检测指标的选择
2020年版《中国药典》中,冰片的描述为冰片(合成龙脑),其中对樟脑的检测要求为不得超过0.50%。本次实验,通过查阅文献,参考其它含冰片制剂中对樟脑残留的检测方法[10],对清肠栓样品进行樟脑含量测定,发现成品栓剂中均未检测到樟脑,证明我院制剂室所用冰片符合药典的相关规定。
2020年版《中国药典》是以龙脑作为冰片的含量测定指标,但通过查阅文献可知,近年对冰片的含量测定中,多以龙脑与异龙脑总量来计算冰片的含量,[11-14]。考虑到本次实验是完善清肠栓的内控标准,提高制剂的稳定性,故本实验以龙脑和异龙脑的总量来计算冰片的含量。
综上所述,本方法为冰片中龙脑、异龙脑的含量测定和樟脑限度检查制定提供参考,操作简单、重复性良好、结果准确,可用于清肠栓中冰片的质量控制。
-
-
[1] 沈丕安. 中华本草[M]. 上海: 上海科学普及出版社, 2017. [2] 马雯芳. 瑶药倒丁风化学成分及质量控制研究[D]. 成都: 成都中医药大学, 2014. [3] 苗明三, 孙玉信, 王晓田. 中药大辞典[M]. 太原: 山西科学技术出版社, 2017. [4] 张美义, 篮振水, 周俊, 等. 云南民间抗肿瘤植物雀梅藤的化学和药理研究[J]. 云南植物研究, 1980, 2(1):62-66. [5] KIM H N, PARK G H, PARK S B, et al. Extracts from Sageretia thea reduce cell viability through inducing cyclin D1 proteasomal degradation and HO-1 expression in human colorectal cancer cells[J]. BMC Complement Altern Med, 2019, 19(1):43. doi: 10.1186/s12906-019-2453-4 [6] 丁永丽, 邓杨林, 陈新利, 等. 雀梅藤药用研究进展[J]. 中药材, 2020, 43(7):1755-1760. [7] 万嘉锺. 雀梅藤治疗甲状腺囊肿、乳腺瘤20例疗效观察[J]. 云南中医学院学报, 1982, 5(1):14-15. [8] 王茂三, 龚维桂, 范华芬, 等. 雀梅藤护肝作用研究[J]. 浙江药学, 1985, 2(5):11-14. [9] AN P, LU D, ZHANG L J, et al. Synergistic antitumor effects of compound-composed optimal formula from Aidi injection on hepatocellular carcinoma and colorectal cancer[J]. Phytomedicine, 2022, 103:154231. doi: 10.1016/j.phymed.2022.154231 [10] 郭晓萌, 魏婷, 张焱. 黑参皂苷的提取纯化及其对MGC-803细胞凋亡的影响[J]. 食品研究与开发, 2023, 44(4):49-57. [11] DENG Y Q, GAO M, LU D, et al. Compound-composed Chinese medicine of Huachansu triggers apoptosis of gastric cancer cells through increase of reactive oxygen species levels and suppression of proteasome activities[J]. Phytomedicine, 2024, 123:155169. doi: 10.1016/j.phymed.2023.155169 [12] 蒙雪雁, 王成海. 基于液质联用技术分析雀梅藤化学成分[J]. 中南农业科技, 2023, 44(3):37-41,55. -





 下载:
下载:
 下载:
下载: