-
烟酰胺腺嘌呤二核苷酸(NAD+)是一种重要的代谢产物,其参与许多生化过程,如能量代谢、基因表达调控、DNA修复等[1, 2]。人体皮肤、血液、肝脏、肌肉和大脑中的NAD+浓度会随着年龄的增长而降低,因此,增强NAD+可能在缓解相关的细胞功能和整体健康受损方面发挥关键作用[3]。烟酰胺单核苷酸(NMN)是NAD+生物合成的前体。体内外研究表明,补充NMN可以提高NAD+水平[4]。NMN可以缓解各种心脑血管疾病的发展,包括中风[5]、心力衰竭[6]和心肌缺血等[7]。此外,NMN还与改善线粒体功能和潜在的抗衰老益处有关[8]。几项临床试验探索了NMN补充剂的有效性和安全性(标识号:NCT04228640[9],NCT04823260[10],UMIN000036321[11])[8],证明了其对心血管保护的潜力。然而,NMN的研究仍然缺乏大规模可靠的人体试验数据,特别是关于其治疗高血压等特定疾病的疗效问题。虽然早期研究显示了一些有希望的结果,但需要更广泛的基础研究和临床试验来证实其在不同患者群体中的疗效和安全性。
高血压是一系列健康问题的重要危险因素,包括心脏、肾脏疾病以及中风等脑血管疾病[12],影响着全世界数百万人[13]。高血压的危险在于,随着时间的推移会导致靶器官损伤,发生如动脉粥样硬化、肾功能衰竭、心力衰竭和中风等疾病。高血压的发生与衰老和肥胖等因素有关,而这两者都源自于NAD+缺乏。因此,NAD+已成为高血压的潜在治疗靶点。
目前关于NMN对高血压的影响研究相对有限。只有一项临床前实验表明NMN可以降低血管紧张素II(Ang II)诱导的高血压小鼠的血压[14]。另有一项临床研究表明,补充NMN可以降低高血压患者的血压(标识号:NCT04903210[14])。然而,目前的证据不足以将NMN开发为抗高血压药物,特别是其缺乏较为全面的临床前药效评价。因此需要更严格的研究来确定NMN是否能作为高血压治疗药物。自发性高血压大鼠(SHR)是一种遗传性高血压模型动物,常用于评估抗高血压药物[15-17]。双肾双夹(2K2C)大鼠是一种实验性易卒中肾血管性高血压模型动物,这些大鼠在术后2周内100%发生高血压[15, 16],也常用于评估抗高血压药物。本次研究中,我们采用单次胃瘘给药和长期药物饲料喂养方式给予受试大鼠NMN治疗,观察NMN对原发性和继发性高血压大鼠模型的血压和器官损伤的影响。此外,我们还观察了终身给药NMN对2K2C大鼠模型死亡率和寿命的影响[15]。
-
Sprague-Dawley(SD)雄性大鼠(160~180 g)购于上海必凯科翼生物科技有限公司。2K2C大鼠由SD大鼠双侧肾动脉嵌套0.2 mm内径的U型银夹制作而成。雄性SHR(250~290 g)购于北京维通利华实验动物技术有限公司。
所有大鼠均饲养于独立通气笼盒(IVC)系统中,饲养温度为24±2°C,相对湿度为40%~60%,照明时间为8:00~20:00,自由饮食和饮水(特定情况除外)。本实验研究严格遵守实验动物福利等伦理原则。
-
NMN(批号2021046B)由尚科生物医药(上海)有限公司提供,氯沙坦钾(Losartan)(批号LOSB-4-06210326)由浙江美诺华药业股份有限公司提供,戊巴比妥钠购于德国Merck公司,注射用青霉素钠购于山东鲁抗医药股份有限公司,肝素钠(批号H3v60)购于上海博光生物科技有限公司,EVG弹力纤维染色试剂盒购于北京索莱宝科技有限公司。
U型银夹(0.2 mm内径)、血压与心率分析系统(型号MPA-HBBS)购于上海奥尔科特生物科技有限公司,聚乙烯导管购于法国Biotrol公司。
-
NMN单次给药治疗研究:包括SHR和2K2C大鼠两种模型,在各自模型实验中,大鼠均被随机分配为对照组(蒸馏水)和NMN给药组(200 mg/kg),并通过胃瘘导管给药。
NMN长期给药(4周)治疗研究:包括SHR和2K2C大鼠两种模型,在各自模型实验中,大鼠均被随机分配为对照组(普通饲料)和NMN给药组[药物饲料,等效NMN剂量200 mg/(kg·d)]。
生存时间观察研究:采用2K2C大鼠模型,实验包括假手术组(正常SD大鼠,普通饲料)和2K2C造模组,2K2C造模组大鼠再被随机分为模型组(普通饲料)、氯沙坦给药组[药物饲料,等效剂量20 mg/(kg·d)]和NMN给药组[药物饲料,等效剂量200 mg/(kg·d)]。
-
2K2C模型是通过在正常SD大鼠的两个肾动脉上放置0.2 mm尺寸的银夹后造成的高血压模型,参考本教研室文献及方案[16,17]。简言之,SD大鼠用2%戊巴比妥钠(40 mg/kg)麻醉,腹部切口,轻轻翻转肾脏,游离出肾动脉后放上内径为0.2 mm的U形银夹。在另一侧肾脏重复相同步骤。小心复位肾脏和周围组织。假手术的大鼠进行相同的操作至游离血管步骤,但不放置U形银夹。以上步骤完成后,滴加青霉素,缝合。然后将大鼠放在电热毯上,苏醒后送回IVC系统笼。
-
用2%戊巴比妥钠(40 mg/kg)麻醉大鼠,腹部区域脱毛并消毒,自剑突下沿腹部中间切口2 cm,使用无菌棉签将胃轻轻拉出,于近幽门段并且避开血管作荷包预缝合,预留区域内戳出小孔,迅速将胃瘘导管缠有胶布端插入胃内,拉紧预缝合线固定导管,经背部皮下牵引至颈后穿出并固定。随后,将胃瘘导管以大鼠马甲方式固定于背部防止动物清醒后抓咬。手术完成后,动物于电热毯上保温至复苏。
-
参考本教研室文献及方案[15, 16],用2%戊巴比妥钠(40 mg/kg)麻醉大鼠,左侧腹股沟区域脱毛并消毒,并沿股动脉方向切开皮肤,暴露股动脉。游离出一段股动脉,插入特制的PE测压导管,导管前端依次穿行过股动脉、髂总动脉并最后进入腹主动脉,此时测得血压为腹主动脉血压,导管的另一端沿皮下穿行至颈部背侧皮肤后穿出,用自制马甲固定,缝合伤口。术后,大鼠饲养于测量系统笼里适应环境,自由饮食和饮水。24 h后,测压导管连接压力传感器,经MPA-HBBS数据分析系统处理后将压力信号转化为血压波形显示在电脑屏幕上。同时以0.3 ml/h的速率连续输注25 U/ml肝素钠,以防止测压过程中凝血。
NMN单次给药实验中,大鼠股动脉插管手术后次日上午9:00开启测量系统,连续记录血压和心率信号。12:00,通过胃管给予相应的药物(NMN或蒸馏水)。连续记录24 h血压和心率变化(取给药前1 h的数据作为基础血压和心率)。NMN长期给药实验中,NMN给药组和对照组的大鼠同样使用上述方法进行血压和心率测量,并连续记录2 h。
-
在完成血压和心率测量后,大鼠再次麻醉并迅速打开胸腔,用4 ℃预冷的生理盐水对大鼠进行心脏灌注。取出脑、肝脏、心脏、肾脏和主动脉(从左锁骨下动脉分支到横膈膜段),测量器官重量,以及主动脉长度、左心室壁厚度、肾皮质和髓质厚度。随后,将脑、心脏、主动脉、和肾脏用4%多聚甲醛固定,并进行病理形态学分析,包括EVG、苏木素-伊红(HE)和Masson染色[18]。
-
所有实验数据均以“均值±标准误(mean±SEM)”表示。使用GraphPad Prism 10软件进行统计分析。使用非配对Student-t检验进行组间比较,生存曲线使用Log-rank检验分析。以P<0.05为具有统计学差异。
-
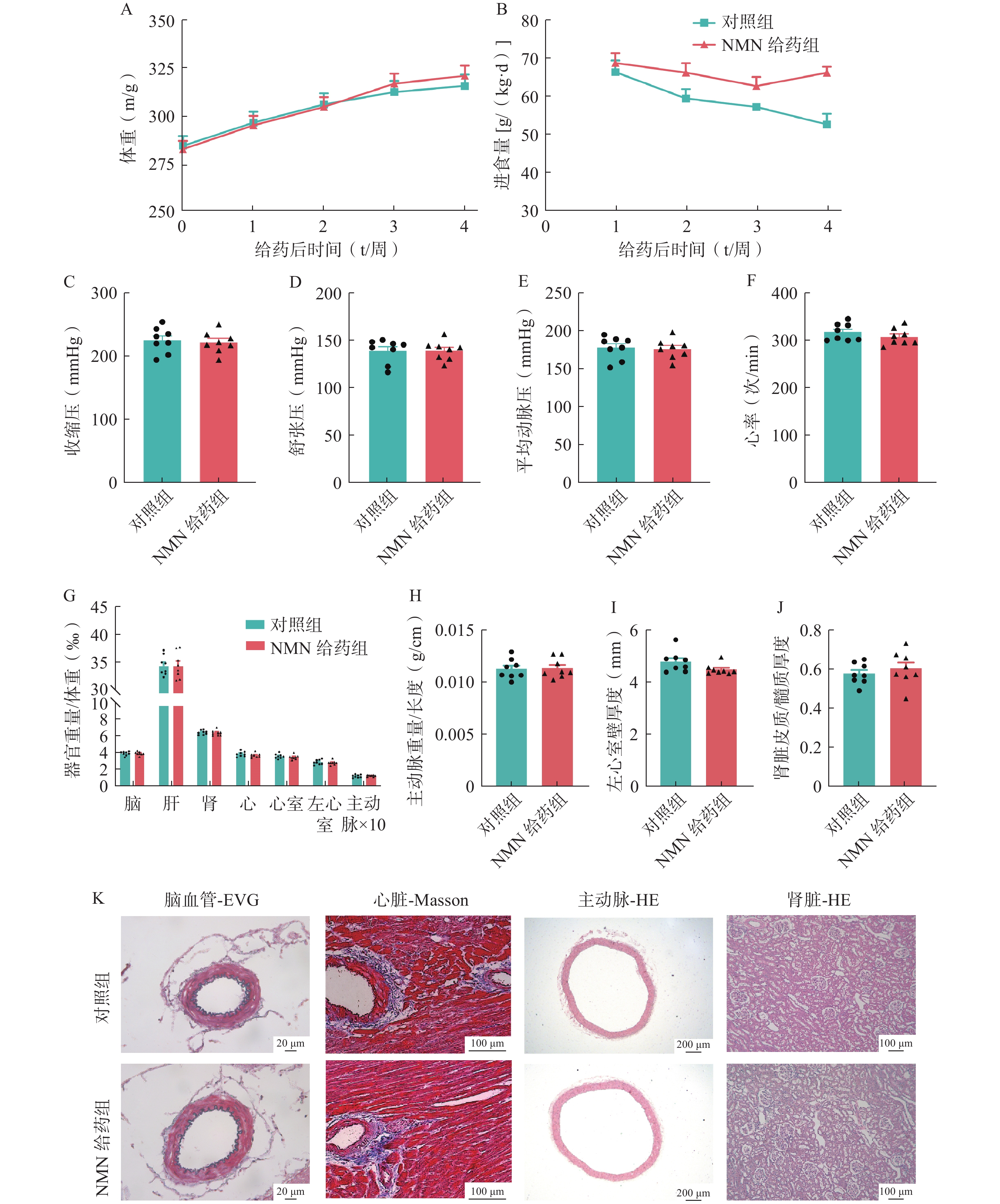
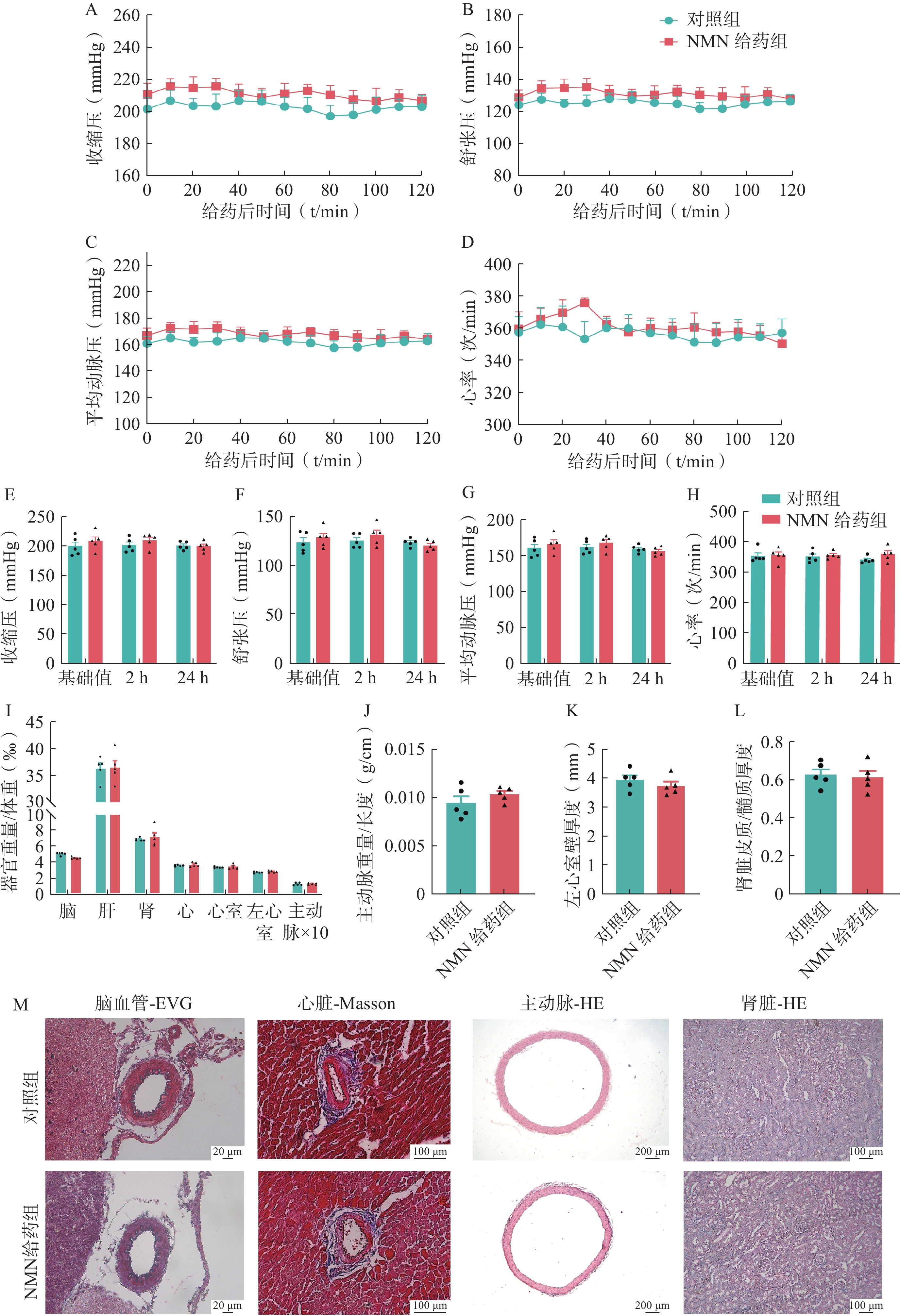
SHR是一种原发性高血压大鼠模型,单次给予200 mg/kg NMN后,2 h内,NMN给药组和溶剂对照组的收缩压、舒张压、平均动脉压或心率没有显著差异(图1:A-D)。对NMN给药后2 h和24 h内的区间血压进行测量分析,两组的收缩压、舒张压、平均动脉压或心率均值也没有显著差异(图1:E-H)。
高血压还可导致心室肥大、主动脉增厚、肾脏皮质萎缩等靶器官损伤。进一步比较两组大鼠的器官损伤程度,与溶剂对照组相比,NMN给药组的脑、肝、肾、心脏、心室、左心室和主动脉的器官相对重量没有显著变化(图1:I)。同时,两组在主动脉重量与长度比、左心室壁厚度和肾皮质与髓质厚度比方面也没有显著差异(图1:J-L)。
对脑血管进行EVG染色,两组大鼠的弹力纤维均清晰、完整,没有发生显著的病理损伤;对心脏进行Masson染色,也没有发现NMN可以改善血管周围的胶原纤维分布;对主动脉和肾脏进行HE染色,同样没有发现NMN减轻主动脉厚度或改善肾小球萎缩等病变(图1:M)。这些结果表明,在SHR模型中,单次给药NMN对血压或器官保护方面没有治疗作用。
-
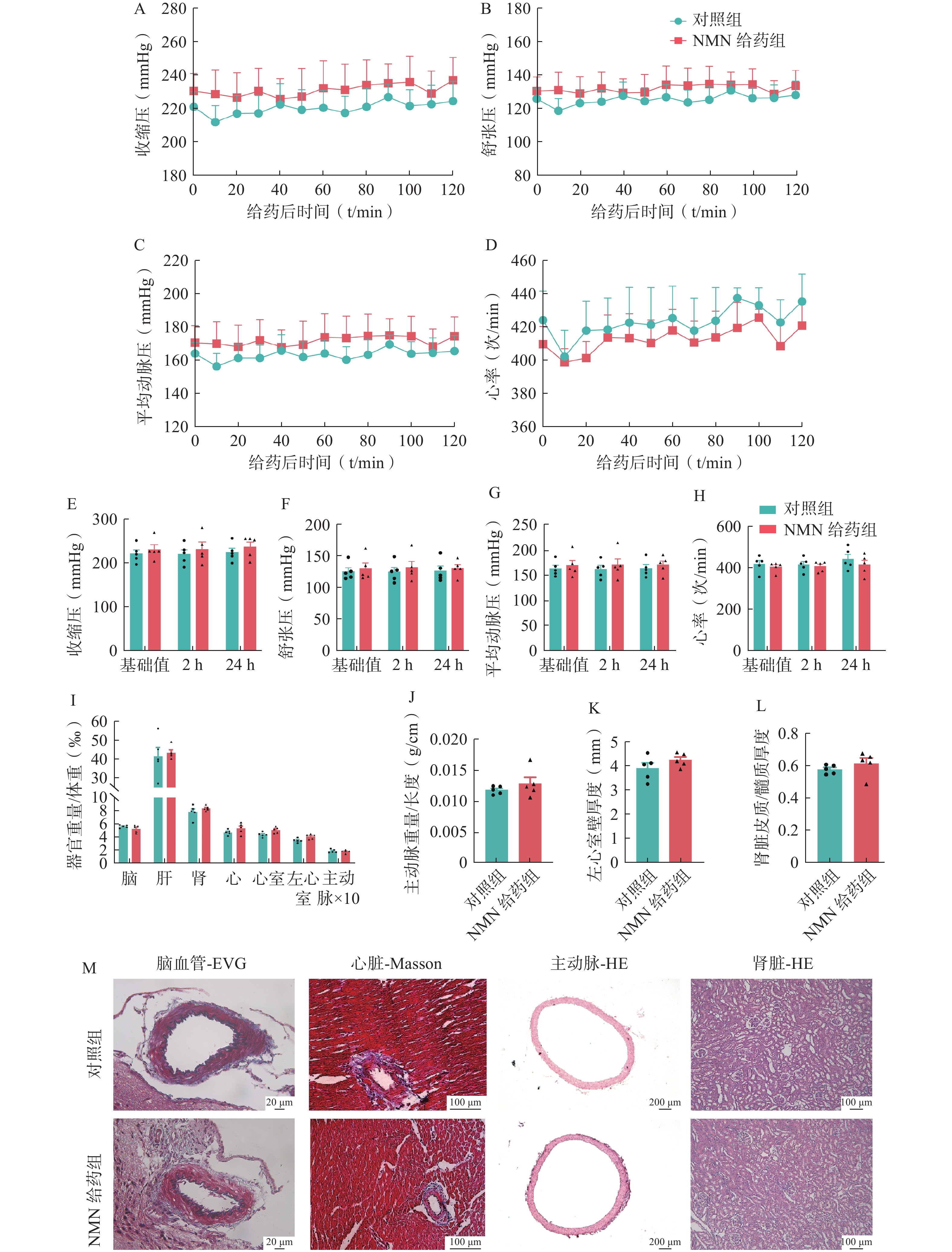
高血压是一种慢性疾病,进一步在SHR模型上长期给予NMN药物饲料喂养4周,等效剂量为200 mg/(kg·d),以评估其对血压和器官损伤的影响。与对照组相比,长期NMN药物饲料治疗组的大鼠体重没有显著变化,但第4周时,NMN给药组大鼠的进食量显著增加(图2:A-B)。NMN药物饲料喂养4周后,对照组和NMN给药组的收缩压、舒张压、平均动脉压或心率均没有显著差异(图2:C-F)。
比较两组大鼠的器官损伤程度,与NMN单次给药治疗的结果相似,NMN药物饲料治疗4周依然没有显著的靶器官保护作用(图2:G-K)。这些结果表明,在SHR模型中,NMN长期给药也没有降低血压或器官保护作用。
-
2K2C大鼠模型是继发性高血压的实验室模型,通过2K2C手术造模后,大鼠血压明显升高[16],进一步研究了在2K2C大鼠模型中单次给药200 mg/kg NMN的治疗效果。与SHR模型中观察到的结果一致,与对照组相比,单次给药NMN后2 h或24 h内对血压和心率没有影响(图3:A-H)。2K2C大鼠单次服用NMN后,脑、心脏、肾脏和主动脉等组织的形态学评估和病理染色也没有显示出任何器官保护作用(图3:I-M)。这些结果表明,在2K2C模型中,单次给药NMN对血压或器官保护方面也没有显著影响。
-
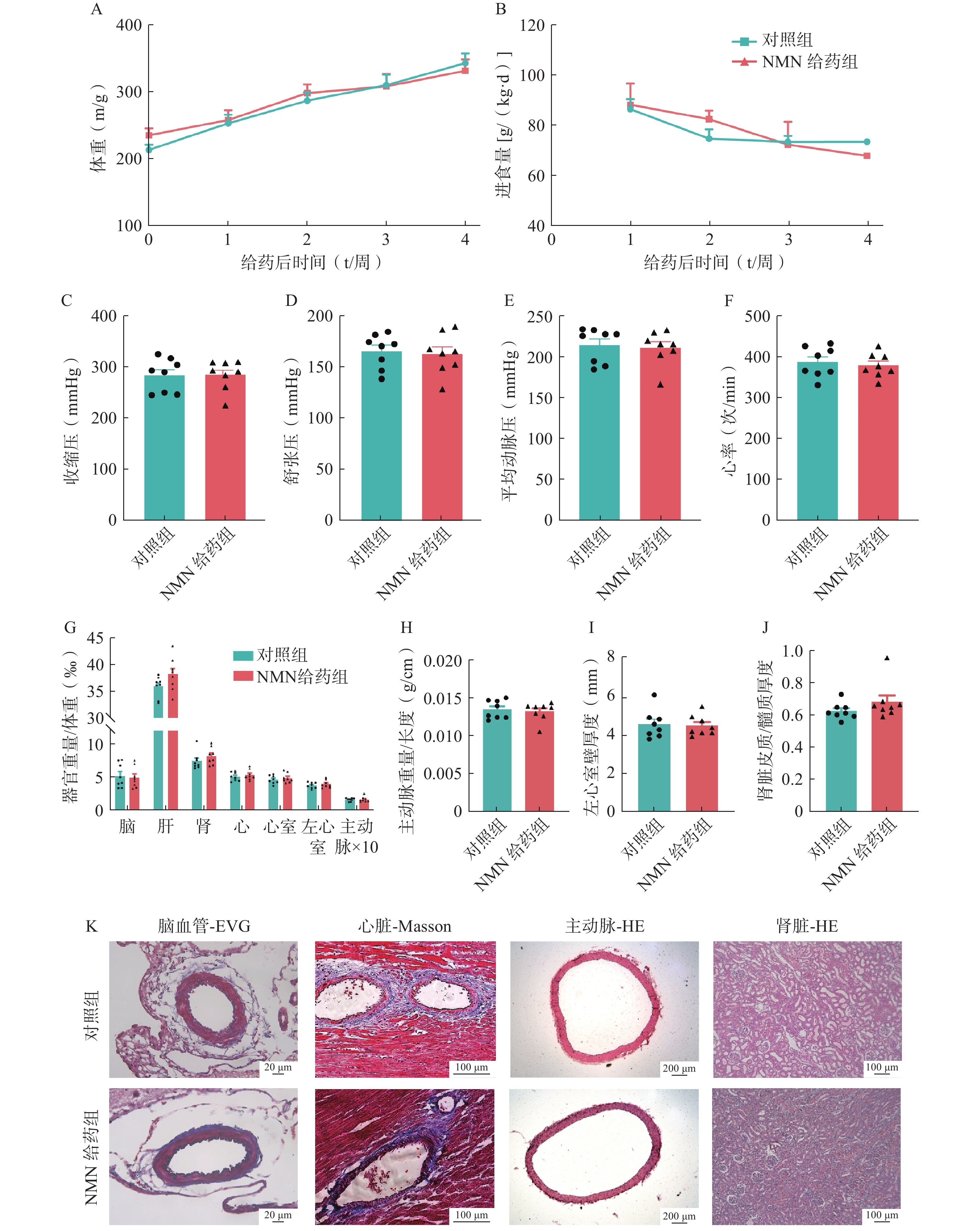
在2K2C模型中长期给予NMN 200 mg/(kg·d),与对照组相比,长期NMN治疗组的体重没有显著变化,尽管第4周的进食量明显减少(图4:A-B)。连续给予NMN 4周后,测量两组大鼠的收缩压、舒张压、平均动脉压或心率,没有观察到显著差异(图4:C-F)。形态学评估,包括脑、肝、肾、心脏、心室、左心室和主动脉的相对器官重量;主动脉重量与长度比;左心室壁厚度、和肾皮质与髓质厚度比;结合EVG、Masson和HE染色,两组之间没有显著差异(图4:G-K)。这些结果表明,在2K2C模型中,长期给药NMN对血压或器官保护也没有显著影响。
-
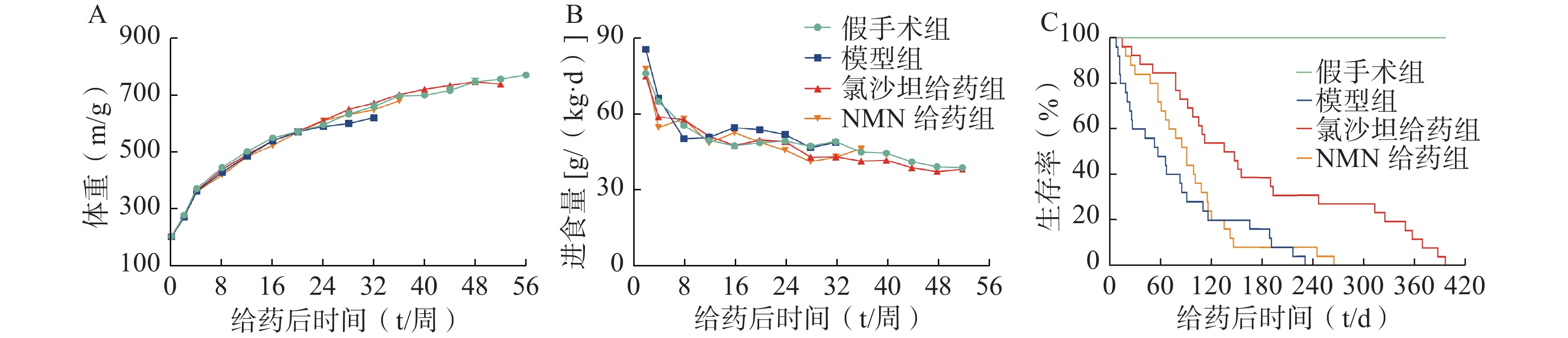
NMN在多种病理生理过程中起着重要作用[10]。进一步考察终身服用NMN是否可以延长2K2C高血压大鼠的存活时间。治疗期间,各组大鼠的体重或进食量没有显著差异(图5:A-B)。与假手术组相比,2K2C模型大鼠的存活时间显著减少,经氯沙坦治疗后,2K2C大鼠的存活时间显著延长。而NMN治疗的2K2C大鼠生存曲线与模型组没有显著差异(图5C)。以上结果表明,在2K2C模型中,NMN没有延长高血压大鼠存活时间的作用。
-
本研究使用两种成熟的高血压大鼠模型:SHR和2K2C大鼠模型,探讨了NMN对高血压的可能影响。研究结果表明,在上述模型中,单次或长期NMN治疗均未显示出显著的抗高血压和保护器官损伤作用,也没有延长生存时间的作用。
高血压对健康存在重大威胁,会导致严重的并发症,如心脏疾病、中风和慢性肾病等。抗高血压治疗在高血压的管理中至关重要。氯沙坦是一种经典的抗高血压药物,能够特异性拮抗血管紧张素II的AT1型受体,并在2K2C和易卒中自发性高血压大鼠(SHR-SP)模型中被证明存在降低血压,减轻器官损伤,延长存活时间的作用[15, 19]。因此,我们选择氯沙坦作为阳性对照药物,它显著延长了高血压大鼠的存活时间。相比之下,NMN并没有延长高血压大鼠的存活时间。此外,在2K2C大鼠和SHR模型中,无论是单次治疗还是长期治疗,NMN对高血压和器官损伤都没有影响。
在最近的一项研究中,在AngⅡ诱导的高血压小鼠模型中证明了NMN有抗高血压和器官保护作用[14]。有几个因素可能导致我们的发现与该团队的发现之间存在差异,如动物模型、给药方案、NMN给药时间和血压测量方法的变化,特别是所用模型之间的差异,SHR和2K2C大鼠模型更广泛地用于评估抗高血压药物的效果。我们使用了与该团队近似的药物剂量进行单次和长期给药来评估NMN药效,但该团队只研究了长期给药。此外,实验动物的血压测量方法可能是观察到结果差异的重要原因。在本研究中,我们采用更为准确的清醒自由活动大鼠血压测定方法,而该团队采用了非侵入性尾套法。总的来说,我们直接评估了NMN对SHR和2K2C大鼠经典高血压模型中高血压和器官损伤的影响,发现NMN对高血压大鼠的血压和器官损伤没有治疗作用。
同时,氯沙坦的降血压作用已多次被我们证实,例如,在2K2C模型上,长期给药氯沙坦4周,收缩压降低约40 mmHg[15],并且氯沙坦的降压作用被国内外广泛证明。因此研究NMN治疗对血压的影响实验中,不设氯沙坦阳性药对照组。而前期我们未证明过氯沙坦对大鼠寿命的影响,因此选择氯沙坦作为阳性对照药物,发现它显著延长了高血压大鼠的存活时间。
关于文中NMN剂量的选择,目前,NMN在各种人群中通常用作营养保健品,剂量范围为50~150 mg/d[20]。小鼠常用NMN剂量为300 mg/kg,对应大鼠剂量约为200 mg/kg,对应人(70 kg)剂量为33 mg/kg;临床试验剂量最大一般设为900 mg/d[21],因此,上述剂量已是较大剂量,若再尝试加大剂量没有实际应用价值,故未设计再高剂量组。
综上,本研究评估了单次和长期NMN治疗对SHR和2K2C大鼠模型中高血压和器官损伤的影响。结果表明,NMN对高血压大鼠的血压、器官损伤和寿命均没有影响,这些发现为NMN的未来临床研究提供了有价值的见解和参考。
The effects of nicotinamide mononucleotide on hypertensive rats
-
摘要:
目的 探讨烟酰胺单核苷酸(NMN)口服给药对高血压大鼠是否具有治疗作用。 方法 采用两种大鼠高血压模型:自发性高血压大鼠(SHR)和双肾双夹(2K2C)易卒中肾血管性高血压大鼠,分别单次、长期或终身给予NMN。通过观察高血压大鼠的血压变化、靶器官损伤程度和生存时间,评估NMN的降血压作用。 结果 NMN没有降低高血压大鼠的血压水平、减轻器官损伤以及延长存活时间的作用。 结论 NMN口服给药对高血压大鼠没有降压作用,为未来NMN的临床研究提供有价值的见解。 Abstract:Objective To exploring the effects of nicotinamide mononucleotide (NMN) on hypertensive rats. Methods Two rat hypertension models including hypertensive rats(SHR)and two-kidney two-clip (2K2C) rats were used to be given single, long-term or lifelong administration of NMN respectively. NMN’s effects were assessed comprehensively by monitoring survival time, blood pressure levels, and the extent of organ damage in hypertensive model rats. Results It was revealed that NMN did not exhibit protective effects in terms of lowering blood pressure levels, reducing organ damage or increasing survival time in hypertensive rats. Conclusion This study suggested that NMN did not demonstrate antihypertensive effects in rat hypertension models and may provide valuable insights for future clinical observation on NMN. -
Key words:
- NMN /
- hypertension /
- rat hypertension models /
- organ damage /
- lifespan
-
氯吡格雷是一种前药,其代谢产物是血小板聚集抑制剂,可以选择性地抑制二磷酸腺苷(ADP)与其血小板P2Y12受体的结合及继发的ADP介导的糖蛋白GPⅡb/Ⅲa复合物的活化。它是经皮冠状动脉介入治疗(PCI)术后治疗方案中的主要药物,可以改善疾病的预后,预防支架内再狭窄[1]。但氯吡格雷作为前药,需要经肝药酶代谢为活性产物才能发挥药效。此外,还有其他因素会影响氯吡格雷的血药浓度和临床疗效,包括基因多态性,生理状况,肝肾功能、合用药物以及年龄等[2]。研究表明,主要是编码CYP2C19酶的等位基因突变会导致氯吡格雷代谢减慢,使其对血小板的抑制作用减弱。已有报道认为在亚裔人群中,能导致P450酶活性下降或者丢失的等位基因有两个位点,一个是CYP2C19*2,另一个是CYP2C19*3,这两个等位基因的突变都会导致氯吡格雷疗效减弱[3-5]。
由于氯吡格雷的疗效和不良反应存在个体差异,不同患者的剂量需求不一样[6-7]。本研究通过实验对PCI术后患者的代谢酶基因型和体内血药浓度进行测定,探索基因多态性对血药浓度、血小板抑制率和安全性的影响,来指导临床实施个体化治疗,为PCI术后患者的合理治疗提供依据。
1. 材料与方法
1.1 仪器与试剂
LC-20AB高效液相色谱系统(检测器为SPD-M20A,日本岛津);TG1650-WS高速离心机(上海卢湘仪);乙腈(色谱纯,德国Merck);甲酸(分析纯,中国国药集团)。荧光检测仪(西安天龙科技有限公司);PHARM-GENE 01 SNP分析保存液;PHARM-GENE 200 SNP分析样本处理试剂;NH4Cl预处理液。氯吡格雷片(波立维,75mg,赛诺菲制药,批准文号:J20180029),阿司匹林肠溶片(拜阿司匹林,100mg,批准文号:H20130339)。
1.2 研究对象
纳入2017年6月至2019年12月心内科87 例PCI 术后服用氯吡格雷联合阿司匹林抗血小板治疗的患者(氯吡格雷75mg,1次/d;阿司匹林100 mg,1次/d)。
纳入标准如下:①接受氯吡格雷联合阿司匹林双抗治疗的患者,年龄<80岁;②氯吡格雷用药时间应大于5 d,以保证体内药物处于稳态。
排除标准如下:①使用了对药物代谢酶活性有影响的药物,包括细胞色素P450 的诱导剂(如苯巴比妥、水合氯醛、苯妥英钠、利福平等)和活性抑制剂(如氯霉素、对氨基水杨酸、异烟肼、保泰松等);②治疗前或治疗中发生了肝或肾功能改变;③同一份样品,经多次测量,其血药浓度变异系数(CV)>25%。本研究经医院伦理委员会批准(批号:2017-KL002-03)。
1.3 血样采集与检测
1.3.1 血样采集
药物在体内经4~5个给药周期可以达到稳态,所以于氯吡格雷开始服药后第6天,在给药前静脉采血。
1.3.2 氯吡格雷血药浓度监测
使用RP-HPLC法检测人血浆中氯吡格雷的药物浓度,血清样品300 μl置于1.5 ml离心管中,加内标溶液900 μl,涡旋振荡30 s,以15000 r/min转速,离心3 min,取上清液10 μl,经0.45 μm滤膜过滤后进样分析[8]。
1.3.3 CYP2C19基因型的检测
使用非扩增免疫杂交技术检测CYP2C19的基因型,操作步骤:①使用耀金保预处理标本,收集DNA;②耀金分带有针对特定SNP位点的荧光染色原位杂交探针,使用耀金分对标本DNA进行原位杂交检测;③标本DNA中含有特定碱基时可以检测到荧光信号,判断目标碱基类型[9]。
1.4 血小板抑制率的评估
血栓弹力图是一种检测方式,便于快速、准确地对血小板的活性以及抗血小板聚集的效果进行评价和分析。记录的参数包括:凝血反应时间(R)、凝血形成时间(K)、凝固角(α)、最大血凝块强度(MA)和综合凝血指数。
1.5 安全性评估
氯吡格雷最主要的不良反应包括呼吸困难以及出血。根据国际多中心、随机对照试验(PLATO)[10],按照呼吸困难的程度划分:轻度,易于察觉到的轻微呼吸困难症状,但可以耐受,不影响正常体力活动;中度,呼吸困难影响了正常的体力活动,但可以耐受;重度,呼吸困难导致无法完成正常的体力活动。根据PLATO研究[10]将出血事件分为:主要出血和次要出血。
1.6 统计分析
样本的基因频率经Hardy-Weinberg遗传平衡检验,检验结果P>0.05,表明收集的样本符合H-W平衡,具有群体代表性。所有数据采用SPSS20.0进行统计分析。率的比较选择双侧χ2检验,各组之间的血药浓度比较采用方差分析或t检验,P<0.05为差异有统计学意义。
2. 结果
2.1 样本基本特征
本研究中共纳入87名患者,均检测了CYP2C19的基因型和氯吡格雷的血药浓度测定。其中男性46名,女性41名,患者平均年龄为(66.2±7.9)岁,平均体重(55.3±12.3)kg。患者基本情况及检测结果见表1。对样本CYP2C19的基因频率进行了Hardy-Weinberg遗传平衡检验,计算结果Chi-square为1.12,P>0.5,结果见表2。结果表明,收集的样本符合H-W平衡,具有群体代表性。
表 1 患者的基本特征(n=87)项目 信息 值 人口学特征 性别(男/女) 46/41 年龄(n±s) 66.2±7.9 体重(n±s) 55.3±12.3 基因型 快(例) 34 中(例) 38 慢(例) 15 血栓弹力图参数 R(min) 5.72±1.51 K(min) 1.52±0.33 α角(deg) 70.44±7.02 MA(mm) 65.58±5.93 综合凝血指数 1.01±1.33 血小板抑制率(%) 62.56±31.22 不良反应 呼吸抑制(%) 10.34%(9/87) 出血(%) 5.75%(5/87) 表 2 CYP2C19基因型分布频率(n=87)基因表型 基因型 基因频率/% Chi-square H-W平衡检验/P 快 CYP2C19*1/*1 43.59(34/87) 1.12 >0.5 中 CYP2C19*1/*2 48.71(38/87) CYP2C19*1/*3 慢 CYP2C19*2/*2 7.69(15/87) CYP2C19*3/*3 2.2 氯吡格雷治疗后的血小板抑制率和安全性
87例患者接受氯吡格雷治疗后,血药浓度分布于2~7 mg/L之间,血小板抑制率分布于20%~90%之间。常见的不良反应是呼吸抑制[10.34%(9/87)]和出血[5.75%(5/87)]。
2.3 基因多态性对血药浓度、血小板抑制率和安全性的影响
在本研究中,根据CYP2C19的基因型进行了分类(快、中、慢)。快、中和慢代谢型患者的平均血药浓度分别为2.64±1.03、2.88±1.79和5.23±3.23 mg/L,使用t检验分析两两之间的血药浓度,结果显示,血药浓度在快、中代谢型之间没有显著性差异(P=0.667),但慢代谢型中的血药浓度在与快、中代谢型比较时有统计学差异(P<0.05)。快、中、慢代谢型的血小板抑制率分别是(66.26±24.71)%、(67.77±22.32)%和(42.45±17.88)%,采用方差分析进行统计,显示基因多态性对血小板抑制率有显著性影响(P<0.05)。不良反应发生率分别是8.97%(7/87)、5.13%(4/87)和0%(0/87),采用Fishier确切概率法对不良反应进行统计分析,结果显示,基因多态性对用药安全亦有显著性影响(P<0.05),见表3。
表 3 CYP2C19基因型与氯吡格雷血药浓度、血小板抑制率和不良反应发生率的关系基因型 基因多态性 浓度(mg/L) 血小板抑制率(%) 不良反应(%) 快 CYP2C19*1/*1 2.64±1.03 66.26±24.71 8.97(7/87) 中 CYP2C19*1/*2 2.88±1.79 67.77±22.32 5.13(4/87) CYP2C19*1/*3 慢 CYP2C19*2/*2 5.23±3.23 42.45±17.88 0(0/87) CYP2C19*3/*3 3. 讨论
氯吡格雷属于前药,需要在体内经代谢后才能起效。因此,不同患者之间存在明显的个体差异。有性别、体重、年龄、合并用药等非遗传因素,但主要还是编码药物代谢酶及转运体的基因多态性。国内外对氯吡格雷在健康和患病人群中进行的一系列深入研究,结果一致表明该药物的体内过程同时受多种因素的影响[11]。对于不同个体、不一样的人群,它的治疗效果和安全性存在较大的差异。所以,我们应该关注基因多态性与血药浓度变化之间的关系。
氯吡格雷的血药浓度受CYP2C19基因型的影响,在治疗前行基因检测可以预测初始疗效,血药浓度监测结合基因检测技术的个体化给药可能有助于减少不良反应且提高疗效。近几年有许多关于CYP2C19基因多态性影响药物药动学参数的研究,比较了CYP2C19突变型与野生型对氯吡格雷代谢的影响,结果显示突变型的血清氯吡格雷浓度较高[11]。这表明CYP2C19基因缺失影响了氯吡格雷的代谢。关于氯吡格雷的群体药动学模型参数的研究显示[12],CYP2C19基因型改变了氯吡格雷的药动学参数,CYP2C19突变型的氯吡格雷原药体内浓度高于野生型,且清除率也高于野生型,不因性别,年龄和体重等因素而改变。这表明CYP2C19发生突变不但可能使活性产物减少,而且还会加快氯吡格雷的体内清除速度。
此外,还有一些现象无法完全用基因型和血药浓度的差异来解释,这可能需要考虑患者的个体差异。如CYP2C19为快代谢型,血药浓度亦处于正常范围,但患者出现了氯吡格雷相关的不良反应或有胸痛等症状。应考虑是个体差异导致的,建议停药,并观察生命体征变化,还需要进一步随访来确证是否为氯吡格雷个体差异所致。
本研究表明,氯吡格雷的血药浓度在CYP2C19快、中代谢型患者中并无差异,但慢代谢型患者的浓度与快、中代谢型患者比较差异较大;且不同CYP2C19基因型对氯吡格雷有效性及安全性的影响也有差异。但个别案例仅通过CYP2C19基因多态性无法解释氯吡格雷疗效的差异,这可能与影响氯吡格雷药效的因素众多有关,故仅根据CYP2C19基因型指导氯吡格雷临床用药并不一定达到较好的治疗效果,可联合CYP2C19基因型检测与血药浓度监测来指导氯吡格雷的临床个体化给药。
-
-
[1] COVARRUBIAS A J, PERRONE R, GROZIO A, et al. NAD+ metabolism and its roles in cellular processes during ageing[J]. Nat Rev Mol Cell Biol, 2021, 22(2):119-141. doi: 10.1038/s41580-020-00313-x [2] WANG P, MIAO C Y. NAMPT as a therapeutic target against stroke[J]. Trends Pharmacol Sci, 2015, 36(12):891-905. doi: 10.1016/j.tips.2015.08.012 [3] YOSHINO J, BAUR J A, IMAI S I. NAD+ intermediates: the biology and therapeutic potential of NMN and NR[J]. Cell Metab, 2018, 27(3):513-528. doi: 10.1016/j.cmet.2017.11.002 [4] YOSHINO J, MILLS K F, YOON M J, et al. Nicotinamide mononucleotide, a key NAD(+)intermediate, treats the pathophysiology of diet- and age-induced diabetes in mice[J]. Cell Metab, 2011, 14(4):528-536. doi: 10.1016/j.cmet.2011.08.014 [5] WANG S N, MIAO C Y. Targeting NAMPT as a therapeutic strategy against stroke[J]. Stroke Vasc Neurol, 2019, 4(2):83-89. doi: 10.1136/svn-2018-000199 [6] YAGI M, DO Y, HIRAI H, et al. Improving lysosomal ferroptosis with NMN administration protects against heart failure[J]. Life Sci Alliance, 2023, 6(12):e202302116. doi: 10.26508/lsa.202302116 [7] DENG H Y, DING D, MA Y, et al. Nicotinamide mononucleotide: research process in cardiovascular diseases[J]. Int J Mol Sci, 2024, 25(17):9526. doi: 10.3390/ijms25179526 [8] SONG Q, ZHOU X F, XU K X, et al. The safety and antiaging effects of nicotinamide mononucleotide in human clinical trials: an update[J]. Adv Nutr, 2023, 14(6):1416-1435. doi: 10.1016/j.advnut.2023.08.008 [9] HUANG H. A multicentre, randomised, double blind, parallel design, placebo controlled study to evaluate the efficacy and safety of uthever(NMN supplement), an orally administered supplementation in middle aged and older adults[J]. Front Aging, 2022, 3:851698. doi: 10.3389/fragi.2022.851698 [10] YI L, MAIER A B, TAO R S, et al. The efficacy and safety of β-nicotinamide mononucleotide(NMN)supplementation in healthy middle-aged adults: a randomized, multicenter, double-blind, placebo-controlled, parallel-group, dose-dependent clinical trial[J]. Geroscience, 2023, 45(1):29-43. doi: 10.1007/s11357-022-00705-1 [11] IGARASHI M, NAKAGAWA-NAGAHAMA Y, MIURA M, et al. Chronic nicotinamide mononucleotide supplementation elevates blood nicotinamide adenine dinucleotide levels and alters muscle function in healthy older men[J]. NPJ Aging, 2022, 8(1):5. [12] XU T Y, WANG P, TIAN J S, et al. Pharmacological characterization of MT-1207, a novel multitarget antihypertensive agent[J]. Acta Pharmacol Sin, 2021, 42(6):885-897. doi: 10.1038/s41401-021-00636-1 [13] RAPSOMANIKI E, TIMMIS A, GEORGE J, et al. Blood pressure and incidence of twelve cardiovascular diseases: lifetime risks, healthy life-years lost, and age-specific associations in 1·25 million people[J]. Lancet, 2014, 383(9932):1899-1911. doi: 10.1016/S0140-6736(14)60685-1 [14] QIU Y M, XU S Y, CHEN X, et al. NAD+ exhaustion by CD38 upregulation contributes to blood pressure elevation and vascular damage in hypertension[J]. Signal Transduct Target Ther, 2023, 8(1):353. doi: 10.1038/s41392-023-01577-3 [15] TIAN J S, WEI Y C, WANG P, et al. Pharmacological effects of MT-1207 in bilateral renal artery stenosis hypertension and its hypotensive targets validation[J]. Biomed Pharmacother, 2024, 178:117234. doi: 10.1016/j.biopha.2024.117234 [16] LING Q S, ZHANG S L, TIAN J S, et al. Allisartan isoproxil reduces mortality of stroke-prone rats and protects against cerebrovascular, cardiac, and aortic damage[J]. Acta Pharmacol Sin, 2021, 42(6):871-884. doi: 10.1038/s41401-021-00684-7 [17] WU M Y, MA X J, YANG C, et al. Effects of allisartan, a new AT(1)receptor blocker, on blood pressure and end-organ damage in hypertensive animals[J]. Acta Pharmacol Sin, 2009, 30(3):307-313. doi: 10.1038/aps.2009.11 [18] OTALI D, FREDENBURGH J, OELSCHLAGER D K, et al. A standard tissue as a control for histochemical and immunohistochemical staining[J]. Biotech Histochem, 2016, 91(5):309-326. doi: 10.1080/10520295.2016.1179342 [19] SHIMAMURA T, IWASAKI T, HAYASAKI-KAJIWARA Y, et al. Effects of losartan and benazepril on abnormal circadian blood pressure rhythm and target organ damage in SHRSP[J]. Clin Exp Hypertens, 2002, 24(3):187-205. doi: 10.1081/CEH-120003200 [20] SOMA M, LALM S K. The role of nicotinamide mononucleotide (NMN) in anti-aging, longevity, and its potential for treating chronic conditions[J]. Molecular Biology Reports, 2022, 49(10):9737-9748. doi: 10.1007/s11033-022-07459-1 [21] Yi L, Maier A B, Tao R, et al. The efficacy and safety of β-nicotinamide mononucleotide (NMN) supplementation in healthy middle-aged adults: A randomized, multicenter, double-blind, placebo-controlled, parallel-group, dose-dependent clinical trial[J]. Geroscience, 2023, 45(1):29-43. doi: 10.1007/s11357-022-00705-1 -





 下载:
下载:
 下载:
下载: