-
盐酸安罗替尼(AL3818)商品名福可维,是我国自主研发的1.1类新药。安罗替尼是一种以血管内皮生长因子受体(VEGFR)、成纤维细胞生长因子受体(FGFR)、血小板衍生生长因子(PDGFR)、干细胞因子(c-kit)受体为靶点的新型口服多靶点酪氨酸激酶抑制剂(TKIs)[1]。截止目前安罗替尼已获国家药品监督管理局(NMPA)批准,用于三线治疗非小细胞肺癌(NSCLC)和小细胞肺癌(SCLC),以及二线治疗软组织肉瘤(STS)。同时,安罗替尼单药或联合放化疗、PD-1/PDL-1治疗恶性肿瘤的多个临床试验正在开展中。预计会有越来越多的患者使用安罗替尼,因此亟需了解其不良反应特性。
与大部分VEGFR抑制剂相同,高血压也是安罗替尼常见的不良反应之一,然而,在临床试验中高血压发生率报道具有很大的差异。先前的荟萃分析(Meta-analysis)表明,使用VEGFR抑制剂与高血压发生风险增加相关[2-7],但目前国内外暂无关于安罗替尼高血压发生率和发生风险的Meta分析报道。由于高血压控制不佳可能导致剂量下调、严重的心血管事件甚至危及生命的后果,所以确定与安罗替尼相关的高血压发生率和发生风险十分重要。本研究拟对已发表的临床试验进行Meta分析,以确定其总体发生率和风险。同时探索VEGFR抑制剂之间高血压发生的差异,这可能会为理解其潜在机制以及制定治疗策略提供更多的参考依据。
-
英文以“anlotinib”“AL3818”“clinical trial”等为检索词,检索Pubmed、Cochrane Library、Embase数据库,同时检索美国临床肿瘤学会(ASCO)获得会议论文,通过ClinicalTrials.gov网站获得相关临床试验信息。中文以“安罗替尼”“福可维”“AL3818”“临床试验”等为检索词,检索中国知网、万方、维普和中国生物医学文献服务系统数据库。检索时间为建库至2020年7月,收集国内外公开发表的与安罗替尼相关的临床试验。
-
纳入标准:①前瞻性Ⅱ期和Ⅲ期临床试验;②受试者经病理组织学或细胞学检查证实为癌症患者;③试验组使用安罗替尼单药;④结局指标至少包含以下其中一种:发生所有等级或高等级(≥3级)高血压事件。
排除标准:①重复发表的文献;②动物实验;③Ⅰ期临床试验;④回顾性研究;⑤观察性研究;⑥病例报道;⑦试验组联合用药;⑧未详细报道本研究定义的结局指标;⑨通讯或评论;⑩同一试验的亚组分析。
-
由2名研究者独立进行文献筛选和数据提取,并进行交叉核对,如出现分歧则通过讨论或咨询第三方解决。对于每一项研究提取以下信息:第一作者姓名、恶性肿瘤种类、试验阶段和类型、治疗方案和对照方案、纳入分析的患者人数及总人数以及发生高血压事件的人数等。纳入的研究根据美国国家癌症研究所的统一评价标准(3.0或4.0版本;http://ctep.cancer.gov)对高血压事件进行评估和记录,高等级(≥3级)为严重的不良事件。
-
采用R软件(3.6.0版本)中的meta程序包进行Meta分析,根据提取到的数据,计算与安罗替尼相关的高血压发生率及其95%置信区间(CI)。为了准确计算相对风险(RR)及其95% CI,仅纳入对照组为安慰剂的随机对照试验(RCT)的数据。采用I2和Q统计量评估纳入研究的异质性,I2≥50%,P<0.05表明异质性较大,采用随机效应模型进行合并分析,反之,使用固定效应模型进行合并分析。应用SPSS软件(26.0版本),分析比较安罗替尼与各种VEGFR抑制剂的高血压发生率。双侧P<0.05表示差异具有统计学意义。
-
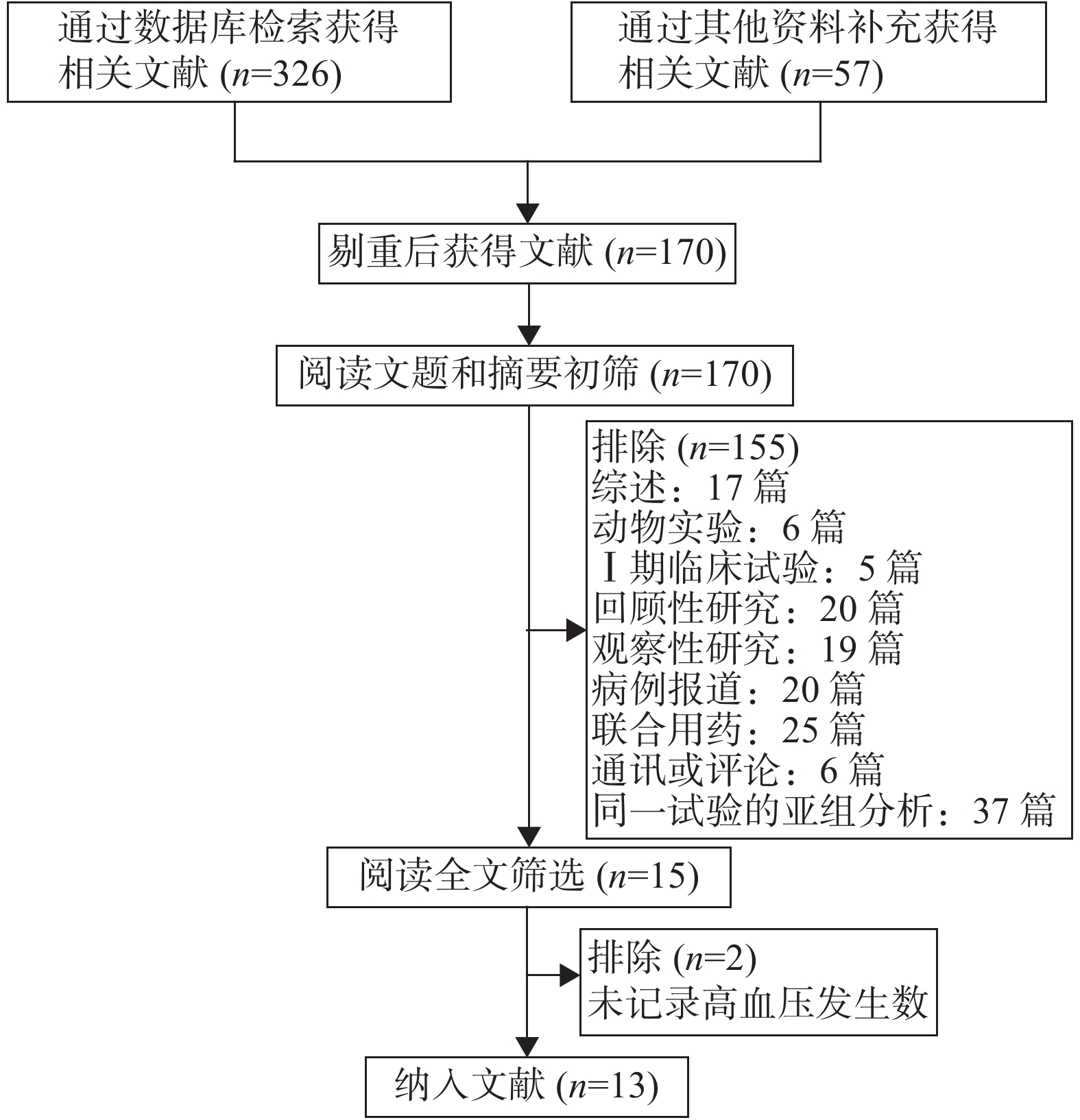
初筛后共获得文献170篇,经阅读文题和摘要后筛选出15篇文献,仔细阅读全文后,纳入符合入选标准的文献13篇。文献筛选流程见图1。
-
纳入的13项研究均为英文文献,包括6篇前瞻性单臂Ⅱ期临床试验,6篇Ⅱ期RCT临床试验,1篇Ⅲ期RCT临床试验,共纳入1387名(安罗替尼:1187人,安慰剂:200人)癌症患者进行Meta分析。纳入研究的基本特征详见表1。
表 1 纳入的13项研究的基本信息
纳入文献 肿瘤类型 试验设计 药物名称 患者数 高血压发生数 试验组 对照组 试验组 对照组 试验组 ≥G3① 对照组 ≥G3② Wu[8] 小细胞肺癌 Ⅱ期 单臂 安罗替尼 NA 45 NA 6 3 NA NA Han[9] 非小细胞肺癌 Ⅲ期RCT 安罗替尼 安慰剂 294 143 199 40 24 0 Ma[10] 转移性肾细胞癌 Ⅱ期 单臂 安罗替尼 NA 42 NA 19 2 NA NA Chi[11] 软组织肉瘤 Ⅱ期 单臂 安罗替尼 NA 166 NA 70 8 NA NA Sun[12] 甲状腺髓样癌 Ⅱ期 单臂 安罗替尼 NA 58 NA 23 3 NA NA Tang[13] 骨癌 Ⅱ期 单臂 安罗替尼 NA 42 NA NR 8 NA NA Shan[14] 卵巢癌 Ⅱ期 单臂 安罗替尼 NA 14 NA 8 0 NA NA Zhou[15] 转移性肾细胞癌 Ⅱ期 RCT 安罗替尼 舒尼替尼 90 43 45 12 29 11 Han[16] 非小细胞肺癌 Ⅱ期RCT 安罗替尼 安慰剂 60 57 33 6 3 0 Chi[17] 软组织肉瘤 Ⅱ期 RCT 安罗替尼 安慰剂 158 75 99 30 NR NR Huang[18] 食管鳞状细胞癌 Ⅱ期 RCT 安罗替尼 安慰剂 110 55 NR 17 NR NR Wang[19] 小细胞肺癌 Ⅱ期 RCT 安罗替尼 安慰剂 46 22 18 7 NR NR Chi[20] 甲状腺髓样癌 Ⅱ期 RCT 安罗替尼 安慰剂 62 NR 29 NR NR NR 注:NA:不适用;NR:未报道;①试验组高血压≥G3的发生数;②对照组高血压≥G3的发生数。 -
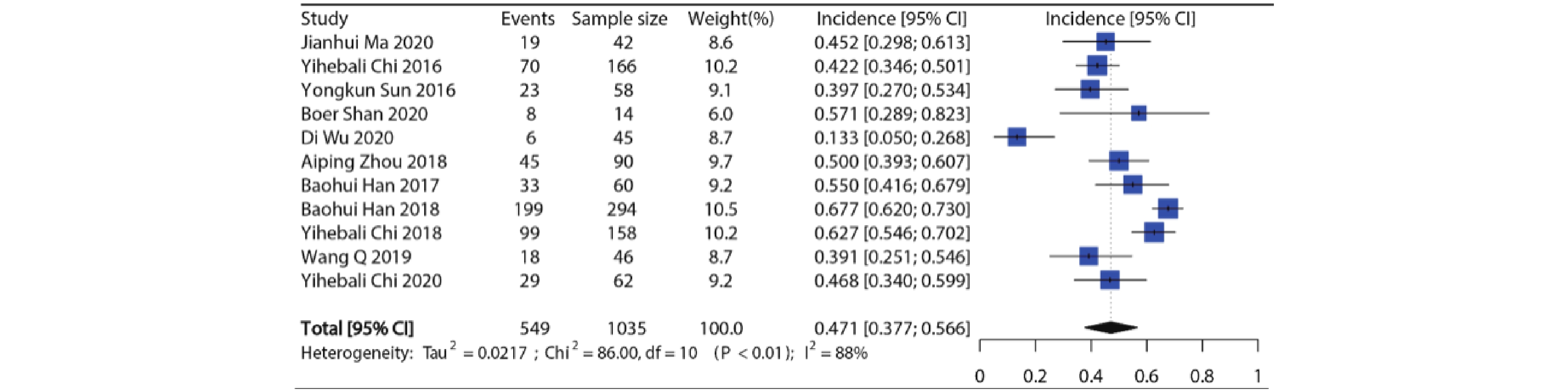
纳入11项研究共1035例病例用于分析,各个研究所有等级高血压发生率在13.3%~67.7%,发生率最低的是用于SCLC的Ⅱ期RCT临床试验[8],发生率最高的是用于NSCLC的Ⅲ期RCT临床试验[9]。Meta分析显示纳入研究之间具有异质性(I2=88%, P<0.01),因此使用随机效应模型合并,接受安罗替尼治疗的患者所有等级高血压的总发生率约为47.1%(95%CI:37.7%~56.6%),结果见图2。
-
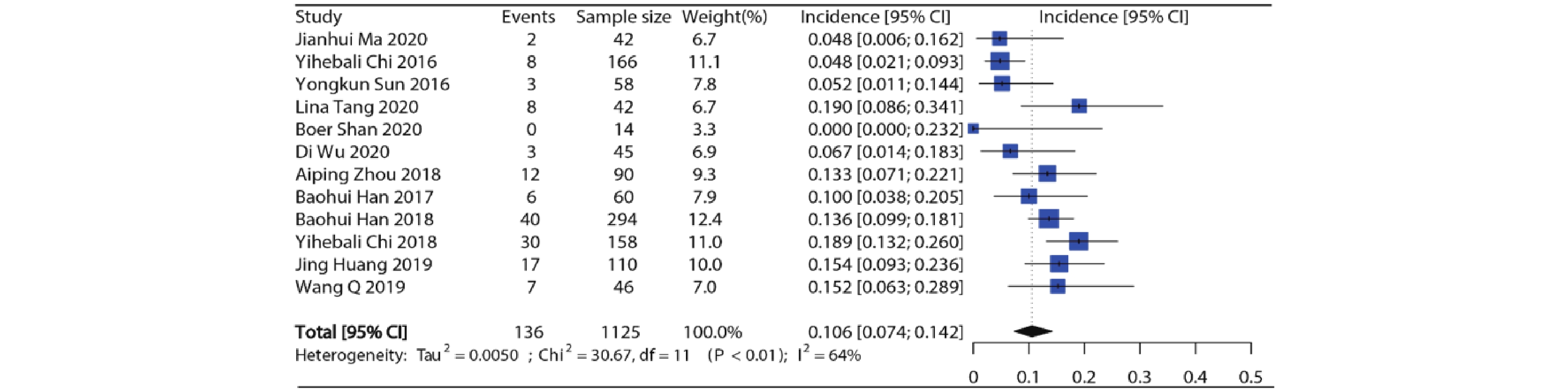
12项研究报道了接受安罗替尼的患者(合计1 125例)高等级高血压发生率,各项研究的高等级高血压发生率在0%~19.0%之间。Meta分析结果显示纳入研究之间存在异质性(I2=64%, P<0.01),因此采用随机效应模型,合并得到安罗替尼高等级高血压总发生率约为10.6%(95%CI:7.4%~14.2%),结果见图3。
-
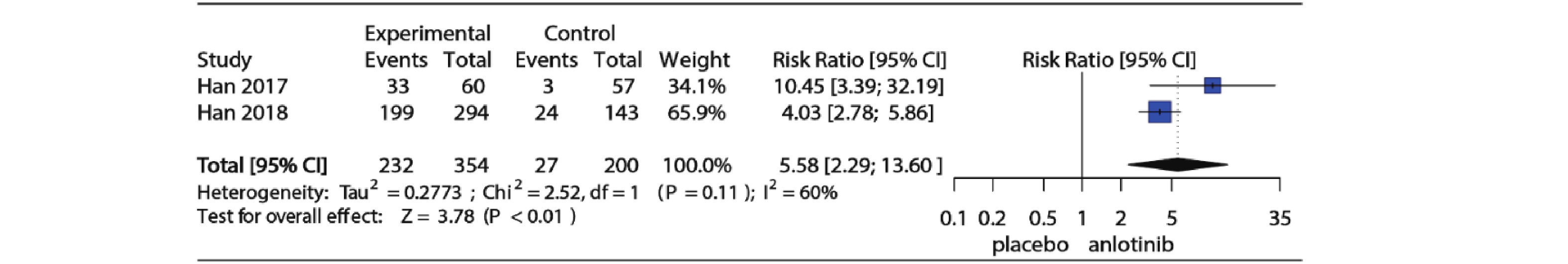
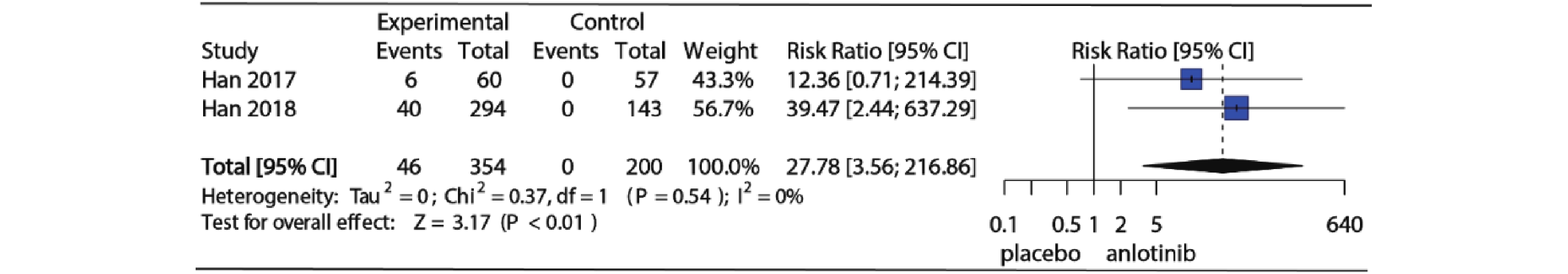
3项RCT研究详细记录了试验组和对照组高血压发生情况,2项对照组为安慰剂,1项对照组为舒尼替尼,为了明确安罗替尼与安慰剂相比高血压发生风险,仅纳入对照组为安慰剂的2项RCT研究。Meta分析结果如图4所示,I2=60%,P=0.11提示研究存在中等异质性,使用随机效应模型合并(RR=5.58, 95%CI:2.29~13.60, P<0.01)。图5为安罗替尼与安慰剂相比发生高等级高血压的相对危险度及Meta分析森林图,I2=0%,P=0.54,提示纳入的2项研究之间无异质性,采用固定效应模型合并(RR=27.78, 95%CI: 3.56~216.86, P<0.01)。
-
比较已发表的6个VEGFR抑制剂药物高血压发生率的Meta分析文献,进一步探讨了安罗替尼与其他VEGFR抑制剂高血压发生率的差异,表明安罗替尼高等级高血压发生率与阿昔替尼(RR=0.79, 95%CI:0.61, 1.02, P=0.066)和卡赞替尼(RR=0.87, 95%CI:0.67, 1.13, P=0.290)相似(见表2)。
表 2 安罗替尼与其他VEGFR抑制剂高血压发生率的比较
序号 比较组别 所有等级高血压 高等级高血压 发生率(样本量) RR(90% CI) P 发生率(样本量) RR(90% CI) P 1 安罗替尼 47.1%(1035) 10.6% (1175) 2 索拉非尼 23.4% (3363) 2.91(2.51~3.37) <0.001 5.7% (3567) 1.96(1.50~2.31) <0.001 3 舒尼替尼 21.6% (4609) 3.23(2.80~3.72) <0.001 6.8% (4407) 1.62(1.30~2.03) <0.001 4 帕唑帕尼 35.9% (1242) 1.59(1.34~1.88) <0.001 6.5% (1286) 1.71(1.28~2.30) <0.001 5 凡德他尼 24.2% (1815) 2.78(2.37~3.28) <0.001 6.4% (1190) 1.73(1.28~2.34) <0.001 6 阿昔替尼 40.1% (1148) 1.33(1.12~1.58) <0.001 13.1% (1148) 0.79(0.61~1.02) 0.066 7 卡赞替尼 27.8% (1083) 2.31(1.93~2.76) <0.001 12.0% (1083) 0.87 (0.67~1.13) 0.290 注:表中RR值和P值均为安罗替尼与其他VEGFR抑制剂相比较;其他VEGFR抑制剂高血压发生率数据从已发表文献中提取。 -
Egger检验和Begg检验结果显示,纳入分析的发生所有等级高血压事件(Egger检验:P=0.050,Begg检验:P=0.243)和高等级高血压事件(Egger检验:P=0.366,Begg检验:P=0.243)的相关文献未见明显发表偏倚。
-
血管内皮生长因子(VEGF)是参与肿瘤血管生成的关键因子,目前VEGFR抑制剂是多种癌症的一线治疗药物。然而,在使用其治疗癌症的同时可能会诱发高血压,高血压不仅会增加心血管系统不良事件的发生风险,还可能累及其他系统,如导致肾脏损害、高血压性视网膜病变等[21]。
本研究共纳入1387例病例,研究结果提示接受安罗替尼治疗的癌症患者高血压发生率较高(所有等级47.1%, 95%CI:37.7%~56.6%;高等级10.6%, 95%CI:7.4%~14.2%);与安慰剂相比,安罗替尼高血压发生风险显著增加(所有等级RR=5.58, 95%CI:2.29~13.60, P<0.01;高等级RR=27.78, 95%CI:3.56~216.86, P<0.01)。因此,在临床应用过程中应重视监测患者的血压,并根据血压的分级及时进行处理。
尽管有实验和临床证据表明VEGFR抑制剂与其发生高血压有直接的关系,但具体病理生理学和分子生物学机制尚不明确。其可能的机制包括:①VEGF通过促进内皮细胞释放一氧化氮(NO)从而产生血管扩张的效应,VEGFR抑制剂则会导致NO合成减少促进血管收缩,导致外周阻力增加和血压升高[22];②内皮素-1分泌增加,导致全身血管阻力增加和高血压效应[23];③VEGF可维持毛细血管网的完整性,当受到抑制时,可能会导致毛细血管的密度下降或结构疏松从而导致高血压[24]。
目前尚无关于使用VEGFR抑制剂治疗的患者血压管理的正式指南,美国国家癌症研究所药物研究委员会的心血管毒性小组建议[25]:①在开始VEGFR抑制剂治疗之前进行正式的心血管风险评估;②在整个治疗过程中监测血压和心脏毒性,在治疗初期更应密切监测;③积极管理早期出现的高血压和心脏毒性以预防长期心血管系统损害。
VEGFR抑制剂诱导血压升高治疗药物的选择应注意避免使用非二氢吡啶钙离子拮抗剂,因为其抑制CYP450 3A4,可能导致VEGFR抑制剂血药浓度升高,加剧VEGFR抑制剂诱导的高血压[26]。应避免同时使用CYP3A4抑制剂(如维拉帕米或地尔硫䓬等)。肾损害也是VEGFR抑制剂常见的不良反应,因此,控制安罗替尼所致的高血压最常用的是血管紧张素转换酶抑制剂(ACEI)或血管紧张素II受体拮抗剂(ARB),若控制不佳,可以加用其他降压药(如钙离子拮抗剂、利尿剂、β阻滞剂等)[27]。
不同VEGFR抑制剂高血压发生率有较大的区别,因此,笔者进一步分析了使用安罗替尼与其他VEGFR抑制剂发生高血压的差异。从表2可以看出,使用安罗替尼的患者高血压发生率均高于其他大部分VEGFR抑制剂(包括索拉非尼[2]、舒尼替尼[3]、帕唑帕尼[4]、凡德他尼[5]、阿昔替尼[6]和卡赞替尼[7])。对于高等级高血压发生率,安罗替尼与阿昔替尼和卡赞替尼相似,高于其他VEGFR抑制剂。不同VEGFR抑制剂高血压发生率具有较大差异的原因可能是由于部分VEGFR抑制剂还作用于其他靶点,如安罗替尼作用于VEGFR、FGFR、PDGFR和c-kit[1],而卡赞替尼作用于VEGFR和间质表皮转化因子受体[7]。然而,缺乏安罗替尼与其他VEGFR抑制剂大样本量的头对头临床研究,而且患者的基线特征可能会影响结局指标,所以应该谨慎解释这些结果。
本研究的局限性:①本研究为Meta分析,不是基于患者的原始数据进行分析,因此可能存在一些混杂因素;②纳入研究未描述基线的高血压发病率,这可能是导致Meta分析后高血压总体发生率较高的原因之一,然而,我们使用了RCT研究的数据进行RR值的合并,从而减少误差;③纳入的研究之间存在潜在的差异,如不同的肿瘤类型等,但纳入计算RR值的临床试验的癌种均为NSCLC;④纳入研究的数量有限;⑤大多数临床试验会排除控制不佳的高血压或重大心血管疾病的患者,因此高血压的发生率和严重程度在真实世界中可能会更高。
-
本文首次对癌症患者接受安罗替尼治疗相关的高血压总体发生率和风险进行Meta分析,使用安罗替尼会显著增加发生高血压的风险,建议临床用药前进行系统的心血管风险评估,用药期间密切监测血压并根据其分级进行适当管理,特别是对于高危患者。选择治疗高血压药物时,需注意药物相互作用。安罗替尼为多靶点TKI,临床应用过程中也应关注与其他靶点相关的不良反应。仍需进一步开展大样本量的研究,以明确其可能发生的机制和与其相关的危险因素。
Incidence and risk of hypertension in cancer patients receiving anlotinib: Review and Meta-analysis
-
摘要:
目的 为了明确癌症患者应用安罗替尼后高血压发生率和发生风险,同时比较安罗替尼与其他血管内皮生长因子受体(VEGFR)抑制剂之间高血压发生率的差异。 方法 检索Pubmed、Cochrane Library、Embase、ASCO、中国知网、万方、维普和中国生物医学文献服务系统数据库,收集与安罗替尼相关的前瞻性Ⅱ期和Ⅲ期且有准确记录高血压不良反应发生情况的临床试验,采用R软件(3.6.0版本)对安罗替尼高血压不良反应发生率和发生风险进行Meta分析,使用SPSS软件(26.0版本)比较安罗替尼与其他VEGFR抑制剂之间高血压发生率的差异。 结果 来自13项研究的1387名癌症患者被纳入Meta分析。使用安罗替尼的高血压总发生率约为47.1%(95% CI: 37.7%~56.6%),高等级高血压发生率约为10.6%(95% CI: 7.4%~14.2%),与安慰剂相比,安罗替尼可显著增加高血压发生风险(RR=5.58, 95% CI: 2.29~13.60, P<0.01)以及高等级高血压发生风险(RR=27.78, 95% CI: 3.56~216.86, P<0.01)。另外,安罗替尼高等级高血压发生率与阿昔替尼(RR=0.79, 95% CI: 0.61~1.02, P=0.066)和卡赞替尼(RR=0.87, 95% CI: 0.67~1.13, P=0.290)相似,其余均高于其他VEGFR抑制剂。 结论 在使用安罗替尼的癌症患者中,高血压发生率较高,且显著增加发生高血压风险,建议临床对血压进行密切监测并及时治疗。 -
关键词:
- 安罗替尼 /
- 癌症 /
- 血管内皮生长因子受体抑制剂 /
- 高血压 /
- 荟萃分析
Abstract:Objective To investigate the overall incidence and risk of hypertension in the treatment of cancer patients who receive anlotinib and compare the differences between anlotinib and other VEGFR inhibitors. Methods Pubmed, Embase, Cochrane Library, ASCO, CNKI, Wangfang, VIP and CBM databases were searched. Eligible studies were phase II and III prospective clinical trials on cancer patients who received anlotinib and had the hypertension data available. Meta-analysis for the incidence and risk of anlotinib was performed by using R software (version 3.6.0). SPSS software (version 26.0) was used to compare the difference between anlotinib and other VEGFR inhibitors. Results A total of 1387 cancer patients from 13 clinical trials were included in the Meta-analysis. The overall incidences of all grade and high grade hypertension in cancer patients who received anlotinib were about 47.1% (95%CI: 37.7%−56.6%) and 10.6% (95%CI: 7.4%−14.2%). The use of anlotinib was associated with significantly increased risk of all grade (RR=5.58, 95%CI: 2.29−13.60, P<0.01) and high grade hypertension (RR=27.78, 95%CI: 3.56−216.86, P<0.01). In addition, the incidence of high grade hypertension associated with anlotinib was similar to axitinib (RR=0.79, 95%CI: 0.61−1.02, P=0.066) and cabozantinib (RR=0.87, 95%CI: 0.67−1.13, P=0.290). The incidences of rest of other VEGFR inhibitors were lower than that of anlotinib. Conclusions There is a high incidence and significant risk of developing hypertension in cancer patients receiving anlotinib. Adequate monitoring and timely treatment of hypertension is recommended. -
Key words:
- anlotinib /
- cancer /
- VEGFR inhibitors /
- hypertension /
- Meta-analysis
-
根据世界卫生组织最新统计显示,心脑血管疾病如心肌梗死、缺血性卒中等是目前全球最主要的致死原因[1]。血小板作为动脉血栓形成的一项重要介质,其高反应性是导致动脉血栓事件发病率和病死率增加的重要危险因素[2, 3]。尽管现有的抗血栓药物可有效减少心血管疾病患者的动脉血栓形成,但出血的不良反应也极大限制了它们的使用。因此为了开发出能在抗血栓形成效果和出血之间取得更好平衡的新一代安全有效的抗血栓药物,迫切需要了解导致血管血栓闭塞的致病机制,开展新靶标的基础研究[4, 5]。
分泌蛋白可由机体各种组织器官分泌,在生理、病理过程中起关键作用,具备良好的研究前景,有望开发成为心脑血管疾病防治的药物、靶标、生物标志物[6, 7]。近期有多项研究表明部分分泌蛋白大量存在于血液之中,可直接作用于血栓调控[8-10]。Metrnl是本实验室前期通过构建限食模型筛选获得的一种与神经营养因子Metrn同源的新型分泌蛋白[11]。迄今为止,多项研究结果表明Metrnl在免疫炎症及代谢性心脑血管疾病中发挥重要作用,例如调节胰岛素敏感性、维持肠道稳态、对抗动脉粥样硬化、促进血管新生等[12-17]。此外,临床研究显示,血液Metrnl水平与冠心病、心肌梗死、缺血性脑卒中等多种血栓性疾病存在相关性[18-20]。以上结果均提示Metrnl在心脑血管疾病病理过程中扮演重要角色,但是Metrnl在血栓形成特别是其对血小板的直接作用尚未可知。
前期,本实验室通过使用Metrnl全身性敲除小鼠,已在多种血栓模型下证明Metrnl缺乏会导致血栓形成能力增强,并且在进一步的血小板功能检测中,证实Metrnl缺乏会导致血小板活性增强[21]。然而,我们尚未证明究竟是循环Metrnl还是血小板Metrnl的缺乏在促进血栓形成中扮演主要角色,且血小板Metrnl是否可以直接调控血小板活性改变,从而在血小板高活性与动脉血栓形成事件发生率增加之间建立联系,目前尚不清楚。
因此,本研究使用Metrnlloxp/loxp小鼠和Pf4-Cre小鼠进行交配繁殖,旨在构建血小板特异性Metrnl敲除小鼠模型,作为深入研究血小板内源性Metrnl在动脉血栓中的作用及调控机制的工具,并对该敲除小鼠的构建成功与否展开验证工作。
1. 材料与方法
1.1 实验试剂和仪器
鼠尾DNA提取试剂盒(CW2094S)购自北京康为世纪生物科技有限公司,5×Evo M-MLV RT Master Mix(AG11706)、通用型RNA提取试剂盒(AG21022)购自湖南艾科瑞生物工程有限公司,小鼠Actin抗体(
66009 -1-IG)购自武汉三鹰技术有限公司,Anti-METRNL抗体(ab235775)购自Abcam公司,辣根过氧化物酶标记山羊抗小鼠IgG(H+L)(A0216)、辣根过氧化物酶标记山羊抗兔IgG(H+L)(A0208)购自上海碧云天生物技术有限公司,红细胞裂解液(BL503B)购自北京兰杰柯科技有限公司。实时荧光定量PCR仪(LightCycler96)来自Roche公司,PCR仪(TP600)来自Takara公司,化学发光分析系统(5200S)来自Tanon公司,动物全血计数仪(pocH-100iV)来自希森美康公司。
1.2 实验动物
Metrnlloxp/loxp小鼠为实验室前期构建所得。SPF级8周龄Pf4-Cre小鼠购自上海南方模式生物技术有限公司。
所有实验小鼠均饲养在独立通气笼盒(IVC)系统中,温度(24±2) ℃,相对湿度为40%~60%,饲养期间笼盒内保持清洁,小鼠在笼内自由活动、进食及饮水,动物房内照明系统为自动控制(12 h照明、12 h黑暗)。动物实验标准均依照国家《实验动物护理使用卫生指南》,并经过海军军医大学大学医学研究伦理委员会批准指导。
1.3 实验方法
1.3.1 动物基因型鉴定
将剪刀消毒后剪取小鼠尾尖约3 mm,剪碎,按照DNA提取试剂盒的说明书方法提取DNA。之后,对目的基因进行PCR扩增,各引物序列如表1。
表 1 PCR扩增实验中的引物序列基因名称 上游引物(5’→3’) 下游引物(5’→3’) Metrnl loxp TGAGGGTTGGAGGCTCCTAGC GGATGAGCGTTTGAGCACAGC Pf4-Cre CCAAGTCCTACTGTTTCTCACTC TGCACAGTCAGCAGGTT 内参基因 CAAATGTTGCTTGTCTGGTG GTCAGTCGAGTGCACAGTTT 将PCR产物进行1.2% 琼脂糖凝胶电泳,上样量为每孔6 μl,电泳条件为100 V×30 min,结束后进行拍照、分析。
1.3.2 小鼠取材
将小鼠称重后,腹腔注射1%戊巴比妥钠溶液(100 mg/kg),待小鼠处于深度麻醉后,打开其腹腔,用1 ml注射器吸取约100 μl 2%枸橼酸钠溶液(枸橼酸钠0.2 g,蒸馏水定容至10 ml),自腹主动脉处缓慢抽取抗凝血液,并转移至15 ml离心管中。组织灌流后迅速剪取小鼠心、肝、脾、肺、肾、脑、结肠组织,放入组织冻存管扔进液氮速冻,待取材结束后及时转入−80 ℃超低温冰箱储存。骨髓提取分离小鼠股骨并剪去多余肌肉和纤维组织,剪掉股骨两端,在干净PBS中反复冲洗骨髓腔,收集冲洗液室温离心
1000 r/min×5 min获得骨髓细胞,用1 ml Triozl溶液重悬混匀,储存至−80 ℃超低温冰箱。1.3.3 小鼠洗涤血小板制备
向小鼠抗凝全血中加入等体积0.9%生理盐水,并加入Apyrase(终浓度2 U/ml),快速颠倒混匀后室温离心800 r/min×10 min;离心后收集最上层富血小板血浆(PRP),转移至新的15 ml离心管,室温离心
1700 r/min×5 min,弃去上清液,取适量台式液重悬。1.3.4 小鼠外周血细胞制备
小鼠心脏采抗凝血后,室温离心
1000 r/min×5 min,弃去上清液后加入5 ml的红细胞裂解液,室温作用10 min,室温离心1000 r/min×5 min,重复1次,在血细胞沉淀中加入5 ml PBS洗涤,室温离心1000 r/min×5 min,弃去上清后根据白细胞沉淀的量加入100~500 μl PBS重悬。红细胞提取在全血中加入等体积红细胞保存液(枸橼酸钠0.8 g,葡萄糖2.05 g,枸橼酸0.0325 g,氯化钠0.42 g,蒸馏水定容至100 ml), 室温离心2 000 r/min×10 min,连续离心洗涤3次后,取压积红细胞加入100~500 μl红细胞保存液重悬。1.3.5 实时荧光定量PCR实验
使用RNA提取试剂盒提取组织RNA,Triozl法提取骨髓RNA,将得到的RNA进行浓度测定与吸光度测定后进行逆转录,得到cDNA用于实时荧光定量PCR实验,各引物序列如表2。
表 2 实时荧光定量PCR实验中的引物序列基因名称 上游引物(5′→3′) 下游引物(5′→3′) Mouse Metrnl CTGGAGCAGGGAGGCTTATTT GGACAACAAAGTCACTGGTACAG Mouse Gapdh GTATGACTCCACTCACGGCAAA GGTCTCGCTCCTGGAAGATG 1.3.6 蛋白免疫印迹实验
取适量组织至2 ml高速离心管,加入蛋白裂解液后,使用高通量匀浆仪匀浆240 s。取出高速离心管,离心:
12000 g×15 min。将上清液转移至另一干净1.5 ml EP管中,进行蛋白浓度测定,剩余样品加入5×蛋白上样缓冲液,97 ℃变性10 min得到蛋白样品。使用10% SDS-PAGE凝胶进行电泳,电泳条件为:150 V×60 min。使用PVDF膜进行转膜,转膜条件为100 V×60 min。
转膜结束后,使用快速封闭液封闭20 min,之后使用1 × TBST缓冲液洗膜,5 min×3次。加入一抗孵育液(1∶
1000 稀释)4 ℃孵育过夜。次日去除一抗孵育液,使用1×TBST缓冲液洗膜,10 min×3次。加入二抗孵育液(1∶1000 稀释)常温孵育1 h,用1×TBST缓冲液洗去二抗,10 min×2次,结束后即可进行扫膜。1.3.7 统计学分析
实验数据使用GraphPad Prism 9.5进行统计分析。两组间的比较使用two-tailed Student’s t test检验,P<0.05视为结果存在统计学意义。
2. 结果
2.1 血小板特异性Metrnl敲除小鼠的构建和基因型鉴定
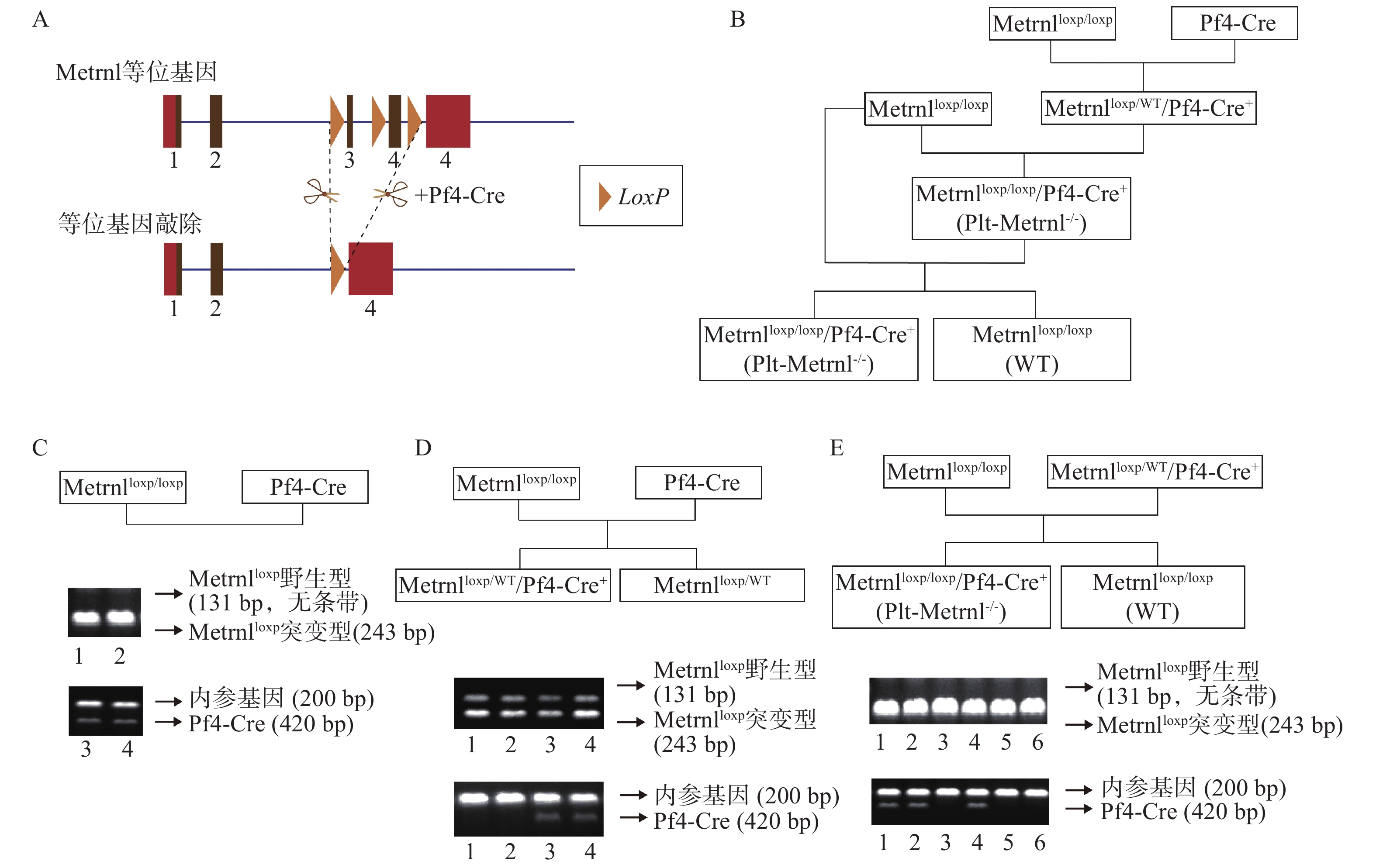
本研究构建策略基于前期构建的Metrnlloxp/loxp小鼠和Cre-LoxP重组酶系统,所构建血小板特异性Metrnl敲除小鼠(Metrnlloxp/loxp/Pf4-Cre+)简称Plt-Metrnl-/-小鼠,具体构建策略如图1A所示。
Metrnlloxp/loxp小鼠是前期构建而成,该小鼠Metrnl基因的3号外显子两侧和4号外显子编码区的都插有同向LoxP位点(即图1A中所示“等位基因”),可基于Cre-LoxP系统在Cre酶的作用下,将LoxP位点之间的序列切除(图1A)[12]。
Pf4-Cre小鼠是由Pf4基因启动子Cre重组酶在巨核细胞及血小板谱系表达的工具鼠,最初开发用于研究APC-Wnt调节途径在巨核细胞生成和血小板产生中的作用,其Cre重组酶的表达受巨核细胞特异性受体Pf4基因的启动子介导,在巨核细胞的成熟Ⅰ期(最早可识别形态期)中即开始发生转录激活,之后广泛表达于成熟的血小板[22, 23]。
将Metrnlloxp/loxp小鼠和Pf4-Cre小鼠进行交配繁殖,巨核细胞特异性表达的Cre酶可将Metrnl同向LoxP位点之间的序列切除,以达到在巨核细胞及血小板谱系特异性敲除Metrnl基因的目的,具体构建繁殖流程如图1B所示,最终可以获得Plt-Metrnl-/-小鼠及其对照小鼠(WT)。
繁殖过程中进行基因型鉴定时,需确认Metrnlloxp基因和Pf4-Cre基因的表达情况。采用相应基因上下游引物分别进行鼠尾基因型鉴定,Metrnlloxp突变型基因阳性条带为243bp,对应野生型序列条带为131bp,Pf4-Cre基因阳性条带为420bp,内参基因阳性条带为200bp。对培育繁殖过程中的母代及子代小鼠均进行了基因型鉴定,如图1C、D、E中DNA电泳条带图所示:图1C中泳道1、2为母代Metrnlloxp/loxp小鼠,泳道3、4为母代Pf4-Cre小鼠;图1D中泳道1、2为Metrnlloxp/WT小鼠,泳道3、4为Metrnlloxp/WT/Pf4-Cre+小鼠;图1E泳道1、2、4为Plt-Metrnl-/-小鼠,泳道3、5、6为WT小鼠。
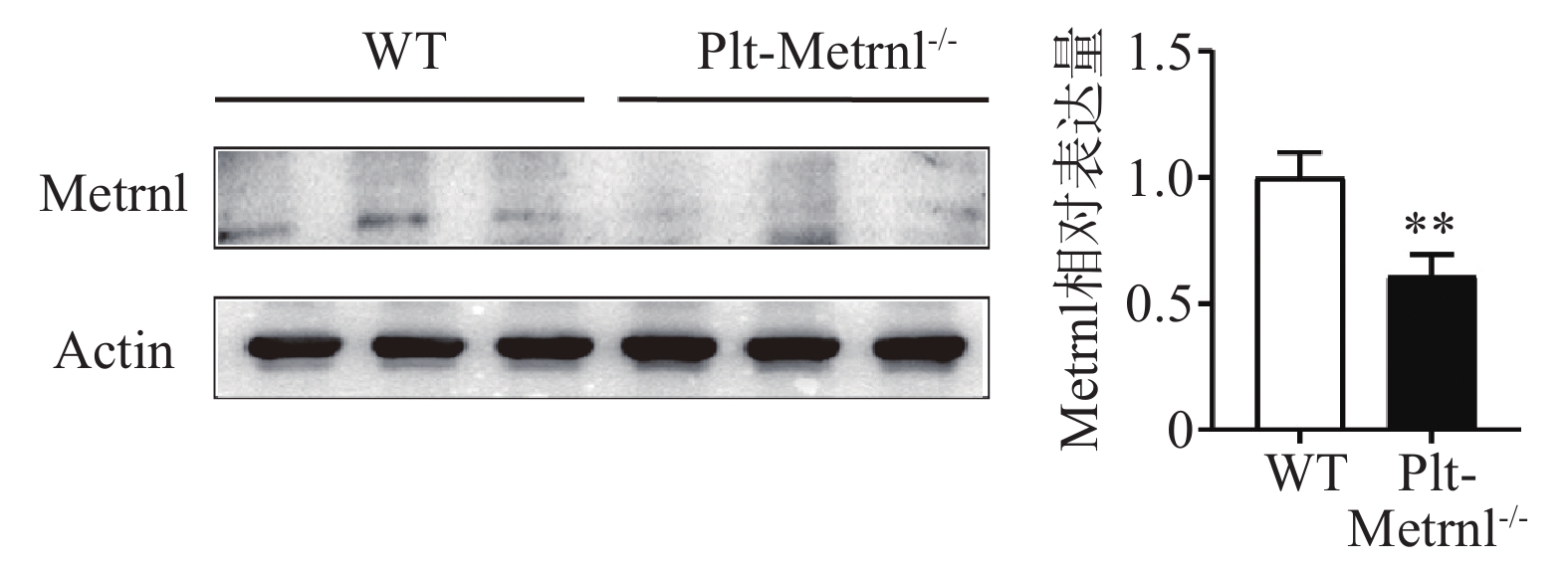
2.2 血小板特异性Metrnl敲除小鼠血小板蛋白表达情况
为验证血小板特异性Metrnl敲除小鼠是否实现血小板特异性Metrnl基因敲除,分别提取Plt-Metrnl-/-小鼠及对照WT小鼠血小板蛋白,使用蛋白免疫印迹实验方法验证敲除情况,结果如图2所示,Plt-Metrnl-/-小鼠血小板蛋白Metrnl表达较对照WT小鼠明显降低,提示Plt-Metrnl-/-小鼠血小板Metrnl成功敲除。
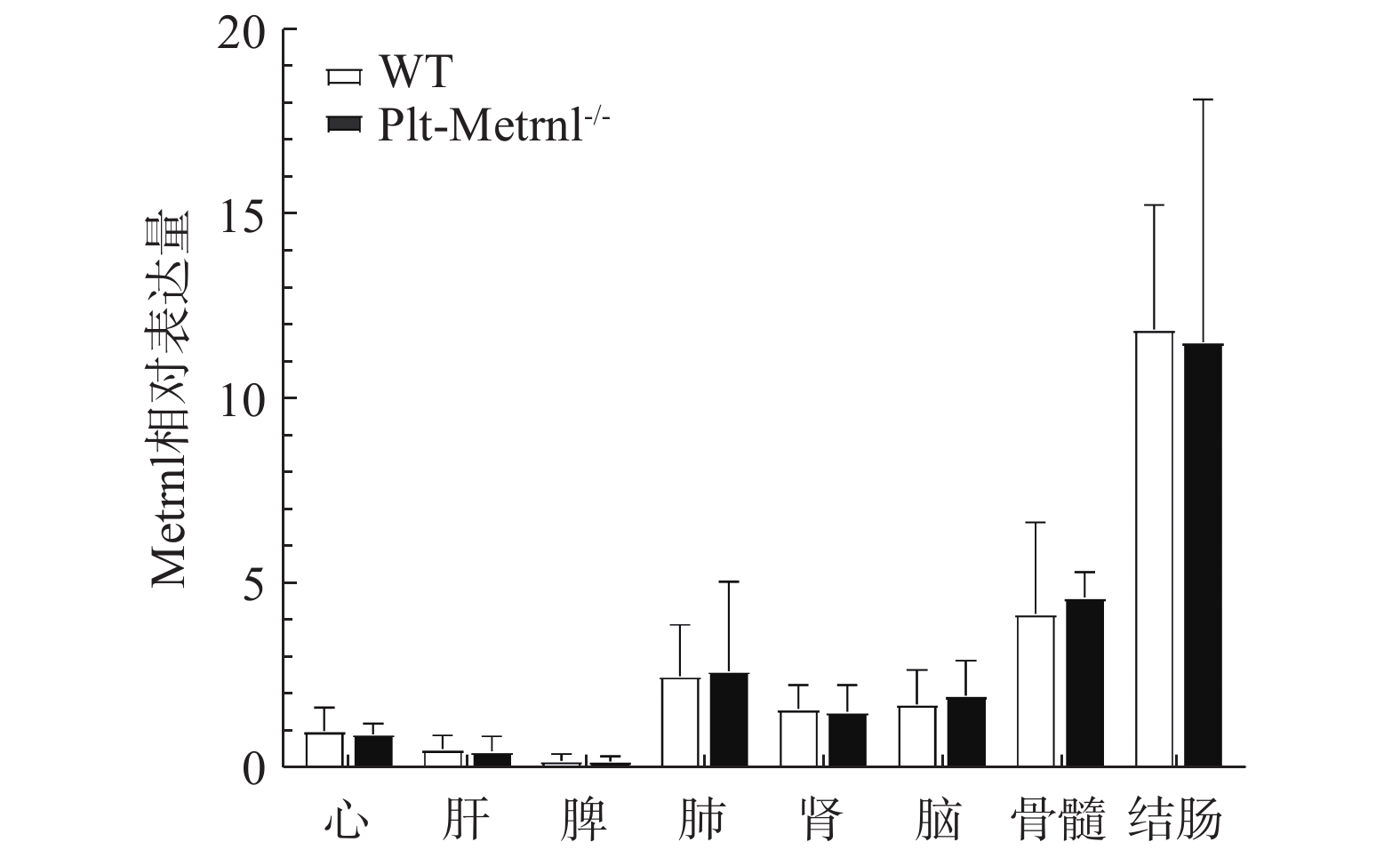
2.3 血小板特异性Metrnl敲除小鼠各组织Metrnl mRNA及蛋白表达情况
为验证血小板特异性Metrnl敲除小鼠是否存在其他组织非特异性敲除,本研究首先利用实时荧光定量PCR技术检测了该小鼠各组织中Metrnl mRNA的表达情况。如图3所示,以WT对照小鼠的心脏Metrnl mRNA表达量为1,Plt-Metrnl-/-小鼠在心、肝、脾、肺、肾、脑、结肠、骨髓组织mRNA水平上并未存在显著差异。该结果说明,血小板特异性Metrnl基因敲除小鼠在组织mRNA水平上并未发生其他组织非特异性敲除。
然后,本研究提取血细胞及各组织的蛋白,使用蛋白免疫印迹实验方法验证Plt-Metrnl-/-小鼠各血细胞及组织中Metrnl蛋白表达情况。如图4所示,并未发现Metrnl蛋白在Plt-Metrnl-/-小鼠和对照WT小鼠各组织中存在显著差异,该结果提示,Plt-Metrnl-/-小鼠在其他血细胞蛋白水平及各组织蛋白水平上并未发生非特异性敲除。
2.4 血小板特异性Metrnl敲除小鼠外周血常规指标情况
分别对Plt-Metrnl-/-小鼠及对照WT小鼠外周血进行血常规指标检测,结果如表3所示,外周血血常规计数红细胞、白细胞、血小板数量未见明显改变,血小板大小及分布未见显著差异,提示血小板特异性敲除Metrnl后不影响外周血细胞数量,且对血小板形态没有明显影响。
表 3 Plt-Metrnl-/-小鼠及对照WT小鼠血常规指标对比(n=6)血常规检验项目 WT Plt-Metrnl-/- 白细胞计数(109/L) 2.10±0.50 2.25±0.30 淋巴细胞计数(109/L) 1.28±0.20 1.52±0.20 淋巴细胞比率(%) 63±3 68±3 嗜酸性粒细胞计数(109/L) 0.10±0.05 0.05±0.02 嗜酸性粒细胞比率(%) 3.0±1.8 1.0±0.3 其他细胞计数(109/L) 0.72±0.20 0.68±0.10 其他细胞比率(%) 34.0±3.3 31±3 红细胞计数(1012/L) 8.49±0.40 7.83±0.40 血红蛋白(g/L) 122.0±5.5 113.0±4.6 红细胞压积(%) 42±2 37±2 平均红细胞体积(fL) 49.1±0.8 47.7±0.9 平均血红蛋白含量(pg) 14.30±0.08 14.5±0.1 平均血红蛋白浓度(g/L) 292±5 304.0±7.7 红细胞分布宽度-SD(fL) 27.6±0.4 26.2±0.6 红细胞分布宽度-CV(%) 13.2±0.4 12.4±0.3 血小板计数(109/L) 1121 ±581049 ±132血小板平均宽度(fL) 6.7±0.4 6.1±0.1 平均血小板体积(fL) 6.20±0.26 5.80±0.08 大型血小板比率(%) 1.9±1.0 3.5±0.3 2.5 血小板特异性Metrnl敲除小鼠一般繁殖情况
Metrnlloxp/loxp/Pf4-Cre+(Plt-Metrnl-/-)小鼠和对照WT小鼠为首次繁殖培育的转基因动物,在生理状态下,血小板Metrnl缺失是否影响动物繁殖情况尚未见报道,因此,本研究统计记录了小鼠基因型分布情况。Plt-Metrnl-/-小鼠扩大繁殖流程如图5A所示,按照遗传学规律,Metrnlloxp/loxp/Pf4-Cre+(Plt-Metrnl-/-)小鼠和Metrnlloxp/loxp小鼠杂交繁殖获得子代鼠中Plt-Metrnl-/-小鼠和WT小鼠的比例应为1∶1。如图5B、5C所示,对繁殖过程中所获得的16窝次共计130只目的鼠进行统计,Plt-Metrnl-/-小鼠共有67只,其中雄鼠31只,雌鼠36只;WT小鼠共有63只,其中雄鼠37只,雌鼠26只。结果表明繁殖鼠遗传规律基本符合预期,无明显差异,提示血小板特异性敲除Metrnl对小鼠胚胎发育和性别比例无明显影响。
3. 讨论与总结
Cre-LoxP重组酶系统主要用于构建条件性基因敲除小鼠模型,是当前阐释基因功能的最直接的方式之一。Pf4-Cre工具鼠长期以来应用于巨核谱系基因敲除动物的构建,虽然有研究表明Pf4-Cre表达不仅限于巨核细胞/血小板谱系,也表达于其他骨髓造血干细胞以及远端肠道的上皮细胞中,但是该小鼠目前仍是巨核细胞谱系遗传修饰的最佳工具,且不影响血小板和血栓形成功能的考察[22-24]。因此本研究利用Pf4-Cre工具鼠和实验室前期构建的Metrnlloxp/loxp小鼠进行杂交繁殖,最终获得血小板特异性Metrnl敲除小鼠,即Plt-Metrnl-/-小鼠。
本研究从mRNA水平、组织蛋白水平、外周血常规水平考察了Plt-Metrnl-/-小鼠血小板Metrnl敲除的情况。本研究结果显示,Plt-Metrnl-/-小鼠血小板Metrnl蛋白表达较对照WT小鼠减低约50%,可能是由于本实验室前期构建的Metrnlloxp/loxp小鼠插入的loxp序列位点在3、4号外显子,因此Pf4-Cre仅介导3、4号外显子间的同向基因序列切除,并未实现Metrnl基因全长敲除。另外,血小板是骨髓巨核细胞分化形成的“细胞碎片”,由于无法获得原代骨髓巨核细胞,本研究并未对骨髓巨核细胞的Metrnl敲除情况进行验证,未证实Metrnl敲除是否会对骨髓巨核细胞的生成和形态产生影响,仅从血常规计数中初步得知血小板的生成未受到明显影响。Metrnl与骨髓巨核细胞之间的关系也可作为下一步的研究方向。
在小鼠培育的过程中,尚未发现Plt-Metrnl-/-小鼠和同窝对照WT小鼠在体重、形态等方面的差异。基于孟德尔遗传定律,Plt-Metrnl-/-小鼠和Metrnlloxp/loxp小鼠杂交进行扩大繁殖和保种的得率也接近50%,说明血小板Metrnl缺失不影响小鼠繁殖情况。
前期本课题组已证实Metrnl全身敲除小鼠血栓形成能力增强,血小板活性明显增强,构建Plt-Metrnl-/-小鼠可考虑用于血小板内源性Metrnl与血小板功能相关性的研究,并且该小鼠可与Metrnl全身敲除小鼠进行血栓形成能力比较,比较全身Metrnl和局部血小板Metrnl的作用,深入研究其作用方式及机制,为血栓性疾病的防治提供新靶点。
-
表 1 纳入的13项研究的基本信息
纳入文献 肿瘤类型 试验设计 药物名称 患者数 高血压发生数 试验组 对照组 试验组 对照组 试验组 ≥G3① 对照组 ≥G3② Wu[8] 小细胞肺癌 Ⅱ期 单臂 安罗替尼 NA 45 NA 6 3 NA NA Han[9] 非小细胞肺癌 Ⅲ期RCT 安罗替尼 安慰剂 294 143 199 40 24 0 Ma[10] 转移性肾细胞癌 Ⅱ期 单臂 安罗替尼 NA 42 NA 19 2 NA NA Chi[11] 软组织肉瘤 Ⅱ期 单臂 安罗替尼 NA 166 NA 70 8 NA NA Sun[12] 甲状腺髓样癌 Ⅱ期 单臂 安罗替尼 NA 58 NA 23 3 NA NA Tang[13] 骨癌 Ⅱ期 单臂 安罗替尼 NA 42 NA NR 8 NA NA Shan[14] 卵巢癌 Ⅱ期 单臂 安罗替尼 NA 14 NA 8 0 NA NA Zhou[15] 转移性肾细胞癌 Ⅱ期 RCT 安罗替尼 舒尼替尼 90 43 45 12 29 11 Han[16] 非小细胞肺癌 Ⅱ期RCT 安罗替尼 安慰剂 60 57 33 6 3 0 Chi[17] 软组织肉瘤 Ⅱ期 RCT 安罗替尼 安慰剂 158 75 99 30 NR NR Huang[18] 食管鳞状细胞癌 Ⅱ期 RCT 安罗替尼 安慰剂 110 55 NR 17 NR NR Wang[19] 小细胞肺癌 Ⅱ期 RCT 安罗替尼 安慰剂 46 22 18 7 NR NR Chi[20] 甲状腺髓样癌 Ⅱ期 RCT 安罗替尼 安慰剂 62 NR 29 NR NR NR 注:NA:不适用;NR:未报道;①试验组高血压≥G3的发生数;②对照组高血压≥G3的发生数。 表 2 安罗替尼与其他VEGFR抑制剂高血压发生率的比较
序号 比较组别 所有等级高血压 高等级高血压 发生率(样本量) RR(90% CI) P 发生率(样本量) RR(90% CI) P 1 安罗替尼 47.1%(1035) 10.6% (1175) 2 索拉非尼 23.4% (3363) 2.91(2.51~3.37) <0.001 5.7% (3567) 1.96(1.50~2.31) <0.001 3 舒尼替尼 21.6% (4609) 3.23(2.80~3.72) <0.001 6.8% (4407) 1.62(1.30~2.03) <0.001 4 帕唑帕尼 35.9% (1242) 1.59(1.34~1.88) <0.001 6.5% (1286) 1.71(1.28~2.30) <0.001 5 凡德他尼 24.2% (1815) 2.78(2.37~3.28) <0.001 6.4% (1190) 1.73(1.28~2.34) <0.001 6 阿昔替尼 40.1% (1148) 1.33(1.12~1.58) <0.001 13.1% (1148) 0.79(0.61~1.02) 0.066 7 卡赞替尼 27.8% (1083) 2.31(1.93~2.76) <0.001 12.0% (1083) 0.87 (0.67~1.13) 0.290 注:表中RR值和P值均为安罗替尼与其他VEGFR抑制剂相比较;其他VEGFR抑制剂高血压发生率数据从已发表文献中提取。 -
[1] SHEN G S, ZHENG F C, REN D F, et al. Anlotinib: a novel multi-targeting tyrosine kinase inhibitor in clinical development[J]. J Hematol Oncol,2018,11(1):120-130. doi: 10.1186/s13045-018-0664-7 [2] WU S, CHEN J J, KUDELKA A, et al. Incidence and risk of hypertension with sorafenib in patients with cancer: a systematic review and meta-analysis[J]. Lancet Oncol,2008,9(2):117-123. doi: 10.1016/S1470-2045(08)70003-2 [3] ZHU X L, STERGIOPOULOS K, WU S H. Risk of hypertension and renal dysfunction with an angiogenesis inhibitor sunitinib: systematic review and meta-analysis[J]. Acta Oncol,2009,48(1):9-17. doi: 10.1080/02841860802314720 [4] QI W X, LIN F, SUN Y J, et al. Incidence and risk of hypertension with pazopanib in patients with cancer: a meta-analysis[J]. Cancer Chemother Pharmacol,2013,71(2):431-439. doi: 10.1007/s00280-012-2025-5 [5] QI W X, SHEN Z, LIN F, et al. Incidence and risk of hypertension with vandetanib in cancer patients: a systematic review and meta-analysis of clinical trials[J]. Br J Clin Pharmacol,2013,75(4):919-930. doi: 10.1111/j.1365-2125.2012.04417.x [6] QI W X, HE A N, SHEN Z, et al. Incidence and risk of hypertension with a novel multi-targeted kinase inhibitor axitinib in cancer patients: a systematic review and meta-analysis[J]. Br J Clin Pharmacol,2013,76(3):348-357. doi: 10.1111/bcp.12149 [7] ZHANG X, SHAO Y J, WANG K J. Incidence and risk of hypertension associated with cabozantinib in cancer patients: a systematic review and meta-analysis[J]. Expert Rev Clin Pharmacol,2016,9(8):1109-1115. doi: 10.1080/17512433.2016.1190269 [8] WU D, NIE J, HU W H, et al. A phase II study of anlotinib in 45 patients with relapsed small cell lung cancer[J]. Int J Cancer,2020. doi: 10.1002/ijc.33161 [9] HAN B, LI K, WANG Q, et al. Effect of anlotinib as a third-line or further treatment on overall survival of patients with advanced non-small cell lung cancer: the ALTER 0303 phase 3 randomized clinical trial[J]. JAMA Oncol,2018,4(11):1569-1575. doi: 10.1001/jamaoncol.2018.3039 [10] MA J H, SONG Y, SHOU J Z, et al. Anlotinib for patients with metastatic renal cell carcinoma previously treated with one vascular endothelial growth factor receptor-tyrosine kinase inhibitor: a phase 2 trial[J]. Front Oncol,2020,10:664. doi: 10.3389/fonc.2020.00664 [11] CHI Y, SUN Y K, CAI J Q, et al. Phase II study of anlotinib for treatment of advanced soft tissues sarcomas[J]. J Clin Oncol,2016,34(15_suppl):11005. doi: 10.1200/JCO.2016.34.15_suppl.11005 [12] SUN Y K, CHI Y, TANG P Z, et al. Phase II study of anlotinib for treatment of advanced medullary thyroid carcinoma[J]. J Clin Oncol,2016,34(15_suppl):6015. doi: 10.1200/JCO.2016.34.15_suppl.6015 [13] TANG L N, NIU X H, WANG Z, et al. A phase II study of anlotinib in treating patients with relapsed or metastatic primary malignant bone tumor[J]. J Clin Oncol,2020,38(15_suppl):11525. doi: 10.1200/JCO.2020.38.15_suppl.11525 [14] SHAN B E, SHEN W B, WANG H Y. Anlotinib in patients with recurrent platinum-resistant or refractory ovarian carcinoma: a prospective, single-arm, single-center, phase II clinical study[J]. J Clin Oncol,2020,38(15_suppl):6061. doi: 10.1200/JCO.2020.38.15_suppl.6061 [15] ZHOU A P, BAI Y X, SONG Y, et al. Anlotinib versus sunitinib as first-line treatment for metastatic renal cell carcinoma: a randomized phase II clinical trial[J]. Oncol,2019,24(8):e702-e708. [16] HAN B H, LI K, ZHAO Y Z, et al. Anlotinib as a third-line therapy in patients with refractory advanced non-small-cell lung cancer: a multicentre, randomised phase II trial (ALTER0302)[J]. Br J Cancer,2018,118(5):654-661. doi: 10.1038/bjc.2017.478 [17] CHI Y, YAO Y, WANG S S, et al. Anlotinib for metastasis soft tissue sarcoma: a randomized, double-blind, placebo-controlled and multi-centered clinical trial[J]. J Clin Oncol,2018,36(15_suppl):11503. doi: 10.1200/JCO.2018.36.15_suppl.11503 [18] HUANG J, XIAO J X, FANG W T, et al. Anlotinib in chemotherapy-refractory metastatic esophageal squamous cell carcinoma (ESCC): a randomized, double-blind, multicenter phase II trial[J]. J Clin Oncol,2019,37(4_suppl):95. doi: 10.1200/JCO.2019.37.4_suppl.95 [19] WANG Q, CHENG Y, LI K, et al. Effect of anlotinib in advanced small cell lung cancer patients previously received chemoradiotherapy: a subgroup analysis in ALTER 1202 trial[J]. J Thorac Oncol,2019,14(10):S211. [20] CHI Y, GAO M, TANG P Z, et al. Exploration of associations between adverse drug reactions and clinical outcomes in anlotinib treatment against medullary thyroid carcinoma (MTC): a subgroup analysis based on the ALTER01031 trial[J]. J Clin Oncol,2020,38(15_suppl):e18518. doi: 10.1200/JCO.2020.38.15_suppl.e18518 [21] LIU B, DING F X, LIU Y, et al. Incidence and risk of hypertension associated with vascular endothelial growth factor receptor tyrosine kinase inhibitors in cancer patients: a comprehensive network meta-analysis of 72 randomized controlled trials involving 30013 patients[J]. Oncotarget,2016,7(41):67661-67673. doi: 10.18632/oncotarget.11813 [22] KAMBA T, MCDONALD D M. Mechanisms of adverse effects of anti-VEGF therapy for cancer[J]. Br J Cancer,2007,96(12):1788-1795. doi: 10.1038/sj.bjc.6603813 [23] STACHON A, SCHLÜTER T, JUNKER K, et al. The secretion of endothelin-1 by microvascular endothelial cells from human benign prostatic hyperplasia is inhibited by vascular endothelial growth factor[J]. Growth Factors,2004,22(4):281-289. doi: 10.1080/08977190400004835 [24] AGARWAL M, THAREJA N, BENJAMIN M, et al. Tyrosine kinase inhibitor-induced hypertension[J]. Curr Oncol Rep,2018,20(8):65. doi: 10.1007/s11912-018-0708-8 [25] STEINGART R M, BAKRIS G L, CHEN H X, et al. Management of cardiac toxicity in patients receiving vascular endothelial growth factor signaling pathway inhibitors[J]. Am Heart J,2012,163(2):156-163. doi: 10.1016/j.ahj.2011.10.018 [26] RHIAN M T, LANG N N. Hypertension and antiangiogenesis: The Janus Face of VEGF Inhibitors[J]. JACC: Cardio Oncology,2019,1(1):37-40. doi: 10.1016/j.jaccao.2019.08.010 [27] SI X Y, ZHANG L, WANG H P, et al. Management of anlotinib-related adverse events in patients with advanced non-small cell lung cancer: Experiences in ALTER-0303[J]. Thorac Cancer,2019,10(3):551-556. doi: 10.1111/1759-7714.12977 期刊类型引用(1)
1. 赵昕,闵旭红,胡文俊,庞喆,李云,叶伟. 安罗替尼联合化疗三线治疗晚期非小细胞肺癌的临床分析. 中华肺部疾病杂志(电子版). 2021(01): 72-75 .  百度学术
百度学术其他类型引用(2)
-





 下载:
下载:
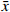
 下载:
下载: