-
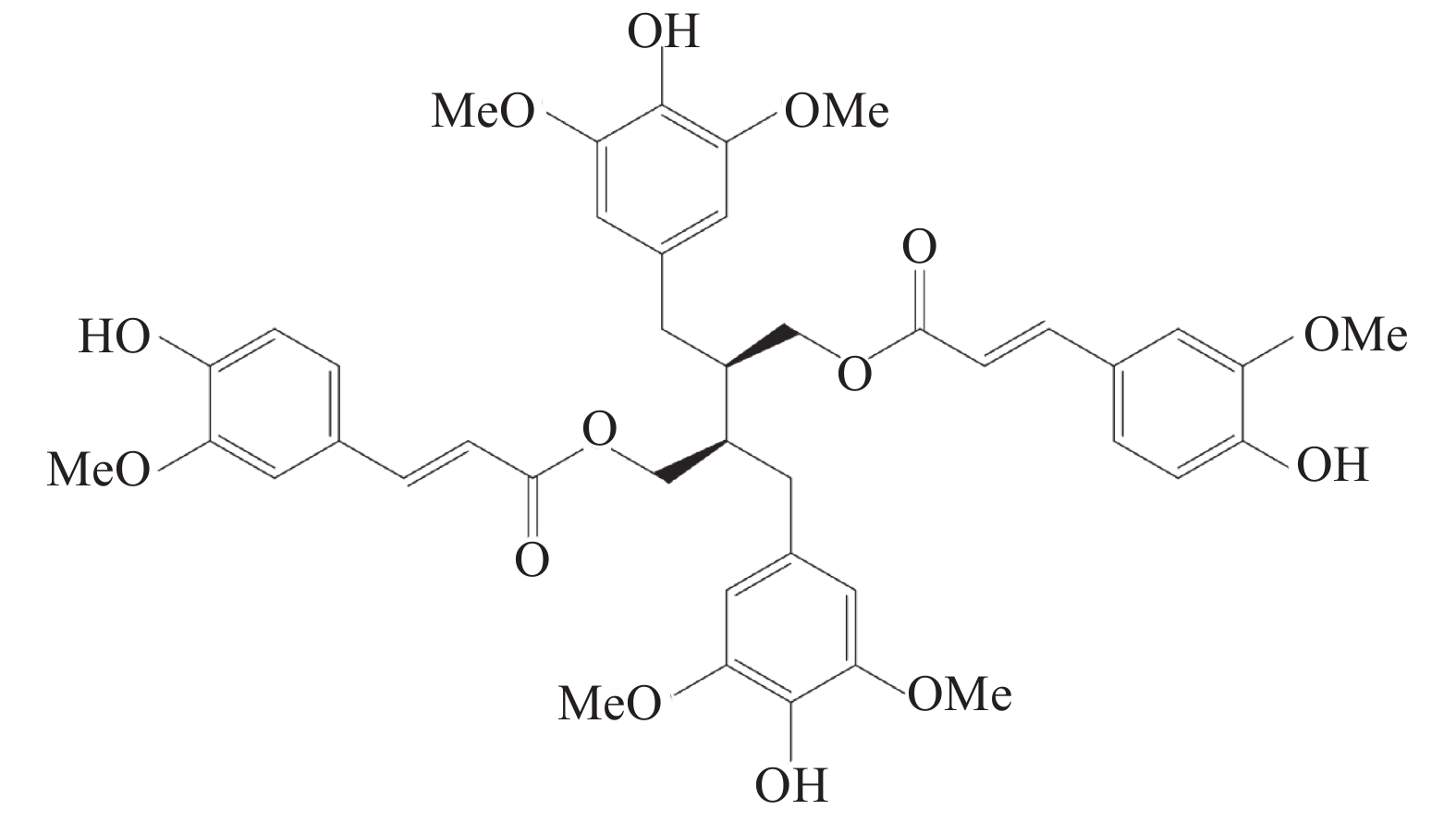
炎症泛指机体受到创伤或病原体感染等刺激后所产生的生理反应,主要表现为疼痛、红肿、发热等[1]。通常情况下,机体受到创伤等刺激后,所产生的炎症反应是一种生理性保护反应,有益于机体损伤的修复[2-3],但当机体内的抗炎系统过于活跃时,会引起自身免疫系统紊乱,对机体正常的细胞及组织进行攻击,如系统性红斑狼疮及类风湿性关节炎等免疫疾病[4]。目前,临床上常用的抗炎药物主要分为甾体类抗炎药(SAIDs)、非甾体类抗炎药(NSAIDs)及免疫调节药,但这几类药物多具有副作用[5-7],因此,新型抗炎药物的研发具有极高的科研前景和社会价值。豆豉姜是樟科植物山鸡椒Litsea cubeba(Lour.)Pers的根及根茎,被傣医学及中医作为广泛的民间方剂,多用于祛风散寒、息肝风、消肿、治风湿痹痛的治疗。前期课题组提取分离得到新型的二苄基丁烷型木脂素9,9’-O-二-(E)-阿魏酰基-内消旋-5,5’-二甲氧基开环异落叶松树脂酚(LCA)化学结构如图1所示,并发现其具有改善类弗氏完全佐剂大鼠关节炎模型中炎性症状的疗效[8],因此,课题组推测LCA是豆豉姜中具有抗炎活性的天然化合物,故采用小鼠耳肿胀和棉球肉芽肿模型及RAW264.7细胞实验,对其抗炎作用进行研究。
-
二甲苯致小鼠耳廓肿胀实验模型:5周龄SPF级雄性昆明小鼠,体重:(20±2)g;大鼠棉球肉芽肿实验:4周龄SPF级雄性SD大鼠,体重:(120±10)g。动物由海军军医大学实验动物中心提供,并饲养于海军军医大学药学院动物房,室温控制为24 ℃,12 h光照+12 h黑暗,水及食物充足供应。RAW264.7(海军军医大学药学院生药学教研室)。
-
LCA(海军军医大学药学系有机化学教研室合成及鉴定);吲哚美辛(海军军医大学附属长海医院);二甲苯、水合氯醛、羧甲基纤维素钠CMC-Na、对氨基苯磺酸、磷酸、N-α-萘乙二胺(中国医药集团);棉球(中国朝阳公司);ELISA试剂盒(中国联科公司);iNOS、COX-2、GAPDH抗体及二抗(CST,USA)。分析天平(MettlerToledo,USA);CO2恒温细胞培养箱(Sanyo,Japan);ELx 800酶标仪(Fisher,US);凝胶成像仪(Tanon-5200 multi,中国上海)。
-
小鼠耳廓肿胀模型建立:将60只5周龄健康雄性昆明鼠安置于动物实验中心适应1周,按体重随机分为4组,各10只,组别标记为:模型组;LCA组(20、40 mg/kg);吲哚美辛组(8 mg/kg)。给药以灌胃的形式每日一次,模型组则予相同体积的0.5% CMC-Na连续3 d灌胃,在末次给药1 h后,将二甲苯以0.05 ml/只剂量均匀涂布于小鼠右耳廓的双面,左耳不做处理,连续刺激45 min后处死小鼠,用打孔器分别于左右耳廓同一位置打下圆形耳片[9],称重,用于计算比较耳肿胀程度及耳肿胀抑制率(%)。
大鼠棉球肉芽肿模型建立:将20只4周龄健康雄性SD大鼠安置于动物实验中心适应1周,按体重随机分为4组:模型组;LCA组(20、40 mg/kg);吲哚美辛组(5 mg/kg)。用水合氯醛对大鼠进行麻醉,于左右两边腋窝下切开一小口,将2个灭菌棉球(20 mg)分别植入小鼠左右腋窝,缝合后第2天给药。且以灌胃的形式每日一次,模型组则予相同体积的0.5% CMC-Na连续7 d[10-11]。第8天处死大鼠,将腋下棉球及附着的肉芽组织剥离,称重,用于计算比较干湿重及抑制率。
-
耳肿胀度=右耳片重量-左耳片重量
耳肿胀抑制率(%)=(模型组平均耳肿胀度-给药组平均耳肿胀度)/模型组平均耳肿胀度×100%
平均棉球肉芽肿重量=(右侧棉球肉芽肿重量+左侧棉球肉芽肿重量)/2
棉球肉芽肿抑制率(%)=(模型组平均棉球肉芽肿重量-给药组平均棉球肉芽肿重量)/模型组平均棉球肉芽肿重量×100%
-
RAW264.7(小鼠单核巨噬细胞)用DMEM高糖完全培养基(10% DMEM+90% FBS+1%双抗)培养于37 ℃恒温细胞培养箱中。
-
将RAW264.7细胞以1×103个/孔接种于96孔板,完全培养基培养24 h,弃上清液,给予不同浓度的LCA培养液(3、1.5、0.75和0.375 μmol/L),并设置空白对照组,每组5个复孔,培养24 h,采用MTT法测定LCA对小鼠单核巨噬细胞的增殖作用。
-
将RAW264.7细胞以1×106个/孔接种于24孔板,24 h后弃上清液,脂多糖(LPS)组和LCA组中加入1 ml含2 μg/ml LPS的完全培养基,刺激2 h,于空白组和LPS组中加入1 ml完全培养基,给药组加入各浓度LCA(1.5、0.75和0.375 μmol/L)的完全培养基,作用24 h后,测NO含量:取100 μl上清液与100 μl Griess试剂(A液:对氨基苯磺酸0.1 g,加5%磷酸10ml;B液:N-α-萘乙二胺0.01 g,加10ml蒸馏水,等体积混合)混合避光显色30 min,用酶标仪于540 nm处测各孔吸光度(A)值;测TNF-α:取上清液,根据ELISA试剂盒说明书步骤测量上清液中炎症因子TNF-α的含量。
-
将RAW264.7细胞以1×106个/孔接种于6孔板,细胞贴壁后,处理组(LPS组、LCA组)中加入1ml含2 μg/ml LPS的完全培养基,刺激2 h,于空白组和LPS组中加入1 ml完全培养基,给药组加入各浓度LCA(1.5、0.75和0.375 μmol/L)的完全培养基,作用24 h后,细胞裂解提取蛋白并定量,蛋白变性后SDS-PAGE凝胶电泳分离后,转膜,封闭,依次用iNOS,COX-2及GAPDH于4 ℃孵育过夜,用洗膜液(TBST)清洗3次后,二抗室温孵育1 h,TBST洗涤后,用化学发光试剂盒于凝胶成像仪中显影拍片。
-
本实验指标均为定量数据,数据以(
$\bar{x}\pm s$ )形式表示。多组定量数据的比较,采用单因素方差分析,方差分析检验后两两比较采用Dunnett's t-test法。采用GraphPad Prism 5统计软件进行统计学分析。结果以P<0.05、P<0.01表示差异具有统计学意义。 -
如表1所示,与模型组对比,吲哚美辛(8 mg/kg)可抑制由二甲苯造成的小鼠耳廓肿胀(P<0.05),抑制率为29.80%;LCA(40 mg/kg)组显著抑制小鼠耳廓肿胀度(P<0.01),抑制率为37.41%,而LCA(20 mg/kg)组对小鼠耳廓肿胀度的抑制无统计学意义(P>0.05)。
表 1 LCA对二甲苯致小鼠耳廓肿胀的影响(n=10,
$\bar{ x}\pm {{s}}$ )组别 肿胀度(m/mg) 抑制率(%) 模型组 3.02±0.63 — LCA组(20 mg/kg) 2.52±0.29 16.56 LCA组(40 mg/kg) 1.89±0.54** 37.41 吲哚美辛组(8 mg/kg) 2.12±0.61* 29.80 *P<0.05,**P<0.01,与模型组比较。 -
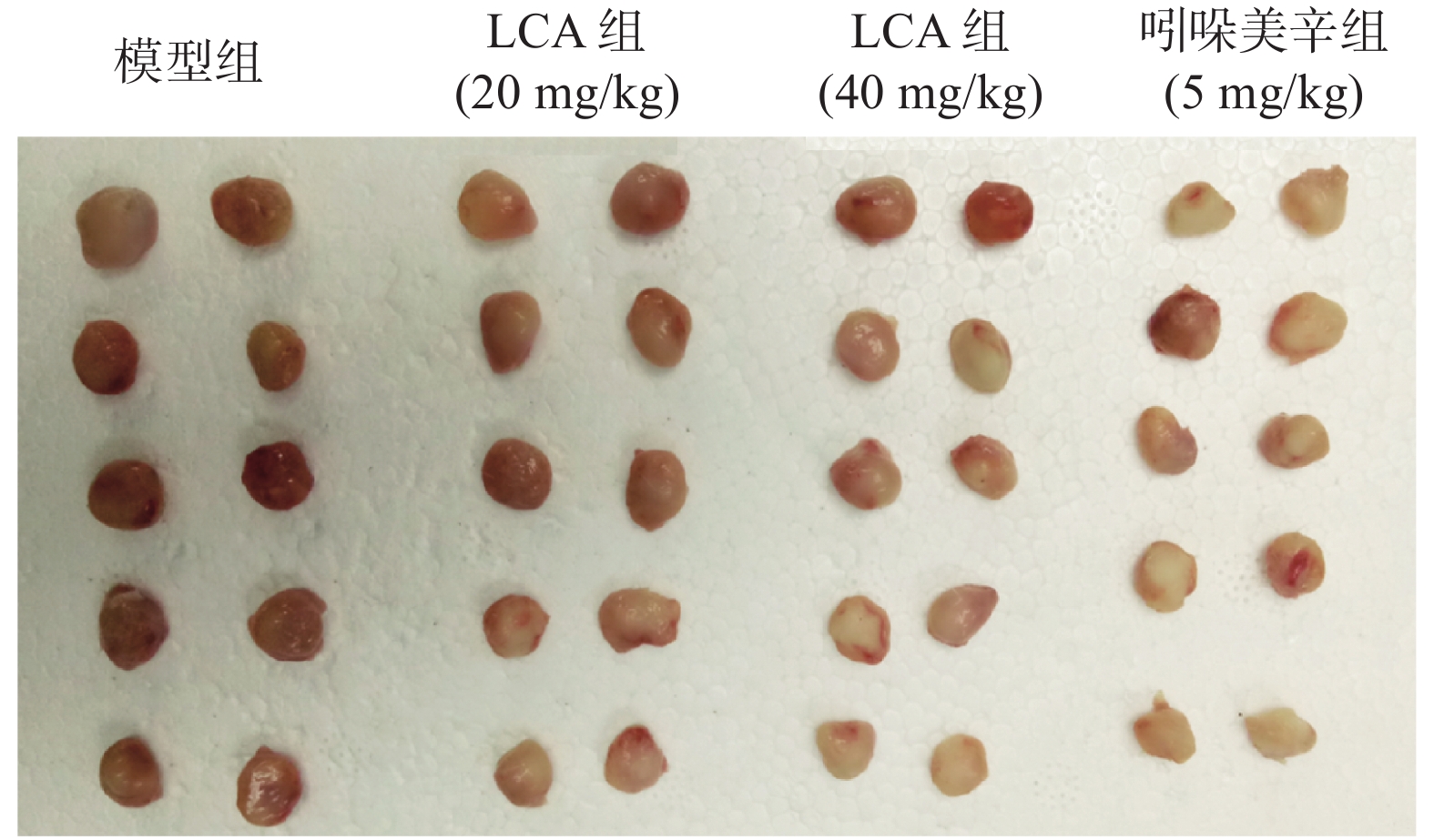
如图2,模型组大鼠棉球肉芽肿体积较大且颜色鲜红,吲哚美辛组的棉球肉芽肿体积小且颜色浅,而LCA组的棉球肉芽肿在色泽和大小上均有别于模型组。数据分析显示(表2、表3),与模型组相比,阳性药组吲哚美辛明显抑制大鼠的棉球肉芽肿(P<0.001),且干重、湿重的抑制率分别为48.73%和44.19%;LCA高剂量组也可明显减少棉球肉芽肿的干重及湿重(P<0.01),且抑制率达到23.89%和29.90%。
表 2 LCA对大鼠棉球肉芽肿湿重的影响(n=5,
$\bar{ x}\pm {{s}}$ )组别 棉球肉芽肿湿重(m/mg) 抑制率(%) 模型组 300.1±53.26 — LCA组(20 mg/kg) 256.0±36.36 14.70 LCA组(40 mg/kg) 228.4±51.16*** 23.89 吲哚美辛组(5 mg/kg) 167.5±15.74*** 44.19 ***P<0.001,与模型组比较。 表 3 LCA对大鼠棉球肉芽肿干重的影响(n=5,
$\bar{ x}\pm {{s}}$ )组别 棉球肉芽肿干重(m/mg) 抑制率(%) 模型组 48.1±10.05 — LCA组(20 mg/kg) 42.32±10.19 12.05 LCA组(40 mg/kg) 33.73±7.10** 29.90 吲哚美辛组(5 mg/kg) 24.67±7.39*** 48.73 **P<0.01,***P<0.001,与模型组比较。 -
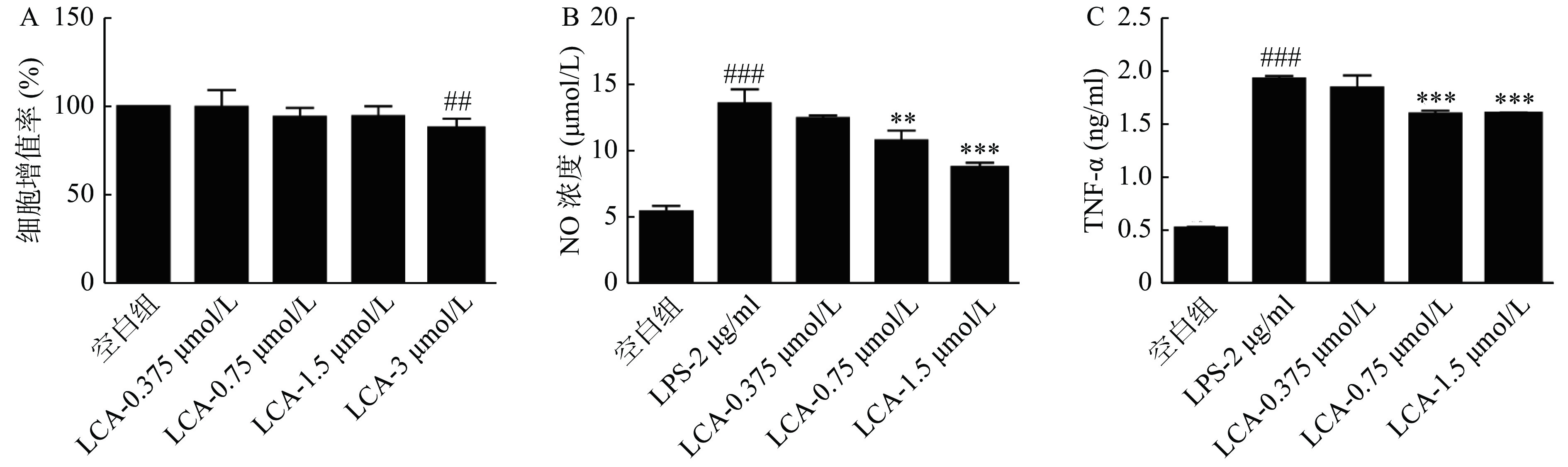
如图3所示,LCA的安全剂量不高于3 μmol/ml,且在0.75和1.5 μmol/ml浓度下显著降低LPS诱导的RAW264.7细胞分泌的NO和TNF-α浓度,差异均具有统计学意义(P<0.01)。
-
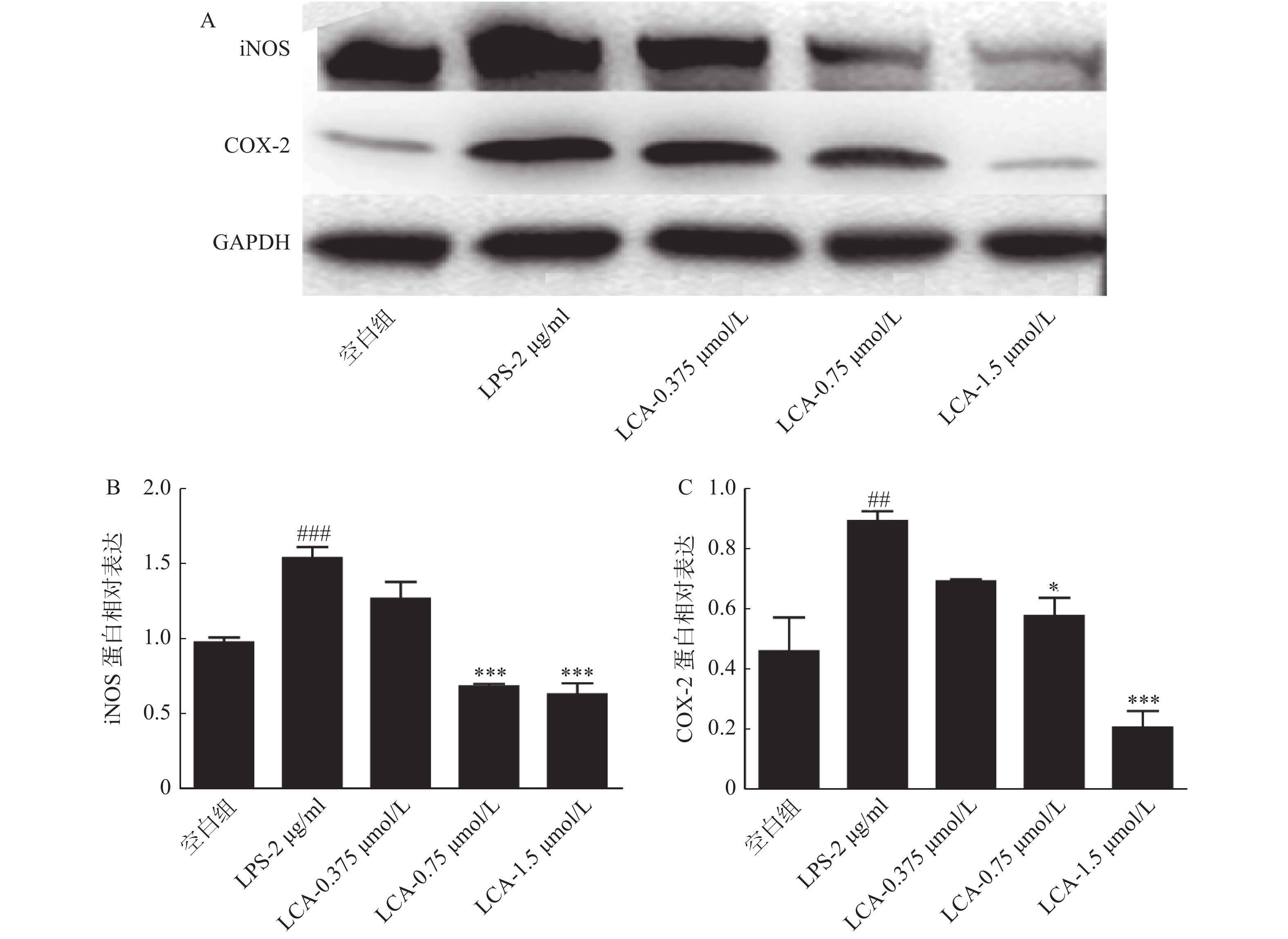
如图4所示,LCA在1.5 μmol/ml浓度下显著抑制了炎症相关蛋白iNOS、COX-2蛋白的表达(P<0.001)。
-
据报道[12],许多从中药中提取的活性天然化合物可以达到抗炎效果,包括黄芩苷、青藤碱和大黄素等,多为甘草次酸酰胺类衍生物。LCA不同于这些抗炎药物,它具有新颖的二苄基丁烷型结构,本研究从体内、体外两方面对它进行较为系统的抗炎药效评价。
二甲苯诱导的小鼠耳肿胀模型是评价药物体内抗炎活性的急性炎症模型之一[13],本实验模型组中二甲苯作为致炎剂刺激小鼠耳廓皮肤,促进血管舒张、增加血管通透性致使炎性物质渗出,耳片重量明显高于未经处理的耳片重量,LCA组能明显改善小鼠耳部的炎性渗出及肿胀程度,且高浓度组的抑制率高于阳性药吲哚美辛组(由于吲哚美辛高浓度有强烈的胃肠道反应,故根据临床用药剂量换算出实验动物的剂量,并参考相关文献确定用药量[13],即8 mg/kg),表明LCA对急性炎症有显著作用。在慢性炎症期,由于巨噬细胞和纤维母细胞等增生而形成肉芽组织,棉球肉芽肿实验可模拟炎症病理过程中炎性细胞浸润和肉芽组织的增生[14]。结果显示LCA降低棉球肉芽肿的湿重与干重,表明LCA可以控制慢性炎症过程中炎性渗出物的转移,同时抑制棉球外侧小血管和结缔组织的增生,证明LCA可以减少慢性炎症进程中肉芽组织的形成。结合上述两个动物实验可知LCA对急性炎症以及慢性炎症都具有一定的抑制作用。
炎症的普遍特征是病灶区域有大量炎症细胞的浸润,并释放大量炎症因子和介质,如IL-1、IL-6、TNF-α、前列腺素(PG)、组织胺和NO等。其中,NO可激活NF-κB信号通路,诱导促炎因子(IL-6、TNF-α等)的分泌,引起机体组织损伤以及血管扩张;TNF-α可刺激细胞免疫中T细胞产生炎症因子,进而诱导炎症的加重和扩大。iNOS可介导产生的大量NO并参与炎症反应;COX-2介导产生的前列腺素与慢性炎症的发展和持续有关,致使白细胞聚集和浸润,引起微血管内皮细胞的损伤。在本研究中,LPS刺激后,RAW264.7细胞分泌的NO和TNF-α含量,以及细胞内iNOS和COX-2蛋白水平明显增高,LCA浓度为1.5 μmol/ml时显著抑制激活状态下NO和TNF-α炎症介质的分泌,同时下调iNOS及COX-2蛋白的表达水平。由此进一步证实LCA具有抗炎作用。然而,LCA抗炎的具体作用机制尚不明确,有待今后进行更深层次的研究探讨。
豆豉姜活性成分9,9’-O-二-(E)-阿魏酰基-内消旋-5,5’-二甲氧基开环异落叶松树脂酚(LCA)抗炎作用研究
doi: 10.12206/j.issn.1006-0111.201912159
Anti-inflammatory study on 9,9'-O-di-(E)-feruloyl-meso-5,5'-dimethoxysecoisolariciresinol (LCA), an active ingredient in Litsea cubeba (Lour.) Pers
-
摘要:
目的 对傣药豆豉姜活性成分LCA在动物及细胞水平上的抗炎作用进行评价。 方法 采用耳肿胀和棉球肉芽肿模型进行LCA抗炎的体内药效学评价。采用脂多糖(LPS)诱导的小鼠单核巨噬细胞(RAW264.7),通过检测其一氧化氮(NO)、肿瘤坏死因子-α(TNF-α)的分泌量以及诱导型一氧化氮合酶(iNOS)、环氧合酶-2(COX-2)蛋白的表达水平,以评价LCA的体外抗炎活性。 结果 在小鼠耳肿胀的实验中,LCA组的耳肿胀度明显低于模型组,且高浓度组对小鼠耳肿胀的抑制率高于阳性药组;在大鼠棉球肉芽肿实验中,LCA高剂量组显著减轻了棉球肉芽肿的湿重与干重。此外,LCA显著减少LPS诱导的RAW264.7细胞中NO、TNF-α的分泌,降低iNOS、COX-2蛋白的表达。 结论 LCA具有显著的体内外抗炎作用,值得进一步深入研究。 -
关键词:
- LCA /
- 抗炎 /
- 耳肿胀 /
- 肉芽肿 /
- RAW264.7细胞
Abstract:Objective To evaluate the anti-inflammatory effects of LCA, which is the active component from Litsea cubeba (Lour.) Pers. Methods Pharmacodynamic evaluations of ear swelling and cotton ball granuloma models were used in animal experiments. In vitro experiment, lipopolysaccharide (LPS) stimulated monocyte macrophage RAW264.7 cells were used to evaluate the anti-inflammatory activity of LCA by detecting the secretions of nitric oxide (NO), tumor necrosis factor-α (TNF-α), the expressions of inducible nitric oxide synthase (iNOS) and cyclooxygenase-2 (COX-2) protein. Results In ear swelling experiment, the extent of ear swelling was significantly lower in the LCA treated group than the model group. The inhibition rate was greater in the high LCA concentration group than the positive drug group. In addition, LCA reduced the weight of cotton ball granuloma markedly. At the cell level, LCA significantly inhibited the secretions of NO, TNF-α and reduced the expressions of iNOS and COX-2 in LPS-stimulated RAW 264.7 cells. Conclusion LCA has significant anti-inflammatory effects in vitro and in vivo. The further studies are warranted for the development of anti-inflammatory drugs. -
Key words:
- LCA /
- anti-inflammatory /
- ear swelling /
- granuloma of cotton ball /
- RAW264.7 cell
-
随着经济的发展和人民生活水平的提高,糖尿病的患病率仍在逐年上升,血管并发症是导致患者残疾和死亡的主要原因,并给社会和经济的发展带来了沉重负担。内皮祖细胞(endothelial progenitor cells, EPCs)在各种因素刺激下,从骨髓动员到外周血,参与损伤内皮的修复,在血管新生中具有重要作用[1-3]。但是高血糖会导致EPCs数量减少及功能受损[4-5]。研究表明,雌激素降低是心血管疾病发病的危险因素。因此,本实验通过研究雌激素对糖尿病大鼠EPCs功能的改善作用并探讨可能的作用机制,为探讨糖尿病血管并发症提供理论依据。
1. 材料
1.1 实验动物
SPF 级 Wistar大鼠,雄性,体重(180±10)g(上海斯莱克实验动物有限公司)。实验期间,保持动物房室温在22 ℃左右,相对湿度70%左右,早8点至晚8点自动照明。动物自由进食,自由饮水,所有实验动物均符合实验动物伦理学要求。
1.2 药物与主要试剂
雌激素(Abcam公司);链脲佐菌素(Sigma aldrich公司);FITC标记的荆豆凝集素I(FITC-UAE-I)(美国Sigma公司);Dil 标记的乙酰化低密度脂蛋白(Dil-ac-LDL)(Molecular Probe公司);甲醛溶液(国药集团化学试剂有限公司);基质胶(matrigel)(Thermo Fisher公司);EGM-2 培养基(LON-ZA 公司);CCK-8试剂盒(日本Dojindo公司);NO检测试剂盒(美国Abcam公司)。
2. 方法
2.1 动物模型的制备
Wistar雄性大鼠,10~12周,适应性地喂养1周后,连续7 d空腹腹腔注射新鲜配制的链脲佐菌素(streptozotocin, STZ)55 mg/(kg·d),对照组大鼠腹腔注射等体积枸橼酸钠缓冲液。7 d后测空腹血糖(禁食12 h),将血糖值为13.5~25 mmol/L的大鼠作为糖尿病大鼠进行实验。注射STZ后,每周称体重,观察体重变化。大鼠给药、饲养过程中勤换垫料,勤补水。
2.2 大鼠骨髓来源EPCs的分离培养
大鼠麻醉后处死,将大鼠整体置于75%乙醇浸泡10 min。取出大鼠,使用吸水纸吸干动物身上水分后转移至超净工作台,剥离胫骨,使用无菌剪刀减去骨头两端,使用1ml PBS通过注射器冲洗骨髓并将冲洗液转移至15 ml无菌离心管,冲洗过程重复操作3次。用密度梯度离心法获取单核细胞,将单核细胞重悬于培养基EGM-2并调整细胞浓度至1×106个/ml,接种于预先包被好纤维连接蛋白的细胞培养皿,置于细胞培养箱37 ℃和5%CO2条件下培养。培养3 d后洗去未贴壁细胞,以后每3 d换培养液培养至7 d。PBS洗去未贴壁细胞,贴壁细胞供实验用。
2.3 大鼠骨髓来源EPCs的鉴定
培养7 d的EPCs用0.25%胰蛋白酶消化后收集于15 ml离心管中,将细胞用PBS 1000r/min离心5 min,清洗3次。用PBS 100 μl重悬细胞,每管加入CD34和CD133抗体各2 μl,4 ℃避光孵育30 min后用PBS清洗离心,将细胞重悬于300 μl PBS中避光保存待上机检测;同时将消化的细胞采用DiI-Ac-LDL 和FITC-UAE-I双染,倒置荧光显微镜观察染色结果,双染色阳性细胞为正在分化的EPCs。
2.4 实验分组
实验分3组:①对照组;②糖尿病组:M199培养基;③雌激素组:含雌激素10 nmol/L的M199培养基。在37 ℃,5% CO2培养箱中孵育24 h 后进行实验。
2.5 大鼠骨髓来源EPCs功能测定[6-7]
2.5.1 细胞迁移实验
3组EPCs用0.25%胰酶消化,将细胞重悬于EBM-2 培养基中,调整细胞密度为5×105个/ml,并取100 μl接种于Transwell 上室,在下室中加入600 μl含50 ng/ml 血管内皮生长因子的EGM-2 培养基。37 ℃、5% CO2孵育24 h 后,取出上室,用棉球轻轻擦拭上室底部膜内上表面的细胞,下室上表面用甲醛室温固定20 min,于37 ℃用0.1%结晶紫染色30 min,用PBS多次冲洗晾干后在160倍光学显微镜下观察并拍照,随机选取5个视野计算迁移细胞数并计算平均值。
2.5.2 EPCs小管形成实验
在冰上将48 孔板预冷,然后加入150 μl的基质胶Matrigel,放置于37 ℃孵育30 min。3组EPCs用0.25%胰酶消化,将5×104个细胞接种于Matrigel上,在37 ℃、5% CO2培养箱中孵育24 h 后,于160倍光学显微镜下观察并拍照,随机选取5个视野计算形成小管的数目并计算平均值。
2.6 骨髓来源EPCs中NO水平的测定
3组EPCs用0.25%胰酶消化,经PBS清洗2次,制成细胞悬液,采用NO检测试剂盒测定EPCs中NO的水平。按照说明书的操作方法,完成后置于酶标仪在540 nm波长处测定吸光度(A)。
2.7 EPCs增殖能力的测定
3组EPCs用0.25%胰酶消化,将100 μl细胞悬液接种于96孔培养板中并置于37 ℃、5% CO2培养箱培养24 h。每孔加入CCK-8溶液10 μl培养4 h,置于酶标仪于450 nm处测A值。
2.8 Western blotting测定EPCs中MnSOD水平
收集3组EPCs并提取蛋白,应用BCA法进行蛋白质定量。蛋白样本经煮沸变性、SDS-PAGE电泳后加入兔抗人锰超氧化物歧化酶(MnSOD)和肌动蛋白(β-actin)多克隆抗体(1∶1500稀释),蛋白质湿法转移至硝基纤维素膜,羊抗兔二抗(1∶2000稀释)室温孵育2 h,用ECL化学发光法显色,Image J凝胶成像分析系统扫描成像,测定目标条带的A值,以β-actin为内参比较同一条带与β-actin的灰度值进行分析。
2.9 ELISA检测EPCs上清液中TSP-1蛋白水平
收集3组EPCs上清液,按照说明书步骤进行操作。取各组细胞上清液各100 μl加入酶标板中37 ℃孵育90 min,然后加入100 μl生物素标记抗体工作液37 ℃孵育60 min。洗涤3次,加入100 μl酶结合物工作液在37 ℃孵育30 min后,洗涤5次。加入90 μl底物溶液37 ℃孵育15 min,最后加入终止液50 μl后,立即在450 nm波长处测量A值。
2.10 统计学处理
实验数据以(
$ \overline{\text{x}}\text{±}\text{s} $ )表示,采用GraghPad Prism软件进行统计处理,采用单因素方差分析(One-way ANOVA)检验差异的显著性。以P<0.05为差异有统计学意义。3. 实验结果
3.1 各组大鼠体重和血糖的变化
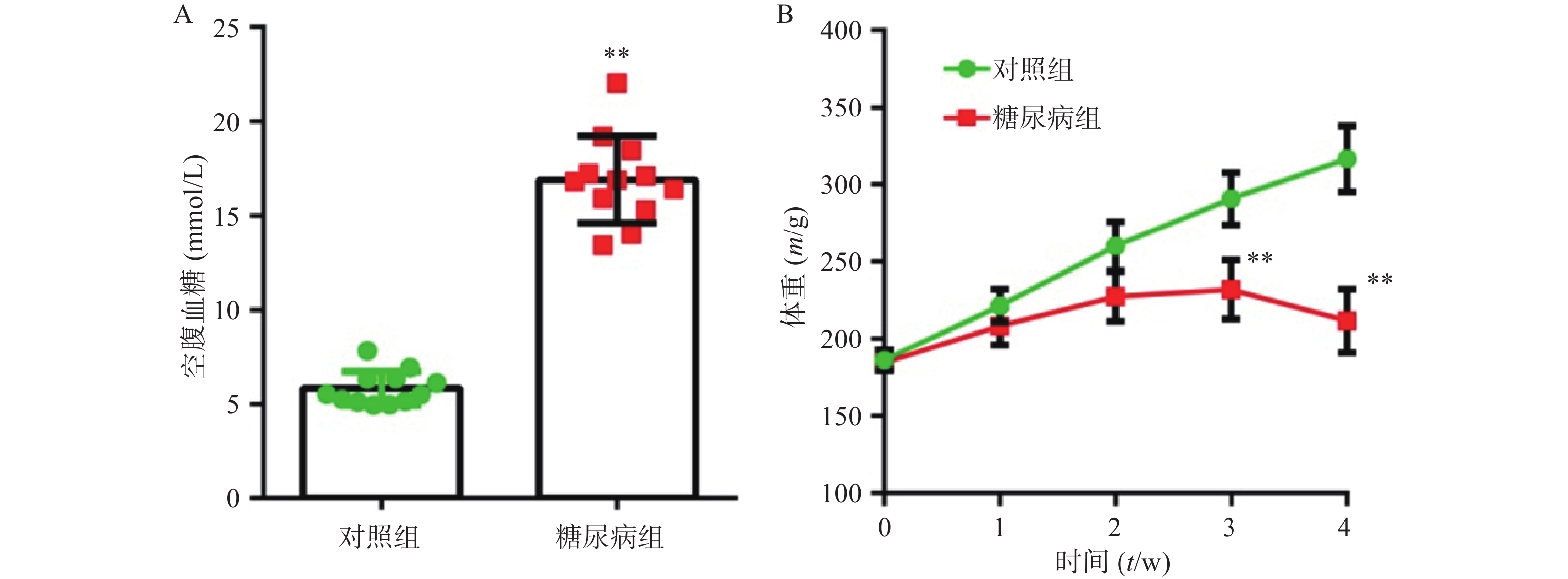
正常组大鼠,精神状态良好,动作自如,反应灵敏,毛发平伏有光泽。而糖尿病大鼠体重变轻,精神萎靡,反应迟钝,毛杂乱无光泽,动作迟缓,弓背捲体,尿量显著增加。在建模4周后,糖尿病模型组空腹血糖值(23.33±3.61)mmol/L明显高于对照组(16.91±2.30)mmol/L,组间差异有统计学意义(P<0.01) (图1A) 。对照组动物体重随时间增加而增加,模型组在前3周随时间缓慢增加,但最后1周出现体重下降趋势。在第3、4周,两组动物体重有显著差异(P<0.01) (图1B) 。
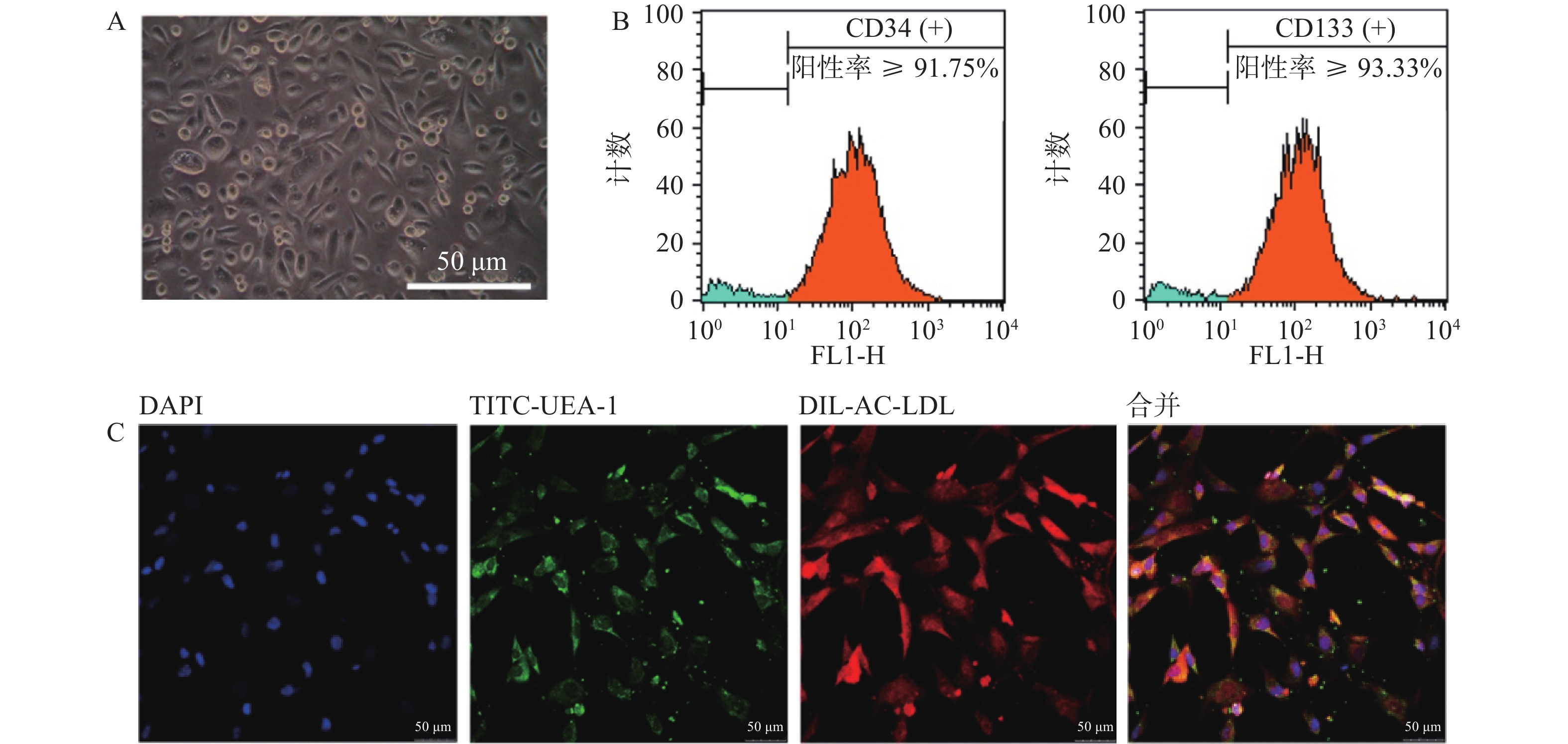
3.2 大鼠骨髓来源EPCs的分离培养和鉴定
以EGM-2培养基定向诱导培养5 d后,镜下观察可见贴壁细胞形态由圆形逐渐向梭形转化(图2A)。流式细胞仪检测结果显示,CD34与CD133双阳性细胞占比不小于总细胞数的85.63%(图2B)。采用Dil-Ac-LDL和TITC-UEA-1双染细胞,显示红绿荧光双阳性细胞占视野中细胞的绝大多数(图2C)。上述结果表明,我们成功地制备了大鼠骨髓来源EPCs细胞,且细胞具有较高纯度。
3.3 雌激素孵育改善糖尿病大鼠EPCs的增殖和功能
与对照组比较,糖尿病大鼠EPCs的对数期增殖活性明显降低(P<0.01),而雌激素孵育后其增殖活性明显改善(P<0.01)(图3A)。与对照组比较,糖尿病大鼠EPCs的小管形成功能明显下降(P<0.01),而雌激素能够明显改善其小管形成功能(P<0.01)(图3B)。细胞迁移实验表明,与对照组比较,糖尿病大鼠EPCs细胞迁移能力明显受损(P<0.01),而雌激素孵育能够明显改善受损的细胞迁移能力(P<0.01)(图3C)。
3.4 雌激素孵育上调糖尿病EPCs细胞内NO含量
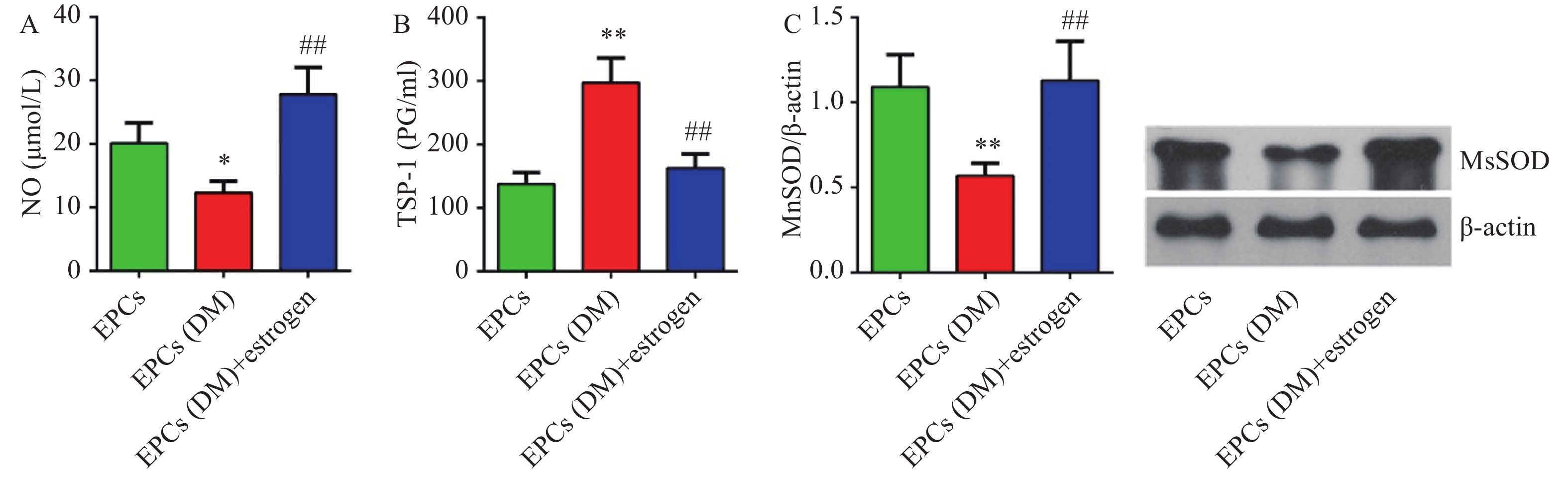
糖尿病大鼠EPCs细胞中NO含量较对照组明显降低(P<0.05),而雌激素孵育能够明显上调NO的含量(P<0.01)(图4A)。
3.5 雌激素孵育上调EPCs细胞中MnSOD的表达并下调上清液中TSP-1的表达
糖尿病组大鼠EPCs细胞上清液中TSP-1含量明显高于对照组(P<0.01),而给与雌激素孵育后细胞上清液中TSP-1含量明显降低(P<0.05,图4C)。Western blotting检测显示,糖尿病组大鼠EPCs中MnSOD蛋白表达较对照组明显降低(P<0.01),而雌激素孵育能够明显上调细胞中MnSOD蛋白表达(P<0.01)(图4D)。
4. 讨论
EPCs主要来源于骨髓,在血管新生中具有重要作用。1997年Asahara等[1]首次将其命名为内皮祖细胞,而后其在心血管方面的研究越来越多。EPCs与心血管疾病存在密不可分的联系。研究表明,EPCs的数量和功能与高血压、糖尿病、血脂等呈负相关[8-11]。此外,EPCs在脑缺血、阿尔茨海默症治疗中表现出较好的疗效[12-13]。故改善EPCs功能及增加其数量可作为改善糖尿病血管并发症的新靶点。并将能表达CD34、CD133 等干细胞特征或血管内皮生长因子受体2 (VEGFR2)等细胞标志物定义为EPCs[14]。用密度梯度离心法获取骨髓单核细胞,经培养并采用流式细胞术和荧光显微镜法对细胞进行鉴定,结果表明本实验成功制备大鼠骨髓来源EPCs细胞,且细胞具有较高纯度。
流行病学提示雌激素为心脑血管疾病的保护因素。绝经后女性卒中发生风险明显高于绝经前女性[15]。美国的调查数据显示,年龄在18~39岁的成年男性发生高血压的风险高于同龄女性,但是在年龄大于60岁成人中男性风险低于女性[16]。不同性别发生高血压及靶器官损伤的差异与雌激素相关[17]。此外,杨莹莹[18]等的研究表明雌激素对急性期高血压脑出血患者的EPCs功能有改善作用且与雌激素浓度呈正相关。但是雌激素对糖尿病EPCs功能改善作用及相关机制的研究较少。
本实验采用腹腔注射链脲佐菌素制作大鼠糖尿病模型,提取其骨髓来源的EPCs进行实验,结果发现糖尿病大鼠骨髓EPC的增殖能力较正常EPCs明显下降,而雌激素体外孵育能明显促进其增殖活力;除增殖活力受到抑制外,糖尿病大鼠EPCs的迁移能力和小管形成功能也明显受损,而在体外给予雌激素10 nmol/L孵育后细胞功能得到明显改善。说明雌激素能促进糖尿病大鼠EPCs的增殖并改善其功能。
研究表明氧化应激可导致血管内皮损伤。MnSOD是一种存在于线粒体并能清除机体新陈代谢中产生的过多的氧自由基(O2·−)等有害物质的一种酶[19,]。MnSOD在一定程度上能抵抗高糖所增加线粒体中的活性氧(ROS)细胞的伤害[20]。本实验采用Western blotting检测EPCs细胞中MnSOD蛋白表达,糖尿病组大鼠EPCs细胞中MnSOD蛋白表达明显低于对照组,而给与雌激素体外孵育后能明显上调细胞中MnSOD蛋白表达,说明雌激素通过上调EPCs中MnSOD水平而改善细胞功能。
一氧化氮(NO)与血管健康密切相关。NO通过促进EPCs向内皮细胞分化进而修复受伤的内皮,而抑制内源性NO的合成对EPCs的迁移能力有不良影响[21]。有文献报道,高血糖通过增加活性氧积聚、降低一氧化氮生物利用度及抑制内皮依赖性血管舒张功能,导致严重的血管内皮功能障碍[22-23]。凝血酶敏感蛋白-1(TSP-1)属细胞外基质糖蛋白,其过表达能抑制EPCs的功能[24],而NO含量降低能诱导TSP-1的表达[25]。本实验发现,糖尿病组大鼠EPCs中NO含量明显降低而细胞上清中TSP-1含量明显升高,雌激素处理能够逆转上述改变,说明雌激素通过增加EPC内NO水平并降低TSP-1含量进而改善糖尿病EPCs功能。
综上所述,本研究证实雌激素能改善受损的糖尿病大鼠EPCs功能并促进其增殖,作用机制可能与其降低细胞内的氧化应激及下调TSP-1的表达相关。本研究为将来进一步进行雌激素在糖尿病血管并发症方面的研究提供了深入的实验与理论依据。
-
表 1 LCA对二甲苯致小鼠耳廓肿胀的影响(n=10,
$\bar{ x}\pm {{s}}$ )组别 肿胀度(m/mg) 抑制率(%) 模型组 3.02±0.63 — LCA组(20 mg/kg) 2.52±0.29 16.56 LCA组(40 mg/kg) 1.89±0.54** 37.41 吲哚美辛组(8 mg/kg) 2.12±0.61* 29.80 *P<0.05,**P<0.01,与模型组比较。 表 2 LCA对大鼠棉球肉芽肿湿重的影响(n=5,
$\bar{ x}\pm {{s}}$ )组别 棉球肉芽肿湿重(m/mg) 抑制率(%) 模型组 300.1±53.26 — LCA组(20 mg/kg) 256.0±36.36 14.70 LCA组(40 mg/kg) 228.4±51.16*** 23.89 吲哚美辛组(5 mg/kg) 167.5±15.74*** 44.19 ***P<0.001,与模型组比较。 表 3 LCA对大鼠棉球肉芽肿干重的影响(n=5,
$\bar{ x}\pm {{s}}$ )组别 棉球肉芽肿干重(m/mg) 抑制率(%) 模型组 48.1±10.05 — LCA组(20 mg/kg) 42.32±10.19 12.05 LCA组(40 mg/kg) 33.73±7.10** 29.90 吲哚美辛组(5 mg/kg) 24.67±7.39*** 48.73 **P<0.01,***P<0.001,与模型组比较。 -
[1] ANTONISAMY P, DURAIPANDIYAN V, IGNACIMUTHU S, et al. Anti-diarrhoeal activity of friedelin isolated from Azima tetracantha lam. in wistar rats[J]. Sijbs,2015,1(1):34. doi: 10.22205/sijbs/2015/v1/i1/100440 [2] CHEN M, FU Q T, SONG X, et al. Preparation of resveratrol dry suspension and its immunomodulatory and anti-inflammatory activity in mice[J]. Pharm Biol,2020,58(1):8-15. doi: 10.1080/13880209.2019.1699123 [3] ANTONISAMY P, AGASTIAN P, KANG C W, et al. Anti-inflammatory activity of Rhein isolated from the flowers of Cassia fistula L. and possible underlying mechanisms[J]. Saudi J Biol Sci,2019,26(1):96-104. doi: 10.1016/j.sjbs.2017.04.011 [4] 翁丽丽, 邱金文, 宋启印. 榆耳发酵液醇沉物抗炎作用[J]. 吉林中医药, 2007, 27(10):56. doi: 10.3969/j.issn.1003-5699.2007.10.047 [5] MEIRA N A, KLEIN L C Jr, ROCHA L W, et al. Anti-inflammatory and anti-hypersensitive effects of the crude extract, fractions and triterpenes obtained from Chrysophyllum cainito leaves in mice[J]. J Ethnopharmacol,2014,151(2):975-983. doi: 10.1016/j.jep.2013.12.014 [6] RATHI M A, MEENAKSHI P, GOPALAKRISHNAN V K. Hepatoprotective activity of ethanolic extract of Alysicarpus vaginalis against nitrobenzene-induced hepatic damage in rats[J]. Sijbs,2015,1(2):60. doi: 10.22205/sijbs/2015/v1/i2/100420 [7] WANG J W, CHEN S S, ZHANG Y M, et al. Anti-inflammatory and analgesic activity based on polymorphism of cedrol in mice[J]. Environ Toxicol Pharmacol,2019,68:13-18. doi: 10.1016/j.etap.2019.02.005 [8] LIN B, ZHANG H, ZHAO X X, et al. Inhibitory effects of the root extract of Litsea cubeba (lour.) pers. on adjuvant arthritis in rats[J]. J Ethnopharmacol,2013,147(2):327-334. doi: 10.1016/j.jep.2013.03.011 [9] BOOTS A W, WILMS L C, SWENNEN E L, et al. In vitro and ex vivo anti-inflammatory activity of quercetin in healthy volunteers[J]. Nutrition,2008,24(7-8):703-710. doi: 10.1016/j.nut.2008.03.023 [10] 刘玉明, 刘慧民, 蒋定文, 等. 复方苦参酊剂对炎症小鼠和大鼠的抗炎作用研究[J]. 中国药师, 2019, 22(11):2108-2110. doi: 10.3969/j.issn.1008-049X.2019.11.039 [11] LI Z P, HU J F, SUN M N, et al. Anti-inflammatory effect of IMMLG5521, a coumarin derivative, on Sephadex-induced lung inflammation in rats[J]. Int Immunopharmacol,2012,14(2):145-149. doi: 10.1016/j.intimp.2012.06.004 [12] 张志锋, 吴尤娇, 陈丽, 等. 藏药材白花刺参总皂苷的抗炎作用及机制[J]. 中药药理与临床, 2018, 34(5):49-52. [13] LIU X B, YANG B X, ZHANG L, et al. An in vivo and in vitro assessment of the anti-inflammatory, antinociceptive, and immunomodulatory activities of Clematis terniflora DC. extract, participation of aurantiamide acetate[J]. J Ethnopharmacol,2015,169:287-294. doi: 10.1016/j.jep.2015.04.009 -






 下载:
下载:

 下载:
下载: