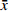-
免疫介导的炎性眼前段疾病(immune-mediated inflammatory anterior ocular diseases, IIAODs)是一类常见的眼科疾病,包括过敏性角结膜炎、前葡萄膜炎等。这类疾病可能引起某些严重的并发症和后遗症,是主要的致盲原因之一[1]。他克莫司(tacrolimus,FK506)是治疗IIAODs的一种强力而有效的免疫抑制剂。然而,其水溶性差(3 μg/ml)[2]、生物利用度低,是限制其用于眼科临床的主要障碍。为此,人们研究了许多新型他克莫司眼用制剂,如软膏剂[3-5]、胶束[6]、纳米乳[7]、混悬液[8]等,但其生物利用度仍未得到明显改善。目前,他克莫司眼用制剂在国内上市剂型为混悬液(Talymus®,日本千寿药业),其药效较常规滴眼液有一定程度的提高,但仍然容易受到泪液冲刷而流失大量药物。因此,研发一种眼部高滞留FK506制剂是一个亟待解决的问题。
本研究以阳离子纳米乳(cationic nanoemulsion, CNE)作为他克莫司的载体,以泊洛沙姆407和泊洛沙姆188作为凝胶基质,制备了他克莫司阳离子微乳凝胶(FK506-loaded cationic nanoemulsion-based in-situ gel, FK506 CNE GEL)。该制剂兼具阳离子纳米乳及温敏型原位凝胶的双重特性,不仅改善了他克莫司低水溶性问题,而且其所带的正电荷能与角膜所带的负电荷发生静电相互作用,以及凝胶对眼黏膜的强亲和力均大大延长了眼部滞留时间。本研究根据适宜的胶凝温度筛选出最优凝胶基质处方并对最优处方制备的他克莫司微乳凝胶进行体外释药研究,为后期进一步研究提供基础。
-
Agilent 1100型高效液相色谱系统(美国安捷伦公司);AL204 电子天平(梅特勒托利多仪器有限公司);DF-101S集热式恒温加热磁力搅拌器(上海精密试验设备有限公司);NS1001L型高压均质机(意大利Niro Soavi公司);JEM-1230透射电子显微镜(日本JEOL公司);ZHWY-200D恒温培养振荡器(上海智城分析仪器制造有限公司);TA-Discovery II旋转流变仪(美国TA仪器公司);OS20-Pro电动搅拌器(北京大龙兴创实验仪器有限公司);YAOHUA 1306精密温度计(耀华仪器有限公司)。
-
他克莫司对照品(含量99.3%,福建科瑞药业有限公司);蓖麻油(湖南宏康制药股份有限公司);中链脂肪酸甘油酯(铁岭北亚药用油有限公司);吐温-80(四川金山制药有限公司);泊洛沙姆188(德国BASF公司);泊洛沙姆407(德国BASF公司);西他氯胺(Sigma-Aldrich);甘油(湖南尔康制药有限公司);注射用水(明澈D24UV);异丙醇、磷酸、乙腈、二水氯化钙(国药集团化学试剂有限公司);碳酸氢钠(上海虹光化工厂有限公司);氯化钠(西陇科学股份有限公司);氯化钾(天津恒兴化学试剂制造有限公司);其他药品和试剂均为药用规格或分析纯。
-
色谱柱:Agilent Zorbax Eclipse XDB-C18 (150 mm×4.6 mm, 5 μm);流动相:乙腈-水(磷酸调节pH 至4.5)(65∶35,V∶V);波长:210 nm;柱温:50 ℃;流速:1.0 ml/min;进样量:20 μl。
-
精密称取他克莫司对照品10.0 mg,置于10 ml量瓶中,加适量异丙醇溶解并稀释至刻度,制成1.0 mg/ml的储备液,4 ℃下避光保存。精密移取3.0 ml储备液,置于10 ml量瓶中,加适量异丙醇溶解并稀释至刻度,摇匀后即得。
-
取他克莫司微乳凝胶样品3 g,加入异丙醇溶解并稀释至10 ml,经0.22 μm滤膜过滤后,取续滤液,即得。
-
取空白阳离子微乳凝胶样品 3 g,加入异丙醇溶解并稀释至10 ml,经0.22 μm滤膜过滤后,取续滤液,即得。
-
分别精密吸取他克莫司储备液0.2、0.4、0.8、1.0、2.0、4.0、8.0、10.0 ml,置于10 ml量瓶中,用异丙醇稀释至刻度制成系列浓度的他克莫司溶液,摇匀后取上述溶液各20 μl,注入液相色谱仪,记录对应色谱图。以他克莫司色谱峰面积A为纵坐标,以他克莫司浓度C(μg/ml)为横坐标,进行线性回归,得线性回归方程:
$$ A = 15557C - 30.426,\;\;r = 0.9993 $$ 结果表明他克莫司在20~1000 μg/ml浓度范围内与峰面积呈良好的线性关系。
-
取对照品溶液在上述色谱条件下重复进样6次,计算他克莫司色谱峰面积的RSD值为1.78%。
-
取同一批他克莫司微乳凝胶6份,在上述色谱条件下测定,计算他克莫司微乳凝胶中他克莫司含量的RSD值为2.41%。表明仪器精密度及方法重复性良好。
-
他克莫司低、中、高3个浓度的提取回收率分别为(97.78±0.64)%、(98.22±0.51)%、(98.70±0.69)%,符合《中国药典》2015年版四部通则9101的要求,方法回收率良好,详见表1。
表 1 加样回收率试验结果(n=3)
加入量 (mg/ml) 测得量 (mg/ml) 回收率 (%) $\bar x$(%) RSD (%) 0.24 0.236 98.33 97.78 0.64 0.24 0.233 97.08 0.24 0.235 97.92 0.30 0.293 97.67 98.22 0.51 0.30 0.295 98.33 0.30 0.296 98.67 0.36 0.358 99.44 98.70 0.69 0.36 0.353 98.06 0.36 0.355 98.61 -
精密量取0.1 g 他克莫司、0.02 g西他氯胺、6 g中链脂肪酸甘油酯、4 g蓖麻油放入烧杯A中,在50 ℃下加热溶解作为油相;精密量取1 g吐温-80、0.1 g泊洛沙姆188、2.2 g甘油放入烧杯B中,加入适量注射用水并加热至50 ℃作为水相。将油相缓慢逐滴加入水相中,匀速搅拌同时避免乳滴溅出,控制搅拌速度为500 r/min。在50 ℃下继续搅拌30 min制得初乳,加入注射用水至100 ml,经600 bar高压均质8次后用0.1 mol/L氢氧化钠调节pH至7.4制得他克莫司纳米乳(0.1%,W/V)。
-
精密称取10 ml 他克莫司纳米乳,缓慢加入一定量的泊洛沙姆407和泊洛沙姆188,冰浴条件下充分搅拌使凝胶基质均匀分散于微乳溶液,再置于4 ℃恒温冰箱中溶胀24 h,取出搅拌均匀即得他克莫司微乳凝胶。
-
称取6.78 g 氯化钠,1.38 g氯化钾,2.18 g碳酸氢钠及0.084 g 二水合氯化钙,加入纯化水至1000 ml。
-
采用“玻璃瓶倒置法”[10],将装有10 ml他克莫司微乳凝胶的玻璃瓶静置于恒温磁力搅拌水浴锅中,设置初始温度为10 ℃,初始平衡20 min。放入转子以确保温度均匀扩散,控制升温速度为0.5~1.0℃/min,每次升温平衡1 min,期间不断将玻璃瓶倾斜60°~90°并观察瓶内溶液是否流动,将其不流动时的温度记为胶凝温度(T1),每个样品重复测定3次取平均值。
-
量取10 ml 他克莫司微乳凝胶于玻璃瓶中,再加入1.75 ml STF[11],按“2.7.4”项下方法测定并记录胶凝温度(T2),每个样品重复测定3次取平均值。
-
以泊洛沙姆407 和泊洛沙姆188共同作为温敏型他克莫司微乳凝胶的凝胶基质,考察不同凝胶基质浓度的他克莫司微乳凝胶对胶凝温度的影响,从而筛选出他克莫司微乳凝胶最终处方。
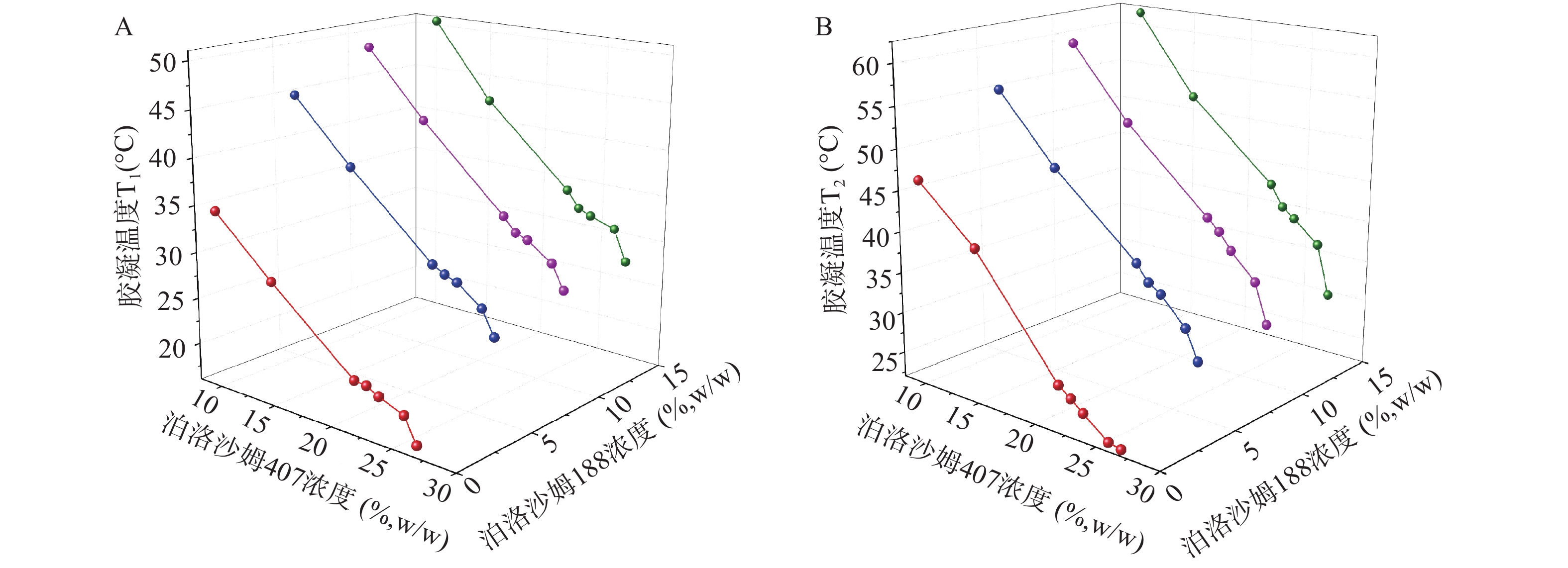
理想的微乳凝胶,其胶凝温度应高于室温,确保以滴入形式给药,并且经泪液稀释后仍能在低于眼表温度下35~36℃形成凝胶,以确保到达用药部位后立即转变为凝胶,因此合适的胶凝温度应在30~36℃之间。当泊洛沙姆407浓度小于22%或大于26%时,在30~36℃温度范围内难以形成凝胶。由图1可见,他克莫司微乳凝胶的胶凝温度随泊洛沙姆407浓度的增加几乎呈线性降低。保持泊洛沙姆407 浓度不变,随着溶液中泊洛沙姆188浓度的增加,胶凝温度呈现上升趋势。利用SPSS软件对胶凝温度(T)与泊洛沙姆407浓度(C407)及泊洛沙姆188浓度(C188)进行多元线性回归分析,求得加入STF前后多元回归方程(2)和(3)分别为:
$$\begin{split} {{\rm{T}}_1} = & - 0.745{C_{407}} + 1.831{C_{188}} - 0.077{C_{188}}^2 + \\ & 38.963,\;r = 0.989 \end{split}$$ (1) $$\begin{split} {{\rm{T}}_2} = & - 1.455{C_{407}} + 2.178{C_{188}} - 0.089{C_{188}}^2 + \\ & 60.539,\;r = 0.990 \end{split}$$ (2) 在回归方程(2)中,泊洛沙姆188浓度在11.89%处达到极值;在回归方程(3)中,泊洛沙姆188浓度在12.24%处达到极值,此时泊洛沙姆188升高胶凝温度的效果最好。因此,将处方中的泊洛沙姆188浓度拟定为12%,泊洛沙姆407浓度为26%。根据上述方程计算得到胶凝温度理论值T1为30.5 ℃,T2为36.0 ℃,两者均处于30~36℃,既满足室温下处于液态,又满足在眼表温度下形成凝胶。按照优化后的凝胶基质(26%泊洛沙姆407和12%泊洛沙姆188)制备他克莫司微乳凝胶,测得其加入STF前后分别于(31±0.17)℃、(35.7±0.26)℃发生胶凝,与理论值接近,说明上述方程预测结果可信且实验结果符合要求。
-
按照“2.7.1”项下方法制备100 ml 他克莫司阳离子纳米乳(0.2%,W/V),将其与100 ml泊洛沙姆溶液(含52% 泊洛沙姆407和24% 泊洛沙姆188)混匀,在冰浴条件下用机械搅拌器搅拌,使凝胶基质均匀分散于微乳溶液,直至得到无团块、分散均匀的他克莫司微乳凝胶(0.1%,W/V)。
-
制得的他克莫司微乳凝胶在室温下为乳白色液体,具有一定流动性;当升温至胶凝温度时,他克莫司微乳凝胶发生胶凝,呈半固体凝胶状且不具有流动性。采用磷钨酸负染法通过透射电镜观察他克莫司微乳凝胶的稀释形态,由图2可见其呈分布较均匀的球形。
-
采用TA-Discovery II旋转流变仪,设置振荡频率为1 Hz,升温速率为1 ℃/min,振荡模式下考察他克莫司微乳凝胶加入STF前后在5~50℃温度范围内凝胶相转变过程。
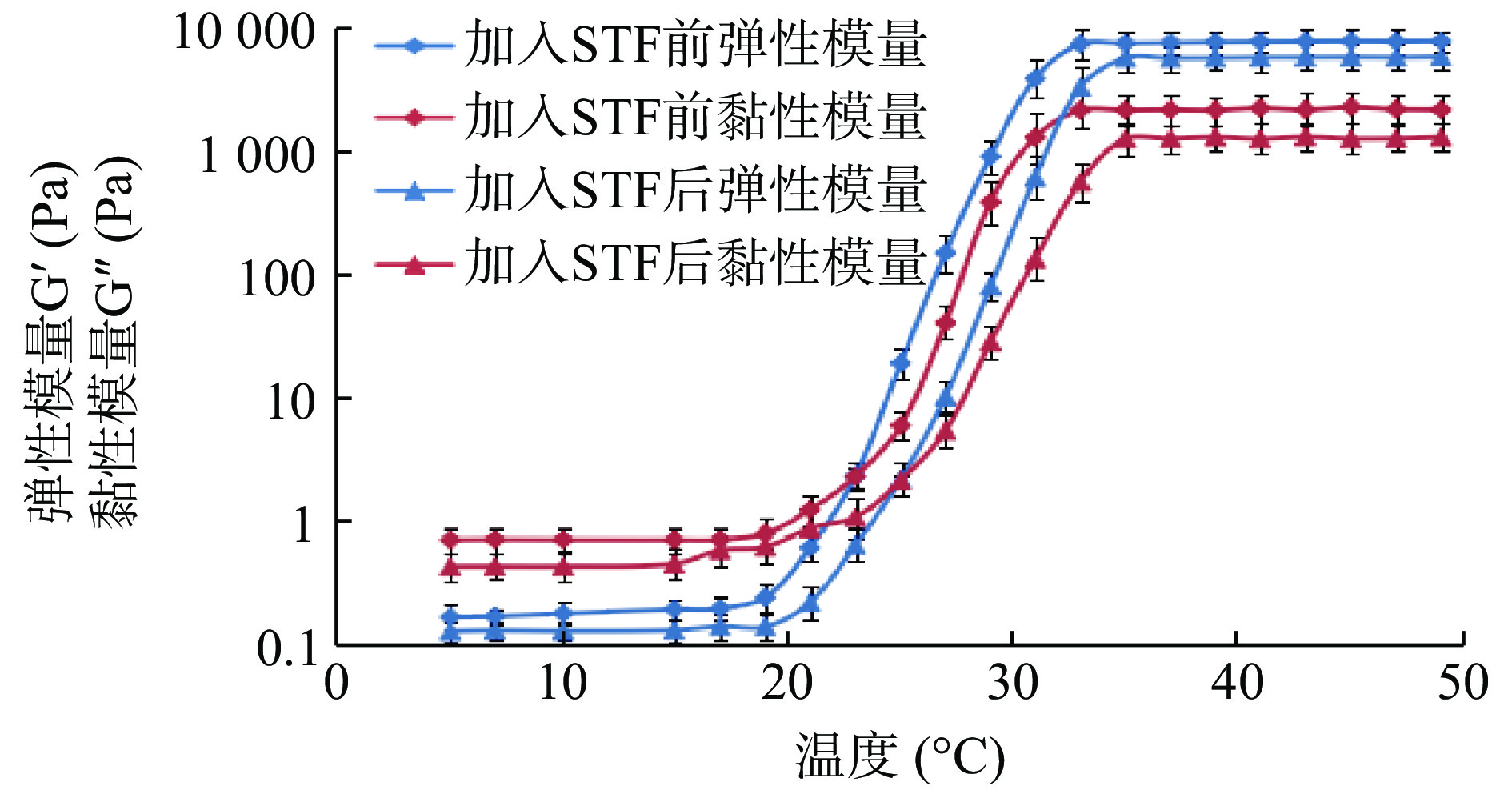
由图3可知,他克莫司微乳凝胶的相转变过程可以通过黏弹性模量的急剧增大而清晰地呈现。当温度较低时弹性模量G′和黏性模量G′′变化不大,趋势平稳,此时G′′>G′,呈液态特征。当上升至一定温度时,G′=G′′,体系开始由液态转变为半固体凝胶态。随着温度继续升高,G′>G′′,直至弹性模量G′和黏性模量G′′变化曲线趋于平缓,完成相转变。若将此时温度定义为胶凝温度,则与玻璃瓶倒置法测定结果相近。由加入STF前后G′、G′′曲线对比可知,加入STF后他克莫司微乳凝胶的胶凝温度升高[加入STF前后胶凝温度分别为(32±0.31)℃、(35±0.26)℃],G′、G′′均降低,说明体系受STF稀释需要更高的温度完成相转变,与玻璃瓶倒置法测定结果一致。加入STF前后黏弹性模量增长速率相近,说明STF的加入不改变凝胶胶凝机制。
-
精密量取2 g 他克莫司微乳凝胶倒入表面积为 1.99 cm2的加盖玻璃瓶,置于恒温培养振荡器中,35 ℃条件下加热15 min,使之完全形成凝胶。加入2.4 ml STF作为释放介质,在100 r/min振荡条件下恒温振荡30 min后倾出释放介质,称量玻璃瓶重量并记录。重复上述操作直至剩余凝胶不足10%,实验重复3次取平均值,作凝胶经时溶蚀曲线图。凝胶经时溶蚀曲线经动力学方程拟合后得到方程:
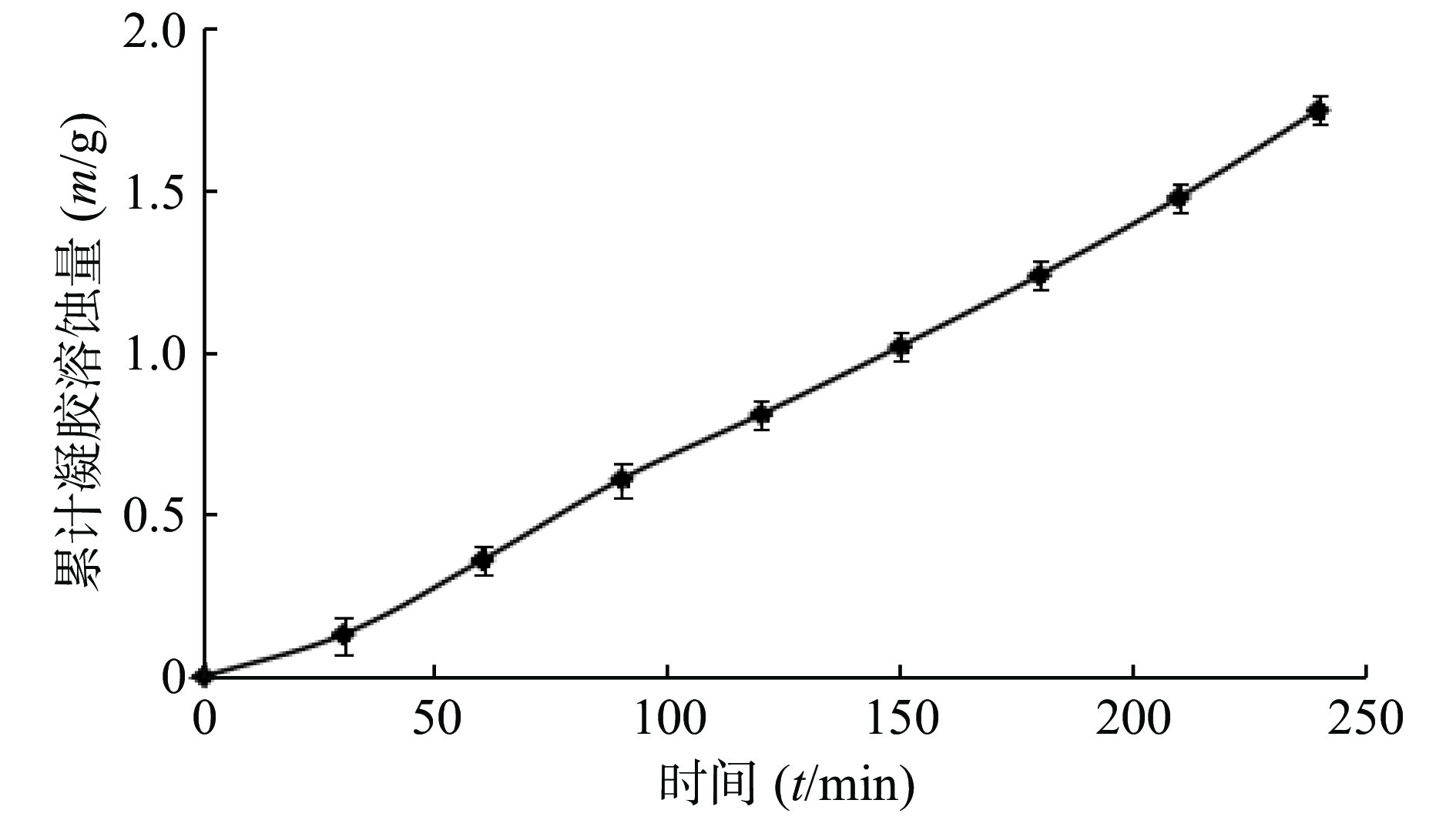
$$ y = 0.0073x - 0.0591,r = {\rm{ }}0.997 $$ 由图4可见,凝胶溶蚀以恒定的速率进行,与时间呈现良好的线性关系。
-
将“2.9.1”项下得到的释放介质倒入10 ml容量瓶,取适量异丙醇溶解至刻度,超声处理15 min,10000 r/min离心10 min,上清液用0.22 μm微孔滤膜滤过,取续滤液,HPLC测定药物浓度。以累积药物释放量对时间作图,得到药物释放曲线。释药曲线经动力学方程拟合后,方程为:
$$ y = 0.0074x - 0.0105,r = 0.999 $$ 由图5可见,药物释放曲线与时间呈现良好线性关系,显示出零级动力学特征。
-
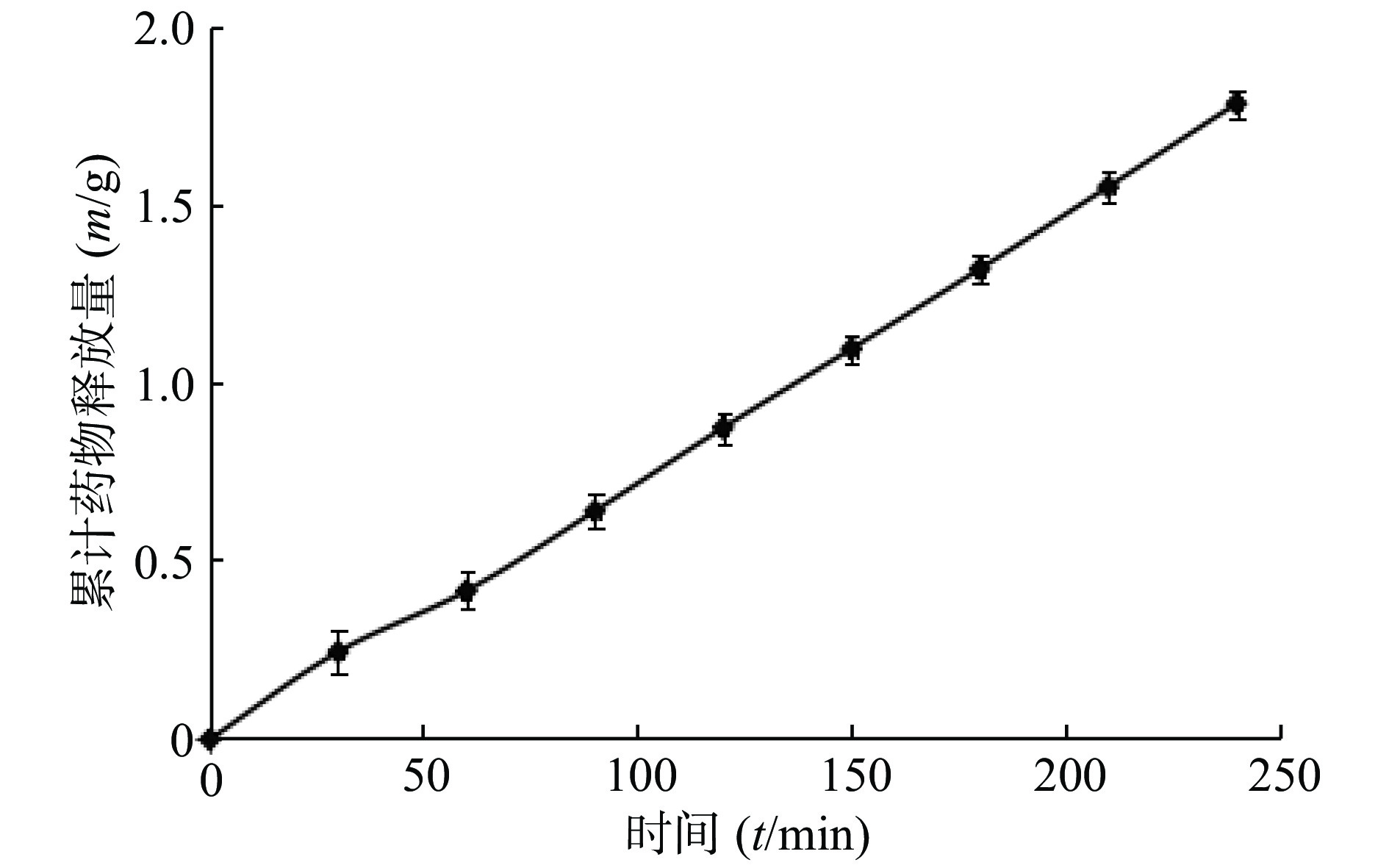
以累积凝胶溶蚀率为横坐标,以累积药物释放率为纵坐标作图,结果如图6所示,曲线拟合后得到方程:
$$ y = 1.0025x + 2.7505,r = 0.997 $$ 其斜率接近于1,说明凝胶溶蚀速率是影响体外释药速率大小的关键因素。
-
实验前期使用乙腈破乳,但其破乳能力较弱,需要较大量才能使阳离子纳米乳完全破乳,对样品的稀释较大,不利于后期定量测定,所以选择破乳能力更强的异丙醇。此外,他克莫司在异丙醇中较稳定。根据预实验结果,使用异丙醇的破乳效果较好且他克莫司浓度处于定量范围内,辅料峰与他克莫司峰分离度>1.5,他克莫司峰形较好,辅料等对其测定无干扰。
-
选择非离子型表面活性剂泊洛沙姆407和泊洛沙姆188作为凝胶基质是由于阴离子材料可与阳离子纳米乳发生相互作用,因而不宜作为凝胶基质,而阳离子材料具有较大毒性,通常也不适用于眼科使用。而所以选择两者共同作为凝胶基质是由于低浓度的泊洛沙姆407胶凝温度较高,不易形成凝胶,而高浓度的泊洛沙姆407在室温条件下即可形成凝胶。因此,泊洛沙姆407不宜单独作为凝胶基质[12]。泊洛沙姆溶液发生胶凝是由于亲水性聚氧化乙烯(PEO)包裹在疏水性聚氧化丙烯(PPO)内核的外部形成胶束,且胶束间相互聚集、缠绕的结果。通常增加亲水性PEO含量可升高胶凝温度,因此为避免室温下形成凝胶,在泊洛沙姆407溶液中加入泊洛沙姆188,从而增加PEO含量,得到适宜的胶凝温度。
Preparation and in vitro release of tacrolimus-loaded cationic nanoemulsion-based in-situ gel
-
摘要:
目的 为了改善他克莫司水溶性差、眼部生物利用度低的问题,研制了他克莫司阳离子微乳原位凝胶,并研究其体外药物释放行为,为后期进一步研究提供基础。 方法 通过高压均质法制得他克莫司阳离子纳米乳,并将其分散于泊洛沙姆407和泊洛沙姆188中制备他克莫司阳离子微乳原位凝胶。采用无膜溶出模型研究其体外释放行为。 结果 采用玻璃瓶倒置法测定胶凝温度,筛选出最优凝胶基质处方为26%泊洛沙姆407和12%泊洛沙姆188;体外释药结果显示凝胶溶蚀速率是决定体外释药速率的关键。 结论 成功制备了他克莫司阳离子微乳原位凝胶,其体外释药稳定,能满足眼用制剂要求,展现出良好的眼部应用前景。 Abstract:Objective In order to improve the problems of poor water-solubility and low bioavailability of ocular tacrolimus, a cationic nanoemulsion in-situ gel of tacrolimus was developed and its drug release behavior in vitro was studied to provide a basis for further research. Methods Tacrolimus-loaded cationic nanoemulsion was prepared by high pressure homogenization and dispersed in poloxamer 407 and poloxamer 188 to prepare tacrolimus-loaded cationic nanoemulsion-based in-situ gel. The membraneless dissolution model was used to study the in vitro drug release behavior. Results The inverse glass bottle method was used to determine the gelation temperature. The optimal formulation of gel matrix was screened out as 26% poloxamer 407 and 12% poloxamer 188. The in vitro release results showed that the rate of gel dissolution determined the in vitro drug release. Conclusion Tacrolimus-loaded cationic nanoemulsion-based in-situ gel is successfully prepared. Its in vitro drug release is stable. It meets the requirement of ophthalmic formulation and shows good prospects for ocular application. -
免疫介导的炎性眼前段疾病(immune-mediated inflammatory anterior ocular diseases, IIAODs)是一类常见的眼科疾病,包括过敏性角结膜炎、前葡萄膜炎等。这类疾病可能引起某些严重的并发症和后遗症,是主要的致盲原因之一[1]。他克莫司(tacrolimus,FK506)是治疗IIAODs的一种强力而有效的免疫抑制剂。然而,其水溶性差(3 μg/ml)[2]、生物利用度低,是限制其用于眼科临床的主要障碍。为此,人们研究了许多新型他克莫司眼用制剂,如软膏剂[3-5]、胶束[6]、纳米乳[7]、混悬液[8]等,但其生物利用度仍未得到明显改善。目前,他克莫司眼用制剂在国内上市剂型为混悬液(Talymus®,日本千寿药业),其药效较常规滴眼液有一定程度的提高,但仍然容易受到泪液冲刷而流失大量药物。因此,研发一种眼部高滞留FK506制剂是一个亟待解决的问题。
本研究以阳离子纳米乳(cationic nanoemulsion, CNE)作为他克莫司的载体,以泊洛沙姆407和泊洛沙姆188作为凝胶基质,制备了他克莫司阳离子微乳凝胶(FK506-loaded cationic nanoemulsion-based in-situ gel, FK506 CNE GEL)。该制剂兼具阳离子纳米乳及温敏型原位凝胶的双重特性,不仅改善了他克莫司低水溶性问题,而且其所带的正电荷能与角膜所带的负电荷发生静电相互作用,以及凝胶对眼黏膜的强亲和力均大大延长了眼部滞留时间。本研究根据适宜的胶凝温度筛选出最优凝胶基质处方并对最优处方制备的他克莫司微乳凝胶进行体外释药研究,为后期进一步研究提供基础。
1. 材料
1.1 仪器
Agilent 1100型高效液相色谱系统(美国安捷伦公司);AL204 电子天平(梅特勒托利多仪器有限公司);DF-101S集热式恒温加热磁力搅拌器(上海精密试验设备有限公司);NS1001L型高压均质机(意大利Niro Soavi公司);JEM-1230透射电子显微镜(日本JEOL公司);ZHWY-200D恒温培养振荡器(上海智城分析仪器制造有限公司);TA-Discovery II旋转流变仪(美国TA仪器公司);OS20-Pro电动搅拌器(北京大龙兴创实验仪器有限公司);YAOHUA 1306精密温度计(耀华仪器有限公司)。
1.2 药物与试剂
他克莫司对照品(含量99.3%,福建科瑞药业有限公司);蓖麻油(湖南宏康制药股份有限公司);中链脂肪酸甘油酯(铁岭北亚药用油有限公司);吐温-80(四川金山制药有限公司);泊洛沙姆188(德国BASF公司);泊洛沙姆407(德国BASF公司);西他氯胺(Sigma-Aldrich);甘油(湖南尔康制药有限公司);注射用水(明澈D24UV);异丙醇、磷酸、乙腈、二水氯化钙(国药集团化学试剂有限公司);碳酸氢钠(上海虹光化工厂有限公司);氯化钠(西陇科学股份有限公司);氯化钾(天津恒兴化学试剂制造有限公司);其他药品和试剂均为药用规格或分析纯。
2. 方法与结果
2.1 色谱条件
色谱柱:Agilent Zorbax Eclipse XDB-C18 (150 mm×4.6 mm, 5 μm);流动相:乙腈-水(磷酸调节pH 至4.5)(65∶35,V∶V);波长:210 nm;柱温:50 ℃;流速:1.0 ml/min;进样量:20 μl。
2.2 溶液的配制
2.2.1 对照品溶液的配制
精密称取他克莫司对照品10.0 mg,置于10 ml量瓶中,加适量异丙醇溶解并稀释至刻度,制成1.0 mg/ml的储备液,4 ℃下避光保存。精密移取3.0 ml储备液,置于10 ml量瓶中,加适量异丙醇溶解并稀释至刻度,摇匀后即得。
2.2.2 供试品溶液的配制
取他克莫司微乳凝胶样品3 g,加入异丙醇溶解并稀释至10 ml,经0.22 μm滤膜过滤后,取续滤液,即得。
2.2.3 阴性供试品溶液的配制
取空白阳离子微乳凝胶样品 3 g,加入异丙醇溶解并稀释至10 ml,经0.22 μm滤膜过滤后,取续滤液,即得。
2.3 线性关系考察
分别精密吸取他克莫司储备液0.2、0.4、0.8、1.0、2.0、4.0、8.0、10.0 ml,置于10 ml量瓶中,用异丙醇稀释至刻度制成系列浓度的他克莫司溶液,摇匀后取上述溶液各20 μl,注入液相色谱仪,记录对应色谱图。以他克莫司色谱峰面积A为纵坐标,以他克莫司浓度C(μg/ml)为横坐标,进行线性回归,得线性回归方程:
$$ A = 15557C - 30.426,\;\;r = 0.9993 $$ 结果表明他克莫司在20~1000 μg/ml浓度范围内与峰面积呈良好的线性关系。
2.4 精密度试验
取对照品溶液在上述色谱条件下重复进样6次,计算他克莫司色谱峰面积的RSD值为1.78%。
2.5 重复性试验
取同一批他克莫司微乳凝胶6份,在上述色谱条件下测定,计算他克莫司微乳凝胶中他克莫司含量的RSD值为2.41%。表明仪器精密度及方法重复性良好。
2.6 回收率试验
他克莫司低、中、高3个浓度的提取回收率分别为(97.78±0.64)%、(98.22±0.51)%、(98.70±0.69)%,符合《中国药典》2015年版四部通则9101的要求,方法回收率良好,详见表1。
表 1 加样回收率试验结果(n=3)加入量 (mg/ml) 测得量 (mg/ml) 回收率 (%) $\bar x$(%) RSD (%) 0.24 0.236 98.33 97.78 0.64 0.24 0.233 97.08 0.24 0.235 97.92 0.30 0.293 97.67 98.22 0.51 0.30 0.295 98.33 0.30 0.296 98.67 0.36 0.358 99.44 98.70 0.69 0.36 0.353 98.06 0.36 0.355 98.61 2.7 他克莫司微乳凝胶的处方筛选
2.7.1 他克莫司阳离子纳米乳的制备
精密量取0.1 g 他克莫司、0.02 g西他氯胺、6 g中链脂肪酸甘油酯、4 g蓖麻油放入烧杯A中,在50 ℃下加热溶解作为油相;精密量取1 g吐温-80、0.1 g泊洛沙姆188、2.2 g甘油放入烧杯B中,加入适量注射用水并加热至50 ℃作为水相。将油相缓慢逐滴加入水相中,匀速搅拌同时避免乳滴溅出,控制搅拌速度为500 r/min。在50 ℃下继续搅拌30 min制得初乳,加入注射用水至100 ml,经600 bar高压均质8次后用0.1 mol/L氢氧化钠调节pH至7.4制得他克莫司纳米乳(0.1%,W/V)。
2.7.2 他克莫司阳离子微乳凝胶的制备
精密称取10 ml 他克莫司纳米乳,缓慢加入一定量的泊洛沙姆407和泊洛沙姆188,冰浴条件下充分搅拌使凝胶基质均匀分散于微乳溶液,再置于4 ℃恒温冰箱中溶胀24 h,取出搅拌均匀即得他克莫司微乳凝胶。
2.7.3 模拟泪液(simulated tear fluid, STF)的制备[9]
称取6.78 g 氯化钠,1.38 g氯化钾,2.18 g碳酸氢钠及0.084 g 二水合氯化钙,加入纯化水至1000 ml。
2.7.4 加入STF前胶凝温度的测定
采用“玻璃瓶倒置法”[10],将装有10 ml他克莫司微乳凝胶的玻璃瓶静置于恒温磁力搅拌水浴锅中,设置初始温度为10 ℃,初始平衡20 min。放入转子以确保温度均匀扩散,控制升温速度为0.5~1.0℃/min,每次升温平衡1 min,期间不断将玻璃瓶倾斜60°~90°并观察瓶内溶液是否流动,将其不流动时的温度记为胶凝温度(T1),每个样品重复测定3次取平均值。
2.7.5 加入STF后胶凝温度的测定
量取10 ml 他克莫司微乳凝胶于玻璃瓶中,再加入1.75 ml STF[11],按“2.7.4”项下方法测定并记录胶凝温度(T2),每个样品重复测定3次取平均值。
2.7.6 联合使用泊洛沙姆407和泊洛沙姆188对胶凝温度的影响
以泊洛沙姆407 和泊洛沙姆188共同作为温敏型他克莫司微乳凝胶的凝胶基质,考察不同凝胶基质浓度的他克莫司微乳凝胶对胶凝温度的影响,从而筛选出他克莫司微乳凝胶最终处方。
理想的微乳凝胶,其胶凝温度应高于室温,确保以滴入形式给药,并且经泪液稀释后仍能在低于眼表温度下35~36℃形成凝胶,以确保到达用药部位后立即转变为凝胶,因此合适的胶凝温度应在30~36℃之间。当泊洛沙姆407浓度小于22%或大于26%时,在30~36℃温度范围内难以形成凝胶。由图1可见,他克莫司微乳凝胶的胶凝温度随泊洛沙姆407浓度的增加几乎呈线性降低。保持泊洛沙姆407 浓度不变,随着溶液中泊洛沙姆188浓度的增加,胶凝温度呈现上升趋势。利用SPSS软件对胶凝温度(T)与泊洛沙姆407浓度(C407)及泊洛沙姆188浓度(C188)进行多元线性回归分析,求得加入STF前后多元回归方程(2)和(3)分别为:
$$\begin{split} {{\rm{T}}_1} = & - 0.745{C_{407}} + 1.831{C_{188}} - 0.077{C_{188}}^2 + \\ & 38.963,\;r = 0.989 \end{split}$$ (1) $$\begin{split} {{\rm{T}}_2} = & - 1.455{C_{407}} + 2.178{C_{188}} - 0.089{C_{188}}^2 + \\ & 60.539,\;r = 0.990 \end{split}$$ (2) 在回归方程(2)中,泊洛沙姆188浓度在11.89%处达到极值;在回归方程(3)中,泊洛沙姆188浓度在12.24%处达到极值,此时泊洛沙姆188升高胶凝温度的效果最好。因此,将处方中的泊洛沙姆188浓度拟定为12%,泊洛沙姆407浓度为26%。根据上述方程计算得到胶凝温度理论值T1为30.5 ℃,T2为36.0 ℃,两者均处于30~36℃,既满足室温下处于液态,又满足在眼表温度下形成凝胶。按照优化后的凝胶基质(26%泊洛沙姆407和12%泊洛沙姆188)制备他克莫司微乳凝胶,测得其加入STF前后分别于(31±0.17)℃、(35.7±0.26)℃发生胶凝,与理论值接近,说明上述方程预测结果可信且实验结果符合要求。
2.7.7 他克莫司微乳凝胶的最优处方及制备工艺
按照“2.7.1”项下方法制备100 ml 他克莫司阳离子纳米乳(0.2%,W/V),将其与100 ml泊洛沙姆溶液(含52% 泊洛沙姆407和24% 泊洛沙姆188)混匀,在冰浴条件下用机械搅拌器搅拌,使凝胶基质均匀分散于微乳溶液,直至得到无团块、分散均匀的他克莫司微乳凝胶(0.1%,W/V)。
2.8 他克莫司微乳凝胶的表征
2.8.1 外观及透射电镜形态学
制得的他克莫司微乳凝胶在室温下为乳白色液体,具有一定流动性;当升温至胶凝温度时,他克莫司微乳凝胶发生胶凝,呈半固体凝胶状且不具有流动性。采用磷钨酸负染法通过透射电镜观察他克莫司微乳凝胶的稀释形态,由图2可见其呈分布较均匀的球形。
2.8.2 他克莫司微乳凝胶流变学研究
采用TA-Discovery II旋转流变仪,设置振荡频率为1 Hz,升温速率为1 ℃/min,振荡模式下考察他克莫司微乳凝胶加入STF前后在5~50℃温度范围内凝胶相转变过程。
由图3可知,他克莫司微乳凝胶的相转变过程可以通过黏弹性模量的急剧增大而清晰地呈现。当温度较低时弹性模量G′和黏性模量G′′变化不大,趋势平稳,此时G′′>G′,呈液态特征。当上升至一定温度时,G′=G′′,体系开始由液态转变为半固体凝胶态。随着温度继续升高,G′>G′′,直至弹性模量G′和黏性模量G′′变化曲线趋于平缓,完成相转变。若将此时温度定义为胶凝温度,则与玻璃瓶倒置法测定结果相近。由加入STF前后G′、G′′曲线对比可知,加入STF后他克莫司微乳凝胶的胶凝温度升高[加入STF前后胶凝温度分别为(32±0.31)℃、(35±0.26)℃],G′、G′′均降低,说明体系受STF稀释需要更高的温度完成相转变,与玻璃瓶倒置法测定结果一致。加入STF前后黏弹性模量增长速率相近,说明STF的加入不改变凝胶胶凝机制。
2.9 他克莫司微乳凝胶体外释放研究
2.9.1 他克莫司微乳凝胶的溶蚀动力学
精密量取2 g 他克莫司微乳凝胶倒入表面积为 1.99 cm2的加盖玻璃瓶,置于恒温培养振荡器中,35 ℃条件下加热15 min,使之完全形成凝胶。加入2.4 ml STF作为释放介质,在100 r/min振荡条件下恒温振荡30 min后倾出释放介质,称量玻璃瓶重量并记录。重复上述操作直至剩余凝胶不足10%,实验重复3次取平均值,作凝胶经时溶蚀曲线图。凝胶经时溶蚀曲线经动力学方程拟合后得到方程:
$$ y = 0.0073x - 0.0591,r = {\rm{ }}0.997 $$ 由图4可见,凝胶溶蚀以恒定的速率进行,与时间呈现良好的线性关系。
2.9.2 他克莫司微乳凝胶中药物的释放
将“2.9.1”项下得到的释放介质倒入10 ml容量瓶,取适量异丙醇溶解至刻度,超声处理15 min,10000 r/min离心10 min,上清液用0.22 μm微孔滤膜滤过,取续滤液,HPLC测定药物浓度。以累积药物释放量对时间作图,得到药物释放曲线。释药曲线经动力学方程拟合后,方程为:
$$ y = 0.0074x - 0.0105,r = 0.999 $$ 由图5可见,药物释放曲线与时间呈现良好线性关系,显示出零级动力学特征。
2.9.3 凝胶溶蚀与药物释放的相关性分析
以累积凝胶溶蚀率为横坐标,以累积药物释放率为纵坐标作图,结果如图6所示,曲线拟合后得到方程:
$$ y = 1.0025x + 2.7505,r = 0.997 $$ 其斜率接近于1,说明凝胶溶蚀速率是影响体外释药速率大小的关键因素。
3. 讨论
3.1 溶剂的选择
实验前期使用乙腈破乳,但其破乳能力较弱,需要较大量才能使阳离子纳米乳完全破乳,对样品的稀释较大,不利于后期定量测定,所以选择破乳能力更强的异丙醇。此外,他克莫司在异丙醇中较稳定。根据预实验结果,使用异丙醇的破乳效果较好且他克莫司浓度处于定量范围内,辅料峰与他克莫司峰分离度>1.5,他克莫司峰形较好,辅料等对其测定无干扰。
3.2 凝胶基质的特性
选择非离子型表面活性剂泊洛沙姆407和泊洛沙姆188作为凝胶基质是由于阴离子材料可与阳离子纳米乳发生相互作用,因而不宜作为凝胶基质,而阳离子材料具有较大毒性,通常也不适用于眼科使用。而所以选择两者共同作为凝胶基质是由于低浓度的泊洛沙姆407胶凝温度较高,不易形成凝胶,而高浓度的泊洛沙姆407在室温条件下即可形成凝胶。因此,泊洛沙姆407不宜单独作为凝胶基质[12]。泊洛沙姆溶液发生胶凝是由于亲水性聚氧化乙烯(PEO)包裹在疏水性聚氧化丙烯(PPO)内核的外部形成胶束,且胶束间相互聚集、缠绕的结果。通常增加亲水性PEO含量可升高胶凝温度,因此为避免室温下形成凝胶,在泊洛沙姆407溶液中加入泊洛沙姆188,从而增加PEO含量,得到适宜的胶凝温度。
-
表 1 加样回收率试验结果(n=3)
加入量 (mg/ml) 测得量 (mg/ml) 回收率 (%) $\bar x$ (%)RSD (%) 0.24 0.236 98.33 97.78 0.64 0.24 0.233 97.08 0.24 0.235 97.92 0.30 0.293 97.67 98.22 0.51 0.30 0.295 98.33 0.30 0.296 98.67 0.36 0.358 99.44 98.70 0.69 0.36 0.353 98.06 0.36 0.355 98.61 -
[1] SHOUGHY S S. Topical tacrolimus in anterior segment inflammatory disorders[J]. Eye Vis (Lond),2017,4:7. doi: 10.1186/s40662-017-0072-z [2] LIN H R, SUNG K C. Carbopol/pluronic phase change solutions for ophthalmic drug delivery[J]. J Control Release,2000,69(3):379-388. doi: 10.1016/S0168-3659(00)00329-1 [3] PASTOR-CLERIGUES A, SERRANO A, MILARA J, et al. Evaluation of the ocular tolerance of three tacrolimus topical pharmaceutical preparations by bovine corneal opacity and permeability test[J]. Curr Eye Res,2016,41(7):890-896. doi: 10.3109/02713683.2015.1082187 [4] ABEYSIRI P, JOHNSTON N R, MOLTENO A C. The use of topical tacrolimus 0.1% skin ointment for anterior segment conditions: a case series[J]. Ophthalmol Eye Dis,2010,2:5-8. [5] TAM P M, YOUNG A L, CHENG L L, et al. Topical 0.03% tacrolimus ointment in the management of ocular surface inflammation in chronic GVHD[J]. Bone Marrow Transplant,2010,45(5):957-958. [6] KUTLEHRIA S, VHORA I, BAGDE A, et al. Tacrolimus loaded PEG-cholecalciferol based micelles for treatment of ocular inflammation[J]. Pharm Res,2018,35(6):117. doi: 10.1007/s11095-018-2376-7 [7] SILVA-CUNHA A, DA SILVA G R, DE CASTRO W V, et al. Evaluation of the pharmacokinetics and ocular tolerance of a microemulsion containing tacrolimus[J]. J Ocul Pharmacol Ther,2014,30(1):59-65. doi: 10.1089/jop.2013.0128 [8] OHASHI Y, EBIHARA N, FUJISHIMA H, et al. A randomized, placebo-controlled clinical trial of tacrolimus ophthalmic suspension 0.1% in severe allergic conjunctivitis[J]. J Ocul Pharmacol Ther,2010,26(2):165-174. doi: 10.1089/jop.2009.0087 [9] HÄGERSTRÖM H, PAULSSON M, EDSMAN K. Evaluation of mucoadhesion for two polyelectrolyte gels in simulated physiological conditions using a rheological method[J]. Eur J Pharm Sci,2000,9(3):301-309. doi: 10.1016/S0928-0987(99)00070-6 [10] LIU Y, LU W L, WANG J C, et al. Controlled delivery of recombinant hirudin based on thermo-sensitive Pluronic F127 hydrogel for subcutaneous administration: In vitro and in vivo characterization[J]. J Control Release,2007,117(3):387-395. doi: 10.1016/j.jconrel.2006.11.024 [11] LEDERER C M Jr, HAROLD R E. Drop size of commercial Glaucoma medications[J]. Am J Ophthalmol,1986,101(6):691-694. doi: 10.1016/0002-9394(86)90771-3 [12] 魏刚. 体温敏感眼用凝胶的研究[D]. 沈阳: 沈阳药科大学, 2002. -





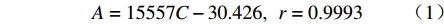
 下载:
下载:
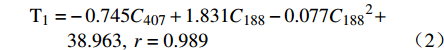
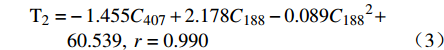

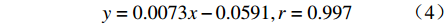
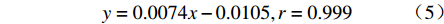
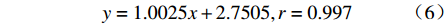
 下载:
下载: