-
在我国,肺炎链球菌是引起中国婴幼儿和老年人发病和死亡的重要病因,是社区获得性肺炎(community-acquired pneumonia, CAP)、菌血症、儿童化脓性脑膜炎的常见病原菌[1]。2012年亚太地区病原体耐药监测网络数据显示,肺炎链球菌(Streptococcus pneumoniae, S.p)在亚洲地区总体多重耐药比例为59.3%,而在中国的多重耐药比例高达83.3%[2],且部分地区肺炎链球菌耐药率呈逐年增长趋势[3-4]。
莫西沙星属第四代喹诺酮类抗菌药物,DNA拓扑异构酶抑制剂,抗菌谱广,对常见呼吸道病菌特别是肺炎链球菌抗菌作用强大,2016年中国成人CAP诊治指南推荐可选择莫西沙星等喹诺酮类药物作为初始经验性抗感染药物[5]。莫西沙星所有适应证口服给药的常规剂量均为400 mg/d。随着莫西沙星上市以来临床研究的深入,不良反应事件也有所增加[6]。本研究采用微透析方法获取肺炎大鼠肺组织间液中的游离药物浓度,旨在模拟莫西沙星在感染患者靶器官中的药动学变化,探究正常与感染状态下的靶器官药物分布的差异,分析链球菌感染状态下莫西沙星体内代谢动力学的变化。
-
取Wistar大鼠24只,雄性,SPF级,4~6周龄,其体质量为200~220g(上海斯莱克实验动物有限公司,合格证编号:2007000514232)。随机分为健康组及肺炎组各12只,两组大鼠体质量分别为(210.92±5.95)g和(208.58±5.33)g,无统计学差异(P>0.05)。实验前各组大鼠禁食12 h过夜,动物饲养遵从中华人民共和国实验动物使用协议。
-
CMA402型微量泵、CMA820型微量收集器、血管探针、肺探针(瑞典 CMA公司);ALC-V8S小动物呼吸机(上海奥尔科特生物科技有限公司);安捷伦1100高效液相色谱仪,配有Chemstation工作站;XW-80型涡旋混合器(其林贝尔);Thermo LEGEND Micro 17高速离心机(赛默飞);METTLER AE240电子天平(梅特勒)。莫西沙星标准品(中国食品药品检定研究院,纯度>99%,批号1448606),莫西沙星片(拜耳医药保健有限公司,批号BJ13520);甲醇(HPLC级,Burdick & Jackson公司),乙腈(HPLC级,Merck公司),甲酸(Fluka公司,瑞士)。
-
肺炎链球菌由第二军医大学附属长海医院微生物实验室提供,于接种前1 d接种于血琼脂平板,置于37 ℃ CO2培养箱中培养24 h,用无菌生理盐水稀释成含细菌浓度为0.6×108 cfu/ml的混悬液,备用。质控菌株为肺炎链球菌标准株(ATCC49619 上海宝米科生物科技有限公司提供)。
-
造模:采用气管穿刺法注入菌液建立肺炎大鼠模型。腹腔麻醉后,切开颈部皮肤暴露气管,经气管软骨环间穿刺,注入肺炎链球菌混悬液 0.2 ml(约0.12×108cfu/只),将大鼠直立位20 s,再使大鼠保持右侧卧位10 min,促使菌液充分流入右肺。于接种后第5~7天建立大鼠右侧肺炎模型。所有大鼠实验结束后行病理解剖及肺组织匀浆培养证实建模成功。
-
取造模成功的肺炎大鼠麻醉后,固定于保温垫,在气管上段做一T型切口,插入气管导管,接小动物呼吸机辅助通气,频率75~80次/min,潮气量2.5 ml。于大鼠右侧胸壁做斜行切口,止血钳离断第5肋骨前肋,充分暴露右肺。用注射器针尖稍刺破右肺中叶脏层胸膜,将肺探针向肺门方向钝性植入肺组织,复位肺叶,固定探针并关闭胸腔。切开左侧股静脉,植入血管探针推送至下腔静脉固定。
-
取莫西沙星1片,刮去包衣后磨成细粉末状,加入0.5%羧甲基纤维素钠无菌注射用水溶解,制成混悬溶液,浓度为10 mg/ml。
两组大鼠分别通过灌胃给药的方式注入莫西沙星混悬液,给药剂量按4 ml/kg计算,5 s内注入完毕,立即开始收集血浆及肺组织透析样品。采用HPLC法分别测定前5 h的莫西沙星浓度。
-
(1)色谱条件 色谱柱:Agilent SB-C18 (250 mm×4.6 mm,5.0 µm),流动相:乙腈: 0.1%甲酸水(25:75,V/V);流速:1.0 ml/min,分析时间10 min,柱温:30 ℃,进样量:5 μl,检测波长295 nm。
(2)透析液处理 精密量取100 μl透析液样品,置1.5 ml塑料离心管中,加入200 μl甲醇,漩涡混合30 s后,12000 r/min离心10 min,取200 μl上清液于进样瓶中,进样5 μl进行HPLC分析。
(3)标准曲线与线性范围 取空白透析液100 μl,精密加入莫西沙星标准对照品溶液20 μl旋涡混匀,配成莫西沙星浓度分别为5.00、2.00、1.00、0.50、0.20、0.10及0.05 µg/ml标准含药肺透析液,除不加200μl醇外,其余按“透析液样品处理方法”项下操作,进样分析,记录色谱图,计算莫西沙星峰面积。莫西沙星以肺透析液中待测物浓度(X)为横坐标,莫西沙星峰面积(Y)为纵坐标,求得回归方程:
Y=14.273X+0.555,r=0.999
结果表明莫西沙星在0.05~5.00 µg/ml浓度范围内线性关系良好。
-
配制莫西沙星浓度为0.05 µg/ml的标准含药透析液5份,进行分析,依照当日标准曲线方程求得实测浓度为(0.051 ± 0.004)µg/ml,准确度90.8%~116.66%。结果表明莫西沙星在血浆中的定量下限为0.05 µg/ml,S/N>10,线性关系良好。经逐级稀释,按S/N>3测得莫西沙星在血浆中的检测限为0.015 µg/ml。
-
制备含莫西沙星的浓度分别为0.05、0.50、5.00 µg/ml的标准含药肺透析液(每个浓度做5份),按“肺透析液样品预处理方法”项下操作,进样分析,连续做3 d,计算日内和日间精密度。测得日内精密度RSD分别为6.6281%、2.6247%、2.8282%;日间精密度分别为2.3793%、1.0271%、2.4221%,均小于10%,符合精密度要求。
-
以相对回收率表示,按“标准曲线制备”项下制备含有莫西沙星浓度分别为0.05、0.50、5.00 µg/ml的标准含药肺透析液,按“肺透析液样品预处理方法”项下操作,进样分析,记录色谱峰面积,代入标准曲线方程,计算实测浓度与实际浓度的比值即为相对回收率。结果分别为105.21%、104.82%、106.45%,均在80%~120%范围内,且RSD<10%,符合要求。
-
莫西沙星浓度分别为0.05、0.5、5.0 µg/ml的肺透析液样品各3份,分别进行室温、4 ℃及冻融稳定性考察,RSD均<10%。结果表明样品在上述条件下保持稳定。
-
采用反向透析法测定探针回收率(Rdial),体内实际药物浓度(Cu)由所得透析液浓度(Cm)按公式计算,Cu=Cm/Rdial转化获得。采用Pksolver 2.0软件,以非房室模型计算以下药动学数据:曲线下面积(AUC)、平均滞留时间(MRT)、药物消除半衰期(t1/2)、药物峰浓度(Cmax)、药物在肺部的穿透率(PR=C肺/C血液)、药物的分布系数(AUC肺/AUC血液)。
采用SPSS 17.0版统计学软件分析,计量资料采用均值±标准差(
$\bar{x}\pm s$ )表示。药动学参数先经方差齐性分析,符合正态分布者,采用两样本t检验,P<0.05表示其差异有统计学意义。 -
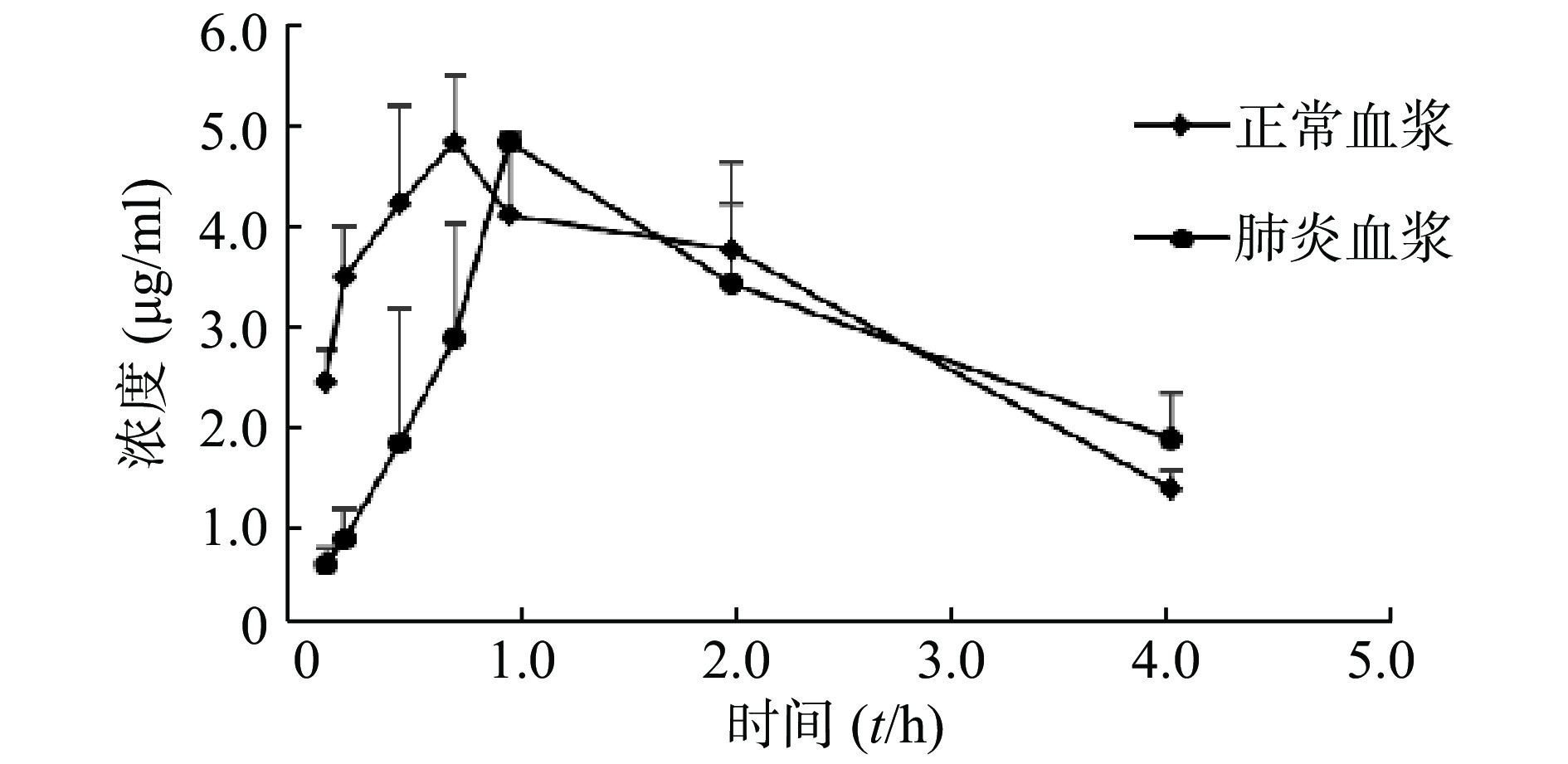
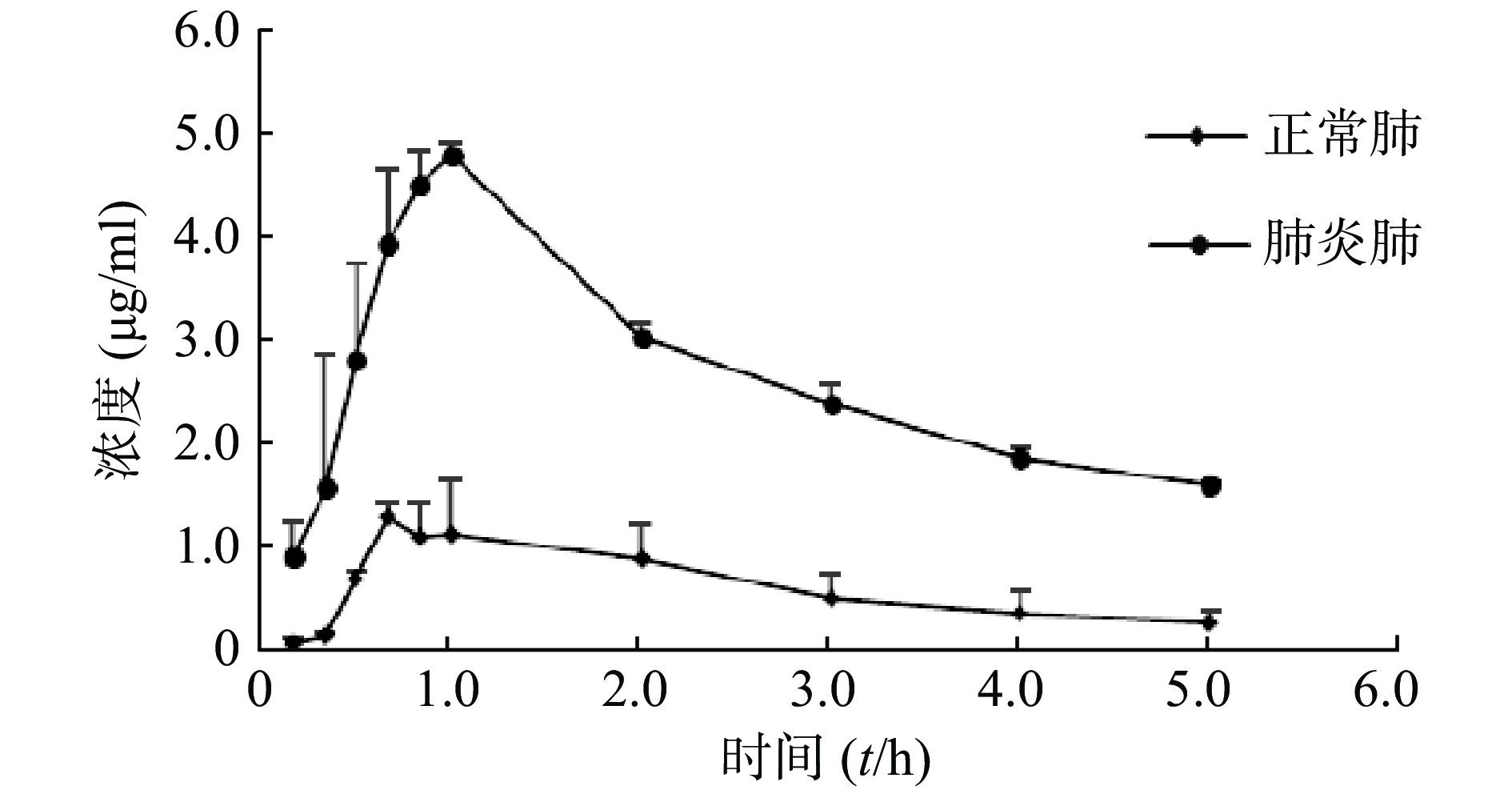
经灌胃给予莫西沙星后,正常大鼠及肺炎大鼠肺组织药物浓度迅速上升,约1 h达峰,随后两者同步下降。整个实验过程肺炎大鼠肺组织浓度均高于正常大鼠,肺炎大鼠肺组织Cmax约为正常大鼠的3.4倍。两组大鼠肺组织中莫西沙星的浓度-时间数据分布情况见图1。
-
灌胃给予莫西沙星后,正常大鼠及肺炎大鼠血浆游离药物浓度明显上升,Cmax无明显差异,两组大鼠血浆中莫西沙星的血药浓度-时间数据分布情况见图2。
-
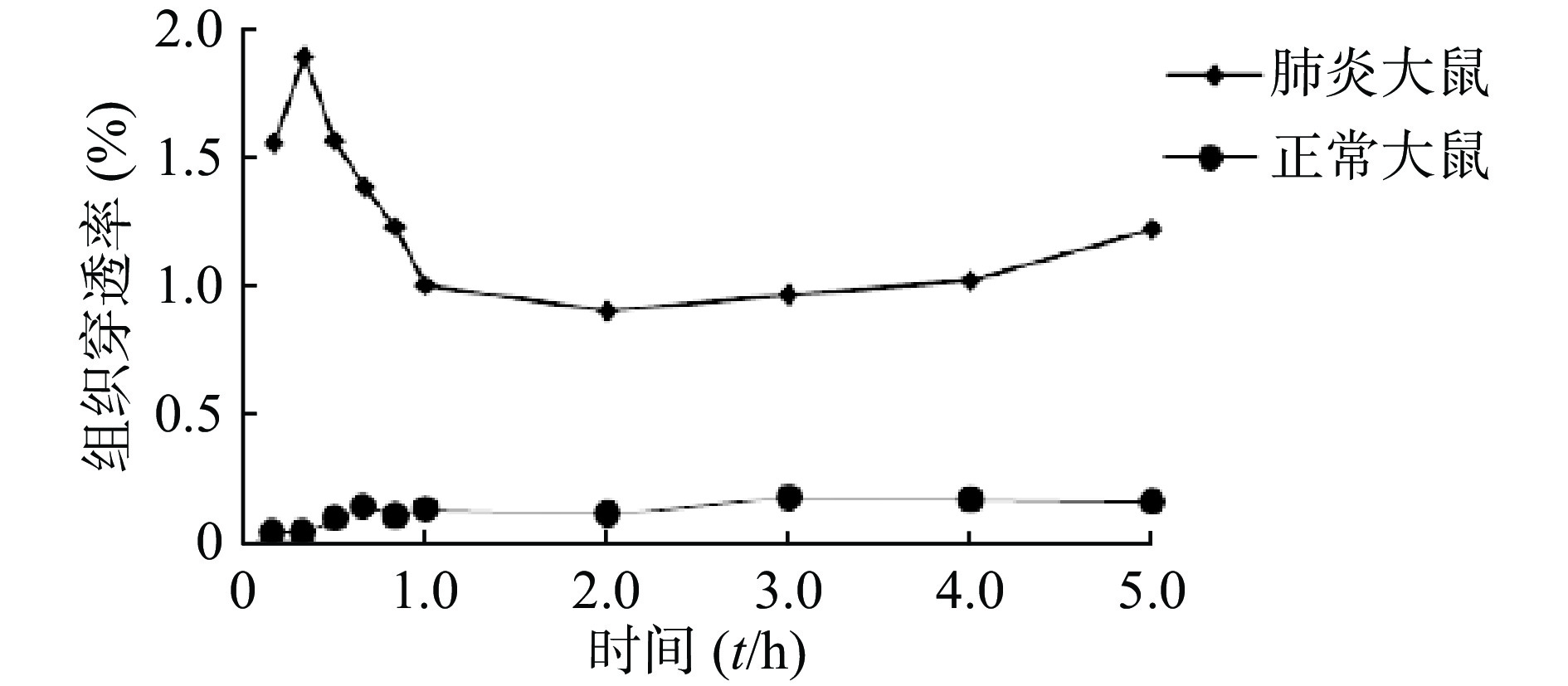
计算各时间点在肺组织中的穿透率(PR值),正常大鼠和肺炎大鼠肺组织穿透率最高分别为0.27和1.87;最低分别为0.16和0.89,平均值分别为0.18±0.10和1.26±0.32(P<0.05),见图3。
-
大鼠灌胃莫西沙星后,正常大鼠及肺炎大鼠药动学参数采用非房室模型进行分析,结果见表1。
表 1 灌胃给予莫西沙星的正常大鼠与肺炎大鼠血浆和肺组织中的药动学参数
参数 单位 血浆 肺组织 正常组 肺炎组 正常组 肺炎组 Lambda_z 1/h 0.2±0.13 0.32±0.01 0.4±0.15 0.21±0.06 t1/2 h 5.27±4.38 2.15±0.07 1.9±0.63 3.39±0.79 Tmax h 0.67±0.14 1±0 0.89±0.2 0.94±0.1 Cmax μg/ml 4.94±0.98 4.83±0.05 1.42±0.05 4.84±0.02## Tlag h 0±0 0±0 0±0 0±0 Clast_obs/Cmax 0.02±0.03 0.27±0.04## 0.18±0.09 0.33±0.01 AUC 0-t μg/ml·h 22.33±2.02 12.88±1.19# 3.06±1.07 13.16±0.53## AUC 0-inf_obs μg/ml·h 23.51±1.41 16.96±1.71 3.77±1.29 20.93±1.35 AUC0-t/0-inf_obs 0.95±0.08 0.76±0.01 0.81±0.09 0.63±0.07# AUMC 0-inf_obs μg/ml·h2 151.89±92.76 62.01±8.56 11.93±5.14 107.01±25.39# MRT 0-inf_obs h 6.41±3.77 3.65±0.14 3.17±0.77 5.07±0.92 Vz/F_obs (mg/kg)/(μg/ml) 13.51±10.9 7.76±0.97 33.98±20.28 9.74±1.72 CL/F_obs (mg/kg)/(μg/ml)·h 1.79±0.11 2.49±0.26# 12.02±3.9 2.01±0.13 #P<0.05,##P<0.01,与正常组比较 正常大鼠及肺炎大鼠肺组织Cmax分别为(1.42±0.05)μg/ml、(4.84±0.02)μg/ml(P<0.01),t1/2分别为(1.9±0.63)h、(3.39±0.79)h(P>0.05),一阶矩曲线下面积AUMC分别为(11.93±5.14)μg/ml·h2、(107.01±25.39)μg/ml·h2(P<0.05),AUC0-t分别为(3.06±1.07)μg/ml·h、(13.16±0.53)μg/ml·h(P<0.01)
-
结合相关报道的最低抑菌浓度(MIC)[7]及防耐药突变浓度(mutant prevention concentration,MPC)[8]值,将本实验结果Cmax和AUC0-∞与之相比,莫西沙星对肺炎链球菌的PK/PD参数见表2 [莫西沙星对肺炎链球菌的MIC90为0.125 mg/L;莫西沙星对肺炎链球菌的MPC90为2 mg/L]。
表 2 正常大鼠和肺炎大鼠体内莫西沙星的PK/PD参数比较
PK/PD参数 血浆 肺组织 正常组 肺炎组 肺炎组/正常组 正常组 肺炎组 肺炎组/正常组 Cmax/MIC90 39.52 38.64 0.98 11.36 38.72 3.41 AUC0-∞/MIC90 188.08 135.68 0.72 30.16 167.44 5.54 Cmax/MPC90 2.47 2.42 0.98 0.71 2.42 3.41 AUC0-∞/MPC90 11.76 8.48 0.72 1.89 10.47 5.54 -
我国的多中心研究结果显示,莫西沙星对肺炎链球菌的敏感度达99%,MIC90为0.125 mg/L[7]。莫西沙星和青霉素类、头孢菌素类、氨基糖苷类、大环内酯类、四环素类抗菌药物均无交叉耐药性,口服生物利用度总计91%,可以被快速吸收并分布到血管外隙,稳态时表观分布容积可以达到21/kg。血浆蛋白结合率为45%,其在肺、窦及炎性损伤组织的药物浓度超过血药浓度。相关研究表明,口服莫西沙星400 mg后,在人肺组织[8]、微支气管镜肺泡灌洗液[9]、痰液[10]中的药时曲线与在血浆中的趋势相似,药物在以上样本中的浓度高于血浆,显示出良好组织穿透性,本研究的前期结果也得出相似的结论[11]。
莫西沙星为浓度依赖性抗菌药,抗生素后效应(PAE)较长,喹诺酮类治疗革兰阳性菌所需的AUC0-24h/MIC靶值为30~40。当PK/PD参数Cmax/MIC≥8~10和AUC0~24h/MIC≥125时可以明显减少氟喹诺酮类药物治疗革兰阴性杆菌、包括铜绿假单胞菌耐药菌出现的危险性[12]。本研究结果表明,莫西沙星在正常及肺炎链球菌感染大鼠血浆和肺组织的Cmax/MIC均远大于8~10,在肺炎大鼠的血浆及肺组织的AUC0-24h/MIC为135.68和167.44,正常大鼠血浆为188.08,远大于125。
耐药突变选择窗(MSW)是指防耐药突变浓度(MPC)与最低抑菌浓度(MIC)之间的浓度范围;当治疗药物浓度高于MPC时,在保证疗效的同时也能防止耐药突变;药物浓度如果在突变选择窗内,即使抑制了敏感菌生长,临床治疗可能成功,但还可能导致耐药突变。近年来在优化喹诺酮类给药方案的研究中,常需评价抗菌药物在耐药突变窗中的存在时间百分比和MPC值。TMSW<20%是预测防止出现耐药的有效参数,本研究药动学参数显示,莫西沙星在正常大鼠及肺炎大鼠的血浆和肺组织中的浓度基本保持在莫西沙星耐药突变选择窗之外。
药物常规剂量是在群体药动学结果和有限临床实践上建立的,大多数患者按照常规剂量会获得较好的临床疗效和安全性,但患者个体差异,生理病理状态都会对药动学参数产生一定影响。近年来,关于抗菌药物PK/PD的研究进展迅速,研究发现重症感染患者与健康人的PK/PD数据明显不同,例如万古霉素在重症感染患者群体分布相较正常人群快,患者存在高代谢和高循环动力状态,因而需要对治疗药物监测与给药方案的调整[13]。一项大样本临床研究表明莫西沙星最常见的药物不良反应为胃肠道症状,口服剂量400 mg/d,发生恶心、腹泻和头晕不良反应事件概率分别为7.1%、5.2%和2.6%[14]。国内也有莫西沙星不良反应的文献报道[15-16],此外,莫西沙星的中枢神经系统潜在危险与其他喹诺酮类药物一致[17],因此老年人、中枢神经系统损伤的老年患者(如癫痫、明显动脉硬化)应当谨慎使用,必要时减量,但目前尚无莫西沙星剂量调整的相关依据。
机体发生感染后,病原菌释放内毒素和外毒素,诱发的全身炎症反应,大量的细胞因子炎性介质释放,引起机体内环境稳态失衡,血管内皮破坏和毛细血管通透性增加,导致体液向第三间隙渗漏迁移[18],这一过程会使组织间分布的亲水性抗生素药物稀释,血浆和组织药物浓度下降,对亲脂性药物影响不大[19]。此外药物在体内以一定比例与血浆蛋白结合, 感染状态下血管通透性增加,蛋白向血管外间隙渗漏增加,以及肝脏合成减少,血浆白蛋白减低引起药物游离比例增多,这可能会增加组织内抗生素分布而增加抗感染效果,但同时可能增加药物的毒性作用[20],莫西沙星是表观分布容积较高的脂溶性药物,在感染状态肺组织浓度较健康状态增高,可能与血管通透性增加,血浆蛋白结合率降低有关。
有研究表明喹诺酮类抗菌药物马波沙星在感染小鼠肺组织的药物浓度是血浆药物浓度的2~3倍[21],多杀性巴氏杆菌感染显著增加了马波沙星的AUC、Cmax、MRT,这与本研究结论相似。肺炎模型大鼠与正常大鼠相比,莫西沙星在血浆中的浓度没有显著差异,而在肺炎大鼠肺组织中的浓度明显高于正常大鼠,最高为正常大鼠肺组织的3.4倍,这提示在肺炎链球菌感染的病理状态下,莫西沙星的肺组织穿透率升高。
莫西沙星在正常小鼠和肺炎链球菌感染小鼠的血浆和肺组织浓度均能够达到杀灭细菌并防止产生耐药性的要求。在感染状态下机体高敏、肝肾功能减退等病理因素可能增加莫西沙星不良反应的发生概率,而在肺炎病理状态下,莫西沙星肺组织AUC0-24h/MIC达到167.44,目前实验数据表明小鼠肺炎链球菌感染时莫西沙星肺组织浓度远高于健康状态,也远大于MIC和MPC,理论上有一定剂量调整的空间,其机制和具体方案还有待进一步实验研究,为优化特殊病人给药方案,调整药物剂量,减少药物不良反应提供可参考的数据。
Comparative of pharmacokinetic of moxifloxacin in the plasma and lung tissues of pneumonia rats and normal rats
-
摘要:
目的 莫西沙星(MXF)口服给药在被肺炎链球菌(S.p)感染肺炎大鼠与正常大鼠的血浆及肺组织中药动学比较研究。 方法 建立肺炎链球菌肺炎大鼠和正常大鼠模型,莫西沙星42 mg/kg灌胃给药,采用微透析技术对肺炎大鼠及正常大鼠的血液及肺组织取样,用高效液相色谱法测定莫西沙星在各样本中的游离药物浓度,计算药动学参数,进行肺炎大鼠和正常大鼠口服莫西沙星的药动学比较。 结果 莫西沙星在正常大鼠及肺炎大鼠血液中的t1/2分别为(5.27±4.38)h、(2.15±0.07)h(P>0.05),Cmax分别为(4.94±0.98)μg/ml、(4.83±0.05)μg/ml(P>0.05),Clast_obs/Cmax分别为0.02±0.03、0.27±0.04(P<0.05),AUC0-t分别为(22.33±2.02)μg/ml·h、(12.88±1.19)μg /ml·h(P<0.05),CL/F 分别为(1.79±0.11)(mg/kg)/(μg/ml)·h、(2.49±0.26)(mg/kg)/(μg/ml)·h(P<0.05);在正常大鼠及肺炎大鼠肺组织中的Cmax分别为(1.42±0.05)μg/ml、(4.84±0.02)μg /ml(P<0.05),t1/2分别为(1.9±0.63)h、(3.39±0.79)h(P>0.05),AUMC分别为(11.93±5.14)μg/ml·h2、(107.01±25.39)μg/ml·h2(P<0.05),AUC0-t分别为(3.06±1.0)7μg/ml·h、(13.16±0.53)μg /ml·h(P<0.01)。 结论 ①在400mg/d剂量条件下,莫西沙星灌胃给药后,血液及肺组织内的游离药物浓度较高,远超过最低抑菌浓度(MIC)和防耐药突变浓度(MPC),可以有效清除肺炎链球菌。②肺炎链球菌感染大鼠肺组织中莫西沙星游离浓度始终高于正常大鼠,Cmax约为正常大鼠的3.4倍,莫西沙星在肺炎大鼠的肺组织穿透率显著高于正常大鼠。 Abstract:Objective To compare the pharmacokinetics of moxifloxacin (MXF) administered orally in the plasma and lung tissues of rats with pneumonia infected by Streptococcus pneumoniae (S.p) and normal rats. Methods To establish a model of Streptococcus pneumoniae pneumonia rats and normal rats. Moxifloxacin was administered by intragastric administration at 42 mg/kg. Microdialysis technique was used to sample the blood and lung tissues of pneumonia rats and normal rats to determine the free drug concentration of moxifloxacin in each sample, calculate the pharmacokinetic parameters, and compare the pharmacokinetics of oral moxifloxacin in pneumonia rats and normal rats. Results The t1/2 of moxifloxacin in the blood of normal rats and pneumonia rats were (5.27±4.38) h, (2.15±0.07) h (P>0.05), and Cmax were (4.94±0.98) μg/ml, respectively, (4.83±0.05) μg/ml (P>0.05), Clast_obs/Cmax were 0.02±0.03, 0.27±0.04 (P<0.05), AUC0-t were (22.33±2.02)μg/ml·h, (12.88±1.19)μg /ml·h (P<0.05), CL/F are (1.79±0.11)(mg/kg)/(μg/ml)·h, (2.49±0.26)(mg/kg)/(μg/ml)·h (P<0.05); Cmax of lung tissue of normal rats and pneumonia rats were (1.42±0.05) μg/ml, (4.84±0.02) μg/ml (P<0.05), t1/2 are (1.9±0.63)h, (3.39±0.79)h (P>0.05), AUMC are (11.93±5.14)μg/ml·h2, (107.01±25.39)μg/ml·h2 (P<0.05), AUC0-t are (3.06±1.0) 7μg/ml·h, (13.16±0.53)μg/ml·h (P<0.01). Conclusions ① Under the 400 mg/d dose condition, after intragastric administration of moxifloxacin, the concentration of free drugs in the blood and lung tissues is higher, far exceeding the minimum inhibitory concentration (MIC) and anti-drug resistance concentration (MPC), can effectively remove Streptococcus pneumoniae. ②The free concentration of moxifloxacin in the lung tissue of rats infected with Streptococcus pneumoniae is always higher than that of normal rats, and the Cmax is about 3.4 times that of normal rats. The penetration rate of moxifloxacin in lung tissue of pneumonia rats is significantly higher than that of normal rats. -
Key words:
- moxifloxacin /
- pneumococcal pneumonia /
- microdialysis /
- pharmacokinetics
-
卡培他滨是一种新型的氟尿嘧啶类口服药,它是5-氟尿嘧啶(5-FU)的前体药物。卡培他滨口服给药方便、依从性好、疗效确切,是治疗结直肠癌的基石药物,但在治疗过程中产生的不良反应(手足综合征等)极大地影响了患者的治疗。手足综合征(HFS)是卡培他滨引起的不良反应中较为特殊的反应,也是卡培他滨在治疗过程中的药物剂量限制性不良反应,主要表现为皮肤红肿、水泡、出血、疼痛。合并使用环氧合酶、尿素霜、维生素B6、奥美拉唑也不能完全阻断手足综合征的发生[1-3];合并使用中草药如白芍、桂枝、甘草等可降低手足综合征的发生率[4]。口服卡培他滨的患者手足综合征发生率高达60%[1],严重降低患者用药依从性,严重手足综合征(约17%)的患者只能减少药物摄入量乃至停止服用药物,影响化疗按期、足量进行[5-6]。明确手足综合征的发生机制和有效干预对卡培他滨安全有效的应用具有重要价值。目前手足综合征模型的建立还没有统一的金标准,本实验尝试用ICR小鼠灌胃卡培他滨后建立手足综合征模型,为卡培他滨致手足综合征模型的建立及机制研究提供参考。
1. 材料与方法
1.1 动物与药品
雄性ICR小鼠,SPF级,5周龄左右,共42只小鼠,小鼠由上海西普尔-必凯实验动物有限公司提供。经上海中医药大学动物伦理委员会批准,实验动物伦理审查号为PZSHUTCM210715004。将小鼠随机编号1~42号,对照组ICR小鼠6只,实验组ICR小鼠36只。卡培他滨(商品名希罗达,上海罗氏制药有限公司,规格:0.5 g/片,国药准字号H20073024);羧甲基纤维素钠(CMC-Na)(国药集团);离心管(Titan公司);动物解剖手术器材(瑞沃德公司);消毒酒精、棉花球、锡箔纸(国药集团)。
1.2 饲养条件与环境
造模前小鼠先饲养1周,保证充足的水源与饲料,42只ICR小鼠自由摄取食物,环境湿度保持区间50%~60%(±5%),控制温度在(23±1) ℃,调节光照为12 h(6: 30至18: 30光照),其余时间为光暗周期。定期观察小鼠培养环境,定期为小鼠更换垫料,清理排泄物。
1.3 给药剂量、方式及周期
卡培他滨0.5 g/片,溶解于10 ml CMC-Na(0.5%)中,制得50 mg/ml悬浊液备用。实验组ICR小鼠(36只),灌胃给药,按275 mg/kg(即小鼠0.15 ml/30g)连续灌胃14 d,2次/d(按照卡培他滨临床给药方案1 250 mg/kg,2次/d的剂量换算)。对照组ICR小鼠(6只),灌胃给予CMC-Na(0.5%)溶液,按照4 ml/kg剂量连续的灌胃14 d,2次/d。
1.4 手足综合征阳性判断标准
1.4.1 小鼠手足综合征观察
取ICR小鼠的后足跖部皮肤组织,用生理盐水冲洗并擦干,以多聚甲醛(4%)对小鼠组织进行固定,石蜡包埋切片,使用苏木精-伊红对小鼠组织染色(H&E染色),使用普通光镜(比例尺5 μm)检测(注:染色呈现蓝色的为表皮层,该层位于淡粉色的角质层和淡蓝色的真皮层之间)。每天肉眼观察,若小鼠出现足跖部特征性改变,立即拍照并记录手足综合征发生时间,每3 d拍照记录小鼠足跖部皮肤变化情况。
1.4.2 小鼠体重观察
实验组与对照组自由饲养1周后称重,记录原始体重,灌胃给药后每3 d对所有实验小鼠称重一次并记录体重变化。
1.4.3 手足综合征阳性参考标准
标准参考美国国家癌症研究所(NCI)关于手足综合征的分级规定,建模实验中若实验小鼠足跖部的皮肤呈现了红色斑块、组织肿胀、角质层脱屑、溃疡、角质层厚度明显增加及其他明显体征者均可判定为手足综合征阳性。
1.5 样本收集方案
1.5.1 手足综合征阳性ICR小鼠的血浆和足趾部皮肤组织样本制备
对于手足综合征阳性的小鼠,在出现手足综合征后,经眼眶采样,用1.5 ml离心管(肝素钠抗凝)取血约0.5 ml,12 000 r/min离心10 min,收集血浆约0.25 ml,置于−80 ℃冰箱冷冻保存。采集小鼠血样后按照实验动物伦理要求规范处死小鼠,用手术剪取小鼠手足部皮肤,生理盐水冲洗后用锡纸包裹住样本并标号。所有样本置于−80 ℃冰箱冷冻保存,所有操作在1 h内完成。
1.5.2 手足综合征阴性ICR小鼠的血浆和足趾部皮肤组织样本制备
小鼠经过14 d给药未出现手足综合征阳性反应,则认定该类小鼠为造模失败小鼠,在第15天对该类小鼠统一进行眼眶采血和足趾部皮肤组织样本收集,方法同“1.5.1”。对照组小鼠在第15天收集样本,方法同“1.5.1”。
1.6 统计分析
数据采用平均值±标准差(mean±SD)表示,组与组之间根据数据分布状态比较采用学生t检验或秩检验,P<0.05认为有统计学差异。制图采用Excel或Graphpad 8.0软件。
2. 结果与讨论
2.1 小鼠体重变化及生存状态
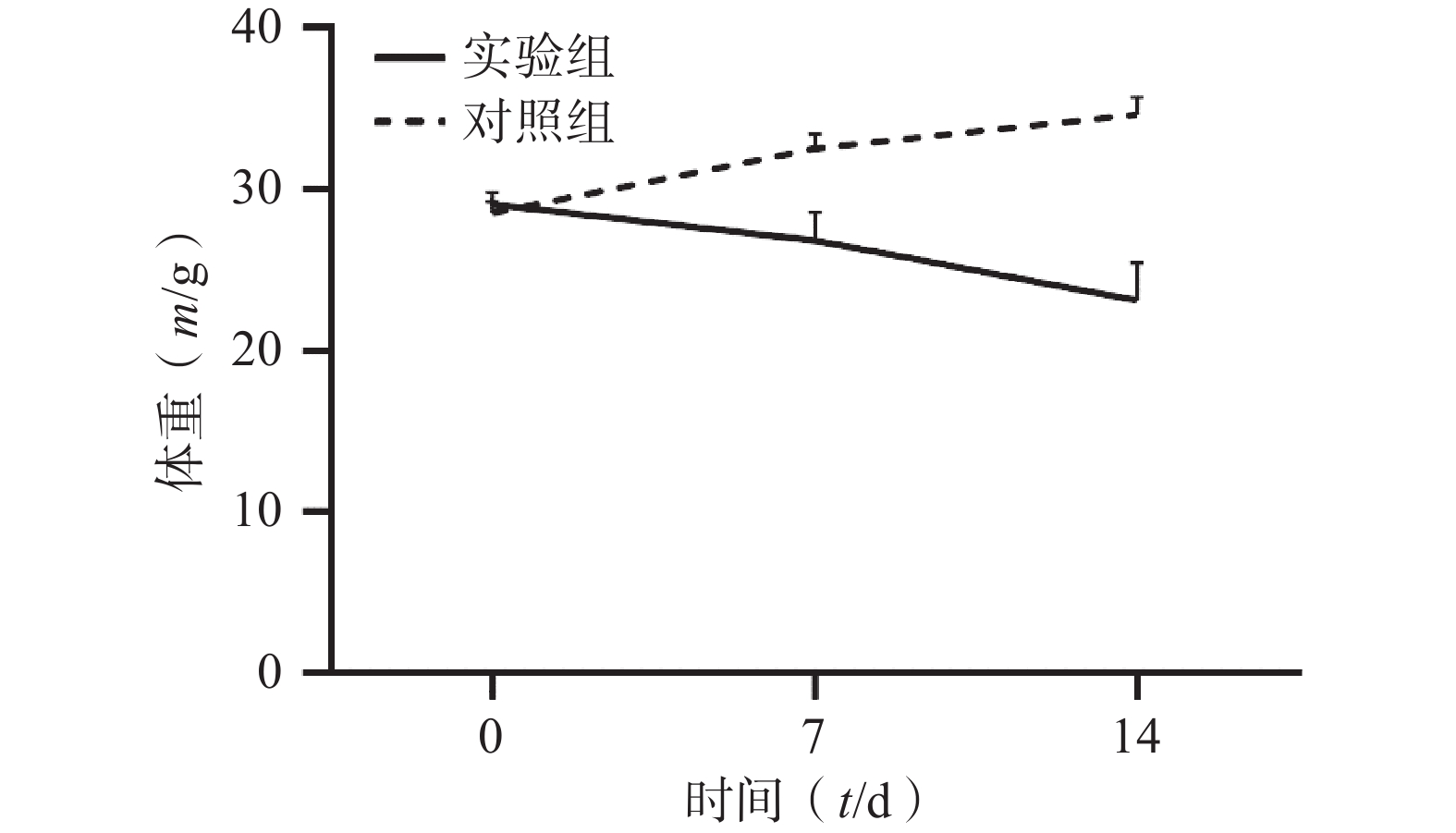
通过对比对照组与实验组ICR小鼠体重变化,发现对照组ICR小鼠,灌胃14 d后,体重明显增加;而实验组ICR小鼠,灌胃14 d后,体重明显降低。表1和图1 为14 d内ICR小鼠的体重变化,实验过程中实验组小鼠死亡3只。
表 1 实验周期内小鼠体重变化情况(m/g,$ \bar{x}\pm s $ )组别 n 0 d 7 d 14 d 对照组 6 28.54±0.71 32.56±0.88 34.66±1.07 实验组 33 29.07±0.76 26.84±1.74*** 23.15±2.31*** *** P<0.001,与对照组比较。 2.2 小鼠手足综合征病理观察
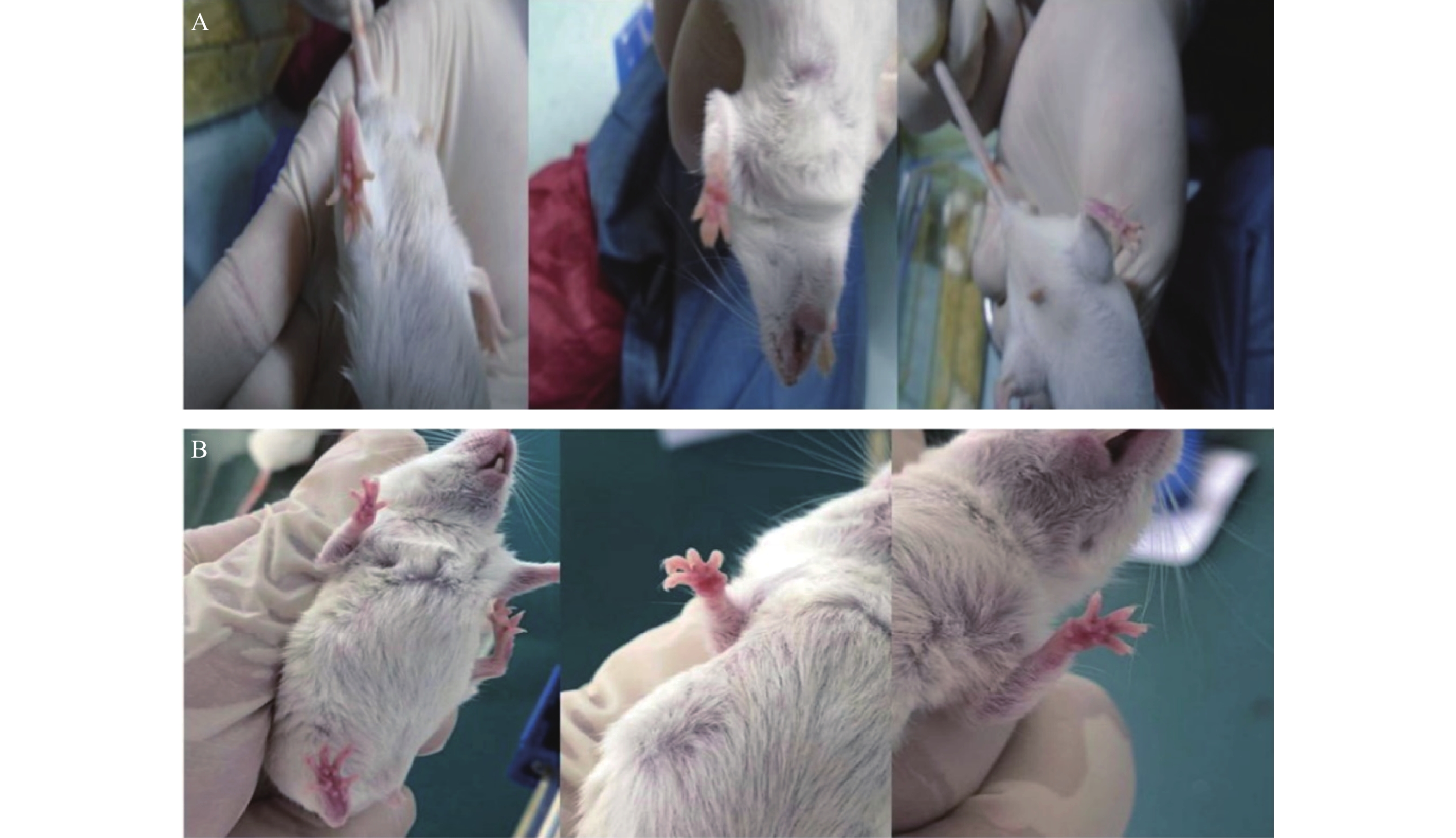
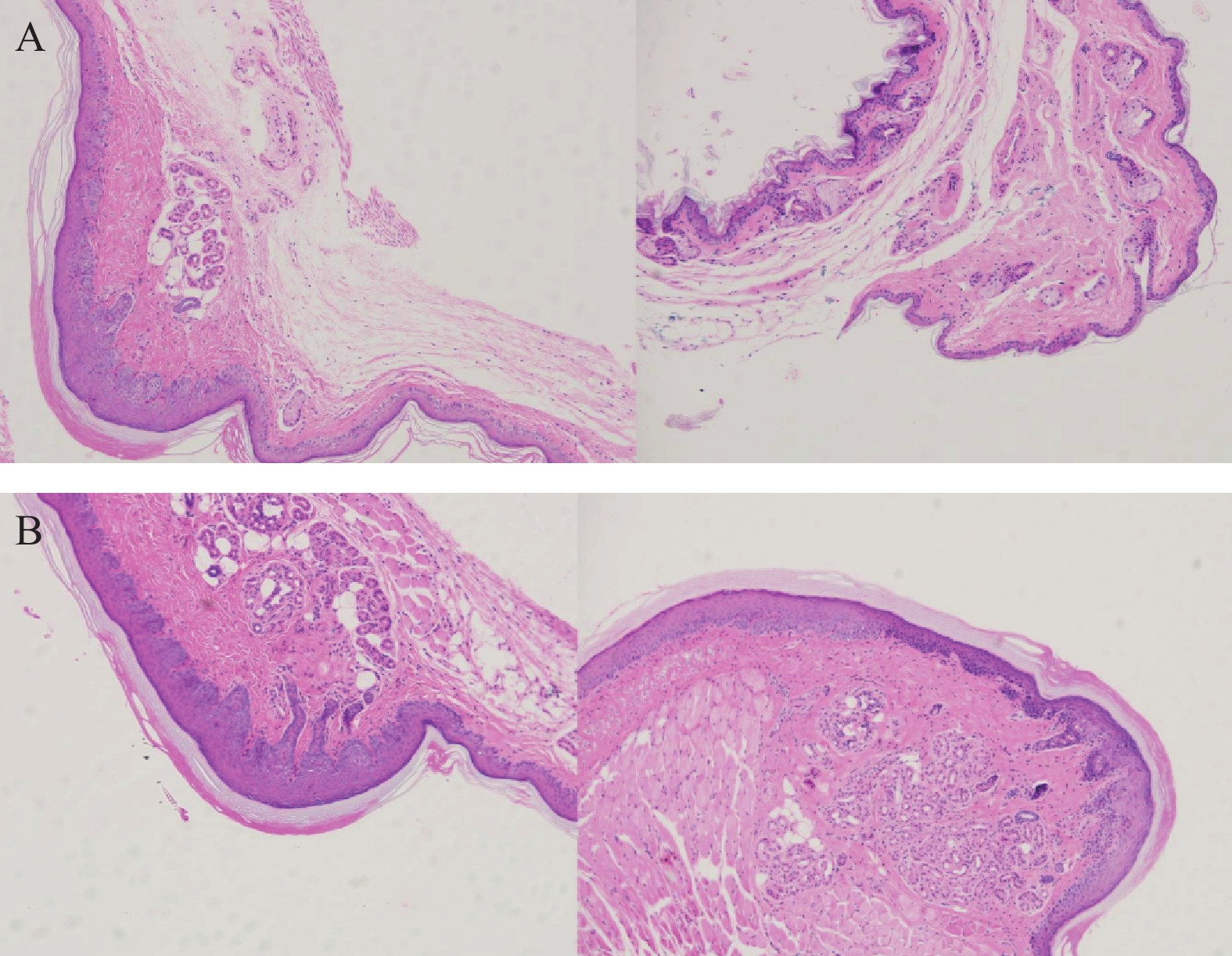
与对照组ICR小鼠相比,19只实验组小鼠的足底皮肤明显出现红斑、肿涨并出现少许水泡(图2),认为该小鼠出现手足综合征,按照伦理要求将小鼠处死,收集足底皮肤组织样本和血浆样本。
2.3 小鼠足底皮肤H&E染色
将ICR小鼠四肢皮肤用4%多聚甲醛固定后进行H&E染色(因苏木精呈碱性,细胞核内的染色质与胞质内的核酸显紫蓝色;伊红呈酸性,细胞质和细胞外基质中的成分显红色),如图3显示。与正常ICR小鼠相比,手足综合征阳性小鼠皮肤表皮层增厚,角质层呈现粉红色,真皮层呈现浅蓝色,表皮层处在二者之间呈现蓝色。发生HFS小鼠皮肤颗粒层变薄,基底层和棘层间细胞数量减少。正常小鼠角质层明显较薄。
2.4 小鼠手足综合征发生率
ICR小鼠共39只(对照组6只,实验组33只),19只实验组ICR小鼠出现手足综合征阳性症状,发生率为57.58%。实验组ICR小鼠灌胃给药1周,出现手足综合征阳性小鼠与未出现手足综合征小鼠相比:实验组小鼠足底皮肤颜色变深(深红色),少量小鼠四肢掌心有透明水泡样组织出现;在灌胃给药10 d后,实验组小鼠出现手足综合征阳性症状,四肢出现了红斑、脱屑、水泡(红斑出现最多,脱屑其次,水泡最少)等情况。
2.5 卡培他滨及其代谢产物暴露浓度分析
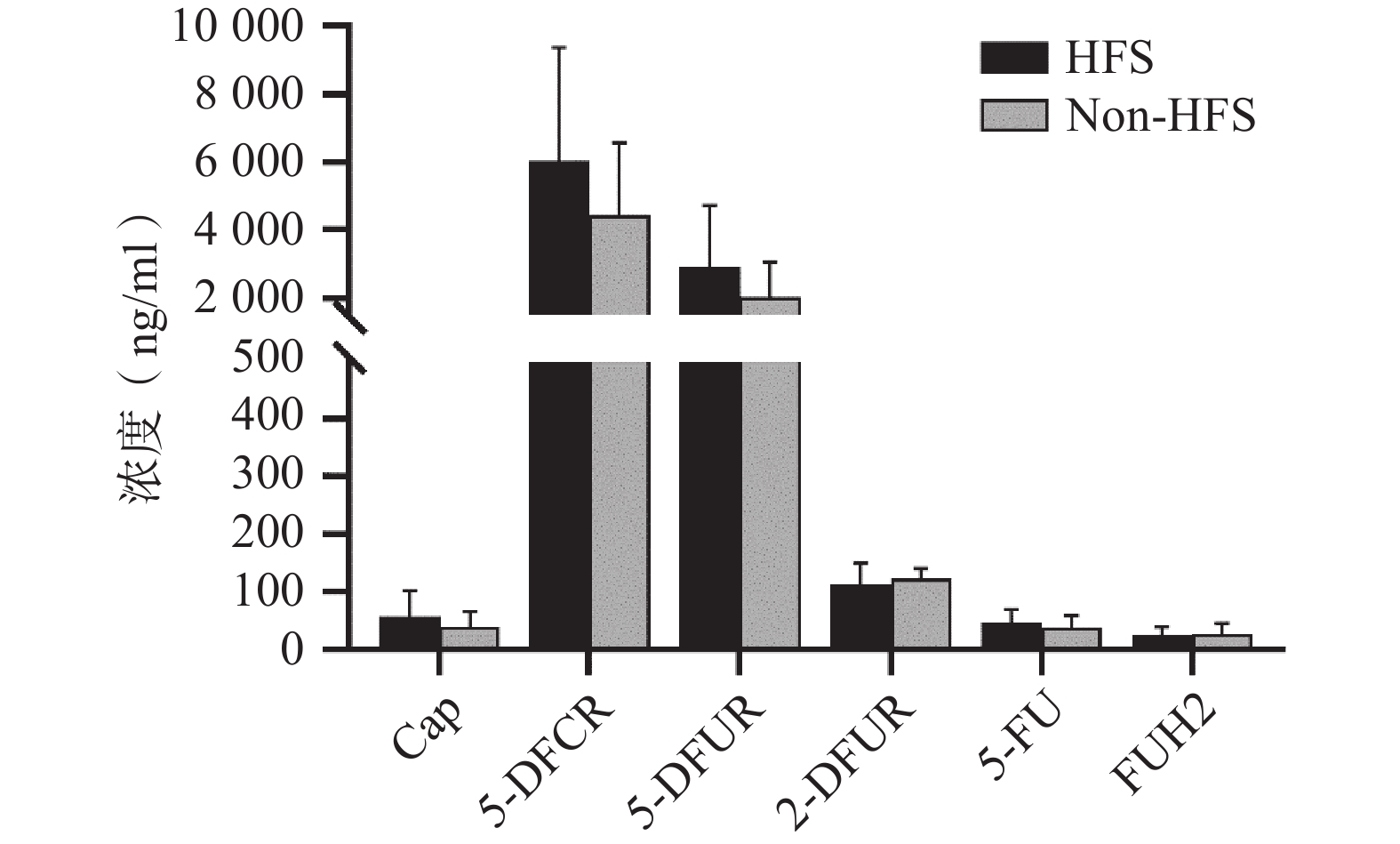
将收集的血浆样本按照前期报道的方法进行卡培他滨及其5种代谢产物(5'-脱氧-5-氟胞嘧啶核苷、去氧氟尿苷、5'-氟-2'-脱氧尿苷、5-氟尿嘧啶、5-氟二氢嘧啶-2,4-二酮[7])定量(ng/ml,mean±SD)。结果发现,发生手足综合征小鼠与未发生手足综合征小鼠相比,卡培他滨浓度(ng/ml)分别为(58.08±44.54)和(39.23±26.98),5'-脱氧-5-氟胞嘧啶核苷浓度(ng/ml)分别为(
6047.42 ±3331.94 )和(4442.77 ±2140.44 ),去氧氟尿苷浓度(ng/ml)分别为(2899.28 ±1821.15 )和(2018.81 ±1037.86 ),5'-氟-2'-脱氧尿苷浓度(ng/ml)分别为(112.89±36.85) 和(122.23±19.16),5-氟尿嘧啶浓度(ng/ml)分别为(46.86±23.08)和(38.33±20.62),5-氟二氢嘧啶-2,4-二酮浓度(ng/ml)分别为(24.45±14.79)和(27.34±17.84)。卡培他滨及其代谢产物在发生和未发生手足综合征小鼠体内暴露水平均无明显差异(P>0.05,图4)。3. 讨论
体内药物暴露水平同药物疗效和不良反应密切相关。目前药物暴露水平常用的参数有曲线下面积(AUC)、稳态浓度(css)、峰浓度(cmax)、谷浓度(cmin)等。有研究发现[8],根据5-FU的AUC调整给药剂量后,患者血液系统出现3~4级不良反应发生率从之前的17.5%下降为 7.6%(P<0.05),黏膜炎的发生率也从5%降低为0%(P<0.01),总生存时间显著增加,从原来的16个月延长到22个月(P<0.01)。因此,5-FU在体内浓度可能成为预测疗效及不良反应的潜在预警生物标志物之一[9-10]。本研究中未发现卡培他滨及其代谢产物同手足综合征具有相关性,但Daher Abdi在20名75岁以上老年患者中发现,卡培他滨及其代谢产物在发生手足综合征患者体内暴露水平明显较高[11],但体外研究表明,5-FU同手足综合征无明显关联[12]。另有研究表明,手足皮肤局部较高表达的胸苷磷酸化酶可产生局部较高浓度的5-FU,同卡培他滨引发的手足综合征密切相关[13]。总之,卡培他滨引发手足综合征的机制仍需进一步研究。
在卡培他滨致手足综合征模型的建立方面,黎鹏等灌胃给予SD大鼠200~400 mg/d,2次/d,用药1~2周(1周后停药3 d),建立了卡培他滨致手足综合征模型,并认为200 mg/kg的剂量,灌胃2周可较好地建立手足综合征模型(造模成功率77.5%)[14]。但有研究显示,卡培他滨在大鼠体内的代谢过程与人体不同,因大鼠体内胞苷脱胺酶活性较低,5-DFCR通过糖基化生成其他产物,产生的5-FU较少,而卡培他滨在小鼠体内的代谢过程与人体基本相同,可能是最好的动物模型[15-16];Hiromoto [3]等利用ICR小鼠,灌胃给予200 mg/kg,1次/d,5次/周的方法建立手足综合征模型,3周建立手足综合征模型,但成功率未报道。He和Chen等给予ICR小鼠灌胃200 mg/kg,1次/d,连续灌胃30 d后,6只小鼠中仅有1只未发生手足综合征[17]。前期预实验中,采用灌胃200 mg/kg,2次/d的方法在ICR小鼠上建立手足综合征模型,灌胃1周后,6只小鼠仅有1只发生手足综合征。因此,根据临床卡培他滨用药剂量(1 250 mg/kg,2次/d)换算小鼠剂量为275 mg/kg,2次/d,既缩短了给药时间,又提高了建模成功率(57.6%),且较少有小鼠死亡(3只)。
4. 小结
本实验成功建立了卡培他滨致手足综合征的ICR小鼠模型,在给药时长、造模成功率方面均有一定优势。卡培他滨及其代谢产物在小鼠体内暴露浓度同手足综合征发生可能无关。手足综合征的发生机制仍需进一步研究。
-
表 1 灌胃给予莫西沙星的正常大鼠与肺炎大鼠血浆和肺组织中的药动学参数
参数 单位 血浆 肺组织 正常组 肺炎组 正常组 肺炎组 Lambda_z 1/h 0.2±0.13 0.32±0.01 0.4±0.15 0.21±0.06 t1/2 h 5.27±4.38 2.15±0.07 1.9±0.63 3.39±0.79 Tmax h 0.67±0.14 1±0 0.89±0.2 0.94±0.1 Cmax μg/ml 4.94±0.98 4.83±0.05 1.42±0.05 4.84±0.02## Tlag h 0±0 0±0 0±0 0±0 Clast_obs/Cmax 0.02±0.03 0.27±0.04## 0.18±0.09 0.33±0.01 AUC 0-t μg/ml·h 22.33±2.02 12.88±1.19# 3.06±1.07 13.16±0.53## AUC 0-inf_obs μg/ml·h 23.51±1.41 16.96±1.71 3.77±1.29 20.93±1.35 AUC0-t/0-inf_obs 0.95±0.08 0.76±0.01 0.81±0.09 0.63±0.07# AUMC 0-inf_obs μg/ml·h2 151.89±92.76 62.01±8.56 11.93±5.14 107.01±25.39# MRT 0-inf_obs h 6.41±3.77 3.65±0.14 3.17±0.77 5.07±0.92 Vz/F_obs (mg/kg)/(μg/ml) 13.51±10.9 7.76±0.97 33.98±20.28 9.74±1.72 CL/F_obs (mg/kg)/(μg/ml)·h 1.79±0.11 2.49±0.26# 12.02±3.9 2.01±0.13 #P<0.05,##P<0.01,与正常组比较 表 2 正常大鼠和肺炎大鼠体内莫西沙星的PK/PD参数比较
PK/PD参数 血浆 肺组织 正常组 肺炎组 肺炎组/正常组 正常组 肺炎组 肺炎组/正常组 Cmax/MIC90 39.52 38.64 0.98 11.36 38.72 3.41 AUC0-∞/MIC90 188.08 135.68 0.72 30.16 167.44 5.54 Cmax/MPC90 2.47 2.42 0.98 0.71 2.42 3.41 AUC0-∞/MPC90 11.76 8.48 0.72 1.89 10.47 5.54 -
[1] 王华庆, 安志杰. 肺炎球菌性疾病免疫预防专家共识(2017版)[J]. 中国预防医学杂志, 2018, 19(3):161-191. [2] KIM S H, SONG J H, CHUNG D R, et al. Changing trends in antimicrobial resistance and serotypes of Streptococcus pneumoniae isolates in Asian countries: an Asian Network for Surveillance of Resistant Pathogens (ANSORP) study[J]. Antimicrob Agents Chemother,2012,56(3):1418-1426. doi: 10.1128/AAC.05658-11 [3] LYU S, YAO K H, DONG F, et al. Vaccine serotypes of Streptococcus pneumoniae with high-level antibiotic resistance isola-ted more frequently seven years after the licensure of PCV7 in Beijing[J]. Pediatr Infect Dis J,2016,35(3):316-321. doi: 10.1097/INF.0000000000001000 [4] SONG J H. Advances in pneumococcal antibiotic resistance[J]. Expert Rev Respir Med,2013,7(5):491-498. doi: 10.1586/17476348.2013.816572 [5] 中华医学会呼吸病学分会. 中国成人社区获得性肺炎诊断和治疗指南(2016 年版)[J]. 中华结核和呼吸杂志, 2016, 39(4):1-27. [6] 赵东玲, 屈清慧, 李瑞林, 等. 莫西沙星致不良反应3445例文献分析[J]. 中国药房, 2015, 26(21):2913-2915. doi: 10.6039/j.issn.1001-0408.2015.21.13 [7] 赵春江, 张菲菲, 王占伟, 等. 2012年中国成人社区获得性呼吸道感染主要致病菌耐药性的多中心研究[J]. 中华结核和呼吸杂志, 2015, 38(1):18-22. doi: 10.3760/cma.j.issn.1001-0939.2015.01.008 [8] SOMAN A, HONEYBOURNE D, ANDREWS J, et al. Concentrations of moxifloxacin in serum and pulmonary compartments following a single 400 mg oral dose in patients undergoing fibreoptic bronchoscopy[J]. J Antimicrob Chemother,1999,44(6):835-838. doi: 10.1093/jac/44.6.835 [9] 王小均, 刘春涛, 余勤, 等. 盐酸莫西沙星的全身和肺部药代动力学比较研究[J]. 中国呼吸与危重监护杂志, 2008, 7(2):88-92. doi: 10.3969/j.issn.1671-6205.2008.02.002 [10] BREILH D, JOUGON J, DJABAROUTI S, et al. Diffusion of oral and intravenous 400 mg once-daily moxifloxacin into lung tissue at pharmacokinetic steady-state[J]. J Chemother,2003,15(6):558-562. doi: 10.1179/joc.2003.15.6.558 [11] 李奕, 成熙, 曹玉书, 等. 莫西沙星在肺炎大鼠血液及肺组织的药代动力学研究[J]. 中国药物应用与监测, 2017, 14(6):336-340. doi: 10.3969/j.issn.1672-8157.2017.06.003 [12] 郭蓓宁, 郁继诚, 张菁, 等. 氟喹诺酮类药物对临床分离肺炎链球菌的防突变浓度[J]. 中国感染与化疗杂志, 2010, 10(1):13-16. [13] 黄兴富, 童伟, 吴静, 等. 万古霉素在重症感染患者的药动学[J]. 医药导报, 2018, 37(6):745-749. [14] BALL P, STAHLMANN R, KUBIN R, et al. Safety profile of oral and intravenous moxifloxacin: cumulative data from clinical trials and postmarketing studies[J]. Clin Ther,2004,26(7):940-950. doi: 10.1016/S0149-2918(04)90170-1 [15] 陈晓红, 赵志刚, 王慧媛. 122例莫西沙星所致不良反应分析[J]. 中国医院用药评价与分析, 2009, 9(10):782-783. [16] 刘宪军. 1824例莫西沙星不良反应报告分析[J]. 中国药业, 2015, 24(13):56-58. [17] 谷建俐, 王书民, 秦智彬, 等. 莫西沙星引发的神经/精神系统不良反应分析[J]. 医学综述, 2018, 24(19):3937-3940, 3945. doi: 10.3969/j.issn.1006-2084.2018.19.038 [18] BOCHUD P Y, CALANDRA T. Pathogenesis of Sepsis: new concepts and implications for future treatment[J]. BMJ,2003,326(7383):262-266. doi: 10.1136/bmj.326.7383.262 [19] JOYNT G M, LIPMAN J, GOMERSALL C D, et al. The pharmacokinetics of once-daily dosing of ceftriaxone in critically ill patients[J]. J Antimicrob Chemother,2001,47(4):421-429. doi: 10.1093/jac/47.4.421 [20] FLECK A, RAINES G, HAWKER F, et al. Increased vascular permeability: a major cause of hypoalbuminaemia in disease and injury[J]. Lancet,1985,1(8432):781-784. [21] 瞿颖, 卢燕, 孙美珍, 等. 马波沙星在健康小鼠和感染多杀性巴氏杆菌小鼠体内的药动学比较[J]. 华南农业大学学报, 2016, 37(2):14-19. doi: 10.7671/j.issn.1001-411X.2016.02.003 期刊类型引用(5)
1. 娄梅梅,王海亮,徐兰霞. 莫西沙星与左氧氟沙星联合哌拉西林/他唑巴坦治疗社区获得性肺炎的临床优势比较. 临床合理用药. 2023(07): 70-73 .  百度学术
百度学术2. 庄海涛,许洋. 痰热清注射液联合莫西沙星注射液治疗老年社区获得性肺炎的临床效果及对血清炎性因子的影响. 临床合理用药杂志. 2022(11): 13-16 .  百度学术
百度学术3. 杨丽雄,蔡丽秋. 莫西沙星治疗肺部感染的临床疗效评价及药物相互作用分析. 中国卫生标准管理. 2022(06): 108-110 .  百度学术
百度学术4. 于宝腾. 莫西沙星在成人术后感染中的应用现状. 天津药学. 2022(06): 64-68 .  百度学术
百度学术5. 胡贺佳,陈艳,王爱民,王永林,巩仔鹏. 微透析技术在药动学及药动学-药效学模型研究中的应用进展. 江苏大学学报(医学版). 2021(01): 44-50 .  百度学术
百度学术其他类型引用(0)
-






 下载:
下载:
 下载:
下载: