-
红色诺卡菌(Nocardia rubra,Nr)是一种放线菌,其细胞壁骨架(Nocardia rubra cell wall skeleton,Nr-CWS)具有免疫调节作用[1]。Nr-CWS作为一种治疗药物现已在国内上市并在临床使用。研究表明,Nr-CWS在增强体内巨噬细胞、T细胞和自然杀伤细胞活性的同时,还能诱导机体产生LAK细胞,提高机体内T辅助性细胞和杀伤细胞活力、增强巨噬细胞和天然杀伤细胞免疫活性,抑制肿瘤和增强免疫能力的功效[2-4]。但Nr-CWS在发挥作用的同时,往往还伴随一些副作用的发生。究其主要原因是由于红色诺卡菌细胞壁是个细胞粗提物[5],其中的成分复杂,具体哪种成分起相应的药理作用还不清楚,这极大地影响了其临床使用及后续药理作用机制的研究。本研究拟采用UHPLC-Q-TOF/MS分析方法首先对Nr-CWS提取物中化学成分进行分离分析,鉴别其中的化学成分;并对其中的多糖成分进行水解,然后对水解后的单糖进行衍生化处理,与其他分析方法相比, UHPLC-MS/MS具有较大的优越性[6-8], 其灵敏度高、专属性强、可以快速准确地测定单糖的含量。所以本研究采用UHPLC-MS/MS方法对单糖衍生化产物进行定量分析测定,这将为后期开展Nr-CWS活性成分筛选及药理作用机制的研究奠定基础。
-
安捷伦-1290 Infinity高效液相色谱系统-电喷雾离子源(安捷伦,Palo Alto, CA, USA)串联安捷伦6538四级杆-高分辨飞行时间质谱(UHPLC-Q-TOF/MS),安捷伦-1290 Infinity高效液相色谱系统-电喷雾离子源(安捷伦,Palo Alto, CA, USA)串联安捷伦6460三重四级杆质谱(UHPLC-MS/MS),AMIDE色谱柱(3.0 mm×100 mm,3.5 µm,Waters,USA),Waters Xbridge C18色谱柱(2.1 mm×100 mm,1.7 μm),Milli-Q50 SP纯水制备系统制备(Millipore Corporation, MA, USA),电热干燥箱(上海恒科仪器有限公司,DHG-9145AZ)。
-
Nr-CWS提取物(辽宁格瑞士特生物科技有限公司,按照产品工艺提取);Sephadex G-100(国药集团化学试剂有限公司);D-甘露糖、D-核糖、L-鼠李糖、D-果糖、D-葡萄糖、D-木糖、D-半乳糖、D-阿拉伯糖(纯度>98%,国药集团化学试剂有限公司);三氟乙酸(TFA)、1-苯基-3-甲基-5-吡唑啉酮(PMP,国药集团化学试剂有限公司);HPLC色谱级甲醇、乙腈(默克公司,Darmstadt, Germany);乙醇、甲酸(Fluka公司,Buchs, Switzerland)。
-
UHPLC-Q-TOF/MS分析在安捷伦1290 Infinity 液相色谱系统和安捷伦6538四极杆-高分辨飞行时间串联质谱仪(Agilent,USA)上进行,色谱分离在Amide色谱柱上进行(3.0 mm×100 mm,3.5 µm,Waters,USA),柱温40 ℃,流动相A为0.1 %甲酸水溶液,流动相B为乙腈溶液,流速0.4 ml/min,流动相采用梯度洗脱,洗脱条件为:0~1 min,5 % A;1~5 min,5 %~20 % A;5~20 min,20%~45 % A;20~30 min,45 % A,进样量为5 µl,自动进样器温度保持在25 ℃。电喷雾离子源(ESI)采用正、负离子模型。Q-TOF/MS质谱参数如下:毛细管电压,正离子模式下4 kV,负离子模式下3.5 kV;干燥器流速11 L/min;气体温度350 ℃;雾化器压力45 psig;碎片电压120 eV;Skimmer电压60 eV。质谱的采集范围m/z 50~1100,分析碰撞能量10~40 eV。
-
取Nr-CWS提取物溶于1 ml纯水中,充分涡旋溶解后制成Nr-CWS提取物母液,取100 µl于1.5 ml EP管中,加入3倍量的乙醇进行蛋白沉淀。然后4 ℃下13 000 r/min离心15 min,吸取200 µl上清液,于进样瓶中用于UHPLC-Q-TOF/MS分析。
-
采用UHPLC-Q-TOF/MS分析方法对Nr-CWS提取物样品溶液进行快速地分离与分析,获得正、负离子模式下的总离子流图,通过与Metlin数据库中代谢物信息比对分析,可对Nr-CWS提取物中化学成分进行快速分析与鉴别,结果如图1和表1所示。
表 1 Nr-CWS中化学分析的UHPLC-Q-TOF/MS数据信息
序号 化合物名称 [M+X] 分子式 m/z 保留时间(t/min) 1 2-(S-glutathionyl)acetyl glutathione M-H C22H34N6O13S2 654.162 5 0.91 2 2-(S-glutathionyl)acetyl glutathione M+H C22H34N6O13S2 654.668 0 0.91 3 estradiol-17alpha 3-D-glucuronoside M-H C24H32O8 448.209 7 1.12 4 tyrosine M+H C9H11NO3 181.190 0 1.13 5 cer(d18∶0/23∶0) M+H C41H83NO3 637.637 3 1.30 6 palmitic acid M-H C16H32O2 256.424 1 1.31 7 stearic acid M-H C18H36O2 284.271 5 1.31 8 L-threonine M+H C4H9NO3 119.120 0 1.33 9 D-xylose M-H C5H10O5 150.130 0 1.34 10 N-acetyl-D-glucosamine M-H C8H15NO6 221.210 0 1.39 11 meso-2,6-diaminopimelic acid M+H C7H14N2O4 190.197 1 1.39 12 leinoleic acid M+H C18H32O2 280.445 5 1.41 13 choline M+H C5H15NO 104.170 8 1.56 14 L-rhamnose monohydrate M-H C6H12O5 164.160 0 1.64 15 docosapentaenoic acid M-H C22H34O2 330.255 9 1.67 16 proline M-H C5H9NO2 115.130 0 1.93 17 fructose 1,6-bisphosphate M+H C6H14O12P2 339.996 0 2.22 18 glucose 6-phosphate M+H C6H13O9P 260.135 8 2.28 19 fucose M-H C6H12O5 164.150 0 2.34 20 L-proline M-H C5H9NO2 115.063 3 2.34 21 PG(18∶0/20∶3(8Z,11Z,14Z)) M-H C44H81O10P 800.556 7 5.96 22 tetracosanoic acid M-H C24H48O2 368.636 7 7.07 23 orotidylic acid M-H C10H13N2O11P 368.190 8 7.65 24 sphinganine M+H C18H39NO2 301.507 8 7.72 25 valine M-H C5H11NO2 117.150 0 7.74 26 cervonoyl ethanolamide M-H C24H36O3 372.540 8 7.94 27 phytosphingosine M+H C18H39NO3 317.507 2 7.94 28 tryptophan M+H C11H12N2O2 204.230 0 7.97 29 trihexosylceramide (d18∶1/12∶0) M-H C48H89NO18 967.608 0 8.10 30 histidine M+H C6H9N3O2 155.160 0 8.45 31 L-asparagine M-H C4H8N2O3 132.120 0 9.65 32 galactinol dihydrate M-H C12H26O13 378.327 0 9.66 33 3-hydroxydodecanoyl carnitine M+H C19H37NO5 359.500 8 9.70 34 L-cysteine M+H C3H7NO2S 121.120 0 9.84 35 cysteinyl-threonine M-H C7H14N2O4S 222.067 4 9.98 36 D-mannose M-H C6H12O6 180.160 0 10.10 37 MG (0∶0/24∶1(15Z)/0∶0) M-H C27H52O4 440.386 6 10.11 38 4-(methylnitrosamino)-1-(3-pyridyl)-1-butanol glucuronide M-H C16H23N3O8 385.369 1 11.32 39 D-glucose M-H C6H12O6 180.160 0 11.34 40 desmosine M+H C24H40N5O8 526.603 1 11.38 41 L-methionine M+H C5H11O2NS 149.210 0 11.59 42 glycogen M-H C24H42O21 666.577 7 11.90 43 levan M-H C18H32O16 504.437 1 11.90 44 D-galactose M-H C6H12O6 180.160 0 11.92 45 L-beta-aspartyl-L-aspartic acid M+H C8H12N2O7 248.190 1 12.00 46 muramic acid M-H C9H17NO7 251.233 8 12.16 47 1-pyrroline-2-carboxylic acid M-H C5H7NO2 113.114 6 12.25 48 ADP-glucose M-H C16H25N5O15P2 589.341 7 12.25 49 DG(42∶10) M+H C45H68O5 688.506 7 12.27 50 isoleucine M-H C6H13NO2 131.170 0 12.55 51 leucine M-H C6H13NO2 131.170 0 12.79 52 PGP(16∶1(9Z)/18∶0) M-H C40H78O13P2 828.491 8 12.99 53 PGP(16∶0/20∶4) M+H C42H76O13P2 850.992 6 13.01 54 TG(62∶6) M-H C65H114O6 990.861 5 13.60 55 ganglioside GM3 (d18∶1/16∶0) M-H C57H104N2O21 1152.713 2 14.15 56 valyl-methionine M+H C10H20N2O3S 248.342 0 14.18 57 DG(18∶2n6/0∶0/22∶6n3) M-H C44H70O5 678.522 3 15.27 58 PS(16∶0/18∶2) M-H C40H74NO10P 759.990 0 15.90 59 PGP(18∶1/22∶6) M-H C46H78O13P2 900.491 8 16.62 60 CDP-DG(16∶0/18∶0) M-H C46H85N3O15P2 981.545 6 17.41 61 TG(22∶6(4Z,7Z,10Z,13Z,16Z,19Z)/24∶0/22∶6(4Z,7Z,10Z,13Z,16Z,19Z)) M-H C71H114O6 1 062.861 5 18.28 62 TG(24∶0/24∶0/24∶0) M-H C75H146O6 1 143.111 9 19.25 63 serine M-H C3H7NO3 105.090 0 27.23 64 alanine M-H C3H7NO2 89.090 0 27.28 -
准确称取D-甘露糖、D-核糖、L-鼠李糖、D-果糖、D-葡萄糖、D-木糖、D-半乳糖、D-阿拉伯糖各10 mg,分别置10 ml 容量瓶,各加水定容,即得1 mg/ml浓度的各单糖标准品溶液。分别精密取上述单糖标准品溶液,混合后加重蒸水稀释,制成100 μg/ml的单糖混合标准溶液。
-
精密称取1-苯基-3-甲基-5-吡唑啉酮(PMP)1.0 g,置10 ml量瓶中,加甲醇溶解并定容,摇匀,制得0.5 mol/L的PMP 甲醇溶液。
-
精密吸取单糖及混合标准品溶液100 μl置2 ml EP管中,添加100 μl氨水,再加入100 μl 0.5 mol/L的PMP甲醇溶液,涡旋30~45 s,于70 ℃烘箱中加热30 min,取出放冷至室温。加入100 μl乙酸,涡旋30 s中和,加重蒸水至1 ml,再加500 μl氯仿,涡旋30 s,混匀,弃去下层溶液,重复3 次,12 000 r/min离心10 min,水层经0.22 μm微孔滤膜滤过,取次滤液用于UHPLC-MS/MS分析,见表2。
表 2 UHPLC-MS/MS分析测定的质谱条件
序号 化合物名称 保留时间(t/min) 分子式 单糖分子量 衍生物分子量 母离子 子离子 碰撞电压(eV) 1 D-甘露糖 2.012 C6H12O6 180.1 512.1 511.1 175.0, 217.1 34 2 D-核糖 2.216 C5H10O5 150.1 482.1 481.1 175.0, 217.1 31 3 L-鼠李糖 2.423 C6H14O6 164.1 496.1 495.1 175.0, 217.1 31 4 D-果糖 2.504 C6H12O6 180.1 512.1 511.1 175.0, 217.1 34 5 D-葡萄糖 3.725 C6H12O6 180.1 512.1 511.1 175.0, 217.1 34 6 D-木糖 3.917 C5H10O5 150.1 482.1 481.1 175.0, 217.1 31 7 D-半乳糖 3.918 C6H12O6 180.1 512.1 511.1 175.0, 217.1 34 8 D-阿拉伯糖 4.086 C5H10O5 150.1 482.1 481.1 175.0, 217.1 31 -
UHPLC-MS/MS分析采用安捷伦1290 Infinity 液相色谱系统和安捷伦6460三重四极杆串联质谱仪(Agilent,USA)。色谱分离在Waters Xbridge C18色谱柱(2.1 mm×100 mm,1.7 μm),柱温40 ℃,流动相A为20 mmol/L的乙酸铵水溶液(氨水调pH 8.0),流动相B为乙腈溶液,流速0.4 ml/min,流动相采用梯度洗脱,洗脱条件为:0~2 min,15%~20% B;2~4 min,20%~25% B;4~5 min,25%~95 % B,5~6 min,15 % B,样品分析时间5 min,柱后平衡时间1 min。进样量为2 µl,自动进样器温度保持25 ℃。三重四级杆质谱条件为:电喷雾离子源(ESI)采用负离子,多级反应选择离子监测模式:毛细管电压3.5 kV;干燥器流速11 L/min;气体温度350 ℃;雾化器压力40 psig;碎片电压80 eV;Skimmer电压60 eV。
-
精密吸取Nr-CWS提取物溶液1 ml,加入2 mol/L的TFA 2.0 ml,放入110 ℃的真空干燥箱中,酸性条件下水解6 h,冷却至室温,4 ℃条件下离心干燥,挥发三氟乙酸,加重蒸水1 ml复溶,用于衍生化处理。
-
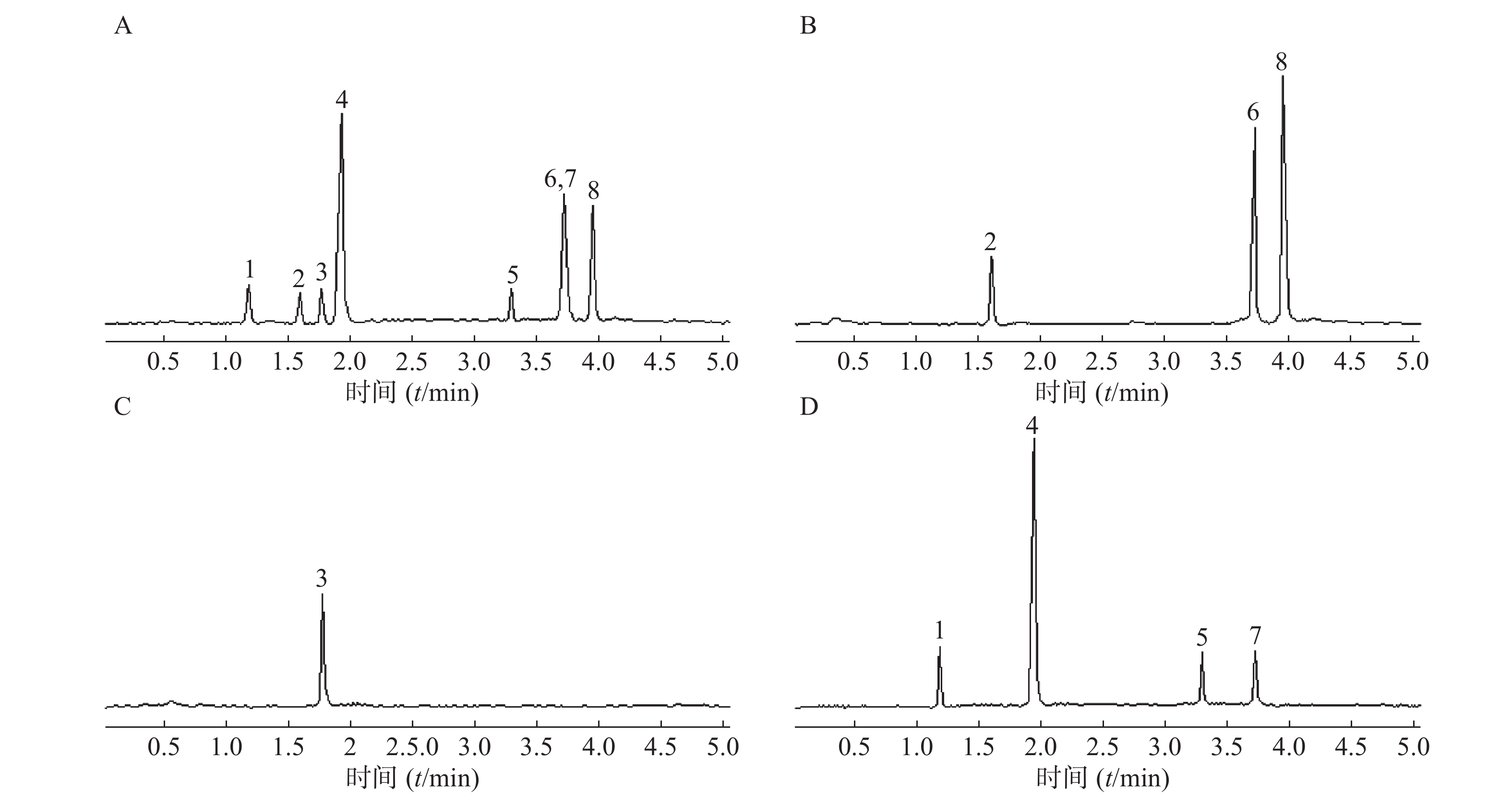
精密吸取Nr-CWS提取物的水解液100 μl,按照前述单糖衍生化方法进行前处理后,精密吸取前处理后的样品溶液2 μl进UHPLC-MS/MS分析,混合标准品和Nr-CWS样品衍生化后的UHPLC-MS/MS色谱图见图2。
-
精密吸取单糖混合标准品溶液,按前述单糖衍生化方法进行前处理后,精密吸取前处理后的样品溶液2 μl用UHPLC-MS/MS法分析,以各单糖峰面积与相应浓度进行线性回归分析,计算回归方程和相关系数,逐步稀释后,按照信噪比S/N=10和3,分别计算其定量限和检测限,结果见表3。
表 3 单糖衍生物的标准曲线及定量限和检测限
序号 化合物 回归方程 r 浓度范围(μg/ml) 定量限(ng/ml) 检测限(ng/ml) 1 D-甘露糖 Y = 383.2 X − 92.4 0.996 0.05~10 20 5 2 D-核糖 Y = 656.8 X − 109.5 0.994 0.10~20 50 20 3 L-鼠李糖 Y = 1025.3 X − 386.4 0.992 0.50~100 20 5 4 D-果糖 Y = 902.3 X − 133.1 0.994 0.10~20 100 50 5 D-葡萄糖 Y = 2875.3 X − 342.9 0.993 0.50~100 100 50 6 D-木糖 Y = 2391.1 X − 1004.6 0.995 0.05~10 50 20 7 D-半乳糖 Y =3482.4 X − 1093.5 0.998 1.00~200 100 50 8 D-阿拉伯糖 Y = 5436.8 X − 2102.3 0.992 5.00~1000 50 20 -
取经水解和衍生化反应后的单糖混合标准溶液,按照前述UHPLC-MS/MS分析测定条件,连续进样6次,计算其测定结果的RSD为3.13%,结果表明该方法的精密度良好,符合分析测定的要求。
-
Nr-CWS提取物溶液经水解和衍生化反应后,室温下放置,分别于0、5、l5、30、60、120 min进样,进行UHPLC-MS/MS分析,测定其浓度,对样品的稳定性进行评价,结果6次测定结果的RSD为7.63%,表明样品在2 h内稳定性良好,符合分析测定的要求。
-
取同一批样品,重复测定6次,计算其测定结果RSD为4.67%,表明该方法的重复性良好,符合分析测定的要求。
-
精密吸取已知含量的Nr-CWS提取物加入接近等量的单糖混合标准品溶液,经水解和衍生化反应后,进行UHPLC-MS/MS分析,计算其平均回收率为86.93%,RSD为9.15%,符合分析测定的要求。
-
精密吸取Nr-CWS提取物样品溶液6份,经水解衍生化后,按照前述UHPLC-MS/MS分析条件对衍生化后的样品进行分离分析,测定其中单糖的含量,结果见表4,可以看出8种单糖成分都能被检出,其中阿拉伯糖和半乳糖的含量最高。
表 4 Nr-CWS提取物(1~6)中8种单糖成分的含量测定结果
提取物编号 单糖成分(μg/ml) D-甘露糖 D-核糖 D-鼠李糖 D-果糖 D-葡萄糖 D-木糖 D-半乳糖 D-阿拉伯糖 1 0.9 5.3 12.2 18.9 55.1 20.9 320.8 456.1 2 2.1 4.6 21.4 12.4 48.3 19.2 205.6 504.8 3 3.2 3.5 30.5 9.8 61.9 23.1 223.0 327.3 4 5.5 6.6 19.8 15.4 45.8 27.8 305.4 462.8 5 1.5 4.9 23.4 14.7 39.1 12.1 311.7 489.1 6 4.7 7.6 25.1 22.5 52.7 27.2 289.2 510.8 平均值 3.0 5.4 22.1 15.6 50.5 21.7 276.0 458.5 -
Nr-CWS提取物中化学成分的分析鉴别,采用UHPLC-Q-TOF/MS分析方法对Nr-CWS提取物样品溶液进行快速地分离分析[15-16],获得正、负离子模式下的总离子流图,通过与Metlin数据库中代谢物信息快速地比对分析,共鉴别出Nr-CWS提取物中64个化学成分,其中包含氨基酸、脂肪酸、单糖、胞壁酸、粘肽等成分,说明Nr-CWS提取物中含有很多的细胞代谢产物,且以氨基酸、脂肪酸和糖类成分为主,这些成分就是Nr-CWS提取物发挥作用的主要成分。
由于Nr-CWS提取物中成分复杂,采用UHPLC-Q-TOF/MS方法直接对提取物进行分析,仅能检测到个别单糖成分,如木糖、半乳糖、葡萄糖等,说明Nr-CWS提取物中主要含有多糖成分,经水解衍生化后[17-20],采用UHPLC-MS/MS方法进行检测,8个单糖都能被检测到,且阿拉伯糖和半乳糖的含量最高,说明Nr-CWS中的多糖主要由阿拉伯糖和半乳糖组成,这将为进一步的多糖成分分析鉴别奠定基础。
对单糖进行分析测定的方法有很多,我们通过比较衍生化和不衍生化方法的检测限和定量限,发现单糖衍生化后,其定量限和检测限更低,测定干扰更少,分析方法学验证结果表明,其精密度、重现性、稳定性和回收率均符合分析测定的要求。
-
本研究采用UHPLC-Q-TOF/MS方法对Nr-CWS提取物中化学成分进行了快速地分离与分析,通过与Metlin代谢物成分数据库比对,共鉴别出Nr-CWS提取物中64个化学成分,主要包括氨基酸、糖类、脂肪酸等成分;对Nr-CWS提取物中糖类成分衍生化后,采用UHPLC-MS/MS分析方法对Nr-CWS提取物中8种单糖成分进行含量测定。结果表明,Nr-CWS中阿拉伯糖的含量最高,其次为半乳糖,说明Nr-CWS中发挥作用的主要多糖类成分可能主要由这几种单糖组成。通过本研究为后期开展Nr-CWS活性成分筛选及药理作用机制的研究奠定了基础。
Identification of chemical components and monosaccharide assay in Nocardia rubra cell wall skeleton
-
摘要:
目的 分析鉴别红色诺卡菌细胞壁骨架(Nr-CWS)中的化学成分,并对其中的单糖成分进行分析测定。 方法 首先,采用UHPLC-Q-TOF/MS方法对Nr-CWS提取物中的化学成分进行分离与分析,通过与Metlin数据库中代谢物成分信息比对,快速鉴别其中化学成分。然后,对Nr-CWS提取物中多糖水解后衍生化,采用UHPLC-MS/MS法对单糖衍生物进行定量分析,测定单糖的含量。 结果 共鉴别出Nr-CWS提取物中的64个化学成分,主要包括氨基酸、单糖、脂肪酸等成分。此外,建立了8种单糖柱前衍生化的UHPLC-MS/MS含量测定方法,含量测定结果表明,Nr-CWS中阿拉伯糖和半乳糖的含量最高,说明阿拉伯糖、半乳糖是组成Nr-CWS中多糖的主要组成成分。 结论 通过对Nr-CWS中的主要化学成分进行了分离与分析,对多糖水解后的单糖成分进行含量测定,为今后开展Nr-CWS活性成分的筛选及药理作用机制的研究奠定基础。 -
关键词:
- 红色诺卡菌细胞壁骨架 /
- 化学成分 /
- 鉴别 /
- 单糖 /
- 含量测定
Abstract:Objective To analyze and identify the chemical components in the Nocardia rubra cell wall skeleton (Nr-CWS), and to determine the contents of monosaccharides accurately. Methods The extract of Nr-CWS was separated and analyzed by UHPLC-Q-TOF/MS method. The chemical components were quickly identified by matching the data with the information in the Metlin database. The monosaccharide contents in the Nr-CWS extract were determined by UHPLC-MS/MS method after derivatization. Results A total of 64 chemical components were identified in the extract of Nr-CWS, including amino acids, monosaccharides and so on. A assay method for 8 monosaccharides by UHPLC-MS/MS was successfully established. The content of arabinose in Nr-CWS was the highest, followed by galactose, which indicated that the main polysaccharide components in Nr-CWS may be composed of these monosaccharides. Conclusion In this study, we analyzed the main chemical components of Nr-CWS, which are amino acids, fatty acids and so on. The content of monosaccharide after polysaccharide hydrolysis was determined by UHPLC-MS/MS. This will lay a foundation for the screening of the active components of Nr-CWS and the study of its pharmacological mechanism. -
Key words:
- Nocardia rubra cell wall skeleton /
- chemical component /
- identification /
- monosaccharide /
- determination
-
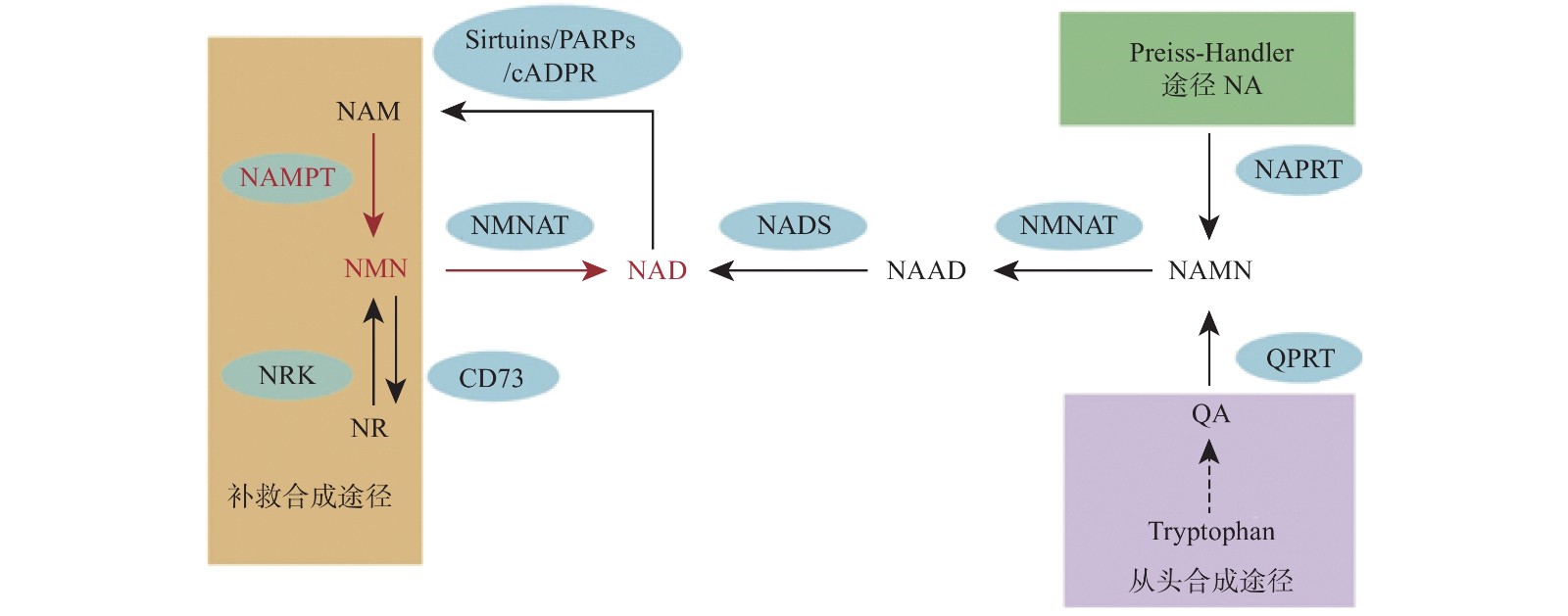
烟酰胺腺嘌呤二核苷酸(NAD)是真核细胞中的一种重要的代谢氧化还原辅酶,它在各种生物过程中起关键作用,包括新陈代谢、衰老、细胞死亡、DNA 修复和表达[1-2]。NAD主要有3种生物合成途径,在哺乳动物中,补救途径是NAD的主要来源并且该途径只有两个步骤(图1)。NAD 在该途径中的合成速率主要由烟酰胺磷酸核糖基转移酶(Nampt)决定,该步骤首先将烟酰胺(NAM)和5-磷酸核糖基-1-焦磷酸(PRPP)转化为烟酰胺单核苷酸(NMN)。然后,在第二步中将NMN与ATP偶联并转化为NAD[3]。直接使用NMN可以弥补NAD的不足,因此NMN可以参与多种疾病的调节,如2型糖尿病、肥胖症、心力衰竭、神经再生和炎症等[4-8]。
溃疡性结肠炎是炎症性肠病的一种。近年来,其病因和发病机制的研究受到广泛关注[9-11]。目前治疗溃疡性结肠炎的手段主要是对症治疗,如抗感染药、糖皮质激素和免疫抑制剂等,但这些药物长期使用会带来很多不良反应[12-13]。NAD与多种炎症性疾病有关,如败血症和类风湿性关节炎[14-15]。此外,有报道显示,炎症性肠病患者结肠组织和血清中Nampt浓度升高,并将Nampt作为小儿炎症性肠病严重程度的标志物[16-17]。因此,作为NAD合成的中间重要产物NMN,也有可能对炎症性肠病产生一定作用。与此同时,目前有很多含有NMN的保健品问世,但是由于NMN参与调节的功能非常复杂,并且有研究表明NMN可以促进肿瘤的增殖等作用[18],因此,补充NMN并不一定对人体都有益。并且,NMN作为保健品需要长期服用,但对于一些患有如炎症性肠病的慢性病患者,评价其对于患者的安全性极其重要。
本研究主要考察NMN对DSS诱导的溃疡性结肠炎小鼠模型的作用。以评价NMN作为保健品是否适用于患有溃疡性结肠炎的患者。
1. 材料与方法
1.1 DSS诱导肠炎模型的制备
雄性C57小鼠(8周龄,上海西普尔-必凯实验动物有限公司),放于实验室适应2周后进行造模。按照之前的方法进行模型制备[19],将DSS(美国MP公司,分子量为36 000~50 000)溶于水中,至终浓度为3%,让小鼠自由饮用。
1.2 分组及给药情况
将NMN[音芙医药科技(上海)有限公司]溶于生理盐水中,制备不同浓度的NMN溶液,将雄性C57小鼠分为6组,分别为生理盐水对照组,3、10、30、100、300 mg/kg NMN的不同剂量组。按照容积0.1 ml/10 g,通过灌胃(ig)和腹腔注射(ip)两种方式,从第1天开始给药,每天1次,直至实验观察结束。
1.3 疾病评分(DAI)
按照之前的评分标准进行评分[19],对体重下降程度、大便性状、血便情况分别进行评分,而后进行加和,计算总分数。具体评分标准见表1。
表 1 疾病评分评分 体重下降(%) 大便性状 血便情况 0 无 正常 无 1 1~5 — — 2 5~10 半稀便 潜血 3 10~15 — — 4 ≥15 稀便 肉眼血便 注:“—”表示无此项评分。 1.4 形态学检测及组织学染色
小鼠处死后,取整个结肠部位,测量长度进行比较。而后将结肠下段部位组织用4%多聚甲醛固定24 h,然后包埋在石蜡中。准备厚度为4 μm的切片,按照之前的实验方法,进行HE染色[19]。
1.5 统计分析
本实验指标均为定量数据,数据以(
$\bar x \pm s$ )表示。两两比较采用t-test法进行,采用GraphPad Prism 7统计软件进行统计分析。2. 结果
2.1 NMN对DSS诱导的溃疡性结肠炎模型小鼠生存时间的影响
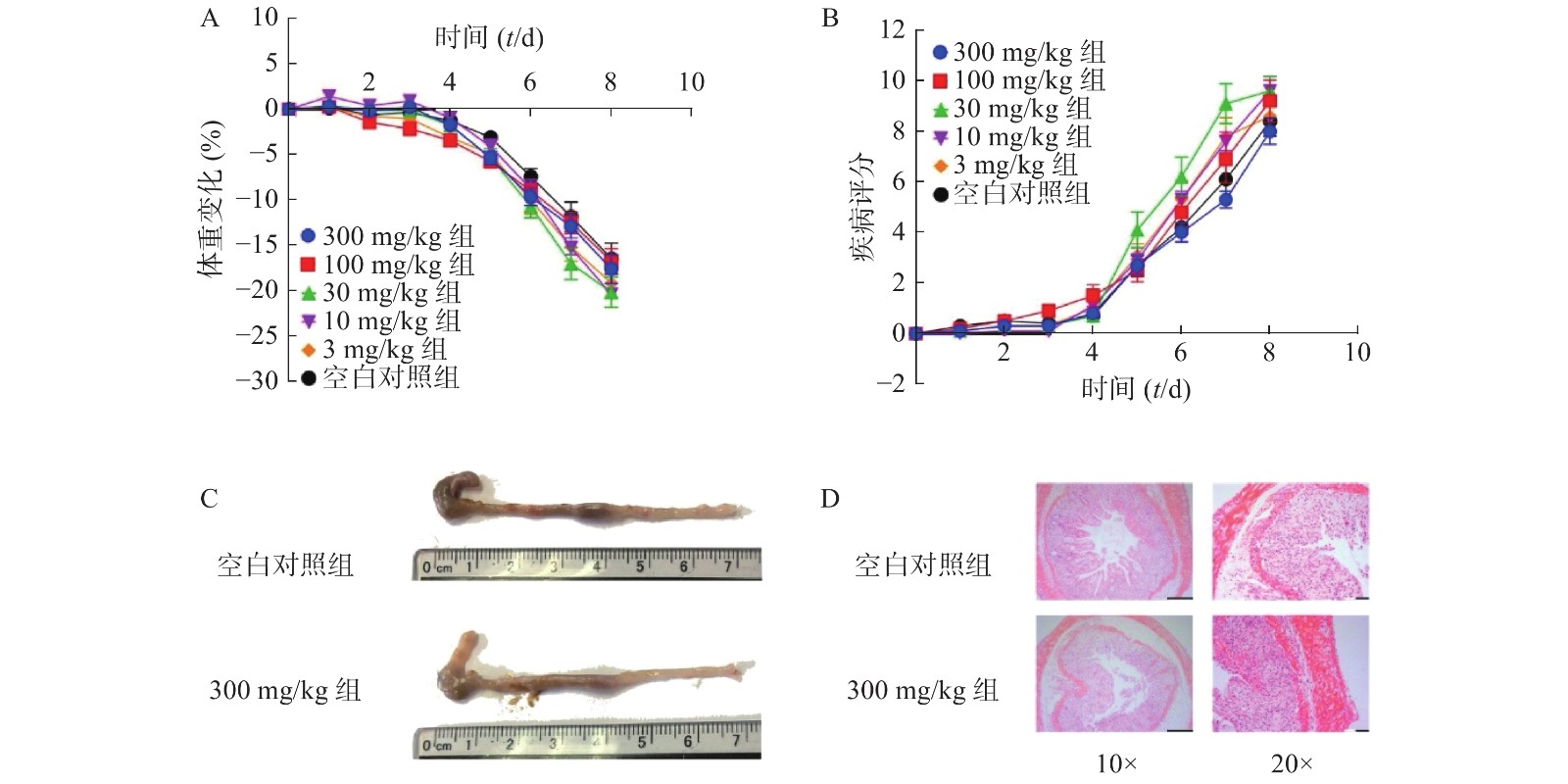
为了确定实验的最佳观察时间,首先对小鼠的生存曲线进行测定。将100和300 mg/kg的NMN通过灌胃的给药方式,检测3%DSS诱导的溃疡性结肠炎模型小鼠生存时间(图2),在给药第9天时,300 mg/kg组中有2只小鼠死亡,生理盐水对照组和100 mg/kg组在第10 天出现小鼠死亡。第17天时,300 mg/kg组小鼠全部死亡,而在第20天时,生理盐水对照组和100 mg/kg组全部死亡。3组生存曲线之间并无统计学差异。由于在给药第9天时,有小鼠出现死亡,因此我们将后面实验的观察时间设定为8 d。
2.2 NMN不同给药方式对DSS诱导的溃疡性结肠炎模型小鼠体重和DAI的影响
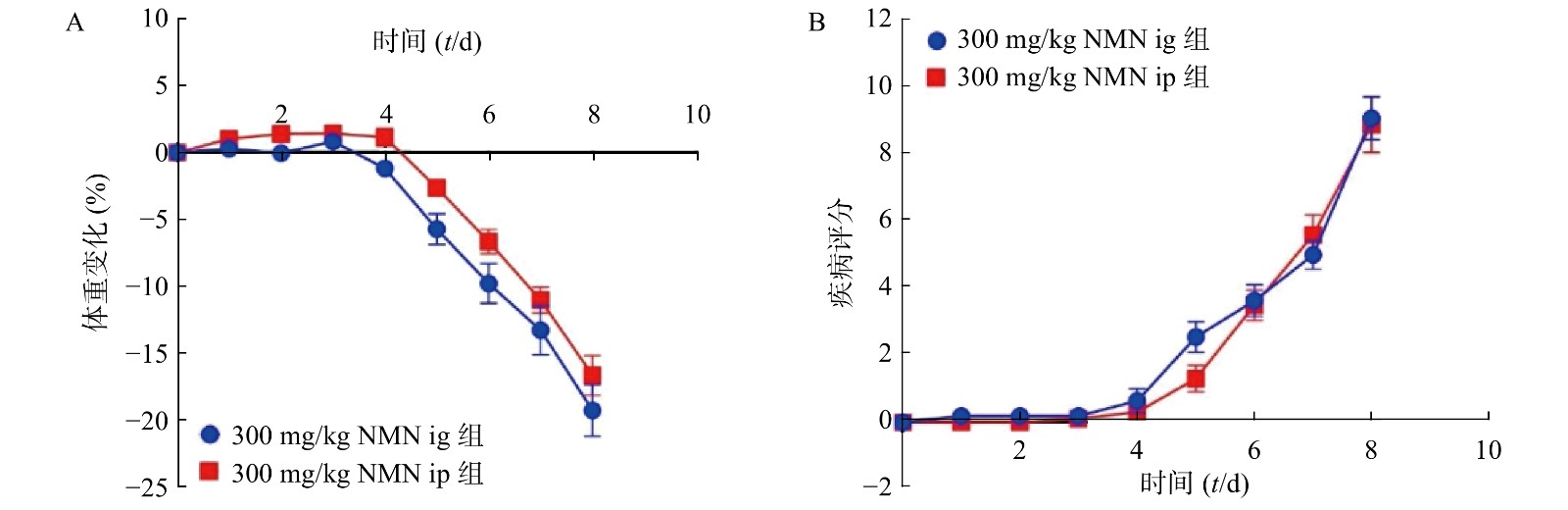
为了考察不同给药方式对小鼠的影响,我们分别通过灌胃和腹腔注射两种给药方式,观察NMN对于小鼠体重和DAI的影响,如图3所示,灌胃和腹腔注射两种给药方式对溃疡性结肠炎模型小鼠体重和DAI分数的影响无显著性差异,二者都在第5天时表现出体重下降并出现稀便情况。因此,为了更真实的模拟人用药环境,我们在后续实验中均采用灌胃的给药方式。
2.3 NMN对DSS诱导的溃疡性结肠炎模型小鼠结肠长度与形态的影响
为了进一步考察不同浓度NMN对DSS诱导的溃疡性结肠炎模型小鼠的影响,我们应用了不同浓度的NMN通过灌胃给药的方式,分别对小鼠的体重和DAI进行了检测。结果显示(图4A、4B),不同浓度的NMN对小鼠的体重和DAI的影响,与对照组相比均无显著性差异。为了更进一步确认,我们又对结肠长度和结肠形态进行了检测,结果显示(图4C、4D),300 mg/kg的NMN与对照组相比,肠道长度和免疫组化切片结果并无显著性差异。
3. 讨论
本研究测定了不同剂量的NMN对DSS诱导的溃疡性结肠炎小鼠的体重、DAI评分、结肠长度和肠道形态的影响,即NMN对DSS诱导的溃疡性结肠炎小鼠并无显著作用。
NMN作为NAD的前体,其功能目前认为是通过NAD来体现的,NNM和NAD的代谢是紧密联系的。NAD在人体内有3条生化途径:Preiss-Handler途径、从头合成途径和补救合成途径(图1)[20]。Preiss-Handler途径从NA开始,经过NAPRT催化变成NAMN,经过NMNAT的催化,变成NAAD,然后再被NAD合成酶NADS催化成NAD[21]。从头合成途径首先是从食物中摄取的色氨酸开始,经过一系列体内生化反应生成喹啉酸(QA),而后经过(QPRT催化生成NAMN进入Preiss-Handler途径[22]。补救合成途径从NAM开始,然后经过NAMPT催化后,变成NMN,NMN同样通过NMNAT酶的催化转变成NAD,而后NAD在经过3个消耗途径NAD依赖的去乙酰化酶(Sirtuins)、多聚ADP核糖聚合酶(PARPs)、环腺苷二磷酸核糖(cADPR)合酶后变成烟酰胺完成循环[2]。NAD的含量在这3条途径下保持平衡,补救合成途径是人体NAD的主要来源,该过程中的NAMPT是这个循环的限制步骤[23]。
NMN作为NAD合成的重要中间产物,存在于多种类型的细胞中,并参与了不同的生物学过程。NMN可防止由NAD分解代谢酶而引起的NAD耗竭。目前报道的NMN大部分作用对人体都是有益的,但是随着研究的深入,NAD的增加也能够加重某些疾病的发展,如炎症和肿瘤[18, 24-25]。近期有研究表明,在克罗恩结肠炎和溃疡性结肠炎患者的结肠组织中,血浆Nampt和mRNA水平均显著升高[16]。更有研究表明,Nampt的特异性抑制剂FK866,改善了DSS诱导的溃疡性结肠炎模型小鼠症状,并抑制了小鼠中与炎症相关的肿瘤发生。由于Nampt是NMN的重要合成生物酶,因此,我们怀疑NMN可能也会加重DSS诱导的溃疡性结肠炎模型小鼠症状。基于此,我们首先检测了不同剂量的NMN对模型小鼠的生存曲线的影响,发现与对照组相比,NMN并不会显著改变模型小鼠的生存时间。而后我们发现不同给药方式也不能显著改变小鼠溃疡性结肠炎的状态。最后我们又检测不同浓度的NMN对于肠炎小鼠的影响,发现300 mg/kg 剂量以下的NMN,对于模型小鼠的体重、DAI评分、结肠组织均不能引起显著性改变。因此,NMN对DSS诱导的溃疡性结肠炎小鼠并无影响。
综上,NMN具有广泛的人体生物调节作用,目前市面上出现了很多含有NMN的保健品。虽然我们的研究结果表明NMN对DSS诱导的溃疡性结肠炎模型小鼠无明显毒副作用,但是对于NMN的副作用仍需继续考察,特别是对于长期使用NMN的人群来说,充分考察其安全性尤为重要。
-
表 1 Nr-CWS中化学分析的UHPLC-Q-TOF/MS数据信息
序号 化合物名称 [M+X] 分子式 m/z 保留时间(t/min) 1 2-(S-glutathionyl)acetyl glutathione M-H C22H34N6O13S2 654.162 5 0.91 2 2-(S-glutathionyl)acetyl glutathione M+H C22H34N6O13S2 654.668 0 0.91 3 estradiol-17alpha 3-D-glucuronoside M-H C24H32O8 448.209 7 1.12 4 tyrosine M+H C9H11NO3 181.190 0 1.13 5 cer(d18∶0/23∶0) M+H C41H83NO3 637.637 3 1.30 6 palmitic acid M-H C16H32O2 256.424 1 1.31 7 stearic acid M-H C18H36O2 284.271 5 1.31 8 L-threonine M+H C4H9NO3 119.120 0 1.33 9 D-xylose M-H C5H10O5 150.130 0 1.34 10 N-acetyl-D-glucosamine M-H C8H15NO6 221.210 0 1.39 11 meso-2,6-diaminopimelic acid M+H C7H14N2O4 190.197 1 1.39 12 leinoleic acid M+H C18H32O2 280.445 5 1.41 13 choline M+H C5H15NO 104.170 8 1.56 14 L-rhamnose monohydrate M-H C6H12O5 164.160 0 1.64 15 docosapentaenoic acid M-H C22H34O2 330.255 9 1.67 16 proline M-H C5H9NO2 115.130 0 1.93 17 fructose 1,6-bisphosphate M+H C6H14O12P2 339.996 0 2.22 18 glucose 6-phosphate M+H C6H13O9P 260.135 8 2.28 19 fucose M-H C6H12O5 164.150 0 2.34 20 L-proline M-H C5H9NO2 115.063 3 2.34 21 PG(18∶0/20∶3(8Z,11Z,14Z)) M-H C44H81O10P 800.556 7 5.96 22 tetracosanoic acid M-H C24H48O2 368.636 7 7.07 23 orotidylic acid M-H C10H13N2O11P 368.190 8 7.65 24 sphinganine M+H C18H39NO2 301.507 8 7.72 25 valine M-H C5H11NO2 117.150 0 7.74 26 cervonoyl ethanolamide M-H C24H36O3 372.540 8 7.94 27 phytosphingosine M+H C18H39NO3 317.507 2 7.94 28 tryptophan M+H C11H12N2O2 204.230 0 7.97 29 trihexosylceramide (d18∶1/12∶0) M-H C48H89NO18 967.608 0 8.10 30 histidine M+H C6H9N3O2 155.160 0 8.45 31 L-asparagine M-H C4H8N2O3 132.120 0 9.65 32 galactinol dihydrate M-H C12H26O13 378.327 0 9.66 33 3-hydroxydodecanoyl carnitine M+H C19H37NO5 359.500 8 9.70 34 L-cysteine M+H C3H7NO2S 121.120 0 9.84 35 cysteinyl-threonine M-H C7H14N2O4S 222.067 4 9.98 36 D-mannose M-H C6H12O6 180.160 0 10.10 37 MG (0∶0/24∶1(15Z)/0∶0) M-H C27H52O4 440.386 6 10.11 38 4-(methylnitrosamino)-1-(3-pyridyl)-1-butanol glucuronide M-H C16H23N3O8 385.369 1 11.32 39 D-glucose M-H C6H12O6 180.160 0 11.34 40 desmosine M+H C24H40N5O8 526.603 1 11.38 41 L-methionine M+H C5H11O2NS 149.210 0 11.59 42 glycogen M-H C24H42O21 666.577 7 11.90 43 levan M-H C18H32O16 504.437 1 11.90 44 D-galactose M-H C6H12O6 180.160 0 11.92 45 L-beta-aspartyl-L-aspartic acid M+H C8H12N2O7 248.190 1 12.00 46 muramic acid M-H C9H17NO7 251.233 8 12.16 47 1-pyrroline-2-carboxylic acid M-H C5H7NO2 113.114 6 12.25 48 ADP-glucose M-H C16H25N5O15P2 589.341 7 12.25 49 DG(42∶10) M+H C45H68O5 688.506 7 12.27 50 isoleucine M-H C6H13NO2 131.170 0 12.55 51 leucine M-H C6H13NO2 131.170 0 12.79 52 PGP(16∶1(9Z)/18∶0) M-H C40H78O13P2 828.491 8 12.99 53 PGP(16∶0/20∶4) M+H C42H76O13P2 850.992 6 13.01 54 TG(62∶6) M-H C65H114O6 990.861 5 13.60 55 ganglioside GM3 (d18∶1/16∶0) M-H C57H104N2O21 1152.713 2 14.15 56 valyl-methionine M+H C10H20N2O3S 248.342 0 14.18 57 DG(18∶2n6/0∶0/22∶6n3) M-H C44H70O5 678.522 3 15.27 58 PS(16∶0/18∶2) M-H C40H74NO10P 759.990 0 15.90 59 PGP(18∶1/22∶6) M-H C46H78O13P2 900.491 8 16.62 60 CDP-DG(16∶0/18∶0) M-H C46H85N3O15P2 981.545 6 17.41 61 TG(22∶6(4Z,7Z,10Z,13Z,16Z,19Z)/24∶0/22∶6(4Z,7Z,10Z,13Z,16Z,19Z)) M-H C71H114O6 1 062.861 5 18.28 62 TG(24∶0/24∶0/24∶0) M-H C75H146O6 1 143.111 9 19.25 63 serine M-H C3H7NO3 105.090 0 27.23 64 alanine M-H C3H7NO2 89.090 0 27.28 表 2 UHPLC-MS/MS分析测定的质谱条件
序号 化合物名称 保留时间(t/min) 分子式 单糖分子量 衍生物分子量 母离子 子离子 碰撞电压(eV) 1 D-甘露糖 2.012 C6H12O6 180.1 512.1 511.1 175.0, 217.1 34 2 D-核糖 2.216 C5H10O5 150.1 482.1 481.1 175.0, 217.1 31 3 L-鼠李糖 2.423 C6H14O6 164.1 496.1 495.1 175.0, 217.1 31 4 D-果糖 2.504 C6H12O6 180.1 512.1 511.1 175.0, 217.1 34 5 D-葡萄糖 3.725 C6H12O6 180.1 512.1 511.1 175.0, 217.1 34 6 D-木糖 3.917 C5H10O5 150.1 482.1 481.1 175.0, 217.1 31 7 D-半乳糖 3.918 C6H12O6 180.1 512.1 511.1 175.0, 217.1 34 8 D-阿拉伯糖 4.086 C5H10O5 150.1 482.1 481.1 175.0, 217.1 31 表 3 单糖衍生物的标准曲线及定量限和检测限
序号 化合物 回归方程 r 浓度范围(μg/ml) 定量限(ng/ml) 检测限(ng/ml) 1 D-甘露糖 Y = 383.2 X − 92.4 0.996 0.05~10 20 5 2 D-核糖 Y = 656.8 X − 109.5 0.994 0.10~20 50 20 3 L-鼠李糖 Y = 1025.3 X − 386.4 0.992 0.50~100 20 5 4 D-果糖 Y = 902.3 X − 133.1 0.994 0.10~20 100 50 5 D-葡萄糖 Y = 2875.3 X − 342.9 0.993 0.50~100 100 50 6 D-木糖 Y = 2391.1 X − 1004.6 0.995 0.05~10 50 20 7 D-半乳糖 Y =3482.4 X − 1093.5 0.998 1.00~200 100 50 8 D-阿拉伯糖 Y = 5436.8 X − 2102.3 0.992 5.00~1000 50 20 表 4 Nr-CWS提取物(1~6)中8种单糖成分的含量测定结果
提取物编号 单糖成分(μg/ml) D-甘露糖 D-核糖 D-鼠李糖 D-果糖 D-葡萄糖 D-木糖 D-半乳糖 D-阿拉伯糖 1 0.9 5.3 12.2 18.9 55.1 20.9 320.8 456.1 2 2.1 4.6 21.4 12.4 48.3 19.2 205.6 504.8 3 3.2 3.5 30.5 9.8 61.9 23.1 223.0 327.3 4 5.5 6.6 19.8 15.4 45.8 27.8 305.4 462.8 5 1.5 4.9 23.4 14.7 39.1 12.1 311.7 489.1 6 4.7 7.6 25.1 22.5 52.7 27.2 289.2 510.8 平均值 3.0 5.4 22.1 15.6 50.5 21.7 276.0 458.5 -
[1] 林清强, 石颖岚, 李琼, 等. 红色诺卡氏菌细胞壁骨架多糖成分的分离纯化[J]. 赤峰学院学报(自然科学版), 2015, 31(16):17-19. [2] 黄文伟, 谢必峰. 基于响应面法对红色诺卡氏菌发酵条件的优化及其发酵动力学研究[J]. 药物生物技术, 2015, 22(1):49-52. [3] 张祝兰, 林善, 唐文力, 等. 红色诺卡氏菌细胞壁骨架的理化性质、化学成分及含量测定的研究[J]. 中国抗生素杂志, 2002, 27(9):532-534. doi: 10.3969/j.issn.1001-8689.2002.09.006 [4] AZUMA I, TANIYAMA T, YAMAWAKI M, et al. Adjuvant and antitumor activities of <italic>Nocardia</italic> cell-wall skeletons[J]. Gan,1976,67(5):733-736. [5] 张元芬. 红色诺卡氏菌细胞壁骨架(N-cws)通过产生LAK细胞辅助因子对人LAK细胞的增强作用[J]. 福建医药杂志, 1991, 13(5):10. [6] 梁宇庭, 周骏辉, 南铁贵, 等. 柱前衍生化UPLC-MS/MS测定12种单糖含量的方法学研究及其应用[J]. 中国中药杂志, 2018, 43(22):4469-4473. [7] 胡蓉蓉, 姚鑫. UPLC-MS/MS测定银杏叶提取物中10个黄酮类成分的含量[J]. 中国实验方剂学杂志, 2017, 23(24):90-95. [8] 王笑笑, 周勇, 徐国群, 等. 黄酮类成分在蜂蜜抗菌性中的效能研究[J]. 中国现代应用药学, 2017, 34(3):363-369. [9] 周彦强, 吴光斌, 陈发河. PMP柱前衍生化HPLC法测定黄秋葵多糖的单糖组成[J]. 食品科学, 2019, 40(4):266-271. doi: 10.7506/spkx1002-6630-20180130-426 [10] XUE S J, WANG L L, CHEN S Q, et al. Simultaneous analysis of saccharides between fresh and processed <italic>Radix</italic> rehmanniae by HPLC and UHPLC-LTQ-orbitrap-MS with multivariate statistical analysis[J]. Molecules,2018,23(3):E541. doi: 10.3390/molecules23030541 [11] JIANG W X, DI S X, HUA H M, et al. Structural characterization of polysaccharide from <italic>Cyclocarya paliurus</italic> leaves and itsα-glucosidase inhibitory effect[J]. Chin Tradition Herb Drugs,2017,48(8):1524-1528. [12] 张璐瑶, 赵峡, 陈欢欢. 糖类化合物PMP衍生分析进展[J]. 分析测试学报, 2016, 35(3):367-372. doi: 10.3969/j.issn.1004-4957.2016.03.020 [13] LI H L, LONG C N, ZHOU J, et al. Rapid analysis of mono-saccharides and oligo-saccharides in hydrolysates of lignocellulosic biomass by HPLC[J]. Biotechnol Lett,2013,35(9):1405-1409. doi: 10.1007/s10529-013-1224-4 [14] GAO Y Y, JIANG Y, CHEN G C, et al. A sensitive and rapid UPLC-MS/MS method for determination of monosaccharides and anti-allergic effect of the polysaccharides extracted from <italic>Saposhnikoviae radix</italic>[J]. Molecules,2018,23(8):E1924. doi: 10.3390/molecules23081924 [15] 赵丹, 冯峰, 粟有志, 等. 超高效液相色谱-串联质谱法测定螺旋藻多糖的单糖组成[J]. 色谱, 2017, 35(4):413-420. [16] FAN B L, LI T T, SONG X F, et al. A rapid, accurate and sensitive method for determination of monosaccharides in different varieties of <italic>Osmanthus fragrans</italic> Lour by pre-column derivatization with HPLC-MS/MS[J]. Int J Biol Macromol,2019,125:221-231. doi: 10.1016/j.ijbiomac.2018.12.033 [17] 王媛媛, 张晖, 杨俊松, 等. 柱前衍生化高效液相色谱法分析9种多糖中的单糖组成[J]. 济宁医学院学报, 2016, 39(4):241-244. doi: 10.3969/j.issn.1000-9760.2016.04.004 [18] WU X D, JIANG W, LU J J, et al. Analysis of the monosaccharide composition of water-soluble polysaccharides from <italic>Sargassum fusiforme</italic> by high performance liquid chromatography/electrospray ionisation mass spectrometry[J]. Food Chem,2014,145:976-983. doi: 10.1016/j.foodchem.2013.09.019 [19] 李婷婷, 王雪吟, 胡丹荔, 等. 柱前衍生法测定桂花多糖中的6种单糖的含量[J]. 食品工业, 2019, 40(4):323-327. [20] 符梦凡, 赵一帆, 阎卫东. 柱前衍生化HPLC法分析枸杞多糖中单糖组成[J]. 食品科学, 2018, 39(18):186-191. doi: 10.7506/spkx1002-6630-201818029 期刊类型引用(7)
1. 王秀芹,林彤,毕福钧,严家浪,刘主洁. 薄层生物自显影技术评价生脉饮抗氧化活性. 中成药. 2024(08): 2805-2809 .  百度学术
百度学术2. 毕建璐,马柯,罗仁. 罗仁教授从肝肾论治失眠验案举隅. 中国民族民间医药. 2023(03): 61-64 .  百度学术
百度学术3. 赵晓晓,孙春全,刘福梅,谢雁鸣,王连心,陈澍. 基于倾向性评分的真实世界生脉注射液治疗心肌梗死有效性研究. 中国中医基础医学杂志. 2023(06): 960-965 .  百度学术
百度学术4. 钱紫萱,孙雪杨,张辰明,刘龙婵,李林楠,张皓月,杨莉,王峥涛. 生脉方化学成分及分析方法研究进展. 世界科学技术-中医药现代化. 2023(08): 2699-2708 .  百度学术
百度学术5. 林涌泉,李薛莹,陈明凤. 生脉注射液辅助治疗对低灌注/栓子清除能力下降型脑梗死患者脑血流动力学的影响. 基层医学论坛. 2021(16): 2240-2243 .  百度学术
百度学术6. 李然,朱晓宁. 丹参联合生脉注射液通过IL-23/IL-17轴调节脓毒症患者Treg/Th17失衡作用机制研究. 中国中医药现代远程教育. 2021(12): 72-74 .  百度学术
百度学术7. 易艳,李春英,赵雍,田静卓,王连嵋,潘辰,梁爱华. 清开灵注射液和生脉注射液联合应用对内毒素血症大鼠脏器损伤协同保护作用研究. 中国中药杂志. 2021(16): 4193-4200 .  百度学术
百度学术其他类型引用(2)
-





 下载:
下载:


 下载:
下载: