-
高血压是我国最常见的心血管系统慢性疾病之一,是冠心病、心力衰竭、终末期肾病等临床疾患的重要诱因。其中,自发性高血压占所有高血压类型的90%以上[1],目前针对自发性高血压的治疗方案仍是对症降压治疗,而因长期服药产生的副作用依然无法避免。据此,积极地寻找安全、可靠、不良反应少的降血压药物是目前研究高血压病的重点。随着中医药的不断发展,利用中草药降压也逐渐得到大众的认可,同时在中药治疗低副作用的特点下,广大患者对使用以植物药为基础的治疗方案兴趣增强[2, 3]。
中药鬼针草(Bidens pilosa L.)是一种菊科植物,属于鬼针草属,广泛分布于全国。,又名鬼钗草、鬼菊花、婆婆草等。《本草拾遗》中记载,鬼针草味苦、性平、无毒,有清热解毒、散瘀消肿的功效。目前,国内对鬼针草的应用多集中于抗菌、抗溃疡、止血以及治疗烧伤等方面[4, 5],随着其在临床上不断扩大的应用范围,越来越多研究证明鬼针草在治疗原发性高血压方面具有较好的疗效[6]。
-
通过查阅鬼针草的相关文献可知[7],鬼针草作为常见中药材,主要分为羽叶鬼针草(Bidens maximowicziana Oett.)、柳叶鬼针草(Bidens cernua L.)和白花鬼针草(Bidens alba(L.)DC.)3种。羽叶鬼针草分布在中国黑龙江、吉林、辽宁和内蒙古,柳叶鬼针草和白花鬼针草现广泛分布于中国华东、华中、华南及西南各地。虽鬼针草种类不同,但功能相似,都具有清热、解毒、散瘀、消肿等功效。其中,《常用中草药手册》[8]中记载鬼针草具有活血散瘀,清热解毒的作用。《临床中药辞典》[9]中认为鬼针草还具有活血止痛、祛风除湿的作用。此外,《中华药海下》、《土单验方中草药汇编》等均记载鬼针草具有清热、解毒、活血利尿的功效[10, 11]。
中医是一种集辨证论治为一体的治疗观念,致力于改善患者临床表现,现已逐步应用于慢性疾病的治疗。有研究表明,当利尿药用于中医药治疗高血压时,明显促进了高血压患者血压水平的降低。据此,认为鬼针草清热燥湿、利尿消肿等作用可能与鬼针草在临床研究中调节高血压的作用有关。
-
近年来,鬼针草被发现对血压具有良好的双向调节作用[3, 12],高血压患者服用此药后,可使血压降低。而血压偏低者用药后,可使血压升至正常水平。且有文献指出,鬼针草作为传统的药食同源的植物,无明显毒性作用[13]。
临床上,将鬼针草用于降压治疗时,发现其降血压效果安全可靠,还可以避免某些降压药降压同时带来的副作用[14]。有文献显示[15],在给家兔注射鬼针草提取液后,收缩压和舒张压均有所下降,脉压略增大,平均动脉压下降,心率不变,进一步说明鬼针草的降压作用,且对心率无影响。郑梅生等[16]通过构建原发性高血压大鼠模型,给予大鼠服用鬼针草提取液,发现当给药90 min后,对高血压大鼠的降压作用最为明显。且实验还通过鬼针草急性毒性实验检测鬼针草对大鼠的毒性,结果表明鬼针草使用较安全,无毒性作用。有临床报道[17],用银海双钩鬼针草汤治疗240例高血压病患者,疗效令人满意,实验组治疗总有效率为95.0%。李庆东等[18]通过对324例高血压患者的临床观察,发现悦年片(100%鬼针草提取物压片)不但对患者有降压作用,而且有降低血脂、改善血液流变性、调节微循环作用。周志彬、沙静姝等[19, 20]通过临床实验对悦年片进行观察,实验显示悦年片抗原发性高血压总有效率为89.9%,对降低血清胆固醇、甘油三酯以及高血压并发症等的治疗亦取得较好的结果。
不仅鬼针草单味药对降压有一定疗效,而且一些研究也根据鬼针草的作用特点,对鬼针草降压相关的中药复方进行研究。孙阳等[21]采用双盲安慰剂对照的临床试验方法,通过对比分析治疗组(鬼针草复方颗粒剂)和对照组(鬼针草复方颗粒模拟剂)的临床疗效及相关生物指标,验证了复方鬼针草颗粒剂作用于高血压的降压效果,且在治疗组中未发现鬼针草对人体有明显的毒副作用。以鬼针草为君药的降压益肾颗粒衍生于补肾阴名方六味地黄汤,该中药复方具有显著的降压、降脂等作用且能够有效的保护肾脏[22]。又有中医利用五草降压汤(鬼针草 30 g,夏枯草30 g, 益母草 15 g,五叶草 30 g,车前草 20 g)治疗高血压,亦取得较好的降压效果[23]。
-
为进一步对鬼针草起治疗作用成分进行分析,通过查阅文献,发现鬼针草中的化学成分主要为黄酮类、酚类、挥发性成分以及氨基酸等。采用化学成分数据库构建-液质数据采集-数据库检索-质谱数据验证的方法鉴定鬼针草中所含的主要化学成分。结果共鉴定出了鬼针草中的28种化学成分,其中主要包含黄酮类和有机酸类[24]。鬼针草中黄酮类化合物含量较为丰富,仅其叶中的含量就高达5%,其主要包含查尔酮类、黄酮醇类、噢瞬类等[25]。其中研究较多的黄酮类化合物主要包括槲皮素3,3'-二甲醚7-0-β-D-葡萄糖苷和奥卡宁 7-O-β-D-(2",4",6"-三乙酰)-葡萄糖苷等。另外,研究人员采用多种色谱方法对鬼针草化合物进行分离,并通过波谱学方法对化合物的结构进行鉴定,分离鉴定出6种酚酸类化合物,分别为咖啡酸、奎尼酸、原儿茶酸、2,3,4-三羟基异戊酸-2,3,5-二[1-O-(5-咖啡酰)喹宁酸基]-4-咖啡酰喹宁酸、对羟基桂皮酸[26]。
鬼针草中还含有挥发油类成分,在其各部位中,以茎中所含的挥发油含量最高,达97.81%[27]。含量较高的挥发油类化合物为石竹烯(15.68%~ 16.62%)、(Z)-1,11-十三二烯-3,5,7,9-四炔(19.41%~37.16%)等[7]。鬼针草叶的挥发油的主要组分为α-蒎烯(14.7%)、ε-石竹烯(13.5)和α-辛烯,其具有较好的抗氧化活性[28]。鬼针草中还含有生物碱、鞣质、皂苷等多种化学成分,具有多方面的药理作用,尤其对心血管系统、消化系统显示良好的药理活性[29]。但目前关于鬼针草相关成分的研究仍相对较为欠缺。因而加强对鬼针草药用成分的进一步探究,对开发鬼针草的药用价值具有重要意义。
-
目前,已有多项研究证明了鬼针草的抗压作用,但鬼针草的抗高血压的药理学机制尚未明确。众所周知,黄酮类化合物有广谱的药理活性[30]。有研究表明[31],黄酮类物质在心血管系统等方面具有明显的药理作用,其对血压的影响主要集中于以下几个方面。①阻断肾素-血管紧张素-醛固酮(RAAS)系统。②抑制交感神经活动。③对血管内皮素(ET)的抑制作用。④促进一氧化氮(NO)的生成。⑤激活钾通道的开放以及阻滞钙离子通道。圈号6改善心血管重构。
Larson AJ等[32]评估了鬼针草的乙酸乙烯酯提取物对非特异性NO抑制剂诱导的高血压大鼠的保护作用,证实鬼针草的抗高血压作用可能是由于槲皮素3,3'-二甲醚7-0-β-D-葡萄糖苷的作用。阮氏香江等[33]进一步证实了鬼针草水提物对一氧化氮合酶抑制剂诱导的高血压大鼠具有显著的降压作用,其作用可能与促进NO的产生,减少内源性缩血管活性物质血浆中内皮素Ⅰ及肾素血管紧张素Ⅱ的释放有关,对高血压大鼠心率无显著影响。
有研究者[14, 15]通过给健康家兔注射新鲜鬼针草提取液,观察到家兔血压下降,当给予去甲肾上腺素进行干预后,家兔血压上升,进而证明鬼针草的降压作用与阻断肾上腺素受体无关,而是直接扩张血管平滑肌而降压。Chen等[34]体外评估了鬼针草的活性物质并发现其通过抑制肾素及血管紧张素转化酶的活性从而降低血压。此外,鬼针草提取物还能够降低大鼠血浆中甘油三酯和低密度脂蛋白胆固醇,能够有效阻止动脉粥样硬化指数的升高[35]。目前的研究结果还证实[36-38],鬼针草能够在肝脏和儿童体内调节脂质的分布,对抗氧化应激和细胞损伤,并改善高血压动物模型的内皮功能,这些结果也可能是由于黄酮类成分的作用。
还有部分研究者提出鬼针草及其有效成分可以通过上调上皮表型,减少细胞外基质成分的表达,进而达到降血压的目的[39]。此外,相关研究人员发现鬼针草对高血压所引发肾损伤也有很好的治疗作用。其作用机理可能通过防止细胞外基质成分在肾间质的过度堆积,维持细胞外基质合成/降解平衡,遏制高血压肾损害、肾上皮-间充质转化过程,从而达到逆转肾纤维化的目的,为高血压肾损害的靶向治疗提供思路[40]。
-
中药具有多成分多靶点的特性,但也因此使得中药开发和研究的难度大大增加。当中药进入人体后,可通过多种途径对机体功能进行调控,这对治疗多种慢性疾病具有较好的效果。中药鬼针草作为中国的国药,对生长环境的要求较低,药品来源较为广泛,全草均可入药,毒副作用少、价格便宜,易于采集和贮存,所含的化学成分新颖,因而使用鬼针草治疗高血压病可大大降低成本,能够减轻广大基层高血压患者的经济负担,使患者能够坚持连续用药,具有巨大的潜在开发价值。但目前鬼针草尚未得到广泛利用。虽然近几年关于鬼针草降压的临床应用的相关报道逐渐增多。然而对其作用成分、作用机制、制剂等的研究还比较浅显,很多应用也只是作为经验方流传于民间。因此,加强对鬼针草等天然中草药的研究开发迫在眉睫。因此,加强对鬼针草的现代化研究,深入探究其药效学物质基础,阐明其作用机制,是开发鬼针草的基础工作。同时,规范鬼针草的临床应用,加强对鬼针草剂型的研究,借鉴西药的给药理论与技术,开发出适合患者使用的安全、有效的剂型和给药方式也是鬼针草研究的一个重要领域。
除此之外,复方是中药的主要形式,但也存在复方制剂成分复杂,对其探索的深度和广度都不够等问题。目前,关于鬼针草作为中药的降压复方虽有研究,但亦存在对其起作用的主要活性成分的研究还不明确等问题,因此,加强对鬼针草化学成分的研究,将其活性成分进行分类归纳,寻找不同活性成分在不同状态下的作用规律,并进一步探究不同活性物质之间在不同状态下的相互协同、拮抗、叠加等的作用,从而使鬼针草从理论基础到临床治疗的研究都得到现代化的发展。在未来的研究过程中,应加大对鬼针草药用成分的分离与纯化,对有效成分进行鉴定以及定量分析的研究,深入探讨鬼针草降压的作用机理,以期为开发新的有效的降压中药提供新的思路。
Progress and prospect of the antihypertensive effect from Bidens pilosa L. and its
-
摘要: 高血压是一种全身性慢性血管疾病,从中医辩证来看,高血压属于肝火、眩晕、肝阳、头痛等的范畴。而中医药治疗高血压也逐渐成为当今的研究热点,利用中草药进行降压也取得较好的效果。近年来,关于中药鬼针草降压的研究也逐渐增多。本文主要通过对鬼针草的相关研究进行总结,围绕鬼针草的古文献记载、近现代研究、作用成分以及作用机理这几方面展开综述,并对鬼针草的降压应用进行展望,以期为鬼针草的进一步开发应用以及高血压的治疗提供参考。Abstract: Hypertension is a systemic chronic vascular disease. From the perspective of Traditional Chinese Syndromes, hypertension belongs to the category of liver fire, vertigo, liver yang, headache and so on. Chinese medicine treatment of hypertension has gradually become a hot research topic, and using Chinese herbal medicine to reduce blood pressure has also achieved good results. In recent years, researches on anti-hypotension of Bidens pilosa L. has gradually increased. The related research of Bidens pilosa L., including the ancient literature, modern research, functional components and mechanism were mainly summarized, the application of Bidens pilosa L. in lowering blood pressure were anticipated, with a view to provide reference for the further development and utilization of Bidens pilosa L. in treatment of hypertension.
-
Key words:
- Bidens pilosa L. /
- antihypertensive /
- ancient books /
- chemical composition /
- mechanism of action
-
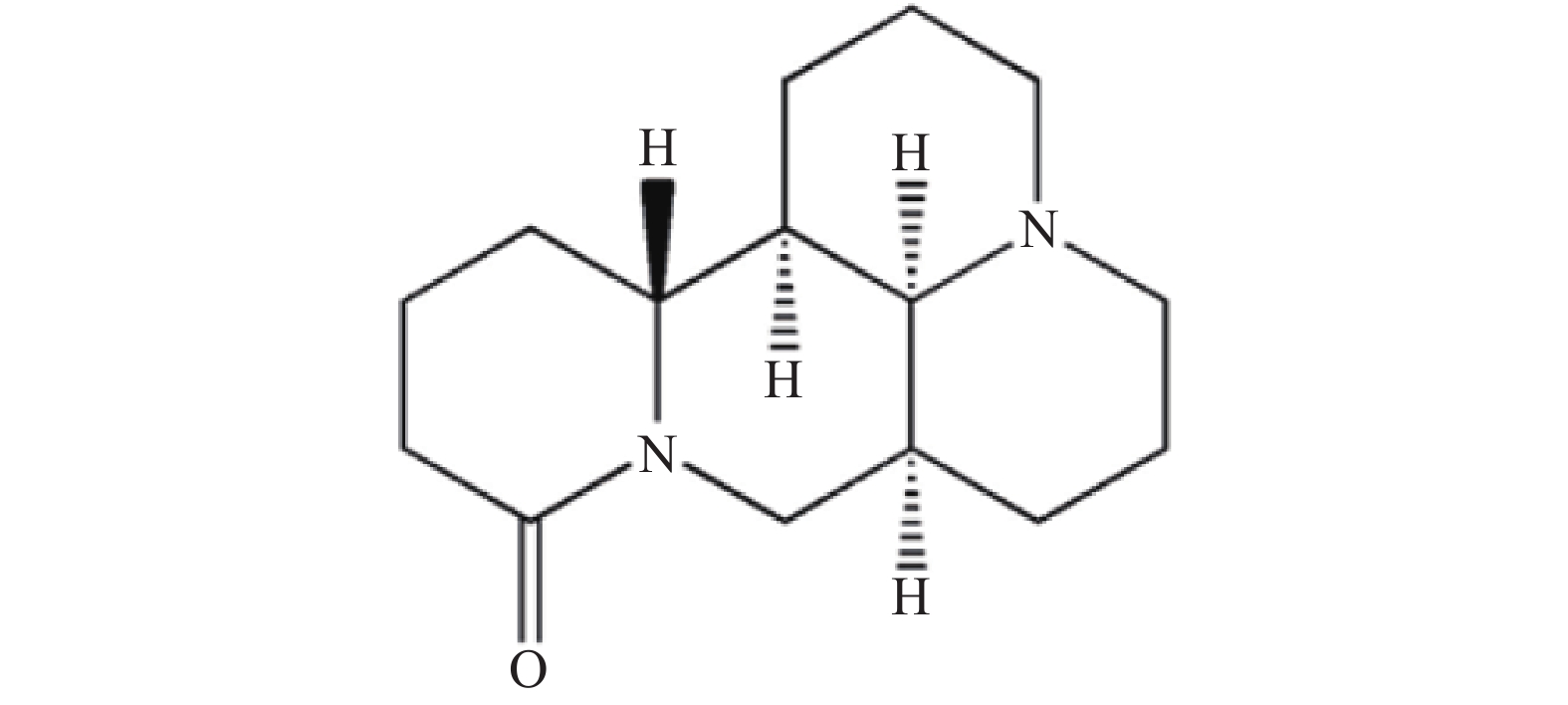
苦参碱(Matrine)是传统中药苦参的主要活性成分[1],是从苦参根中提取的生物碱类化合物,属于喹诺里西啶类生物碱,其化学结构见图1。苦参碱具有广泛的药理活性,包括抗肿瘤、抗病毒、抗纤维化、抗糖尿病、抗心衰、抗血小板和抗动脉粥样硬化等[2-4]。苦参碱存在着生物利用度低、化学稳定性差、生物毒性较高等一系列问题[5-6]。人们通过对苦参碱D环C-13、C-14和C-15位点的修饰,以及使D环的放开或融合等方法[7-9],获得了一系列活性更高、毒性更低的苦参碱衍生物,如硫代苦参碱[10]、13-羟基乙胺苦参碱[11]、13-酰胺基取代苦参碱[12]等。目前,对于苦参碱衍生物的研究多聚焦于抗肿瘤的活性,充分了解并探索其抗炎活性及机制,有助于人们开发苦参碱衍生物在炎症性疾病中的应用。本文将就苦参碱及衍生物的抗炎作用及其机制进行综述,为药物研发及临床应用提供理论支持。
1. 苦参碱及衍生物在各系统疾病中抗炎作用的研究
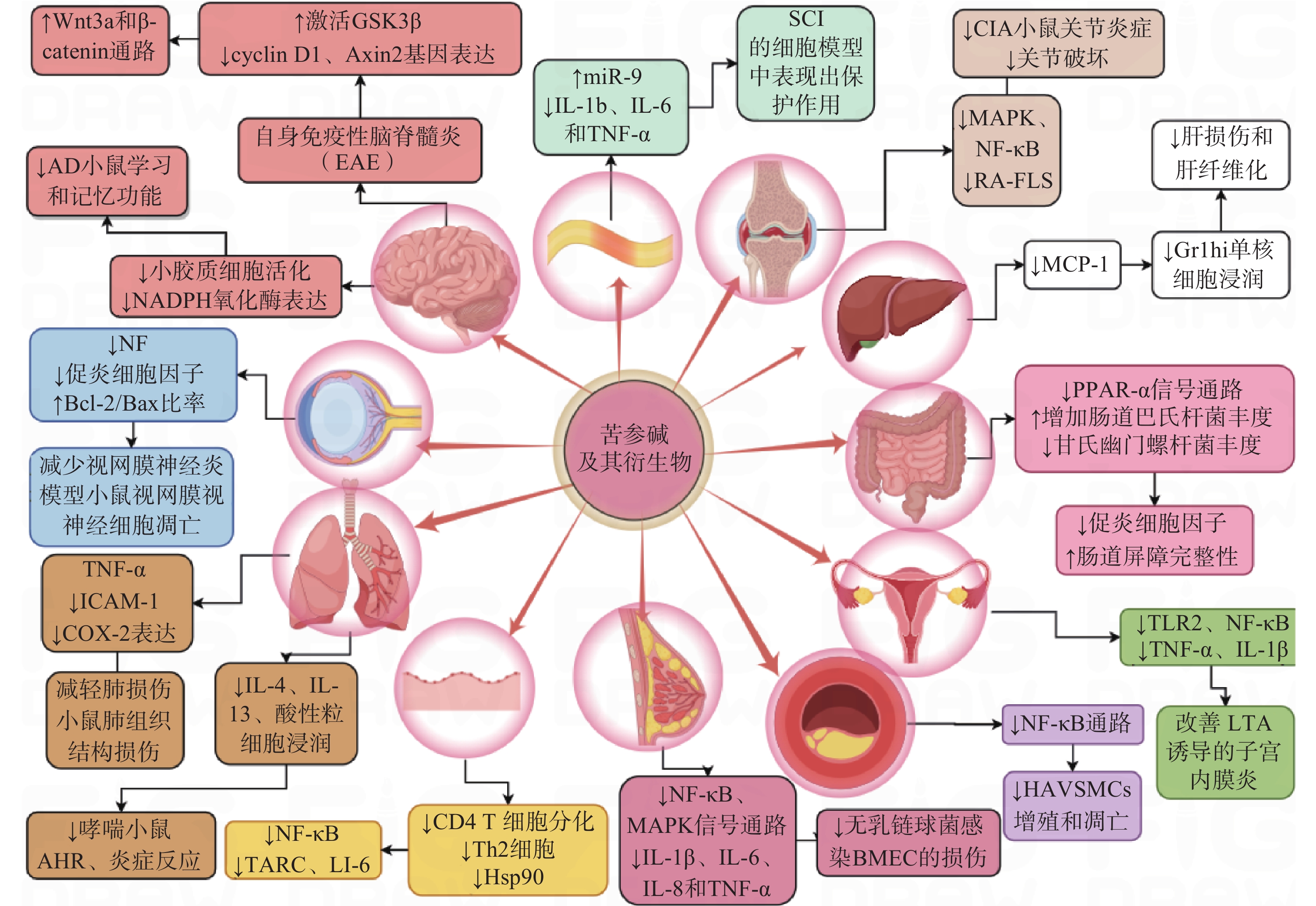
炎症是一种高度受控的过程,它被多种信号通路调控以维持机体的稳态[13]。苦参碱及其衍生物可能通过调节多种细胞信号通路或分子靶标在多系统炎症性疾病中发挥治疗作用(图2)。
1.1 神经系统
苦参碱可以通过抑制髓鞘少突胶质细胞糖蛋白MOG35-55诱导的自身免疫性脑脊髓灰质炎(EAE)小鼠中枢神经中Wnt 家族成员 3A(Wnt3a)和β-连环蛋白(β-catenin)活化,激活糖原合成酶激酶-3β(GSK-3β),降低Wnt3a/β-catenin通路中的两个靶基因G1/S-特异性周期蛋白-D1(cyclin-D1)和Axis抑制蛋白2(Axin2)的表达,促进少突胶质细胞(OL)的成熟和髓鞘修复功能,从而改善多发性硬化症(MS)动物模型的神经功能缺损[14]。苦参碱也可以通过抑制Ⅰ型星形胶质细胞的增殖与浸润,有效减轻中枢神经系统炎症促进神经再生,显著改善EAE 的临床评分[15]。
在阿尔茨海默病(AD)小鼠模型中,科研人员发现苦参碱可以降低海马组织中小胶质细胞的活性氧(ROS)、肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)和IL-6水平,显著改善AD模型小鼠的学习和记忆功能[16]。
在脊髓损伤(SCI)的体外实验中,有研究发现苦参碱能够上调miR-9的表达来抑制c-Jun氨基末端激酶(JNK)和核因子κB(NF-κB)通路,并抑制IL-1β、IL-6和TNF-α的释放,保护大鼠肾上腺嗜铬细胞瘤细胞(PC 12)免受脂多糖(LPS)诱导的炎症损伤[17]。
此外,苦参碱还能够通过增加视神经中神经丝蛋白(NFs)的表达,降低Iba1细胞(巨噬细胞/小胶质细胞)数量,上调B淋巴细胞瘤-2(Bcl-2)/BCL2相关X蛋白(Bax)的比率,从而减少炎性浸润、脱髓鞘和视网膜神经节细胞凋亡[18]。
1.2 呼吸系统
有研究表明,苦参碱可以通过抑制急性肺损伤模型中单核细胞趋化蛋白-1(MCP-1)、IL-6和IL-8的表达,改善造模小鼠的肺组织损伤程度[19]。
在卵清蛋白(OVA)诱导的过敏性哮喘小鼠模型中,人们发现苦参碱可以通过抑制嗜酸性粒细胞趋化因子和Th2细胞因子的产生,显著降低哮喘小鼠的嗜酸性粒细胞浸润、减轻气道高反应性和气道炎症[20]。在过敏性哮喘小鼠模型和TNF-α诱导的人气管上皮细胞实验中,苦参碱可以减少IL-4、IL-6、IL-13和粘附分子的表达,抑制模型小鼠上皮细胞中的细胞因子信号传导抑制因子3 (SOCS3)表达,改善OVA诱导引发的气道高反应性、炎症细胞浸润、杯状细胞分化和黏液产生, 减少气管上皮细胞中促炎细胞因子的产生, 达到缓解哮喘症状的效果[21]。
1.3 消化系统
苦参碱可以抑制过氧化物酶增殖物激活受体-α(PPAR-α)信号通路,增加肠道巴氏杆菌的丰度,降低甘氏幽门螺杆菌的丰度[22]。在葡聚糖硫酸钠(DSS)诱导的溃疡性结肠炎小鼠模型中,苦参碱可以显著抑制炎性细胞因子水平,改善肠道屏障的完整性。
苦参碱衍生物能通过抑制MCP-1的产生和活性,减少炎症性Gr1hi单核细胞在肝脏中的浸润,从而明显减轻四氯化碳(CCl4)诱导的急性肝损伤和肝纤维化[23]。
1.4 风湿免疫系统
在胶原诱导的关节炎(CIA)小鼠模型中,人们观察到苦参碱衍生物MASM通过丝裂原活化蛋白激酶(MAPK)和NF-κB通路抑制炎症介质表达,诱导成纤维样滑膜细胞(RA-FLS)的凋亡来减轻CIA小鼠的关节炎严重程度,降低了CIA小鼠的炎症和关节破坏程度[24]。
1.5 循环系统
动脉粥样硬化是一种慢性炎症性疾病,与炎症反应以及血管平滑肌细胞不受控制的增殖和过度凋亡有关。研究发现,苦参碱通过抑制NF-κB通路,降低氧化低密度脂蛋白(oxLDL)诱导的动脉粥样硬化模型中人主动脉血管平滑肌细胞的增殖和凋亡,表现出抗炎作用[25]。
在缺氧性肺动脉高压(HPAH)模型中,炎性细胞因子可浸润肺动脉血管,使肺动脉平滑肌细胞异常增殖,导致肺血管重构。人们发现苦参碱可降低大鼠α平滑肌肌动蛋白和肺动脉介质中增殖细胞核抗原(PCNA)的表达,降低TNF-α和IL-1β水平,将细胞周期延缓在S期,并降低p50、p65、PCNA、Bcl-2的表达,逆转缺氧诱导的肺动脉平滑肌细胞(PASMCs)增殖和凋亡的失衡,降低大鼠右心室收缩压和平均肺动脉压,改善缺氧诱导的肺血管重塑(PVR)[26]。
1.6 其他
苦参碱可以提高小鼠调节性T细胞(Treg)细胞比例,降低CD4+/CD8+比例,减轻移植心脏的炎性细胞浸润,延长心脏移植小鼠的存活时间。更重要的是,苦参碱可以下调NF-κB通路,上调ERK 1/2信号通路,抑制小鼠树突状细胞(DCs)成熟,减少同种异体心脏的氧化损伤和凋亡[27]。
研究发现,在特应性皮炎(AD)小鼠模型和TNF-α/IFN-γ处理的人表皮角质形成细胞(HaCaT)模型中,苦参碱可以减少T淋巴细胞和肥大细胞浸润,抑制CD4+ T细胞分化,调节Th1/Th2炎症反应,抑制Hsp90/NF-κB信号轴来抑制TNF-α/IFN-γ处理的HaCaT细胞炎性因子分泌,从而减轻AD的症状[28]。
无乳链球菌是牛乳腺炎的主要致病菌,在其诱导的乳腺炎体外模型中,可导致牛乳腺上皮细胞 (BMEC)细胞凋亡,研究发现,苦参碱可以抑制NF-κB和MAPK信号通路,显著下调IL-1β、IL-6、IL-8和TNF-α等促炎细胞因子的产生并预防BMEC细胞损伤[29]。
在金黄色葡萄球菌脂磷壁酸(LTA)诱导的小鼠子宫内膜炎模型中,苦参碱可以抑制Toll样受体2(TLR2)的表达及其下游NF-κB的活化,降低TNF-α和IL-1β的表达,发挥对子宫内膜细胞的保护作用[30]。在临床试验中,应用苦参碱治疗慢性盆腔炎,苦参碱组患者的血清TNF-α、IL-1β和IL-6水平显著低于对照组,苦参碱组疗效明显优于对照组[31]。
2. 苦参碱及衍生物的抗炎作用机制
2.1 对炎症细胞的调节作用
在肽聚糖、脂蛋白等因子的刺激作用下,巨噬细胞发生极化并表现出两种主要表型M1和M2。其中,M1型巨噬细胞产生炎性细胞因子,M2型巨噬细胞则参与炎症的消退和修复[3]。研究表明,苦参碱可以抑制M1巨噬细胞侵袭与浸润,促进M1型巨噬细胞向M2型转化,降低M1/M2的比例,发挥抗炎作用[32]。
中性粒细胞是炎症反应的重要调节剂,它能够表达和产生多种细胞因子参与炎症过程,如IL-1β、IL-6和IL-17等。这些细胞因子在疾病的炎症反应中发挥重要作用。有研究表明,在香烟烟雾暴露诱导的肺炎小鼠模型中,苦参碱能够显著降低其支气管肺泡灌洗液 (BALF) 中嗜中性粒细胞数量,减轻肺部炎症和损伤。进一步研究发现, 苦参碱不是参与抑制中性粒细胞相关的细胞因子及趋化因子, 而是通过诱导中性粒细胞凋亡来起到调节炎症反应的作用[33]。 此外, 苦参碱也可以通过抑制细胞间黏附分子-1(ICAM-1)、 血管细胞粘附分子-1(VCAM-1)来减少中性粒细胞与病变组织的黏附改善炎症反应[34]。
2.2 炎症相关信号通路的影响
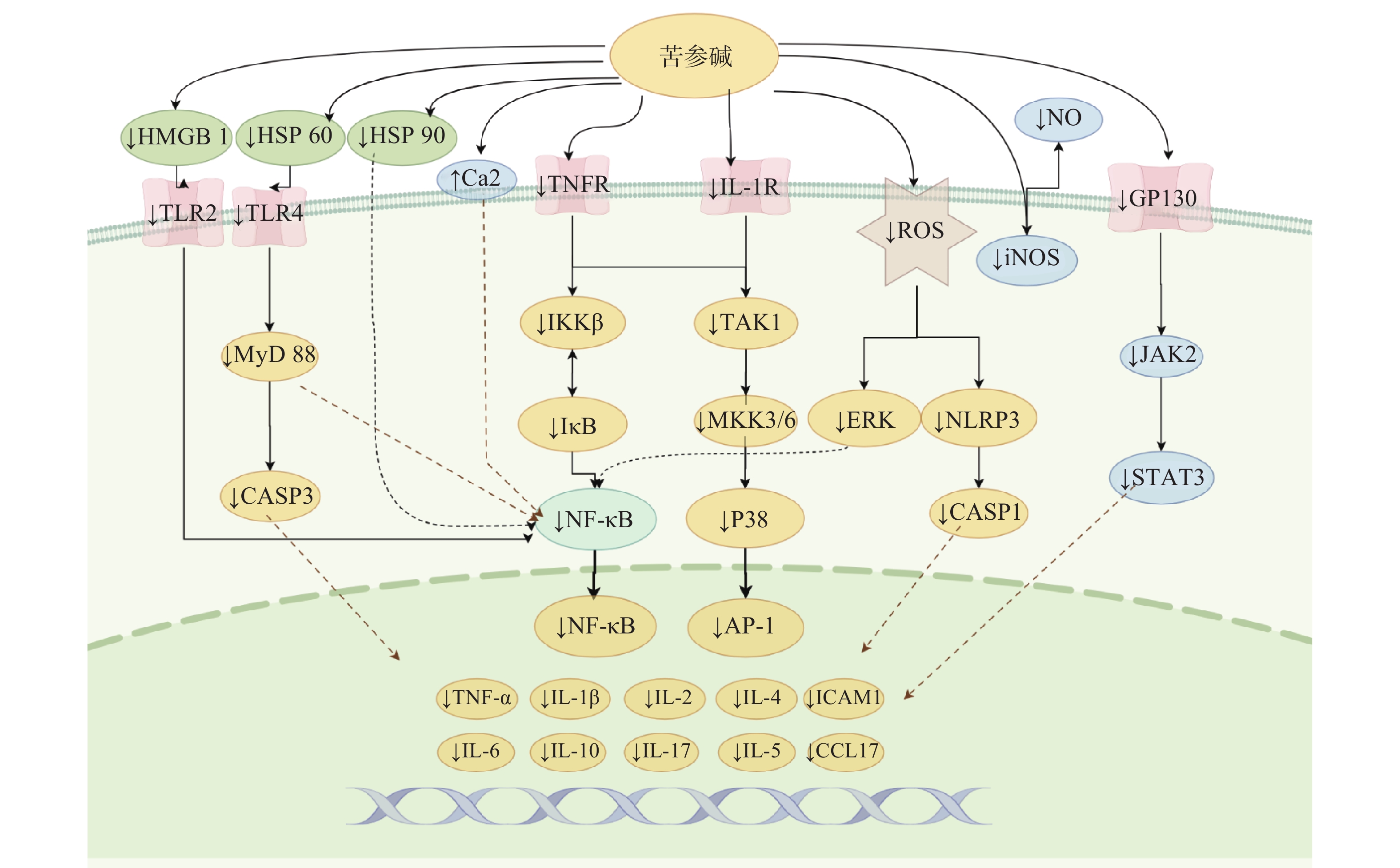
苦参碱及衍生物可以抑制包括NF-κB、JAK2/STAT3、MKK/p38 MAPK信号通路在内的多种炎症信号通路的激活,从而减少炎症因子的分泌,起到抗炎的效果,这也是苦参碱及衍生物发挥抗炎作用的最主要机制。其对各通路的影响汇总并阐述如下(图3)。
2.2.1 一氧化氮信号通路
一氧化氮(NO)是人体内重要的调节分子,诱导型一氧化氮合酶(iNOS)是产生NO的上游调节因子。多种炎症刺激可触发iNOS产生NO,并引发炎症反应。有研究表明,在LPS刺激的RAW 264.7细胞中,氧化苦参碱可以显著抑制iNOS的过表达,从而减少NO水平[35]。
2.2.2 NF-κB信号通路
NF-κB通路在许多生物过程的调节中起着至关重要的作用,是一种典型的促炎症信号通路,与炎症因子TNF和IL的分泌密切相关[27]。苦参碱可以通过刺激上调钙敏感受体的表达,来抑制NF-κB信号通路的激活,从而保护肠脏器并恢复肠屏障的完整性[36]。
氧化苦参碱能够抑制NF-κB和MAPKs信号通路,显著减轻LPS诱导的乳腺损伤[37];苦参碱可以上调miRNA-9的表达,通过抑制JNK和NF-κB通路,从而改善LPS诱导的PC 12细胞炎症损伤,减轻小鼠脊髓损伤的继发性损伤[17]。苦参碱通过NF-κB通路减弱HAVSMCs中的异常生物反应,减少oxLDL诱导的血管平滑肌细胞异常增殖和过度凋亡,表现出抗炎作用[25]。苦参碱衍生物MASM可显著减轻LPS诱导的小鼠腹腔巨噬细胞和RAW264.7细胞中NF-κB通路的激活,减少了TNF-α、IL-6和NO/iNOS的释放[38]。苦参碱也可以通过抑制NF-κB和MAPK途径的活化,抑制LPS刺激的人肺上皮A549细胞中环氧合酶-2(COX-2)和ICAM-1的转录和表达[19]。
2.2.3 JAK2/STAT3信号通路
JAK2/STAT3通路的异常激活与一些炎性疾病的进展密切相关,包括关节炎、肝炎、肾炎和溃疡性结肠炎等。苦参碱可阻断JAK2/STAT3信号通路,抑制DSS诱导的肠上皮细胞促炎因子水平、髓过氧化物酶(MPO)活性、NO产生和细胞凋亡[39]。苦参碱能够抑制脓毒症诱导的沉默信息调节因子1(SIRT-1)下调和NF-κB p65亚基和p53的去乙酰化,减少肺中M1型巨噬细胞的浸润数量,增加M2型巨噬细胞浸润,减轻脓毒症诱导的肺损伤 [32]。
2.2.4 MKK/p38 MAPK信号传导途径
P38 MAPK信号通路在许多细胞类型中诱导炎症反应。p38 MAPK的激活依赖于其上游激酶MKK3和MKK6的磷酸化。研究发现ox-LDL暴露后显著促进MKK3、MKK6和p38的磷酸化,激活p38 MAPK炎症信号通路。而苦参碱能够通过抑制MKKs/p38 MAPK信号通路来减轻ox-LDL诱导的炎症,减少ox-LDL诱导的THP-1细胞ROS产生,发挥抗炎作用[3]。苦参碱能够抑制无乳链球菌诱导的BMEC细胞NF-κB、IκBα、p38和ERK磷酸化水平升高,抑制IL-1β、IL-6、IL-8和TNF-α的mRNA,减少无乳链球菌感染引起的BMEC损伤[29]。
2.2.5 Toll样受体通路
TLR4位于多种促炎细胞表面,是炎症反应中的主要受体。LPS激活免疫细胞中的TLR4启动信号级联,触发NF-κB通路的激活,从而导致后续一系列细胞因子和炎症介质的产生。研究发现,氧化苦参碱可以通过抑制TLR4的表达而减少NF-κB的活化,下调TLR4/NF-κB通路,抑制LPS刺激诱导的炎症反应[35]。炎症介质高迁移率族蛋白1(HMGB 1)是一种非组蛋白DNA结合蛋白,具有多种生物学效应,在炎症过程中,HMGB1可以通过结合TLR4,从而激活NF-κB信号通路,促进促炎细胞因子的转录。自身免疫性脑脊髓炎的发生发展便与这一通路的激活密切相关,有研究发现,苦参碱可抑制HMGB1/TLR4/NF-κB信号传导,减少炎症因子的产生,抑制炎性细胞浸润,从而减轻脑脊髓炎模型小鼠的炎性损伤[40]。
2.2.6 热休克蛋白通路
热休克蛋白60(HSP 60)于细胞外释放结合TLR4,可以刺激神经元细胞加重炎症反应。苦参碱可以通过抑制HSP60/TLR4/MyD88信号传导通路,抑制LPS诱导的小胶质细胞活化,发挥神经保护和抗炎作用[41]。苦参碱可以抑制炎性细胞因子-胸腺活化调节趋化因子TARC/CCL17和IL-6分泌,改善AD小鼠的炎症反应;苦参碱还可以通过抑制 Hsp90/NF-κB 信号轴来调节 Th1/Th2 炎症反应,从而缓解特应性皮炎[28]。
3. 总结与展望
苦参碱是从传统中药中提取出来的一种天然成分,具有相当大的药用价值。目前在炎症相关疾病中研究较为深入的苦参碱类生物碱主要包括苦参碱、氧化苦参碱、槐果碱3种。三者之中,苦参碱在多系统多器官的炎症性疾病中都有广泛研究;氧化苦参碱在支气管哮喘[42]、溃疡性结肠炎[43]的动物模型中表现出了一定的治疗效果;槐果碱则主要在类风湿性关节炎[44]、脓毒症[45]的动物模型中表现出了疗效。考虑到成药性,苦参碱的药理活性低、体内药效维持时间短,其临床应用局限很大,仅能偶尔作为辅助药物使用。因此,研究人员对苦参碱进行了结构修饰,提高了其药理活性,改善了其药代动力学特点,苦参碱衍生物在动物实验中表现出了明确的有效性和安全性。例如,苦参碱衍生物MASM已被证实在小鼠关节炎[24]和脓毒症等模型[38]中表现出较好的治疗效果。在实际临床工作中,对于严重感染引发的急危重症脓毒症,患者的致残致死率极高,给临床工作带来极大困难,如果联合应用安全有效的苦参碱衍生物可能会取得很好的疗效,苦参碱衍生物的临床应用前景值得期待。
与此同时,目前对于苦参碱及其衍生物在抗炎机制研究还不够深入,目前大部分研究还是集中在其抑制炎症相关通路(如NO、NF-κB、MAPK等)以及减少炎症因子分泌(IL-1β、IL-6、TNF-α等)的探讨上,缺乏对其特异性靶点的探索。此外,目前合成苦参碱衍生物通常需要经过多步合成反应,制备工艺还相对复杂,且有些合成产物的稳定性差,易被氧化或降解,距离产业化和临床应用还有较长的一段路要走。综上所述,苦参碱及其衍生物在炎症相关疾病中的应用是一个富有前景的研究方向,仍有许多极富价值的课题有待科研人员去探索和解决。
-
[1] HEALTH T W C O T R O C, CHINA D I. 中国心血管健康与疾病报告2022概要 [J]. 心脑血管病防治, 2023, 23(7): 1-19. [2] 邓湘俊, 潘卫松, 张婷, 等. 鬼针草属植物药的药理作用研究进展[J]. 中国药房, 2017, 28(13): 1860-1864. [3] ANWAR M A, AL DISI S S, EID A H. Anti-hypertensive herbs and their mechanisms of action: part II[J]. Front Pharmacol, 2016, 7:50. [4] 张传伟, 王育良. 鬼针草的现代研究进展[J]. 辽宁中医药大学学报, 2010, 12(6):38-39. [5] 孙阳, 朱明军, 李彬, 等. 鬼针草治疗高血压病刍议[J]. 国医论坛, 2019, 34(3):57-59. [6] RUIZ-REYES E, MENDOZA-CEVALLOS M A, POLANCO-MOREIRA A P, et al. Phytochemical study of the plant species Bidens pilosa L. (Asteraceae) and Croton floccosus(Euphorbiaceae)[J]. F1000Res, 2022, 11:702. doi: 10.12688/f1000research.112653.2 [7] 沈艺玮, 林丽清, 林新华, 等. 鬼针草的化学成分及药理活性研究进展[J]. 福建医科大学学报, 2015, 49(1):58-61. [8] 广州部队后勤部, 卫生部. 常用中草药手册[M]. 北京: 人民卫生出版社, 1969. [9] 熊辅信. 临床中药辞典[M]. 昆明: 云南科技出版社, 1988. [10] 冉先德. 中华药海[M]. 哈尔滨: 哈尔滨出版社, 1993. [11] 永城县革命委员会文教卫生局编写小组. 土单验方中草药汇编[M]. 永城: 永城县革命委员会文教卫生局, 1970. [12] 张瑞, 孙硕, 陈艾东. 利尿药联合其他药物抗高血压的临床新进展[J]. 医学理论与实践, 2018, 31(22):3347-3349. [13] BARTOLOME A P, VILLASEÑOR I M, YANG W C. Bidens pilosa L. (Asteraceae): botanical properties, traditional uses, phytochemistry, and pharmacology[J]. Evid Based Complementary Altern Med, 2013, 2013(1):340215. [14] 王碧晴, 赵俊男, 张颖, 等. 鬼针草的药理作用研究进展[J]. 中医药导报, 2019, 25(18):100-103,107. [15] 王其龙, 文敏, 卢红, 等. 鬼针草提取物对实验性兔高血压的影响[J]. 中兽医医药杂志, 2020, 39(2):83-85. [16] 郑梅生, 朱琳, 郑云菊, 等. 鲜鬼针草降压作用的实验研究[J]. 中医临床研究, 2016, 8(24):16-19. doi: 10.3969/j.issn.1674-7860.2016.24.007 [17] 付军. 自拟银海双钩鬼针草汤治疗痰瘀互阻型高血压病120例临床观察[J]. 内蒙古中医药, 2016, 35(13):12-13. doi: 10.3969/j.issn.1006-0979.2016.13.013 [18] 李庆东, 边蕙霖, 凌之甫, 等. 鬼针草治疗高血压病的临床观察[J]. 中西医结合杂志, 1989(6): 364. [19] 周志彬. 悦年片的疗效观察[J]. 中国中药杂志, 1989(4): 52-53. [19] 沙静姝, 毛洪奎. 悦年片[J]. 中国药学杂志, 1991(10):629. [20] 孙阳, 朱明军, 李彬, 等. 复方鬼针草颗粒治疗1级高血压病湿热血瘀证患者的临床疗效[J]. 中国实验方剂学杂志, 2021, 27(22):100-107. [21] 严冬. 降压益肾颗粒防治高血压病早期肾损害临床及实验研究[D]. 南京: 南京中医药大学, 2007. [22] 陈川. 鬼针草的临床应用[J]. 临床合理用药杂志, 2013, 6(6):28. doi: 10.3969/j.issn.1674-3296.2013.06.019 [23] 李胜峰, 刘阿娜, 蒋海强, 等. 小花鬼针草化学成分液质联用分析[J]. 山东中医杂志, 2016, 35(7):641-644. [24] SINGH G, PASSSARI A K, SINGH P, et al. Pharmacological potential of Bidens pilosa L. and determination of bioactive compounds using UHPLC-QqQLIT-MS/MS and GC/MS[J]. BMC Complement Altern Med, 2017, 17(1):492. doi: 10.1186/s12906-017-2000-0 [25] SHEN Y W, SUN Z L, SHI P Y, et al. Anticancer effect of petroleum ether extract from Bidens pilosa L and its constituent’s analysis by GC-MS[J]. J Ethnopharmacol, 2018, 217:126-133. doi: 10.1016/j.jep.2018.02.019 [26] 王美霞. 鬼针草挥发油的提取、应用及抑菌活性测试研究[J]. 山东化工, 2022, 51(9):39-40,43. doi: 10.3969/j.issn.1008-021X.2022.09.013 [27] GOUDOUM A, ABDOU A B, NGAMO L S, et al. Antioxidant activities of essential oil of Bidens pilosa(Linn. Var. Radita)used for the preservation of food qualities in North Cameroon[J]. Food Sci Nutr, 2016, 4(5):671-678. doi: 10.1002/fsn3.330 [28] 赵紫艳, 麻秋团, 吴一航, 等. 鬼针草的化学成分研究[J]. 云南民族大学学报(自然科学版), 2022, 31(6):627-632. doi: 10.3969/j.issn.1672-8513.2022.06.001 [29] HARAHAP U, SYAHPUTRA R A, AHMED A, et al. Current insights and future perspectives of flavonoids: a promising antihypertensive approach[J]. Phytother Res, 2024, 38(6):3146-3168. doi: 10.1002/ptr.8199 [30] MAALIKI D, SHAITO A A, PINTUS G, et al. Flavonoids in hypertension: a brief review of the underlying mechanisms[J]. Curr Opin Pharmacol, 2019, 45:57-65. doi: 10.1016/j.coph.2019.04.014 [31] LARSON A J, SYMONS J D, JALILI T. Therapeutic potential of quercetin to decrease blood pressure: review of efficacy and mechanisms[J]. Adv Nutr, 2012, 3(1):39-46. doi: 10.3945/an.111.001271 [32] 阮氏香江, 陈宁, 黄婉苏, 等. 鬼针草水提物的降血压作用及其作用机制研究[J]. 广西医科大学学报, 2017, 34(2):177-180. [33] CHEN Y, LUO J G, ZHANG Q, et al. Identification of active substances for dually modulating the renin–angiotensin system in Bidens pilosa by liquid chromatography–mass spectrometry–based chemometrics[J]. J Funct Foods, 2016, 21:201-211. doi: 10.1016/j.jff.2015.12.011 [34] BILANDA D C, DZEUFIET P D D, KOUAKEP L, et al. Bidens pilosa Ethylene acetate extract can protect against L-NAME-induced hypertension on rats[J]. BMC Complement Altern Med, 2017, 17(1):479. doi: 10.1186/s12906-017-1972-0 [35] SUZIGAN M I, BATTOCHIO A P, COELHO K L, et al. An acqueous extract of Bidens pilosa L. protects liver from cholestatic disease: experimental study in young rats[J]. Acta Cir Bras, 2009, 24(5):347-352. doi: 10.1590/S0102-86502009000500003 [36] YUAN L P, CHEN F H, LING L, et al. Protective effects of total flavonoids of Bidens pilosa L. (TFB) on animal liver injury and liver fibrosis[J]. J Ethnopharmacol, 2008, 116(3):539-546. doi: 10.1016/j.jep.2008.01.010 [37] ZHUANG G, WANG Y Q, LI S J, et al. Tissue distribution and molecular docking research on the active components of Bidens bipinnata L. against hyperlipidemia[J]. Biomed Chromatogr, 2021, 35(4):e5026. doi: 10.1002/bmc.5026 [38] 方媛, 方祝元. 鬼针草及其有效成分治疗高血压肾损害机制研究概况[J]. 中医杂志, 2018, 59(9):800-803. [39] XUAN T D, KHANH T D. Chemistry and pharmacology of Bidens pilosa: an overview[J]. J Pharm Investig, 2016, 46(2):91-132. doi: 10.1007/s40005-016-0231-6 -

 点击查看大图
点击查看大图
计量
- 文章访问数: 1413
- HTML全文浏览量: 1061
- PDF下载量: 0
- 被引次数: 0




 下载:
下载:

 下载:
下载:
