-
2019年12月以来,世界各地先后出现了新型冠状病毒肺炎(简称“新冠肺炎”,COVID-19)疫情,中国政府及时采取有效的举措,使我国疫情得到有效控制。新冠肺炎是一种急性呼吸道传染病,根据《中华人民共和国传染病防治法》规定为乙类传染病,按照甲类传染病管理。在我国战胜新冠肺炎疫情过程中,中医药发挥了重要作用,本文对中药防治新冠肺炎进行概述。
-
2019年12月,新冠肺炎得到首次报告,是一种由新型冠状病毒感染引起的以发热、乏力、干咳为主要表现的急性呼吸道传染病[1]。世界卫生组织将该冠状病毒命名为2019新型冠状病毒(SARS-CoV-2)。新型冠状病毒属于冠状病毒科正冠状病毒亚科Sarbe病毒亚属β属的冠状病毒,有包膜,颗粒呈圆形或椭圆形,常为多形性,直径60~140 nm[2]。新型冠状病毒与严重急性呼吸综合征冠状病毒(SARS-CoV)、中东呼吸综合征病毒(MERS-CoV)同属于冠状病毒,具有相似的结构,由突刺糖蛋白(spike glycoprotein,S)、血凝素乙酰酯酶粒蛋白、膜糖蛋白、小分子被膜糖蛋白、糖衣壳磷酸蛋白和核糖核酸构成。血管紧张素转化酶2(angiotensin-coverting enzyme2,ACE2)是新冠病毒的宿主细胞受体。S蛋白在识别并结合宿主细胞表面受体与介导病毒包膜与细胞膜融合的过程中起到关键作用。S蛋白可能通过与人的ACE2蛋白互相结合感染人的呼吸道上皮细胞[3-4]。
新冠病毒侵入细胞后,包膜会与细胞膜融合,释放病毒遗传物质RNA,在细胞内合成更多的RNA和病毒蛋白质结构,组成新的冠状病毒颗粒,通过高尔基体分泌至细胞外,感染新的细胞。病毒迅速蔓延到器官、支气管,最终到达肺泡引发肺炎。其临床表现为发烧、咳嗽、呼吸急促、氧饱和度下降,影像学表现有双侧肺炎,多发斑片状阴影和磨玻璃样阴影,严重者发展为急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)。大量病毒进入人体的同时,激活机体免疫反应,T细胞和巨噬细胞分泌白介素-6(IL-6)等大量炎症因子,机体对细胞因子产生过度的免疫反应从而产生全身炎症反应综合征,或称炎症因子风暴,严重者造成多器官的衰竭而死亡。
-
新冠肺炎在中医属疫病范畴,病因为感受疫戾之气,病位在肺,基本病机特点为“湿、热、毒、瘀”。国家卫生健康委办公厅、国家中医药管理局办公室下发的《新型冠状病毒肺炎诊疗方案》(试行第七版),为新冠肺炎医学观察期、确认病例的轻型、普通型、重型、危重型以及恢复期患者提供了中药治疗方案。
医学观察期常表现为乏力伴发热或胃肠不适。确诊的轻型又分为寒湿郁肺症、湿热蕴肺症。普通型分为湿毒郁肺症、寒湿阻肺症。重型分为疫毒闭肺症、气营两燔症。危重型中医归为内闭外脱症,临床表现为呼吸困难、动辄气喘或需要机械通气,伴神昏,烦躁,汗出肢冷,舌质紫暗,苔厚腻或燥,脉浮大无根。各期各型推荐的中成药包括藿香正气胶囊、金花清感颗粒、连花清瘟胶囊、疏风解毒胶囊;中药注射液包括血必净、醒脑静、热毒宁、痰热清、参附、生脉、参麦注射液等。
值得注意的是清肺排毒汤被国家卫生健康委等部门推荐为中医临床治疗期首选用药,其适用于轻型、普通型、重型患者。对于危重型患者结合实际情况也可合理使用。基础方剂由麻杏石甘汤、射干麻黄汤、小柴胡汤、五苓散等方综合而成,方剂由二十一味中药组成:麻黄9 g、炙甘草6 g、杏仁9 g、生石膏15~30 g(先煎)、桂枝9 g、泽泻9 g、猪苓9 g、白术9 g、茯苓15 g、柴胡16 g、黄芩6 g、姜半夏9 g、生姜9 g、紫菀9 g、冬花9 g、射干9 g、细辛6 g、山药12 g、枳实6 g、陈皮6 g、藿香9 g。方中麻黄辛温,发汗散寒,宣肺平喘,利水消肿,宣肺,解表以散邪;石膏辛甘大寒,清泄肺热以透邪。柴胡辛、苦,微寒,能疏散退热,升举阳气,黄芩苦寒,善清火散邪。方中诸药温凉并济,攻补兼施,针对寒、热、湿、毒、虚诸邪,共奏宣肺止咳、清热化湿、解毒祛邪之功效。可明显改善发热、咳嗽、乏力、咽干、食欲减退等症状,对淋巴细胞、中性粒细胞的指标改善明显,中西医结合治疗平均住院时间显著缩短。经临床救治观察进一步证实中西医结合使用清肺排毒汤对治疗新冠肺炎具有良好的临床疗效,总有效率90%以上[5]。
-
金银花为忍冬科植物忍冬Lonicera japonica Thunb. 的干燥花蕾或带初开的花。能清热解毒,疏散风热。可用于风热感冒,温病发热。金银花含有机酸类、黄酮类、三萜皂苷类、挥发油类等成分,绿原酸、咖啡酸、槲皮素、木樨草苷等是抗流感病毒的主要活性成分,对甲型流感病毒、病毒性心肌炎、疱疹病毒及腺病毒均有抑制作用,其中,绿原酸和咖啡酸可与流感病毒被膜上的神经氨酸酶结合,从而抑制流感病毒的早期复制[6]。金银花多糖能显著降低甲型流感病毒FM1株滴鼻感染小鼠的死亡率,延长小鼠的生存时间,减轻肺病变程度,抗病毒作用与增强机体免疫力有关[7]。在金银花中发现一种植物miRNA-miR2911,作为新型的抗流感病毒成分,其结构稳定、耐煎煮,在体内肺部富集,可直接靶向H1N1、H5N1和H7N9甲型流感病毒,通过抑制H1N1编码的PB2和NS1蛋白的表达从而抑制病毒复制,其中,miR2911在体内、体外对H5N1和H7N9甲型流感病毒均有抑制作用[8]。
-
麻黄为麻黄科植物草麻黄Ephedra sinica Stapf、中麻黄E. intermedia Schrenk et C. A. Mey. 或木贼麻黄E. equisetina Bge.的干燥草质茎。为发汗解表要药。用于风寒感冒,胸闷喘咳。麻黄主要含生物碱类成分,其中,甲基麻黄碱、L-麻黄碱和D-伪麻黄碱能明显抑制甲型流感病毒的体外增殖[9],麻黄碱还能抑制H1N1型流感病毒对犬肾细胞的感染,并呈浓度依赖性[10]。
-
黄岑为唇形科植物黄芩Scutellaria baicalensis Georgi的干燥根,属于清热燥湿药,能泻火解毒。可用于肺热咳嗽等症。黄芩根中分离出的黄酮类成分5,7,4-三羟基-8-甲氧基黄酮(异黄芩素-8-甲醚)可抑制小鼠感染流感病毒,对唾液酸酶有特异的抑制活性,并能抑制流感病毒膜融合及脱壳[11]。黄芩苷还具有抗SARS冠状病毒的活性[12],并能缓解甲型流感病毒PR8诱导的小鼠肺炎性病理损伤,通过下调内质网应激反应和抑制组织细胞的凋亡,发挥抗流感病毒感染的作用[13]。黄芩素具有明显的体外抗H1N1及H3N2流感病毒活性,并能减轻感染A型流感病毒的ICR小鼠的肺部炎症[14]。黄芩苷可以通过抑制H1N1流感病毒的中后期mRNA的转录和复制,抑制神经氨酸苷酶活性,以及抑制病毒诱导的巨噬细胞和肺上皮细胞中促炎基因的表达,从而影响IL-6和IL-8等白介素的合成有关[15-16]。
-
柴胡为伞形科植物柴胡Bupleurum chinense DC.或狭叶柴胡B. scorzonerifolium Willd.的干燥根。为常用解表药,擅疏散退热,具有较好的解热、镇痛、抗菌和抗病毒作用,临床常用于急性上呼吸道感染等疾病的治疗。化学成分主要为三萜皂苷、挥发油、多糖、黄酮、木脂素、脂肪酸、香豆素、植物甾醇等。低浓度的柴胡丙酮提取物可明显抑制甲型H1N1病毒感染的犬肾细胞的病理改变,并可抑制甲型H1N1病毒感染的人支气管上皮细胞分泌细胞趋化因子(RANTES),表明柴胡丙酮提取物对犬肾细胞具有保护作用[17]。
-
连翘为木犀科植物连翘Forsythia suspensa (Thunb.) Vahl的干燥果实。能清热解毒,消肿散结,疏散风热。主要用于风热感冒,温病初起。连翘具有抗甲型流感病毒作用,治疗甲型流感的中成药银翘散、连花清瘟胶囊均含有连翘,连翘苷为其重要活性成分,其机制为通过减弱MAPK信号和减少病毒RNP输出达到抗甲型H1N1流感的作用[18-21]。金银花-连翘药对防治H7N9流感病毒具有较好疗效,两者成分具有协同效应。以H7N9的神经氨酸酶N9及其两种突变型N9-R294K和N9-R292K为受体,以金银花-连翘药对中24个化合物为配体,应用分子对接虚拟筛选结果表明,19个化合物可与H7N9神经氨酸酶结合。其中部分化合物的结合能力显著高于对照药奥司他韦羧酸盐。连翘酯苷A和亚油酸乙酯可望作为流感病毒H7N9的潜在抑制剂[22]。
-
甘草为豆科植物甘草Glycyrrhiza uralensis Fisch.、胀果甘草G. inflata Bat.或光果甘草G. glabra L.的干燥根和根茎。具有淸热解毒,祛痰止咳的功效,并能调和诸药,缓解药物的毒性和烈性。甘草醇提液在体外对呼吸道合胞病毒有明显抑制作用,既能干扰其吸附、生物合成过程,也能直接产生杀伤作用[23],甘草主要活性成分甘草酸能够抑制冠状病毒毒株的复制(IC50=0.27 mg/ml),干扰两种病毒的吸附和渗透复制的周期[24]。新冠病毒与SARS冠状病毒进入细胞的途径均是通过ACE2受体,甘草酸可与ACE2结合,在抗新型冠状病毒方面值得进一步研究[2]。
-
广藿香为唇形科植物广藿香Pogostemon cablin (Blanco) Benth.的干燥地上部分。能芳香化浊,和中止呕,发表解暑。用于暑湿表证,寒湿闭暑,鼻渊头痛等症。含挥发油、多酚类成分。所含的咖啡酰基多酚类化合物具有抑制A型流感病毒神经氨酸酶作用[25]。广藿香醇能使感染流感病毒模型小鼠的存活率和存活时间均显著提高,明显减轻肺部炎症[26]。
-
栀子为茜草科植物栀子Gardenia jasminoides Ellis的干燥成熟果实。味苦性寒,归心肺三焦经,能泻火除烦,清热利湿,凉血解毒。为治疗温毒疫病的要药。研究表明,栀子提取物流感病毒感染所致小鼠的肺部炎症有明显抑制作用,明显降低小鼠的死亡率,延长存活时间,同时降低小鼠血清中NO含量,在体外对流感病毒等6种病毒引起的细胞病变有明显抑制作用[27]。
-
穿心莲为爵床科植物穿心莲Andrographis paniculata (Burm. f.) Nees的干燥地上部分。能清热解毒,凉血,消肿。用于感冒发热,咽喉肿痛,蛇虫咬伤等症。主要活性成分为二萜内酯类和黄酮类。穿心莲内酯具有多方面的药理作用[28]。穿心莲内酯磺化物具有抗甲型流感病毒株(H1N1、H3N2)和乙型流感病毒株的作用,可用于预防甲型和乙型流感[29]。以穿心莲内酯磺化物为主要成分的喜炎平注射液联合扎那米韦治疗甲型流感,临床药效优于单用扎那米韦,可降低扎那米韦使用量,且不产生耐药性[30]。
-
免疫调节对于新冠肺炎的防治具有重要作用。轻症患者通过增强自身免疫力,依靠免疫机制清除病毒而较快痊愈。许多中药不仅能“祛邪”,还能“扶正”,帮助提高机体免疫功能以抵御疾病。因此,预防新冠肺炎以及在感染早期的治疗中,扶正祛邪具有重要价值。中医认为“邪之所凑,其气必虚”,“正气存内,邪不可干”。中药调节免疫功能除了增强免疫外,还有一些中药可以下调过度的免疫反应,缓解炎症风暴所致的损伤。中药对于机体免疫系统的调节功能与T细胞、B细胞、NK细胞、巨噬细胞以及细胞因子的产生和活性密切相关。
-
具有增强人体免疫功能的中药有人参、党参、明党参、黄芪、丹参、西洋参、白术、麦冬、地黄、北沙参等。明党参煎液和多糖能显著增加小鼠胸腺指数、脾指数、外周血细胞数、淋巴细胞数,促进网状内皮系统的吞噬功能[31]。人参和丹参提取物对流感病毒A感染小鼠具有免疫调节作用,能促进肺特异性抗体IgA的产生[32]。黄芪多糖是中药黄芪的重要活性成分,通过调节免疫器官、免疫细胞、免疫因子以及某些信使物质,具有显著的体内外免疫调节作用[33]。楮实子可提高环磷酰胺致免疫功能低下小鼠的碳粒廓清率,促进血清溶血素形成,增强免疫功能[34]。
-
白芍、昆明山海棠、青蒿等中药具有免疫抑制作用。雷公藤总苷能明显抑制小鼠的细胞免疫和体液免疫功能,显著抑制T淋巴细胞、B淋巴细胞的增殖和抗体生成,减少IL-1、IL-6等炎性细胞因子的生成,可作为中药免疫抑制剂[35]。
青蒿具有抗疟疾作用,其主要成分青蒿素能明显抑制刀豆蛋白A诱导的T淋巴细胞增殖,对迟发型超敏反应小鼠模型也显示有免疫抑制效应 [36]。
-
金银花、地黄、白芍、忍冬藤、芦荟、大黄等中药对免疫系统具有双向调节作用。三七总皂苷对免疫功能具有双向调节作用,可增强T细胞介导的细胞免疫,抑制炎症因子,从而抑制免疫反应对靶器官的损伤,调节炎症和抗炎细胞因子网络的平衡,发挥免疫调节作用[37-38]。西洋参对IL-6、IL-23A、IFN-α等大多数细胞因子产生上调作用,而对TNF-β及IL-13等少数细胞因子产生下调作用,从而达到增强免疫细胞作用[39]。
金银花多糖能提高环磷酰胺诱导的免疫抑制型模型小鼠细胞免疫功能,提高胸腺、脾脏指数及IL-2的产生,溶血素抗体生成加快[40]。而金银花提取物对刀豆蛋白A诱导下的小鼠淋巴细胞体外活化和增殖具有免疫抑制作用[41]。生物信息学方法分析结果表明,金银花通过巨噬细胞中IL-12信号生成通路调节流感相关机体免疫,金属蛋白酶家族是潜在关键蛋白质[42]。研究表明,许多中药复方对病毒性肺炎具有明确作用,如麻杏石甘汤对环磷酰胺模型小鼠能通过提高其机体免疫,调节细胞因子表达和分泌,从而减轻肺部炎症[43]。
-
病毒进入人体后,激活了机体白细胞、淋巴细胞、巨噬细胞等免疫细胞,会分泌一些细胞因子,同时有大量感染病毒的细胞死亡,临床研究表明新冠肺炎重症患者相比轻症患者,血浆多种促炎因子包括IL2、IL6、IL7、IL10、IP10、MCP1、MIP1A、GCSF、TNF-α等表达水平明显增高,而这些炎性指标提示重症患者发生了细胞因子风暴[44-45]。目前,糖皮质激素仍是直接降低细胞因子风暴的常用有效药物,然而应用糖皮质激素会抑制机体正常免疫力,不利于对冠状病毒的清除。因此,采用抗IL-6单抗、抗氧化剂、COX(环氧合酶)抑制剂、抗氧化剂、抗肿瘤坏死因子、中医药等疗法来避免或减缓炎症因子损伤是治疗新冠肺炎的一条重要途径[46]。连花清瘟胶囊、疏风解毒胶囊、清开灵注射液等中成药可显著减轻模型小鼠肺部炎性损伤及炎性因子含量,在动物模型上证实对治疗新冠肺炎有效[47]。
芍药苷能减轻博莱霉素诱导的肺纤维化模型小鼠炎症细胞浸润、间质纤维化和细胞外基质在肺组织中的沉积。其抑制肺纤维化的机制与通过抑制TGF-β/Smad途径的激活和IFN-γ的表达,抑制Ⅰ型胶原合成有关[47]。
金银花具有明确的抗炎作用,其中绿原酸、咖啡酸及其酯类化合物、新绿原酸等成分有抗炎活性,能有效降低脂多糖诱导的小鼠巨噬细胞炎症反应模型小鼠炎性因子NO、肿瘤坏死因子及IL-6的释放[48]。金银花中的多酚类物质能够通过NF-κB炎症信号通路及有丝分裂激活蛋白酶(MAPKs)途径抑制促炎因子TNF、IL-1β、COX-2和IL-6等的分泌[49-50]。
-
中医药在新冠肺炎的预防和治疗中具有明显优势,许多中药具有抗病毒、抗炎、免疫调节等作用,毒副作用低,尤其是一些药食两用的中药对免疫系统具有双向调节作用,通过增强机体免疫力提高机体抗病毒能力,同时对各器官具有保护作用。还可以下调过度的免疫反应,缓解炎症风暴所致的损伤。清肺排毒汤、麻黄、金银花、黄芪等中药在控制病情进展,维护心、肺、肾功能,保护靶器官以及调节免疫、退热、促进食欲等方面均有一定优势,且防护和治疗成本低,后遗症少,在新冠肺炎的疫情防控和治疗方面具有广阔的应用前景,值得进一步深入研究。
Prevention and treatment of COVID-19 with Traditional Chinese Medicine
-
摘要: 新型冠状病毒肺炎(COVID-19)是由新型冠状病毒(SARS-CoV-2)感染引起的以发热、乏力、干咳为主要表现的急性呼吸道传染病。此次疫情,中医药在防治新冠肺炎中起到了重要作用。本文概述了新冠肺炎的发病机制,中医药辨证论治以及抗病毒中药、抗炎中药、免疫调节中药的应用前景,尤其是一些具有双向调节作用中药的应用,以期为新冠肺炎的预防和治疗提供科学思路。Abstract: The novel coronavirus pneumonia is an acute respiratory infectious disease mainly manifested by fever, fatigue and dry cough, caused by new coronavirus 2019-nCoV infection(COVID-19). Traditional Chinese Medicine played an important role in the prevention and treatment of COVID-19 during this breakout. This article reviews the clinical treatments of SARS-CoV-2 with TCM, the pathogenesis of COVID-19, dialectical treatment with TCM, and the antiviral, anti-inflammatory, immune regulatory effects of TCM. Some TCM with dual immuno-modulatory effects draw special attention, which may shed light on the prevention and treatment of COVID-19.
-
Key words:
- Traditional Chinese Medicine /
- SARS-CoV-2 /
- pneumonia /
- immune regulation
-
在美国疾病预防控制中心耐碳青霉烯类肠杆菌(CRE)控制指南(2012年版)中,定义耐碳青霉烯肺炎克雷伯菌 (CRKP),是指在药敏试验中至少对厄他培南、美罗培南或亚胺培南其中之一者耐药,且对头孢曲松、头孢噻肟及头孢他啶耐药的肺炎克雷伯菌(KP)。CRKP引发的血流感染 (BSI) 因药物选择有限,致死率高达54.3%[1]。长期规律血液透析(HD)的尿毒症患者CRKP血流感染时,因HD的特殊性,更增加了治疗难度,特别是使用氨基糖苷类药物开展治疗时。临床药师需要根据HD患者代谢和排出的实际情况,结合药动学/药效学(PK/PD)理论对药物选择、剂量计算、以及给药时间进行优化。本文以1例 HD尿毒症患者为例,探讨阿米卡星在治疗合并CRKP血流感染的透析患者时的经验和体会。
1. 病史简介
1.1 基本信息
患者男性,64岁,农民,身高176 cm,体重65 kg。主诉“间断发热2 d”,于2019年10月21日入院。既往高血压病史20余年,多囊肾、多囊肝病史30余年,癫痫病史1年余,尿毒症病史4年,无尿状态,规律血液透析4年(每周一、三、五,2次血液透析+1次血液透析滤过),右侧颈静脉留置导管。2019年1月至9月,患者因“多囊肝伴感染”多次入院治疗,血培养多次报告超广谱β内酰胺酶(ESBLs)阳性的KP,曾多次接受哌拉西林他唑巴坦、替加环素、米诺环素、美罗培南、法罗培南等治疗。入院前2 d,患者再次无明显诱因出现发热,体温最高37.5 ℃,伴畏寒寒战,腰痛及呃逆,无明显咳嗽咳痰,服用“法罗培南”无明显改善,为求进一步诊治再次入院。入院查体:体温(T)38.6 ℃、脉搏(P)112次/min、呼吸频率(R)22次/min、血压(BP)117/97 mmHg。患者呈慢病面容,被动体位,查体欠合作,双肺呼吸音清,未闻及干湿啰音,腹部膨隆,无压痛及反跳痛,移动性浊音阳性,肝肾区无叩痛。辅助检查:血常规:白细胞计数(WBC) 10.74×109/L、中性粒细胞百分比(N%) 85.8%、血红蛋白(Hb) 109 g/L、血小板(PLT) 117×109/L;血生化:尿素氮(BUN) 30.8 mmol/L、肌酐(Cr) 912μmol/L、丙氨酸氨基转移酶(ALT) 6 U/L、天冬氨酸氨基转移酶(AST) 8 U/L;C-反应蛋白(CRP) 254 mg/L、降钙素原(PCT) 17.35 ng/ml、血沉(ESR) 95 mm/h。腹部核磁示肝右叶多发片状DWI异常信号影,多囊肝,双侧多囊肾。胸部CT未见异常。入院诊断:肝囊肿合并感染、尿毒症、血液透析状态、慢性左心功能不全、心功能Ⅲ级、心律失常、阵发性房颤。
1.2 治疗经过
入院当日抽取静脉血做细菌培养,经验性给予美罗培南0.5 g,1次/d。治疗期间,患者仍间断发热,体温在37~38 ℃波动。10月26日化验结果显示:WBC 5.35×109/L、N% 71.2%、BUN 18.41 mmol/L、Cr 631μmol/L、CRP 179 mg/L、PCT 16.97 ng/ml、ESR 96 mm/h。10月26日细菌血培养为产丝氨酸碳青霉烯酶(KPC)的CRKP (药敏见表1)。导管内血培养阴性。临床药师对导管相关感染进行评估:患者导管处皮肤干燥,无渗液,考虑血流感染与多囊肝伴发的感染可能性更大。药敏结果示病原菌对氨基糖苷类药物敏感。经确认,患者本人及家族成员无氨基糖苷类药物的过敏史与不良反应史。临床药师建议:选择美罗培南联合敏感药物阿米卡星抗感染治疗。美罗培南剂量增加至0.5 g每12 h给药1次,延长滴注时间至2 h。阿米卡星首次剂量给予0.8 g,维持剂量0.2 g,于每次透析后给药,滴注时间不少于30 min。
表 1 患者肺炎克雷伯菌血培养和药敏结果抗生素 敏感度(mg/L) 抗生素 敏感度(mg/L) 复方新诺明 ≤20敏感 美罗培南 ≥16耐药 粘菌素 ≤0.5敏感 亚胺培南 ≥16耐药 替加环素 ≥8耐药 氨曲南 ≥64耐药 米诺环素 ≥16耐药 头孢泊肟酯 ≥32耐药 多西环素 ≥16耐药 头孢哌酮舒巴坦 ≥64耐药 左氧氟沙星 ≥8耐药 头孢他啶 ≥32耐药 环丙沙星 ≥4耐药 哌拉西林他唑巴坦 ≥128耐药 妥布霉素 ≤1敏感 替卡西林克拉维酸钾 ≥128耐药 阿米卡星 ≤2敏感 10月27日,患者体温恢复正常,病情缓解,查体:T 35.9 ℃、P 60次/min、R 16次/min、BP 148/93 mmHg。10月29日WBC 5.7×109/L、N% 59%、CRP 30.25 mg/L、PCT 3.92 ng/ml、ESR 67 mm/h。10月30日,患者血培养结果阴性,病情平稳,未诉不适。11月4日,患者体温、炎性指标等检测指标均正常,在院期间,患者未出现头晕、耳鸣等不良反应。11月8日,患者遵医嘱出院。两周后电话随访,患者未再出现发热。
2. 讨论
2.1 氨基糖苷类药物在CRKP-BSI中的治疗地位
CRKP是一类具有较厚荚膜且大多数存在菌毛的
${\rm{G}}^- $ 菌,较厚的荚膜与高耐药性相关[2]。近5年来,CRKP的抗菌治疗一般局限于头孢他啶/阿维巴坦、美罗培南/维博巴坦、多粘菌素、替加环素、磷霉素、碳青霉烯类以及氨基糖苷类等药物[3-7]。氨基糖苷类药物因存在神经毒性和肾毒性,较少用于一线治疗,因此对许多耐药菌仍有一定的敏感性,常常用于耐药${\rm{G}}^- $ 菌的联合治疗。多项研究表明,氨基糖苷类与β-内酰胺类药物联合治疗${\rm{G}}^- $ 菌感染的休克患者时,尤其以碳青霉烯类药物为基础的联合方案与任何一种单药治疗方案相比可显著降低患者病死率[8-9, 10-11]。根据药敏结果,药师建议美罗培南抗感染治疗联合药敏敏感且价格低廉的阿米卡星作为治疗方案。阿米卡星可破坏KP胞浆膜的完整性,通过抑制致病菌蛋白质的合成发挥抑菌作用,对KP的敏感率为85.7%[12]。2.2 规律血液透析(HD)患者阿米卡星剂量如何调整
2.2.1 氨基糖苷类药物药动学/药效学(PK/PD)特点及给药方式
氨基糖苷类药物是浓度依赖性的静止期杀菌剂,有3个PK/PD特点:①预测疗效的PK/PD指标主要为血药峰浓度/最小抑菌浓度(cmax/MIC)≥8~10[13]或0~24 h药时曲线下面积/最小抑菌浓度(AUC0~24/MIC) ≥100[14];②抗菌药物后效应(PAE)较长,阿米卡星对KP的PAE>12 h[15];③有耐药适应性,即接触药物暴露后细菌杀灭率降低,可能是细菌对药物的摄取下调导致的[9]。氨基糖苷类药物最理想的体内过程,是获得高的cmax,以及一段时间的无药期,以减少适应耐药性。这是氨基糖苷类药物提高给药剂量、延长给药间隔的理论基础。对于肾脏功能正常的人群,氨基糖苷类药物推荐的给药方式多为每日剂量一次给予[9, 14]。
2.2.2 氨基糖苷类药物HD患者的给药时机选择
氨基糖苷类药物是中等分子量(465~600)的化合物,蛋白结合低,分布体积较小。HD可以有效清除氨基糖苷类药物。HD患者,传统的给药方式是首剂给予肾功能正常患者的推荐剂量,每次透析后补充正常剂量的一半。有新的观点提倡,每次HD之前给予正常剂量[16-17],或在透析过程中给药,以获得体内较高的cmax,随后由透析过程将体内药物浓度降低。但是这种给药方式也有局限性:①必须依赖于准确的HD疗程将药物浓度降低,否则,会导致药物蓄积,加重不良反应。②对于可能因意外情况而中断HD的患者以及不能进行血药浓度监测的医疗机构,有一定的风险。③HD患者无法完全排出体内的氨基糖苷类药物,不存在无药期,不能减少细菌获得性耐药产生[18]。临床药师结合本例患者的癫痫病史,且我院尚未开展阿米卡星血药浓度监测的实际情况,仍建议选择传统的透析后补充低剂量的策略,医生采纳。
2.2.3 阿米卡星HD患者给药剂量计算
根据桑德福《抗微生物指南》(第48版)推荐,阿米卡星尿毒症患者行血液透析的给药方案为:①2次/d给药方案:7.5 mg/kg,间隔48 h再次给药,做透析后额外增加3.75 mg/kg。②1次/d给药方案:首剂(推荐剂量15 mg/kg),间隔72 h+透析后额外补充3 mg/kg。根据PK/PD理论,本例患者选择1次/d的给药方式。
Hideo[19]等对阿米卡星PK/PD评价发现:对于MIC≤2 mg/L,10 mg/kg可获得>90%的治疗目标。本例患者校正体重68.8 kg,负荷剂量选择10 mg/kg给药,给药剂量0.69 g。根据制剂规格0.2 g/支,给予0.8 g(11.6 mg/kg),每日一次。维持剂量:每周一、三、五规律血透,每次透析后给药0.2 g(3 mg/kg)。患者用药后,第2天体温下降至正常。
2.3 尿毒症患者使用阿米卡星安全性及相关监护指标
氨基糖苷类药物可导致听觉、前庭毒性和肾脏毒性以及神经肌肉阻滞。氨基糖苷类耳毒性发生率为15%~20%,通常表现为听力下降或损失,以及前庭损害,同时使用其他肾毒性药物时[20],须关注耳毒性反应。
氨基糖苷类药物存在肾损害、神经肌肉病、食物中毒、低钙血症,同时使用肌松药时,需关注可能出现呼吸衰竭等严重不良反应[21]。神经肌肉阻滞的发生与滴速有关,滴注时间至少30 min以上。本例患者未出现听力损伤及神经肌肉阻滞不良反应。
-
[1] WANG D W, HU B, HU C, et al. Clinical characteristics of 138 hospitalized patients with 2019 novel coronavirus-infected pneumonia in Wuhan, China[J]. JAMA,2020. [2] ZHOU P, YANG X L, WANG X G, et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin[J]. Nature,2020,579(7798):270-273. doi: 10.1038/s41586-020-2012-7 [3] ZHU N, ZHANG D Y, WANG W L, et al. A novel coronavirus from patients with pneumonia in China, 2019[J]. N Engl J Med,2020,382(8):727-733. doi: 10.1056/NEJMoa2001017 [4] WU F, ZHAO S, YU B, et al. A new coronavirus associated with human respiratory disease in China[J]. Nature,2020,579(7798):265-269. doi: 10.1038/s41586-020-2008-3 [5] 王君平.《新型冠状病毒肺炎诊疗方案(试行第七版)》公布, 清肺排毒汤入选抗疫, 中医药添加新力量[N].人民日报, 2020-03-12(13). [6] 路俊仙, 梁瑞雪, 林慧彬. 金银花抗流感病毒作用研究进展[J]. 现代中药研究与实践, 2018, 32(5):77-81. [7] 贾伟, 毛淑敏, 张盼盼, 等. 金银花多糖体内抗病毒作用研究[J]. 辽宁中医药大学学报, 2018, 20(6):25-27. [8] ZHOU Z, LI X H, LIU J X, et al. Honeysuckle-encoded atypical microRNA2911 directly targets influenza A viruses[J]. Cell Res,2015,25(1):39-49. doi: 10.1038/cr.2014.130 [9] WEI W Y, DU H X, SHAO C Y, et al. Screening of antiviral components of Ma Huang Tang and investigation on the Ephedra alkaloids efficacy on influenza virus type A[J]. Front Pharmacol,2019,10:961. doi: 10.3389/fphar.2019.00961 [10] HYUGA S, HYUGA M, OSHIMA N, et al. Ephedrine alkaloids-free Ephedra Herb extract: a safer alternative to Ephedra with comparable analgesic, anticancer, and anti-influenza activities[J]. J Nat Med,2016,70(3):571-583. doi: 10.1007/s11418-016-0979-z [11] 扬克文, 张军. 黄芩根中抗流感A(H3N2)和B病毒的黄酮类成分5,7,4′-羟基-8-甲氧基黄酮[J]. 国外医学(中医中药分册), 1996, 18(3):46. [12] CHEN F, CHAN K H, JIANG Y, et al. In vitro susceptibility of 10 clinical isolates of SARS coronavirus to selected antiviral compounds[J]. J Clin Virol,2004,31(1):69-75. doi: 10.1016/j.jcv.2004.03.003 [13] 吴彤, 牛姝力, 白梅. 黄芩苷对流感病毒PR8感染小鼠内质网应激反应的干预作用[J]. 中国病原生物学杂志, 2017, 12(6):553-556, 559. [14] DING Y, DOU J, TENG Z J, et al. Antiviral activity of baicalin against influenza A (H1N1/H3N2) virus in cell culture and in mice and its inhibition of neuraminidase[J]. Arch Virol,2014,159(12):3269-3278. doi: 10.1007/s00705-014-2192-2 [15] SU Z Z, DOU J, XU Z P, et al. A novel inhibitory mechanism of baicalein on influenza A/FM1/1/47(H1N1) virus: interference with mid-late mRNA synthesis in cell culture[J]. Chin J Nat Med,2012,10(6):415-420. [16] HOUR M J, HUANG S H, CHANG C Y, et al. Baicalein, ethyl acetate, and chloroform extracts of Scutellaria baicalensis inhibit the neuraminidase activity of pandemic 2009 H1N1 and seasonal influenza A viruses[J]. Evid Based Complement Alternat Med,2013,2013:750803. [17] SU W, XU H F, HANG H. In vitro anti-influenza A H1N1 effect of extract of Bupleuri Radix[J]. Immunopharmacol Immunotoxicol,2011,33(3):433-437. doi: 10.3109/08923973.2010.527985 [18] 张美玲, 李峰, 王聪聪, 等. 连翘抗病毒作用研究进展[J]. 辽宁中医药大学学报, 2016, 18(10):130-132. [19] 陈杲, 广慧敏, 李立, 等. 连花清瘟颗粒/胶囊治疗甲型H1N1流感作用机理的网络生物学分析[J]. 中医杂志, 2014, 55(8):703-707. [20] 段林建, 张清, 王农荣, 等. 连翘苷对甲型流感病毒核蛋白基因表达的影响研究[J]. 中国全科医学, 2012, 15(18):2082-2084. [21] WANG X F, HAO O M, WANG W L, et al. Evaluation of the use of different solvents to extract the four main components of Yinqiaosan and their in vitro inhibitory effects on influenza-A virus[J]. Kaohsiung J Med Sci,2010,26(4):182-191. doi: 10.1016/S1607-551X(10)70027-9 [22] 罗旋, 沈霞, 胡本祥. 基于分子对接方法进行金银花、连翘抗流感病毒H7N9的研究[J]. 现代中医药, 2016, 36(2):75-78. [23] 黄筱钧. 甘草体外抗呼吸道合胞病毒的作用及机制[J]. 中国老年学杂志, 2015, 35(9):2315-2317. doi: 10.3969/j.issn.1005-9202.2015.09.005 [24] NOMURA T, FUKUSHI M, ODA K, et al. Effects of traditional kampo drugs and their constituent crude drugs on influenza virus replication in vitro : suppression of viral protein synthesis by glycyrrhizae Radix[J]. Evid Based Complement Alternat Med,2019,2019:3230906. [25] LIU F, CAO W, DENG C, et al. Polyphenolic glycosides isolated from Pogostemon cablin (Blanco) Benth. as novel influenza neuraminidase inhibitors[J]. Chem Cent J,2016,10:51. doi: 10.1186/s13065-016-0192-x [26] LI Y C, PENG S Z, CHEN H M, et al. Oral administration of patchouli alcohol isolated from Pogostemonis Herba augments protection against influenza viral infection in mice[J]. Int Immunopharmacol,2012,12(1):294-301. doi: 10.1016/j.intimp.2011.12.007 [27] 王意忠, 崔晓兰, 高英杰, 等. 栀子提取物抗病毒试验研究[J]. 中国中药杂志, 2006, 31(14):1176-1178. doi: 10.3321/j.issn:1001-5302.2006.14.013 [28] 王刚, 孙丹丹, 耿子凯, 等. 穿心莲抗病毒作用研究进展[J]. 辽宁中医药大学学报, 2019, 21(7):108-111. [29] 王思源, 平静, 谢宁, 等. 穿心莲内酯磺化物体外抗流感病毒药效学研究[J]. 中南药学, 2013, 11(5):331-334. doi: 10.7539/j.issn.1672-2981.2013.05.003 [30] 冯晓敏. 喜炎平注射液联合扎那米韦治疗甲型H1N1流感的临床研究[J]. 北方药学, 2017, 14(2):119-120. doi: 10.3969/j.issn.1672-8351.2017.02.103 [31] 季晓, 宣槐斌, 黄宝康. 明党参活性成分及药理作用研究进展[J]. 药学实践杂志, 2015, 33(2):102-105, 137. doi: 10.3969/j.issn.1006-0111.2015.02.002 [32] QUAN F S, COMPANS R W, CHO Y K, et al. Ginseng and Salviae herbs play a role as immune activators and modulate immune responses during influenza virus infection[J]. Vaccine,2007,25(2):272-282. doi: 10.1016/j.vaccine.2006.07.041 [33] 李钦, 胡继宏, 高博, 等. 黄芪多糖在免疫调节方面的最新研究进展[J]. 中国实验方剂学杂志, 2017, 23(2):199-206. [34] 王玉凤, 凤良元, 鄢顺琴, 等. 楮实子对环磷酰胺致免疫功能低下小鼠免疫功能的影响[J]. 中华中医药学刊, 2008, 26(5):1023-1025. [35] 韩锐, 贾立华, 刘泽源, 等. 几种常见免疫抑制剂的研究进展[J]. 中国药业, 2011, 20(13):1-4. doi: 10.3969/j.issn.1006-4931.2011.13.001 [36] 李覃, 陈虹, 梅昕, 等. 青蒿素的免疫抑制作用及其调控机制研究[J]. 中国药理学通报, 2011, 27(6):848-854. doi: 10.3969/j.issn.1001-1978.2011.06.026 [37] 陈秋莹, 詹剑华. 中药免疫调节作用及其研究进展[J]. 江西医药, 2019, 54(2):181-184. [38] 李玉卿, 朱月春, 赵文娟, 等. 三七总皂苷免疫调节作用研究进展[J]. 云南中医中药杂志, 2015, 36(6):96-98. [39] LEMMON H R, SHAM J, CHAU L A, et al. High molecular weight polysaccharides are key immunomodulators in North American ginseng extracts: characterization of the ginseng genetic signature in primary human immune cells[J]. J Ethnopharmacol,2012,142(1):1-13. doi: 10.1016/j.jep.2012.04.004 [40] 毛淑敏, 许家珍, 焦方文, 等. 金银花多糖对免疫低下小鼠免疫功能的影响[J]. 辽宁中医药大学学报, 2016, 18(2):18-20. [41] 侯会娜, 曾耀英, 黄秀艳, 等. 金银花提取物对小鼠淋巴细胞体外活化与增殖的影响[J]. 免疫学杂志, 2008, 24(2):178-180, 183. doi: 10.3969/j.issn.1000-8861.2008.02.016 [42] 李立, 杜雅薇, 寇爽, 等. 金银花、连翘对甲型H1N1流感免疫调节通路影响的生物信息学分析[J]. 中国实验方剂学杂志, 2017, 23(10):201-204. [43] 李玲, 吴佳敏, 欧阳建军, 等. 抗流感病毒性肺炎的有效中药复方筛选及机制研究[J]. 中国免疫学杂志, 2018, 34(8):1168-1173. doi: 10.3969/j.issn.1000-484X.2018.08.009 [44] HUANG C L, WANG Y M, LI X W, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China[J]. Lancet,2020,395(10223):497-506. doi: 10.1016/S0140-6736(20)30183-5 [45] FANG Y C, ZHANG H Q, XU Y Y, et al. CT manifestations of two cases of 2019 novel coronavirus (2019-nCoV) pneumonia[J]. Radiology,2020,295(1):208-209. doi: 10.1148/radiol.2020200280 [46] LIU Q, ZHOU Y H, YANG Z Q. The cytokine storm of severe influenza and development of immunomodulatory therapy[J]. Cell Mol Immunol,2016,13(1):3-10. doi: 10.1038/cmi.2015.74 [47] 操秀英, 杨朝晖. 中药治疗新冠肺炎在动物模型上证实有效——总书记关心的科研攻关进展(一)[N]. 科技日报, 2020-03-05(2). [48] JI Y, WANG T, WEI Z F, et al. Paeoniflorin, the main active constituent of Paeonia lactiflora roots, attenuates bleomycin-induced pulmonary fibrosis in mice by suppressing the synthesis of type I collagen[J]. J Ethnopharmacol,2013,149(3):825-832. doi: 10.1016/j.jep.2013.08.017 [49] 宋亚玲, 王红梅, 倪付勇, 等. 金银花中酚酸类成分及其抗炎活性研究[J]. 中草药, 2015, 46(4):490-495. doi: 10.7501/j.issn.0253-2670.2015.04.006 [50] PARK K I, KANG S R, PARK H S, et al. Regulation of proinflammatory mediators via NF-κB and p38 MAPK-dependent mechanisms in RAW 264.7 macrophages by polyphenol components isolated from Korea Lonicera japonica THUNB[J]. Evid - Based Complementary Altern Med,2012,2012:1-10. 期刊类型引用(4)
1. 孙慧珠,王晓蕾,刘永利. UPLC/MS/MS法同时测定肾衰宁胶囊中9种成分及一致性分析. 中成药. 2023(01): 29-34 .  百度学术
百度学术2. 张芦燕,杨洁,钱一鑫,王庆. 基于HPLC法和指纹图谱的桑菊感冒片质量评价研究. 医学信息. 2023(07): 139-142 .  百度学术
百度学术3. 周辉. 海昆肾喜胶囊联合肾衰宁胶囊对肾衰竭患者肾功能及炎性因子的影响. 临床合理用药. 2023(11): 116-118 .  百度学术
百度学术4. 曹舒兴,宋永周,王进. 肾衰宁片的HPLC特征图谱及9个成分的含量测定. 药物分析杂志. 2023(07): 1172-1182 .  百度学术
百度学术其他类型引用(0)
-

 点击查看大图
点击查看大图
计量
- 文章访问数: 10519
- HTML全文浏览量: 3067
- PDF下载量: 94
- 被引次数: 4




 下载:
下载:
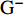

 下载:
下载:
