-
2019年12月,武汉市出现多例不明原因的病毒性肺炎病例,病例临床表现主要为发热、咳嗽,少数病人腹泻、呕吐、呼吸困难,胸片呈双肺浸润性病灶[1]。2020年2月11日,世界卫生组织将该病命名为新型冠状病毒肺炎(corona virus disease 2019,COVID-19),并称引起该病的病毒为SARS-CoV-2,与成年人相比,儿童更不易感染该病毒,65岁以上老年人更易受感染[2]。目前全球疫情愈演愈烈,国内用了两个多月控制住疫情,中医药做出了巨大贡献,但部分地区输入性病例和无症状感染者不断增加,寻找相应的群体性配方,是当前一项十分紧迫的研究任务。据古文献记载,加上黄煌教授临床经验和近期的个案报道,建议可以采用两首古代相传的治疗时令病的经验成方——荆防败毒散和十神汤,作为群体性预防用方[3]。
荆防败毒散,出自《摄生众妙方》,由荆芥、防风、羌活、独活、柴胡、前胡、川芎、枳壳、茯苓、桔梗、甘草等十一味中药组成,已上市的中成药包括荆防颗粒、荆防合剂。临床研究表明,荆防败毒散能缓解发热、咳嗽、喘息与肺部啰音等作用,调节机体炎症因子和细胞免疫状况,增强机体的免疫功能[4-6]。现代药理学研究证明其具有解热、镇痛和抗炎的作用[7]。
本文通过网络药理学筛选出荆防败毒散作用靶点,并进行聚类分析,预测荆防败毒散中核心活性成分,进而运用分析软件对药材-成分-靶点进行分子对接及信号通路分析,并预测其治疗COVID-19的作用机制,为荆防败毒散用于预防及治疗COVID-19的可能性提供理论参考。
-
借助中药系统药理分析平台(TCMSP,http://tcmspw.com/tcmsp.php)[8],分别以荆芥、防风、羌活、独活、柴胡、前胡、川芎、枳壳、茯苓、桔梗、甘草为关键词搜索荆防败毒散中的成分。本研究结合口服生物利用度(OB≥30%)和类药性(DL≥0.18),筛选收集到的化学成分,并结合《中国药典》2015年版中药物的含量测定项对已筛选的成分进行补充,最终建立荆防败毒散的成分库。
-
经OB和DL筛选合格的成分,在TCMSP数据库对其成分靶点进行收录。对未在TCMSP中收录靶点的成分,在PubChem查询成分对应的Canonical SMILES序列,并利用此序列在SwissTarget数据库[9](http://www.swisstargetprediction.ch/)中对该成分的靶点进行预测,收集预测结果中的靶标蛋白基因名称。最后对收集的所有靶点在Unitprot数据库[10](http://www.Unitprot.org/)输入蛋白名称并限定来源为Homo sapiens,获取官方基因名作为荆防败毒散的靶点库。通过Cytoscape 3.6.1软件,构建荆防败毒散药材-成分-靶点网络,分析成分和靶点网络。
-
在CTD、NCBI和GeneCards数据库中,以“COVID-19”、“novel coronavirus pneumonia”等检索词检索,检索时间为2020年7月13日。将检索结果合并、去重,获取新冠肺炎疾病相关基因,并把相关基因编码的蛋白质作为药物治疗的潜在作用靶点。
-
将荆防败毒散成分的靶点与COVID-19靶点分别导入String数据库,获取荆防败毒散成分靶点和COVID-19靶点的蛋白-蛋白相互作用(PPI)关系,通过Cytoscape软件Merge功能,取两者交集,挖掘关键靶点网络。
-
为了进一步了解上述筛选出的靶标蛋白基因的功能及在信号通路中的作用,将筛选得到的作用靶点导入Metascape数据库[11](https://metascape.org/),通过输入靶基因名称列表并限定物种为人,进行GO(gene ontology)生物过程(BP,Biological Process)、细胞组成(CC,cellular component)、分子功能(MF,molecular function)富集分析和KEGG(kyoto encyclopedia of genes and genomes)信号通路富集分析,并利用R 4.0.0软件将其结果可视化。
-
从ZINC数据库[12](http://zinc.docking.org/)下载Degree值前10成分的mol2格式文件,用Autodock Tool软件打开该成分,使其能量最小化并判定成分的Root、选定可扭转的键,保存为*pdbqt格式文件。从PDB数据库[13](https://www.rcsb.org/)下载SARS-CoV-2 3CL水解酶(Mpro,PDB ID: 6LU7)和血管紧张素转化酶II(ACE2,PDB ID: 1R42)的3D结构PDB格式文件[14-15],运用Pymol软件移除靶蛋白中的配体和非蛋白分子(如水分子),再保存为PDB格式文件。随后用Autodock Tool软件打开的PDB文件,加氢、计算电荷并给蛋白添加原子类型(Assign AD4 type),将其保存为*pdbqt格式文件[16]。
运用Autodock Vina将成分和受体对接。结合能小于0说明配体与受体可以自发结合,目前对于活性分子的靶点筛选尚无统一标准,本文根据结合能进行排序,结合能数值的绝对值越大,对接结果较好,该成分可视为荆防败毒散预防COVID-19的潜在活性成分。
-
从TCMSP数据库中搜索荆防败毒散各味药的成分,并依据OB≥30%及DL≥0.18要求,得到最终选定的结果为187个不同的成分(28个无已知靶点),其中荆芥11个、防风18个、羌活15个、独活9个、柴胡17个、前胡24个、川芎7个、枳壳5个、茯苓15个、桔梗7个、甘草92个。筛选后的荆防败毒散中部分活性成分的基本信息见表1。
表 1 荆防败毒散中部分活性成分的基本信息
成分名称 MOL ID MW OB (%) DL 药味归属 β谷甾醇 MOL000358 414.79 36.91 0.75 荆芥、防风、羌活、前胡、独活、枳壳 谷甾醇 MOL000359 414.79 36.91 0.75 荆芥、防风、羌活、前胡、川芎、甘草 槲皮素 MOL000098 302.25 46.43 0.28 荆芥、柴胡、前胡、甘草 异欧前胡素 MOL001942 270.30 45.46 0.23 防风、前胡、羌活、独活 欧前胡素 MOL001941 270.30 34.55 0.22 防风、前胡、羌活、独活 紫花前胡苷 MOL004792 408.44 57.12 0.69 羌活、独活、前胡 柚皮素 MOL004328 272.27 59.29 0.21 枳壳、甘草 异鼠李素 MOL000354 316.28 49.60 0.31 柴胡、甘草 豆甾醇 MOL000449 412.77 43.83 0.76 荆芥、柴胡 亚油酸乙酯 MOL001494 308.56 42.00 0.19 防风、川芎 山奈酚 MOL000422 286.25 41.88 0.24 柴胡、甘草 紫花前胡素 MOL013077 328.39 39.27 0.38 防风、前胡 木犀草素 MOL000006 286.25 36.16 0.25 荆芥、桔梗 甘草酚 MOL002311 366.39 90.78 0.67 甘草 宽叶甘松酸 MOL013098 328.39 87.48 0.37 前胡 Divaricate acid MOL011737 320.32 87.00 0.32 防风 甘草吡喃
香豆素MOL004904 384.41 80.36 0.65 甘草 shinpterocarpin MOL004891 322.38 80.30 0.73 甘草 芒柄花黄素 MOL000392 268.28 69.67 0.21 甘草 xambioona MOL005018 388.49 54.85 0.87 甘草 丹参酮IIA MOL007154 294.37 49.89 0.40 前胡 异甘草酚 MOL004948 366.39 44.70 0.84 甘草 去氢齿孔酸 MOL000300 453.75 44.17 0.83 茯苓 7-甲氧基-2-甲基异黄酮 MOL003896 266.31 42.56 0.20 甘草 美迪紫檀素-3-O-葡萄糖苷 MOL004924 432.46 40.99 0.95 甘草 过氧化麦角
甾醇MOL000283 430.74 40.36 0.81 茯苓 去氢茯苓酸 MOL000276 526.83 35.11 0.81 茯苓 茯苓酸 MOL000289 528.85 33.63 0.81 茯苓 kanzonol F MOL004988 420.54 32.47 0.89 甘草 汉黄芩素 MOL000173 284.28 30.68 0.23 防风 -
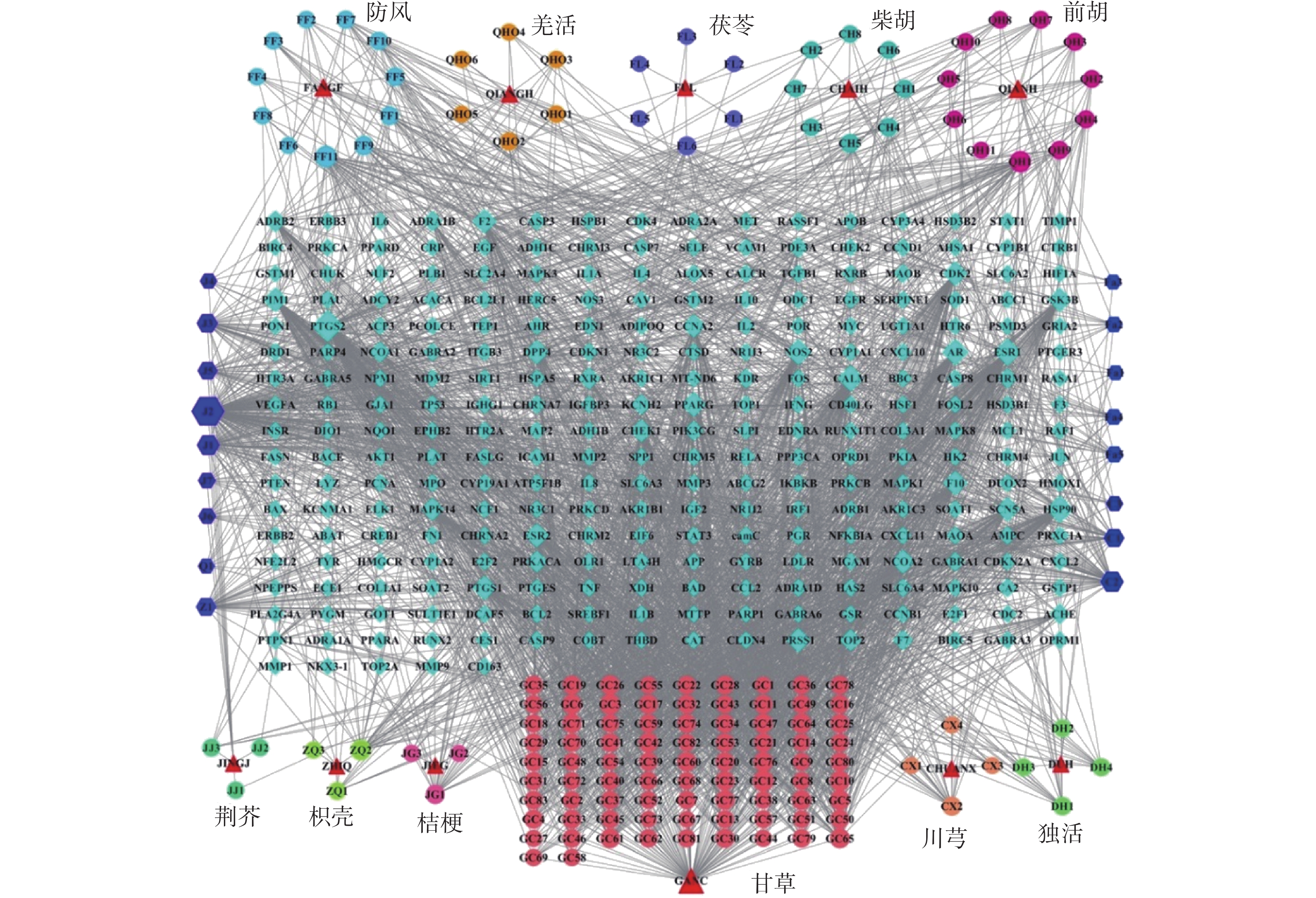
利用Cytoscape软件进行“荆防败毒散药材-成分-靶点”网络的构建,网络共包括447个节点(11种药材节点、159个成分节点、277个靶点节点)和2718条边,如图1所示,其中形状“△”代表药材,“〇”代表成分,“◇”代表基因,每条边则表示药材中所含成分及成分与靶点相互作用关系。性状的大小代表Degree值的大小。按照Degree值,排名前10位的成分分别是槲皮素、山奈酚、木樨草素、汉黄芩素、β-谷甾醇、7-甲氧基-2甲基异黄酮、丹参酮IIA、柚皮素、芒柄花黄素、异鼠李素。
-
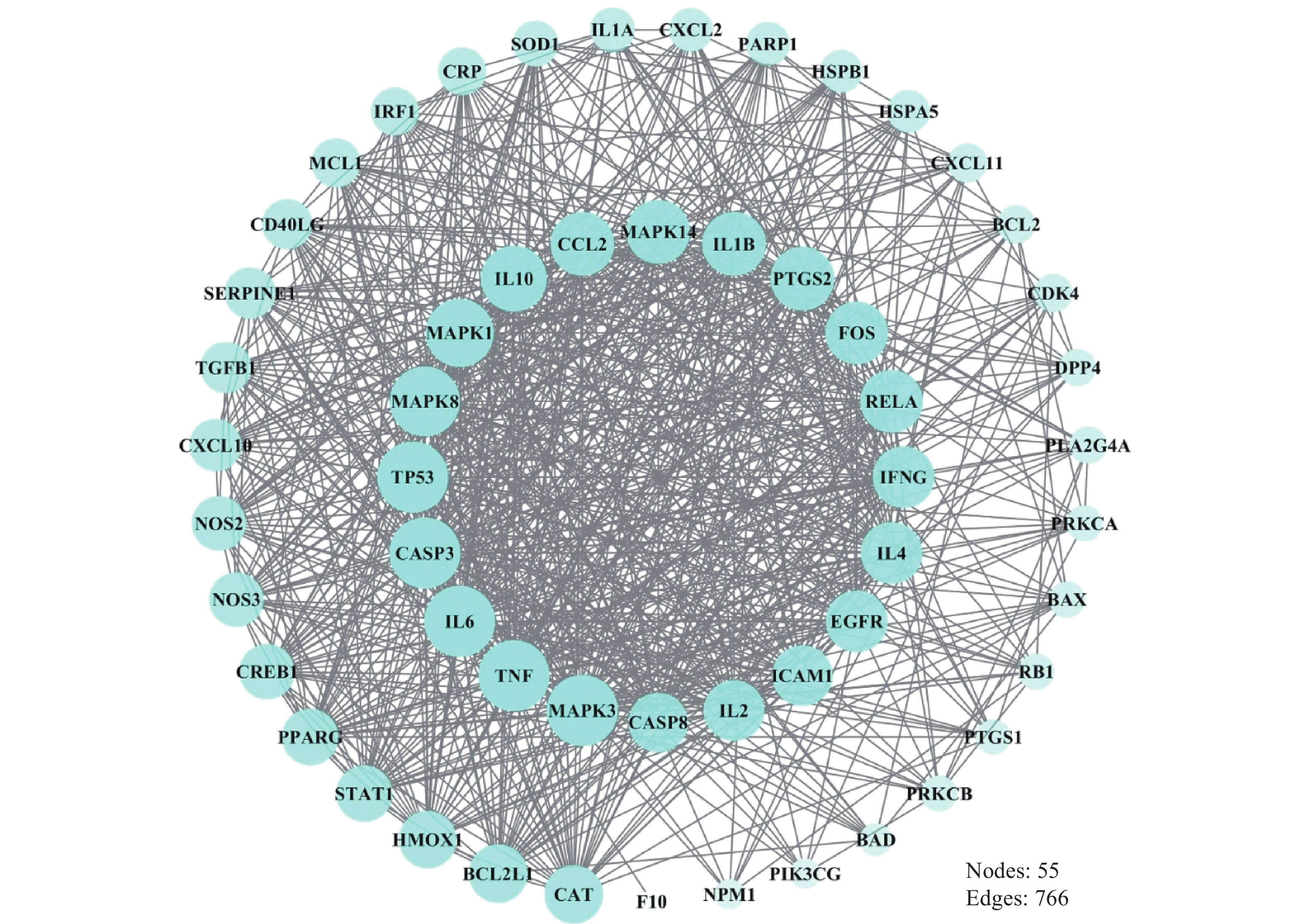
在数据库中检索并筛选得到COVID-19相关的273个靶点,将273个疾病靶点和277个荆防败毒散活性成分的作用靶点导入String数据库,得到靶点PPI关系,利用Cytoscape软件将两者进行Merge取交集处理,得到包含55个靶点和766条边的Hub网络,见图2。按照Degree值从高到低,Hub网络中排名前10位的靶点分别为MAPK3、TNF、IL6、CASP3、TP53、MAPK8、MAPK1、IL10、CCL2、MAPK14。
-
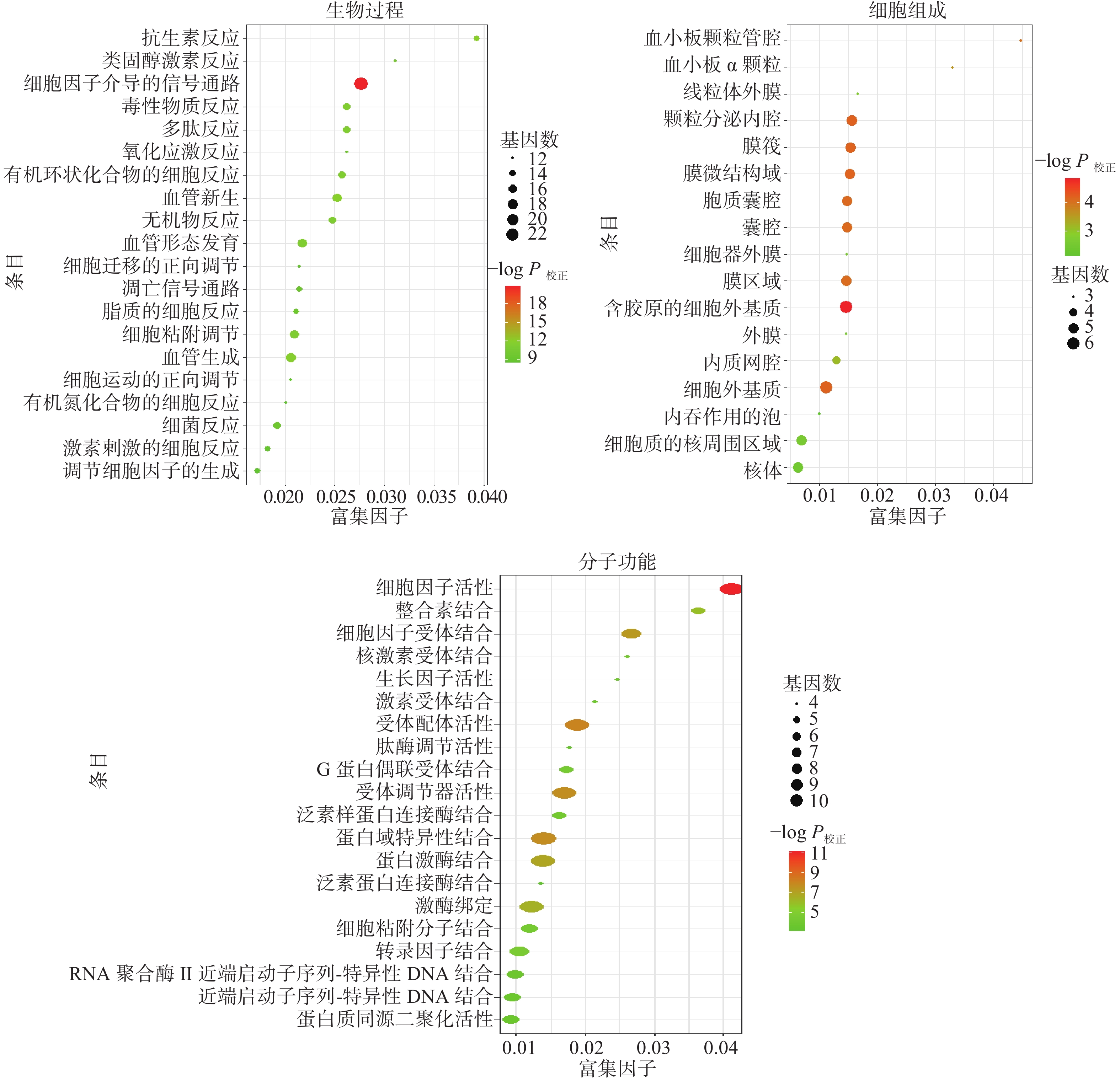
通过Metascape数据库进行的GO功能富集分析得到GO条目1376个(P<0.01),其中BP条目1304个,包括细胞因子和凋亡信号、刺激反应、多生物过程、免疫过程、细胞代谢、生物进程调控等;CC条目19个,包括细胞膜、细胞器膜、基质、转录因子等;MF条目53个,包括酶活性和酶结合、细胞因子活性和结合能力、转录因子结合、蛋白特异性结合等各类别分析中排名前20位的条目,见图3。
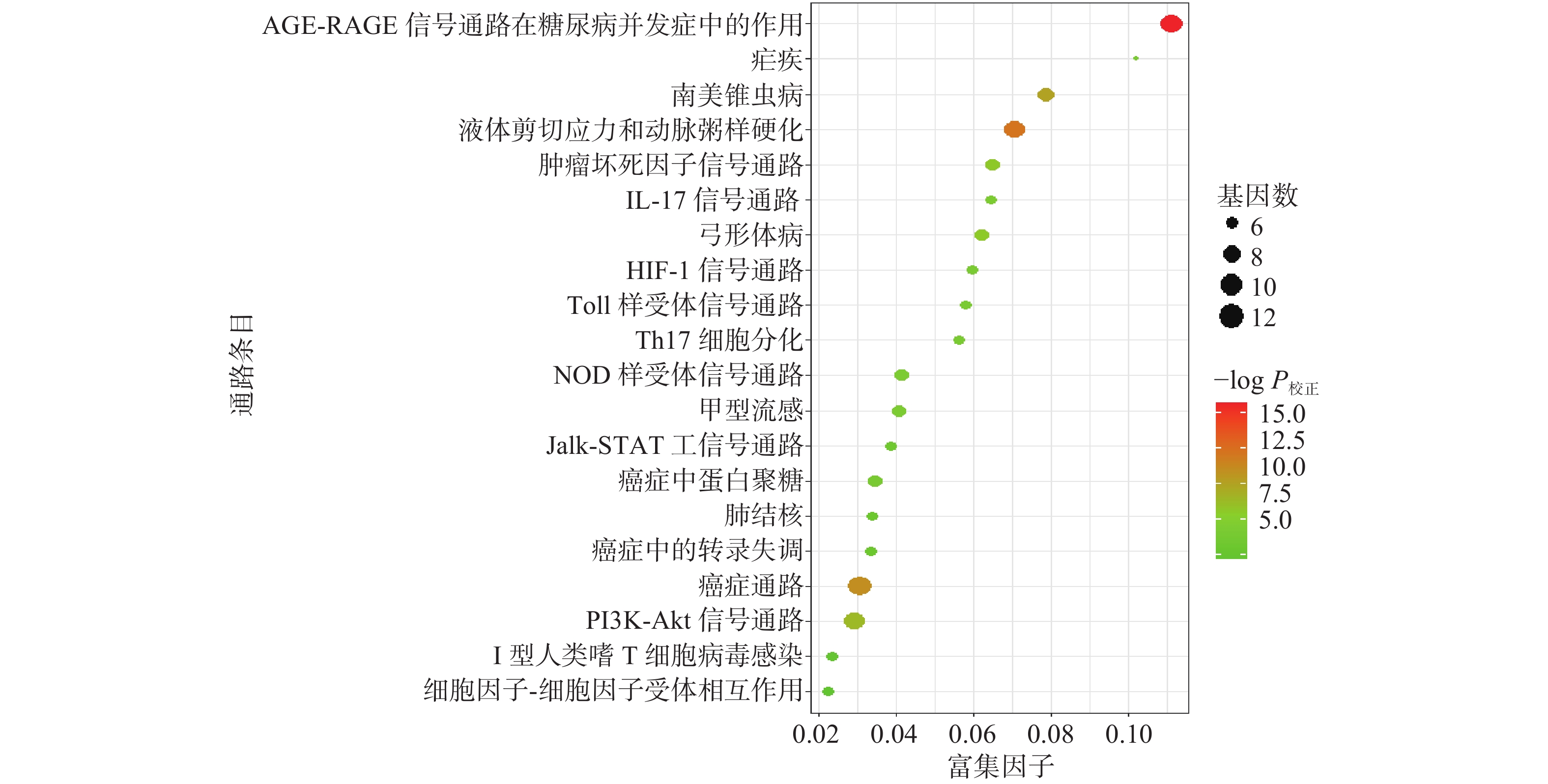
KEGG通路富集分析筛选得到136条(P<0.01)通路,涉及与寄生虫、真菌、病毒感染引起的疾病通路有22条(如朊病毒、甲型流感、人类嗜T淋巴细胞病毒I型感染、丙肝、肺结核、疟疾、百日咳等)、癌症相关的通路17条(如非小细胞肺癌、小细胞肺癌、黑色素瘤、癌症中碳代谢、转录失调等)、细胞进程、免疫系统进程、信号通路等。选Count值较大的前20条通路进行可视化,结果见图4。
-
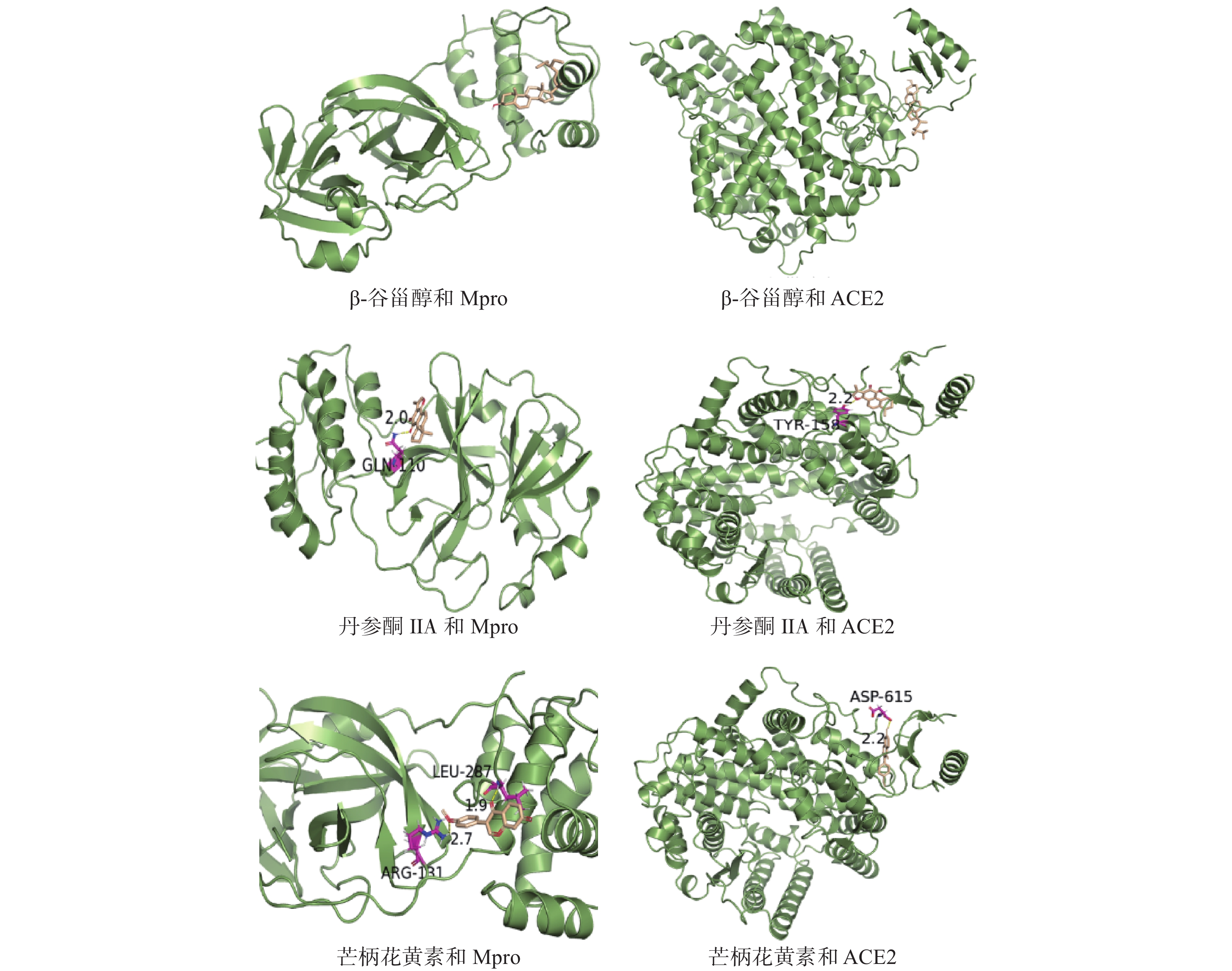
将荆防败毒散中排序前10的核心成分分别与Mpro、ACE2受体进行分子对接。一般认为配体与受体结合的构象稳定时能量越低,发生的作用可能性越大,结合能≤–5.0 kJ/mol作为筛选标准,结合能≤–20.93 kJ/mol时则视为成分与靶点有较好的活性,结合能≤–29.336 kJ/mol时则结合活性强烈[17]。分子对接结果显示,筛选出的荆防败毒散核心成分与Mpro结合能远小于–20.93 kJ/mol,与ACE2受体结合能远小于–29.336 kJ/mol(见表2)。选择结合能均小于–29.336 kJ/mol的β-谷甾醇、丹参酮IIA、芒柄花黄素,对其与Mpro、ACE2的结合形式进行分析,丹参酮IIA可与Mpro的110位谷氨酰胺(GLN)和ACE2的158位络氨酸(TYR)形成氢键(键长20 nm和22 nm);芒柄花黄素可与Mpro的131位精氨酸(ARG)和287位亮氨酸(LEU)分别形成氢键(键长27 nm和19 nm),与ACE2的615位天冬氨酸(ASP)形成氢键(键长22 nm)。氢键、疏水作用可能是荆防败毒散成分与两个受体主要的结合形式,结果见图5。分子对接结果表明荆防败毒散中活性成分与Mpro、ACE2结合活性较强,与后者的结合能力优于前者。
表 2 荆防败毒散中核心成分与Mpro、ACE2的结合能
成分 CAS号 化学式 结合能(kJ/mol) Mpro ACE2 槲皮素 117-39-5 C15H10O7 −27.21 −34.33 山奈酚 520-18-3 C15H10O6 −27.21 −32.66 木樨草素 491-70-3 C15H10O6 −28.89 −34.33 汉黄芩素 10-29-7 C16H12O5 −27.21 −33.91 7-甲氧基-2-甲基异黄酮 19725-44-1 C17H14O3 −25.96 −32.24 β-谷甾醇 83-46-5 C29H50O −31.40 −36.84 丹参酮IIA 568-72-9 C19H18O3 −30.14 −36.43 异鼠李素 480-19-3 C16H12O7 −27.21 −33.49 芒柄花黄素 485-72-3 C16H12O4 −29.73 −30.14 柚皮素 153-18-4 C15H12O5 −28.47 −33.49 -
突如其来的疫情给人类带来巨大挑战,人类必须努力了解疾病特点,尽快寻找到控制措施[18]。荆防败毒散,由人参败毒散去人参加荆芥、防风而成。以荆芥、防风,羌活、独活发汗解表,开泄皮毛,使风寒之邪随汗而解,为通治一身风寒湿邪的常用组合。柴胡、枳壳、桔梗调畅气机,川芎行血合营,羌活、茯苓化痰渗湿,三组合用,意在解表祛邪与疏通气血津液。甘草调和药性,祛风散寒之力较强,宜于外感风寒湿邪较重者。荆防败毒散治退热效果极佳,用于流行性感冒见效快[19-20]。新冠肺炎疫情属于寒湿疫。因此,基于辨证论治的原则,荆防败毒散可作为群体性预防用药的选择,并对初期轻症(寒湿证)的新冠肺炎有一定治疗效果。
根据KEGG分析,得到136条通路,包括感染性疾病通路、癌症通路、细胞进程通路、免疫系统通路、信号通路等。KEGG前20条通路中,频率最高的靶点为RELA、MAPK1、MAPK3、TNF、IL6。RELA在调节对感染的免疫应答中起关键作用,而且其磷酸化调节作用可抑制肿瘤的发生[21]。丝裂原活化蛋白激酶(MAPK)是信号从细胞表面传导到细胞核内部的重要传递者。TNF在抗肿瘤、抗感染、免疫、炎症等多种生理病理过程中发挥着关键的作用[22]。结果表明荆防败毒散呈现出中药多成分-多靶点-多途径协同作用的特点,通过对上述靶点的作用,调节感染类疾病通路、免疫损伤性、炎症通路,起到防治COVID-19的作用。
ACE2是SARS-CoV和SARS-CoV-2的宿主细胞受体,SARS-CoV-2 通过表达的S-蛋白与人体ACE2结合,导致病毒入侵而致病,这可作为治疗COVID-19的突破口[23-24]。Mpro是单正链RNA病毒前体多聚蛋白水解酶核心部分,将宿主细胞内的病毒RNA翻译成蛋白以产生子代毒,在RNA复制、逆转录过程中具有重要的作用[25-26],抑制Mpro活性将能阻止病毒的感染和复制。通过分子对接,这10个成分与SARS-CoV-2 3CL水解酶的结合能远小于−20.93 kJ/mol,与ACE2受体的结合能远小于−29.336 kJ/mol,与二者结合最好的成分均为β-谷甾醇和丹参酮IIA,结合形式包括氢键、疏水作用。此外,槲皮素、山柰酚、异鼠李素也具有较强的结合能力[27-28]。表明荆防败毒散核心成分与COVID-19相关蛋白有较强的结合能力。
基于上述研究,荆防败毒散对肺部疾病有一定的保护治疗作用,能提高机体免疫力,对COVID-19具有潜在的防治作用,可作为群体性预防用药以及发病初期的治疗。鉴于网络药理学和分子对接的局限性,荆防败毒散防治COVID-19的效果有待临床进一步验证。
Study on active ingredients of Jingfang Baidu San for preventing COVID-19 based on network pharmacology and molecular docking
-
摘要:
目的 运用网络药理学和分子对接方法,预测荆防败毒散预防新型冠状病毒肺炎(COVID-19)的活性成分,为临床用药提供参考。 方法 通过中药系统药理学分析平台,检索荆防败毒散组方中所有药材的化学成分和作用靶点。通过Uniprot数据库校正靶点对应的基因,利用Cytoscape软件构建药材-成分-靶点网络并进行可视化处理,利用疾病数据库检索COVID-19相关的靶点,筛选出重合的靶点,通过String数据库构建蛋白-蛋白相互作用网络。通过Metascape进行GO富集分析和KEGG通路富集分析,预测其作用机制,通过分子对接,计算核心成分在预防新型冠状病毒肺炎的作用强度。 结果 限定筛选条件为口服生物利用度(OB)≥30%、类药性(DL)≥0.18,共得到荆防败毒散的159个活性成分和277个靶点,与获得的273个COVID-19相关的靶点取交集,得到55个核心靶点;对核心靶点进行GO富集分析和KEGG通路富集分析,得到GO条目1376个和136条信号通路,涉及感染性疾病、癌症、细胞进程、免疫系统、信号等通路。分子对接结果显示荆防败毒散核心成分与SARS-CoV-2 3CL水解酶、血管紧张素转化酶II(ACE2)具有较强的结合能力,结合形式有氢键、疏水作用。 结论 荆防败毒散中的活性成分能通过抑制新型冠状病毒(SARS-CoV-2)蛋白,ACE2结合,通过对多靶点、多通路的作用发挥对COVID-19的防治作用。 Abstract:Objective To investigate the active ingredients of Jingfang Baidu San for the prevention and treatment of COVID-19 by using network pharmacology and molecular docking, and to provide references for clinical applications. Methods The chemical constituents and action targets of all medicinal materials in Jingfang Baidu San were retrieved from TCMSP. Uniprot database was used to search the corresponding genes of targets. Cytoscape software was used to construct the network of medicinal materials-compounds-targets for visualization. The target proteins of COVID-19 were searched by disease databases. The intersection of both was considered to be analyzed to establish the protein-protein interaction (PPI) network by STRING database. GO function enrichment analysis and KEGG pathway enrichment analysis were performed through Metascape database to predict its mechanism. The effective strength of core constituents on preventing COVID-19 was calculated by molecular docking method. Results A total of 159 effective ingredients and 277 potential targets were obtained in Jingfang Baidu San within the given screening conditions [oral bioavailability (OB) ≥30%; drug-like (DL) ≥ 0.18], including 55 core targets with the intersection of 273 targets of COVID-19. According to the results of GO and KEGG enrichment analysis performed on the core targets, 1376 GO items and 136 KEGG pathways were obtained, involving infectious diseases, cancer, cell progress, immune system, signaling pathways etc. The results of molecular docking indicated strong binding capacity between the core ingredients and SARS-CoV-2 3CL hydrolase or angiotensin-converting enzyme II (ACE2). The hydrogen binding and hydrophobic effect were the main forms of the interaction. Conclusion The active ingredients in Jingfang Baidu San can inhibit the binding between SARS-CoV-2 protein and ACE2, thus regulating multiple targets and signal pathways, which plays a role in the prevention and the treatment of COVID-19. -
Key words:
- Jingfang Baidu San /
- SARS-CoV-2 /
- COVID-19 /
- network pharmacology /
- molecular docking
-
补体系统是人体重要的免疫防御系统之一,是由30多种广泛存在于血清、组织液和细胞膜表面的蛋白质组成的,具有精密调控机制的蛋白质反应系统,其主要通过3种途径激活:经典途径、旁路途径和甘露糖结合凝集素途径。补体系统正常激活,可在靶细胞上形成膜攻击复合物,导致靶细胞的溶解,补体的这一功能在机体的免疫系统中起重要的防御和免疫监视作用,对抵御外来微生物的入侵和维持机体平衡有重要的作用。然而该系统的过度激活将释放炎性过敏毒素C3a和C5a,具有化学诱导作用的C5a能趋化嗜中性粒细胞、中核细胞和嗜酸性粒细胞,这些细胞释放蛋白酶和具有趋化作用细胞因子,进一步聚集T、B淋巴细胞和其他炎性细胞,从而促进炎症反应的发生,引起系统性红斑狼疮、类风湿性关节炎、动脉粥样硬化、肾小球肾炎等[1-2]。近年来已有研究表明[3],补体系统的激活是类风湿性关节炎中慢性滑膜炎的发病因素之一。因此,抑制补体系统的过度激活可能是治疗类风湿性关节炎的重要机制之一。
三色片为复旦大学附属中山医院的院内制剂,由雷公藤、黄芪和丹参三味药材按1∶1∶1的比例配伍组成,在临床上用于治疗类风湿性关节炎、系统性红斑狼疮、银屑病和湿疹等结缔组织疾病。我院临床医生在长期的医疗实践中总结出来的经验方,效果显著[4]。组方中雷公藤,性味辛寒,有大毒,归肝、肾经,具有清热解毒、活血化瘀、通络止痛、杀虫止痒等功效。现代研究表明,雷公藤内酯醇对大鼠脑皮质内注射β-淀粉酶后补体C1q和C3的表达有抑制作用,表明雷公藤对补体系统有抑制作用,目前临床上广泛用于治疗类风湿性关节炎、系统性红斑狼疮、银屑病和湿疹等结缔组织疾病[5]。组方中的黄芪用于脾肺气血或中气下陷之症、卫气虚所致表虚自汗、气虚血滞导致的肢体麻木、关节痹痛等症,可联合治疗类风湿性关节炎[6]。黄芪在治疗2型糖尿病大鼠的研究中发现其能降低补体C3的水平,表明其对补体系统具有一定的调节作用[7-8]。丹参是最常用的活血化瘀中药之一,具有祛瘀止痛,养血安神的功效,现代药理学研究表明其还具有保护肝脏的功能[9],可拮抗雷公藤的肝毒性。本研究通过经典途径抗补体活性测定方法筛选出三色片醇提物的乙酸乙酯部位抗补体活性最佳,并采用UPLC-Q-TOF-MS法对该部位的化学成分进行结构表征,为三色片抗补体活性药效物质基础及治疗补体过度激活相关疾病提供科学依据。
1. 仪器、试剂与材料
Tripie TOF5600+型四级杆-飞行时间串联质谱仪,配备电喷雾电离源和CDS自动校正系统(美国Applied Biosystems公司);Peak view2.2和Master view1.1数据处理系统(美国Applied Biosystems公司);LC-30A超高效液相色谱仪,包括高压输液泵,自动进样器,柱温箱和在线脱气机(日本岛津公司);KQ5200E型超声清洗器(昆山市超声仪器有限公司);甲醇、乙腈(色谱纯,德国Merck公司);甲酸(色谱纯,美国Sigma-Aldrich公司); 蒸馏水(娃哈哈集团);三色片提取物由作者自制,现样品存放于复旦大学附属中山医院药剂科(SSP2018);补体、溶血素(自制);毛蕊异黄酮(批号:ST088101),雷公藤甲素(批号:ST020501),雷公藤内酯酮(批号:ST049901),丹参酮II A(ST014601)、黄芪甲苷(ST001601)(纯度≥ 98%,均购自上海斯丹德生物技术有限公司)。
2. 方法
2.1 三色片醇提物及各极性部位的制备
雷公藤、黄芪和丹参三味药材按1∶1∶1配伍,其中,黄芪和丹参加6倍量的水浸泡2 h后,煎煮2次,第一次1.5 h,第二次加水4倍量煎煮1 h,煎液滤过,合并滤液并浓缩至相对密度为1.10~1.20(70 ℃),加入2倍量的乙醇,静置沉淀24 h,取上清液备用。雷公藤分别加4倍量的乙醇加热回流2次,每次1.5 h,合并提取液,滤过,加入上述备用药液,混匀,回收乙醇至无醇味,浓缩后即得三色片醇提物,经现有的质量标准检验为制备三色片制剂合格的提取物。精密称取三色片醇提物2.0 g,置于100 ml萃取瓶中,加25 ml蒸馏水溶解后,用等量的石油醚、乙酸乙酯和正丁醇进行萃取,浓缩干燥后,放冷至室温,得到三色片醇提物的石油醚部位0.36 g,乙酸乙酯部位0.42 g,正丁醇部位0.56 g和水溶性部位。
2.2 经典途径的抗补体活性测定
取各极性部位样品2 mg溶于DMSO,采用BBS缓冲液稀释成不同浓度的样品,并加入临界浓度的补体(1∶80稀释的豚鼠血清),溶血素和2%绵羊红细胞(SRBC)。37 ℃水浴30 min,离心后取上清液在405 nm波长下测定吸光度(A)值。同时设置中药对照组(将等量的中药提取物加入BBS缓冲液中,用于测定中药本底A值)、补体组(取临界浓度的补体直接加入适量的BBS缓冲液、溶血素和2%SRBC,用于测定临界浓度补体所造成红细胞溶血的A值)和全溶血组(将2%SRBC加入水中使之全溶血,用于观察补体组是否达到或接近全溶血水平),并以肝素作为阳性对照组,计算溶血抑制率。以供试品浓度为横坐标(X),溶血抑制率为纵坐标(Y),计算CH50(经典途径50%抑制溶血所需供试品浓度)。溶血抑制率=1−(A中药−A中药对照)/A全溶血。
2.3 不同浓度的样品色谱与质谱条件
2.3.1 色谱条件
色谱柱为ACQUITY UPLC BEH C18(2.1 mm×100 mm,1.7 μm);流动相0.1%甲酸和水溶液(A)−乙腈(B);梯度洗脱:0~9 min,10%~23% B;9~13 min,23% B;13~28 min,23%~40% B;28~32 min,40%~50% B;32~37 min,50%~100% B;37~42 min,100% B;42~42.1 min,10%B;42.1~50 min,10% B;流速为0.25 ml/min,柱温为35 ℃;进样量为2 μl。
2.3.2 质谱条件
在正/负离子模式,离子源选择电喷雾离子化源(ESI);使用m/z 50~1250扫描范围;碰撞能量35 eV,碰撞能量叠加(35±15)eV;喷雾电压5 500 V;雾化气温度550 ℃;去簇电压100 V;雾化气和辅助气均为50 psi;气帘气25 psi;数据采集时间50 min;采用母离子触发的子离子(TOF-MS-IDA-MS/MS)扫描方式;多重质量亏损和动态背景扣除为触发二级的条件,满足该条件进行二级扫描。
2.4 对照品溶液的制备
精密称取毛蕊异黄酮、雷公藤甲素、雷公藤内酯酮、丹参酮Ⅱ A和黄芪甲苷对照品1.0 mg,加甲醇2 ml,溶解,摇匀,即得各对照品溶液。
2.5 供试品溶液的制备
取三色片醇提物的乙酸乙酯部位样品0.2 g,置于10 ml量瓶中,加入70%甲醇5 ml,超声处理(功率250 W,频率40 kHz)30 min,放冷至室温,70%甲醇定容至刻度,摇匀,滤过,取续滤液,即得供试品溶液。
2.6 三色片中化学成分数据库的建立
根据三色片中各药材化学成分研究文献,收集3种药材所含化合物成分的基本信息,包括化合物名称、分子式、精确分子量、准分子离子峰和碎片离子峰。通过精确分子量匹配,对照品的保留时间,二级谱所得到的离子碎片与文献报道进行比对,最终确定化合物的结构。
3. 结果与分析
3.1 三色片醇提物各极性部位的抗补体活性
分别对三色片醇提物的石油醚部位、乙酸乙酯部位和正丁醇部位进行经典途径的抗补体活性测定,以肝素为对照品,结果发现乙酸乙酯部位的抗补体活性最好,其抗补体活性略低于肝素钠,其次是正丁醇部位,结果见表1。
表 1 三色片提取物不同部位抗补体活性测定编号 研究对象 抗补体活性(CH50,μg/ml) 1 肝素 14.4±1.2 2 三色片-石油醚部位 − 3 三色片-乙酸乙酯部位 233.9±10.1 4 三色片-正丁醇部位 344.0±14.5 注:“—”表示该部位无抗补体活性。 3.2 三色片醇提物乙酸乙酯部位的UPLC-Q-TOF-MS分析
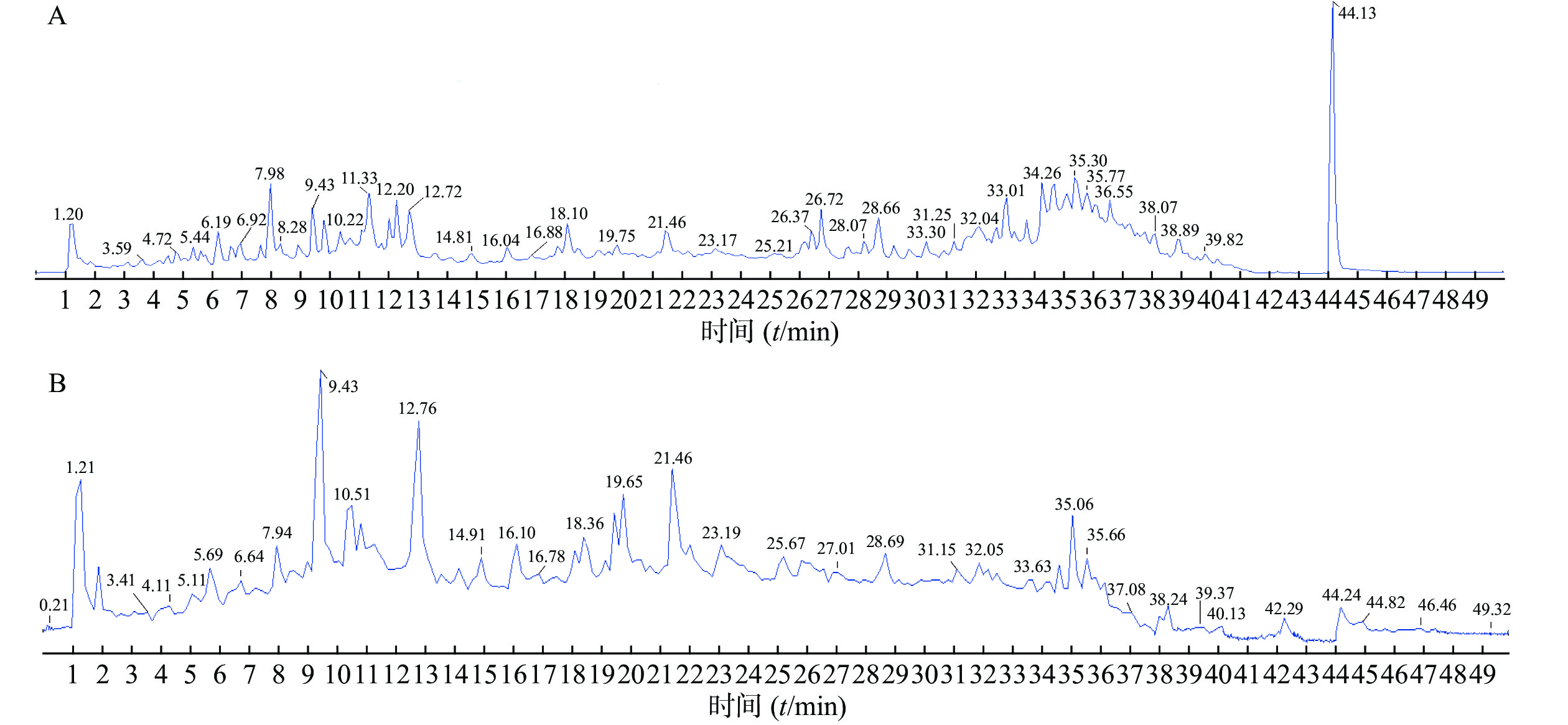
精密吸取对照品溶液和供试品溶液2 μl,采用“2.1”项下的色谱与质谱条件对样品进行分析,通过正、负离子全扫描,获得正、负离子模式下的总离子流图,见图1。
通过与对照品比对,分子离子峰质谱数据解析,与参考文献比对,共鉴定出三色片醇提物乙酸乙酯部位42个化合物,结果见表2。
表 2 三色片提取物中各成分主要碎片离子及谱峰归属化合物
编号tR/min 分子式 理论值(m/z) 模式 实测值(m/z) 误差(×10−6) 碎片离子(m/z) 化合物名称 参考文献 1 3.54 C7H6O3 139.039 0 [M+H]+ 139.039 4 3.0 121.028 7 原儿茶醛 [10] 2 4.76 C21H27N3O3 370.212 5 [M+H]+ 370.214 3 4.8 249.124 6,160.112 6,95.013 3,166.086 6,100.076 2,91.054 8 南蛇藤糠酰胺碱 [11] 3 6.63 C22H22O10 447.128 6 [M+H]+ 447.130 4 4.2 285.077 5,270.053 5,253.050 8,225.055 6,137.023 5 毛蕊异黄酮-7-O-β-D-葡萄糖苷 [12] 4 7.04 C23H29N3O2 380.233 3 [M+H]+ 380.235 1 4.8 176.106 9,160.112 6,105.033 8,100.076 5 苯代南蛇碱 [11] 5 9.41 C9H10O5 197.045 6 [M-H]− 197.044 7 −4.2 179.038 3,135.044 3 丹参素 [10] 6 9.42 C9H8O4 179.035 0 [M-H]− 179.034 2 4.7 135.044 8 咖啡酸 [13] 7 11.16 C16H12O4 431.133 7 [M+H]+ 431.136 3 6.1 269.082 6,253.050 3,225.055 5,213.091 7,197.060 2,136.014 6,118.041 7 芒柄花苷 [12] 8 12.71 C16H12O5 285.075 8 [M+H]+ 285.077 4 5.7 270.053 4,253.050 3,225.055 3,137.023 5 毛蕊异黄酮* [12] 9 12.76 C17H16O5 301.107 1 [M+H]+ 301.109 0 6.4 167.070 8,152.047 3,147.043 2,105.034 0,123.043 3 astrapterocarpan [12] 10 13.06 C20H24O6 361.164 6 [M+H]+ 361.166 5 5.5 269.154 3,227.108 3,185.096 9,157.101 7,129.070 3,91.054 9 雷公藤甲素* [14-15] 11 13.92 C17H14O6 315.086 3 [M+H]+ 315.088 1 5.6 300.064 7,243.065 5,167.034 2 熊竹素 [16] 12 18.21 C18H12O7 341.065 6 [M+H]+ 341.066 9 3.9 295.060 7,277.050 9,249.056 0 丹酚酸G [17] 13 19.76 C26H20O10 491.098 4 [M-H]− 491.097 0 −2.9 311.054 9,293.044 6,267.064 6,135.044 7 丹酚酸C [18] 14 21.46 C16H12O4 269.080 8 [M+H]+ 269.082 7 4.1 253.015 3,237.052 6,225.055 5,213.092 3,136.015 9,118.041 7,197.060 2 芒柄花素 [12] 15 22.57 C36H45NO17 764.276 0 [M+H]+ 764.278 3 2.9 746.276 1,686.246 3,644.235 1,206.081 7,188.070 9,178.086 5 aquifoliunine E-Ⅲ [14] 16 23.45 C20H22O6 359.148 9 [M+H]+ 359.150 7 4.9 267.138 0,225.019 5,183.079 9,128.061 8,91.054 3 雷公藤内酯酮* [19] 17 24.01 C38H47NO19 822.281 5 [M+H]+ 822.284 1 3.2 804.275 8,204.066 2,176.071 4 alatusinnine [20] 18 25.01 C39H45NO19 832.265 9 [M+H]+ 832.269 0 3.8 804.273 3,194.081 9,176.071 2 hypoglaunine E [11] 19 26.14 C41H68O14 829.458 0 [M+COOH]− 829.460 7 3.3 783.457 9,621.404 3,489.357 2 黄芪甲苷* [14] 20 28.19 C38H47NO18 806.286 6 [M+H]+ 806.290 3 3.8 788.279 5,686.247 0,206.082 1, 178.086 5 雷公藤定宁 E [20] 21 28.65 C39H45NO18 816.271 0 [M+H]+ 816.273 9 3.6 798.261 9,756.250 9,206.081 3,178.086 1,160.075 2 1-去乙酰基雷公藤吉碱 [11] 22 28.70 C43H70O15 871.468 6 [M+COOH]− 871.470 8 2.5 825.470 2,765.448 2,489.356 8 黄芪皂苷Ⅱ [13] 23 29.09 C41H47NO20 874.276 4 [M+H]+ 874.278 5 2.3 856.269 2,846.282 9,828.272 3,674.245 1,204.065 6,176.070 7 雷公藤春碱 [11] 24 29.72 C38H47NO18 806.286 6 [M+H]+ 806.291 2 3.8 788.280 4,686.247 4,206.082 4 peritassine A [20] 25 30.24 C43H70O15 871.468 6 [M+COOH]− 871.470 3 2.5 825.464 1,765.440 5 异黄芪皂苷Ⅱ
(异构体1)[16] 26 30.89 C19H16O4 309.112 1 [M+H]+ 309.114 2 6.7 281.667 0,263.106 0,235.076 7 丹参醛 [21] 27 31.58 C43H70O15 871.468 6 [M+COOH]− 871.470 8 2.5 825.470 2,765.448 0 异黄芪皂苷Ⅱ
(异构体2)[13] 28 32.12 C21H20O4 337.143 4 [M+H]+ 337.142 5 −2.7 309.686 6 丹参新醌丁 [10] 29 32.16 C43H49NO19 884.297 2 [M+H]+ 884.299 7 2.8 856.304 5,674.246 0,204.663 0,176.071 2 雷公藤定碱 [14] 30 32.96 C45H72O16 913.479 1 [M+COOH]− 913.482 4 3.5 867.481 7,825.469 8,807.464 3,765.450 6 黄芪皂苷Ⅰ [16] 31 32.99 C41H47NO19 858.281 5 [M+H]+ 858.285 4 4.6 840.275 7,798.263 8,746.269 1,738.243 5,686.248 0,206.082 5,178.087 1 雷公藤晋碱 [20] 32 33.04 C38H47NO18 806.286 6 [M+H]+ 806.289 7 3.8 788.278 3,686.244 4,206.082 1,728.257 0 卫矛碱 [20] 33 33.70 C45H72O16 913.479 1 [M+COOH]− 913.484 7 3.8 867.478 5,825.283 5,807.458 4,765.432 6 异黄芪皂苷Ⅰ
(异构体1)[16] 34 34.60 C45H72O16 913.479 1 [M+COOH]− 913.483 3 3.8 867.477 8,825.282 1,807.456 4,765.443 2 异黄芪皂苷Ⅰ
(异构体2)[16] 35 34.92 C46H49NO22 968.281 9 [M+H]+ 968.286 3 4.5 856.677 0,838.257 4,684.228 8,204.065 6,178.070 8 雷公藤素B [20] 36 35.01 C43H49NO18 868.302 2 [M+H]+ 868.304 6 2.7 868.364 0,850.295 8,746.268 9,686.247 6,206.082 4,178.087 1 雷公藤次碱 [20] 37 35.02 C41H47NO17 826.291 7 [M+H]+ 826.295 1 4.2 808.285 3,748.264 0,206.082 2,178.086 8 tripterygiumine Ⅰ [20] 38 35.49 C19H20O3 297.148 5 [M+H]+ 297.145 0 4.8 251.144 0,279.139 3,254.054 9,268.110 5,282.126 3 隐丹参酮 [10,17] 39 35.70 C20H28O2 299.201 7 [M-H]− 299.199 6 −6.7 283.168 2,213.090 8,201.916 0, 雷酚萜 [22] 40 35.86 C48H51NO18 930.317 9 [M+H]+ 930.321 3 3.7 912.308 7,310.111 0,206.081 8,188.071 2,178.086 5,105.033 6 ebenifoline E-Ⅱ [20] 41 36.81 C19H18O3 295.132 9 [M+H]+ 295.134 9 4.0 277.124 3,249.127 5,266.095 3,262.097 7,280.109 9 丹参酮Ⅱ A* [10,18,23] 42 37.49 C19H22O2 283.169 3 [M+H]+ 283.169 3 0 265.098 1,240.032 2,223.106 7,195.095 8,181.101 1 丹参新酮 [17,21,24] 注:*表示与对照品鉴定的化合物。 3.2.1 黄酮类化合物结构解析
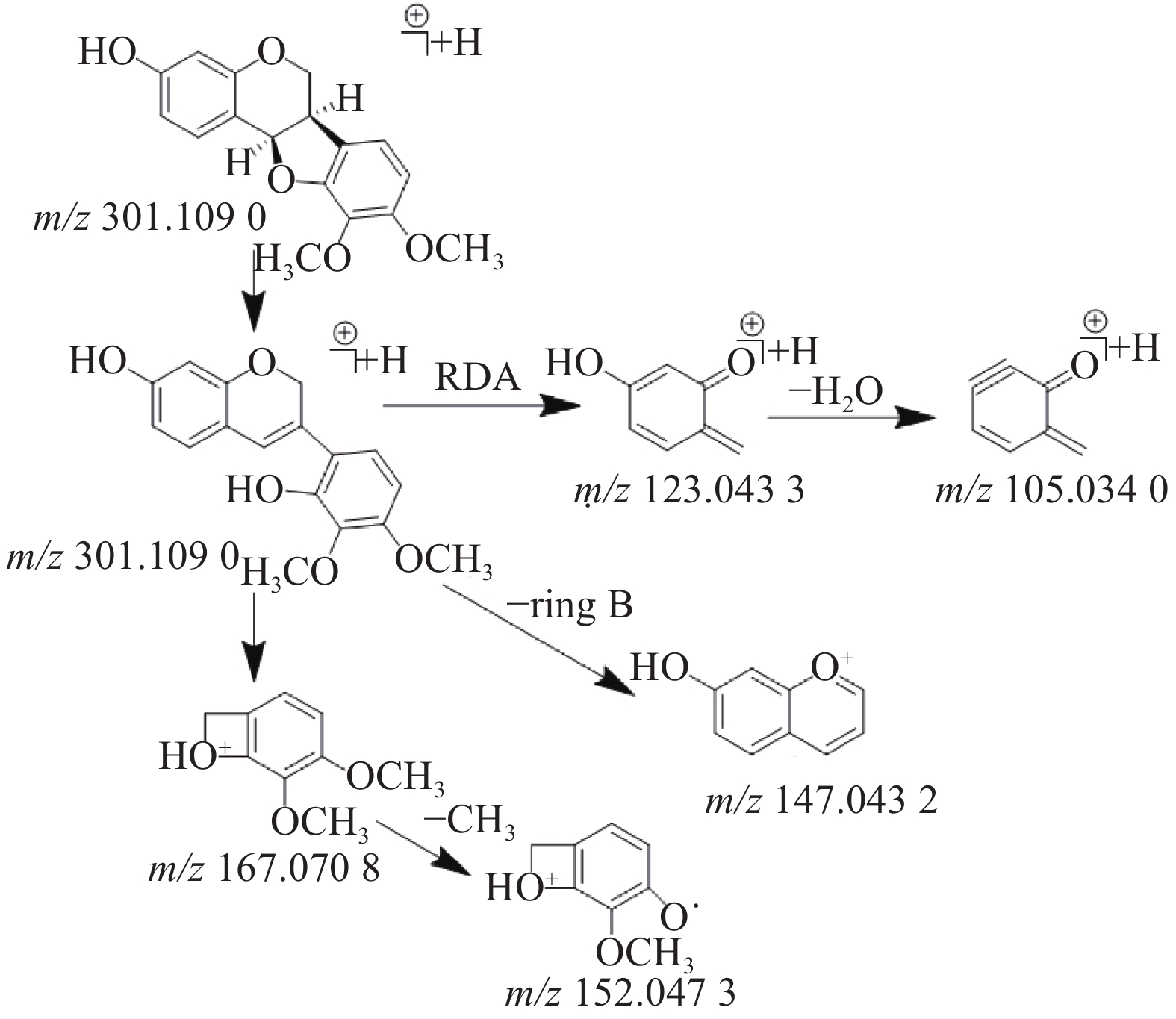
在乙酸乙酯部位中共鉴定出6个黄酮类化合物,其中4个黄酮苷元和2个黄酮苷,苷元为黄酮、异黄酮和紫檀烷,该类化合物在正离子模式下具有较好的响应。二级质谱中黄酮苷元易发生中性丢失,形成[M+H-H2O]+、[M+H-CO]+、[M+H-CH3]+等碎片离子,如在化合物8的二级质谱中可见m/z 270.053 4和m/z 253.050 3,则为m/z 285.077 4分别脱去-CH3和CH3OH形成的[M+H-CH3]+和[M+H-CH3OH]+碎片离子峰,m/z 225.055 3是m/z 253.050 3脱去1分子的CO形成的碎片离子峰,通过对照品的保留时间和参考文献[12]质谱数据比对确定化合物8为毛蕊异黄酮,m/z 137.023 5的碎片离子峰为异黄酮母核C环发生RDA裂解所产生。黄酮苷类易脱去糖基形成较强的分子离子峰,如化合物3(m/z 447.130 4)的二级质谱脱去糖基形成m/z 285.077 5的分子离子峰,并与化合物8(m/z 285.077 4)的二级质谱图非常相似,说明化合物3和化合物8在结构上是相似的,但化合物3的分子量多了162(C6H10O5),通过数据库比对和参考文献[12]推测化合物3则为毛蕊异黄酮-7-O-β-D-葡萄糖苷。化合物9(m/z 301.109 0)通过数据库比对发现两种候选化合物分别为astrapterocarpan和astraisoflavan,二级质谱中主要碎片离子峰为C环裂解产生的含A环和B环片段的碎片离子,其中,m/z 167.070 8为含B环的碎片离子峰且为基峰,进一步脱甲基形成m/z 152.047 3,m/z 123.043 3为含A环的碎片离子峰,进一步脱水形成m/z 105.034 0,m/z 147.043 2为母离子m/z 301.109 0脱去B环形成的碎片离子峰,根据m/z 167.070 8的碎片离子峰为基峰和含有m/z 147.043 2的碎片离子峰这两个特征,结合参考文献[12]的质谱数据,推测该化合物为astrapterocarpan,其相关裂解途径见图2。
3.2.2 三萜皂苷类化合物结构解析
在乙酸乙酯部位中鉴定出7个三萜皂苷类化合物,在负离子模式下均具有较好的响应,一级质谱中产生[M+COOH]−的准分子离子峰,二级质谱中产生较强的[M-H]-碎片离子峰和脱去糖基的较弱的分子离子峰。化合物19在负离子模式下产生的准分子离子峰为[M+COOH]−(m/z 829.458 0),二级质谱中产生m/z 783.457 9[M-H]−峰,脱去1分子六碳糖(C6H10O6)形成m/z 621.404 3的碎片离子峰,m/z 489.357 2则为m/z 621.404 3进一步脱去1分子五碳糖(C5H6O5)后形成的苷元碎片离子峰,推测其苷元为9,19-环阿尔廷烷,通过对照品的保留时间,参考文献[13]的离子碎片比对确定该化合物为黄芪甲苷。
3.2.3 生物碱类化合物结构解析
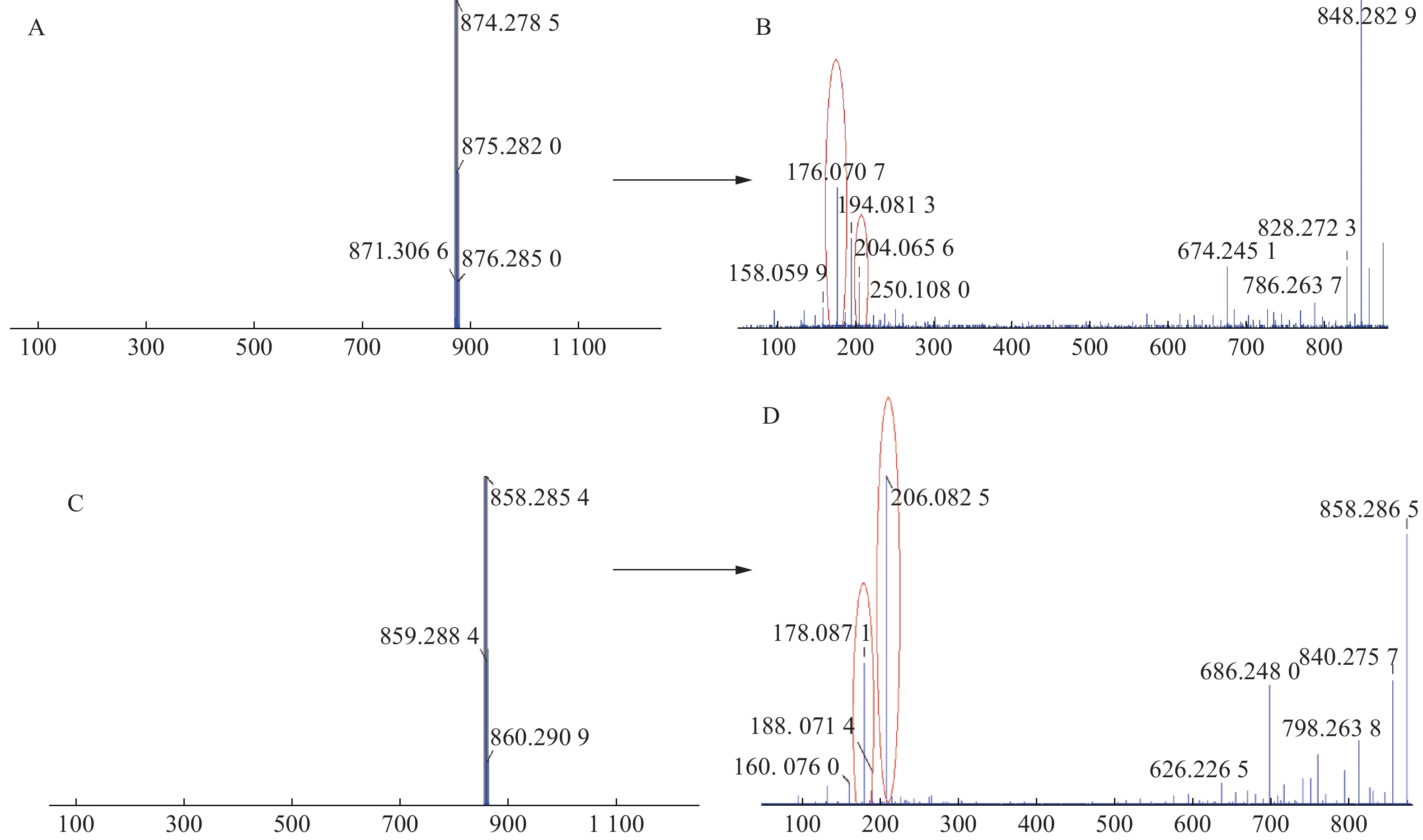
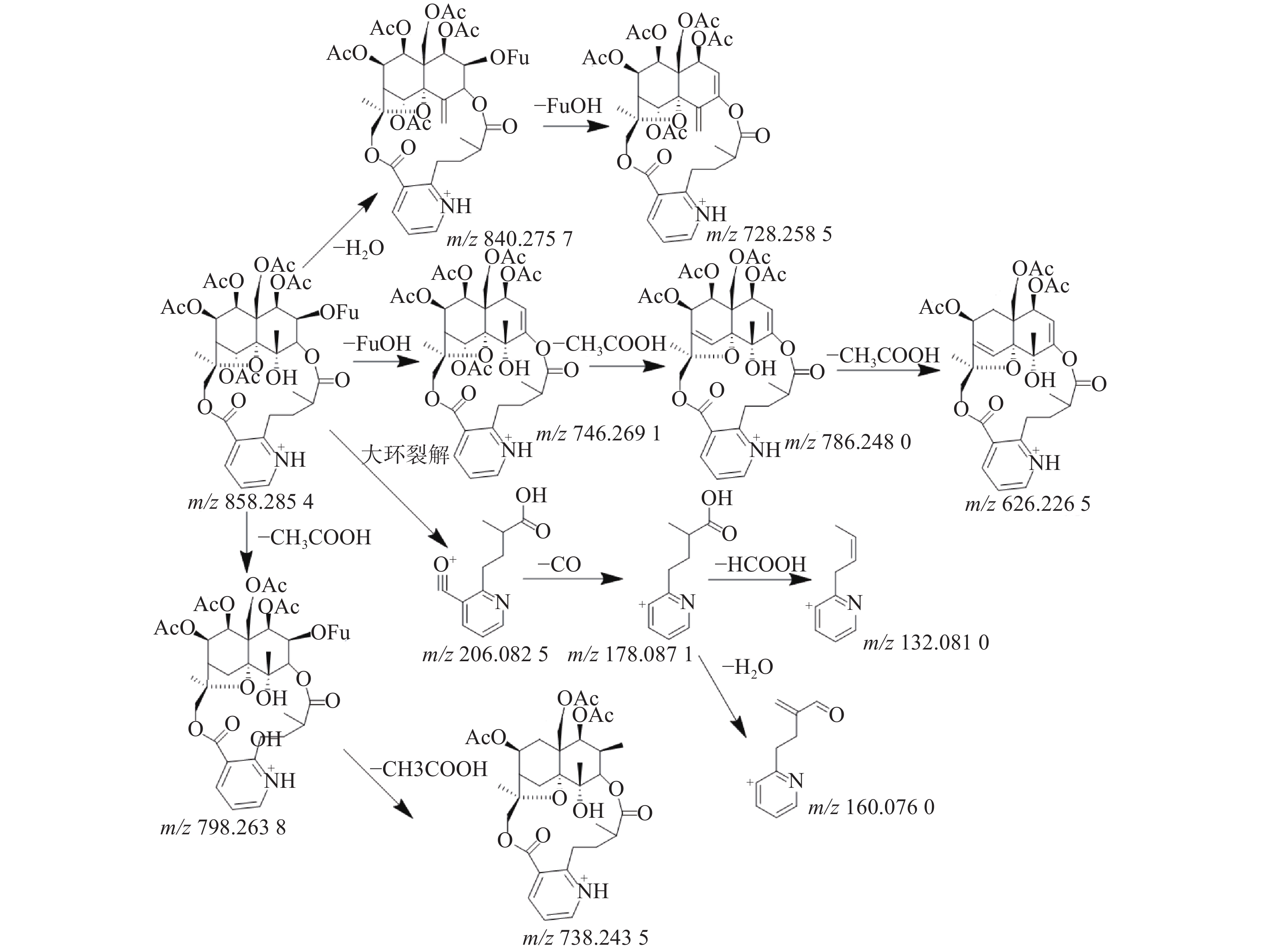
三色片提取物中共鉴定出16个生物碱类化合物,均来自雷公藤药材,在正离子模式下具有较好的响应,一级质谱中产生[M+H]+的准分子离子峰,二级质谱发现该类型的化合物容易脱去H2O、CO和CH3COOH等中性小分子而产生碎片离子峰,多数生物碱含有吡啶二羧酸部位的碎片离子峰。如化合物23在正离子模式下产生m/z 874.278 5的准分子离子峰,二级质谱中产生脱去1分子CO的m/z 846.282 9的基峰,脱去1分子H2O的m/z 856.2692的碎片离子峰和脱去1分子HCOOH的m/z 828.272 3的碎片离子峰,m/z 674.245 1峰为m/z 846.2829脱去C5H4O3侧链和CH3COOH形成的碎片离子峰,m/z 204.065 6峰为大环开裂产生的吡啶二羧酸部分脱水产生的碎片离子,该离子进一步脱羧形成m/z 176.070 7的碎片离子,通过数据库和参考文献[11]质谱数据的比对,推测化合物23为雷公藤春碱。化合物31在正离子模式下产生m/z 858.285 4的准分子离子峰,二级质谱中产生脱去1分子H2O的m/z 840.275 7的碎片离子峰,准分子离子峰脱去1分子CH3COOH形成较强的m/z 798.263 8峰,在进一步脱去1分子CH3COOH形成738.243 5峰,准分子离子峰m/z 858.285 4脱去FuOH(C5H4O3)侧链形成的m/z 746.269 1的碎片离子峰,再进一步脱去1分子CH3COOH,形成m/z 686.248 0的碎片离子,m/z 206.082 5峰为大环开裂产生的吡啶二羧酸部分脱水产生的碎片离子,该离子进一步脱羧形成m/z 178.087 1的碎片离子,通过数据库和参考文献[20]质谱数据的比对,推测化合物31为雷公藤晋碱。雷公藤晋碱中吡啶二羧酸部分较雷公藤春碱中少一个羟基,故其易产生m/z 206.0825的碎片离子峰,并通过脱羧产生m/z 178.087 1峰。两种化合物的质谱图见图3。以雷公藤晋碱为例,解析此类化合物的裂解规律,见图4。因此得出吡啶二羧酸部分含有羟基的生物碱会产生m/z 204系列的特征碎片离子峰,不含羟基的生物碱则产生m/z 206系列的特征碎片离子峰。
3.2.4 萜类化合物结构解析
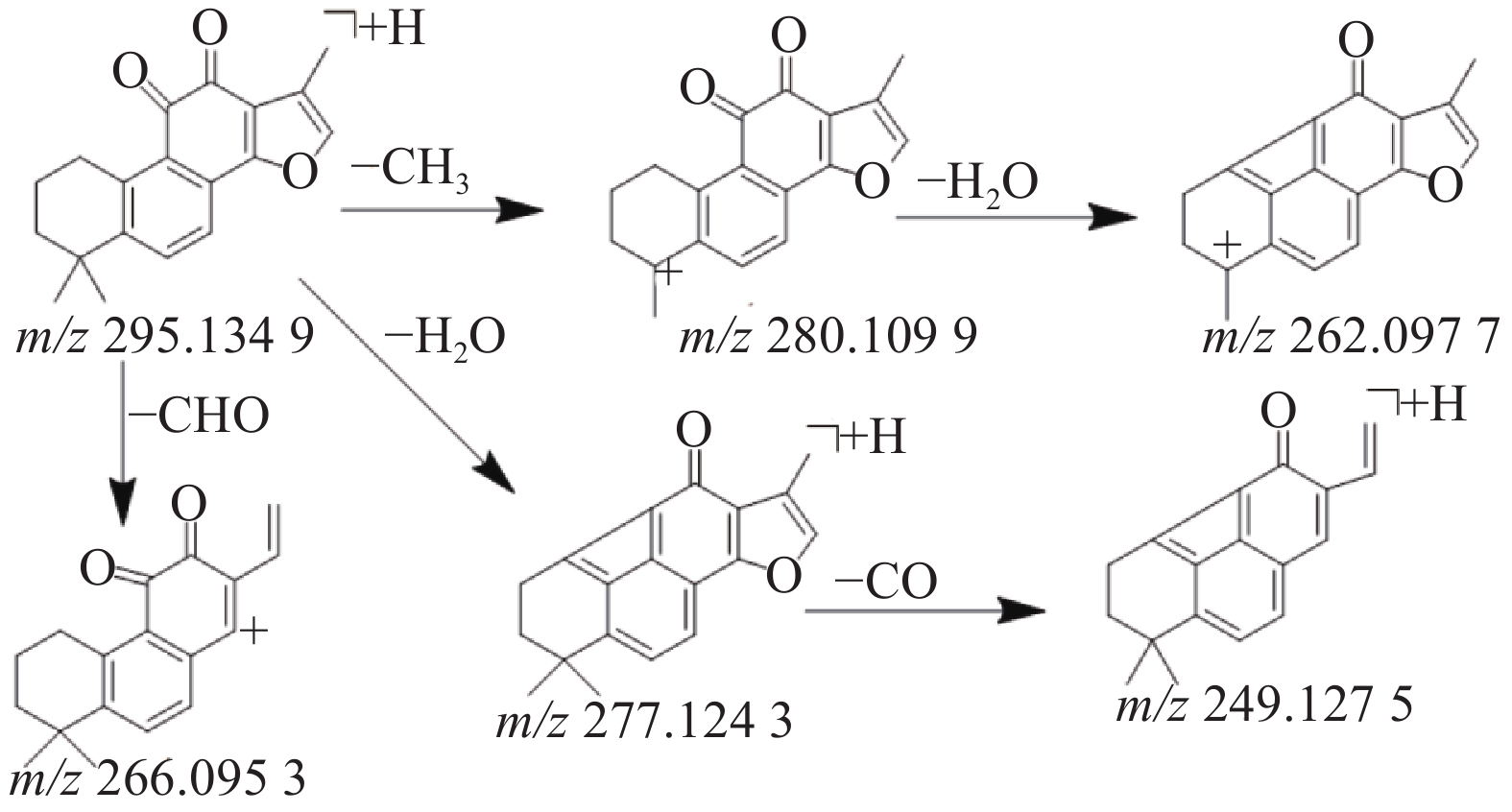
本研究共鉴定出8种萜类化合物,其中源于丹参药材中的5种萜类成分,丹参中的萜类化合物因其结构中主要含有羟基,羰基等取代基,所以质谱碰撞中主要丢失H2O,CO和-CH3等中性分子,产生一系列的碎片离子峰。化合物41在正离子模式下产生m/z 295.134 9的[M+H]+准分子离子峰,二级质谱中产生脱去1分子甲基形成的m/z 280.1099的碎片离子峰,在此基础上有丢失1分子水形成m/z 262.097 7峰,准分子离子峰脱去1分子H2O或脱去1个-CHO形成m/z 277.124 3峰或m/z 266.095 3峰,m/z 249.127 5峰是m/z 277.124 3脱去1分子H2O形成的碎片峰,通过对照品的保留时间和参考文献[10,18,23]数据比对,鉴定该化合物为丹参酮Ⅱ A,其质谱裂解规律见图5。
来源于雷公藤药材中的3种二萜类成分,该类化合物的二级质谱中出现一系列的脱水、脱CO和异丙基等碎片离子峰。化合物11在正离子模式下产生m/z 361.166 5的准分子离子峰,脱去2分子H2O和2分子CO形成m/z 269.154 3的碎片离子峰,m/z 227.108 3为m/z 269.154 3脱去1分子CH2CHCH3形成的碎片离子,其进一步脱1分子H2O和HCHO形成m/z 185.096 9的碎片离子,通过对照品比对和参考文献[14-15]的质谱数据,确定化合物10为雷公藤甲素。化合物18在正离子模式下产生m/z 359.148 9的准分子离子峰,脱去2分子H2O和2分子CO形成m/z 267.138 0的碎片离子峰,m/z 225.019 5为m/z 267.138 0脱去1分子CH2CHCH3形成的碎片离子,其进一步脱1分子H2O和HCHO形成m/z 183.0799的碎片离子,通过对照品比对和参考文献[19]的质谱数据,确定化合物16为雷公藤内酯酮。化合物39在负离子模式下产生m/z 299.199 6 的准分子离子峰,二级质谱中产生m/z 283.168 2的碎片离子, 提示为丢失1个-CH3后形成双键产生的碎片离子峰,A环发生RDA裂解产生m/z 213.090 8的碎片离子峰,通过数据库比对和参考文献[22]的质谱数据,推测化合物39为雷酚萜。
3.2.5 酚酸类化合物结构解析
在正负离子模式下共鉴定出乙酸乙酯部位中5种酚酸类成分,均来自于丹参药材,参考文献[18]报道的丹参中酚酸类成分的裂解规律发现,酚酸类化合物主要含有羰基、羧基和羟基,所以在质谱碰撞中易丢失CO、H2O和CO2的中性碎片;丹参素和咖啡酸作为基本母核而其他的水溶性酚酸类化合物大多数为这两者的聚合或缩合产物,主要为缩酚酸类的成分,在质谱碰撞中易丢失[M-H-180]−和[M-H-198]−中性碎片;含有羧基的单体化合物在负离子模式下会产生135[C8H7O2]−和179[C9H7O4]−的特征性碎片。化合物5中,在负离子模式下产生m/z 197.044 7的[M-H]−准分子离子峰,二级质谱进一步产生丢失1分子H2O和1分子CO2,形成的m/z 179.038 3和m/z 135.044 3的碎片离子峰,推测出结构中含有羧基,结合其精确分子量和参考文献[10]质谱数据,推测该化合物为丹参素。化合物12中,负离子模式下产生m/z 491.097 0的[M-H]−准分子离子峰,二级质谱中产生m/z 311.054 9和m/z 293.044 6的碎片离子峰,分别为[M-H-180]−和[M-H-198]−, m/z 267.064 6峰为m/z 311.054 9脱去1分子CO2所产生,根据m/z 135.044 7峰推测结构中含有羧基,结合其精确分子量和参考文献[18]质谱数据的比较,推测该化合物为丹酚酸C。化合物1中,正离子模式下给出m/z 139.039 4的[M+H]+准分子离子峰,脱去1分子H2O形成m/z 121.028 7的碎片离子峰,通过数据库比对和参考文献[10],推测该化合物1为原儿茶醛。化合物13中,在正离子模式下产生m/z 341.066 9的[M+H]+准分子离子峰,脱去1分子CO2形成m/z 295.060 7的碎片离子峰,m/z 277.050 9和m/z 249.056 0的碎片离子峰是m/z 295.060 7峰分别脱去1分子H2O和1分子CO2形成的,通过数据库比对和参考文献[17]质谱数据,推测该化合物为丹酚酸G。
4. 讨论
4.1 色谱与质谱条件考察
本实验流动相考察了乙腈-水系统和甲醇-水系统,结果乙腈-水系统中化合物的分离度较好,加入甲酸可以改善峰形,有助于化合物的离子化,提高质谱的响应,最终选择乙腈-0.1%甲酸水系统作为本次研究的流动相。
4.2 化学成分的定性分析
据以往文献中三色片各化学成分的研究报道,收集各药材的主要化学成分的精确分子量,碎片离子峰等信息,建立相应的化学成分数据库。通过数据库比对,对照品保留时间及参考文献中质谱数据鉴定三色片醇提物乙酸乙酯部位的化学成分。本研究共鉴定出42个化合物,其中5个是通过对照品鉴定得出,对无对照品的化合物,通过质谱的裂解特征及参考文献进行结构表征,对同分异构体应结合其在液相色谱中化合物的保留时间及质谱行为,综合对其定性鉴别。
三色片醇提物的乙酸乙酯部位具有较强的抗补体活性,本研究采用UPLC-Q-TOF-MS法对其中的化学成分进行结构表征,结果发现该部位主要含有生物碱类,萜类,黄酮和酚酸类等化学成分。其中以来源于雷公藤药材中极性中等的生物碱类成分含量较多,这与三色片提取物的制备工艺有关,三色片中雷公藤药材采用乙醇加热回流提取的方式,而黄芪和丹参药材采用水提取醇沉淀的方式。此外,先前的研究发现广藿香中的黄酮和萜类化合物对旁路途径的补体激活具有明显的抑制作用,紫花地丁中的生物碱类成分对旁路途径也有抑制作用(AP50=0.22~0.50 g/L), 牡丹皮和毛七公的抗补体活性成分研究中发现酚羟基决定抗补体活性的存在与否,没食子酰基可改善抗补体活性,甲基则对抗补体活性不利[25-27]。通过本次研究对三色片醇提物的乙酸乙酯部位的化学成分进行了初步表征,为阐明三色片的药效物质基础提供参考依据。研究的不足之处在于,仍有部分化学成分尚未定性鉴定,含量较高的单体成分未进行体外抗补体活性的测定,未来将通过中药化学的方法获得含量较高的单体成分,并进行结构鉴定和抗补体活性测定。
-
表 1 荆防败毒散中部分活性成分的基本信息
成分名称 MOL ID MW OB (%) DL 药味归属 β谷甾醇 MOL000358 414.79 36.91 0.75 荆芥、防风、羌活、前胡、独活、枳壳 谷甾醇 MOL000359 414.79 36.91 0.75 荆芥、防风、羌活、前胡、川芎、甘草 槲皮素 MOL000098 302.25 46.43 0.28 荆芥、柴胡、前胡、甘草 异欧前胡素 MOL001942 270.30 45.46 0.23 防风、前胡、羌活、独活 欧前胡素 MOL001941 270.30 34.55 0.22 防风、前胡、羌活、独活 紫花前胡苷 MOL004792 408.44 57.12 0.69 羌活、独活、前胡 柚皮素 MOL004328 272.27 59.29 0.21 枳壳、甘草 异鼠李素 MOL000354 316.28 49.60 0.31 柴胡、甘草 豆甾醇 MOL000449 412.77 43.83 0.76 荆芥、柴胡 亚油酸乙酯 MOL001494 308.56 42.00 0.19 防风、川芎 山奈酚 MOL000422 286.25 41.88 0.24 柴胡、甘草 紫花前胡素 MOL013077 328.39 39.27 0.38 防风、前胡 木犀草素 MOL000006 286.25 36.16 0.25 荆芥、桔梗 甘草酚 MOL002311 366.39 90.78 0.67 甘草 宽叶甘松酸 MOL013098 328.39 87.48 0.37 前胡 Divaricate acid MOL011737 320.32 87.00 0.32 防风 甘草吡喃
香豆素MOL004904 384.41 80.36 0.65 甘草 shinpterocarpin MOL004891 322.38 80.30 0.73 甘草 芒柄花黄素 MOL000392 268.28 69.67 0.21 甘草 xambioona MOL005018 388.49 54.85 0.87 甘草 丹参酮IIA MOL007154 294.37 49.89 0.40 前胡 异甘草酚 MOL004948 366.39 44.70 0.84 甘草 去氢齿孔酸 MOL000300 453.75 44.17 0.83 茯苓 7-甲氧基-2-甲基异黄酮 MOL003896 266.31 42.56 0.20 甘草 美迪紫檀素-3-O-葡萄糖苷 MOL004924 432.46 40.99 0.95 甘草 过氧化麦角
甾醇MOL000283 430.74 40.36 0.81 茯苓 去氢茯苓酸 MOL000276 526.83 35.11 0.81 茯苓 茯苓酸 MOL000289 528.85 33.63 0.81 茯苓 kanzonol F MOL004988 420.54 32.47 0.89 甘草 汉黄芩素 MOL000173 284.28 30.68 0.23 防风 表 2 荆防败毒散中核心成分与Mpro、ACE2的结合能
成分 CAS号 化学式 结合能(kJ/mol) Mpro ACE2 槲皮素 117-39-5 C15H10O7 −27.21 −34.33 山奈酚 520-18-3 C15H10O6 −27.21 −32.66 木樨草素 491-70-3 C15H10O6 −28.89 −34.33 汉黄芩素 10-29-7 C16H12O5 −27.21 −33.91 7-甲氧基-2-甲基异黄酮 19725-44-1 C17H14O3 −25.96 −32.24 β-谷甾醇 83-46-5 C29H50O −31.40 −36.84 丹参酮IIA 568-72-9 C19H18O3 −30.14 −36.43 异鼠李素 480-19-3 C16H12O7 −27.21 −33.49 芒柄花黄素 485-72-3 C16H12O4 −29.73 −30.14 柚皮素 153-18-4 C15H12O5 −28.47 −33.49 -
[1] 大汇临床研究. 重磅!钟南山院士最新千例新冠肺炎研究结果来了![EB/OL]. (2020-02-10)[2020-02-15]. https://mp.weixin.qq.com/s/SzFloKDdXQNG8fbLYqfThg. [2] ZHANG J J, LITVINOVA M, LIANG Y X, et al. Changes in contact patterns shape the dynamics of the COVID-19 outbreak in China[J]. Science,2020,368(6498):1481-1486. doi: 10.1126/science.abb8001 [3] 黄煌. 基于经方医学对新型冠状病毒肺炎的思考[J]. 南京中医药大学学报, 2020, 36(2):152-156. [4] 胡相萍, 张兰萍. 荆防败毒散联合阿奇霉素治疗小儿急性支气管炎临床疗效及其对患儿肺功能的动态观察[J]. 中国妇幼保健, 2016, 31(19):3975-3978. [5] 吴晖, 邵丹, 文丹, 等. 加减荆防败毒散治疗风寒型外感热病疗效观察及对TNF-α、IL-1β的影响[J]. 福建中医药, 2017, 48(3):11-13. doi: 10.3969/j.issn.1000-338X.2017.03.005 [6] 邵丹, 吴晖, 文丹, 等. 加减荆防败毒散对急性上呼吸道感染患者外周血T淋巴细胞亚群的影响[J]. 福建中医药, 2014, 45(2):18-19. [7] 张奎, 陈红英, 马瑜. 荆防败毒散药效学研究[J]. 河南中医, 2009, 29(6):601-602. [8] RU J L, LI P, WANG J N, et al. TCMSP: a database of systems pharmacology for drug discovery from herbal medicines[J]. J Cheminform,2014,6:13. doi: 10.1186/1758-2946-6-13 [9] DAINA A, MICHIELIN O, ZOETE V. SwissTargetPrediction: updated data and new features for efficient prediction of protein targets of small molecules[J]. Nucleic Acids Res,2019,47(w1):W357-W364. doi: 10.1093/nar/gkz382 [10] UniProt Consortium. UniProt: a worldwide hub of protein knowledge[J]. Nucleic Acids Res,2019,47:D506-D515. doi: 10.1093/nar/gky1049 [11] ZHOU Y Y, ZHOU B, PACHE L, et al. Metascape provides a biologist-oriented resource for the analysis of systems-level datasets[J]. Nat Commun,2019,10(1):1523. doi: 10.1038/s41467-019-09234-6 [12] STERLING T, IRWIN J J. ZINC 15: ligand discovery for everyone[J]. J Chem Inf Model,2015,55(11):2324-2337. doi: 10.1021/acs.jcim.5b00559 [13] GOODSELL D S, ZARDECKI C, DI COSTANZO L, et al. RCSB Protein Data Bank: Enabling biomedical research and drug discovery[J]. Protein Sci,2020,29(1):52-65. doi: 10.1002/pro.3730 [14] CHEN C N, LIN C P, HUANG K K, et al. Inhibition of SARS-CoV 3C-like protease activity by theaflavin-3, 3'-digallate (TF3)[J]. Evid Based Complement Alternat Med,2005,2(2):209-215. doi: 10.1093/ecam/neh081 [15] MENACHERY V D, YOUNT B L Jr, DEBBINK K, et al. A SARS-like cluster of circulating bat coronaviruses shows potential for human emergence[J]. Nat Med,2015,21(12):1508-1513. doi: 10.1038/nm.3985 [16] NGUYEN N T, NGUYEN T H, PHAM T N H, et al. Autodock vina adopts more accurate binding poses but Autodock4 forms better binding affinity[J]. J Chem Inf Model,2020,60(1):204-211. doi: 10.1021/acs.jcim.9b00778 [17] HSIN K Y, MATSUOKA Y, ASAI Y, et al. systemsDock: a web server for network pharmacology-based prediction and analysis[J]. Nucleic Acids Res,2016,44(w1):W507-W513. doi: 10.1093/nar/gkw335 [18] WANG C, HORBY P W, HAYDEN F G, et al. A novel coronavirus outbreak of global health concern[J]. Lancet,2020,395(10223):470-473. doi: 10.1016/S0140-6736(20)30185-9 [19] 林伯良. 小柴胡汤证的研究[M]. 北京: 人民卫生出版社, 1959: 23. [20] 邓翠娟. 探究荆防败毒散加减配合拔罐治疗风寒感冒的临床效果[J]. 内蒙古中医药, 2017, 36(14):42-43. doi: 10.3969/j.issn.1006-0979.2017.14.043 [21] 李丽, 陈玉婷, 曾希. RelA/p65的磷酸化调节及其与肿瘤的关系[J]. 中南医学科学杂志, 2018, 46(2):216-220. [22] 冯馨锐, 崔雨舒, 何志涛, 等. 肿瘤坏死因子-α的生物学功能研究进展[J]. 吉林医药学院学报, 2019, 40(1):66-68. [23] ZHOU P, YANG X L, WANG X G, et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin[J]. Nature,2020,579(7798):270-273. doi: 10.1038/s41586-020-2012-7 [24] 齐阳, 黄爱文, 宋洪涛. 血管紧张素转换酶2抗新冠病毒药理作用机制的研究进展[J/OL]. 中国医院药学杂志: 1-5[2020-07-14]. https://kns.cnki.net/kcms/detail/42.1204.R.20200420.1846.047.html. [25] 张启燕, 张文会, 肖军海, 等. 3C和3CL蛋白酶及广谱抑制剂的研究进展[J]. 国际药学研究杂志, 2016, 43(3):425-430. [26] ZHANG L L, LIN D Z, SUN X, et al. Crystal structure of SARS-CoV-2 main protease provides a basis for design of improved α-ketoamide inhibitors[J]. Science,2020,368(6489):409-412. doi: 10.1126/science.abb3405 [27] 张泽鑫, 吴汶丰, 谢丹, 等. 基于网络药理学和分子对接分析达原饮治疗新型冠状病毒肺炎(COVID-19)的分子靶点和机制[J/OL].中药材: 1-8[2020-05-14]. https://kns.cnki.net/kcms/detail/44.1286.R.20200511.1748.002.html. [28] 詹群璋, 黄英杰, 林树红, 等. 基于网络药理学和分子对接的玉屏风散预防新型冠状病毒肺炎(COVID-19)活性化合物的研究[J]. 中草药, 2020, 51(7):1731-1740. doi: 10.7501/j.issn.0253-2670.2020.07.007 期刊类型引用(11)
1. 周超,尚丹丹,杨雯萱,代龙,姚景春. 荆防颗粒联合复方黄柏液涂剂对宫颈HPV感染的临床研究. 长春中医药大学学报. 2025(01): 55-59 .  百度学术
百度学术2. 孟珈同,邱智东,李军鸽,王永春,唐秋竹. 荆防败毒散关键信息考证. 中成药. 2024(04): 1262-1271 .  百度学术
百度学术3. 吕婧,高燕,赵渤年,姚景春,梁红宝. 荆防颗粒增强免疫作用机制研究. 中草药. 2024(16): 5541-5550 .  百度学术
百度学术4. 唐勇琛,张洪平,樊玲凤,杨玉竹,张亚洲. 心脉舒一号口服液治疗心脏病分子机制网络药理学研究. 中国药业. 2024(17): 66-73 .  百度学术
百度学术5. 尉雅洁,刘明飞,孙成宏,王伟,肖贺,程国良,陈颖. 基于网络药理学和动物实验探究荆防颗粒对高尿酸血症的治疗作用及机制. 中草药. 2023(03): 808-816 .  百度学术
百度学术6. 张永康,孙成宏,王西双,姚景春,张贵民. 基于网络药理学和实验验证探讨荆防颗粒对自身免疫性肝炎小鼠的治疗作用及作用机制. 中草药. 2023(05): 1461-1470 .  百度学术
百度学术7. 尉雅洁,刘明飞,周诗喆,项海鑫,孙成宏,陈颖. 荆防颗粒对氧嗪酸钾诱导小鼠高尿酸肾病的防治作用机制探讨. 山东医药. 2023(15): 1-5 .  百度学术
百度学术8. 鲍柏屹,孙美玲,陈祥,曹兆流,唐书炳,李歆. 基于网络药理学和分子对接研究地奥心血康治疗心脏神经官能症的相关机制. 中国医药导报. 2023(17): 9-13 .  百度学术
百度学术9. 阚雪纯,何润东,葛佳颖,吴俊,苗登顺. 基于网络药理学的续断抗骨质疏松分子作用机制研究. 南京医科大学学报(自然科学版). 2022(01): 35-40 .  百度学术
百度学术10. 姚世霞,刘东升,牛钰婷,朱旭江,刘志浩,朱琳. 荆防颗粒质量评价. 中成药. 2022(10): 3130-3136 .  百度学术
百度学术11. 徐庆仪,郁冬冬,黄烨炜. 临床治疗新型冠状病毒肺炎中药复方所使用高频数中药的网络药理学探讨. 海峡药学. 2021(10): 69-74 .  百度学术
百度学术其他类型引用(4)
-





 下载:
下载:
 下载:
下载: