-
信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)是一种信号转录蛋白[1]。该蛋白在结构上主要有N末端、卷曲螺旋、DNA接合、连结、SH2和转录激活区域6个位置域[2]。现有的研究结果表明,STAT3抑制剂可靶向作用于STAT3蛋白的不同结构区域,抑制其在细胞中的表达,为抗炎、抗癌治疗提供思路[3-4]。
-
近年来研究者对STAT3蛋白的探索不断加深,对其在体内的活化机制也有清晰的发现[5]。STAT3在细胞质中分析信号、转导,在细胞核中转录激活[6]。STAT3蛋白在细胞中扮演着重要角色,可影响细胞的生长凋亡机制,研究者们观察到失控的STAT3在异常激活中会导致细胞发生恶性转化,对肿瘤细胞的形成和发展具有重要影响[7]。
STAT3的激活可通过各种细胞因子、生长因子和激素与细胞表面的受体结合而实现。在Janus激酶(JAK)-STAT3信号途径中,细胞因子与细胞膜上的蛋白受体结合,成为二聚体。二聚体在细胞质中募集并激活JAK激酶蛋白,激活的JAK蛋白磷酸化受体酪氨酸残基。随后,STAT3的Tyr705残基被JAKs磷酸化,STAT3蛋白被活化再形成二聚体后,从细胞质转移到细胞核中,与特异性DNA反应元件结合,最终调节STAT3靶基因的表达[8]。
STAT3的每个结构域各有其独特的生物作用。STAT3的N末端结构域对STAT3二聚体核易位以及DNA结合具有重要作用;卷曲螺旋结构域对STAT3与各种蛋白质的协同效应具有一定影响。DNA结构域可匹配特殊的DNA序列,然后形成STAT3-DNA复合物。连接区域参加与细胞转录系统的相互作用。SH2结构域对于STAT3二聚化也至关重要。因为在肿瘤细胞中的过度激活现象,以及抗STAT3的抑制剂对于抗炎免疫具有良好效果,STAT3已成为近年来药物研发的一个热门方向,研究人员纷纷投入巨大热情,不断挖掘STAT3的医药价值[9-10]。
-
STAT3抑制剂可靶向作用于STAT3蛋白,抑制其在癌细胞中的磷酸化、二聚化以及核易位,使其转录功能丧失,有可能为疾病治疗提供新方向[11]。
-
Turkson等[12]研究了STAT3的结合肽PY*LKTK(Y*代表磷酸酪氨酸)在体外破坏STAT3活性的能力。核提取物中PY*LKTK的存在会导致STAT3的DNA结合活性水平显著降低,因此破坏了核易位。作为肽直接抑制STAT3的功能重要性的证据,发现PY*LKTK-mts(mts,膜移位序列)可在体内选择性抑制组成型和配体诱导的STAT3激活。此外,PY*LKTK-mts可抑制Src癌蛋白的转化。Turkson通过确定了抑制STAT3信号转导的最小肽,为使用该肽作为新型拟肽药物进行临床治疗STAT3异常激活的疾病提供了概念基础。
Timofeeva等[13]在表征STAT3-N末端域的选择性抑制剂ST3-H2A2的作用中,观察到该化合物使凋亡基因强烈激活,在癌细胞中诱导细胞凋亡。通过DNA-chip技术和平铺人类启动子阵列技术,发现响应ST3-H2A2的基因在表达激活的同时会伴随着STAT3染色质结合而改变。此外,将siRNA敲低可证实ST3-HA2A对基因表达和染色质结合的影响是STAT3依赖性的,而C/EBP同源蛋白(CHOP)启动子的STAT3结合区位于癌细胞中染色质的DNase I超敏位点中,而不是未转化细胞中,这表明STAT3结合和抑制作用极有可能与染色质结构有关。因此我们猜想,STAT3-N末端选择性抑制剂可调节癌细胞凋亡基因的表达,促使细胞凋亡,为癌症治疗提供新方案。
-
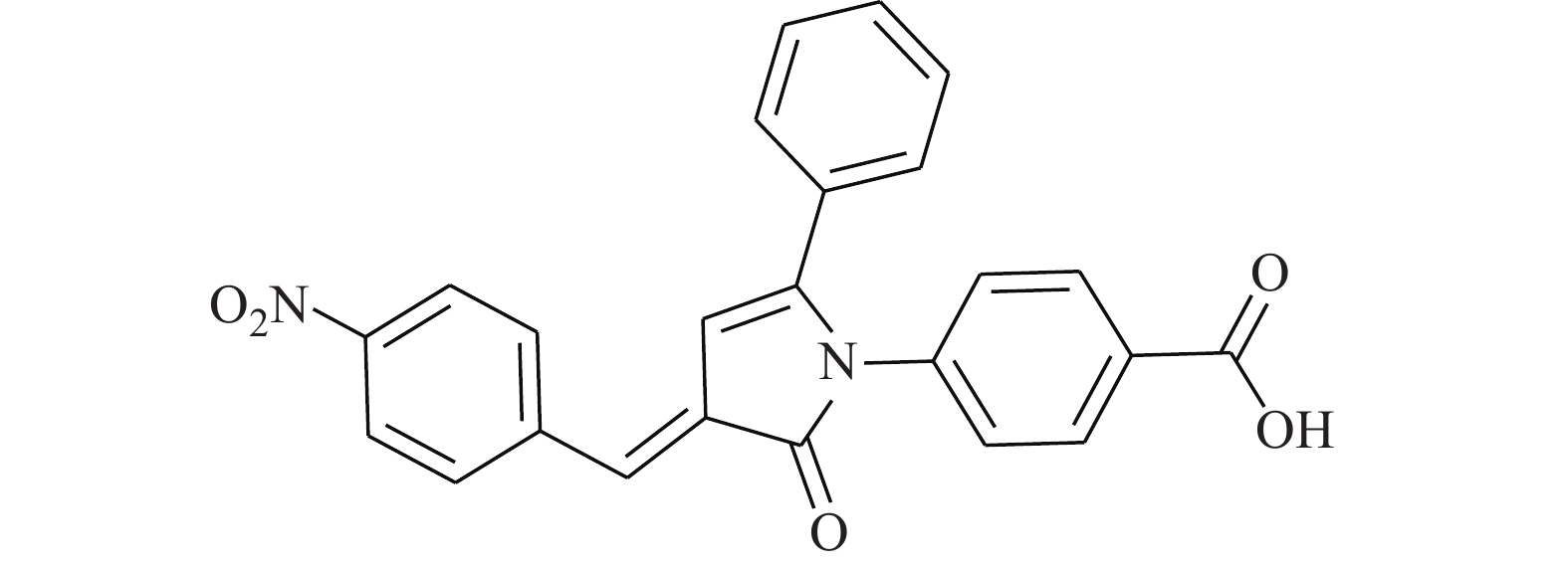
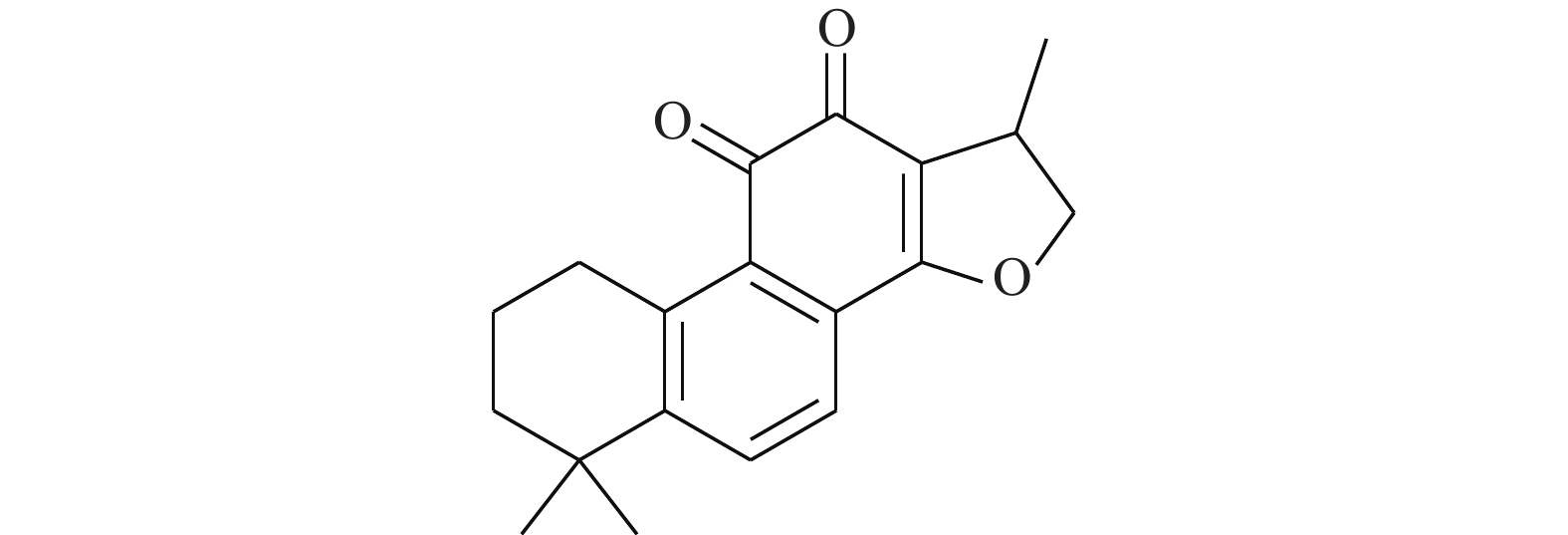
Huang等[14]使用计算机虚拟筛选(AlloFinder)的途径对STAT3的C端卷曲螺旋区域(CCD)进行匹配,通过对分数排名前15的化合物进行生物测定,筛得理论最佳化合物K116(图1)。在此化合物的作用下,荧光偏振显示STAT3的IC50值为7.99 μmol/L。在免疫印迹实验中,STAT3的Y705磷酸化被抑制,而上游的激酶Src及其磷酸化无影响。同时,在肿瘤细胞株MDAMB-468及DU145中,K116表现出对STAT3很强的抑制,IC50为4.46和23.85 μmol/L,表明K116具有良好的特异性抑制STAT3的作用。从K116的研究历程来看,未来进行虚拟筛选的计算化学方法将逐步成为药物研发的一种趋势,在此趋势发展的初期,我们还需要不断改进底层算法并完善数据库内容。
-
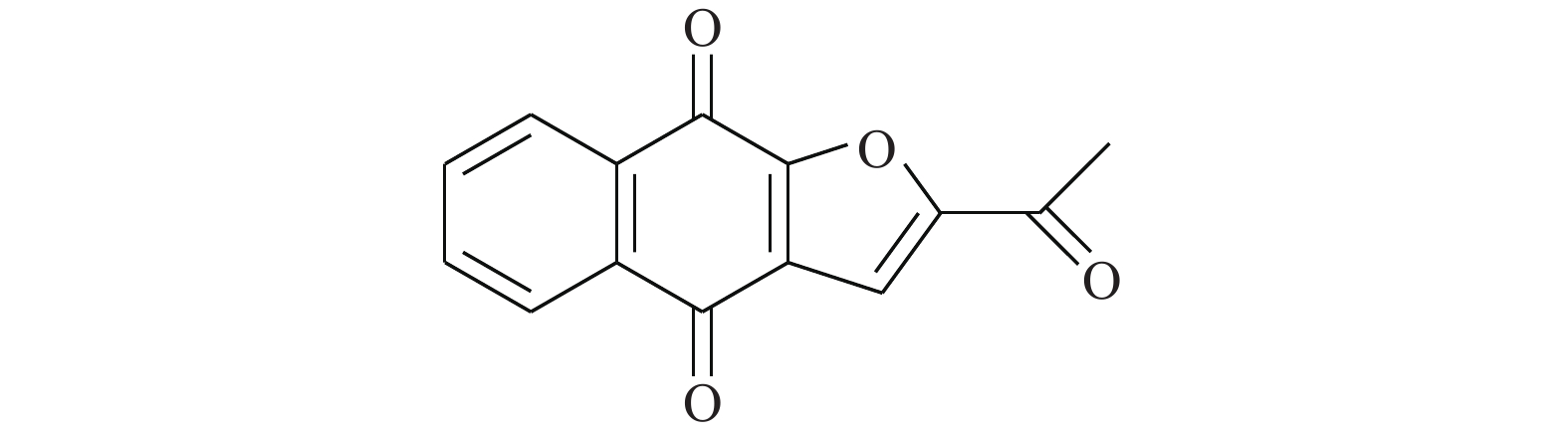
Huang等[15]通过使用改进的虚拟筛选策略靶向STAT3的DNA结合域(DBD),得到了靶向STAT3-DBD的小分子化合物inS3-54(图2)。采用[32P]标记的DNA双链探针及电泳迁移率变动分析表明,inS3-54选择性抑制STAT3与DNA的结合,而对STAT1无影响。与非癌细胞相比,inS3-54优先抑制癌症细胞的增殖,抑制STAT3下游靶基因的表达和STAT3原位结合染色质。因为inS3-54不与SH2结构域相连接,不抑制STAT3二聚化,但可以抑制STAT3与基因组DNA的结合。inS3-54代表了一种新型探针,对于开发靶向STAT3的DBD域特异性抑制剂具有积极意义。
Buettner等[16]为了证明化合物C48(图3)可作为STAT3的选择性抑制剂,使用定点诱变和多种生化技术,探明C48将STAT3中的Cys468烷基化的过程。进一步研究证明,C48会在STAT3过度表达的肿瘤细胞系中阻止STAT3核易位,导致小鼠体内肿瘤生长的显著抑制。这些发现表明,STAT3中的Cys468代表了一个新的治疗干预位点,并推测烷基化有望成为STAT3相关类型癌症的潜在治疗方法。
-
Cheng等[17]研究化合物6-OAP(图4)与肺癌细胞的作用关系,发现该化合物在H1975和A549细胞中以剂量和时间依赖性的方式抑制了STAT3的转录(抑制位点Tyr705),进而抑制由IL-6等细胞因子诱导的STAT3的活化、磷酸化与二聚体的形成。6-OAP在STAT3的SH2结构域与Ser611/Ser613/Arg609形成氢键,阻碍IL-6诱导的STAT3磷酸化,对肺癌细胞和对S期激酶相关蛋白转录有抑制作用。药理实验表明,6-OAP抑制静脉注射肺癌细胞的SCID小鼠的肿瘤生长。6-OAP的效果优异,毒副作用较小,有望进一步挖掘其药用价值。
Schust等[18]从化学数据库中通过模拟筛选得到化合物Stattic(图5)。Stattic能有效抑制STAT3的SH2结构域,对STAT3的激活、二聚化和核易位等关键步骤有阻滞作用。将MDA-MB-231和MDA-MB-435S细胞在指定浓度下用Stattic处理2 h,对STAT3、p-STAT3和其他信号分子(JAK1/JAK2等)的全细胞裂解物进行蛋白质印迹分析,证明了Stattic对STAT3的磷酸化有显著的抑制效应,且其特异选择性较高,有潜力成为高效的STAT3抑制剂。
Chen等[19]通过传统的有机合成方法得到了化合物HJC0152(图6),发现其对人乳腺癌和胰腺癌细胞显示出比氯硝柳胺相似或更高的效力。经过结构修饰后(将苯环上的烷氧基改为氨基)的HJC0152显示出优异的水溶性,与氯硝柳胺相比提高了约3 300倍。在光学显微镜的观察下,将MDA-MB-231乳腺癌细胞用化合物HJC0152处理48 h,观察细胞形态变化,发现细胞周期进程被抑制,细胞凋亡变得更加常见。在带有乳腺肿瘤异种移植物的裸鼠中,HJC0152显著抑制了肿瘤的生长。从这些结果中推测,具有更好水溶性的化合物HJC0152有望被开发成用于癌症治疗的口服生物利用剂。
Shin等[20]首次报道了隐丹参酮(图7)抗癌活性是通过抑制STAT3实现的。隐丹参酮可快速抑制DU145人前列腺癌细胞中的STAT3的Tyr705磷酸化,降低STAT3下游靶蛋白的表达。隐丹参酮抑制STAT3磷酸化是由独立于JAK2的机制引起的,且不影响上游酪氨酸激酶。隐丹参酮可直接与STAT3分子结合(STAT3的SH2结构域),抑制其二聚化,并下调细胞周期蛋白D1、Bcl-xL和survivin的表达,使G0-G1期的细胞蓄积,降低STAT3转录调控活性。这些结果表明,隐丹参酮是良好的STAT3靶向抑制剂。
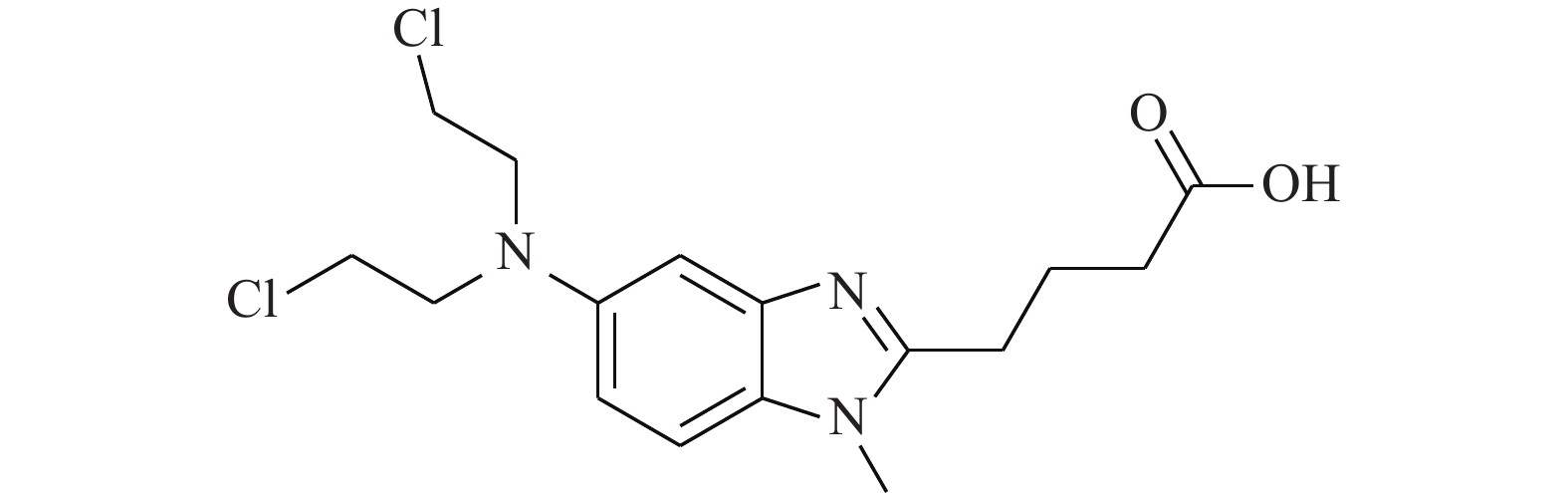
Iwamoto等[21]研究发现,苯达莫司汀(BENDA,图8)作为一种烷化剂,对多种癌症具有临床活性,包括但不限于非霍奇金淋巴瘤、慢性淋巴细胞性白血病和多发性骨髓瘤等。BENDA可以选择性结合细胞中的STAT3并抑制其活性,BENDA在体外选择性地拮抗STAT3-SH2结构域(IC50=7.4 μmol/L),而不是其他含有SH2的蛋白质(拮抗STAT1-SH2的IC50为60 μmol/L)。BENDA结合到STAT3中的半胱氨酸残基Cys550和Cys712位置上,从而抑制SH2与相应的p-Tyr肽的结合。
Chang等[22]研究发现,STAT3抑制剂BBI608(图9)是降低EGFR阳性肺癌细胞系细胞活力的潜在药物。BBI608可降低组蛋白甲基转移酶G9a介导的表皮生长因子受体3表达,抑制EGFR阳性肺癌(包括EGFR E746-A750 HCC827、WT-A549和T790 M H1975)的细胞活力。在与阿法替尼的对照实验中,BBI608更为明显地降低了A549和H1975细胞的生存能力,并降低了A549的细胞迁移。因此,BBI608极有潜力成为EGFR阳性肺癌的治疗药物。
研究表明,STAT3在各种类型的癌症中被组成性激活,并且直接参与癌细胞的免疫调节。Shastri等[23]对骨髓增生异常综合征(MDS)和急性髓性白血病(AML)患者的造血干细胞和祖细胞群体进行转录组分析,发现STAT3存在异常激活现象,而敲除STAT3后,体内白血病细胞的生长也受到了抑制,各类癌基因在恶性细胞中的表达也随之下降。
-
STAT3在多种实体瘤和血液性肿瘤中会过度激活,对肿瘤的发生和发展有着重要影响。因此,STAT3作为治疗肿瘤的新靶点已被研究人员所认同;同时,STAT3抑制剂对抗炎免疫有重要作用,在类风湿性关节炎等疾病研究中颇有成效。21世纪以来,STAT3抑制剂的临床前研究不断深入,但进入临床使用的药物却很少。因此,研发高效、低毒的STAT3抑制剂仍将是一种挑战。近年来,研究人员将多种天然产物(如雷公藤红素等)作为先导化合物,合成了更有效的小分子化合物,通过不断筛选、评价和选择活性大、特异性强的STAT3抑制剂,将中西医药物治疗与放疗、化疗结合,这可能是今后的STAT3研究方向之一,为抗肿瘤以及抗炎免疫研究提供新方向。
Research progress of STAT3 inhibitors
-
摘要: 信号转导及转录激活因子3(signal transducer and activator of transcription 3,STAT3)是一种信号转录蛋白。STAT3的异常激活与细胞的增殖、分化、癌变等密切相关,其在乳腺癌、胰腺癌、淋巴癌、肺癌等癌干细胞中存在异常表达。因此,抑制STAT3的异常表达已成为抗炎免疫、抗肿瘤治疗的一种新思路。Abstract: Signal transducer and activator of transcription 3 (STAT3) is a signal transcription protein that exists in the cytoplasm. The abnormal activation of STAT3 is closely related to cell proliferation, differentiation, and canceration. It has abnormal expression in cancer stem cells such as breast cancer, pancreatic cancer, lymphoma, and lung cancer. Therefore, inhibiting the abnormal expression of STAT3 has become a new approach for antitumor therapy.
-
疼痛是继血压、体温、呼吸、脉搏之后的第五大生命体征,长期的疼痛会严重影响躯体和社会功能,使患者无法参与正常的生活和社交活动,选择合适的镇痛药物,缓解疼痛症状,能有效改善患者生活质量、延缓疾病进程。麻醉药品的合理使用能有效消除或减轻患者中、重度疼痛,反之,不合理使用会使患者致成瘾性疼痛反复发作、依从性低、引发潜在的社会安全事件等危害。随着《上海市医疗机构麻醉药品、第一类精神药品管理规定》的颁布和实施,麻醉药品的合理使用和规范管理将成为医院下一阶段工作的重点。现对海军军医大学附属长海医院麻醉药品的使用情况进行统计分析。
1. 资料与方法
1.1 资料来源
数据来源于我院医院信息系统(HIS系统),收集2016—2019年我院住院患者使用麻醉药品的情况及相关数据。
1.2 方法
对麻醉药品处方数、用量、金额进行统计;筛选出病区患者麻醉药品处方,根据剂型、诊断、处方数等进行排序,分析麻醉药品的使用情况。
2. 结果
2.1 麻醉药品的用量
2016—2019年,我院住院患者麻醉药品用量情况详见表1。
表 1 住院患者麻醉药品用量情况年份 处方数(张) 使用量(m/kg) 金额(万元) 2016年 49 580 2 953.8 475.4 2017年 53 188 2 867.9 561.9 2018年 54 905 2 891.1 609.8 2019年 53 588 2 903.4 578.6 由表1可见,我院住院患者2016—2019年麻醉药品处方数、使用量、金额分别在53 000张、2 900 kg和550万元浮动;处方数、使用量和金额都未出现大幅度的波动,基本保持稳定。
2.2 麻醉药品的剂型选择
2016—2019年,不同剂型麻醉药品处方数详见表2。
表 2 麻醉药品各剂型处方张数与占比情况[张(%)]剂型 2016年 2017年 2018年 2019年 注射 15 820(61.4) 15 813(61.5) 16 682(64.7) 17 293(71.5) 口服 7 005(27.2) 7 159(27.8) 7 355(28.5) 6 043(25.0) 外用 2 947(11.4) 2 742(10.7) 1 760(6.8) 837(3.5) 合计 25 772(100.0) 25 714(100.0) 25 797(100.0) 24 173(100.0) 由表2可见,注射剂型的麻醉药品处方占比最高并逐年上升,分别为15 820张(61.4%)、15 813张(61.5%)、16 682张(64.7%)、17 293张(71.5%);口服剂型处方数相对稳定,外用剂型处方数逐年递减。
2.3 麻醉药品的选择
2016—2019年麻醉药品处方数详见表3。
表 3 处方中所用的麻醉药品品种及其占比情况[张(%)]药名 2016年 2017年 2018年 2019年 盐酸哌替啶注射液 8 009(31.1) 7 707(30.0) 7 151(27.7) 6 844(28.3) 盐酸羟考酮缓释片 3 623(14.1) 3 944(15.3) 4 431(17.2) 2 963(12.3) 枸橼酸芬太尼注射液 3 546(13.8) 2 596(10.1) 1 916(7.4) 1 341(5.5) 芬太尼贴剂 2 947(11.4) 2 742(10.7) 1 760(6.8) 837(3.5) 盐酸瑞芬太尼注射剂 1 824(7.1) 3 207(12.5) 5 590(21.7) 7 083(29.3) 盐酸吗啡缓释片 1 425(5.5) 1 270(4.9) 1 135(4.4) 1 380(5.7) 盐酸吗啡注射液 1 375(5.3) 1 228(4.8) 1 090(4.2) 981(4.1) 阿桔片 1 209(4.7) 1 270(4.9) 1 075(4.2) 1 132(4.7) 盐酸布桂嗪注射液 1 066(4.1) 1 074(4.2) 895(3.5) 784(3.2) 盐酸吗啡片 417(1.6) 442(1.7) 553(2.1) 477(2.0) 磷酸可待因片 331(1.3) 233(0.9) 161(0.6) 91(0.4) 枸橼酸舒芬太尼注射液 0(0.0) 1(0.0) 40(0.2) 260(1.1) 合计 25 772(100.0) 25 714(100.0) 25 797(100.0) 24173(100.0) 由表3可见,盐酸哌替啶注射液处方占比最高,分别为:8 009张(31.1%)、7 707张(30.0%)、7 151张(27.7%),2019年排名下降1位,但处方数和占比依然很高,为6 844张(28.3%)。盐酸瑞芬太尼注射剂处方数上升较快,分别为1 824张(7.1%)、3 207张(12.5%)、5 590张(21.7%)、7 083张(29.3%)。盐酸羟考酮缓释片是处方数和占比最高的口服麻醉药品,分别为3 623张(14.1%)、3 944张(15.3%)、4 431(17.2%)、2 963张(12.3%)。外用剂型麻醉药品处方数占比较低且逐年减少。
2.4 哌替啶处方诊断汇总
我院2016—2019年盐酸哌替啶注射液处方诊断汇总详见表4。
表 4 使用哌替啶处方的主要诊断及其分布情况排序 2016年 2017年 2018年 2019年 诊断 处方数[张(%)] 诊断 处方数[张(%)] 诊断 处方数[张(%)] 诊断 处方数[张(%)] 1 癌症 2 171(27.1) 癌症 1 927(25.0) 癌症 1 402(19.6) 癌症 1 633(23.9) 2 慢性胰腺炎 757(9.5) 慢性胰腺炎 1 101(14.3) 慢性胰腺炎 1 177(16.5) 慢性胰腺炎 1 107(16.2) 3 总胆管结石 560(7.0) 总胆管结石 518(6.7) 主动脉夹层主动脉瘤 501(7.0) 主动脉夹层主动脉瘤 394(5.8) 4 Ⅲ度烧伤 228(2.8) 主动脉夹层主动脉瘤 404(5.2) 总胆管结石 454(6.3) 总胆管结石 340(5.0) 5 多处特指部位①Ⅲ度烧伤 178(2.2) 梗阻性黄疸 188(2.4) 肺部阴影 151(2.1) 肺部阴影 262(3.8) 6 胰结石 168(2.1) 多处特指部位Ⅲ度烧伤 187(2.4) 多处特指部位Ⅲ度烧伤 141(2.0) 多处特指部位Ⅲ度烧伤 160(2.3) 7 冠状动脉粥样硬化性心脏病 135(1.7) 肺部阴影 130(1.7) 梗阻性黄疸 137(1.9) 胰占位性病变 159(2.3) 8 马凡综合征(Marfan) 128(1.6) 冠状动脉粥样硬化性心脏病 126(1.6) 胰占位性病变 132(1.8) 梗阻性黄疸 118(1.7) 9 肺部阴影 126(1.6) 胰占位性病变 121(1.6) 冠状动脉粥样硬化性心脏病 111(1.6) 冠状动脉粥样硬化性心脏病 116(1.7) 10 梗阻性黄疸 121(1.5) 胰结石 81(1.1) 下肢动脉硬化闭塞症(坏疽期) 108(1.5) 食管肿物 77(1.1) 合计 4 572(57.1) 4 783(62.1) 4 314(60.3) 4 366(63.8) 注:①特指部位指头面部和会阴部。 由表4可见,癌症和慢性胰腺炎是使用盐酸哌替啶注射液处方的主要诊断,诊断为癌症的处方数分别为:2 171张(27.1%)、1 927张(25.0%)、1 402张(19.6%)、1 633张(23.9%);诊断为慢性胰腺炎的处方数分别为:757张(9.5%)、1 101张(14.3%)、1 177张(16.5%)、1 107张(16.2%);其他主要诊断还有总胆管结石、主动脉夹层主动脉瘤等。
3. 分析与讨论
3.1 剂型的选择
我院住院药房的麻醉药品现有9个注射剂型,包括粉针剂和水剂;7个口服剂型,包括缓释制剂和普通制剂;2个外用剂型,为缓释贴剂;共18个品规,能满足临床对该类药物的诊疗需要。我院医生主要选择使用注射剂型的麻醉药品,以迅速缓解中、重度疼痛患者的症状。注射给药包括静脉注射、皮下注射和肌内注射;芬太尼类麻醉药品常以静脉注射给药,对于需要深度镇静的患者,静脉泵注芬太尼类麻醉药品能取得较好的效果;布桂嗪注射液、哌替啶注射液则以皮下或肌内注射给药,相比口服起效更快,肌内注射给药会引起注射痛,同时还有单次用药量大、副作用明显、重复给药易出现镇痛盲区等特点。口服给药有无创、使用方便、患者可自行服用的优点,根据WHO癌痛三阶梯治疗原则、麻醉药品临床应用指导原则等,都推荐非创伤给药途径作为镇痛的首选给药途径,《癌症疼痛诊疗规范》(2018版)则以口服给药作为首选,同时,根据具体情况选择其他途径用药,包括静脉、皮下、直肠和经皮给药等。口服给药在我院使用比例较低(不足30%),非创伤途径给药不足50%,非创伤给药作为首选途径的原则并未得到体现。由癌症引起的疼痛多为慢性疼痛,使用口服的控缓释制剂或者外用缓释贴剂,可使血药浓度保持稳定,避免因药物的血药浓度波动减弱镇痛效果,疼痛得不到控制的患者可能会引起或加重其焦虑、抑郁、乏力、失眠、食欲减退等症状[1]。WHO癌痛三阶梯治疗原则指出,止痛药应规律地按时给予,注射剂型作用时间短,反复注射可引起局部炎症、硬结和肌肉组织纤维化[2]。麻醉药品用于缓解中、重度疼痛,应选择合理的剂型,以提高治疗的满意度,减少不良反应。
3.2 品种的选择与使用
盐酸哌替啶注射液和盐酸瑞芬太尼注射剂是我院处方数最多的两种麻醉药品。盐酸瑞芬太尼注射剂是新型芬太尼衍生物,具有起效迅速、维持时间短、消失极快的特点;盐酸哌替啶注射液为人工合成的镇痛药,镇痛效力为盐酸吗啡的1/10,起效快、皮下或肌内注射后约10 min起效,镇痛作用维持3~4 h,作用时间较吗啡短。癌症引起的疼痛常为持续的慢性疼痛,哌替啶起效快、半衰期短,频繁的肌注给药会给患者造成极大痛苦,而且往往很快产生耐受性;同时,其代谢产物为去甲哌替啶,在体内半衰期长, 重复用药对于中枢神经系统有激惹毒性,可致精神异常、震颤和惊厥等不良反应,故哌替啶不宜用于癌痛患者的止痛。在部分医院哌替啶已越来越少在临床使用,更多使用口服或外用剂型的阿片类药物,以减少不良反应,增加患者依从性[3]。盐酸哌替啶注射液在我院主要用于因癌症、胰腺炎、结石、重度烧伤等疾病引起的疼痛,存在不合理使用的情况。在日常审方过程中,药师对不合理的药物选择应进行干预,推进麻醉药的合理使用,同时,癌痛示范病房的建设对麻醉药品规范合理使用能起到一定的带动作用[4]。盐酸羟考酮缓释片是处方数最多的口服剂型麻醉药品,羟考酮属于半合成的阿片类药物,主要作用于阿片μ、κ受体,口服生物利用度高,镇痛效果强,盐酸羟考酮缓释片是一种双相释放制剂,起效迅速并且缓释成分能维持平稳的血药浓度,适合慢性癌痛的治疗[5]。杨洋等[6-8]指出,盐酸羟考酮缓释片与硫酸吗啡缓释片相比,具有相同的镇痛效果,但盐酸羟考酮缓释片的不良反应更少、安全性更高。
4. 结语
综上所述,我院麻醉药品的使用还存在不合理现象,注射给药仍是我院医生首选的镇痛药给药方式,哌替啶在临床诊疗中使用过多,同时存在不合理使用,药师在审方工作中应加强对中、重疼痛患者麻醉药品处方的干预,提高麻醉药品使用的规范性和合理性。
-
[1] BANERJEE K, RESAT H. Constitutive activation of STAT3 in breast cancer cells: a review[J]. Int J Cancer,2016,138(11):2570-2578. doi: 10.1002/ijc.29923 [2] QIN J J, YAN L, ZHANG J, et al. STAT3 as a potential therapeutic target in triple negative breast cancer: a systematic review[J]. J Exp Clin Cancer Res,2019,38(1):195. doi: 10.1186/s13046-019-1206-z [3] 孙思博, 金时代, 郭人花. STAT3在非小细胞肺癌耐药中的研究进展[J]. 中国肺癌杂志, 2019, 22(7):457-463. doi: 10.3779/j.issn.1009-3419.2019.07.08 [4] ZHANG W D, YU W Y, CAI G P, et al. A new synthetic derivative of cryptotanshinone KYZ3 as STAT3 inhibitor for triple-negative breast cancer therapy[J]. Cell Death Dis,2018,9(11):1098. doi: 10.1038/s41419-018-1139-z [5] 王雨辰, 陈越, 季鸣, 等. STAT3靶点抑制剂Bt354抗前列腺癌作用及其分子机制研究[J]. 药学学报, 2019, 54(10):1851-1857. [6] XU L Y, SHI L X, QIU S S, et al. Design, synthesis, and evaluation of cyanopyridines as anti-colorectal cancer agents via inhibiting STAT3 pathway[J]. Drug Des Devel Ther,2019,13:3369-3381. doi: 10.2147/DDDT.S217800 [7] DAI X X, YIN C T, ZHANG Y, et al. Osthole inhibits triple negative breast cancer cells by suppressing STAT3[J]. J Exp Clin Cancer Res,2018,37(1):322. doi: 10.1186/s13046-018-0992-z [8] MCHUGH J. Systemic sclerosis: STAT3 - A key integrator of profibrotic signalling[J]. Nat Rev Rheumatol,2017,13(12):693. doi: 10.1038/nrrheum.2017.190 [9] LIU L, LIU F B, HUANG M, et al. Circular RNA ciRS-7 promotes the proliferation and metastasis of pancreatic cancer by regulating miR-7-mediated EGFR/STAT3 signaling pathway[J]. HBPD INT,2019,18(6):580-586. [10] YU H, LEE H, HERRMANN A, et al. Revisiting STAT3 signalling in cancer: new and unexpected biological functions[J]. Nat Rev Cancer,2014,14(11):736-746. doi: 10.1038/nrc3818 [11] CHEN Q, LV J, YANG W W, et al. Targeted inhibition of STAT3 as a potential treatment strategy for atherosclerosis[J]. Theranostics,2019,9(22):6424-6442. doi: 10.7150/thno.35528 [12] TURKSON J, RYAN D, KIM J S, et al. Phosphotyrosyl peptides block Stat3-mediated DNA binding activity, gene regulation, and cell transformation[J]. J Biol Chem,2001,276(48):45443-45455. doi: 10.1074/jbc.M107527200 [13] TIMOFEEVA O A, TARASOVA N I, ZHANG X P, et al. STAT3 suppresses transcription of proapoptotic genes in cancer cells with the involvement of its N-terminal domain[J]. Proc Natl Acad Sci USA,2013,110(4):1267-1272. doi: 10.1073/pnas.1211805110 [14] HUANG M, SONG K, LIU X Y, et al. AlloFinder: a strategy for allosteric modulator discovery and allosterome analyses[J]. Nucleic Acids Res,2018,46(W1):W451-W458. doi: 10.1093/nar/gky374 [15] HUANG W, DONG Z Z, WANG F, et al. A small molecule compound targeting STAT3 DNA-binding domain inhibits cancer cell proliferation, migration, and invasion[J]. ACS Chem Biol,2014,9(5):1188-1196. doi: 10.1021/cb500071v [16] BUETTNER R, CORZANO R, RASHID R, et al. Alkylation of cysteine 468 in Stat3 defines a novel site for therapeutic development[J]. ACS Chem Biol,2011,6(5):432-443. doi: 10.1021/cb100253e [17] CHENG X, LIU Y Q, WANG G Z, et al. Proteomic identification of the oncoprotein STAT3 as a target of a novel Skp1 inhibitor[J]. Oncotarget,2017,8(2):2681-2693. doi: 10.18632/oncotarget.13153 [18] SCHUST J, SPERL B, HOLLIS A, et al. Stattic: a small-molecule inhibitor of STAT3 activation and dimerization[J]. Chem Biol,2006,13(11):1235-1242. doi: 10.1016/j.chembiol.2006.09.018 [19] CHEN H J, YANG Z D, DING C Y, et al. Discovery of O-alkylamino tethered niclosamide derivatives as potent and orally bioavailable anticancer agents[J]. ACS Med Chem Lett,2013,4(2):180-185. doi: 10.1021/ml3003082 [20] SHIN D S, KIM H N, SHIN K D, et al. Cryptotanshinone inhibits constitutive signal transducer and activator of transcription 3 function through blocking the dimerization in DU145 prostate cancer cells[J]. Cancer Res,2009,69(1):193-202. doi: 10.1158/0008-5472.CAN-08-2575 [21] IWAMOTO K, UEHARA Y, INOUE Y, et al. Inhibition of STAT3 by anticancer drug bendamustine[J]. PLoS One,2017,12(1):e0170709. doi: 10.1371/journal.pone.0170709 [22] CHANG Y F, LIM K H, CHIANG Y W, et al. STAT3 induces G9a to exacerbate HER3 expression for the survival of epidermal growth factor receptor-tyrosine kinase inhibitors in lung cancers[J]. BMC Cancer,2019,19(1):959. doi: 10.1186/s12885-019-6217-9 [23] SHASTRI A, CHOUDHARY G, TEIXEIRA M, et al. Antisense STAT3 inhibitor decreases viability of myelodysplastic and leukemic stem cells[J]. J Clin Invest,2018,128(12):5479-5488. doi: 10.1172/JCI120156 期刊类型引用(3)
1. 李慧,聂雷,张佩瑶,刘煜,高士培. 奥马珠单抗辅助治疗难治性过敏性哮喘伴鼻炎患儿的效果. 中国医学创新. 2024(02): 10-14 .  百度学术
百度学术2. 周雯,刘小红. 奥马珠单抗联合布地奈德治疗重度支气管哮喘患儿的临床效果. 妇儿健康导刊. 2024(05): 91-94 .  百度学术
百度学术3. 周璇,张岩,张冰雪,邢琼琼,宋桂华,陈小松,张贵春. 儿童难治性哮喘的中西医治疗进展. 中国医药. 2023(12): 1902-1906 .  百度学术
百度学术其他类型引用(0)
-





 下载:
下载:
 下载:
下载: