-
抗菌药物耐药性是一个全球性的公共卫生问题。碳青霉烯类抗生素被认为是治疗多重耐药菌感染的最后防线,但随着其在临床的广泛应用及不合理使用,导致耐碳青霉烯类肠杆菌(CRE)特别是耐碳青霉烯类肺炎克雷伯菌(CRKP)激增,给临床抗感染治疗带来巨大挑战。
头孢他啶/阿维巴坦(ceftazidime/avibactam,CAZ/AVI)是一种新型β-内酰胺类/β-内酰胺酶抑制剂,研究表明,阿维巴坦在体外可抑制Ambler分类中的A类、C类和某些D类酶的活性,由于缺乏活性位点丝氨酸残基,对B类金属酶没有活性[1]。阿维巴坦可重新环化恢复活性从而可长效抑制β-内酰胺酶[2],能够恢复或增强头孢他啶抗菌活性,CAZ/AVI组合具有广谱抗菌活性,对包括CRE在内的多重耐药革兰阴性杆菌(MDR-GNB)具有强有力的杀菌活性。CAZ/AVI于2015年在美国获批上市,随后在欧洲和中国获批上市。现已陆续被美国食品药品管理局(FDA)、欧洲药品管理局(EMA)和国家药品监督管理局(NMPA)批准用于成人治疗方案有限或无其他选择的G-菌感染的治疗。目前,有一些小样本的回顾性研究表明[3-7],CAZ/AVI可能是治疗CRE/CRKP的有效替代品,但没有关于CAZ/AVI与其他抗菌药物用于CRE/CRKP的疗效和安全性比较的系统评价,以至于无法客观的评估两者之间的差异。本研究拟采用Meta分析方法,对国内外公开发表的CAZ/AVI治疗碳青霉烯类耐药菌感染的疗效和安全性研究进行系统评价,以期为CAZ/AVI的临床选用提供循证依据。
-
计算机检索PubMed、Embase、Cochrane Library、中国生物医学文献数据库(CBM)、中国知网(CNKI)、维普中文科技期刊数据库(VIP),并在此基础上进行手工检索及追查纳入文献的参考文献。检索时限为各数据库建库起至2021年2月。中文检索词为:头孢他啶阿维巴坦;英文检索词为:“ceftazidime/avibactam”“carbapenem-resistanece Enterobacteriaceae(CRE)”“carbapenem-resistance Klebsiella pneumonia(CRKP)”“carbapenemase-producing Enterobacteriaceae(CPE)”。检索采取主题词和自由词相结合的方式检索,如PubMed检索式:(“avibactam, ceftazidime drug combination [Supplementary Concept]”OR“avibactam-ceftazidime”OR“ceftazidime-avibactam”OR“Avycaz”) AND (“carbapenem-resistanece enterobacteriaceae”OR“carbapenem-resistance klebsiella pneumonia”OR“carbapenemase-producing enterobacteriaceae”)。
-
①研究类型:收集所有类型的中、英文临床研究,包括随机对照研究、队列研究、病例对照研究、有对照的病例报告(样本量≥10)。②研究对象:年龄≥18岁,临床确诊为CRE/CRKP感染患者,性别不限。③干预措施:试验组患者接受CAZ/AVI抗感染治疗,给药时间≥24 h,用法用量及疗程不等;对照组为其他常规抗菌药物,如多粘菌素或替加环素或碳青霉烯类或β-内酰胺酶抑制剂或氨基糖苷类等抗感染治疗。④结局指标:临床治愈率、临床缓解率、28 d/30 d全因病死率、感染复发率、不良事件发生率(adverse events,AEs)和严重不良事件发生率(SAEs)。
-
①重复发表或数据重复的文献;②报道信息太少、质量差及数据无法利用或错误的文献;③会议论文、病例报告和病例系列(样本量<10)、动物实验、体外实验。
-
由2名研究者通过阅读标题和摘要对检索所得文献进行初选和去重,再阅读全文并按照纳入与排除标准独立确定纳入文献。如有分歧则讨论解决,必要时提请第三方仲裁。提取数据包括第一作者及发表年限;研究设计类型;纳入人群的基本特征(分组及样本量、年龄、性别、耐药菌等);抗菌药物给药方案和结局指标。
-
由两位评价者依据纽卡斯尔-渥太华量表[8](Newcastle-Ottawa Scale,NOS)对纳入研究进行质量评价,如存在分歧则讨论决定。NOS主要包括研究人群选择、组间可比性和结果测量3个项目共8个条目,对文献质量的评价采用星级系统的半量化原则,该量表以星数代表分值,满分为9颗星。评分>6颗星为高质量研究,评分6颗星为中等质量研究,评分<6颗星为低质量研究[9]。NOS评分≥6颗星的文献方可纳入研究。
-
采用Cochrane协作网提供的RevMan 5.3统计软件进行Meta分析。本研究所有结局指标均为计数资料,故采用效应量比值比(OR)及其95%置信区间(CI)表示。采用χ2检验分析各研究结果间的统计学异质性,若各研究结果间异质性无统计学意义(P>0.10或I2<50%),则采用固定效应模型进行Meta分析,反之,则采用随机效应模型进行Meta分析。
-
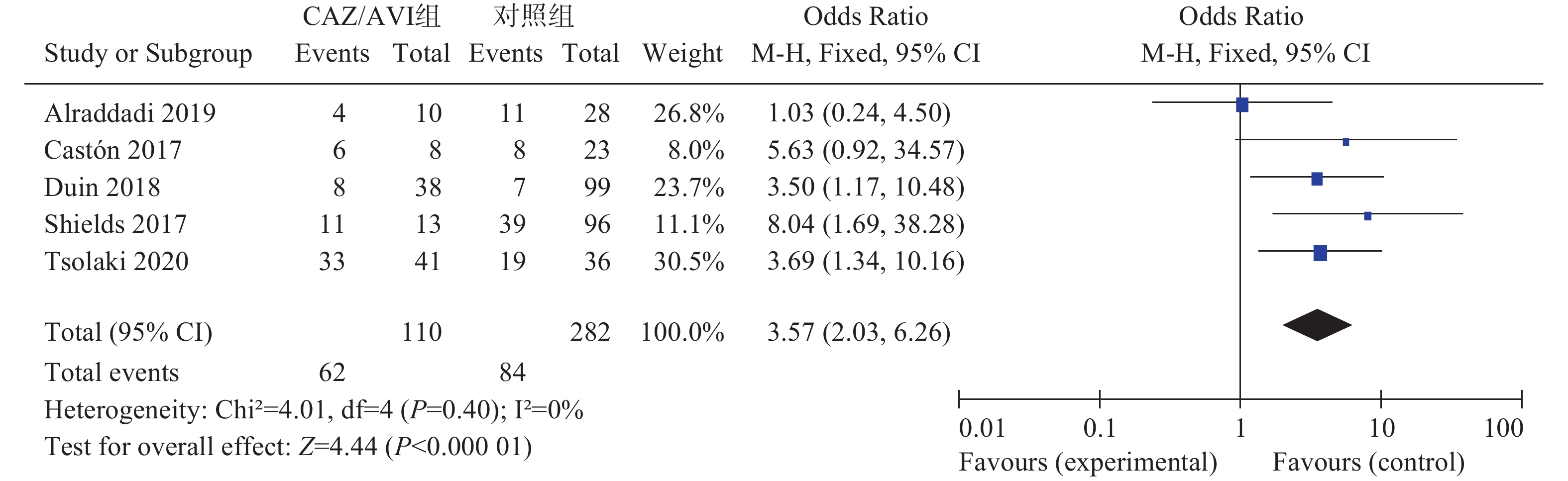
初筛得到相关文献564篇,其中,英文文献486篇(PubMed 315篇、Embase 83篇、Cochrane Library 88篇),中文文献78篇(CBM 28篇、CNKI 27篇、VIP 23篇)。剔除重复文献后获得248篇,阅读标题后排除与CAZ/AVI治疗CRE/CRKP/CPE感染不相关文献227篇。阅读剩余文献摘要,排除结局指标缺失或指标不相关文献33篇,得到文献11篇。阅读全文剔除样本量<10的文献后,最终纳入5篇英文文献[3-7]进入本研究。共计患者392例,其中,试验组110例,对照组282例。其中,1项为前瞻性研究,4项为回顾性研究。4项研究为CRE感染,1项研究为CRKP感染,4项CRE研究进行了碳青霉烯酶检测确定绝大部分菌株产KPC酶。纳入研究的基本信息见表1。
表 1 纳入研究基本信息
纳入研究 中心情况 研究类型 研究时间(年) 分组及样本量 平均年龄(岁) 男性(%) 致病菌 观察时间(t/d) 给药方案 伴随疗法 结局指标 Shields[3]
2017单中心
(美国)回顾性 2009-2017 T(13) 66 54 CRKP 90 CAZ/AVI GEN ①③④⑤⑥⑦ C(96) 59 (57.3) CB+AG,CB+COL,其他疗法 Castón[4]
2017多中心(西班牙、以色列) 回顾性 2012-2016 T(8) 61 50 CRE 30 CAZ/AVI AM,CB,FOS,TGC,COL ①③ C(23) 59 (65.2) CB,AG,
BLIBL,TGC,
FOS,COLDuin[5] 2018 多中心
(美国)前瞻性 2011-2016 T(38) 57 61 CRE 30 CAZ/AVI TIG,AG,GEN,CB,FOS,
SXT①②③⑥⑦ C(99) 63 (42) COL Alraddadi[6]2019 单中心(沙特阿拉伯) 回顾性 2017-2018 T(10) 59.5 80 CRE 30 CAZ/AVI - ①②③⑤ C(28) 61.5 (57.1) COL,CB,TGC,AM,QU,SXT,AZT Tsolaki[7]
2019多中心
(希腊)回顾性 40个月 T(41) 61.9 68.3 CRE 28 CAZ/AVI - ①③⑤ C(36) 59.1 (77.3) 适当抗生素
治疗注:T:试验组;C:对照组。结局指标:①临床治愈率;②临床缓解率;③28 d/30 d全因病死率;④感染复发率;⑤AEs;⑥SAEs。CAZ/AVI:头孢他啶/阿维巴坦;CB:碳青霉烯类;AG:氨基糖苷类;GEN:庆大霉素;COL:多粘菌素E;TGC:替加环素;BLIBL:β-内酰胺酶抑制剂;FOS:磷霉素;QU:喹诺酮类;SXT:复方磺胺甲唑;AZT:氨曲南。 -
依据NOS对5项观察性研究进行质量评价,NOS评分均为6颗星,符合纳入Meta分析标准。
-
5项研究[3-7]报道了临床治愈率,各研究间无统计学异质性(I2=0%,P=0.40),选择固定效应模型分析,结果显示,CAZ/AVI组患者临床治愈率高于对照组,结果有统计学意义[OR=3.57,95% CI(2.03,6.26),P<0.00001],见图1。
-
两项研究[5-6]报道了临床缓解率,各研究间无统计学异质性(I2=0%,P=0.45),选择固定效应模型分析,结果显示两组患者临床缓解率相当,结果无统计学意义[OR=1.92,95% CI(0.93,3.97),P=0.08]。
-
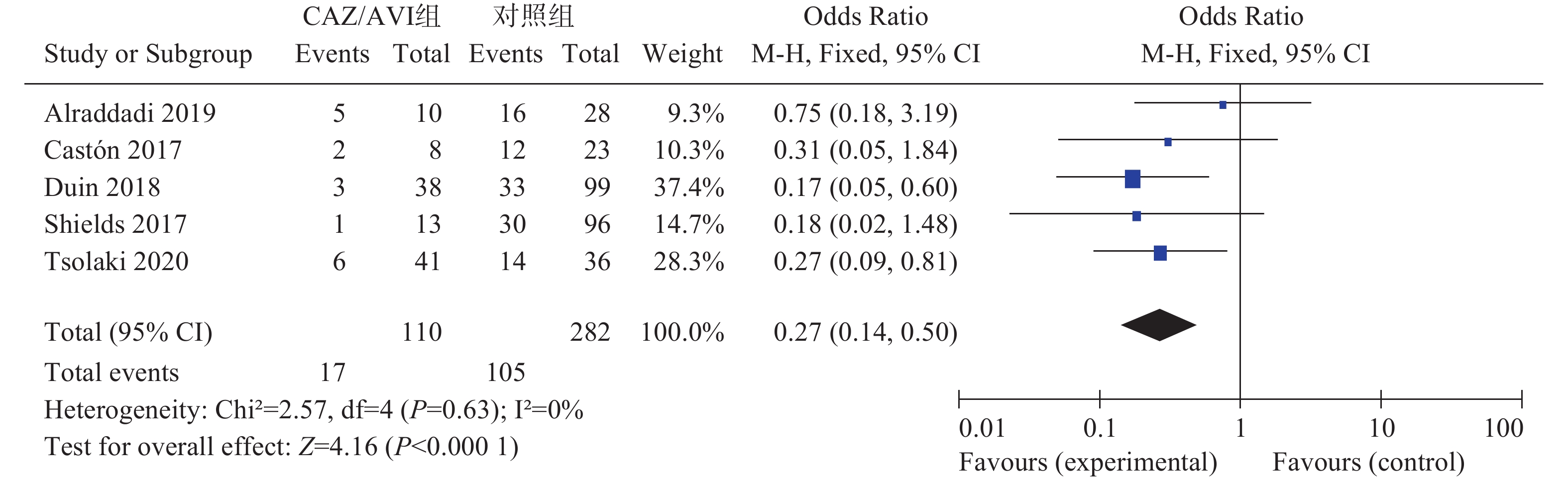
5项研究[3-7]报道了28 d/30 d全因病死率,各研究间无统计学异质性(I2=0%,P=0.63),选择固定效应模型分析,结果显示CAZ/AVI组患者28 d/30 d全因病死率低于对照组,结果有统计学意义[OR=0.27,95% CI(0.14,0.50),P<0.0001],见图2。
-
3项研究[3, 5-6]报道了感染复发率,各研究间有统计学异质性(I2=61%,P=0.08),选择随机效应模型分析,结果显示两组患者感染复发率相当,结果无统计学意义[OR=0.44,95% CI(0.11,1.85),P=0.26]。
-
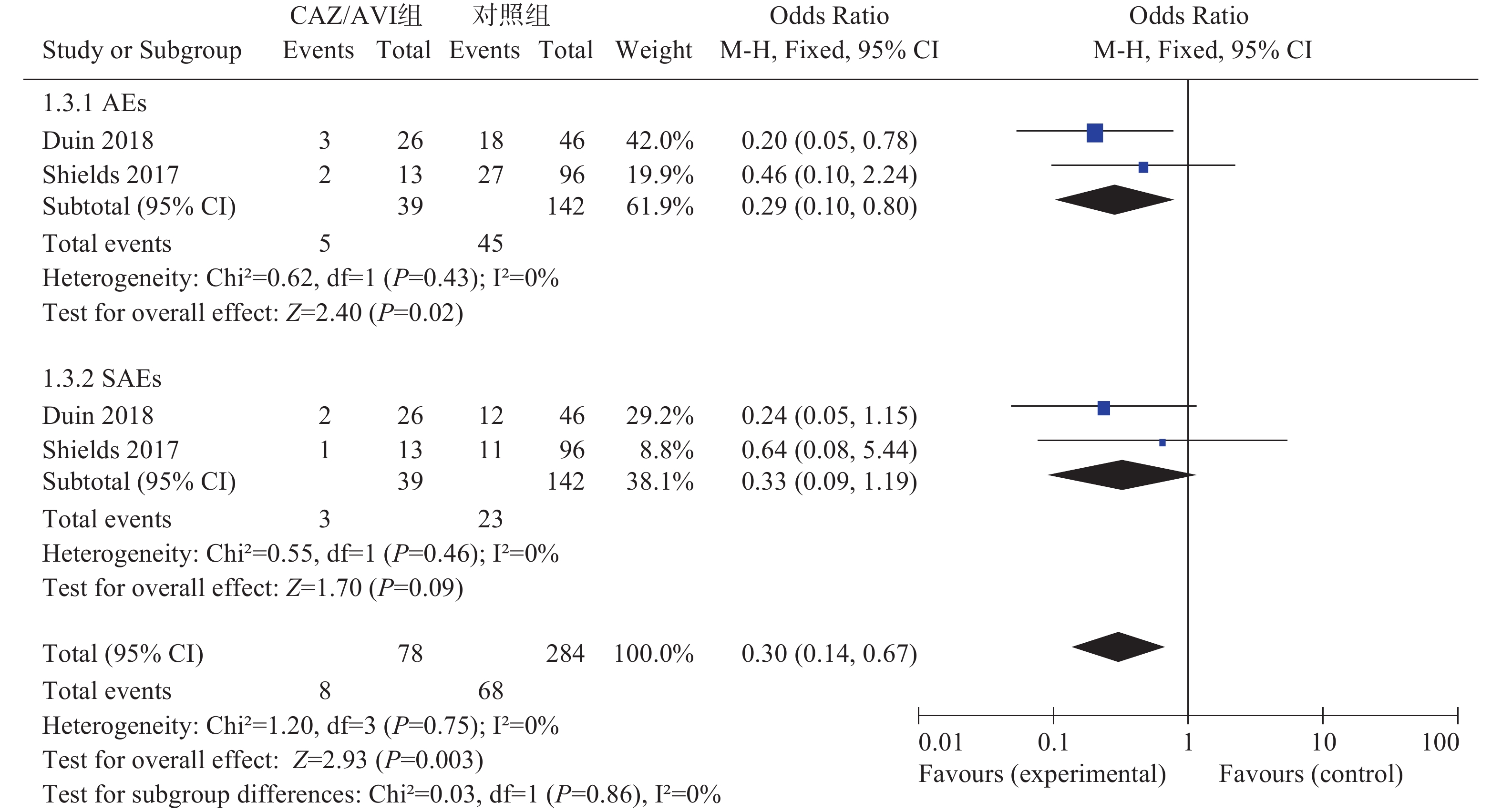
2项研究[3, 5]分别报道了不良事件(AEs)和严重不良事件(SAEs),各研究间均无统计学异质性(I2=0%,P=0.43)和(I2=0%,P=0.46),选择固定效应模型分析,结果显示,CAZ/AVI组患者AEs低于对照组,结果有统计学意义[OR=0.29,95% CI(0.10,0.80), P=0.02]。两组患者SAEs相当,结果无统计学意义[OR=0.33,95% CI(0.09,1.19), P=0.09],见图3。
-
由于缺乏有效和安全的替代治疗方案,碳青霉烯类抗生素耐药性的上升尤其令人担忧,临床迫切需要新的抗菌药物来解决耐药性带来的治疗难题。CAZ/AVI是第三代头孢菌素和新型的非β-内酰胺类的β-内酰胺酶抑制剂阿维巴坦相结合的抗生素,将CAZ的自身疗效与AVI的抑酶作用结合,能更广泛且安全有效地对抗大多数MDR-GNB引起的感染[10]。目前CRE/CRKP对其耐药率低,但其广泛的体外活性、人们对头孢他啶比较熟悉以及耐药菌治疗药物选择严重受限等情况,可能会刺激临床对CAZ/AVI使用。本研究结果对包括392例患者的5项队列研究进行了统计分析,对CAZ/AVI治疗碳青霉烯类耐药菌感染的疗效和安全性进行了系统评价,可为临床治疗CRE/CRKP感染提供循证支持,同时可作为评价CAZ/AVI用于MDR-GNB复杂感染的系统评价的最新补充。
疗效方面,CAZ/AVI组患者临床治愈率优于对照组,CAZ/AVI组患者28 d/30 d全因病死率低于对照组,差异均有统计学意义;两组患者临床缓解率和感染复发率相当,差异无统计学意义。提示CAZ/AVI在治疗CRE/CRKP感染中疗效优于多粘菌素、替加环素、碳青霉烯类、氨基糖苷类等其他抗菌药物。Zhong等[11]通过Meta分析指出CAZ/AVI在治疗革兰阴性菌感染时,临床治愈率和细菌清除率与碳青霉烯类(多利培南、亚胺培南-西司他丁、美罗培南、厄他培南)相当,差异无统计学意义。亚组分析显示,与对照组相比,CAZ/AVI可显著提高CRE患者的临床治愈率和降低患者病死率,差异有统计学意义。同时,最新的研究[12]结果显示,在CRE感染患者治疗中,CAZ/AVI与新药美罗培南-法硼巴坦有相似的临床成功率。值得注意的是,有研究[13-14]发现,CAZ/AVI单用治疗CRE感染时常出现耐药性。
安全性方面,CAZ/AVI组患者AEs低于对照组,差异有统计学意义;两组患者SAEs相当,差异无统计学意义。研究报道[15],阿维巴坦具有较低的潜在药物相互作用,其安全性和耐受性已在CAZ/AVI研发过程中的多个临床数据中确定,包括肾功能不全和接受药物联合治疗的受试者。多项关于CAZ/AVI的Meta分析结果显示,CAZ/AVI组与对照组患者发生不良事件包括严重不良事件相当。但在一些支持CAZ/AVI作为碳青霉烯类药物替代品的研究中,有报道不良事件发生率有所增加[16-17]。同时最新研究[18]结果表明,在ESBL阳性率为25%的肠杆菌科细菌中,CAZ/AVI组患者SAEs明显高于碳青霉烯类组。本文中安全性结果仅纳入2项研究,同时鉴于CAZ/AVI上市时间较短,且主要用于严重复杂感染患者,该药的安全性还有待进一步评估。
本研究经过广泛而全面的检索,通过系统评价合并扩大了样本量,除感染复发率外其他结局指标均无异质性,结果可信度较高。但因存在以下局限性,结论仍应被谨慎对待。第一,本研究纳入统计分析的患者样本量较少(<400);第二,本研究纳入文献数量较少,且均为观察性研究,研究质量低于随机对照研究,且由于数据受限,所采用的研究数据都是未经过调整的混杂因素(如患者基础疾病、疾病的严重程度、感染源、敏感性实验折点、细菌对碳青霉烯类的MIC值等),各纳入研究对照组患者治疗方案及伴随疗法有所出入,这些都可能导致假阳性或假阴性结果;第三,本研究纳入研究的语种限制为中、英文,存在选择性偏倚。
综上所述,与多粘菌素、替加环素等常规抗CRE/CRKP感染治疗方案相比,CAZ/AVI抗生素可提高该类患者临床治愈率、有效降低28 d/30 d全因病死率,临床疗效较优。不良事件发生率显著低于对照组,但严重不良事件发生率相当,安全性略优。鉴于纳入研究数量较少、质量不高,本研究结论有待设计更优的大型临床随机对照试验来验证,以期为临床工作提供科学合理的参考。
The efficacy and safety of ceftazidime/avibactam therapy on carbapenem-resistant Enterobacteriaceae infections: a Meta-analysis
-
摘要:
目的 系统评价头孢他啶/阿维巴坦(ceftazidime/avibactam,CAZ/AVI)治疗耐碳青霉烯类肠杆菌/肺炎克雷伯菌(CRE/CRKP)感染的疗效和安全性,以期为临床治疗提供循证依据。 方法 计算机检索PubMed、Embase、The Cochrane Library、CBM、CNKI、VIP电子数据库,收集从建库起至2020年5月公开发表的使用CAZ/AVI治疗CRE/CRKP感染的研究,由2名评价员独立按纳入与排除标准筛选文献、提取资料并评价纳入研究的方法学质量后,采用RevMan 5.3统计软件对结果进行分析。 结果 共纳入5篇英文文献,合计392例患者。结果显示有效性方面:CAZ/AVI组患者临床治愈率[OR=3.57, 95% CI(2.03, 6.26), P<0.00001]显著高于对照组。CAZ/AVI组患者28 d/30 d全因病死率[OR=0.27, 95% CI(0.14, 0.50), P<0.0001]显著低于对照组。两组患者临床缓解率[OR=1.92, 95% CI(0.93, 3.97), P=0.08]和感染复发率[OR=0.44, 95% CI(0.11, 1.85), P=0.26]无显著性差异。安全性方面:CAZ/AVI组患者不良事件(AEs) [OR=0.29, 95% CI(0.10, 0.80), P=0.02]显著低于对照组,两组患者严重不良事件(SAEs) [OR=0.33, 95% CI(0.09, 1.19), P=0.09]无显著性差异。 结论 当前证据表明,CAZ/AVI治疗碳青霉烯类耐药菌感染具有生存优势且并不增加SAEs,安全性好。受纳入研究质量和数量限制,上述结论有待更多高质量的RCT加以验证。 -
关键词:
- 头孢他啶/阿维巴坦 /
- 耐碳青霉烯类肠杆菌 /
- 耐碳青霉烯类肺炎克雷伯菌 /
- 系统评价 /
- 荟萃分析
Abstract:Objective To systematically evaluate the efficacy and safety of ceftazidime/avibactam(CAZ/AVI) in the treatment of carbapenem-resistant Enterobacteriaceae(CRE) or carbapenem-resistance Klebsiella pneumonia (CRKP), and to provide evidence-cased reference for clinic therapy. Methods A comprehensive literature search from PubMed, Embase, the Cochrane Library, CBM, CNKI and VIP database was conducted for the CAZ/AVI therapy on CRE/CRKP infections published before May.2020. Two reviewers independently screened literatures according to the inclusion and exclusion criteria, extracted data, and assessed the methodological quality of the included studies. The results were analyzed by RevMan 5.3 statistical software. Results Five studies in English involving 392 patients were included for the analysis. In terms of effectiveness, the results showed CAZ/AVI group significantly increased the clinical cure rate[OR=3.57, 95% CI (2.03, 6.26), P<0.00001] compared with the control group. Also CAZ/AVI group significantly decreased the 28/30 day all-cause mortality [OR=0.27, 95% CI (0.14, 0.50), P<0.0001]. There were no significant difference between the two groups in the clinical remission rate [OR=1.92, 95% CI (0.93, 3.97), P=0.08] and the infection recurrence rate [OR=0.44, 95% CI (0.11, 1.85), P=0.26]. In terms of safety, the incidence of adverse events in CAZ/AVI group were lower than those in control group [OR=0.29, 95% CI (0.10, 0.80), P=0.02]. There was no significant difference between two groups in the incidence of serious adverse events[OR=0.33, 95% CI (0.09, 1.19), P=0.09]. Conclusion The current evidence shows that CAZ/AVI therapy has advantage in survival rate for the treatment of CRE/CRKP infections without increase of SAEs. Limited by the quality and quantity of the included studies, the above conclusions need to be verified with more high-quality RCTs. -
雀梅藤Sageretia thea(Osbeck)Johnst又名雀梅刺、对角刺、碎米子等,为鼠李科雀梅藤属植物,主要分布地区包括云南、安徽、江苏等[1-2]。根、茎、叶均可入药,其性甘、淡、平,具有降气化痰、祛风利湿等功效[3]。民间常用雀梅藤药材煎汤或浸酒内服治疗乳腺肿瘤、淋巴结肿大和水肿等疾病,具有较好效果[4]。现代药理研究表明,雀梅藤具有抗结直肠癌、抗炎、抗氧化、抗病毒、抗菌和肝保护等活性[5-6],但尚未见雀梅藤对乳腺癌等其他肿瘤影响的报道。该研究通过多种体外实验观察雀梅藤对乳腺癌细胞增殖及凋亡的影响,并初步探索其作用机制,以证实民间应用该药材治疗乳腺肿瘤的合理性,为进一步的药物开发奠定基础。
1. 材料和仪器
1.1 试剂和仪器
CCK8 试剂盒(大连美仑生物技术有限公司);Spark酶标仪(瑞士Tecan公司);二氧化碳培养箱(Thermo Fisher);96孔培养板(泰坦);电子分析天平(塞多利斯 BSA2245-CW);细胞计数仪(Corning 6749);倒置相差显微镜(奥林巴斯 IX73)。
1.2 药材提取
雀梅藤药材购自昆明井田药业有限公司,生产许可证号:滇20160155。经海军军医大学药学系生药学教研室辛海量教授鉴定为鼠李科雀梅藤属植物雀梅藤Sageretia thea(Osbeck)Johnst.的茎。取雀梅藤干燥药材660 g,粉碎后用8倍量75%乙醇回流提取3次,每次1.5 h。合并提取液,过滤后回收溶剂,得乙醇提取物。乙醇提取物用水溶解混悬,加入等体积的石油醚萃取3次,收集萃取液,通过旋转蒸发得到石油醚萃取部位。进一步采用真空冷冻干燥机在−80 ℃下冻干,分别称重,获得乙醇和石油醚提取物质量为57 g和0.91 g,提取得率分别为8.63%和0.13%。
1.3 提取物溶解
称取20 mg雀梅藤石油醚提取物溶于1 ml的DMSO溶剂中,然后用培养液稀释成不同药物浓度,药物最高剂量下的DMSO浓度不超过0.3%。同时,对照组培养液中添加0.3%的DMSO作为阴性对照。
1.4 细胞株
三阴性人乳腺癌细胞株MDA-MB-231、BT549购自中国科学院上海细胞库;人脐静脉血管内皮细胞株购自上海赋望实业有限公司。
2. 方法
2.1 细胞活力分析
分别取对数生长期的人三阴性乳腺癌细胞株MDA-MB-231和BT549及人脐静脉血管内皮细胞株(HUVEC)并计数,以每孔5×103个的细胞密度接种到96孔板,在37 ℃的细胞培养箱中过夜培养至细胞贴壁。实验分为对照组和给药组,对照组以正常培养基培养,给药组以不同浓度含药培养基孵育细胞24 h。随后按试剂盒说明书进行操作,每孔加入10%的CCK8试剂,在培养箱中孵育2 h后,用酶标仪在450 nm处检测各孔的吸光度(OD)值。对照组细胞活力换算为100%,其余各给药组按以下公式计算:细胞增殖抑制率(%)=[(对照组A值−实验组A值)/(对照组A值−空白组A值)]×100%。
2.2 平板克隆试验
取上述对数生长期的人三阴性乳腺癌细胞株,以每孔500个细胞的密度均匀接种在12孔板内,过夜,使细胞贴壁,随后加入雀梅藤提取物孵育24 h。吸弃培养基,用含10%的胎牛血清培养基继续培养,当培养皿中出现肉眼可见的克隆形成时,终止培养。吸弃上清液,用PBS小心浸洗,然后甲醇固定。去除固定液,加入适量的结晶紫染色液进行染色,采用PBS多次轻轻洗去周边染色液,干燥后拍照,随后用Image J软件进行统计分析。
2.3 活死细胞分析
将两种乳腺癌细胞接种于96孔板,放置培养箱中过夜,随后加入提取物孵育24 h。吸弃培养基,用PBS温和洗涤细胞一次,每孔加入100 μl的Calcein AM/PI染色工作液,放入37 ℃培养箱中避光孵育15 min后,用高内涵系统采集图像。
2.4 细胞周期分析
取对数生长期乳腺癌细胞株,以每孔40万个细胞接种于6孔板,培养箱中过夜,待细胞贴壁后,用含不同浓度提取物的培养基处理24 h,消化,离心收集细胞,以预冷的70%乙醇混悬固定过夜。离心,去除乙醇,用PBS清洗一次,加入500 μl的碘化丙啶染色工作液,避光染色30 min后用流式细胞仪分析细胞周期。
2.5 流式凋亡分析
将对数生长期的三阴性乳腺癌细胞株以每孔40万个接种于6孔板中,过夜,待细胞贴壁后,用含不同浓度提取物的培养基孵育24 h。消化,离心收集细胞,用100 μl的1×结合缓冲液混悬后加入FITC Annexin V 和PI各5 μl,轻微振荡,室温下避光孵育15 min,流式细胞仪分析凋亡率。
2.6 DAPI染色分析
将上述对数生长期的人三阴性乳腺癌细胞株以每孔20万个接种于6孔板,过夜,待细胞贴壁后,用含不同浓度提取物的培养基孵育24 h,吸弃培养基,每孔加入1 ml稀释过的DAPI染液孵育细胞10 min,PBS清洗2遍后采用Cytation 5拍照。
2.7 线粒体膜电位(MMP)分析
将对数生长期的人三阴性乳腺癌细胞株以每孔20万个接种于6孔板,过夜,待细胞贴壁后,用含不同浓度提取物的培养基孵育细胞24 h。吸弃培养液,PBS洗涤细胞之后每孔加入1 ml的JC-1染液,在37 ℃培养箱中孵育20 min。吸除上清液,用缓冲液洗涤细胞3次后加入2 ml细胞培养液,高内涵系统拍照。
2.8 活性氧(ROS)含量检测
取上述对数生长期细胞株,以每孔20万个的细胞密度接种于6孔板,过夜,待细胞贴壁后,用含不同浓度提取物的培养基孵育24 h。吸弃培养基,每孔加入1 ml含DCFH-DA的新鲜培养基孵育细胞20~30 min,DAPI复染,采用高内涵系统拍照。
2.9 统计学处理
使用Graphpad Prism 8.0.1分析软件对所获得的实验数据进行统计学分析,组间比较采用单因素方差分析,两组比较采用t检验,以P<0.05为差异有统计学意义。
3. 结果
3.1 抑制乳腺癌细胞生长
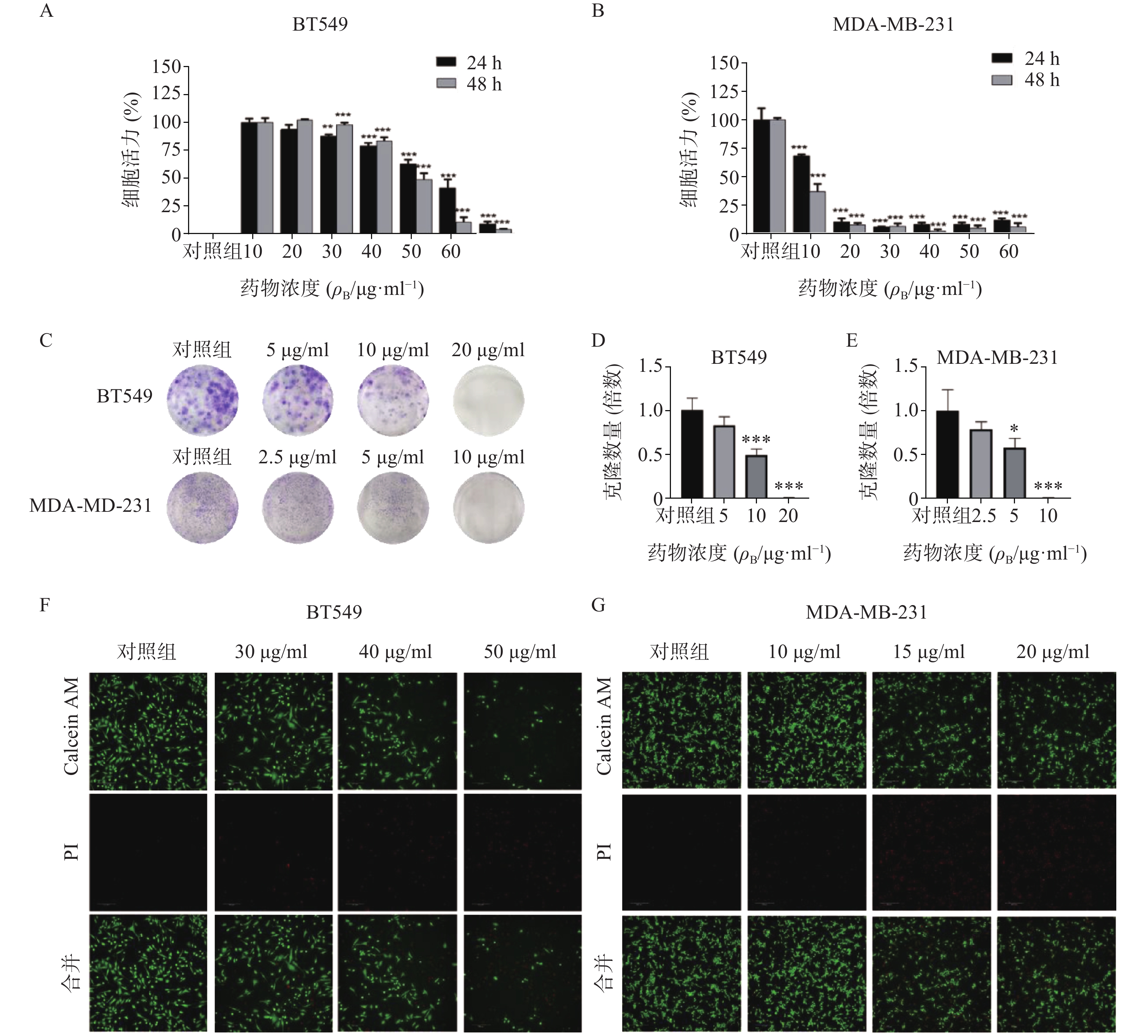
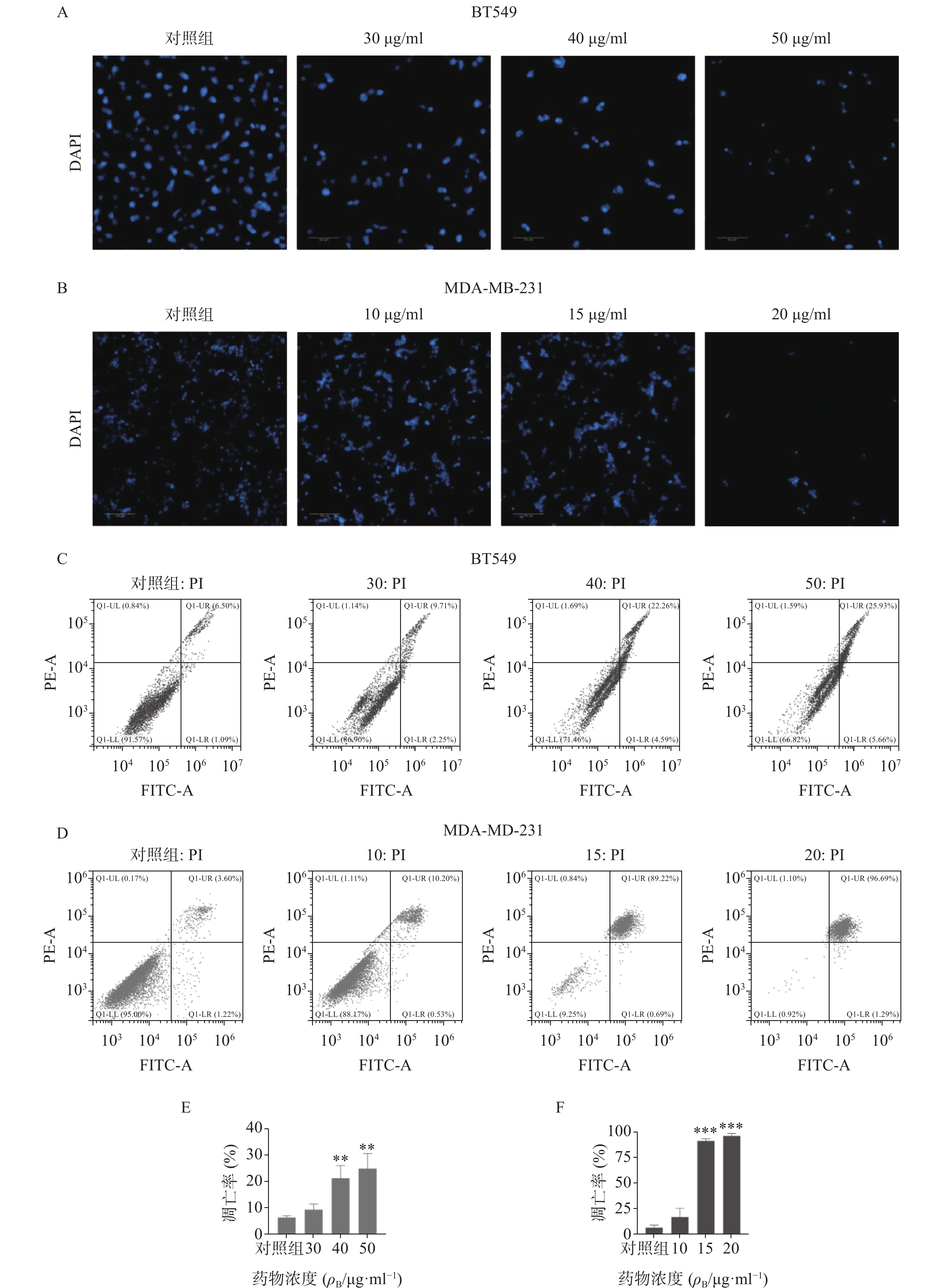
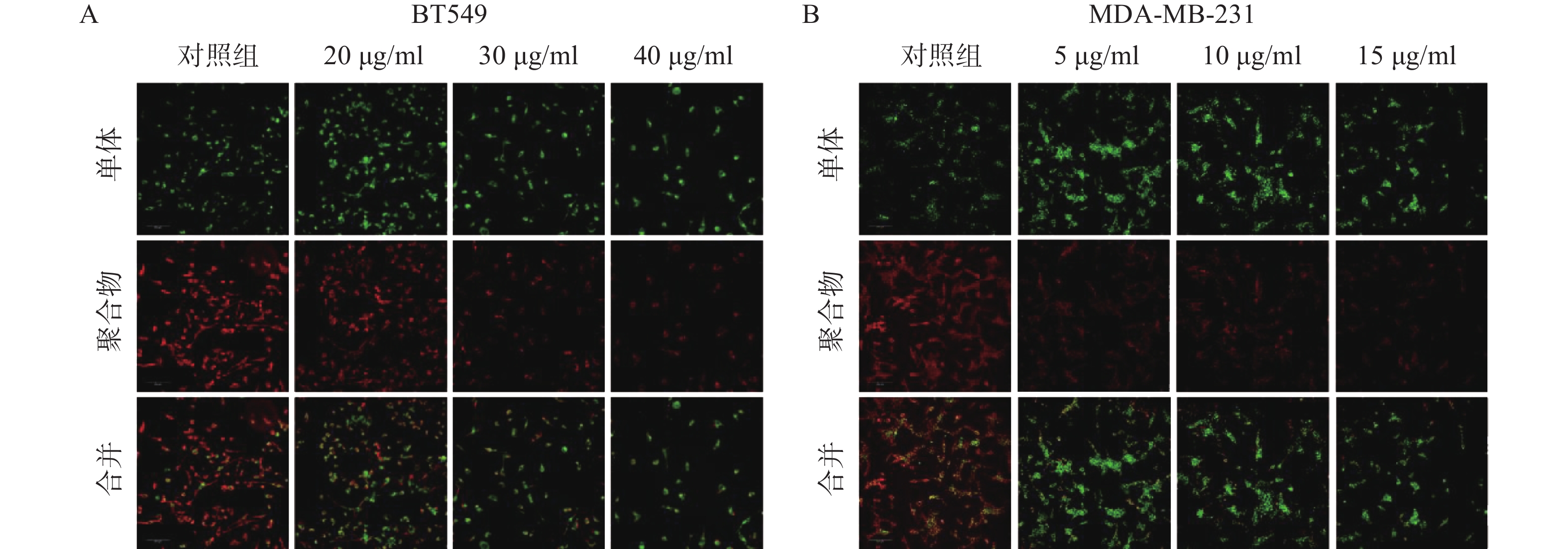
通过细胞活力分析发现,雀梅藤石油醚提取部位对多种癌细胞均有明显细胞毒性,其中对乳腺癌细胞株抑制作用最强,而且明显强于乙醇提取物。结合临床应用,实验选择两种人三阴性乳腺癌系(BT549和MDA-MB-231)进一步研究(见图1)。CCK8结果表明(图1A-B),雀梅藤石油醚提取物以剂量和时间依赖的方式抑制乳腺癌细胞活力,作用24 h和48 h的IC50值分别为45.40、12.23 μg/ml和38.87、7.60 μg/ml。平板克隆实验结果显示(图1C-E),随着雀梅藤石油醚提取物剂量的增加,两种乳腺癌细胞生长均被显著抑制。浓度分别在10 μg/ml和20 μg/ml时,MDA-MA-231和BT549细胞株的生长被完全抑制。Calcein AM/PI活死细胞染色显示(图1F-G),随着药物剂量增加,活细胞(绿色)数量较对照组显著减少,而死亡细胞(红色)数量则显著增加,与对照组比较有极显著差异。
3.2 诱导乳腺癌细胞周期阻滞
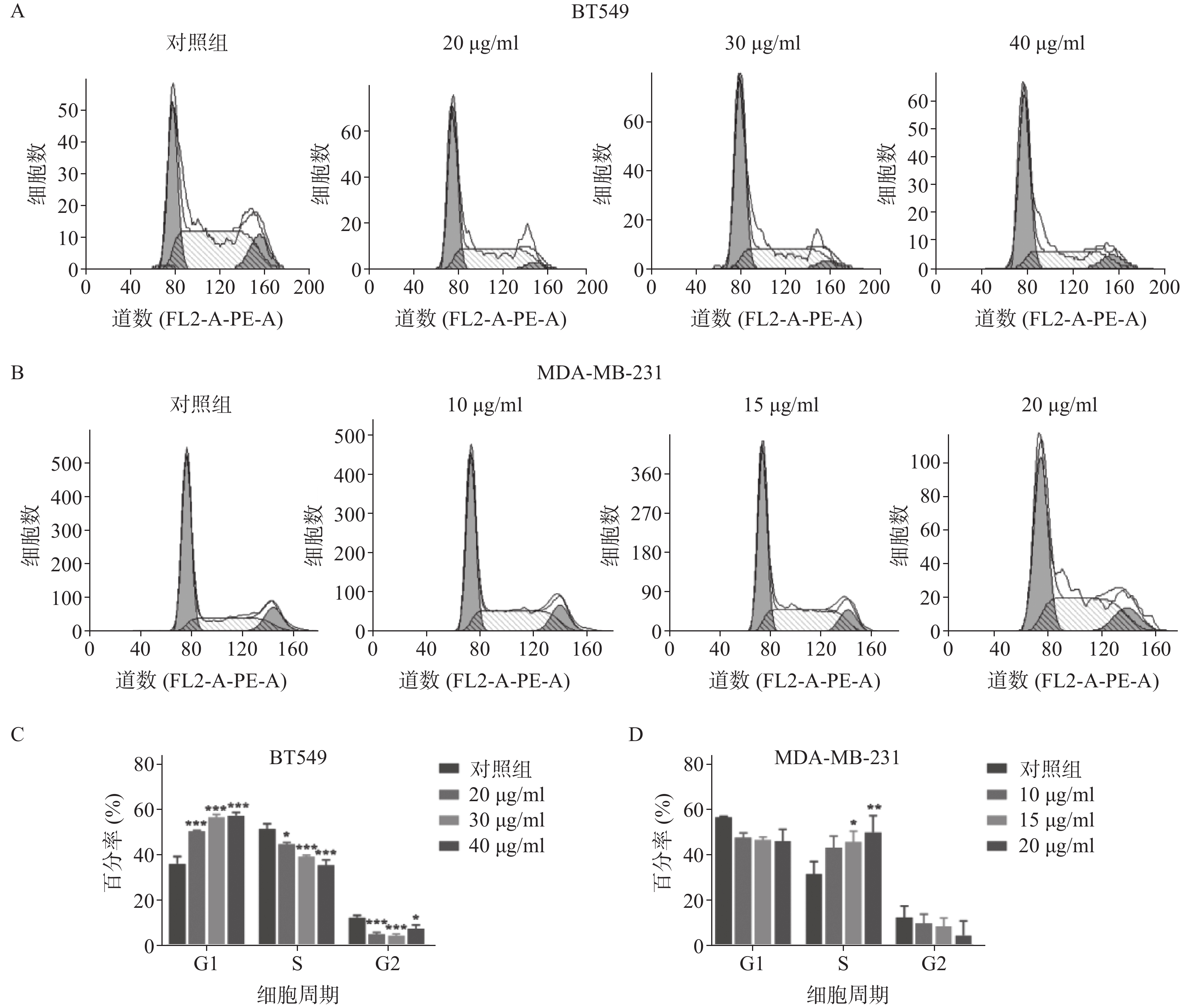
雀梅藤石油醚提取物孵育乳腺癌细胞24 h后,采用流式细胞仪测定细胞的增殖周期情况(见图2)。结果显示,药物明显阻滞两种乳腺癌细胞株的细胞周期,但对两种细胞阻滞周期不同,BT549细胞阻滞在G1期(图2A和2C,给药组G1期细胞比率较对照组显著升高),MDA-MA-231细胞阻滞在S期(图2B和2D,给药组S期细胞比率较对照组显著升高),提示石油醚提取物对两种细胞株的细胞周期阻滞可能存在不同机制。
3.3 诱导乳腺癌细胞凋亡
采用DAPI染色方法对细胞核形态进行分析(见图3)。如图3A-B所示,正常对照组乳腺癌细胞核呈均匀的圆形浅蓝色,药物处理后细胞核质固缩或碎裂成凋亡小体,且呈剂量依赖性。流式细胞仪凋亡定量分析显示(图3C-F),石油醚提取物显著增加两种乳腺癌细胞的凋亡率,与对照组比较有显著性差异,其中尤以MDA-MA-231细胞株明显,20 μg/ml浓度下几乎诱导细胞全部凋亡。
3.4 诱导线粒体膜电位坍塌
线粒体通路是肿瘤细胞最常见的凋亡途径,最典型的特征是线粒体膜电位(MMP)水平显著下降。因此,研究采用JC-1免疫荧光染色检测线粒体膜电位水平。结果如图4所示,给药组红色荧光随剂量增加明显减弱,绿色荧光则明显增强,说明给药组线粒体膜电位显著下降。实验结果提示,雀梅藤石油醚提取物可能通过损伤线粒体而促进了乳腺癌细胞凋亡。
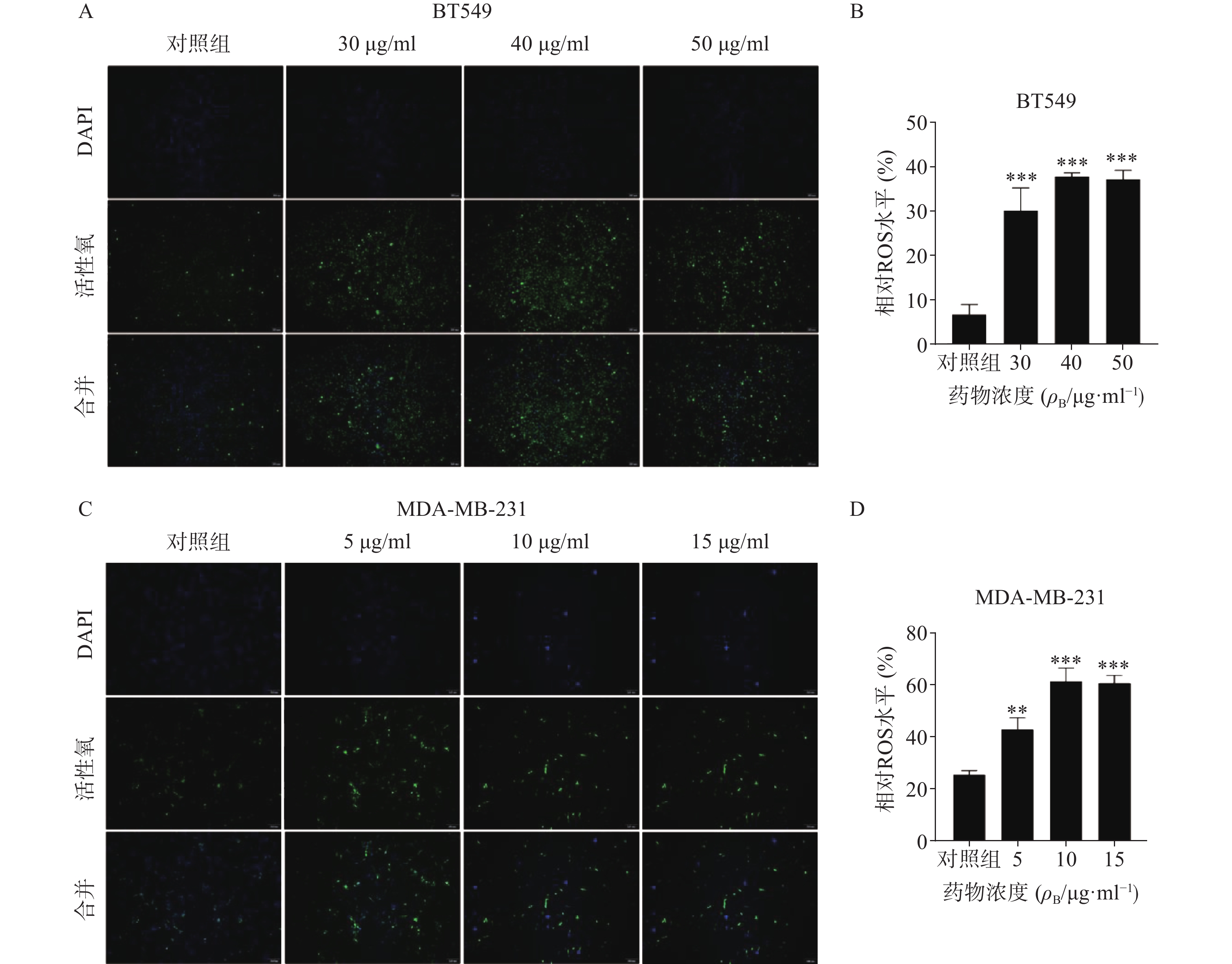
3.5 促进乳腺癌细胞活性氧生成
ROS升高是激活线粒体通路诱导肿瘤细胞凋亡的重要原因之一,因此进一步检测了药物处理24 h后ROS含量变化(图5)。结果代表ROS水平的绿色荧光在对照组仅有少量表达,而在给药组则显著增加,经统计学处理有显著性差异,其中尤以BT549细胞株明显,提示药物可能通过促进ROS生成而诱导了乳腺癌细胞凋亡。
3.6 对正常血管内皮细胞活力的影响
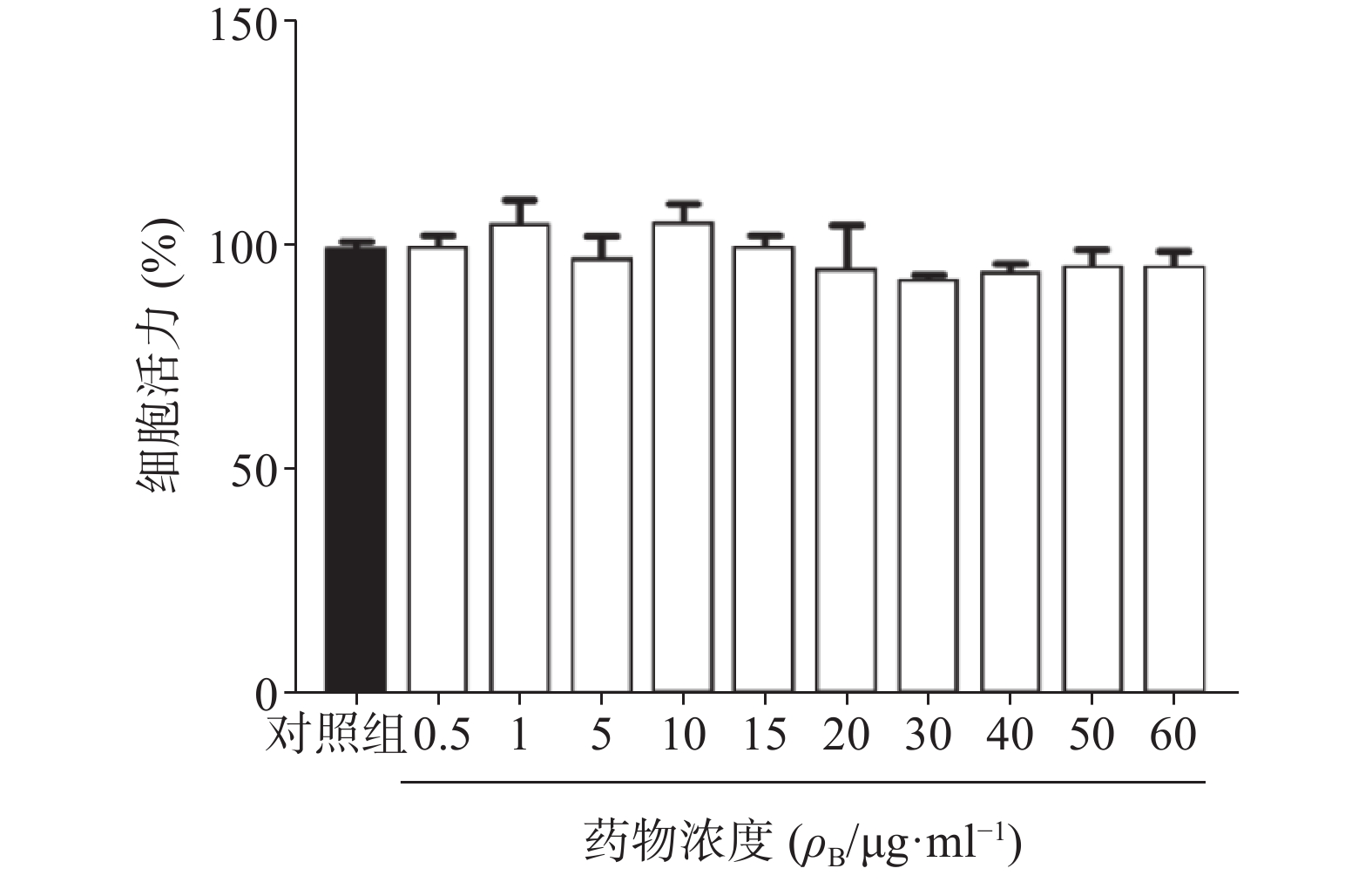
为了确定雀梅藤提取物是否对正常细胞产生毒性,进一步采用同样剂量对人正常脐静脉血管内皮细胞(HUVEC)进行CCK8细胞活力分析。结果提取物孵育24 h后,即使在60 μg/ml的最高浓度下亦未观察到内皮细胞活力受到影响,与对照组比较无明显差异(图6),提示雀梅藤石油醚提取物对正常细胞并不产生毒性,具有较好的安全性。
4. 讨论
雀梅藤为云南等地民间常用中药,临床观察发现其对乳腺瘤生长有明显抑制作用[7],且毒性较小[4, 8]。研究前期对雀梅藤的乙醇、石油醚、乙酸乙酯、二氯甲烷、正丁醇等5个部位提取物进行了多种肿瘤细胞活性筛选,结果显示,对多数癌细胞,如乳腺癌、结肠癌、肝癌等,都具有明显杀伤作用,其中以石油醚部位提取物对癌细胞作用最为显著。进一步实验发现,雀梅藤石油醚提取物时间和剂量依赖地抑制乳腺癌细胞活力,显著减少细胞克隆形成率,阻滞细胞周期在G1/S期,明显增加癌细胞凋亡率,但并不影响正常血管内皮细胞活力,提示其细胞毒性具有明显的选择性。
引起细胞凋亡的途径包括线粒体通路、死亡受体通路和内质网应激通路,其中线粒体通路是药物诱导肿瘤细胞凋亡的最常见途径[9],因此研究人员进一步观察了雀梅藤石油醚提取物是否通过损伤线粒体诱导乳腺癌细胞凋亡。结果通过JC-1染色发现,两种乳腺癌细胞的线粒体膜电位均显著降低,提示雀梅藤提取物诱导了细胞线粒体途径的凋亡。
ROS的主要来源之一是线粒体内膜的呼吸链底物端,ROS升高会引起线粒体内膜损伤,造成细胞毒性,从而促进肿瘤细胞凋亡[10]。研究人员用荧光探针方法检测雀梅藤石油醚提取物孵育BT549和MDA-MB-231细胞后的ROS水平,结果发现代表ROS的绿色荧光逐渐增强,表明石油醚提取物显著升高了线粒体内ROS水平。这些结果提示,石油醚提取物可能通过升高线粒体内ROS水平,造成ROS累积,损伤了线粒体,导致线粒体内容物如细胞色素c等流出到细胞质,进而激活caspase级联瀑布反应,从而诱导了细胞凋亡[9,11]。
虽然雀梅藤提取物在体外研究中表现出较好的抗乳腺癌细胞生长作用,但是凋亡信号转导通路和作用靶点尚不明确,线粒体中蛋白表达的变化犹未可知,因此具体作用机制尚需进一步研究。此外,已有研究人员从雀梅藤药材中鉴定出43种化学成分,可分为有机酸类、黄酮类及其他类,有机酸类包括儿茶素及其衍生物等,黄酮类包括异槲皮素等[12]。但是雀梅藤提取物中究竟何种成分发挥主要抗癌作用仍需进一步证实。
-
表 1 纳入研究基本信息
纳入研究 中心情况 研究类型 研究时间(年) 分组及样本量 平均年龄(岁) 男性(%) 致病菌 观察时间(t/d) 给药方案 伴随疗法 结局指标 Shields[3]
2017单中心
(美国)回顾性 2009-2017 T(13) 66 54 CRKP 90 CAZ/AVI GEN ①③④⑤⑥⑦ C(96) 59 (57.3) CB+AG,CB+COL,其他疗法 Castón[4]
2017多中心(西班牙、以色列) 回顾性 2012-2016 T(8) 61 50 CRE 30 CAZ/AVI AM,CB,FOS,TGC,COL ①③ C(23) 59 (65.2) CB,AG,
BLIBL,TGC,
FOS,COLDuin[5] 2018 多中心
(美国)前瞻性 2011-2016 T(38) 57 61 CRE 30 CAZ/AVI TIG,AG,GEN,CB,FOS,
SXT①②③⑥⑦ C(99) 63 (42) COL Alraddadi[6]2019 单中心(沙特阿拉伯) 回顾性 2017-2018 T(10) 59.5 80 CRE 30 CAZ/AVI - ①②③⑤ C(28) 61.5 (57.1) COL,CB,TGC,AM,QU,SXT,AZT Tsolaki[7]
2019多中心
(希腊)回顾性 40个月 T(41) 61.9 68.3 CRE 28 CAZ/AVI - ①③⑤ C(36) 59.1 (77.3) 适当抗生素
治疗注:T:试验组;C:对照组。结局指标:①临床治愈率;②临床缓解率;③28 d/30 d全因病死率;④感染复发率;⑤AEs;⑥SAEs。CAZ/AVI:头孢他啶/阿维巴坦;CB:碳青霉烯类;AG:氨基糖苷类;GEN:庆大霉素;COL:多粘菌素E;TGC:替加环素;BLIBL:β-内酰胺酶抑制剂;FOS:磷霉素;QU:喹诺酮类;SXT:复方磺胺甲唑;AZT:氨曲南。 -
[1] VAN DUIN D, BONOMO R A. Ceftazidime/avibactam and ceftolozane/tazobactam: second-generation β-lactam/β-lactamase inhibitor combinations[J]. Clin Infect Dis,2016,63(2):234-241. doi: 10.1093/cid/ciw243 [2] ZHANEL G G, LAWSON C D, ADAM H, et al. Ceftazidime-avibactam: a novel cephalosporin/β-lactamase inhibitor combination[J]. Drugs,2013,73(2):159-177. doi: 10.1007/s40265-013-0013-7 [3] SHIELDS R K, NGUYEN M H, CHEN L, et al. Ceftazidime-avibactam is superior to other treatment regimens against carbapenem-resistant Klebsiella pneumonia bacteremia[J]. Antimicrob Agents Chemother,2017,61(8):e00883-17. [4] CASTÓN J J, LACORT-PERALTA I, MARTÍN-DÁVILA P, et al. Clinical efficacy of ceftazidime/avibactam versus other active agents for the treatment of bacteremia due to carbapenemase-producing Enterobacteriaceae in hematologic patients[J]. Int J Infect Dis,2017,59:118-123. doi: 10.1016/j.ijid.2017.03.021 [5] VAN DUIN D, LOK J J, EARLEY M, et al. Colistin versus ceftazidime-avibactam in the treatment of infections due to carbapenem-resistant Enterobacteriaceae[J]. Clin Infect Dis,2018,66(2):163-171. doi: 10.1093/cid/cix783 [6] ALRADDADI B M, SAEEDI M, QUTUB M, et al. Efficacy of ceftazidime-avibactam in the treatment of infections due to Carbapenem-resistant Enterobacteriaceae[J]. BMC Infect Dis,2019,19(1):772. doi: 10.1186/s12879-019-4409-1 [7] TSOLAKI V, MANTZARLIS K, MPAKALIS A, et al. Ceftazidime-avibactam to treat life-threatening infections by carbapenem-resistant pathogens in critically ill mechanically ventilated patients[J]. Antimicrob Agents Chemother,2019,64(3):1-11. [8] WELLS G, SHEA B, O'CONNELL D, et al. New Castle-Ottawa Quality Assessment Scale-Cohort Studies[EB/OL]. [2020-03-28]. http://www.ohri.ca/programs/clinical_epidemiology/oxford.asp. [9] OWNBY R L, CROCCO E, ACEVEDO A, et al. Depression and risk for Alzheimer disease: systematic review, meta-analysis, and metaregression analysis[J]. Arch Gen Psychiatry,2006,63(5):530-538. doi: 10.1001/archpsyc.63.5.530 [10] GARBER K. A β-lactamase inhibitor revival provides new hope for old antibiotics[J]. Nat Rev Drug Discov,2015,14(7):445-447. doi: 10.1038/nrd4666 [11] ZHONG H, ZHAO X Y, ZHANG Z L, et al. Evaluation of the efficacy and safety of ceftazidime/avibactam in the treatment of Gram-negative bacterial infections: a systematic review and meta-analysis[J]. Int J Antimicrob Agents,2018,52(4):443-450. doi: 10.1016/j.ijantimicag.2018.07.004 [12] ACKLEY R, ROSHDY D, MEREDITH J, et al. Meropenem-vaborbactam versus ceftazidime-avibactam for treatment of carbapenem-resistant Enterobacteriaceae infections[J]. Antimicrob Agents Chemother,2020,64(5). doi: 10.1128/aac.02313-19 [13] LI D, LIAO W, HUANG H H, et al. Emergence of hypervirulent ceftazidime/avibactam-resistant Klebsiella pneumoniae isolates in a Chinese tertiary hospital[J]. Infect Drug Resist,2020,13:2673-2680. doi: 10.2147/IDR.S257477 [14] ZHANG P, SHI Q, HU H, et al. Emergence of ceftazidime/avibactam resistance in carbapenem-resistant Klebsiella pneumoniae in China[J]. Clin Microbiol Infect,2020,26(1):124.e1-124124.e4. doi: 10.1016/j.cmi.2019.08.020 [15] TORRES A, ZHONG N S, PACHL J, et al. Ceftazidime-avibactam versus meropenem in nosocomial pneumonia, including ventilator-associated pneumonia (REPROVE): a randomised, double-blind, phase 3 non-inferiority trial[J]. Lancet Infect Dis,2018,18(3):285-295. doi: 10.1016/S1473-3099(17)30747-8 [16] LUCASTI C, POPESCU I, RAMESH M K, et al. Comparative study of the efficacy and safety of ceftazidime/avibactam plus metronidazole versus meropenem in the treatment of complicated intra-abdominal infections in hospitalized adults: results of a randomized, double-blind, Phase II trial[J]. J Antimicrob Chemother,2013,68(5):1183-1192. doi: 10.1093/jac/dks523 [17] GATTI M, RASCHI E, DE PONTI F. Relationship between adverse drug reactions to antibacterial agents and the Klebsiella pneumoniae carbapenemase-producing (KPC) Klebsiella pneumoniae outbreak: insight from a pharmacovigilance study[J]. BMC Pharmacol Toxicol,2019,20(1):65. doi: 10.1186/s40360-019-0364-0 [18] STERNBACH N, LEIBOVICI WEISSMAN Y, AVNI T, et al. Efficacy and safety of ceftazidime/avibactam: a systematic review and meta-analysis[J]. J Antimicrob Chemother,2018,73(8):2021-2029. doi: 10.1093/jac/dky124 -





 下载:
下载:
 下载:
下载: