-
盐酸安罗替尼(AL3818)商品名福可维,是我国自主研发的1.1类新药。安罗替尼是一种以血管内皮生长因子受体(VEGFR)、成纤维细胞生长因子受体(FGFR)、血小板衍生生长因子(PDGFR)、干细胞因子(c-kit)受体为靶点的新型口服多靶点酪氨酸激酶抑制剂(TKIs)[1]。截止目前安罗替尼已获国家药品监督管理局(NMPA)批准,用于三线治疗非小细胞肺癌(NSCLC)和小细胞肺癌(SCLC),以及二线治疗软组织肉瘤(STS)。同时,安罗替尼单药或联合放化疗、PD-1/PDL-1治疗恶性肿瘤的多个临床试验正在开展中。预计会有越来越多的患者使用安罗替尼,因此亟需了解其不良反应特性。
与大部分VEGFR抑制剂相同,高血压也是安罗替尼常见的不良反应之一,然而,在临床试验中高血压发生率报道具有很大的差异。先前的荟萃分析(Meta-analysis)表明,使用VEGFR抑制剂与高血压发生风险增加相关[2-7],但目前国内外暂无关于安罗替尼高血压发生率和发生风险的Meta分析报道。由于高血压控制不佳可能导致剂量下调、严重的心血管事件甚至危及生命的后果,所以确定与安罗替尼相关的高血压发生率和发生风险十分重要。本研究拟对已发表的临床试验进行Meta分析,以确定其总体发生率和风险。同时探索VEGFR抑制剂之间高血压发生的差异,这可能会为理解其潜在机制以及制定治疗策略提供更多的参考依据。
-
英文以“anlotinib”“AL3818”“clinical trial”等为检索词,检索Pubmed、Cochrane Library、Embase数据库,同时检索美国临床肿瘤学会(ASCO)获得会议论文,通过ClinicalTrials.gov网站获得相关临床试验信息。中文以“安罗替尼”“福可维”“AL3818”“临床试验”等为检索词,检索中国知网、万方、维普和中国生物医学文献服务系统数据库。检索时间为建库至2020年7月,收集国内外公开发表的与安罗替尼相关的临床试验。
-
纳入标准:①前瞻性Ⅱ期和Ⅲ期临床试验;②受试者经病理组织学或细胞学检查证实为癌症患者;③试验组使用安罗替尼单药;④结局指标至少包含以下其中一种:发生所有等级或高等级(≥3级)高血压事件。
排除标准:①重复发表的文献;②动物实验;③Ⅰ期临床试验;④回顾性研究;⑤观察性研究;⑥病例报道;⑦试验组联合用药;⑧未详细报道本研究定义的结局指标;⑨通讯或评论;⑩同一试验的亚组分析。
-
由2名研究者独立进行文献筛选和数据提取,并进行交叉核对,如出现分歧则通过讨论或咨询第三方解决。对于每一项研究提取以下信息:第一作者姓名、恶性肿瘤种类、试验阶段和类型、治疗方案和对照方案、纳入分析的患者人数及总人数以及发生高血压事件的人数等。纳入的研究根据美国国家癌症研究所的统一评价标准(3.0或4.0版本;http://ctep.cancer.gov)对高血压事件进行评估和记录,高等级(≥3级)为严重的不良事件。
-
采用R软件(3.6.0版本)中的meta程序包进行Meta分析,根据提取到的数据,计算与安罗替尼相关的高血压发生率及其95%置信区间(CI)。为了准确计算相对风险(RR)及其95% CI,仅纳入对照组为安慰剂的随机对照试验(RCT)的数据。采用I2和Q统计量评估纳入研究的异质性,I2≥50%,P<0.05表明异质性较大,采用随机效应模型进行合并分析,反之,使用固定效应模型进行合并分析。应用SPSS软件(26.0版本),分析比较安罗替尼与各种VEGFR抑制剂的高血压发生率。双侧P<0.05表示差异具有统计学意义。
-
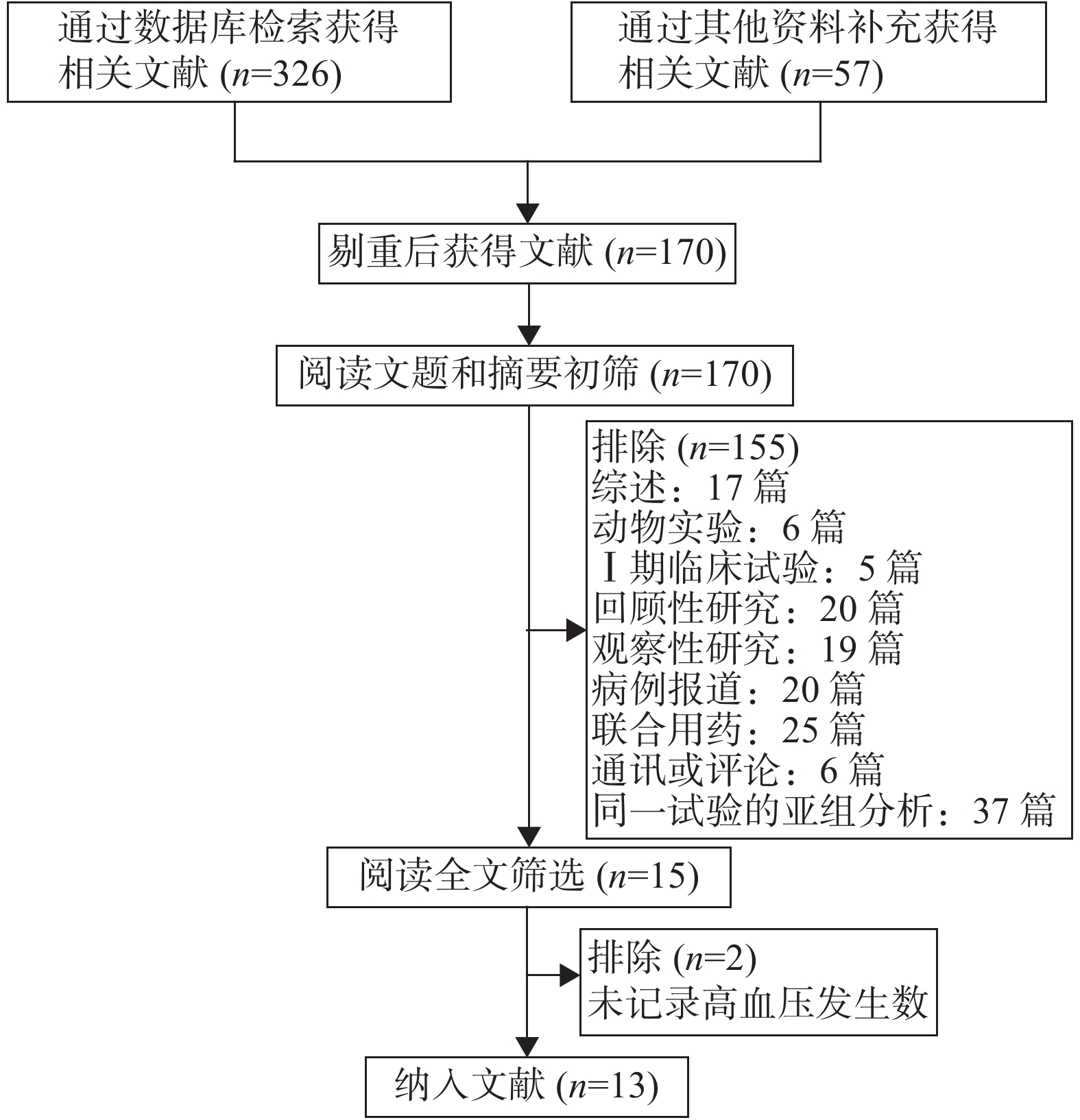
初筛后共获得文献170篇,经阅读文题和摘要后筛选出15篇文献,仔细阅读全文后,纳入符合入选标准的文献13篇。文献筛选流程见图1。
-
纳入的13项研究均为英文文献,包括6篇前瞻性单臂Ⅱ期临床试验,6篇Ⅱ期RCT临床试验,1篇Ⅲ期RCT临床试验,共纳入1387名(安罗替尼:1187人,安慰剂:200人)癌症患者进行Meta分析。纳入研究的基本特征详见表1。
表 1 纳入的13项研究的基本信息
纳入文献 肿瘤类型 试验设计 药物名称 患者数 高血压发生数 试验组 对照组 试验组 对照组 试验组 ≥G3① 对照组 ≥G3② Wu[8] 小细胞肺癌 Ⅱ期 单臂 安罗替尼 NA 45 NA 6 3 NA NA Han[9] 非小细胞肺癌 Ⅲ期RCT 安罗替尼 安慰剂 294 143 199 40 24 0 Ma[10] 转移性肾细胞癌 Ⅱ期 单臂 安罗替尼 NA 42 NA 19 2 NA NA Chi[11] 软组织肉瘤 Ⅱ期 单臂 安罗替尼 NA 166 NA 70 8 NA NA Sun[12] 甲状腺髓样癌 Ⅱ期 单臂 安罗替尼 NA 58 NA 23 3 NA NA Tang[13] 骨癌 Ⅱ期 单臂 安罗替尼 NA 42 NA NR 8 NA NA Shan[14] 卵巢癌 Ⅱ期 单臂 安罗替尼 NA 14 NA 8 0 NA NA Zhou[15] 转移性肾细胞癌 Ⅱ期 RCT 安罗替尼 舒尼替尼 90 43 45 12 29 11 Han[16] 非小细胞肺癌 Ⅱ期RCT 安罗替尼 安慰剂 60 57 33 6 3 0 Chi[17] 软组织肉瘤 Ⅱ期 RCT 安罗替尼 安慰剂 158 75 99 30 NR NR Huang[18] 食管鳞状细胞癌 Ⅱ期 RCT 安罗替尼 安慰剂 110 55 NR 17 NR NR Wang[19] 小细胞肺癌 Ⅱ期 RCT 安罗替尼 安慰剂 46 22 18 7 NR NR Chi[20] 甲状腺髓样癌 Ⅱ期 RCT 安罗替尼 安慰剂 62 NR 29 NR NR NR 注:NA:不适用;NR:未报道;①试验组高血压≥G3的发生数;②对照组高血压≥G3的发生数。 -
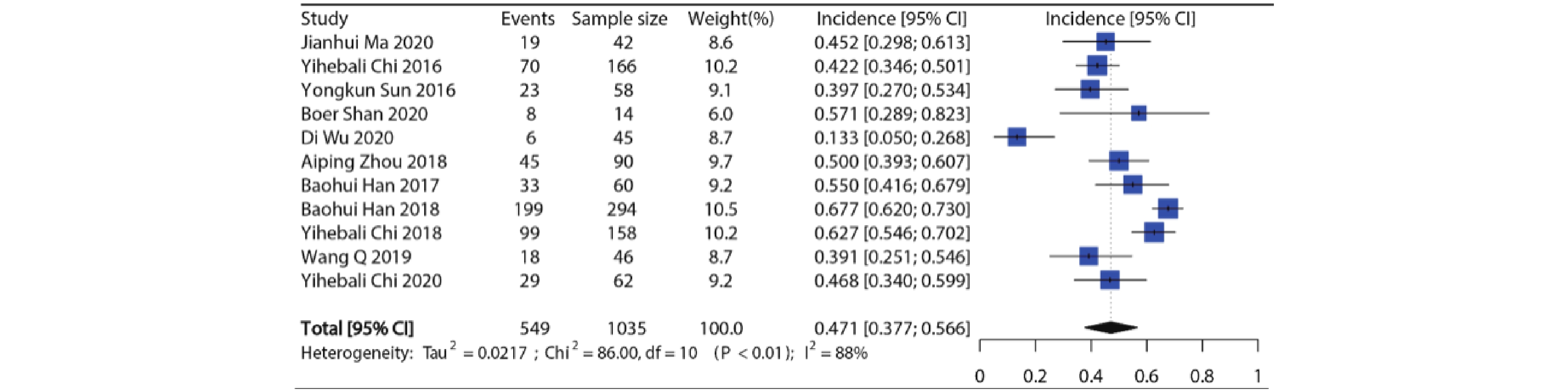
纳入11项研究共1035例病例用于分析,各个研究所有等级高血压发生率在13.3%~67.7%,发生率最低的是用于SCLC的Ⅱ期RCT临床试验[8],发生率最高的是用于NSCLC的Ⅲ期RCT临床试验[9]。Meta分析显示纳入研究之间具有异质性(I2=88%, P<0.01),因此使用随机效应模型合并,接受安罗替尼治疗的患者所有等级高血压的总发生率约为47.1%(95%CI:37.7%~56.6%),结果见图2。
-
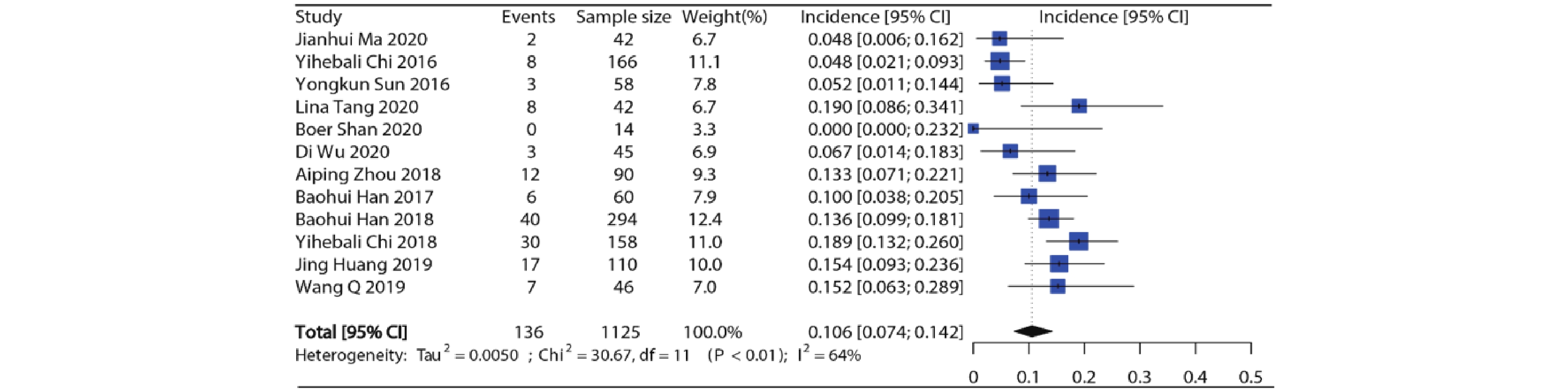
12项研究报道了接受安罗替尼的患者(合计1 125例)高等级高血压发生率,各项研究的高等级高血压发生率在0%~19.0%之间。Meta分析结果显示纳入研究之间存在异质性(I2=64%, P<0.01),因此采用随机效应模型,合并得到安罗替尼高等级高血压总发生率约为10.6%(95%CI:7.4%~14.2%),结果见图3。
-
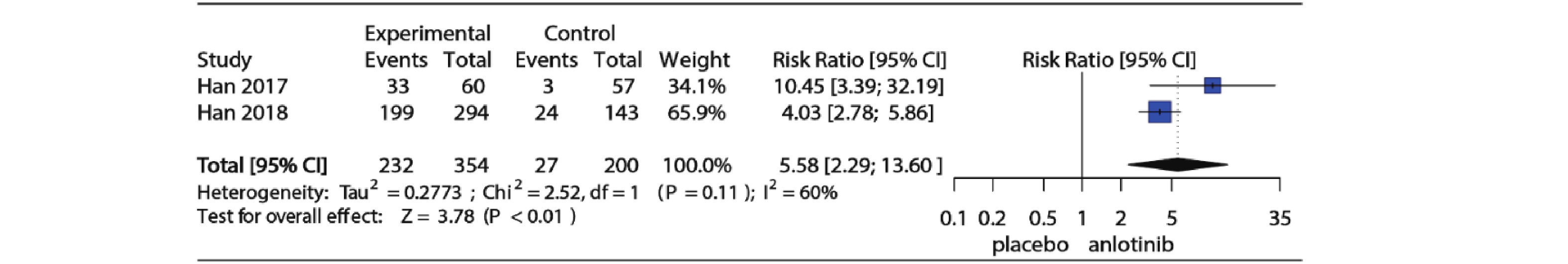
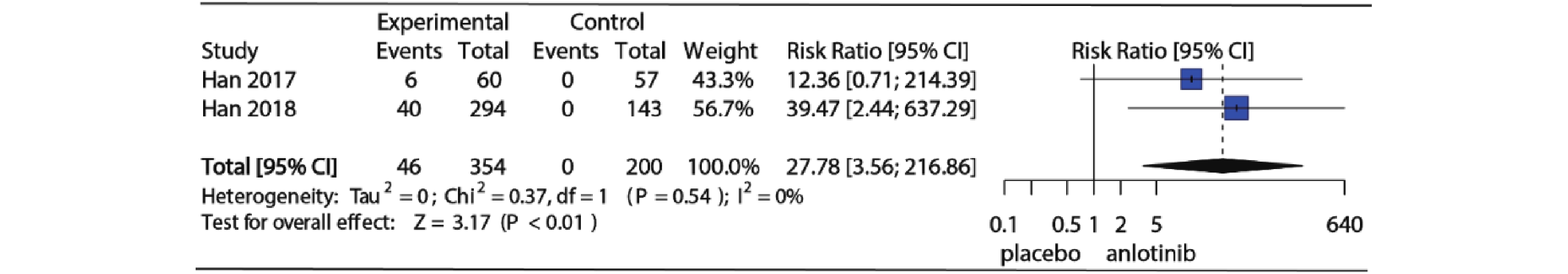
3项RCT研究详细记录了试验组和对照组高血压发生情况,2项对照组为安慰剂,1项对照组为舒尼替尼,为了明确安罗替尼与安慰剂相比高血压发生风险,仅纳入对照组为安慰剂的2项RCT研究。Meta分析结果如图4所示,I2=60%,P=0.11提示研究存在中等异质性,使用随机效应模型合并(RR=5.58, 95%CI:2.29~13.60, P<0.01)。图5为安罗替尼与安慰剂相比发生高等级高血压的相对危险度及Meta分析森林图,I2=0%,P=0.54,提示纳入的2项研究之间无异质性,采用固定效应模型合并(RR=27.78, 95%CI: 3.56~216.86, P<0.01)。
-
比较已发表的6个VEGFR抑制剂药物高血压发生率的Meta分析文献,进一步探讨了安罗替尼与其他VEGFR抑制剂高血压发生率的差异,表明安罗替尼高等级高血压发生率与阿昔替尼(RR=0.79, 95%CI:0.61, 1.02, P=0.066)和卡赞替尼(RR=0.87, 95%CI:0.67, 1.13, P=0.290)相似(见表2)。
表 2 安罗替尼与其他VEGFR抑制剂高血压发生率的比较
序号 比较组别 所有等级高血压 高等级高血压 发生率(样本量) RR(90% CI) P 发生率(样本量) RR(90% CI) P 1 安罗替尼 47.1%(1035) 10.6% (1175) 2 索拉非尼 23.4% (3363) 2.91(2.51~3.37) <0.001 5.7% (3567) 1.96(1.50~2.31) <0.001 3 舒尼替尼 21.6% (4609) 3.23(2.80~3.72) <0.001 6.8% (4407) 1.62(1.30~2.03) <0.001 4 帕唑帕尼 35.9% (1242) 1.59(1.34~1.88) <0.001 6.5% (1286) 1.71(1.28~2.30) <0.001 5 凡德他尼 24.2% (1815) 2.78(2.37~3.28) <0.001 6.4% (1190) 1.73(1.28~2.34) <0.001 6 阿昔替尼 40.1% (1148) 1.33(1.12~1.58) <0.001 13.1% (1148) 0.79(0.61~1.02) 0.066 7 卡赞替尼 27.8% (1083) 2.31(1.93~2.76) <0.001 12.0% (1083) 0.87 (0.67~1.13) 0.290 注:表中RR值和P值均为安罗替尼与其他VEGFR抑制剂相比较;其他VEGFR抑制剂高血压发生率数据从已发表文献中提取。 -
Egger检验和Begg检验结果显示,纳入分析的发生所有等级高血压事件(Egger检验:P=0.050,Begg检验:P=0.243)和高等级高血压事件(Egger检验:P=0.366,Begg检验:P=0.243)的相关文献未见明显发表偏倚。
-
血管内皮生长因子(VEGF)是参与肿瘤血管生成的关键因子,目前VEGFR抑制剂是多种癌症的一线治疗药物。然而,在使用其治疗癌症的同时可能会诱发高血压,高血压不仅会增加心血管系统不良事件的发生风险,还可能累及其他系统,如导致肾脏损害、高血压性视网膜病变等[21]。
本研究共纳入1387例病例,研究结果提示接受安罗替尼治疗的癌症患者高血压发生率较高(所有等级47.1%, 95%CI:37.7%~56.6%;高等级10.6%, 95%CI:7.4%~14.2%);与安慰剂相比,安罗替尼高血压发生风险显著增加(所有等级RR=5.58, 95%CI:2.29~13.60, P<0.01;高等级RR=27.78, 95%CI:3.56~216.86, P<0.01)。因此,在临床应用过程中应重视监测患者的血压,并根据血压的分级及时进行处理。
尽管有实验和临床证据表明VEGFR抑制剂与其发生高血压有直接的关系,但具体病理生理学和分子生物学机制尚不明确。其可能的机制包括:①VEGF通过促进内皮细胞释放一氧化氮(NO)从而产生血管扩张的效应,VEGFR抑制剂则会导致NO合成减少促进血管收缩,导致外周阻力增加和血压升高[22];②内皮素-1分泌增加,导致全身血管阻力增加和高血压效应[23];③VEGF可维持毛细血管网的完整性,当受到抑制时,可能会导致毛细血管的密度下降或结构疏松从而导致高血压[24]。
目前尚无关于使用VEGFR抑制剂治疗的患者血压管理的正式指南,美国国家癌症研究所药物研究委员会的心血管毒性小组建议[25]:①在开始VEGFR抑制剂治疗之前进行正式的心血管风险评估;②在整个治疗过程中监测血压和心脏毒性,在治疗初期更应密切监测;③积极管理早期出现的高血压和心脏毒性以预防长期心血管系统损害。
VEGFR抑制剂诱导血压升高治疗药物的选择应注意避免使用非二氢吡啶钙离子拮抗剂,因为其抑制CYP450 3A4,可能导致VEGFR抑制剂血药浓度升高,加剧VEGFR抑制剂诱导的高血压[26]。应避免同时使用CYP3A4抑制剂(如维拉帕米或地尔硫䓬等)。肾损害也是VEGFR抑制剂常见的不良反应,因此,控制安罗替尼所致的高血压最常用的是血管紧张素转换酶抑制剂(ACEI)或血管紧张素II受体拮抗剂(ARB),若控制不佳,可以加用其他降压药(如钙离子拮抗剂、利尿剂、β阻滞剂等)[27]。
不同VEGFR抑制剂高血压发生率有较大的区别,因此,笔者进一步分析了使用安罗替尼与其他VEGFR抑制剂发生高血压的差异。从表2可以看出,使用安罗替尼的患者高血压发生率均高于其他大部分VEGFR抑制剂(包括索拉非尼[2]、舒尼替尼[3]、帕唑帕尼[4]、凡德他尼[5]、阿昔替尼[6]和卡赞替尼[7])。对于高等级高血压发生率,安罗替尼与阿昔替尼和卡赞替尼相似,高于其他VEGFR抑制剂。不同VEGFR抑制剂高血压发生率具有较大差异的原因可能是由于部分VEGFR抑制剂还作用于其他靶点,如安罗替尼作用于VEGFR、FGFR、PDGFR和c-kit[1],而卡赞替尼作用于VEGFR和间质表皮转化因子受体[7]。然而,缺乏安罗替尼与其他VEGFR抑制剂大样本量的头对头临床研究,而且患者的基线特征可能会影响结局指标,所以应该谨慎解释这些结果。
本研究的局限性:①本研究为Meta分析,不是基于患者的原始数据进行分析,因此可能存在一些混杂因素;②纳入研究未描述基线的高血压发病率,这可能是导致Meta分析后高血压总体发生率较高的原因之一,然而,我们使用了RCT研究的数据进行RR值的合并,从而减少误差;③纳入的研究之间存在潜在的差异,如不同的肿瘤类型等,但纳入计算RR值的临床试验的癌种均为NSCLC;④纳入研究的数量有限;⑤大多数临床试验会排除控制不佳的高血压或重大心血管疾病的患者,因此高血压的发生率和严重程度在真实世界中可能会更高。
-
本文首次对癌症患者接受安罗替尼治疗相关的高血压总体发生率和风险进行Meta分析,使用安罗替尼会显著增加发生高血压的风险,建议临床用药前进行系统的心血管风险评估,用药期间密切监测血压并根据其分级进行适当管理,特别是对于高危患者。选择治疗高血压药物时,需注意药物相互作用。安罗替尼为多靶点TKI,临床应用过程中也应关注与其他靶点相关的不良反应。仍需进一步开展大样本量的研究,以明确其可能发生的机制和与其相关的危险因素。
Incidence and risk of hypertension in cancer patients receiving anlotinib: Review and Meta-analysis
-
摘要:
目的 为了明确癌症患者应用安罗替尼后高血压发生率和发生风险,同时比较安罗替尼与其他血管内皮生长因子受体(VEGFR)抑制剂之间高血压发生率的差异。 方法 检索Pubmed、Cochrane Library、Embase、ASCO、中国知网、万方、维普和中国生物医学文献服务系统数据库,收集与安罗替尼相关的前瞻性Ⅱ期和Ⅲ期且有准确记录高血压不良反应发生情况的临床试验,采用R软件(3.6.0版本)对安罗替尼高血压不良反应发生率和发生风险进行Meta分析,使用SPSS软件(26.0版本)比较安罗替尼与其他VEGFR抑制剂之间高血压发生率的差异。 结果 来自13项研究的1387名癌症患者被纳入Meta分析。使用安罗替尼的高血压总发生率约为47.1%(95% CI: 37.7%~56.6%),高等级高血压发生率约为10.6%(95% CI: 7.4%~14.2%),与安慰剂相比,安罗替尼可显著增加高血压发生风险(RR=5.58, 95% CI: 2.29~13.60, P<0.01)以及高等级高血压发生风险(RR=27.78, 95% CI: 3.56~216.86, P<0.01)。另外,安罗替尼高等级高血压发生率与阿昔替尼(RR=0.79, 95% CI: 0.61~1.02, P=0.066)和卡赞替尼(RR=0.87, 95% CI: 0.67~1.13, P=0.290)相似,其余均高于其他VEGFR抑制剂。 结论 在使用安罗替尼的癌症患者中,高血压发生率较高,且显著增加发生高血压风险,建议临床对血压进行密切监测并及时治疗。 -
关键词:
- 安罗替尼 /
- 癌症 /
- 血管内皮生长因子受体抑制剂 /
- 高血压 /
- 荟萃分析
Abstract:Objective To investigate the overall incidence and risk of hypertension in the treatment of cancer patients who receive anlotinib and compare the differences between anlotinib and other VEGFR inhibitors. Methods Pubmed, Embase, Cochrane Library, ASCO, CNKI, Wangfang, VIP and CBM databases were searched. Eligible studies were phase II and III prospective clinical trials on cancer patients who received anlotinib and had the hypertension data available. Meta-analysis for the incidence and risk of anlotinib was performed by using R software (version 3.6.0). SPSS software (version 26.0) was used to compare the difference between anlotinib and other VEGFR inhibitors. Results A total of 1387 cancer patients from 13 clinical trials were included in the Meta-analysis. The overall incidences of all grade and high grade hypertension in cancer patients who received anlotinib were about 47.1% (95%CI: 37.7%−56.6%) and 10.6% (95%CI: 7.4%−14.2%). The use of anlotinib was associated with significantly increased risk of all grade (RR=5.58, 95%CI: 2.29−13.60, P<0.01) and high grade hypertension (RR=27.78, 95%CI: 3.56−216.86, P<0.01). In addition, the incidence of high grade hypertension associated with anlotinib was similar to axitinib (RR=0.79, 95%CI: 0.61−1.02, P=0.066) and cabozantinib (RR=0.87, 95%CI: 0.67−1.13, P=0.290). The incidences of rest of other VEGFR inhibitors were lower than that of anlotinib. Conclusions There is a high incidence and significant risk of developing hypertension in cancer patients receiving anlotinib. Adequate monitoring and timely treatment of hypertension is recommended. -
Key words:
- anlotinib /
- cancer /
- VEGFR inhibitors /
- hypertension /
- Meta-analysis
-
胰腺癌是一种病死率极高的消化道恶性肿瘤 [1]。超过80%以上的患者一旦确诊即是晚期,手术难以根治,需在术后进行辅助化疗、放疗、对症支持治疗等 [2]。盐酸吉西他滨(hcGEM)是治疗胰腺癌的一线化疗药。由于存在半衰期短、产生耐药性及不可避免的毒副作用等问题,其疗效不尽如人意[3]。因此,hcGEM的临床应用需要联合化疗来提高疗效[4]。
铁死亡是一种铁依赖的非凋亡性细胞死亡形式,针对铁死亡的治疗策略可能为传统疗法难以攻克的癌症提供新的治疗思路 [5]。埃拉斯汀 (Era)作为一种高效持久的铁死亡诱导剂,它可以激活多种信号通路来触发癌细胞的铁死亡 [6]。柳氮磺胺吡啶(SASP)是一种能抑制铁死亡相关的胱氨酸-谷氨酸逆向转运蛋白的抗炎药,可通过降低癌细胞对胱氨酸的摄取以及胞内谷胱甘肽水平来抑制胰腺癌细胞的生长[7]。青蒿琥酯(Art)是一种青蒿素的衍生物,除用作抗疟治疗外,可通过促进铁蛋白吞噬来增加细胞内游离铁水平,进而引发癌细胞的铁死亡[8]。铁死亡诱导剂与盐酸吉西他滨联合应用可能是胰腺癌治疗的潜在策略[9]。
本研究分别考察Era、SASP和Art这三种铁死亡诱导剂单独或联合hcGEM使用,对人胰腺癌PANC-1细胞的增殖抑制作用,以期发现具有潜在协同抑制的联合方案,为今后开发胰腺癌新疗法奠定基础。
1. 实验材料
1.1 试剂
盐酸吉西他滨、柳氮磺胺吡啶、埃拉斯汀(美国MCE公司);青蒿琥酯(上海泰坦科技股份有限公司);胎牛血清、青链霉素、胰酶(以色列BI公司);DMEM高糖培养基、PBS缓冲液(上海泰坦科技股份有限公司),CCK- 8细胞毒性试剂盒(日本同仁化学研究所)。
1.2 细胞株
人胰腺癌PANC-1细胞,来源于海军军医大学第一附属医院消化内科,冻存复苏后培养于含10%胎牛血清的DMEM高糖培养基。
2. 实验方法
2.1 细胞培养
人胰腺癌PANC-1细胞用DMEM完全培养基(含10 %胎牛血清,1 %青-链霉素)于5 % CO2、37 ℃的恒温培养箱中培养。待细胞融合度达80 %~90 %时,移除旧培养基,PBS缓冲液清洗2遍后加入适当体积的胰蛋白酶消化3 min。待大部分细胞镜下变圆,小部分细胞脱落时,加入2倍胰酶体积的完全培养基终止消化,充分吹打使细胞脱离。将细胞悬液以1 000 r/min转速,离心5 min,弃上清液,加入2 ml完全培养基重悬,并按1∶2的比例均匀接种于两个培养皿,加入8 ml完全培养基水平摇匀后置于恒温细胞培养箱内培养,取对数生长期的细胞进行后续细胞毒性实验。
2.2 实验分组
将实验细胞单独用药组根据药物种类与浓度不同,分为hcGEM单药组(hcGEM: 0.015 625、0.031 25、0.062 5、0.125、0.25、0.5、1、2、4 μmol/L),Era单药组(Era:0.25、0.5、1、2、4、8、16、32、64 μmol/L),SASP单药组(SASP: 6.25、12.5、25、50、100、200、400、800、1600 μmol/L)以及Art单药组(Art:0.5、1、2、4、8、16、32、64、128 μmol/L),每种药物都按2倍比率设置浓度梯度,每组各9个浓度;联合用药组根据联合药物组成与比例不同分为hcGEM-Era联合用药组(包括4∶1、1∶1、1∶4和1∶16 联合组)、hcGEM-SASP联合用药组(包括4∶1、1∶1、1∶20和1∶400联合组)、hcGEM-Art联合用药组(包括 2∶1、1∶1、1∶4和1∶16联合组)。每个联合用药组中,hcGEM的浓度均为相同的浓度梯度(hcGEM: 0.015 625、0.031 25、0.062 5、0.125、0.25、0.5、1、2、4 μmol/L),并与恒定比例的联合药物共同作用于细胞。hcGEM-Era 1∶16联合组的药物浓度梯度为0.015 625 μmol/L hcGEM+0.25 μmol/L Era、0.031 25 μmol/L hcGEM+0.5 μmol/L Era、0.062 5 μmol/L hcGEM+1 μmol/L Era、0.125 μmol/L hcGEM+2 μmol/L Era、0.25 μmol/L hcGEM+4 μmol/L Era、0.5 μmol/L hcGEM+8 μmol/L Era、1 μmol/L hcGEM+16 μmol/L Era、2 μmol/L hcGEM+32 μmol/L Era、4 μmol/L hcGEM+64 μmol/L Era。
2.3 CCK-8法检测细胞抑制情况
取对数生长的PANC-1细胞接种于96孔板,密度为5 000个细胞/孔。待细胞贴壁24 h后,弃上清液,每3个复孔加入100 μl不同浓度的每种药物,另设空白对照组与药物未处理组各3个复孔。药物与细胞共培养48 h后,每孔加入含10% CCK-8的DMEM培养基。于恒温培养2 h后,用酶标仪测量450 nm波长下各孔的吸光度值(A值)。使用GraphPad Prism 8.0.2软件对数据进行非线性回归分析,得到各组药物作用于细胞的半数抑制浓度(IC50) 以及细胞增殖抑制率,具体公式为:抑制率=[1−(A用药组−A空白组)/(A未用药组−A空白组)]×100%。
2.4 联合指数计算
根据单独用药组与联合用药组的摩尔浓度与细胞增殖抑制率,使用CompuSyn软件计算联合指数(CI),并依据CI值判断药物的联合效果: CI>1表示拮抗作用;CI=1表示相加作用;CI<1表示协同作用,且协同抑制效果随CI值的减小而增强。
2.5 统计学分析
实验结果以(
$\bar x $ ±s)表示,采用GraphPad Prism 8.0.2软件进行数据的处理分析,多组间比较采用单因素方差分析,两组间比较采用t检验。P<0.05表示组间差异有统计学意义。3. 结果
3.1 hcGEM、Era、SASP、Art单独用药对PANC-1细胞的影响
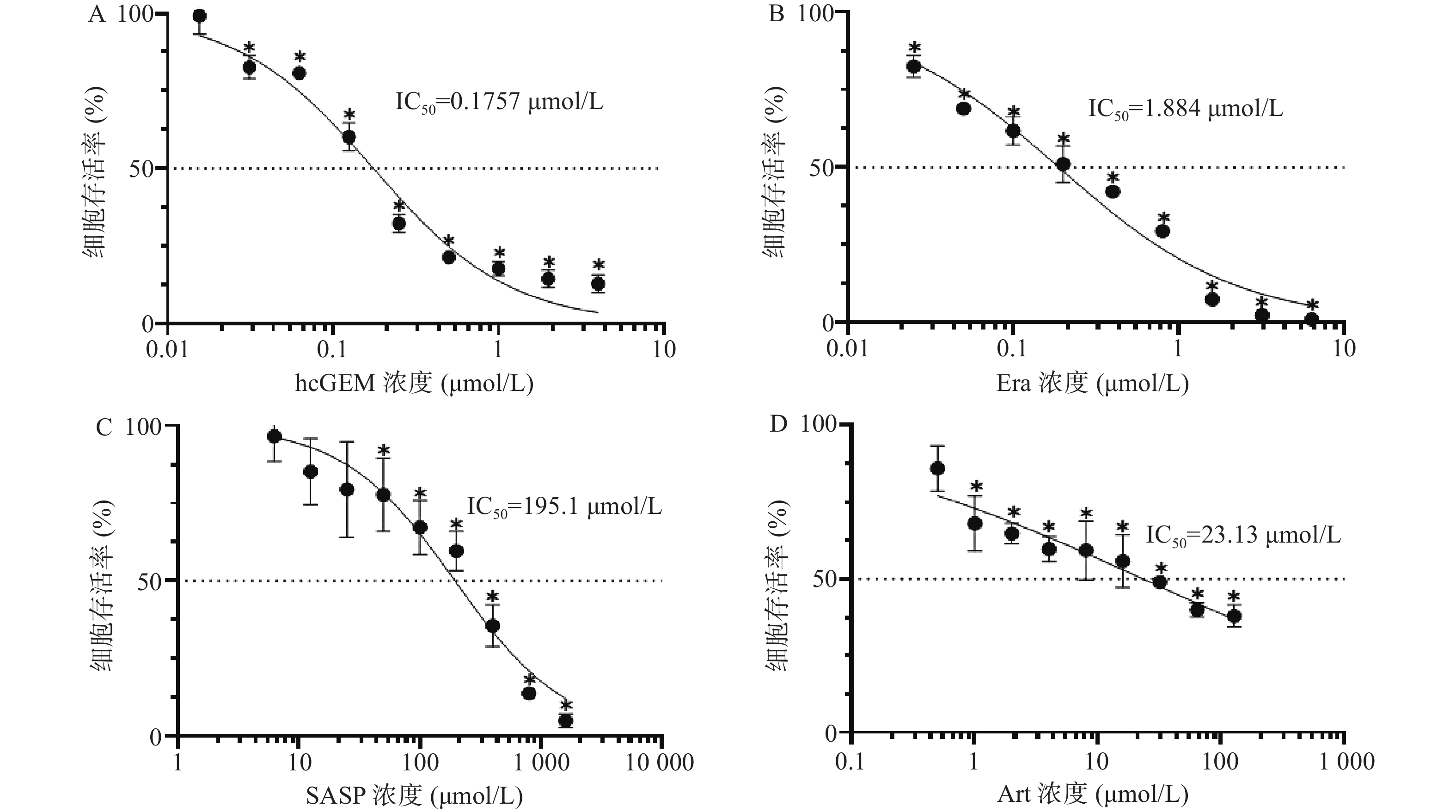
如图1所示,hcGEM、Era、SASP、Art单独作用于PANC-1细胞时可明显抑制细胞的增殖,并且这种抑制作用呈现剂量依赖性。hcGEM、Era、SASP、Art作用于PANC-1细胞的IC50值分别为0.175 7、1.884、195.1、23.13 μmol/L。hcGEM单独用药时,小于0.015 625 μmol/L的剂量对PANC-1细胞的生长几乎无抑制作用,存活率>95%(P>0.05);剂量大于2 μmol/L时,细胞的活性受到显著抑制,存活率<15%(P<0.05)。Era单独用药时,大于16 μmol/L 的剂量能显著抑制PANC-1细胞的生长,存活率<10%(P<0.05),而小于0.25 μmol/L的剂量会使80%以上的细胞存活。SASP单独用药时,大于800 μmol/L的剂量能抑制PANC-1细胞的生长,存活率<15%(P<0.05),而小于12.5 μmol/L的剂量仅轻微抑制PANC-1细胞存活,存活率>85%(P>0.05)。Art单独用药时,大于128 μmol/L的剂量能显著抑制PANC-1细胞的生长,存活率<40%(P<0.05),而小于0.5 μmol/L时,仅能轻微抑制细胞增殖,存活率>85%(P>0.05)。
3.2 hcGEM分别与Era、SASP、Art联合用药对PANC-1细胞的影响
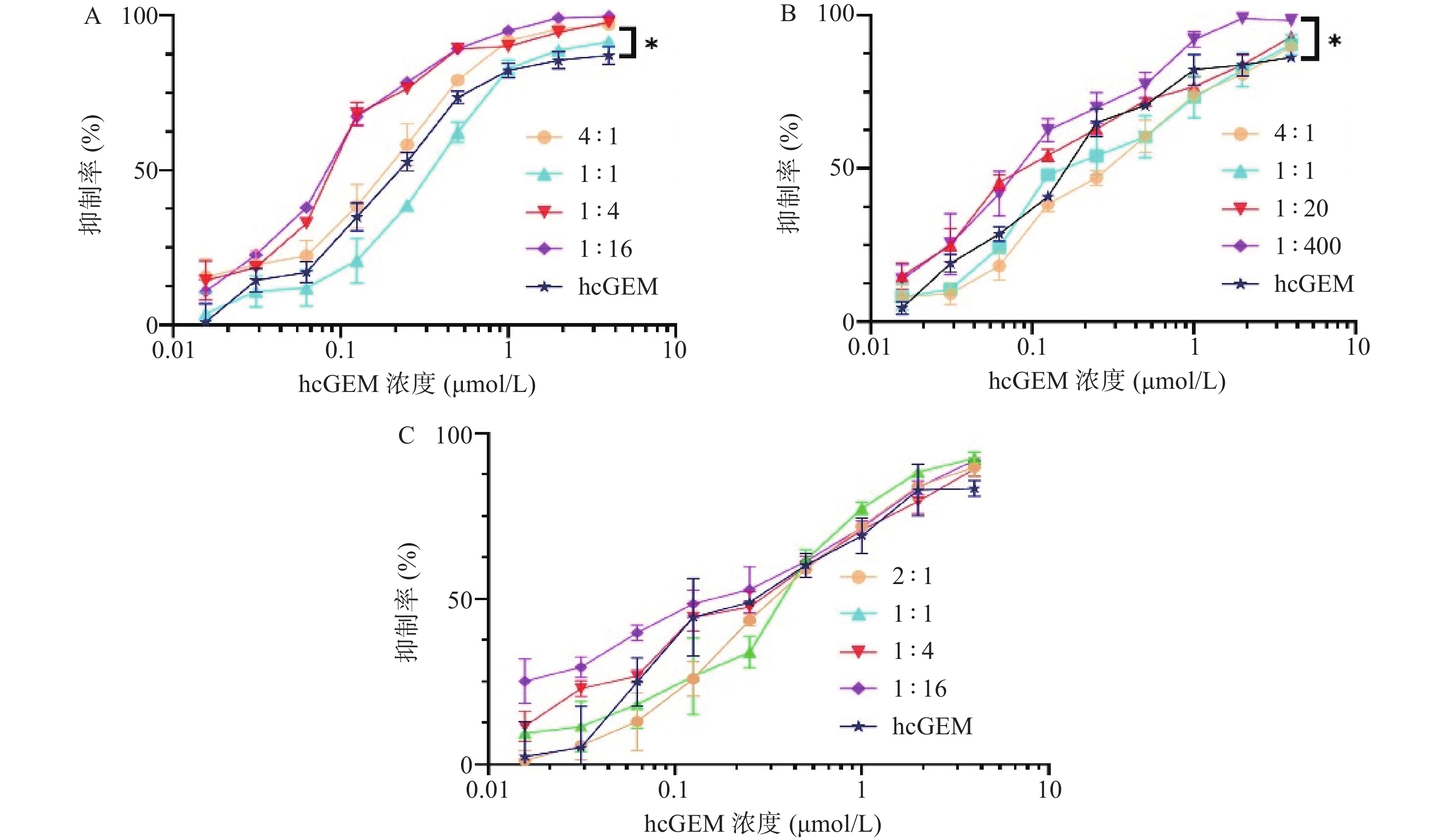
在研究单药对PANC-1细胞抑制效果的基础上,我们进一步探究了hcGEM-Era 4∶1、1∶1、1∶4和1∶16 联合用药,hcGEM-SASP 4∶1、1∶1、1∶20和1∶400联合用药,以及hcGEM-Art 2∶1、1∶1、1∶4和1∶16联合用药,对PANC-1细胞的抑制效果。如图2所示, hcGEM-Era、hcGEM-SASP以及hcGEM-Art联合用药组的抑制效果随着浓度的增加而提高。其中,hcGEM-Era 4∶1、1∶4、1∶16联合组,以及hcGEM-SASP 1∶400联合组对PANC-1细胞抑制效果在所有浓度梯度范围均优于hcGEM组(P<0.05)。此外,hcGEM-Era 4∶1、1∶4、1∶16联合用药组,hcGEM-SASP 1∶20、1∶400联合组,和hcGEM-Art 1∶16联合组的IC50值均小于0.1757 μmol/L(hcGEM单药组的IC50),说明上述联合用药能在一定程度上提高对PANC-1细胞的抑制效果。不同联合用药组hcGEM的IC50值见表1。
表 1 hcGEM联合三种铁死亡诱导剂对胰腺癌PANC-1细胞作用时的IC50值组别 摩尔浓度比 IC50(μmol/L,hcGEM) hcGEM-Era联合组 1∶0.25 0.140 3±0.009 1 1∶1 0.340 2±0.018 3 1∶4 0.091 3±0.005 1 1∶16 0.083 3±0.002 5 hcGEM-SASP联合组 1∶0.25 0.297 5±0.016 1 1∶1 0.240 2±0.021 2 1∶20 0.120 8±0.008 9 1∶400 0.092 6±0.006 7 hcGEM-Art联合组 1∶0.5 0.366 4±0.018 7 1∶1 0.344 4±0.026 3 1∶4 0.249 3±0.015 7 1∶16 0.154 6±0.013 5 3.3 药物联合指数
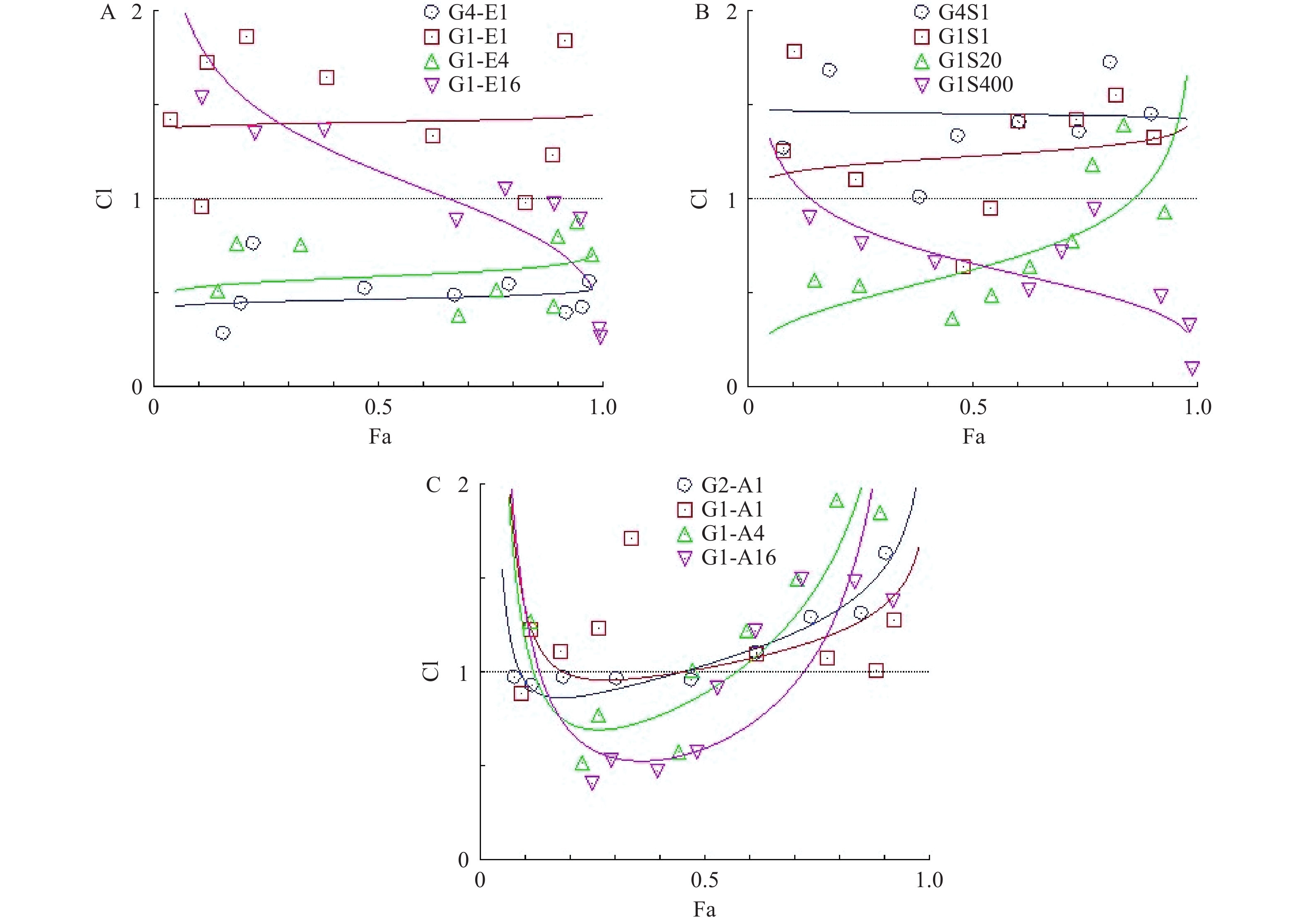
为了研究hcGEM分别与Era、SASP、Art联合用药,对PANC-1细胞是否具有协同抑制作用,我们分别设计了hcGEM与三种铁死亡诱导剂的4种不同比例的联用方案,来探讨不同联合用药组对PANC-1细胞的协同抑制效果。CompuSyn软件分析结果显示,hcGEM-Era 4∶1或1∶4联用组在所有药物浓度下均能对PANC-1细胞产生良好的协同抑制效果(CI<1),且4∶1联用组的协同抑制效果略优于1∶4联用组。对于hcGEM-Era 1∶16联用组,CI值随着联合药物浓度的增加而减小,说明该比例下两药协同抑制效果随着浓度增大有所增强,而hcGEM-Era 1∶1联用组的CI值,仅除1 μmol/LhcGEM+1 μmol/L Era、0.031 25 μmol/L hcGEM+0.031 25 μmol/L Era联用组的CI<1外,其余浓度组CI>1,说明hcGEM-Era 1∶1联用组对PANC-1细胞几乎无协同抑制效果(图3A)。
对于hcGEM与SASP联合用药组对PANC-1细胞的协同抑制效果,CompuSyn分析结果提示,hcGEM-SASP 4∶1联用对PANC-1细胞没有协同作用(CI>1),而hcGEM-SASP 1∶1联用组除了0.25 μmol/L hcGEM+0.25 μmol/L SASP、0.125 μmol/L hcGEM+0.125 μmol/LSASP联用组CI<1外,其余联用浓度组的CI>1,表明hcGEM-SASP 1∶1联合用药对PANC-1细胞几乎无协同抑制作用。hcGEM-SASP 1∶20联合用药对PANC-1细胞,除了1 μmol/LhcGEM+20 μmol/L SASP、2 μmol/L hcGEM+40 μmol/LSASP联用组CI>1外,其余浓度组CI<1,提示hcGEM-SASP 1∶20联合用药对PANC-1细胞主要是协同抑制效果,且协同效果随着浓度的增加而减弱。hcGEM-SASP 1∶400联合用药对PANC-1细胞有良好的协同抑制效果(CI<1),且协同效果随着浓度的增加而增强(图3B)。
对于hcGEM与Art联合用药组对PANC-1细胞的协同抑制效果,CompuSyn结果提示,hcGEM-Art 2∶1联用组在0.031 25 ~0.25 μmol/L hcGEM联合浓度范围内CI <1,且接近1,其余联合浓度组的CI>1,表明hcGEM-Art 2∶1联合用药对PANC-1细胞几乎无协同抑制作用。hcGEM-Art 1∶1联用组CI>1,表明hcGEM-Art 1∶1联合用药对PANC-1细胞无协同抑制作用。hcGEM-Art 1∶4联用组仅在0.031 25~0.125 μmol/L hcGEM联合浓度范围内CI<1,其余联合浓度范围内CI>1,表明hcGEM-Art 1∶4联合用药对PANC-1细胞仅在0.031 25~0.125 μmol/L hcGEM联合浓度范围内存在协同抑制作用。 hcGEM-Art 1∶16联用组在0.015 625~0.25 μmol/L hcGEM联合浓度范围内CI <1,其余联合浓度范围内CI>1,表明hcGEM-Art 1∶16联用组在0.015 625~0.25 μmol/L hcGEM联合浓度范围内对PANC-1细胞有协同抑制作用 (图3C)。
4. 讨论
目前,胰腺癌的一线治疗标准为吉西他滨联合白蛋白结合型紫杉醇或者FOLFIRONOX组合(5-氟尿嘧啶、亚叶酸钙、伊立替康和奥沙利铂)[10]。吉西他滨在一定程度上能提高患者的生存率,但耐药性的出现以及毒副作用限制了临床治疗效果,故临床上常将其与其他化疗药联合使用来提高其疗效[11]。近来大量研究证实,诱导癌细胞铁死亡可能对包括胰腺癌在内的多种类型癌症有效[12]。自2003年发现小分子铁死亡诱导剂埃拉斯汀至今,研究人员已发现多种铁死亡诱导剂,如RSL3、Sorafeni、SASP、Art等[13]。本研究选取了三种铁死亡诱导剂Era、SASP以及Art,首先研究了三种铁死亡诱导剂单独应用对PANC-1细胞的增殖抑制作用。通过CCK-8法检测了三种铁死亡诱导剂的细胞毒性作用,我们发现Era对PANC-1细胞的IC50最小,而SASP的IC50最大,表明在这三种铁死亡诱导剂中,Era对PANC-1细胞的抑制作用最强,而SASP最弱。三种铁死亡诱导剂单独使用对PANC-1细胞的增殖抑制作用呈现剂量依赖性,即浓度越大抑制效果越强。
为了进一步探究三种铁死亡诱导剂Era、SASP、Art与hcGEM联用是否对胰腺癌PANC-1细胞具有协同抑制作用,本研究设计了不同比例的联合用药组来探索最佳的联合协同方案。本次研究结果显示,当三种铁死亡诱导剂分别与hcGEM联合使用时, hcGEM-Era 4∶1或1∶4联用组,hcGEM-SASP 1∶400联用组对PANC-1细胞具有良好的协同抑制效果。hcGEM-Art 1∶4或1∶16联用组仅在一定浓度范围内对PANC-1细胞有协同抑制效果。胰腺导管腺癌患者中,90%存在KRAS突变, 而致癌KRAS将胰腺导管腺癌细胞重新编程为高度抗凋亡的状态。由于KRAS信号突变的副产物是生成大量的ROS,为了上调抗氧化能力,胰腺导管腺癌转而增强葡萄糖和谷氨酰胺代谢途径,使细胞对ROS诱导的、铁依赖性非凋亡的铁死亡模式敏感[13]。激活铁死亡可有效阻止肿瘤进展,增强化疗、放疗和免疫治疗的效果[14]。在治疗胰腺癌的过程中,吉西他滨通过NF-κB信号途径诱导内源性活性氧的产生,进而导致Nrf2信号通路的激活以及细胞内谷胱甘肽增加,最终使胰腺癌细胞对吉西他滨不敏感[15]。埃拉斯汀可通过抑制胱氨酸-谷氨酸逆向转运蛋白的活性来减少胱氨酸进入肿瘤细胞,从而降低胞内谷胱甘肽的合成,抑制线粒体的电压依赖性阴离子通道等多种途径促进线粒体代谢紊乱、活性氧类物质以及脂质过氧化物的大量积累,增强吉西他滨对胰腺癌细胞的杀伤效果[16]。柳氮磺胺吡啶可通过抑制胱氨酸-谷氨酸逆向转运蛋白的功能促进胰腺癌细胞的铁死亡,逆转癌细胞的耐药性 [17]。青蒿琥酯通过诱导铁依赖性氧化损伤促进胰腺癌细胞的死亡,并且这种脂质过氧化性细胞死亡可被铁死亡抑制剂阻断[18]。本研究中三种铁死亡诱导剂联合hcGEM对PANC-1细胞的协同抑制的效果可能与这三种铁死亡诱导剂引起的氧化应激反应的强弱有关,具体相关机制还有待进一步实验。
综上所述,本研究发现三种铁死亡诱导剂分别与hcGEM联合应用时存在对PANC-1细胞的协同抑制联合方案。hcGEM-Era 4∶1或1∶4联合用药以及hcGEM-SASP 1∶400联合用药对PANC-1细胞的协同抑制效果良好,而hcGEM-Art 1∶4或1∶16联合用药仅一定浓度范围能对PANC-1细胞产生协同抑制效果。
-
表 1 纳入的13项研究的基本信息
纳入文献 肿瘤类型 试验设计 药物名称 患者数 高血压发生数 试验组 对照组 试验组 对照组 试验组 ≥G3① 对照组 ≥G3② Wu[8] 小细胞肺癌 Ⅱ期 单臂 安罗替尼 NA 45 NA 6 3 NA NA Han[9] 非小细胞肺癌 Ⅲ期RCT 安罗替尼 安慰剂 294 143 199 40 24 0 Ma[10] 转移性肾细胞癌 Ⅱ期 单臂 安罗替尼 NA 42 NA 19 2 NA NA Chi[11] 软组织肉瘤 Ⅱ期 单臂 安罗替尼 NA 166 NA 70 8 NA NA Sun[12] 甲状腺髓样癌 Ⅱ期 单臂 安罗替尼 NA 58 NA 23 3 NA NA Tang[13] 骨癌 Ⅱ期 单臂 安罗替尼 NA 42 NA NR 8 NA NA Shan[14] 卵巢癌 Ⅱ期 单臂 安罗替尼 NA 14 NA 8 0 NA NA Zhou[15] 转移性肾细胞癌 Ⅱ期 RCT 安罗替尼 舒尼替尼 90 43 45 12 29 11 Han[16] 非小细胞肺癌 Ⅱ期RCT 安罗替尼 安慰剂 60 57 33 6 3 0 Chi[17] 软组织肉瘤 Ⅱ期 RCT 安罗替尼 安慰剂 158 75 99 30 NR NR Huang[18] 食管鳞状细胞癌 Ⅱ期 RCT 安罗替尼 安慰剂 110 55 NR 17 NR NR Wang[19] 小细胞肺癌 Ⅱ期 RCT 安罗替尼 安慰剂 46 22 18 7 NR NR Chi[20] 甲状腺髓样癌 Ⅱ期 RCT 安罗替尼 安慰剂 62 NR 29 NR NR NR 注:NA:不适用;NR:未报道;①试验组高血压≥G3的发生数;②对照组高血压≥G3的发生数。 表 2 安罗替尼与其他VEGFR抑制剂高血压发生率的比较
序号 比较组别 所有等级高血压 高等级高血压 发生率(样本量) RR(90% CI) P 发生率(样本量) RR(90% CI) P 1 安罗替尼 47.1%(1035) 10.6% (1175) 2 索拉非尼 23.4% (3363) 2.91(2.51~3.37) <0.001 5.7% (3567) 1.96(1.50~2.31) <0.001 3 舒尼替尼 21.6% (4609) 3.23(2.80~3.72) <0.001 6.8% (4407) 1.62(1.30~2.03) <0.001 4 帕唑帕尼 35.9% (1242) 1.59(1.34~1.88) <0.001 6.5% (1286) 1.71(1.28~2.30) <0.001 5 凡德他尼 24.2% (1815) 2.78(2.37~3.28) <0.001 6.4% (1190) 1.73(1.28~2.34) <0.001 6 阿昔替尼 40.1% (1148) 1.33(1.12~1.58) <0.001 13.1% (1148) 0.79(0.61~1.02) 0.066 7 卡赞替尼 27.8% (1083) 2.31(1.93~2.76) <0.001 12.0% (1083) 0.87 (0.67~1.13) 0.290 注:表中RR值和P值均为安罗替尼与其他VEGFR抑制剂相比较;其他VEGFR抑制剂高血压发生率数据从已发表文献中提取。 -
[1] SHEN G S, ZHENG F C, REN D F, et al. Anlotinib: a novel multi-targeting tyrosine kinase inhibitor in clinical development[J]. J Hematol Oncol,2018,11(1):120-130. doi: 10.1186/s13045-018-0664-7 [2] WU S, CHEN J J, KUDELKA A, et al. Incidence and risk of hypertension with sorafenib in patients with cancer: a systematic review and meta-analysis[J]. Lancet Oncol,2008,9(2):117-123. doi: 10.1016/S1470-2045(08)70003-2 [3] ZHU X L, STERGIOPOULOS K, WU S H. Risk of hypertension and renal dysfunction with an angiogenesis inhibitor sunitinib: systematic review and meta-analysis[J]. Acta Oncol,2009,48(1):9-17. doi: 10.1080/02841860802314720 [4] QI W X, LIN F, SUN Y J, et al. Incidence and risk of hypertension with pazopanib in patients with cancer: a meta-analysis[J]. Cancer Chemother Pharmacol,2013,71(2):431-439. doi: 10.1007/s00280-012-2025-5 [5] QI W X, SHEN Z, LIN F, et al. Incidence and risk of hypertension with vandetanib in cancer patients: a systematic review and meta-analysis of clinical trials[J]. Br J Clin Pharmacol,2013,75(4):919-930. doi: 10.1111/j.1365-2125.2012.04417.x [6] QI W X, HE A N, SHEN Z, et al. Incidence and risk of hypertension with a novel multi-targeted kinase inhibitor axitinib in cancer patients: a systematic review and meta-analysis[J]. Br J Clin Pharmacol,2013,76(3):348-357. doi: 10.1111/bcp.12149 [7] ZHANG X, SHAO Y J, WANG K J. Incidence and risk of hypertension associated with cabozantinib in cancer patients: a systematic review and meta-analysis[J]. Expert Rev Clin Pharmacol,2016,9(8):1109-1115. doi: 10.1080/17512433.2016.1190269 [8] WU D, NIE J, HU W H, et al. A phase II study of anlotinib in 45 patients with relapsed small cell lung cancer[J]. Int J Cancer,2020. doi: 10.1002/ijc.33161 [9] HAN B, LI K, WANG Q, et al. Effect of anlotinib as a third-line or further treatment on overall survival of patients with advanced non-small cell lung cancer: the ALTER 0303 phase 3 randomized clinical trial[J]. JAMA Oncol,2018,4(11):1569-1575. doi: 10.1001/jamaoncol.2018.3039 [10] MA J H, SONG Y, SHOU J Z, et al. Anlotinib for patients with metastatic renal cell carcinoma previously treated with one vascular endothelial growth factor receptor-tyrosine kinase inhibitor: a phase 2 trial[J]. Front Oncol,2020,10:664. doi: 10.3389/fonc.2020.00664 [11] CHI Y, SUN Y K, CAI J Q, et al. Phase II study of anlotinib for treatment of advanced soft tissues sarcomas[J]. J Clin Oncol,2016,34(15_suppl):11005. doi: 10.1200/JCO.2016.34.15_suppl.11005 [12] SUN Y K, CHI Y, TANG P Z, et al. Phase II study of anlotinib for treatment of advanced medullary thyroid carcinoma[J]. J Clin Oncol,2016,34(15_suppl):6015. doi: 10.1200/JCO.2016.34.15_suppl.6015 [13] TANG L N, NIU X H, WANG Z, et al. A phase II study of anlotinib in treating patients with relapsed or metastatic primary malignant bone tumor[J]. J Clin Oncol,2020,38(15_suppl):11525. doi: 10.1200/JCO.2020.38.15_suppl.11525 [14] SHAN B E, SHEN W B, WANG H Y. Anlotinib in patients with recurrent platinum-resistant or refractory ovarian carcinoma: a prospective, single-arm, single-center, phase II clinical study[J]. J Clin Oncol,2020,38(15_suppl):6061. doi: 10.1200/JCO.2020.38.15_suppl.6061 [15] ZHOU A P, BAI Y X, SONG Y, et al. Anlotinib versus sunitinib as first-line treatment for metastatic renal cell carcinoma: a randomized phase II clinical trial[J]. Oncol,2019,24(8):e702-e708. [16] HAN B H, LI K, ZHAO Y Z, et al. Anlotinib as a third-line therapy in patients with refractory advanced non-small-cell lung cancer: a multicentre, randomised phase II trial (ALTER0302)[J]. Br J Cancer,2018,118(5):654-661. doi: 10.1038/bjc.2017.478 [17] CHI Y, YAO Y, WANG S S, et al. Anlotinib for metastasis soft tissue sarcoma: a randomized, double-blind, placebo-controlled and multi-centered clinical trial[J]. J Clin Oncol,2018,36(15_suppl):11503. doi: 10.1200/JCO.2018.36.15_suppl.11503 [18] HUANG J, XIAO J X, FANG W T, et al. Anlotinib in chemotherapy-refractory metastatic esophageal squamous cell carcinoma (ESCC): a randomized, double-blind, multicenter phase II trial[J]. J Clin Oncol,2019,37(4_suppl):95. doi: 10.1200/JCO.2019.37.4_suppl.95 [19] WANG Q, CHENG Y, LI K, et al. Effect of anlotinib in advanced small cell lung cancer patients previously received chemoradiotherapy: a subgroup analysis in ALTER 1202 trial[J]. J Thorac Oncol,2019,14(10):S211. [20] CHI Y, GAO M, TANG P Z, et al. Exploration of associations between adverse drug reactions and clinical outcomes in anlotinib treatment against medullary thyroid carcinoma (MTC): a subgroup analysis based on the ALTER01031 trial[J]. J Clin Oncol,2020,38(15_suppl):e18518. doi: 10.1200/JCO.2020.38.15_suppl.e18518 [21] LIU B, DING F X, LIU Y, et al. Incidence and risk of hypertension associated with vascular endothelial growth factor receptor tyrosine kinase inhibitors in cancer patients: a comprehensive network meta-analysis of 72 randomized controlled trials involving 30013 patients[J]. Oncotarget,2016,7(41):67661-67673. doi: 10.18632/oncotarget.11813 [22] KAMBA T, MCDONALD D M. Mechanisms of adverse effects of anti-VEGF therapy for cancer[J]. Br J Cancer,2007,96(12):1788-1795. doi: 10.1038/sj.bjc.6603813 [23] STACHON A, SCHLÜTER T, JUNKER K, et al. The secretion of endothelin-1 by microvascular endothelial cells from human benign prostatic hyperplasia is inhibited by vascular endothelial growth factor[J]. Growth Factors,2004,22(4):281-289. doi: 10.1080/08977190400004835 [24] AGARWAL M, THAREJA N, BENJAMIN M, et al. Tyrosine kinase inhibitor-induced hypertension[J]. Curr Oncol Rep,2018,20(8):65. doi: 10.1007/s11912-018-0708-8 [25] STEINGART R M, BAKRIS G L, CHEN H X, et al. Management of cardiac toxicity in patients receiving vascular endothelial growth factor signaling pathway inhibitors[J]. Am Heart J,2012,163(2):156-163. doi: 10.1016/j.ahj.2011.10.018 [26] RHIAN M T, LANG N N. Hypertension and antiangiogenesis: The Janus Face of VEGF Inhibitors[J]. JACC: Cardio Oncology,2019,1(1):37-40. doi: 10.1016/j.jaccao.2019.08.010 [27] SI X Y, ZHANG L, WANG H P, et al. Management of anlotinib-related adverse events in patients with advanced non-small cell lung cancer: Experiences in ALTER-0303[J]. Thorac Cancer,2019,10(3):551-556. doi: 10.1111/1759-7714.12977 -






 下载:
下载:
 下载:
下载: